METODE MEMPERTAHANKAN KUALITAS DAN
KUANTITAS ASAM RIBONUKLEAT (RNA) TANAMAN
M. REZEKI MUAMMAR
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
MUHAMMAD REZEKI MUAMMAR. Metode Mempertahankan Kualitas dan
Kuantitas Asam Ribonukleat (RNA) Tanaman. Dibimbing oleh MARIA
BINTANG dan TETTY CHAIDAMSARI.
ABSTRACT
MUHAMMAD REZEKI MUAMMAR. Quality and Quantity Maintenance
Method of Plant Ribonucleic Acid (RNA). Under the direction of MARIA
BINTANG and TETTY CHAIDAMSARI.
METODE MEMPERTAHANKAN KUALITAS DAN
KUANTITAS ASAM RIBONUKLEAT (RNA) TANAMAN
M. REZEKI MUAMMAR
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Bioimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Metode Mempertahankan
Kualitas
dan
Kuantitas Asam
Ribonukleat (RNA) Tanaman.
Nama
: M. Rezeki Muammar
NIM
: G44103005
Disetujui
Komisi Pembimbing
Prof.Dr.drh. Maria Bintang, M.S.
Ketua
Dr. Tetty Chaidamsari, M.Si.
Anggota
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, M.S.
NIP 131 473 999
PRAKATA
Puji dan syukur kehadirat Allah SWT karena atas rahmat dan karunia-Nya
penulis dapat menyelesaikan penelitian ini beserta laporannya. Laporan ini
disusun berdasarkan hasil penelitian yang dilaksanakan mulai Januari sampai Juni
2007 di Laboratorium Biologi Molekuler dan Rekayasa Genetika, Balai Penelitian
Bioteknologi Perkebunan Indonesia, Bogor.
Terima kasih penulis ucapkan kepada berbagai pihak yang telah membantu
penulis selama penelitian maupun penyusunan laporan ini, antara lain kepada
Prof.Dr.drh. Maria Bintang, M.S. selaku pembimbing Utama, Dr. Tetty
Chaidamsari, M.Si. selaku pembimbing anggota, mbak Niyyah, mbak Herti, mas
Riza serta seluruh staf di Laboratorium Biologi Molekuler dan Rekayasa
Genetika, Balai Penelitian Bioteknologi Perkebunan Indonesia, Bogor. Ucapan
terima kasih juga disampaikan kepada ayah, ibu dan seluruh keluarga yang
senantiasa memberi motivasi, doa dan kasih sayangnya.
Penulis menyadari bahwa laporan ini masih jauh dari kesempurnaan, oleh
karena itu penulis mengharapkan kritik dan saran demi kesempurnaan laporan ini.
Akhirnya penulis berharap agar laporan ini berguna untuk semua pihak.
Bogor, Juli 2007
RIWAYAT HIDUP
Penulis dilahirkan di Aceh Pidie tepatnya di Sigli pada tanggal 17
September 1985 sebagai anak pertama dari tiga bersaudara dari ayah yang
bernama Jarir dan ibu bernama Nurila Nurdin.
Tahun 2003 penulis lulus dari MAS Jeumala Amal Lueng Putu dan pada
tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk
IPB (USMI). Penulis menempuh studi di Program Studi Biokimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR TABEL... …vi
DAFTAR GAMBAR ... ...vii
DAFTAR LAMPIRAN... ..viii
PENDAHULUAN ... ..1
TINJAUAN PUSTAKA
Asam Ribonukleat (RNA) ... ..1
Reverse Transcriptase Polimerase Chain Reaction
(RT PCR) ... ..2
Sodium Asetat... ..2
Etanol Absolut ... ..2
BAHAN DAN METODE
Bahan dan Alat ... ..3
Metode Penelitian ... ..3
HASIL DAN PEMBAHASAN
Hasil Pengukuran Konsentrasi dan Kualitas RNA Setelah Isolasi ... ..5
Penyimpanan RNA dengan Beberapa Perlakuan ... ..6
Penyimpanan RNA dengan Penambahan Sodium Asetat dan Etanol
Absolut serta disimpan pada suhu 4
0C ... ..8
SIMPULAN DAN SARAN ... ..9
DAFTAR PUSTAKA ... 10
DAFTAR TABEL
Halaman
1
Hasil pengukuran konsentrasi RNA dengan spektrofotometer ... ..6
2
Hasil pengukuran konsentrasi RNA dengan spektrofotometer ... ..6
3
Perbandingan konsentrasi RNA antar perlakuan setelah penyimpanan
selama 2 bulan... ..7
4
Hasil pengukuran konsentrasi RNA yang ditambah sodium asetat dan
DAFTAR GAMBAR
Halaman
1
Struktur sodium asetat... ..2
2
Struktur etanol... ..2
3
Hasil elektoforesis gel agarosa 1% RNA tanaman ... ..6
4
Hasil elektoforesis gel agarosa 1% RNA tanaman ... ..7
5
Elektoforesis gel agarosa 1% RNA tanaman yang disimpan pada
-40
0C ... ..8
6
Elektoforesis gel agarosa 1% RNA tanaman yang disimpan pada
suhu ruang ... ..8
7
Elektoforesis gel agarosa 1%
RNA
tanaman
yang ditambah
sodium asetat dan etanol absolut serta disimpan pada 4
0C selama
2 bulan... ..8
8
Elektoforesis gel agarosa 1% RNA tanaman yang ditambah sodium
asetat dan etanol absolut serta disimpan pada - 20
0C selama 2 bulan ... ..8
9
Elektoforesis gel agarosa 1% RNA tanaman yang ditambah etanol
absolut serta disimpan pada 4
0C selama 2 bulan ... ..8
10 Elektoforesis gel agarosa 1% RNA tanaman yang ditambah etanol
absolut serta disimpan pada suhu ruang selama 2 bulan... ..8
11 Elektroforesis agarosa 1% setelah penyimpanan dengan penambahan
sodium asetat dan etanol absolut pada 4
0C ... ..9
12 Hasil RT-PCR RNA sampel... ..9
METODE MEMPERTAHANKAN KUALITAS DAN
KUANTITAS ASAM RIBONUKLEAT (RNA) TANAMAN
M. REZEKI MUAMMAR
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
MUHAMMAD REZEKI MUAMMAR. Metode Mempertahankan Kualitas dan
Kuantitas Asam Ribonukleat (RNA) Tanaman. Dibimbing oleh MARIA
BINTANG dan TETTY CHAIDAMSARI.
ABSTRACT
MUHAMMAD REZEKI MUAMMAR. Quality and Quantity Maintenance
Method of Plant Ribonucleic Acid (RNA). Under the direction of MARIA
BINTANG and TETTY CHAIDAMSARI.
METODE MEMPERTAHANKAN KUALITAS DAN
KUANTITAS ASAM RIBONUKLEAT (RNA) TANAMAN
M. REZEKI MUAMMAR
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Bioimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Metode Mempertahankan
Kualitas
dan
Kuantitas Asam
Ribonukleat (RNA) Tanaman.
Nama
: M. Rezeki Muammar
NIM
: G44103005
Disetujui
Komisi Pembimbing
Prof.Dr.drh. Maria Bintang, M.S.
Ketua
Dr. Tetty Chaidamsari, M.Si.
Anggota
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, M.S.
NIP 131 473 999
PRAKATA
Puji dan syukur kehadirat Allah SWT karena atas rahmat dan karunia-Nya
penulis dapat menyelesaikan penelitian ini beserta laporannya. Laporan ini
disusun berdasarkan hasil penelitian yang dilaksanakan mulai Januari sampai Juni
2007 di Laboratorium Biologi Molekuler dan Rekayasa Genetika, Balai Penelitian
Bioteknologi Perkebunan Indonesia, Bogor.
Terima kasih penulis ucapkan kepada berbagai pihak yang telah membantu
penulis selama penelitian maupun penyusunan laporan ini, antara lain kepada
Prof.Dr.drh. Maria Bintang, M.S. selaku pembimbing Utama, Dr. Tetty
Chaidamsari, M.Si. selaku pembimbing anggota, mbak Niyyah, mbak Herti, mas
Riza serta seluruh staf di Laboratorium Biologi Molekuler dan Rekayasa
Genetika, Balai Penelitian Bioteknologi Perkebunan Indonesia, Bogor. Ucapan
terima kasih juga disampaikan kepada ayah, ibu dan seluruh keluarga yang
senantiasa memberi motivasi, doa dan kasih sayangnya.
Penulis menyadari bahwa laporan ini masih jauh dari kesempurnaan, oleh
karena itu penulis mengharapkan kritik dan saran demi kesempurnaan laporan ini.
Akhirnya penulis berharap agar laporan ini berguna untuk semua pihak.
Bogor, Juli 2007
RIWAYAT HIDUP
Penulis dilahirkan di Aceh Pidie tepatnya di Sigli pada tanggal 17
September 1985 sebagai anak pertama dari tiga bersaudara dari ayah yang
bernama Jarir dan ibu bernama Nurila Nurdin.
Tahun 2003 penulis lulus dari MAS Jeumala Amal Lueng Putu dan pada
tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk
IPB (USMI). Penulis menempuh studi di Program Studi Biokimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR TABEL... …vi
DAFTAR GAMBAR ... ...vii
DAFTAR LAMPIRAN... ..viii
PENDAHULUAN ... ..1
TINJAUAN PUSTAKA
Asam Ribonukleat (RNA) ... ..1
Reverse Transcriptase Polimerase Chain Reaction
(RT PCR) ... ..2
Sodium Asetat... ..2
Etanol Absolut ... ..2
BAHAN DAN METODE
Bahan dan Alat ... ..3
Metode Penelitian ... ..3
HASIL DAN PEMBAHASAN
Hasil Pengukuran Konsentrasi dan Kualitas RNA Setelah Isolasi ... ..5
Penyimpanan RNA dengan Beberapa Perlakuan ... ..6
Penyimpanan RNA dengan Penambahan Sodium Asetat dan Etanol
Absolut serta disimpan pada suhu 4
0C ... ..8
SIMPULAN DAN SARAN ... ..9
DAFTAR PUSTAKA ... 10
DAFTAR TABEL
Halaman
1
Hasil pengukuran konsentrasi RNA dengan spektrofotometer ... ..6
2
Hasil pengukuran konsentrasi RNA dengan spektrofotometer ... ..6
3
Perbandingan konsentrasi RNA antar perlakuan setelah penyimpanan
selama 2 bulan... ..7
4
Hasil pengukuran konsentrasi RNA yang ditambah sodium asetat dan
DAFTAR GAMBAR
Halaman
1
Struktur sodium asetat... ..2
2
Struktur etanol... ..2
3
Hasil elektoforesis gel agarosa 1% RNA tanaman ... ..6
4
Hasil elektoforesis gel agarosa 1% RNA tanaman ... ..7
5
Elektoforesis gel agarosa 1% RNA tanaman yang disimpan pada
-40
0C ... ..8
6
Elektoforesis gel agarosa 1% RNA tanaman yang disimpan pada
suhu ruang ... ..8
7
Elektoforesis gel agarosa 1%
RNA
tanaman
yang ditambah
sodium asetat dan etanol absolut serta disimpan pada 4
0C selama
2 bulan... ..8
8
Elektoforesis gel agarosa 1% RNA tanaman yang ditambah sodium
asetat dan etanol absolut serta disimpan pada - 20
0C selama 2 bulan ... ..8
9
Elektoforesis gel agarosa 1% RNA tanaman yang ditambah etanol
absolut serta disimpan pada 4
0C selama 2 bulan ... ..8
10 Elektoforesis gel agarosa 1% RNA tanaman yang ditambah etanol
absolut serta disimpan pada suhu ruang selama 2 bulan... ..8
11 Elektroforesis agarosa 1% setelah penyimpanan dengan penambahan
sodium asetat dan etanol absolut pada 4
0C ... ..9
12 Hasil RT-PCR RNA sampel... ..9
DAFTAR LAMPIRAN
Halaman
1
Tahapan penelitian ... 12
2
Tahapan penelitian ... 13
3
Isolasi RNA bark kakao, daun karet, tembakau dan kopi (Chaidamsari T
2005) ... 14
4
Isolasi RNA lateks (CIRAD modification 2007) ... 15
5
Isolasi RNA bunga kakao (Chaidamsari T 2005) ... 16
6
Hasil pengukuran konsentrasi RNA setelah penyimpanan. ... 17
PENDAHULUAN
Asam ribonukleat (RNA) merupakan salah satu biomolekul yang memiliki beberapa fungsi yang berbeda. Salah satu turunan dari RNA adalah ribozim yang mengkatalisis reaksi biokimia sebagaimana kerja enzim pada umumnya. Sejak fungsi RNA yang dapat berdisosiasi dengan DNA dan protein dapat diketahui, RNA dianggap molekul biologis orisinil sebagai bentuk molekul evolusi antara DNA dengan protein.
Molekul RNA berperan penting pada ekspresi gen dan biosintesis protein (Koolman J et al 2000). Semua fungsi sel dan jaringan diatur oleh ekspresi gen, oleh karena itu alasan memilih untuk mempelajari atau meneliti RNA sebagai salah satu parameter biokimia seluler adalah karena keragaman populasi intraseluler RNA itu sendiri (Farrell RE 1993).
Molekul RNA adalah polimer panjang yang tidak bercabang dari gugus ribonukleotida monofosfat yang digabungkan dengan ikatan fosfodiester. Secara kimia dan biologi, molekul RNA bersifat tidak stabil terutama pada suhu tinggi dan dalam keadaan basa (Farrell RE 1993). Sifat molekul RNA yang tidak stabil merupakan sebuah hambatan untuk melakukan penelitian yang menggunakan RNA sebagai parameter penelitian. Karena RNA bila disimpan dalam waktu yang lama akan terdegradasi. Pada umumnya penelitian yang melibatkan RNA, molekul RNA harus disimpan pada suhu di bawah -700C.
Telah diketahui sebelumnya bahwa pada isolasi RNA tumbuhan, sodium asetat dan etanol absolut sangat berperan penting yaitu untuk mengendapkan RNA. Oleh sebab itu diharapkan dengan penelitian ini dapat menghasilkan suatu inovasi baru penyimpanan RNA tanaman dengan penambahan sodium asetat dan etanol absolut. Sampel RNA tanaman yang semula disimpan dalam lemari pendingin dengan suhu -700C dapat disimpan pada suhu -200C, 40C atau pada suhu ruang dengan penambahan Sodium asetat dan etanol absolut atau etanol absolut dengan memperoleh konsentrasi dan tingkat kemurnian yang relatif tetap sama serta tidak terdegradasi setelah disimpan dalam jangka waktu tertentu. Sehingga memudahkan membawa RNA tanaman dari suatu laboraorium yang mempunyai material atau sampel RNA tetapi tidak mempunyai teknologi yang berhubungan dengan RNA ke laboratorium lainnya yang mempunyai
teknologi yang berhubungan dengan RNA tetapi tidak mempunyai material atau sampel.
Penelitian ini bertujuan untuk mencari pelarut yang tepat untuk penyimpanan RNA tanaman guna mempertahankan kestabilannya.
Hipotesis penelitian ini adalah campuran sodium asetat dan etanol absolut (0,1:3) atau etanol absolut dapat memperpanjang masa penyimpanan RNA tanaman.
Manfaat dari hasil penelitian ini diharapkan dapat menemukan suatu metode baru untuk penyimpanan RNA tanaman sehingga mempermudah penanganan RNA dari suatu tempat ke tempat lainnya yang selanjutnya akan membantu penelitian-penelitian yang berhubungan dengan ekspresi gen.
TINJAUAN PUSTAKA
Asam Ribonukleat (RNA)
Asam ribonukleat (RNA) senyawa yang merupakan bahan genetik dan memiliki peran utama dalam ekspresi gen. Dalam dogma pokok (central dogma) genetika molekuler, RNA menjadi perantara antara informasi yang dibawa DNA dan ekspresi fenotip yang diwujudkan dalam bentuk protein.
Molekul RNA merupakan polimer panjang yang tidak bercabang dari gugus ribonukleotida monofosfat yang digabungkan dengan ikatan fosfodiester. Monomer RNA disebut nukleotida, strukturnya terdiri atas tiga komponen utama, yaitu pentosa (ribosa atau gula berkarbon 5), gugus fosfat, dan basa nitrogen (purin dan pirimidin). Basa nitrogen berikatan dengan pentosa membentuk nukleosida. Selanjutnya ketika gugus fosfat bergabung dengan nukleosida dengan ikatan fosfodiester maka akan membentuk nukleotida (Farrell RE 1993). Polimer tersusun dari ikatan berselang-seling antara gugus fosfat suatu nukleotida dengan gugus ribosa dari nukleotida yang lain.
Asam ribonukleotida (RNA) adalah salah satu molekul asam nukleat yang dibentuk oleh asam dioksiribonukleotida (DNA) yang berfungsi untuk mensintesis protein di dalam inti sel. Berdasarkan letak dan fungsinya RNA dibagi tiga, yaitu messenger RNA (mRNA),
transport RNA (tRNA), dan ribosome RNA
ribosom dan berperan aktif dalam proses sintesis protein (Nurhadryani Yet al2004).
Secara kimiawi, perbedaan utama antara DNA dengan RNA adalah (1) gugus hidroksil pada RNA bergabung dengan karbon posisi 2 pada gula ribosa sedangkan pada DNA tidak; (2) pada RNA tidak terdapat basa timin tetapi sebagai gantinya adalah basa urasil. Lebih khusus, RNA disusun oleh prekursor ribonukleotida sedangkan DNA disusun dari prekursor deoksiribonukleotida. Selain itu juga secara kimiawi dan biologis molekul RNA lebih tidak stabil dibandingkan dengan molekul DNA, terutama pada suhu tinggi dan dalam keadaan basa (Farrell RE 1993).
Reverse Transcriptase Polimerase Chain Reaction(RT PCR)
Teknik ini merupakan pengembangan dari teknik PCR yang awal mulanya ditemukan oleh Karry B. Mullis pada tahun 1985. Metode PCR adalah suatu metode enzimatis untuk melipatgandakan secara eksponensial suatu sekuen nukleotida tertentu dengan cara
in-vitro.
Teknik RT PCR merupakan suatu pengembangan dari teknik PCR untuk melakukan analisis terhadap RNA hasil transkripsi yang hanya terdapat dalam jumlah yang sedikit di dalam sel. Teknik RT PCR yang dikembangkan sangat spesifik, sehingga dapat digunakan walaupun jumlah RNA yang akan dianalisis sedikit (Yowono T 2006).
Oleh karena PCR tidak dapat dilakukan dengan menggunakan RNA sebagai cetakan maka harus terlebih dahulu dilakukan transkripsi balik (reverse transcription) terhadap molekul RNA sehingga diperoleh molekul cDNA (complementary DNA). Molekul cDNA tersebut selanjutnya digunakan sebagai cetakan untuk proses PCR selanjutnya. Kegunaan teknik RT PCR antara lain adalah untuk mendeteksi ekspresi gen, untuk amplifikasi RNA sebelum dilakukan kloning dan analisis, maupun untuk diagnosis agensia infektif maupun penyakit genetik (Yowono T 2006).
Teknik RT PCR memerlukan enzim transkriptase balik (reverse transcriptase). Enzim transkriptase balik adalah enzim yang digunakan untuk mensintesis cDNA dengan menggunakan RNA sebagai cetakan. cDNA yang disintesis akan bersifat komplementer dengan RNA cetakan. Beberapa enzim transkriptase yang dapat digunakan antara lain
mesophilic viral reverse transcriptase(RTase) yang dikode oleh virus Avian myoblastosis
(AMV) maupun oleh virus Moloney murine leukemia (M-MuL V), dan Tth DNA polymerase (Yowono T 2006).
Sodium Asetat
Sodium asetat merupakan garam sodium dari asam asetat. Bahan ini merupakan bahan kimia yang murah dan dapat digunakan secara luas. Sebagai konjugat basa dari asam asetat, sodium asetat merupakan senyawa yang relatif bersifat basa kuat. Sebagai konjugat basa dari asam lemah, larutan sodium asetat dan asam asetat dapat berperan sebagai bufer untuk menjaga pH konstan. Kegunaan ini sangat penting terutama dalam aplikasi biokimia yang reaksinya bergantung pada pH. Pada isolasi RNA sodium asetat dapat digunakan untuk mengendapkan RNA. Struktur sodium asetat dapat dilihat pada Gambar 1.
Etanol Absolut
Etanol merupakan jenis alkohol yang sering digunakan dalam kehidupan sehari-hari. Etanol berupa cairan jernih yang mudah terbakar dengan titik didih sebesar 78.50C dan titik beku sebesar -114.50C dan tergolong dalam golongan asam lemah, oleh karena itu etanol dapat digunakan sebagai bahan anti beku. Selain itu etanol dapat mengubah protein dan dapat melarutkan lipid. Etanol dapat dibuat melalui sintesis kimia antara gas etilen dengan uap air dan asam sebagai katalis, umumnya katalis yang sering digunakan adalah asam fosfat.
Etanol terbagi dalam beberapa tipe, salah satunya adalah etanol absolut. Etanol absolut atau alkohol anhidrat, biasa juga disebut etanol terpurifikasi yaitu etanol yang mengandung tidak lebih dari 1 persen air. Struktur etanol dapat dilihat pada Gambar 2.
C H H H C O
O-Na+
Gambar 1 Struktur sodium asetat
C H H H C H H OH
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah nitrogen (N2) cair, pereaksi pre-bufer ekstraksi
(pre-BE), LiCl 8 M, Sodium asetat 3,3M pH 5,2, bufer ekstraksi (BE), fenol:kloroform:isoamilalkohol (25:24:1), dietil pirokarbonat (DEPC), akuabides, polivinil pirolidin (PVP), polivinil poli pirolidon (PPVP) kloroform:isoamilalkohol (24:1), etonol 70%, etanol absolut, Kit sintesis
first stand cDNA (Fermentas), bufer PCR, deoksi nukleotida trifosfat (dNTP), MgCl2,
primer , enzim Taq polimerase, agarosa, etidium bromida (EtBr) dan akuades serta sampel tumbuhan. Sampel yang digunakan adalah kulit batang karet (stimulan dengan eter dan nonstimulan), lateks (stimulan dengan eter dan nonstimulan), daun karet, bunga kakao, daun kopi (transgenik dan nontransgenik), sawit hibrida dan embrio kakao.
Alat-alat yang digunakan adalah penangas air, sentrifus BECKMAN COULTER AllegraTM dengan fixed angle rotor model F0630-3006x30ml, sentrifus DNA speed-vac® DNA 110, pipet volumetrik, mikropipet, pengaduk, tabung sentrifus, lemari pendingin, autoklaf, tip, GeneAmp PCR (Poyimerase Chain Reaction) system 2400, spektrofotometer UV-VIS BECKMAN COULTER-DU®530 , UV T2201 Sigma, neraca analitik, mesin pengaduk, timbangan, lemari asam, cetakan gel agarosa dan tabung eppendroft.
Metode Penelitian
Isolasi RNA Tanaman
Isolasi RNA Kulit Batang Karet, Daun Karet, dan Kopi (Chaidamsari T 2005).
Sebanyak 2 gram sampel digerus dengan N2
cair, lalu ditambahkan dengan 10 ml bufer ekstraksi untuk RNA kulit batang dan daun. Campuran tersebut dikocok dengan kuat dan ditambah dengan 1 volume fenol:kloroform: isoamilalkohol (25:24:1) yang kemudian di aduk dengan mesin pengaduk 3 x 30 detik. Selanjutnya campuran tersebut disentrifus dengan kecepatan 15.000 rpm selama 15 menit pada suhu 40C, lalu lapisan atas dipindahkan ke dalam tabung sentrifus baru yang kemudian diekstraksi lagi dengan kloroform:isoamilalkohol (24:1) dan disentrifus dengan kecepatan 15.000 rpm
selama 15 menit pada suhu 40C. Lapisan atas yang diperoleh setelah sentrifus dipindahkan ke dalam tabung sentrifus baru dan ditambahkan dengan 1/30 volume Sodium asetat 3,3 M pH 5,2 serta 1/10 etanol absolut yang kemudian dikocok perlahan dan disimpan di dalam es selama 30 menit. Kemudian larutan tersebut disentrifus dengan kecepatan 15.000 rpm selama 25 menit pada suhu 40C, supernatan yang diperoleh dibuang sedangkan pellet dicuci dengan alkohol 70% dingin (8.000 rpm, 5 menit), lalu sisa etanol tersebut diuapkan dan endapan dilarutkan dengan larutan DEPC sebanyak 750 µl. selanjutnya RNA dipisahkan dari DNA dengan menambahkan LiCl 8 M sebanyak 250 µl (konsentrasi akhir 2 M), larutan tersebut disimpan di dalam kulkas selama semalam. Setelah disimpan selama semalam, larutan tersebut sentrifus kembali dengan kecepatan 15.000 rpm selama 20 menit pada suhu 40C, lalu endapan dibilas dengan etanol 70% dingin (5.000 rpm, 5 menit) yang kemudian dilarutkan dengan larutan DEPC sebanyak 50-100 µl.
selama 10 menit. Lapisan atas dipindahkan ke dalam tabung baru dan ditambahkan dengan 0,1 volume sodium asetat dan 3 volume etanol absolut. Kemudian disimpan pada suhu -400C selama 3 jam. Setelah itu disentrifus dengan kecepatan 12.000 rpm pada suhu 40C selama 30 menit, lalu cuci dengan etanol 70% dingin (8.000 rpm, 5 menit). Sisa etanol diuapkan dan pellet dilarutkan dengan 50-100 µl akuabides.
Isolasi RNA Bunga Kakao
(Chaidamsari T 2005). Sebanyak 1 gram sampel bunga dan 0,3 gram PVP digerus dengan nitrogen cair, lalu dimasukkan ke dalam 20 ml bufer ekstraksi untuk bunga yang telah ditambahkan 250 µl β-merkaptoetanol dan telah dipanaskan pada penangas air 650C. Kocok kuat dengan mesin pengaduk, lalu inkubasi dalam penangas air pada suhu 650C serta kocok setiap 15 menit. Selanjutnya didiamkan pada suhu kamar selama 5 menit, kemudian diekstraksi dengan 1 volume fenol: kloroform: isoamilalkohol (25:24:1), lalu sentrifus dengan kecepatan 12.000 rpm pada suhu 250C selama 15 menit. Selanjutnya lapisan atas dipindahkan ke dalam tabung sentrifus dan diekstraksi dengan 1 volume kloroform:isoamilalkohol (24:1), lalu sentrifus dengan kecepatan 12.000 rpm pada suhu 250C selama 15 menit. Kemudian lapisan atas dipindahkan ke dalam tabung sentrifus baru dan ditambah dengan LiCl 10 M hingga konsentrasi akhir 2 M dan disimpan pada suhu 40C selama satu malam. Setelah disimpan satu malam, disentrifus dengan kecepatan 17.000 rpm pada suhu 40C selama 30 menit. Selanjutnya supernatan dibuang dan pellet dilarutkan dengan 500 µl akuabides, lalu dipindahkan ke dalam tabung kecil. Ekstraksi kembali dengan 1 volume fenol: kloroform: isoamilalkohol (25:24:1), lalu sentrifus dengan kecepatan 12.000 rpm pada suhu 40C selama 15 menit. Selanjutnya diekstraksi dengan 1 volume kloroform:isoamilalkohol (24:1), lalu sentrifus dengan kecepatan 12.000 rpm pada suhu 40C selama 15 menit. Lapisan atas dipindahkan ke dalam tabung baru dan ditambahkan dengan 0,1 volume sodium asetat dan 3 volume etanol absolut. Kemudian disimpan pada suhu -400C selama kurang lebih 3 jam. Setelah itu disentrifus dengan kecepatan 12.000 rpm pada suhu 40C selama 30 menit, lalu cuci dengan etanol 70% dingin (8.000 rpm, 5 menit). Sisa etanol diuapkan dan pellet dilarutkan dengan 50-100 µl akuabides.
Pengukuran Konsentrasi dan Pengecekan Kemurnian RNA.
Pengukuran Konsentrasi RNA. Sebanyak 3 µl RNA dilarutkan dengan 297 µl larutan DEPC. Selanjutnya larutan tersebut diukur absorbansinya pada panjang gelombang 230 nm, 260 nm, 280 nm. Konsentrasi RNA dapat dengan rumus: Konsentrasi RNA = A 260 x 40 ng/ml x fp dengan A260 adalah absorbansi pada panjang gelombang 260 dan fp adalah faktor pengenceran.
Kemurnian RNA dapat dihitung dengan perbandingan absorbans 260 nm/230 nm. Bila perbandingannya lebih dari 2,0 maka dapat dikatakan bahwa RNA tersebut murni.
Pengecekan Kualitas RNA dengan Elektroforesis Gel Agarosa 1%.
Sebelum melakukan elektroforesis agarosa, harus terlebih dahulu dibuat gel agarosa 1%. Gel agarosa 1% dibuat dengan cara mencampurkan 0,3000 gram agarosa dengan 30 ml TBE 0,5x. Selanjutnya campuran tersebut dipanaskan sampai larut, lalu didinginkan dan ditambah dengan 1,5 µl etidium bromida (EtBr). Kemudian larutan tersebut dimasukkan ke dalam cetakan dan di tunggu sampai padat.
Larutan RNA dicampurkanloading buffer
dengan perbandingan 1: 5. Sementara itu gel tersebut dimasukkan ke dalam wadah yang berisi TBE 0.5x sampai gel tersebut terendam. Selanjutnya campuran tersebut dimasukkan ke dalam sumur yang ada pada gel agarosa dengan mikropipet yang kemudian dialiri dengan arus listrik sebesar 50 atau 25 volt selama 60 sampai 120 menit.
Penyimpanan RNA
ruang sebagai kontrol negatif. Penyimpanan dilakukan selama 2 bulan.
Setelah dilakukan penyimpanan, RNA kembali diukur konsentrasinya dan dipisahkan dengan elektroforesis gel agarosa 1%. Pengukuran konsentrasi dan elektroforesis dilakukan untuk melihat konsentrasi dan kemurnian RNA setelah penyimpanan selama 2 bulan dengan perlakuan dan kontrol yang kemudian akan dibandingkan dengan konsentrasi RNA sebelum penyimpanan. Sehingga diperoleh metode penyimpanan RNA yang terbaik.
Metode terbaik yang diperoleh kemudian diulangi kembali pada sampel kulit batang karet (stimulan dan nonstimulan), daun karet, sawit hibrida, kopi (transgenik dan nontransgenik), lateks (stimulan dan nonstimulan), dan embrio kakao. Selanjutnya setelah disimpan dengan perlakuan RNA tersebut diukur konsentrasi dan di elektroforesis gel agarosa untuk mengetahui konsentrasi, kemurnian dan keutuhannya, setelah itu RNA tersebut di RT-PCR untuk mengetahui dapat atau tidaknya terekspresi gen.
Reverse Transcriptase Polimerase Chain Reaction(RT PCR)
Selain dengan mengukur konsentrasi dan elektroforesis gel agarosa RNA juga di RT-PCR untuk mengetahui dapat atau tidaknya RNA tersebut terekspresi gen setelah perlakuan dan penyimpanan. Sintesis cDNA dilakukan dengan cara melarutkan 2 µg RNA dengan 1µl dNTP dan 1µl oligo dT, lalu ditambahkan dengan akuabides hingga volume 12 µl. Selanjutnya dipanaskan dengan mesin PCR pada suhu 650C selama 5 menit. Setelah itu segera dimasukan ke dalam es dan ditambahkan dengan 4 µl bufer RT, 2 µl DTT dan 1 µl inhibitor RNAse, lalu kocok pelan-pelan dan inkubasi pada suhu 420C selama 2 menit pada mesin PCR. Kemudian buka tutup PCR dan langsung tambahkan dengan 1 µl enzim reverse transcriptase (revert Aid M-MulV). Selanjutnya inkubasi pada suhu 420C selama 50 menit, lalu dengan suhu 700C selama 15 menit. Setelah itu keluarkan dari mesin PCR dan simpan pada suhu -400C. Total cDNA yang diperoleh adalah 20 µl.
Reaksi PCR dilakukan dengan cara melarutkan 1 µl cDNA dengan 5 µl bufer, 0,5 µl MgCL2, 1 µl dNTP, 1 µl primer gene
forward, 1 µl primer gene backward, 1 µl
primer actin forward, 1 µl primer actin backwarddan 1 µl enzim Taq polimerase, lalu
ditambahkan dengan larutan DEPC hingga volume total 50 µl. Selanjutnya dimasukkan ke dalam mesin PCR yang telah diprogram dengan suhu denaturasi 940C, suhuannealing
550C dan suhu elongasi 720C.
Untuk mengetahui hasil RT-PCR RNA yang telah disimpan dengan perlakuan dan kontrol, cDNA hasil RT-PCR dengan RNA (kontrol dan perlakuan) yang telah disimpan sebagai cetakan dipisahkan dengan elektroforesis gel agarosa 1%. Hasil elektroforesis ini juga akan dibandingkan antara cDNA dengan cetakan RNA yang mengalami perlakuan dengan cDNA dengan RNA tidak mengalami perlakuan (kontrol).
HASIL DAN PEMBAHASAN
Hasil Pengukuran Konsentrasi dan Kualitas RNA Setelah Isolasi
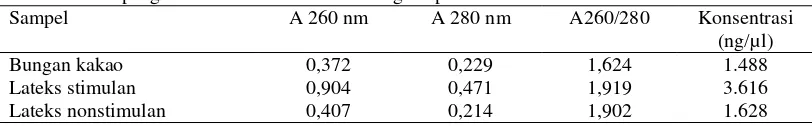
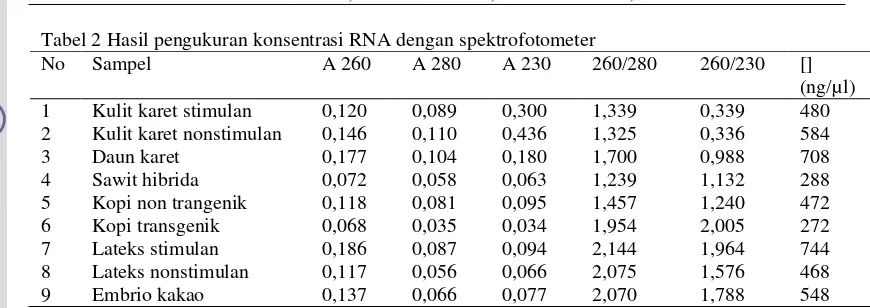
Kuantitas RNA dapat diperoleh dengan cara mengukur konsentrasi RNA sampel, untuk bunga kakao diperoleh konsentrasi sebesar 1.488 ng/µl, lateks stimulan sebesar 3.616 ng/µl dan lateks nonstimulan sebesar 1.628 ng/µl (Tabel 1). Sedangkan untuk sampel kulit karet, daun karet, kopi, sawit hibrida, dan embrio kakao diperoleh konsentrasi yang bervariasi mulai dari yang terendah sebesar 288 ng/µl untuk RNA sawit hibrida sampai yang terbesar sebesar 744 ng/µl untuk RNA lateks stimulan (Tabel 2). Pengukuran konsentrasi RNA dilakukan dengan menggunakan spektrofotometer pada panjang gelombang 260 nm. Selanjutnya dengan absorbansi RNA pada panjang gelombang tersebut dihitung konsentrasinya dengan rumus: [RNA] = A 260 x 40 x fp. dengan A 260 adalah absorbansi pada panjang gelombang 260 nm dan fp adalah faktor pengenceran. Selain pada panjang gelombang 260 nm RNA juga diukur absorbansinya pada panjang gelombang 280 nm untuk mengetahui kemurnian RNA tersebut. Molekul RNA yang murni mempunyai perbandingan absorban pada panjang gelombang 260/280 nm lebih dari 2,0. Bila perbandingan absorbans pada panjang gelombang 260/280nm kurang dari 2.0, pada RNA tersebut masih terdapat pengotor (Farrell RE 1993).
Tabel 1 Hasil pengukuran konsentrasi RNA dengan spektrofotometer
Sampel A 260 nm A 280 nm A260/280 Konsentrasi (ng/µl) Bungan kakao 0,372 0,229 1,624 1.488 Lateks stimulan 0,904 0,471 1,919 3.616 Lateks nonstimulan 0,407 0,214 1,902 1.628
Tabel 2 Hasil pengukuran konsentrasi RNA dengan spektrofotometer
No Sampel A 260 A 280 A 230 260/280 260/230 [] (ng/µl) 1 Kulit karet stimulan 0,120 0,089 0,300 1,339 0,339 480 2 Kulit karet nonstimulan 0,146 0,110 0,436 1,325 0,336 584 3 Daun karet 0,177 0,104 0,180 1,700 0,988 708 4 Sawit hibrida 0,072 0,058 0,063 1,239 1,132 288 5 Kopi non trangenik 0,118 0,081 0,095 1,457 1,240 472 6 Kopi transgenik 0,068 0,035 0,034 1,954 2,005 272 7 Lateks stimulan 0,186 0,087 0,094 2,144 1,964 744 8 Lateks nonstimulan 0,117 0,056 0,066 2,075 1,576 468 9 Embrio kakao 0,137 0,066 0,077 2,070 1,788 548
untuk sampel RNA kulit karet, daun karet, kopi, sawit hibrida, dan embrio kakao juga mempunyai kualitas RNA yang baik dengan menghasilkan 2 pita yang utuh ketika dipisahkan dengan elektroforesis gel agarosa 1% (Gambar 4). Kualitas RNA diamati dengan melakukan elektroforesis gel agarosa 1%. Adanya RNA yang utuh ditandai dengan adanya 2 buah pita yang utuh pada gel agarosa ketika dilihat dengan menggunakan sinar ultraviolet, semakin tebal pita tersebut terlihat semakin bagus pula RNA yang diperoleh. Bila pada gel agarosa hanya terlihat 2 pita yang tidak utuh maka RNA yang diperoleh telah terdegradasi atau rusak (Farrell RE 1993).
Sebelum dilakukan pengukuran konsentrasi dan kualitas RNA, terlebih dahulu dilakukan isolasi RNA dari sampel tanaman yang akan digunakan untuk penelitian. Isolasi RNA tanaman terdiri atas 3 tahap yaitu tahap pemecahan dinding sel yang meliputi penggerusan sampel dengan N2 cair dan
penambahan bufer ektraksi yang berfungsi untuk memecah dinding sel, selanjutnya adalah tahap isolasi RNA yang meliputi ekstraksi dengan fenol:kloroform: isoamilalkohol (25:24:1), kloroform: isoamilalkohol (24:1) yang berfungsi untuk memisahkan lemak, protein dan glukosa serta pengotor lainnya, dan pengendapan RNA dengan etanol absolut dan sodium asetat, tahap selanjutnya adalah tahap pemurnian RNA yang meliputi penambahan LiCl 8 M yang berfungsi untuk memisahkan DNA dengan RNA dan pencucian dengan etanol 70%.
Penyimpanan RNA dengan Beberapa Perlakuan
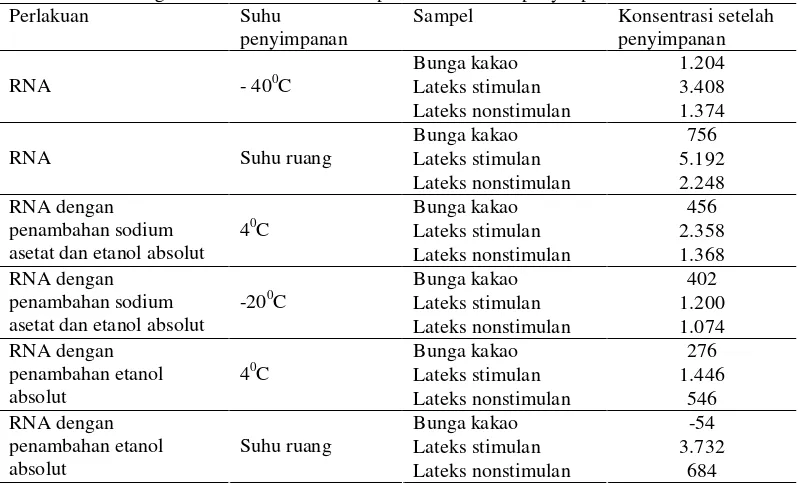
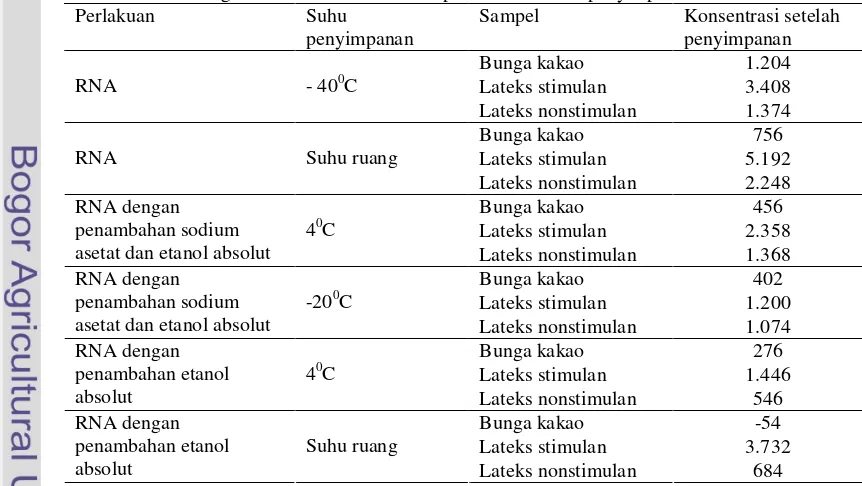
Setelah RNA yang diperoleh disimpan selama 2 bulan dengan beberapa perlakuan. RNA tersebut diukur kembali konsentrasi dan kualitas dengan menggunakan spektrofotometer dan elektroforesis gel agarosa 1%. Konsentrasi RNA tertinggi setelah dilakukan penyimpanan selama 2 bulan diperoleh pada perlakuan dengan menambahkan sodium asetat dan etanol absolut serta disimpan pada suhu 40C. Konsentrasi RNA yang diperoleh pada perlakuan tersebut adalah 456 ng/µl untuk RNA bunga kakao, 2.358 ng/µl untuk RNA lateks stimulan dan 1.368 ng/µl untuk RNA lateks nonstimulan . Konsentrasi tersebut masih lebih rendah dibandingkan dengan konsentrasi RNA kontrol positif yaitu 1.204 ng/µl untuk RNA bunga kakao, 3.408 ng/µl untuk RNA lateks stimulan dan 1.374 ng/µl untuk RNA lateks nonstimulan . Konsentarsi yang lebih rendah dari pada konsentrasi RNA
1 2 3
1 2 3 4 5 6 7 8 9 Gambar 4 Hasil elektoforesis gel agarosa 1%
RNA tanaman. Keterangan: (1&2) RNA kulit batang karet stimulan dan nonstimulan , (3) RNA daun karet, (4) RNA sawit hibrida, (5&6) RNA kopi transgenik dan non trasngenik, (7&8) RNA lateks stimulan dan nonstimulan , (9) RNA embrio kakao
dengan penambahan sodium asetat dan etanol absolut dan disimpan pada 40C diperoleh pada perlakuan-perlakuan yang lainnya. Konsentrasi RNA yang diperoleh dengan penambahan sodium asetat dan etanol absolut serta disimpan pada suhu -200C adalah 402 ng/µl untuk RNA bunga kakao, 1.200 ng/µl untuk RNA lateks stimulan dan 1.074 ng/µl untuk RNA lateks nonstimulan , dengan penambahan etanol absolut dan disimpan pada suhu 40C diperoleh konsentrasi RNA sebesar 276 ng/µl untuk RNA bunga kakao, 1.446 ng/µl untuk RNA lateks stimulan dan 546 ng/µl untuk RNA lateks nonstimulan, dan dengan penambahan etanol serta disimpan pada suhu ruang diperoleh konsentrasi RNA sebesar -54 ng/µl untuk RNA bunga kakao, 3.732 ng/µl untuk RNA lateks stimulan dan 684 ng/µl untuk RNA lateks nonstimulan (Tabel 3).
Selain diperoleh kuantitas, juga diperoleh kualitas RNA setelah penyimpanan selama 2 bulan dengan perlakuan. Sampel RNA yang disimpan pada suhu 400C sebagai kontrol positif mempunyai kualitas RNA yang sangat baik dengan menghasilkan 2 pita yang utuh dan tebal ketika dipisahkan dengan elektroforesis gel agarosa 1% (Gambar 5). Berbeda dengan sampel RNA yang disimpan pada suhu ruang sebagai kontrol negatif akan terdegradasi dan mengalami kerusakan, ketika dipisahkan dengan elektroforesis tidak menunjukkan 2 pita yang utuh (Gambar 6). Penyimpanan RNA pada 40C dengan penambahan sodium asetat dan etanol absolut mempunyai kualitas RNA yang baik setelah penyimpanan walaupun pita yang terbentuk ketika elektroforesis tidak setebal pita yang terbentuk pada kontrol positif (Gambar 7). Begitu pula untuk penyimpanan pada suhu -200C dengan penambahan sodium asetat dan etanol absolut (Gambar 8) dan penyimpanan pada suhu 40C dengan penambahan etanol absolut (Gambar 9) juga memiliki kualitas RNA yang baik. Sedangkan pada penyimpanan pada suhu ruang dengan penambahan etanol absolut akan mengalami kerusakan (Gambar 10).
Walaupun RNA yang diberi perlakuan kualitasnya berkurang tetapi karena konsentrasinya masih tinggi, RNA tersebut masih bisa digunakan untuk penelitian selanjutnya. Metode penyimpanan RNA terbaik berdasarkan perlakuan yang dilakukan adalah RNA yang ditambahkan sodium asetat
Tabel 3 Perbandingan konsentrasi RNA antar perlakuan setelah penyimpanan selama 2 bulan Perlakuan Suhu
penyimpanan
Sampel Konsentrasi setelah penyimpanan Bunga kakao 1.204 Lateks stimulan 3.408 RNA - 400C
Lateks nonstimulan 1.374 Bunga kakao 756 Lateks stimulan 5.192 RNA Suhu ruang
Lateks nonstimulan 2.248 Bunga kakao 456 Lateks stimulan 2.358 RNA dengan
penambahan sodium asetat dan etanol absolut
40C
Lateks nonstimulan 1.368 Bunga kakao 402 Lateks stimulan 1.200 RNA dengan
penambahan sodium asetat dan etanol absolut
-200C
Lateks nonstimulan 1.074 Bunga kakao 276 Lateks stimulan 1.446 RNA dengan
penambahan etanol absolut
40C
Lateks nonstimulan 546 Bunga kakao -54 Lateks stimulan 3.732 RNA dengan
penambahan etanol absolut
Suhu ruang
1 2 3
Gambar 5 Elektoforesis gel agarosa 1% RNA tanaman yang disimpan pada -400C. Keterangan: (1) RNA bunga kakao, (2) RNA leteks stimulan, (3) RNA lateks nonstimulan
1 2 3
Gambar 6 Elektoforesis gel agarosa 1% RNA tanaman yang disimpan pada suhu ruang Keterangan: (1) RNA bunga kakao, (2) RNA leteks stimulan, (3) RNA lateks nonstimulan
1 2 3
Gambar 7 Elektoforesis gel agarosa 1% RNA tanaman yang ditambah sodium asetat dan etanol absolut serta disimpan pada 40C selama 2 bulan. Keterangan: (1) RNA bunga kakao, (2) RNA leteks stimulan, (3) RNA lateks nonstimulan
dan etanol absolut serta disimpan pada suhu 40C, karena selain masih utuh, RNA tersebut juga memiliki konsentrasi tertinggi dibandingkan dengan RNA pada perlakuan yang lain. Oleh karena itu, untuk lebih membuktikan bahwa metode tersebut dapat digunakan untuk penyimpanan RNA. Metode tersebut diuji kembali dengan beberapa sample serta diuji ekspresi gen dengan RT-PCR.
Penyimpanan RNA dengan Penambahan Sodium Asetat dan Etanol Absolut Serta
Disimpan pada Suhu 40C
Setelah penyimpanan pada suhu 40C dengan penambahan sodium asetat dan etanol absolut selama 2 bulan. Sampel RNA diukur kembali konsetrasi dan kualitasnya. Lalu juga dilakukan RT-PCR yang kemudian dibandingkan dengan hasil RT-PCR RNA tanpa perlakuan. Konsentrasi RNA yang ditambah sodium asetat dan etanol absolut
1 2 3
Gambar 8 Elektoforesis gel agarosa 1% RNA tanaman yang ditambah sodium asetat dan etanol absolut serta disimpan pada -200C selama 2 bulan. Keterangan: (1) RNA bunga kakao, (2) RNA leteks stimulan, (3) RNA lateks nonstimulan
1 2 3
Gambar 9 Elektrofresis gel agarosa 1% RNA tanaman yang ditambah etanol absolut serta disimpan pada 40C selama 2 bulan. Keterangan: (1) RNA bunga kakao, (2) RNA leteks stimulan, (3) RNA lateks nonstimulan
1 2 3
Gambar10 Elektoforesis gel agarosa 1% RNA tanaman yang ditambah etanol absolut serta disimpan pada suhu ruang selama 2 bulan. Keterangan: (1) RNA bunga kakao, (2) RNA leteks stimulan, (3) RNA lateks nonstimulan
serta disimpan pada suhu 40C lebih rendah dibandingkan dengan konsentrasi RNA awal. Hal tersebut menunjukkan bahwa sebagian RNA tetap mengalami kerusakan ketika disimpan dengan penambahan sodium asetat dan etanol absolut. Konsentrasi RNA sampel yang tidak diberi perlakuan mencapai 744 ng/µl tetapi setelah ditambah dengan etanol absolut serta disimpan pada suhu 40C, konsentrasi RNA yang diperoleh hanya mencapai 324 ng/µl (Tabel 4). Selain itu, ketika dilakuan elektroforesis, sampel RNA yang tidak diberi perlakuan lebih utuh dibandingkan dengan RNA yang telah ditambah sodium asetat dan etanol absolut serta disimpan pada suhu 40C (Gambar 11).
RNA awal, sampel RNA tersebut masih memungkinkan untuk dipergunakan pada penelitian yang lebih lanjut. Hal tersebut dapat dilihat pada hasil RT-PCR RNA yang ditambah dengan sodium asetat dan etanol absolut serta disimpan pada suhu 40C (Gambar 12), RNA tersebut memberikan hasil ekspresi gen yang sama
[image:30.595.104.501.205.744.2]dengan hasil RT-PCR RNA awal tanpa perlakuan dan penyimpanan (Gambar 13). Kulit karet stimulan, kulit karet nonstimulan, lateks stimulant, lateks nonstimulan, dan daun karet memberikan ekspresi gen pada 275 Kb sedangkan sawit hibrida, kopi transgenik, kopi nontransgenik dan embrio kakao memberikan ekspresi pada 516 Kb.
Tabel 4 Hasil pengukuran konsentrasi RNA yang ditambah sodium asetat dan etanol absolut kemudian disimpan pada suhu 40C selama 2 bulan
No Sampel A 260 A 280 A 230 260/280 260/230 [] (ng/µl) 1 Kulit karet stimulan 0,015 0,010 0,031 1,418 0,480 60 2 Kulit karet nonstimulan 0,039 0,028 0,094 1,407 0,416 156 3 Daun karet 0,032 0,019 0,032 1,687 0,995 128 4 Sawit hibrida 0,024 0,020 0,023 1,214 1,044 96 5 Kopi non trangenik 0,024 0,014 0,017 1,702 1,446 96 6 Kopi transgenik 0,023 0,014 0,016 1,717 1,483 92 7 Lateks stimulan 0,081 0,043 0,052 1,898 1,560 324 8 Lateks nonstimulan 0,037 0,022 0,030 1,689 1,229 148 9 Embrio kakao 0,045 0,025 0,033 1,787 1,337 180
1
2
3
4
5
6
7
8
9
Gambar 11 Elektroforesis agarosa 1% setelah penyimpanan dengan penambahan sodium asetat dan etanol absolut pada 40C. Keterangan:(1&2) RNA kulit batang karet stimulan nonstimulan, (3) daun karet, (4) RNA sawit hibrida, (5&6) kopi transgenik nontrangenik, (7&8) lateks stimulan nonstimulan, (9) embrio kakao
1
2 3 4 5
6
7
8
9 10
Gambar 12 Hasil RT-PCR RNA sampel. Keterangan (1) marker, (2) lateks stimulan, (3) lateks nonstimulan, (4) kulit karet stimulan, (5) kulit karet nonstimulan, (6) daun karet, (7) kopi trangenik, (8) kopi nontransgenik, (9) embrio kakao, (10) sawit hibrida
1 2 3 4 5 6 7 8 9 10 Gambar 13 Hasil RT-PCR RNA setelah
penyimpanan 2 bulan dengan penambahan sodium asetat dan etanol absolut. Keterangan (1) marker, (2) lateks stimulan, (3) lateks nonstimulan, (4) kulit karet stimulan, (5) kulit karet nonstimulan, (6) daun karet, (7) kopi transgenik, (8) kopi non transgenik, (9) embrio kakao, (10) sawit hibrida
SIMPULAN DAN SARAN
Berdasarkan penelitian dapat disimpulkan bahwa RNA tanaman dapat disimpan pada suhu 40C selama dua bulan dengan penambahan sodium asetat dan etanol absolut. Sebagai saran perlu disiapkan RNA berlebih bila menyimpannya pada suhu 40C dengan penambahan sodium asetat dan etanol absolut, karena berkurangnya konsentrasi RNA ketika disimpan. Selain itu juga perlu dilakukan penelitian lebih lanjut untuk mengetahui waktu penyimpanan optimum.
250 Kb
500 Kb
250 Kb
DAFTAR PUSTAKA
Adam RLP, Knowler JT, Leader DP. 1986.
The Biochemistry of The Nucleic Acid.Ed ke-10. New York: Chapman and Hall.
Alberts B et al. 1994. Biologi Molekuler Sel. Ed ke-2. Kantjono AT, penerjemah; Jakarta: Gramedia. Terjemahan dari:
Molecular Biology of The Cell.
Alwine JC, Kemp DJ, Stark GR. 1977. Method for detection of specific RNAs in agarose gel by transfer to diazobenzyloxymethyl paper and hybridization with RNA probe.Proc.nalt. Acad. Sci.U.S.A. 74:5350.
Berger SL, Kimel AR. 1987. Guide to Molecular Cloning Techniques. San Diego: Acdemic Press.
Boetdker H. 1971. Conformation-independent molocular weight determination of RNA by electroforesis .
Biochim. Biophys. Acta. 240:448.
Chaidamsari T. 2005. Biotechnology for cocoa pod borer resistance in cocoa [tesis]. Wageningen: Wageningen University.
Chaidamsari T et al. 2006. Isolation and characterization of an AGAMOUS homologue from cocoa. Plant Science. 170: 968-975.
Chaidamsari T et al. 2006. Ekspresi fenotipe gen APETALA1 kakao (TcAP1) pada eksplan tembakau. Menara Perkebunan. 74: 1-9.
Chang S, Puryear J, Cairney J. 1993. A simple and efficient methods for isolating RNA from pines treess. Plant Mol. Biol. Rep. 16:9-18.
Cooper TG. 1977.The Tools of Biochemstry. New York : John Wiley.
Dahlberg AE, Dingman, Peaccock AC. 1969. Electroforesis characterization of bacterial polysomes in agarose-acryalamide composite gels. Mol. Biol. 41:139.
Farrell RE. 1993. RNA Methodologies: A Laboratory Guide For Isolation and
Characterization. San Diego: Academic Press.
Hart H. 1983. Kimia Organik. Achmadi S, Penerjemah; Jakarta: Erlangga. Terjemahan dari:Organic Chemistry.
Sambrook Jet al. 1989.Molecular Cloning: A Laboratory Manual. 2nd ed. New York: Cold Spring Harbor Laboratory Press.
Koolman J, Klaus HR. 1994. Atlas Berwarna dan Teks Biokimia. Wanandi SI, Penerjemah; Jakarta: Hipokrates. Terjemahan dari: Color Atlas Of Biochemistry.
Lehninger AL. 1982. Dasar-Dasar Biokimia. Thenawijaya M, Penerjemah; Jakarta: Erlangga. Terjemahan dari:Principles Of Biochemistry.
Asif MHet al. 2000. A simple procedure for the isolation of high quality RNA from banana fruit tissue.Plant Mol. Biol.Rep. 18: 1-7.
Asif MHet al. 2000. A simple procedure for the isolation of high quality RNA from ripening banana fruit. Plant Mol. Biol.Rep. 18: 109-115.
Miller K. 1987. Gel electrophoresis of RNA.
Bethesda Res. Lab. Focus.9:14.
Murray RKet al.1999.Biokimia Harper. Ed ke-24. Hartono A, penerjemah; Santoso AH, editor. Jakarta: EGC. Terjemahan dari:Harper’s Biochemisty.
Ogden RC, Adam DA. 1987. Electrophoresis in Agarose and acrylamide gels.Methods Enzymol. 152:61.
Poedjiadi A.1994. Dasar-Dasar Biokimia. Jakarta:UI-Press.
Reijnders L, Sloof P, Borst P (1973). Gel electrophoresis of RNA under denaturing conditions. Biochim. Biophys. Acta. 324: 320.
Isolasi RNA
pengukuran konsentrasi RNA
pengecekan kemurnian RNA
RNA
RNA + sodium asetat dan etanol absolut
RNA + etanol absolut
Simpan 1 minggu
pada -70
0C
Simpan 1minggu
pada -20
0C
Simpan 1 minggu
pada 4
0C
Simpan 1 minggu
pada 4
0C
RNA
Simpan 1 minggu
pada suhu ruang
Pengukuran
konsentrasi &
Elektroforesis
Pengukuran
konsentrasi &
Elektroforesis
Pengukuran
konsentrasi &
Elektroforesis
Pengukuran
konsentrasi &
Elektroforesis
Pengukuran
konsentrasi &
Elektroforesis
Isolasi RNA
pengukuran konsentrasi RNA
pengecekan kualitas RNA
Penyimpanan RNA dengan perlakuan terbaik dari 4 perlakuan yang telah dilakukan
pengukuran konsentrasi RNA
pengecekan kualitas RNA
Lampiran 3 Isolasi RNA bark kakao, daun karet, tembakau dan kopi (Chaidamsari
T 2005).
2 gram sampel digerus dengan N
2cair
Masukkan ke dalam 10 ml pereaksi BE
kocok kuat dan + 1 v fenol: kloroform: isoamilalkohol (25:24:1), kocok 3 x 30 detik
sentrifus 15.000 rpm, 15 menit pada suhu 4
0C
lapisan atas diekstraksi dengan 1v kloroform: isoamilalkohol (24:1), sentrifus 15.000 rpm, 15 menit, 4
0C
Lapisan atas ditambahkan dengan 1/30 volume Sodium asetat 3.3 M pH 5.2 serta 1/10 etanol absolut,
kocok perlahan dan disimpan di dalam es selama 30 menit
sentrifus 15.000 rpm, 25 menit pada suhu 4
0C
Supernatan dibuang dan pellet dicuci dengan etanol 70%
Tambah 750 µl DEPC dan 250 µl LiCl 8 M, simpan 1 malam pada T = 4
0C
Sentrifus 12.000 rpm, 20 menit, 4
0C
Cuci dengan etanol 70% dingin
Lampiran 4 Isolasi RNA lateks (CIRAD modification 2007)
Lateks beku + bufer dipanaskan dalam penangas pada suhu 50
0C selama 1 jam
Sentrifus 15.000 rpm, 30 menit, 20
0C
Fraksi putih diekstrak dengan 1v P: C: I (25: 24:1). Sentrifus 10.000 rpm, 10 menit, 4
0C
lapisan atas diekstrak dengan 1v C: I (24:1). Sentrifus 10.000 rpm, 10 menit, 4
0C
lapisan atas ditambah 1/3 volume LiCl 8 M dan disimpan pada suhu 4
0C 1 malam
Sentrifus 10.000 rpm, 30 menit, 4
0C
Supernatan dibuan, pellet dilarutkan dengan 400 µl akuabides
Sentrifus 10.000 rpm, 10 menit, 4
0C
Ektraksi dengan P: C: I (25:24:1) dan dengan C: I (24:1)
Lapisan atas ditambahkan dengan 0,1v sodium asetat dan 3v etanol absolut
Lampiran 5 Isolasi RNA bunga kakao (Chaidamsari T 2005).
1 g sampel bunga + 0,3 g PVP digerus N
2cair
masukkan ke dalam 20 ml buffer CTAB + 250 µl
β
-merkaptoetanol, kocok kuat
inkubasi dalam penangas pada suhu 65
0C, kocok setiap 15 menit.
ekstrak dengan 1v P: C: I (25: 24:1). Sentrifus 12.000 rpm, 15 menit, 25
0C
lapisan atas diekstrak dengan 1v C: I (24:1). Sentrifus 12.000 rpm, 15 menit, 25
0C
lapisan atas ditambah LiCl 10 M hingga konsentrasi akhir 2 M. disimpan pada suhu 4
0C 1 malam
Sentrifus 17.000 rpm, 30 menit, 4
0C
Supernatan dibuang, pellet dilarutkan dengan 500 µl akuabides
Ektraksi dengan P: C: I (25:24:1) dan dengan C: I (24:1)
Sentrifus 12.000 rpm, 15 menit, 4
0C
Lapisan atas ditambahkan dengan 0,1v sodium asetat dan 3v etanol absolut
Simpan pada -40
0C, 3 jam. Sentrifus 12.000 rpm, 30 menit, 4
0C
Lampiran 6 Hasil pengukuran konsentrasi RNA setelah penyimpanan.
Hasil pengukuran konsentrasi RNA yang disimpan pada suhu -40
0C selama 2
bulan
Sampel
A 260 nm
A 280 nm
A260/280
Konsentrasi
(ng/µl)
Bunga kakao
0,301
0,164
1,835
1.204
Lateks stimulan
0,568
0,335
1,600
3.408
Lateks non stimulan
0,229
0,152
1,506
1.374
Hasil pengukuran konsentrasi RNA yang disimpan pada suhu ruang selama 2
bulan
Sampel
A 260 nm
A 280 nm
A260/280
Konsentrasi
(ng/µl)
Bunga kakao
0,189
0,102
1,852
756
Lateks stimulan
1,298
0,711
1,825
5.192
Lateks non stimulan
0,562
0,311
1,807
2.248
Hasil pengukuran konsentrasi RNA yang ditambah sodium asetat dan etanol
absolut kemudian disimpan pada suhu 4
0C selama 2 bulan
Sampel
A 260 nm
A 280 nm
A260/280
Konsentrasi
(ng/µl)
Bunga kakao
0,076
0,053
1,433
456
Lateks stimulan
0,393
0,239
1,644
2.358
Lateks non stimulan
0,228
0,158
1,443
1.368
Hasil pengukuran konsentrasi RNA yang ditambah sodium asetat dan etanol
absolut kemudian disimpan pada suhu -20
0C selama 2 bulan
Sampel
A 260 nm
A 280 nm
A260/280
Konsentrasi
(ng/µl)
Bunga kakao
0,067
0,047
1,425
402
Lateks stimulan
0,200
0,122
1,639
1.200
Lateks non stimulan
0,179
0,112
1,598
1.074
Hasil pengukuran konsentrasi RNA yang ditambah etanol absolut kemudian
disimpan pada suhu 4
0C selama 2 bulan
Sampel
A 260 nm
A 280 nm
A260/280
Konsentrasi
(ng/µl)
Bunga kakao
0,046
0,035
1,314
276
Lateks stimulan
0,241
0,142
1,697
1.446
Lanjutan lampiran 6.
Hasil pengukuran konsentrasi RNA ditambah dengan etanol absolut kemudian
disimpan pada suhu suhu ruang selama 2 bulan
Sampel
A 260 nm
A 280 nm
A260/280
Konsentrasi
(ng/µl)
Bunga kakao
-0,009
0,004
-2,25
-54
Lateks stimulan
0,622
0,336
1,851
3.732
Lampiran 7 Pembuatan pereaksi.
LiCl 8 M
LiCl 8 M dibuat dengan cara melarutkan 16,9560 gram LiCl ke dalam 50 ml
DEPC H
2O.
Sodium asetat 3.3 M pH 5.2
Sodium asetat dibuat dengan cara melarutkan Na-asetat ke dalam 50 ml DEPC
H
2O. Selanjutnya diatur pH menjadi 5,2 dengan asetat glasial.
Triz HCl 1 M pH 8
Trizma basa
= 6.055 gram
HCl
= 0.4 ml
DEPC sampai volume 50 ml
atur pH 8 dengan penambahan HCl pekat
EDTA 0.5 M pH 8
EDTA
= 9.305 gram
NaOH
= 1 gram
DEPC sampai volume 50 ml
atur pH 8 dengan penambahan NaOH 10 N
N- cetyl-N,N,N-trimethyl-ammoniumbromide (CTAB) 10%
NaCl
= 2.05 gram
CTAB
= 5 gram
DEPC sampai volume 50 ml
NaCl 5 M
NaCl
= 14.61 gram
DEPC sampai volume 50 ml
LiCl 10 M
LiCl
= 21.195 gram
Lanjutan lampiran 7.
Pembuatan pereaksi Pre-buffer ekstraksi (pre-BE)
Pre-BE dibuat dengan melarutkan:
Trizma basa
0,2 M : 2,4288 gram
LiCl
0,3 M : 1,2717 gram
EDTA
0,01M : 0,3722 gram
Dilarutkan dengan 100 ml akuades dan diatur pH 8,5 dengan HCl serta ditambah
1% PVP.
Buffer ekstraksi untuk RNA kulit batang dan daun
Ke dalam 50 ml pre-BE ditambahkan dengan:
Thiourea
5 mM : 0,0190 gram
Aurin trikarboksilat
1 mM : 0,0210 gram
Merkaptoetanol
: 0.5 ml
Buffer ekstraksi untuk RNA bunga
Untuk volume 100 ml:
Trisma HCl
0.1M
: 10 ml trizma HCl 1 M pH 8
NaCl
1.4 M
: 28 ml NaCl 5M
EDTA
0.02 M
: 4 ml EDTA 0.5 M
CTAB
2%
: 20 ml 10%
Akuades
: 38 ml
Buffer ekstraksi untuk RNA lateks
Tris HCl pH 9
100 mM
EDTA pH 8
10 mM
LiCl
300 mM
METODE MEMPERTAHANKAN KUALITAS DAN
KUANTITAS ASAM RIBONUKLEAT (RNA) TANAMAN
M. REZEKI MUAMMAR
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
MUHAMMAD REZEKI MUAMMAR. Metode Mempertahankan Kualitas dan
Kuantitas Asam Ribonukleat (RNA) Tanaman. Dibimbing oleh MARIA
BINTANG dan TETTY CHAIDAMSARI.
ABSTRACT
MUHAMMAD REZEKI MUAMMAR. Quality and Quantity Maintenance
Method of Plant Ribonucleic Acid (RNA). Under the direction of MARIA
BINTANG and TETTY CHAIDAMSARI.
METODE MEMPERTAHANKAN KUALITAS DAN
KUANTITAS ASAM RIBONUKLEAT (RNA) TANAMAN
M. REZEKI MUAMMAR
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Bioimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Metode Mempertahankan
Kualitas
dan
Kuantitas Asam
Ribonukleat (RNA) Tanaman.
Nama
: M. Rezeki Muammar
NIM
: G44103005
Disetujui
Komisi Pembimbing
Prof.Dr.drh. Maria Bintang, M.S.
Ketua
Dr. Tetty Chaidamsari, M.Si.
Anggota
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, M.S.
NIP 131 473 999
PRAKATA
Puji dan syukur kehadirat Allah SWT karena atas rahmat dan karunia-Nya
penulis dapat menyelesaikan penelitian ini beserta laporannya. Laporan ini
disusun berdasarkan hasil penelitian yang dilaksanakan mulai Januari sampai Juni
2007 di Laboratorium Biologi Molekuler dan Rekayasa Genetika, Balai Penelitian
Bioteknologi Perkebunan Indonesia, Bogor.
Terima kasih penulis ucapkan kepada berbagai pihak yang telah membantu
penulis selama penelitian maupun penyusunan laporan ini, antara lain kepada
Prof.Dr.drh. Maria Bintang, M.S. selaku pembimbing Utama, Dr. Tetty
Chaidamsari, M.Si. selaku pembimbing anggota, mbak Niyyah, mbak Herti, mas
Riza serta seluruh staf di Laboratorium Biologi Molekuler dan Rekayasa
Genetika, Balai Penelitian Bioteknologi Perkebunan Indonesia, Bogor. Ucapan
terima kasih juga disampaikan kepada ayah, ibu dan seluruh keluarga yang
senantiasa memberi motivasi, doa dan kasih sayangnya.
Penulis menyadari bahwa laporan ini masih jauh dari kesempurnaan, oleh
karena itu penulis mengharapkan kritik dan saran demi kesempurnaan laporan ini.
Akhirnya penulis berharap agar laporan ini berguna untuk semua pihak.
Bogor, Juli 2007
RIWAYAT HIDUP
Penulis dilahirkan di Aceh Pidie tepatnya di Sigli pada tanggal 17
September 1985 sebagai anak pertama dari tiga bersaudara dari ayah yang
bernama Jarir dan ibu bernama Nurila Nurdin.
Tahun 2003 penulis lulus dari MAS Jeumala Amal Lueng Putu dan pada
tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk
IPB (USMI). Penulis menempuh studi di Program Studi Biokimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR TABEL... …vi
DAFTAR GAMBAR ... ...vii
DAFTAR LAMPIRAN... ..viii
PENDAHULUAN ... ..1
TINJAUAN PUSTAKA
Asam Ribonukleat (RNA) ... ..1
Reverse Transcriptase Polimerase Chain Reaction
(RT PCR) ... ..2
Sodium Asetat... ..2
Etanol Absolut ... ..2
BAHAN DAN METODE
Bahan dan Alat ... ..3
Metode Penelitian ... ..3
HASIL DAN PEMBAHASAN
Hasil Pengukuran Konsentrasi dan Kualitas RNA Setelah Isolasi ... ..5
Penyimpanan RNA dengan Beberapa Perlakuan ... ..6
Penyimpanan RNA dengan Penambahan Sodium Asetat dan Etanol
Absolut serta disimpan pada suhu 4
0C ... ..8
SIMPULAN DAN SARAN ... ..9
DAFTAR PUSTAKA ... 10
DAFTAR TABEL
Halaman
1
Hasil pengukuran konsentrasi RNA dengan spektrofotometer ... ..6
2
Hasil pengukuran konsentrasi RNA dengan spektrofotometer ... ..6
3
Perbandingan konsentrasi RNA antar perlakuan setelah penyimpanan
selama 2 bulan... ..7
4
Hasil pengukuran konsentrasi RNA yang ditambah sodium asetat dan
DAFTAR GAMBAR
Halaman
1
Struktur sodium asetat... ..2
2
Struktur etanol... ..2
3
Hasil elektoforesis gel agarosa 1% RNA tanaman ... ..6
4
Hasil elektoforesis gel agarosa 1% RNA tanaman ... ..7
5
Elektoforesis gel agarosa 1% RNA tanaman yang disimpan pada
-40
0C ... ..8
6
Elektoforesis gel agarosa 1% RNA tanaman yang disimpan pada
suhu ruang ... ..8
7
Elektoforesis gel agarosa 1%
RNA
tanaman
yang ditambah
sodium asetat dan etanol absolut serta disimpan pada 4
0C selama
2 bulan... ..8
8
Elektoforesis gel agarosa 1% RNA tanaman yang ditambah sodium
asetat dan etanol absolut serta disimpan pada - 20
0C selama 2 bulan ... ..8
9
Elektoforesis gel agarosa 1% RNA tanaman yang ditambah etanol
absolut serta disimpan pada 4
0C selama 2 bulan ... ..8
10 Elektoforesis gel agarosa 1% RNA tanaman yang ditambah etanol
absolut serta disimpan pada suhu ruang selama 2 bulan... ..8
11 Elektroforesis agarosa 1% setelah penyimpanan dengan penambahan
sodium asetat dan etanol absolut pada 4
0C ... ..9
12 Hasil RT-PCR RNA sampel... ..9
DAFTAR LAMPIRAN
Halaman
1
Tahapan penelitian ... 12
2
Tahapan penelitian ... 13
3
Isolasi RNA bark kakao, daun karet, tembakau dan kopi (Chaidamsari T
2005) ... 14
4
Isolasi RNA lateks (CIRAD modification 2007) ... 15
5
Isolasi RNA bunga kakao (Chaidamsari T 2005) ... 16
6
Hasil pengukuran konsentrasi RNA setelah penyimpanan. ... 17
PENDAHULUAN
Asam ribonukleat (RNA) merupakan salah satu biomolekul yang memiliki beberapa fungsi yang berbeda. Salah satu turunan dari RNA adalah ribozim yang mengkatalisis reaksi biokimia sebagaimana kerja enzim pada umumnya. Sejak fungsi RNA yang dapat berdisosiasi dengan DNA dan protein dapat diketahui, RNA dianggap molekul biologis orisinil sebagai bentuk molekul evolusi antara DNA dengan protein.
Molekul RNA berperan penting pada ekspresi gen dan biosintesis protein (Koolman J et al 2000). Semua fungsi sel dan jaringan diatur oleh ekspresi gen, oleh karena itu alasan memilih untuk mempelajari atau meneliti RNA sebagai salah satu parameter biokimia seluler adalah karena keragaman populasi intraseluler RNA itu sendiri (Farrell RE 1993).
Molekul RNA adalah polimer panjang yang tidak bercabang dari gugus ribonukleotida monofosfat yang digabungkan dengan ikatan fosfodiester. Secara kimia dan biologi, molekul RNA bersifat tidak stabil terutama pada suhu tinggi dan dalam keadaan basa (Farrell RE 1993). Sifat molekul RNA yang tidak stabil merupakan sebuah hambatan untuk melakukan penelitian yang menggunakan RNA sebagai parameter penelitian. Karena RNA bila disimpan dalam waktu yang lama akan terdegradasi. Pada umumnya penelitian yang melibatkan RNA, molekul RNA harus disimpan pada suhu di bawah -700C.
Telah diketahui sebelumnya bahwa pada isolasi RNA tumbuhan, sodium asetat dan etanol absolut sangat berperan penting yaitu untuk mengendapkan RNA. Oleh sebab itu diharapkan dengan penelitian ini dapat menghasilkan suatu inovasi baru penyimpanan RNA tanaman dengan penambahan sodium asetat dan etanol absolut. Sampel RNA tanaman yang semula disimpan dalam lemari pendingin dengan suhu -700C dapat disimpan pada suhu -200C, 40C atau pada suhu ruang dengan penambahan Sodium asetat dan etanol absolut atau etanol absolut dengan memperoleh konsentrasi dan tingkat kemurnian yang relatif tetap sama serta tidak terdegradasi setelah disimpan dalam jangka waktu tertentu. Sehingga memudahkan membawa RNA tanaman dari suatu laboraorium yang mempunyai material atau sampel RNA tetapi tidak mempunyai teknologi yang berhubungan dengan RNA ke laboratorium lainnya yang mempunyai
teknologi yang berhubungan dengan RNA tetapi tidak mempunyai material atau sampel.
Penelitian ini bertujuan untuk mencari pelarut yang tepat untuk penyimpanan RNA tanaman guna mempertahankan kestabilannya.
Hipotesis penelitian ini adalah campuran sodium asetat dan etanol absolut (0,1:3) atau etanol absolut dapat memperpanjang masa penyimpanan RNA tanaman.
Manfaat dari hasil penelitian ini diharapkan dapat menemukan suatu metode baru untuk penyimpanan RNA tanaman sehingga mempermudah penanganan RNA dari suatu tempat ke tempat lainnya yang selanjutnya akan membantu penelitian-penelitian yang berhubungan dengan ekspresi gen.
TINJAUAN PUSTAKA
Asam Ribonukleat (RNA)
Asam ribonukleat (RNA) senyawa yang merupakan bahan genetik dan memiliki peran utama dalam ekspresi gen. Dalam dogma pokok (central dogma) genetika molekuler, RNA menjadi perantara antara informasi yang dibawa DNA dan ekspresi fenotip yang diwujudkan dalam bentuk protein.
Molekul RNA merupakan polimer panjang yang tidak bercabang dari gugus ribonukleotida monofosfat yang digabungkan dengan ikatan fosfodiester. Monomer RNA disebut nukleotida, strukturnya terdiri atas tiga komponen utama, yaitu pentosa (ribosa atau gula berkarbon 5), gugus fosfat, dan basa nitrogen (purin dan pirimidin). Basa nitrogen berikatan dengan pentosa membentuk nukleosida. Selanjutnya ketika gugus fosfat bergabung dengan nukleosida dengan ikatan fosfodiester maka akan membentuk nukleotida (Farrell RE 1993). Polimer tersusun dari ikatan berselang-seling antara gugus fosfat suatu nukleotida dengan gugus ribosa dari nukleotida yang lain.
Asam ribonukleotida (RNA) adalah salah satu molekul asam nukleat yang dibentuk oleh asam dioksiribonukleotida (DNA) yang berfungsi untuk mensintesis protein di dalam inti sel. Berdasarkan letak dan fungsinya RNA dibagi tiga, yaitu messenger RNA (mRNA),
transport RNA (tRNA), dan ribosome RNA
ribosom dan berperan aktif dalam proses sintesis protein (Nurhadryani Yet al2004).
Secara kimiawi, perbedaan utama antara DNA dengan RNA adalah (1) gugus hidroksil pada RNA bergabung dengan karbon posisi 2 pada gula ribosa sedangkan pada DNA tidak; (2) pada RNA tidak terdapat basa timin tetapi sebagai gantinya adalah basa urasil. Lebih khusus, RNA disusun oleh prekursor ribonukleotida sedangkan DNA disusun dari prekursor deoksiribonukleotida. Selain itu juga secara kimiawi dan biologis molekul RNA lebih tidak stabil dibandingkan dengan molekul DNA, terutama pada suhu tinggi dan dalam keadaan basa (Farrell RE 1993).
Reverse Transcriptase Polimerase Chain Reaction(RT PCR)
Teknik ini merupakan pengembangan dari teknik PCR yang awal mulanya ditemukan oleh Karry B. Mullis pada tahun 1985. Metode PCR adalah suatu metode enzimatis untuk melipatgandakan secara eksponensial suatu sekuen nukleotida tertentu dengan cara
in-vitro.
Teknik RT PCR merupakan suatu pengembangan dari teknik PCR untuk melakukan analisis terhadap RNA hasil transkripsi yang hanya terdapat dalam jumlah yang sedikit di dalam sel. Teknik RT PCR yang dikembangkan sangat spesifik, sehingga dapat digunakan walaupun jumlah RNA yang akan dianalisis sedikit (Yowono T 2006).
Oleh karena PCR tidak dapat dilakukan dengan menggunakan RNA sebagai cetakan maka harus terlebih dahulu dilakukan transkripsi balik (reverse transcription) terhadap molekul RNA sehingga diperoleh molekul cDNA (complementary DNA). Molekul cDNA tersebut selanjutnya digunakan sebagai cetakan untuk proses PCR selanjutnya. Kegunaan teknik RT PCR antara lain adalah untuk mendeteksi ekspresi gen, untuk amplifikasi RNA sebelum dilakukan kloning dan analisis, maupun untuk diagnosis agensia infektif maupun penyakit genetik (Yowono T 2006).
Teknik RT PCR memerlukan enzim transkriptase balik (reverse transcriptase). Enzim transkriptase balik adalah enzim yang digunakan untuk mensintesis cDNA dengan menggunakan RNA sebagai cetakan. cDNA yang disintesis akan bersifat komplementer dengan RNA cetakan. Beberapa enzim transkriptase yang dapat digunakan antara lain
mesophilic viral reverse transcriptase(RTase) yang dikode oleh virus Avian myoblastosis
(AMV) maupun oleh virus Moloney murine leukemia (M-MuL V), dan Tth DNA polymerase (Yowono T 2006).
Sodium Asetat
Sodium asetat merupakan garam sodium dari asam asetat. Bahan ini merupakan bahan kimia yang murah dan dapat digunakan secara luas. Sebagai konjugat basa dari asam asetat, sodium asetat merupakan senyawa yang relatif bersifat basa kuat. Sebagai konjugat basa dari asam lemah, larutan sodium asetat dan asam asetat dapat berperan sebagai bufer untuk menjaga pH konstan. Kegunaan ini sangat penting terutama dalam aplikasi biokimia yang reaksinya bergantung pada pH. Pada isolasi RNA sodium asetat dapat digunakan untuk mengendapkan RNA. Struktur sodium asetat dapat dilihat pada Gambar 1.
Etanol Absolut
Etanol merupakan jenis alkohol yang sering digunakan dalam kehidupan sehari-hari. Etanol berupa cairan jernih yang mudah terbakar dengan titik didih sebesar 78.50C dan titik beku sebesar -114.50C dan tergolong dalam golongan asam lemah, oleh karena itu etanol dapat digunakan sebagai bahan anti beku. Selain itu etanol dapat mengubah protein dan dapat melarutkan lipid. Etanol dapat dibuat melalui sintesis kimia antara gas etilen dengan uap air dan asam sebagai katalis, umumnya katalis yang sering digunakan adalah asam fosfat.
Etanol terbagi dalam beberapa tipe, salah satunya adalah etanol absolut. Etanol absolut atau alkohol anhidrat, biasa juga disebut etanol terpurifikasi yaitu etanol yang mengandung tidak lebih dari 1 persen air. Struktur etanol dapat dilihat pada Gambar 2.
C H H H C O
O-Na+
Gambar 1 Struktur sodium asetat
C H H H C H H OH
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah nitrogen (N2) cair, pereaksi pre-bufer ekstraksi
(pre-BE), LiCl 8 M, Sodium asetat 3,3M pH 5,2, bufer ekstraksi (BE), fenol:kloroform:isoamilalkohol (25:24:1), dietil pirokarbonat (DEPC), akuabides, polivinil pirolidin (PVP), polivinil poli pirolidon (PPVP) kloroform:isoamilalkohol (24:1), etonol 70%, etanol absolut, Kit sintesis
first stand cDNA (Fermentas), bufer PCR, deoksi nukleotida trifosfat (dNTP), MgCl2,
primer , enzim Taq polimerase, agarosa, etidium bromida (EtBr) dan akuades serta sampel tumbuhan. Sampel yang digunakan adalah kulit batang karet (stimulan dengan eter dan nonstimulan), lateks (stimulan dengan eter dan nonstimulan), daun karet, bunga kakao, daun kopi (transgenik dan nontransgenik), sawit hibrida dan embrio kakao.
Alat-alat yang digunakan adalah penangas air, sentrifus BECKMAN COULTER AllegraTM dengan fixed angle rotor model F0630-3006x30ml, sentrifus DNA speed-vac® DNA 110, pipet volumetrik, mikropipet, pengaduk, tabung sentrifus, lemari pendingin, autoklaf, tip, GeneAmp PCR (Poyimerase Chain Reaction) system 2400, spektrofotometer UV-VIS BECKMAN COULTER-DU®530 , UV T2201 Sigma, neraca analitik, mesin pengaduk, timbangan, lemari asam, cetakan gel agarosa dan tabung eppendroft.
Metode Penelitian
Isolasi RNA Tanaman
Isolasi RNA Kulit Batang Karet, Daun Karet, dan Kopi (Chaidamsari T 2005).
Sebanyak 2 g