KANDUNGAN TIMAH HITAM (Pb) DAN KADMIUM (Cd)
DALAM A IR, SEDIMEN DAN BIOAKUMULASI SERTA
RESPON HISTOPATOLOGIS ORGAN IKAN ALU-ALU
(Sphyraena barracuda) DI PERAIRAN TELUK JAKARTA
OKTO KHAISAR
SKRIPSI
DEPARTEMEN MANAJEMEN SUMBERDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul :
KANDUNGAN TIMAH HITAM (Pb) DAN KADMIUM (Cd) DALAM AIR, SEDIMEN DAN BIOAKUMULASI SERTA RESPON HISTOPATOLOGIS ORGAN IKAN ALU-ALU (Sphyraena barracuda) DI PERAIRAN TELUK JAKARTA
adalah benar merupakan hasil karya sendiri dan belum pernah diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan oleh penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Skripsi ini.
Bogor, Februari 2006
ABSTR AK
OKTO KHAISAR
.
Kandungan Timah Hitam (Pb) dan Kadmium (Cd) dalam Air, Sedimen dan Bioakumulasi serta Respon Histopatologis Organ Ikan Alu-Alu (Sphyraena barracuda) di Perairan Teluk Jakarta. Dibimbing oleh ETTY RIANIdan M. MUKHLIS KAMAL.
Logam berat yang masuk ke perairan akan terakumulasi baik di badan perairan, sedimen, maupun di dalam tubuh organisme yang hidup pada perairan yang sudah terkontaminasi. Semakin lama suatu perairan tercemar oleh suatu substansi beracun, maka dapat dipastikan keberadaannya membahayakan kondisi biota lingkungan perairan. Penelitian dilaksanakan pada bulan Oktober hingga Desember 2004 pada perairan Ancol, Teluk Jakarta. Lokasi pengambilan contoh dibagi menjadi 4 stasiun, dengan stasiun 1 terletak di sebelah barat dan stasiun 4 di sebelah timur. Pengambilan contoh air dan sedimen dilakukan pada stasiun 1, 2, 3, dan 4, sedangkan contoh ikan alu-alu (Sphyraena barracuda) diambil pada stasiun 1, 3, dan 4. Data primer berupa kandungan logam Pb dan Cd pada ikan didapatkan setelah dilakukan analisa dengan menggunakan metode Atomic Absorption Spectrophotometry (AAS) pada laboratorium terpadu FKH-IPB serta data histologi organ dalam ikan yang dilakukan analisanya di Balai Penelitian dan Veteriner Bogor.
Hasil penelitian menunjukkan bahwa tingkat pencemaran perairan Ancol oleh logam Pb dan Cd pada waktu penelitian berlangsung masih berada di bawah baku mutu kualitas air menurut Keputusan Menteri Negara Lingkungan Hidup nomor 51 tahun 2004 tentang baku mutu air laut. Hal ini dikarenakan konsentrasinya lebih kecil dari 0.0001 ppm. Konsentrasi Pb dan Cd di sedimen perairan pada waktu penelitian juga masih tergolong aman untuk kehidupan biota. Menurut baku mutu standar internasional Dutch Quality Standards for Metals in Sediments, level terendah konsentrasi Pb yang masih dapat ditolerir sebesar 85 mg/kg, sedangkan untuk logam Cd 0.8 mg/kg (IADC/CEDA 1997). Akan tetapi apabila dilakukan analisa hingga tingkat jaringan, maka didapatkan hasil bahwa paparan ikan terhadap logam berat dapat mengakibatkan kerusakan beberapa jaringan organ dalam ikan alu-alu seperti insang, hati, ginjal, limfa, dan daging. Jenis kerusakan yang terjadi seperti degenerasi inti sel (ginjal), vacuolation (ginjal), degenerasi miofibril (daging), peradangan sel (ginjal), pendarahan (hati dan limfa). Hal ini dikarenakan respon dari perubahan struktur sel merupakan parameter yang paling sensitif sebelum terlihatnya respon yang dapat terlihat dari luar seperti perubahan tingkah laku, pola reproduksi, dan struktur komunitas.
KANDUNGAN TIMAH HITAM (Pb) DAN KADMIUM (Cd)
DALAM AIR, SEDIMEN DAN BIOAKUMULASI SERTA
RESPON HISTOPATOLOGIS ORGAN IKAN ALU-ALU
(Sphyraena barracuda
) DI PERAIRAN TELUK JAKARTA
OKTO KHAISAR
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Departemen Manajemen Sumberdaya Perairan
DEPARTEMEN MANAJEMEN SUMBERDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
SKRIPSI
Judul Skripsi : Kandungan Timah Hitam (Pb) dan Kadmium (Cd) dala m Air, Sedimen dan Bioakumulasi serta respon histopatologis organ Ikan Alu-alu (Sphyraena barracuda) di Perairan Teluk Jakarta.
Nama : Okto Khaisar NRP : C24101046
Disetujui, Komisi Pembimbing,
Ketua Anggota
Dr. Ir. Etty Riani. H, MS Dr. Ir. M. Mukhlis Kamal, MSc NIP 131.619.682 NIP 132.084.932
Mengetahui :
Dekan Fakultas Perikanan dan Ilmu Kelautan
Dr. Ir. Kadarwan Suwardi NIP 130.805.031
KATA PENGANTAR
Segala puji dan syukur penulis panjatkan kehadirat Allah SWT yang telah melimpahkan rahmat, hidayah, serta berbagai kemudahan dan kelancaran sehingga akhirnya skripsi ini dapat diselesaikan. Skripsi dengan judul “Kandungan Timah Hitam (Pb) dan Kadmium (Cd) dalam Air, Sedimen dan Bioakumulasi serta Respon Histopatologis Organ Ikan Alu-alu (Sphyraena
barracuda) di Perairan Teluk Jakarta” merupakan hasil penelitian yang dilakukan pada bulan Oktober hingga Desember 2004.
Pada kesempatan ini penulis ingin mengucapkan terima kasih kepada Dr. Ir. Etty Riani. H, M.S dan Dr. Ir. M. Mukhlis Kamal, M.Sc yang telah banyak memberikan bimbingan serta arahan hingga skripsi ini selesai; PPLH-IPB dan BPLHD Propinsi DKI Jakarta yang telah mengizinkan penulis untuk terlibat didalam proyek; Bapak Tarmuzi selaku kepala laboratorium histologi Balai Penelitian Veteriner - Bogor ; Bapak Opi selaku staff laboratorium histologi Balitvet – Bogor; Ir. INN. Suryadiputera selaku pembimbing akademik; seluruh dosen dan pegawai Fakultas Perikana n dan Ilmu Kelautan IPB yang telah memberikan ilmu serta masukkan yang sangat berarti; rekan-rekan tim penelitian (Bram, mba Rima, Mega, Julius) atas kerjasamanya; teman-teman MSP’38 dan teman-teman angkatan 38 FPIK yang telah memberikan warna persahabatan semasa perkuliahan; bapak, ibu, dan adik ya ng telah memberikan do’a serta dukungannya dalam menyelesaikan penulisan skripsi ini.
Akhir kata penulis berharap semoga skripsi ini dapat memberikan manfaat bagi semua pihak yang memerlukan.
Bogor, Februari 2006
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 6 Oktober 1983 sebagai anak pertama (2 bersaudara) dari pasangan bapak Suryadi Hadi Supramono dan ibu Mulyati.
Pendidikan formal yang pernah penulis jalani adalah SMUN 58 Ciracas Jakarta Timur dan lulus tahun 2001. Penulis lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk Institut Pertanian Bogor (USMI) pada tahun ajaran yang sama (2001) dan memilih program studi Pengelolaan Sumberdaya dan Lingkungan Perairan, Departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
DAFTAR ISI
2.1Karakteristik Logam Berat... 4
2.1.1 Logam Timah Hitam (Pb) ... 5
2.1.2 Logam Kadmium (Cd) ... 7
2.2Logam Berat dalam Perairan Laut ... 9
2.3Logam Berat dalam Se dimen... 11
2.4Bioakumulator dan Bioindikator ... 13
2.5Biologi Ikan Alu-alu ... 16
2.6Analisa Histopatologis pada Organ Ikan Alu-alu ... 18
III. METODE PENELITIAN ... 20
4.4Respon Histopatologis Organ Dalam Ikan Alu-alu Terhadap Logam Berat Pb dan Cd ... 38
4.5Kualitas Perairan Teluk Jakarta Saat Penelitian Berlangsung ... 46
V. KESIMPULAN DAN SARAN... 52
5.1 Kesimpulan ... 52
5.2 Saran ... 52
DAFTAR PUSTAKA ... 54
DAFTAR TABEL
Halaman
1. Penggunaan logam berat dalam industri ... 5
2. Bentuk persenyawaan Pb dan kegunaannya ... 6
3. Kriteria Pb dalam badan air ... 6
4. Baku mutu logam Pb pada air laut ... 7
5. Konsentrasi mematikan ion logam Pb (ppm) pada paparan 96 jam .... 7
6. Kriteria Cd dalam badan air ... 8
7. Baku mutu logam Cd pada air laut ... 8
8. Konsentrasi mematikan ion logam Cd (ppm) pada paparan 96 jam .... 9
9. Konsentrasi berat logam dalam air laut ... 11
10. Baku mutu logam berat yang terdapat di sedimen (mg/kg) ... 12
11. Konsentrasi timah hitam (ppm) pada sedimen ... 26
12. Konsentrasi Pb (ppm) pada beberapa jenis ikan di Teluk Jakarta ... 36
13. Konsentrasi Cd (ppm) pada beberapa jenis ikan di Teluk Jakarta ... 36
14. Konsentrasi Pb dan Cd kerang hijau (Perna viridis) di Teluk Jakarta . ... 37
DAFTAR GAMBAR
Halaman
1. Skema perumusan permasalahan ... 3
2. Siklus biogeokimia logam berat dalam lingkungan (Paasivirta 2001) . 10 3. Ikan alu-alu (Sphyraena barracuda, Walbaum 1792) ... 17
4. Peta lokasi pengambilan contoh ikan (•) serta air dan sedimen ( ) di Teluk Jakarta pada bulan Oktober 2004 ... 20
5. Kandungan logam Pb dalam sedimen perairan ... 26
6. Kandungan logam Pb pada organ ikan alu -alu ... 29
7. Kandungan logam Cd pada organ ikan alu-alu ... 32
8. Rantai makana n logam kadmium (Hartung 1972 yang diacu dalam Forstner dan Wittman 1983) ... 35
9. Histopatologi daging ikan alu-alu (x 10) ... 39
10. Histologi miofibril ikan Hoplias malabaricus ... 40
11. Histopatologi miofibril ikan Hoplias malabaricus ... 40
12. Histopatologi ginjal ikan alu-alu (x 40) ... 41
13. Histopatologi ginjal ikan alu-alu (x 40) ... 41
14. Histologi ginjal ikan Channa punctatus... 42
15. Histopatologi hati ikan alu -alu (x 20) (Balitvet 2005) ... 43
16. Histologi hati normal ikan Channa punctatus (x 50) (Bhuiyan et al. 2001) ... 43
17. Histopatologi hati ikan Channa punctatus (x 50) (Bhuiyan et al. 2001) ... 44
18. Histologi hati ikan Hoplias malabaricus... 44
19. Histopatologi insang ikan alu-alu (x 4)... 45
20. Histologi insang normal ikan Clarias gariepinus (x 400) ... 46
21. Histopatologi struktur limfa ikan alu-alu (x 20) (Balitvet 2005) ... 46
22. Sebaran suhu rata-rata perairan ... 47
23. Sebaran rata-rata pH dalam perairan ... 48
24. Sebaran rata-rata DO dalam perairan ... 49
DAFTAR LAMPIRAN
Halaman
1. Lokasi stasiun pengamatan ... 60
2. Tabel kandungan logam Pb dalam ikan alu -alu ... 62
3. Tabel kandungan logam Cd dalam ikan alu-alu ... 62
4. Tabel kandungan logam Pb dalam sedimen ... 62
5. Tabel kualitas air di perairan Ancol, Teluk Jakarta ... 63
6. Mesin Atomic Absorption Spectrophotometric ... 64
7. Denah sungai yang bermuara di Teluk Jakarta ... 65
8. Prosedur kerja analisa logam berat pada ikan, air dan sedimen ... 66
9. Metode analisa, teknik serta alat yang digunakan ... 68
10. Baku mutu air laut untuk biota laut ... 69
11. Kondisi analisa mesin AAS dengan metode Flame Atomization ... 70
12. Kondisi analisa mesin AAS dengan metode Graphite Furnace Atomization ... 71
13. Peralatan di dalam pembuatan histologi ... 72
I.
PENDAHULUAN
1.1 Latar Belakang
Teluk Jakarta merupakan salah satu perairan di Indonesia yang terletak di sebelah utara ibukota Jakarta. Seiring dengan perkembangannya, telah banyak perubahan yang terjadi seperti banyaknya pabrik -pabrik (industri), perumahan, maupun pelabuhan yang berada di sekitar Teluk Jakarta. Hal tersebut tentunya akan menimbulkan masalah apabila terjadi aktivitas pembuangan limbah yang dilakukan secara masal, baik yang dilakukan ole h pabrik untuk pembuangan limbah hasil produksi maupun limbah rumah tangga dan limbah-limbah lainnya yang berasal dari sungai dan saluran-salurannya yang bermuara di perairan teluk. Hal yang menjadi perhatian di sini adalah limbah logam berat yang dihasilkan, karena logam berat merupakan unsur yang banyak digunakan dalam berbagai industri, baik sebagai bahan baku maupun sebagai katalisator. Menurut Hutagalung (1991), logam berat didefinisikan sebagai unsur-unsur yang memiliki berat jenis lebih dari 5 g/cm3, memiliki daya hantar listrik dan panas yang tinggi. Diantara logam berat yang masuk ke perairan teluk adalah timah hitam/timbal dan kadmium. Logam Pb meningkat konsentrasinya di perairan dikarenakan penggunaannya pada industri penambangan, pestisida, cat, bahan stabilizer pada industri plastik, serta dalam bentuk tetraethyl lead yang ditambahkan ke dalam bahan bakar minyak (BBM) digunakan sebagai bahan additive untuk peredaman mesin pembakaran (Clark 1986). Namun secara alamiah Pb masuk melalui pengkristalan Pb di udara dengan bantuan air hujan dan proses korotifikasi batuan mineral. Adapun logam Cd banyak digunakan dalam industri tekstil, peleburan logam Zn, pembuatan termoplastik, serta elektroplating (Darmono 1995).
Logam berat masuk ke perairan me lalui proses kondensasi, presipitasi, maupun terdifusi karena energi angin. Di dalam perairan selanjutnya akan mengalami proses kimia dan biologi, sehingga dari proses tersebut akan mempengaruhi kelarutannya pada badan perairan maupun proses sedimentasi.
dari organel sel yang tergabung dalam jaringan. Salah satu jaringan yang paling peka terhadap pengaruh logam adalah insang, organ lainnya yang juga akan mengalami gangguan akibat pengaruh logam adalah alat pencernaan dan ginjal.
Semakin lama perairan tercemar logam berat, maka jumlah logam berat yang akan terakumulasi di dalam tubuh ikan akan semakin besar sehingga ikan tersebut menjadi tidak sehat, bahkan mengalami kematian. Apabila ikan-ikan tersebut dikonsumsi oleh manusia, maka hal tersebut akan sangat membahayakan kesehatan manusia dan dapat menyebabkan keracunan logam berat yang dapat bersifat kronis bahkan akut jika logam berat yang terakumulasi cukup banyak. Kasus pengaruh negatif logam Cd terhadap manusia juga telah dilaporkan menimbulkan penyakit ’itai-itai’ yang artinya ’aduh-aduh’ di Jepang dan di beberapa negara dunia seperti Venezuela, Irak, Kanada, Swedia dan Amerika serikat (Hutagalung et al. 1997). Logam Pb diperkirakan dapat menyebabkan anemia, serangan kolik perut dan neuropati pada manusia (De Kruijf et al. 1988). Oleh karena itu perlu dilakukan penelitian untuk mengetahui jumlah kandungan logam berat pada ikan, air dan sedimen. Penelitian dilakukan pada ikan, air dan sedimen karena ketiga media tersebut merupakan tempat terjadinya reaksi-reaksi fisika, kimia, dan biologi yang akan dialami oleh logam berat saat memasuki perairan, sehingga ada kemungkinan untuk terakumulasi.
1.2 Perumusan Masalah
Seiring dengan perkembangan yang terjadi di sekitar Te luk Jakarta berupa pembangunan daerah padat industri maupun perumahan penduduk yang terletak dekat dengan daerah teluk, maka bukan hal yang mustahil jika limbah yang bermuara di Teluk Jakarta akan semakin banyak, termasuk di dalamnya limbah timah hitam (Pb) dan kadmium (Cd) sehingga kandungan logam berat, baik yang sudah secara alami ada di perairan maupun yang sengaja dimasukkan di perairan akan semakin terakumulasi. Limbah logam berat akan masuk ke perairan melalui run-off dari sungai-sungai yang bermuara di Teluk Jakarta lalu akan mengendap di
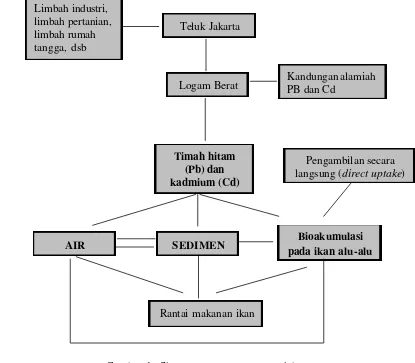
akan menyebabkan terjadinya bioakumulasi dalam tubuh ikan alu -alu. Oleh karena itu penelitian tentang kandungan logam berat pada ikan, air dan sedimen di sekitar Teluk Jakarta harus dilakukan. Penjelasan di atas dirangkum kedalam skema pada Gambar 1 berikut ini :
Gambar 1. Skema perumusan permasalahan
1.3 Tujuan
Penelitian ini bertujuan untuk mengetahui tingkat pencemaran yang terjadi di perairan Teluk Jakarta dengan cara melihat tingkat akumulasi logam berat yang ada dalam tubuh ikan alu-alu (Sphyraena barracuda), di perairan maupun sedimen. Disamping itu juga ingin mengetahui dampak akumulasi logam berat timah hitam (Pb) dan kadmium (Cd) pada kerusakan jaringan organ dalam ikan.
Limbah industri, limbah pertanian, limbah rumah tangga, dsb
Logam Berat
Timah hitam (Pb) dan kadmium (Cd)
Rantai makanan ikan
SEDIMEN Bioakumulasi
pada ikan alu-alu AIR
Teluk Jakarta
Kandungan alamiah PB dan Cd
II. TINJAUAN PUSTAKA
2.1 Karakteristik Logam Berat
Logam adalah elemen atau campuran elemen yang mempunyai karakteristik permukaan yang mengkilap, daya hantar panas dan listrik yang tinggi serta tidak mudah mengalami dekomposisi. Hutagalung et al. (1997) menyatakan bahwa logam berat adala h unsur logam yang mempunyai densitas lebih besar dari 5 g/cm3.
Dalam jumlah yang sangat kecil, keberadaan beberapa unsur logam berat dalam tubuh makhluk hidup sangat dibutuhkan oleh organisme hidup untuk pertumbuhan dalam perkembangan hidupnya (Phillips 1980 yang diacu dalam Hutagalung et al. 1997). Kadar logam berat yang terlalu rendah dalam perairan pun akan dapat menyebabkan defisiensi pada berbagai organisme yang akan menyebabkan fungsi metabolisme terganggu (Bryan 1976). Namun peningkatan kadar loga m berat dalam air laut juga dapat menyebabkan terjadinya peningkatan kadar logam berat yang ada dalam tubuh organisme laut akibatnya dapat berubah menjadi racun yang membahayakan tubuh biota (Hutagalung et al. 1997). Dari seluruh jenis logam berat yang berada di alam, terdapat beberapa yang dianggap sebagai bahan pencemar yang berbahaya dan memberikan akibat yang buruk bagi lingkungan maupun bagi kesehatan manusia yang mengkonsumsinya. Diantaranya yaitu timah hitam (Pb), seng (Zn), kadmium (Cd), tembaga (Cu), dan nikel (Ni).
terakumulasi dalam sedimen dan biota melalui proses gravitasi, bio-akumulasi, bio-konsentrasi dan bio -magnifikasi (Hutagalung et al. 1997). Secara umum industri-industri yang memanfaatkan logam berat dalam proses produksinya dapat dilihat pada Tabel 1 berikut ini :
Tabel 1. Penggunaan logam berat dalam industri
Logam Berat Pemakaian dalam Industri
Kadmium (Cd)
Electroplating; pigmentasi; penstabil termoplastik misalnya pada PVC; baterai; logam campuran (alloy) dengan titik leleh yang
rendah.
Tembaga (Cu) Industri elektronik; logam campuran (alloy) misalnya: kuningan ; katalis kimia; anti-fouling paint; pengawet kayu.
Nikel (Ni) Metalurgi, baja dan logam campuran lainnya; electroplating; katalisator.
Timah (Pb) Stroge battery; additif BBM; pigmentasi misalnya pada cat merah; amunisi; solder; pelindung kabel; anti- fouling paint.
Seng (Zn) Logam campur seng, misalnya kuningan, perunggu; galvanasi; seng gulungan; cat baterai; karet.
Sumber: Bryan (1976).
2.1.1 Logam Timah Hitam (Pb)
Timbal atau timah hitam memiliki nama ilmiah Plumbum (Pb) dengan nomor atom 82, bobot atom 207,21, densitas 11,34 g/cm3, titik lebur 327,5 °C dan titik didih 1725 °C (Reilly 1980). Memiliki karakteristik logam yang lunak, berwarna coklat kehitaman, tahan terhadap korosi atau karat, memiliki kerapatan yang lebih besar dibanding logam-logam biasa dan merupakan penghantar listrik yang buruk (Palar 2004). Sumber utama Pb adalah batuan sulfida Galena, PbS dan batuan karbonat Cerrusite, PbCO3 (Portmann 1972). Pb banyak terdapat
perairan melalui pengendapan jatuhan debu yang mengandung Timbal Tetraetil, erosi dan limbah industri.
Bentuk-bentuk persenyawaan dari logam Pb dengan unsur kimia lainnya, serta fungsi dari bentuk persenyawaannya dapat dilihat pada Tabel 2 berikut :
Tabel 2. Bentuk persenyawaan Pb dan kegunaannya.
Bentuk persenyawaan Kegunaan
Pb dan Sb Kabel telepon
Pb + As + Sn + Bi Kabel listrik
Pb + Cr + Mo + Cl Pewarnaan cat
Pb – Asetat Pengkilapan keramik & bahan anti api
Tetrametil – Pb & Tetraetil - Pb Additif untuk bahan bakar kendaraan bermotor
Sumber : Palar (2004)
Preston (1989) menyatakan bahwa konsentrasi Pb dalam laut terbuka berkisar antara 5 hingga 70 pmol/kg. Tabel 3 berikut dibawah ini menjelaskan mengenai kriteria konsentrasi Pb dalam air.
Tabel 3. Kriteria Pb dalam badan air.
Tipe air Konsentrasi
Sumber: EPA 1987 yang diacu dalam Laws 1993
Tabel 4. Baku mutu logam Pb pada air laut.
Baku mutu air laut Satuan
Biota Wisata bahari Pelabuhan
Timah Hitam mg/l 0.008 0.005 0.05
Sumber: Kep Men LH 2004.
Tabel 5 di bawah ini merupakan hasil penelitian bioassay yang bertujuan untuk mengetahui konsentrasi mematikan ion-ion logam Pb (ppm) pada beberapa biota laut termasuk ikan
Tabel 5. Konsentrasi mematikan ion logam Pb (ppm) pada paparan 96 jam
Jenis Hewan Laut Jenis Logam Berat
Ikan Udang Kerang Polychaeta
Pb 188 - - 7.7 - 20
Sumber : dari berbagai sumber yang diacu dalam Palar (2004).
2.1.2 Logam Kadmium (Cd)
Memiliki karakteristik berwarna putih keperakan seperti logam aluminium, tahan panas, tahan terhadap korosi. Kadmium digunakan untuk elektrolisis, bahan pigmen untuk industri cat, enamel dan plastik. Logam kadmium biasanya selalu dalam bentuk campuran dengan logam lain terutama dalam pertambangan timah hitam dan seng (Darmono 1995).
berasal dari lahan tersebut. Sumber lainnya merupakan hasil buangan manusia berasal dari pertambangan, ekstraksi dan pengolahan Zn (Laws 1993).
Konsentrasi normal kadmium di perairan adalah 0.02 µg/l (Brooks 1960 yang diacu dalam Portmann 1972). Sedangkan menurut Bruland (1983) yang diacu dalam Preston (1989), konsentrasi Cd dalam perairan laut berkisar antara 1 sampai pmol/kg hingga 1.1 nmol/kg. Kriteria konsentrasi Cd dalam perairan yang dikeluarkan oleh Environmental Protection Agency (EPA) dapat dilihat pada Tabel 6 berikut ini :
Tabel 6. Kriteria Cd dalam badan air.
Tipe air Konsentrasi kontinyu
(ppb)
Sumber: EPA 1987 yang diacu dalam Laws 1993 .
Menurut Keputusan Menteri Lingkungan Hidup No.51/Men KLH/I/2004, besarnya konsentrasi logam berat kadmium di perairan yang masih dapat ditolerir dapat dilihat pada Tabel 7 :
Tabel 7. Baku mutu logam Cd pada air laut.
Baku mutu air laut Satuan
Biota Wisata bahari Pelabuhan
Kadmium mg/l 0.001 0.002 0.01
Sumber: KepMen LH 2004.
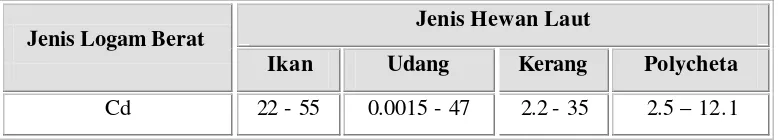
Tabel 8. Konsentrasi mematikan ion logam Cd (ppm) pada paparan 96 jam
Jenis Hewan Laut Jenis Logam Berat
Ikan Udang Kerang Polycheta
Cd 22 - 55 0.0015 - 47 2.2 - 35 2.5 – 12.1
Sumber : dari berbagai sumber yang diacu dalam Palar (2004).
2.2 Logam Berat dalam Perairan Laut
Menurut Verenberg (1974) yang diacu dalam Hamidah (1980), logam-logam di perairan ditemukan dalam bentuk terlarut, yakni ion logam-logam bebas dalam air dan logam yang membentuk kompleks dengan senyawa organik dan anorganik; tidak terlarut, terdiri dari partikel yang berbentuk koloid dan senyawa kelompok metal yang terabsorbsi pada zat tersuspensi. Logam berat yang terdapat dalam perairan biasanya dalam bentuk ion seperti Hg2+, Pb2+, Cd2+, jarang sekali yang berbentuk molekul (Darmono 1995).
Logam berat masuk ke perairan laut melalui berbagai sumber, diantaranya yaitu hasil buangan limbah, limbah berupa lumpur, hasil samping dari sisa pembakaran bahan bakar kendaraan yang sebagian besar mengandung timbal dan juga batubara. Partikel pencemar ini masuk melalui sungai yang bermuara di laut maupun dari air hujan yang akan mengabsorbsi partikel pencemar yang berada diudara bebas. Sedangkan menurut Saeni (1989) mengatakan logam timah hitam masuk ke perairan melalui pengendapan, jatuhan debu yang mengandung timbal yaitu dari hasil pembakaran bensin yang mengandung timbal tetraetil, erosi dan limbah industri.
Reaksi kimia dan biologi
Konsentrasi logam berat yang terdapat dalam perairan dikontrol oleh beberapa faktor seperti presipitasi, adsorpsi partikel yang ada di laut serta absorbsi serta redistribusi oleh proses-proses biologis (Bryan 1976). Parameter lain yang turut mempengaruhi konsentrasi logam berat adalah arus, salinitas, suhu, pH serta padatan tersuspensi (Nanty 1999 dan Damayanti 1999).
Suhu turut mempengaruhi daya toksisitas logam berat dalam perairan. Semakin tinggi suhu maka daya toksisitas akan meningkat pula (Sumardianto 1995 yang diacu dalam Nanty 1999). Namun untuk salinitas ternyata memiliki hubungan berbanding terbalik dengan konsentrasi logam berat yang ada, semakin tinggi salinitas maka konsentrasi akan menurun. Derajat keasaman atau pH perairan juga mempengaruhi kelarutan logam. Menurut Bryan (1976), logam berat Zn pada pH 8 akan berikatan dengan partikel dan mengalami deposisi, sehingga dengan kata lain logam berat akan sukar larut dan berada dalam bentuk partikel tersuspensi. Selanjutnya dengan adanya pengaruh arus akan berdampak pula pada proses pengendapan logam berat di sedimen. Jumlah logam berat, dalam bentuk partikel yang diendapkan ke dasar perairan pada daerah yang
mempunyai arus yang tenang jauh lebih banyak daripada di perairan yang arusnya besar (Hutagalung 1994). Konsentrasi alami dari berbagai logam berat dalam perairan dapat dilihat pada Tabel 9 berikut ini :.
Tabel 9. Konsentrasi berat logam dalam air laut.
Sumber: Kennish (1994)
2.3 Logam Berat dalam Sedimen
Material yang ada di udara maupun permukaan air akan mengalami proses evaporasi, radiasi ultra violet, teroksidasi, serta polymerisasi. Jika material ini tidak tersuspensi dalam perairan maka material tersebut akan saling berikatan satu sama lainnya sehingga akan mengendap ke sedimen. Besar kandungan logam berat yang mengendap di dasar perairan pada daerah yang memiliki arus tenang akan jauh lebih banyak jika dibandingkan perairan berarus kuat (Hutagalung 1994). Namun arus yang kuat akan menyebabkan terjadinya resuspensi dan desolusi logam berat yang ada di sedimen kembali ke badan perairan. Kontaminasi perairan oleh logam berat sering terjadi di daerah estuaria dan perairan pantai serta daerah fjord (lembah es yang terbentuk di dekat laut, lebih rendah dari permukaan laut sehingga intrusi air laut sangat tinggi (Wikipedia 2005)) dimana konsentrasi logam berat dapat mencapai nilai yang sangat tinggi (Bryan 1976).
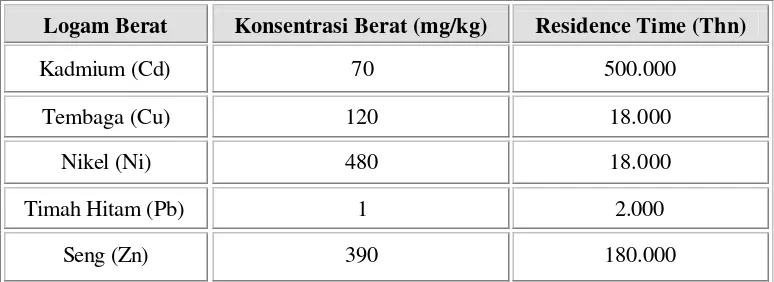
Konsentrasi logam berat tertinggi terdapat dalam sedimen yang partikelnya paling halus, oleh karena itu sedimen yang terkontaminasi oleh logam berat tetap dapat menjadi sumber pencemar bahkan jika sumber asli pencemar telah dihilangkan (Bryan 1976). Konsentrasi logam berat yang ada di sedimen
Logam Berat Konsentrasi Berat (mg/kg) Residence Time (Thn)
Kadmium (Cd) 70 500.000
Tembaga (Cu) 120 18.000
Nikel (Ni) 480 18.000
Timah Hitam (Pb) 1 2.000
sangat dipengaruhi oleh musim (Deu et al. 1994). Jika dibandingkan dengan logam Timbal, konsentrasi logam berat Cu dan Zn akan lebih tinggi pada saat musim hujan dibandingkan pada saat musim kemarau. Hal ini dikarenakan limbah industri maupun limbah domestik yang mengandung logam berat tersebut terkumpul di darat selama musim kemarau, lalu pada saat musim hujan terbawa oleh air hujan ke perairan. Saat musim kemarau kelarutan Timbal juga akan lebih tinggi dibandingkan logam Cu dan Zn. Nilai Pb lebih tinggi daripada musim hujan, karena pada saat musim kemarau debit air rendah, sehingga nilai Pb di perairan lebih tinggi dibandingkan logam Cu dan Zn. Berikut ini merupakan tabel standar internasional baku mutu logam yang terdapat di sedimen (Dutch Quality Standards for Metals in Sediments).
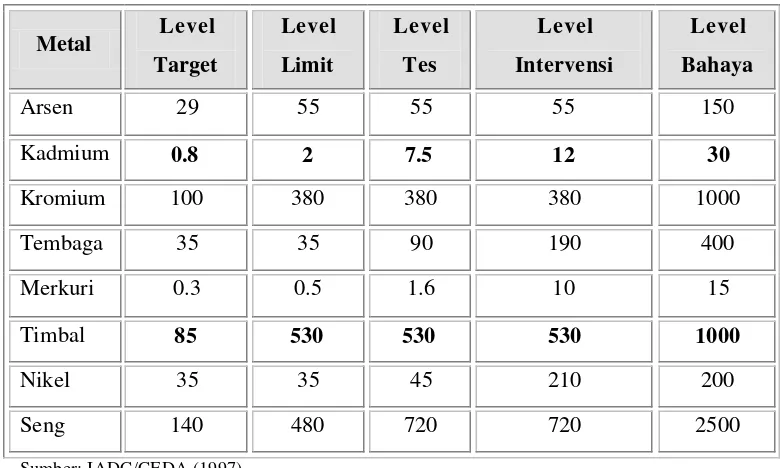
Tabel 10. Baku mutu logam berat yang terdapat di sedimen (ppm).
Metal Level
Definisi masing-masing tingkatan baku mutu pada Tabel 10, adalah sebagai berikut:
b. Level limit. Jika konsentrasi kontaminan yang ada di sedimen memiliki nilai maksimum yang dapat ditolerir bagi kesehatan manusia maupun ekosistem.
c. Level tes. Jika konsentrasi kontaminan yang ada di sedimen berada pada kisaran nilai antara level limit dan test level, maka dikategorikan sebagai tercemar ringan.
d. Level intervensi. Jika konsentrasi kontaminan yang ada di sedimen berada pada kisaran nilai antara level tes dan level intervensi, maka dikategorikan sebagai tercemar sedang.
e. Level bahaya. Jika konsentrasi kontaminan (hanya untuk logam berat) berada pada nilai yang lebih besar dari baku mutu level bahaya maka harus dengan segera dilakukan pembersihan sedimen.
2.4 Bioakumulator dan Bioindikator
Secara alami unsur-unsur logam berat yang berada di perairan laut sudah ada dengan kadar yang rendah yaitu sekitar 10-2 – 10-5 ppm (Hutagalung 1984), sehingga apabila kandungan logam berat di perairan melebihi nilai tersebut berarti ada masukan dari sumber lain, dalam hal ini berarti bahan pencemar yang berasal dari berbagai aktivitas termasuk buangan limbah produksi dari pabrik. Limbah buangan dari industri ini jika tidak dikelola dengan baik dapat memberikan pengaruh yang buruk bagi lingkungan terutama perairan sekitar yang akan tercemar oleh logam berat. Industri yang berpotensi untuk menghasilkan limbah buangan berupa logam berat adalah industri pengolahan logam, electroplating (proses pelapisan suatu permukaan logam dengan logam lain dengan menggunakan arus listrik katoda-anoda (Wikipedia 2005)), pestisida, konduktor listrik, pertambangan dan masih banyak lagi yang menggunakan bahan baku pengolah produksi yang mengandung unsur logam berat. Pestisida dari limbah pertanian yang dihasilkan mengandung bahan campuran dari logam berat juga dapat menjadi sumber pencemar di perairan.
sehingga memungkinkan terjadinya akumulasi secara biologis yang disebut bioakumulasi. Di dalam perairan ada tiga media yang dapat dipakai sebagai indikator pencemaran logam berat yaitu air, sedimen dan organisme hidup. Setiap perairan alami akan dihuni berbagai makhluk hidup dengan trofik levelnya masing-masing. Masuknya bahan pencemar akan membunuh organisme yang paling sensitif sehingga bila bahan pencemar terus masuk maka organisme yang paling sensitif berikutnya akan mati. Sebagai contoh fitoplankton akan dimangsa oleh zooplankton, zooplankton tersebut akan dimangsa ikan-ikan kecil diikuti dengan pemangsaan ikan kecil oleh ikan yang lebih besar seperti ikan cucut, tuna, termasuk juga ikan alu-alu. Sehingga konsentrasi akan sangat tinggi pada organisme konsumen tingkat tinggi, termasuk manusia dimana ikan merupakan salah satu sumber pakan yang berprotein tinggi (Ratkowsky 1975 yang diacu dalam Hutagalung 1984).
Konsentrasi logam berat tertinggi yang akan diserap oleh biota ditemukan pada invertebrata dari jenis ”filter feeder” (Plasket dan Potter 1979 yang diacu dalam Hutagalung 1984). Hal ini dikarenakan logam berat yang masuk ke dalam tubuh organisme khususnya biota laut akan masuk melalui rantai makanan, hanya sedikit sekali logam berat yang berada bebas dalam air akan diserap langsung ke dalam tubuh (Pentreath 1973 yang diacu dalam Waldichuk 1974). Bioakumulasi akan terjadi karena logam berat yang diserap organisme akan cenderung membentuk senyawa kompleks dengan zat-zat organik yang terdapat di dalam tubuh organisme sehingga logam berat akan terfiksasi dan tidak akan terekskresi oleh organisme tersebut (Waldichuk 1974).
Menurut Palar (2004), toksisitas atau daya racun yang dimiliki oleh toksikan logam berat memiliki efek yang berbeda pada tubuh. Hal ini juga terkait dengan sifat, konsentrasi, lama paparan logam berat itu sendiri. Bentuk serangan toksisitas tersebut adalah :
v Toksisitas fisika
kulit. Contoh dari efek toksisitas fisika adalah kulit kering, kulit pecah-pecah dan iritasi.
v Toksisitas kimia
Bentuk serangan secara kimia memiliki variasi yang lebih luas. Sebagai contoh, asam-asam kuat yang berhubungan langsung dengan mata, kulit, atau saluran pencernaan dapa t menyebabkan kerusakan jaringan bahkan kematian sel. Logam merkuri dalam fungsi metabolisme tubuh akan menghalangi kerja enzim, padahal enzim memiliki fungsi sebagai katalisator yaitu substansi yang mendorong laju proses metabolisme di dalam tubuh.
v Toksisitas fisiologis
Bentuk serangan secara fisiologis terkait dengan keberadaan logam berat yang mensubstitusikan keberadaan gugus logam yang berfungsi sebagai ko-faktor enzim dalam fungsi fisiologis tubuh. Hal ini menyebabkan proses fisiologis tubuh yang mengatur keseimbangan metabolisme tubuh agar suatu makhluk hidup bertahan hidup dalam lingkungannya menjadi terganggu.
Faktor konsentrasi didefinisikan sebagai perbandingan antara kadar logam berat dalam tubuh dan dalam air. Besar nilai faktor konsentrasi sangat tergantung pada jenis logam berat, jenis organisme, lamanya pemaparan, serta kondisi fisika kimia perairan seperti pH, temperatur dan salinitas. Misalkan, ikan yang dipelihara dalam air yang mengandung Cd2+ = 10 ppm dapat mengandung Cd2+ sampai 113 ppm. Sedangkan jenis moluska dapat mengakumulasi unsur tersebut hingga 352 kali lebih tinggi dari kadarnya dalam perairan (Eisler 1971 yang diacu dalam Waldichuk 1974).
Hasil penelitian dari Waldichuk (1974) menunjukkan kenaikan suhu, penurunan pH dan salinitas perairan dapat menyebabkan tingkat bioakumulasi semakin meningkat. Sehingga konsentrasi logam yang terkandung dalam tubuh suatu organisme akan semakin beracun atau dengan kata lain tingkat toksisitasnya semakin tinggi. Menurutnya urutan daya rac un logam berat adalah : Hg2+ > Cd2+ > Ag2+ > Ni2+ > Pb2+ > As2+ > Cr2+ > Sn2+ > Zn2+.
a. Pengenceran dan proses pengadukan yang diakibatkan turbulensi dari arus laut.
b. Proses pemekatan melalui :
• Proses biologis yang akan terkait dengan konsep bioakumulasi yaitu dimana bahan pencemar yang terkonsumsi oleh biota konsumen tingkat rendah akan dikonsumsi kembali oleh predator yang trofik levelnya lebih tinggi.
• Proses fisika maupun kimia yaitu melalui proses adsorbsi, pertukaran ion, dan sedimentasi yang terjadi di dasar perairan.
c. Terbawa langsung oleh arus dan biota terutama nekton. Pola penyebara n bahan pencemaran pun akan tergantung pada luas daerah sebaran yang akan mengalami proses yang berbeda-beda sehingga berpengaruh juga pada pengendapan bahan-bahan pencemar tersebut.
Menurut Romirill (1971) dan Mandelli (1976) yang diacu dalam Hutagalung (1984), unsur -unsur logam berat dapat masuk kedalam tubuh organisme melalui rantai makanan, insang dan proses difusi yang terjadi dipermukaan kulit, sedangkan proses pengeluaran logam berat dari dalam tubuh makhluk hidup itu sendiri dapat melalui proses ekskresi urin maupun feses.
2.5 Biologi Ikan Alu-alu
Klasifikasi ikan alu-alu seperti yang diinformasikan dalam situs
www.fishbase.org adalah sebagai berikut : Filum : Pisces
Kelas : Actinopterygii Ordo : Perciformes
Subordo : Scombroidei (Helfman et al., 1997) Famili : Sphyraenidae
Genus : Sphyraena
Gambar 3. Ikan Alu-alu (Sphyraena barracuda, Walbaum 1792) (Sumber: Kamal 2005)
Ikan ini memiliki nama umum great barracuda sedangkan nama lokalnya di Indonesia adalah alu-alu (Jawa). Ikan alu-alu termasuk dalam ikan pelagis besar yang memiliki dimensi panjang total 90-120 cm dan dapat mencapai panjang maksimum hingga 180-200 cm (Mojeta 1992) dengan berat maksimum yang pernah terukur adalah 48 kg (106 lbs) (Bailey et al., 2001). Hidupnya disekitar daerah karang tropis dan subtropis dengan posisi lintang 30°LU – 30°LS yang berkedalaman 0 – 100 m dengan jarak ke arah laut lepas 1-6 mil laut dari arah pantai (Mojeta 1992). Hidup pada daerah bersubstrat pasir maupun pasir berlumpur, sehingga banyak terdapat pada perairan dangkal (Bailey et al., 2001). Ikan alu-alu dapat berenang cepat hingga kecepatan 12 m/s (www.fishbase.org
2005). Sebanyak 20 spesies ikan jenis barracuda terdapat pada Samudera Atlantik, Pasifik dan Hindia (Helfman et al., 1997), namun terdapat juga di perairan Laut Hitam (Black Seas) (Bailey et al., 2001).
Ikan alu-alu termasuk kedalam ikan predator karnivora yang akan memangsa dengan buas ikan-ikan kecil, cephalopoda dan krustasea seperti udang dan kepiting. Ikan ini cukup banyak ditemukan di perairan Samudera Hindia. Tingkah laku hidupnya saat masih individu muda cenderung untuk menggerombol (schooling) berenang sepanjang daerah pesisir bahkan dapat mencapai laguna, akan tetapi pada individu dewasa akan cenderung menyendiri (soliter) (Mojeta 1992). Pada beberapa daerah, ikan alu-alu merupakan ikan ekonomis penting, hal ini dikarenakan dagingnya memiliki rasa yang cukup enak dan gurih namun harganya yang cukup mahal - terutama jika sudah masuk restoran-restoran besar yang menyajikan hidangan laut (sea food) - menyebabkan tidak semua orang dapat memakannya. Namun pada beberapa kasus ditemukan bahwa daging ikan alu-alu bisa saja beracun, hal ini tergantung dari jenis ikan (prey) yang dimakannya (Mojeta 1992).
Waktu memijahnya adalah antara bulan November sampai Januari dengan habitat tempat memijahnya di perairan dalam dekat dengan cekungan benua, dimana telur -telur yang telah dikeluarkan akan terbawa arus hingga ke tepi daratan atau pesisir pantai. Juvenil-juvenil muda akan tinggal di ekosistem mangrove, lamun ataupun daerah pesisir lainnya yang terlindung dari gangguan predator (www.fishbase.org 2005).
2.6 Analisa Histopatologis pada Organ Ikan Alu-alu
Menurut Banks (1986), nekrosis yang terjadi pada sel dapat dikenali secara morfologi dari kerusakan yang terjadi pada inti sel; terjadi homogenisasi sitoplasma; serta peningkatan jumlah eosinofil. Nekrosis sel sangat tergantung dari seberapa tinggi tingkat kerusakan dan lamanya sel mengalami kerusakan. Kerusakan pada inti sel terdiri dari: pyknosis dimana terjadi penyusutan inti; karyolysis dimana inti akan terdissolusi; karyorrhexis yaitu dimana inti akan
mengalami fragmentasi (Banks 1989 dan Copenhaver 1978). Kondisi akut menggambarkan sel yang mengalami kerusakan dalam waktu singkat namun bersifat mematikan (lethal); membran sel akan pecah sehingga isi sel seluruhnya akan ter -dissolusi; terjadi pada sejumlah grup sel. Sedangkan pada kondisi kronis, sel mengalami kerusakan dalam jangka waktu cukup lama dan bersifat sub-letal; inti sel dan sitoplasma akan sangat mengkisut. Gangguan lainnya dalam tubuh dapat berupa gangguan metabolisme sel, gangguan sirkulasi dan radang (Banks 1989 dan Copenhaver 1978).
III. METODE PENELITIAN
3.1 Waktu dan Lokasi
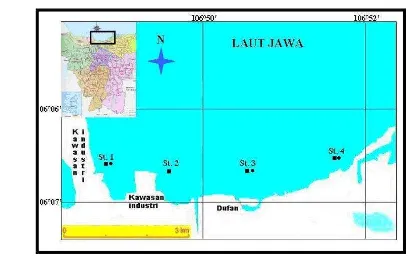
Penelitian dilaksanakan pada bulan Oktober hingga Desember 2004 yang meliputi kegiatan pengambilan sampel di lapangan dan analisa data di laboratorium. Lokasi pengambilan contoh ikan dilakukan di sekitar perairan Pantai Marina Ancol, Teluk Jakarta. Lokasi sampling ikan dilakukan pada 3 titik sampling yaitu stasiun 1, 3, dan 4 yang akan digunakan sebagai data primer dalam penelitian ini; sedangkan lokasi sampling air dan sedimen dilakukan pada 4 titik sampling yaitu stasiun 1, 2, 3, 4 dengan masing-masing ulangan sebanyak 4 kali, data yang didapat pada air dan sedimen akan digunakan sebagai data sekunder dikarenakan penulis mendapatkannya dari UPT Laboratorium Lingkungan - Badan Pengelolaan Lingkungan Hidup Daerah DKI Jakarta. Analisa sampel kandungan logam berat di dalam organ tubuh ikan dilakukan di Laboratorium Terpadu FKH-IPB, Bogor. Lokasi-lokasi pengamatan tersebut terlihat pada Gambar 4 berikut ini :
Lokasi-lokasi titik sampling ini merupakan kegiatan monitoring yang dilakukan oleh kerjasama PKSPL IPB, P2O LIPI, DPTL-BPPT, BRPL-DKP, dan BPLHD Propinsi DKI Jakarta. Lokasi stasiun pengambilan sampel ikan dipilih stasiun-stasiun yang berada dekat dengan daratan, dengan menggunakan asumsi lokasi-lokasi tersebut merupakan lokasi yang paling dekat dengan daratan yang memberikan masukan bahan-bahan pencemar yang berasal dari run-off sungai-sungai yang seluruhnya bermuara ke Teluk Jakarta ini. Stasiun 1 dan 2 merupakan lokasi pengamatan yang dekat dengan daerah industri; stasiun 3 dekat dengan aktivitas wisata seperti DUFAN dan hotel; dan stasiun 4 dekat dengan pelabuhan. Besarnya bahan-bahan pencemar yang terbawa masuk ke perairan oleh aliran sungai diperkirakan berasal dari limbah buangan dari pabrik-pabrik industri yang ada di daerah Jakarta Utara yang juga dilalui aliran sungai diantaranya seperti Sungai Ciliwung, Sungai Pesanggrahan, Kali Grogol, Kali Sunter, dan Kali Cakung (Kantor kependudukan dan lingkungan hidup 1989 diacu dalam Diniah 1995) seperti yang terlihat pada Lampiran 7.
3.2 Alat, Bahan, dan Kegunaan
3.3 Metode Kerja
3.3.1 Pengambilan Contoh Ikan Alu-alu
Penangkapan ikan alu-alu menggunakan jaring bondet (purse seine) dilakukan oleh nelayan setempat pada tiga stasiun yang telah ditentukan. Kemudian sampel ikan yang tertangkap dimasukkan ke dalam kotak pendingin atau cool box yang di dalamnya terdapat es batu untuk selanjutnya ditransportasikan ke Bogor. Sampai di Bogor ikan dibawa ke Laboratorium Ekobiologi Perairan yang berada di Departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan IPB untuk dilakukan penanganan lebih lanjut berupa pembedahan untuk mengambil sampel organ-organ dalam ikan seperti daging, hati, insang, limfa dan ginjal yang akan dilakukan analisa kandungan logam beratnya pada laboratorium terpadu Fakultas Kedokteran Hewan IPB dengan menggunakan AAS (Atomic Absorption Spectrophotometric). Selama proses penanganan sampel organ mulai saat ikan dibedah hingga organ dalam dipisahkan dan ditempatkan ke dalam botol film, sampel selalu disimpan di dalam cool box yang berisikan es batu, hal ini bertujuan agar sampel tidak cepat mengalami pembusukan. Prinsip kerja metode Spektrofotometrik Serapan Atom (AAS) yang digunakan berdasarkan pada hukum Lambert-Beer yaitu banyaknya sinar yang diserap akan berbanding lurus dengan kadar za t. Setelah dilakukan analisa AAS, untuk mendapatkan konsentrasi logam berat yang sebenarnya maka dilakukan konversi nilai dengan perhitungan menggunakan formula sebagai berikut :
Analisa histologi untuk melihat tingkat kerusakan jaringan akibat dari paparan logam berat dilakukan di Laboratorium Patologi/Toksikologi Balai Penelitian Veterinary (Balitvet – Bogor). Organ dalam yang dianalisa histologinya adalah ginjal, hati, limfa, daging, dan insang.
Berat kering (g)
3.3.2 Pengambilan Contoh Air dan Sedimen
Data parameter lainnya seperti suhu, salinitas, pH, DO, logam berat Pb dan Cd merupakan data sekunder yang didapatkan dari Badan Pengelolaan Lingkungan Hidup Daerah propinsi DKI Jakarta. Metode analisa, teknik serta alat yang digunakan dapat dilihat pada Lampiran 9.
3.4 Analisa dan Penyajian Data
3.4.1 Deskriptif
Keseluruhan data parameter kualitas perairan dan logam berat yang ada di sedimen, badan perairan maupun yang terkandung di dalam tubuh ikan alu-alu disajikan secara deskriptif. Data lapang yang didapat akan dibandingkan dengan nilai baku mutu perairan baik untuk perairan laut untuk wisata bahari, pelabuhan, maupun untuk biota. Nilai baku mutu yang digunakan berdasarkan Keputusan Menteri Negara Lingkungan Hidup nomor 51 tahun 2004 tentang baku mutu air laut dan baku mutu standar internasional untuk sedimen mengacu pada Dutch Quality Standards for Metals in Sediments (IADC/CEDA 1997) .
3.4.2 Analisa Histopatologi
IV. HASIL DAN PEMBAHASAN
4.1 Kandungan Pb dan Cd pada Perairan
Logam berat timah hitam (Pb) dan kadmium (Cd) yang terkonsentrasi pada badan perairan di keempat stasiun yang diamati rata -rata memiliki nilai konsentrasi yang masih berada di bawah batas yang dapat ditoleransi. Keberadaan kedua logam tersebut di sampel air yang diambil setelah dilakukan uji analisa dengan menggunakan alat Atomic Absorption Spectrophotometric (AAS) ternyata tak terdeteksi, dengan kata lain memiliki konsentrasi dibawah 0.0001 mg/l (batas deteksi alat yang digunakan). Menurut EPA (1987) yang diacu dalam Laws (1993) menyatakan bahwa batas konsentrasi maksimum logam berat timah hitam di perairan laut adalah sebesar 140 ppb dan untuk logam kadmium 43 ppb. Sedangkan nilai baku mutu kandungan logam berat timah hitam di perairan untuk kehidupan biota laut yang masih ditolerir menurut Keputusan Menteri Lingkungan Hidup No. 51/Men KLH/I/2004 adalah sebesar 0.008 ppm dan untuk kadmium adalah 0.001 ppm.
dekat dasar perairan maupun yang berada di sedimen sekalipun sehingga keberadaannya di perairan tidak akan terkonsentrasi hanya di tempat tertentu saja. Keberadaan logam kadmium di perairan yang tidak terdeteksi juga diduga karena memang keberadaannya yang berasal dari sumber pencemar (industri) sudah mengalami reduksi atau jumlah penggunaan logam berat kadmium di dalam proses produksi sudah dikurangi atau sudah mulai disubstitusikan dengan menggunakan substansi lain yang lebih ramah lingkungan. Sebagai data pembanding adalah penelitian yang dilakukan untuk mengetahui sumber dari beberapa logam berat – diantaranya Cd – dalam perairan Teluk New York (Mueller et al. 1979 yang diacu dalam Palar 2004). Data yang didapat dalam penelitian tersebut menunjukkan bahwa sumber Cd dalam badan perairan yang terkontribusi dari limbah industri sangat sedikit yaitu 0,6 % dari total kandungan Cd yang ada. Kontribusi paling besar dari logam Cd justru berasal dari limbah padat yaitu sebesar 82 %, sedangkan limbah yang berasal dari limbah cair rumah tangga dan aliran dari pemukiman perkotaan adalah 5 %. Hal ini diduga erat ada kaitannya dengan peringatan keras yang diserukan oleh beberapa lembaga-lembaga di dunia yang bergerak dibidang lingkungan hidup - seperti greenpeace, akan baha ya pencemaran logam kadmium, sehingga apabila suatu industri kedapatan secara nyata mencemari perairan dengan kadmium maka dapat saja dicabut ijin buka usahanya.
Faktor lain yang mungkin menjadi penyebab tidak terdeteksinya logam berat yang diteliti adalah sensitifitas alat yang digunakan. Sensitifitas deteksi kandungan logam mesin yang digunakan hanya sebatas 0.0001 ppm.
4.2 Kandungan Pb dan Cd pada sedimen
Besar konsentrasi logam berat timah hitam (Pb) pada sedimen masih berada di bawah tingkat aman standar internasional baku mutu menurut Dutch Quality Standards for Metals in Sediments (IADC/CEDA 1997) . Mengacu pada baku
mutu yang ada, dijelaskan bahwa pada level target, konsentrasi maksimum logam timah hitam adalah 85 ppm. Penjelasan yang terdapat pada Dutch Quality Standards for Metals in Sediments menyatakan bahwa jika konsentrasi
lingkungan (IADC/CEDA 1997). Nilai konsentrasi kandungan logam berat timah hitam yang terdapat di dalam sedimen dapat dilihat pada Tabel 11 dan Gambar 5 berikut ini :
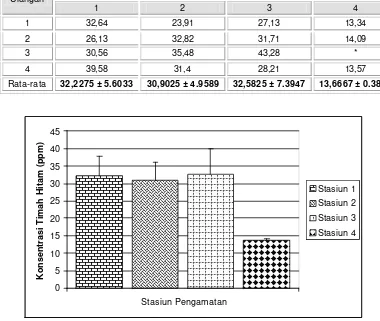
Tabel 11. Konsentrasi timah hitam (ppm) pada sedimen.
0
Gambar 5. Kandungan logam Pb dalam sedimen perairan.
Pada Tabel 11 maupun grafik diatas terlihat nilai rata -rata terendah diperoleh pada stasiun 4, sedangkan nilai rata-rata tertinggi ditemukan di stasiun 3. Konsentrasi logam berat pada tiga stasiun pertama (1, 2, dan 3) relatif tidak berbeda konsentrasinya. Tidak diketahui alasan mengapa pada ulangan ketiga dari stasiun ke-4 tidak terdeteksi (nilai konsentrasi logam dibawah 0.0001 ppm). Salah satu faktor yang mungkin dapat menjadi penjelasan adalah diduga karena stasiun 4 berada pada daerah yang banyak arus, sehingga keberadaan logam timah itu sendiri di perairan maupun di sedimen menjadi tidak stabil. Keberadaan lokasi
stasiun 4 berikut ulangannya yang dekat dengan daratan sebelah timur juga akan menyebabkan kondisi dasar perairan yang tergolong tidak tenang, hal ini dikarenakan gelombang yang menuju pantai akan memecah didekat tepi karena adanya bangunan pemecah gelombang. Keadaan seperti ini akan menyebabkan terjadinya pergolakan massa air yang akan menyebabkan teraduknya sedimen.
Meskipun logam timah hitam yang terdapat pada sedimen masih berada di bawah baku mutu perairan, perlu diwaspadai pula keberadaannya pada biota laut seperti ikan-ikan demersal. Hal ini terkait dengan sistem rantai makanan yang ada, maka bukan hal yang mustahil bahwa konsentrasi timah hitam yang kecil akan menjadi besar (terakumulasi) pada biota dengan trofik level yang lebih tinggi. Logam berat timah hitam yang terakumulasi dalam biota yang dikonsumsi oleh manusia seperti ikan dan kerang-kerangan akan sangat membahayakan. Hal ini sejalan dengan pernyataa n Fostner dan Wittman (1983), keracunan logam berat timah hitam pada masa anak-anak akan menyebabkan kerusakan pada jaringan otak sehingga menyebabkan keterbelakangan mental serta menyebabkan masalah tingkah laku yang serius. Menurut Palar (2004), keracunan akibat kontaminasi logam timah hitam dapat menimbulkan hal-hal seperti : meningkatkan kadar ALA (d-Amino Levulinic Acid) atau asam amino levulinat dalam darah dan urin; meningkatkan kadar protoporphirin dalam sel darah merah; memperpendek umur sel darah merah; menurunkan jumlah sel darah merah; menurunkan kadar retikulosit (sel-sel darah merah yang masih muda); serta meningkatkan kandungan
logam Fe dalam plasma darah. Organ-organ tubuh yang banyak menjadi sasaran keracunan logam timah hitam adalah siste m syaraf, sistem ginjal, sistem reproduksi, sistem endokrin, dan jantung.
Besar konsentrasi logam berat kadmium pada sedimen di perairan Ancol Teluk Jakarta masih tergolong aman bagi kehidupan biota yang ada menurut Dutch Quality Standards for Metals in Sediments yaitu di bawah 0.8 mg/kg
sedimen diduga karena tidak terjadi pembuangan limbah lumpur dari beragam sumber pencemaran seperti dari industri cat dan plastik, kegiatan penambangan, kegiatan ekstraksi dan pengolahan logam Zn, maupun kegiatan-kegiatan industri lainnya yang berada disekitar perairan yang berpotensi menimbulkan pencemaran di perairan Teluk Jakarta. Padahal apabila dilihat dari sifat logam kadmium itu sendiri yang cenderung untuk mengendap ke dasar perairan seharusnya logam tersebut banyak terakumulasi di dasar perairan.
Secara alami logam-logam berat biasanya tidak akan hilang dari ekosistem perairan dan akan cenderung untuk mengakumulasi di sedimen (Fostner dan Wittman 1983). Kemungkinan rendahnya konsentrasi logam kadmium dalam sedimen mengacu kepada Fostner dan Wittman (1983) kontaminasi logam kadmium memang tidak seluas logam-logam lainnya seperti merkuri, namun begitu sama berbahayanya bagi manusia. Hal ini dikarenakan menurut Fasset dan Don (1962) yang diacu dalam Yoga dan Sudarso (1997) bahwa keracunan logam berat kadmium dapat menyebabkan pengaruh pada sekresi kelenjar ludah, muntah yang berkelanjutan, sakit perut, vertigo, diare bahkan dapat hilang kesadarannya apabila seseorang mengkonsumsi ikan yang telah terakumulasi oleh logam berat kadmium cukup banyak.
4.3 Bioakumulasi Pb dan Cd pada Ikan Alu-alu
0
Gambar 6. Kandungan logam Pb pada organ ikan alu-alu.
Konsentrasi logam timah hitam yang tertinggi terdapat pada organ limfa, diduga karena sistem metabolisme tubuh mengenali logam berat timah hitam yang masuk ke dalam tubuh sebagai suatu zat asing, sehingga saat terjadi proses filtrasi darah maka logam Pb akan tersaring dalam plasma limfa (sistem limfatik) untuk selanjutnya dikeluarkan dari tubuh. Hal tersebut sejalan dengan fungsi utama organ limfa itu sendiri yaitu sebagai organ pertahanan atau kekebalan tubuh (immune system) yang memproduksi antibodi (Hibiya 1982; Banks 1986) maupun sebagai tempat untuk memproduksi sel-sel darah putih (defensive cells) dan sel-sel darah merah (eritrosit); mentransportasikan berbagai materi yang terlarut dalam plasma limfa; menyaring darah dan plasma limfa; menghancurkan sel-sel (fagositosis); serta mengeluarkan substansi asing, sel darah putih yang sudah mengalami degenerasi, maupun bakteri yang masuk ke dalam darah dan tersaring oleh plasma limfa (Copenhaver et al., 1978).
sebagai organ yang berfungsi sebagai penyaring atau filtrasi dan menjaga sistem immunitas - masih dalam kondisi bagus di dalam menjalanka n fungsinya.
Fungsi hati juga tidak jauh berbeda dari sistem limfatik, yaitu diantaranya metabolisme lemak, karbohidrat, protein, dan vitamin berlebih yang terdapat dalam darah (Copenhaver et al., 1978); memproduksi serum protein dan lipoprotein (Copenhave r et al., 1978); biotransformasi substansi toksik, senyawa kimia obat-obatan, dan hormon yang dianggap racun baik karena keberadaannya sudah tidak diperlukan oleh sistem metabolisme tubuh, maupun dikarenakan keberadaannya dapat membahayakan organisme tersebut dalam hal ini adalah ikan alu-alu (Banks 1986); mengeluarkan pigmen warna bilirubin pada kantung empedu (Banks 1986). Tingginya logam Pb pada organ hati diduga karena sifat organ hati itu sendiri yang cenderung untuk mengakumulasikan semua hasil filtrasi substansi asing yang berasal dari darah (Banks 1986). Namun penimbunan senyawa toksik dalam hati tidak akan berlangsung lama, proses pengeluaran dari dalam tubuh akan terjadi saat tubuh menganggap tingkat akumulasi dalam hati sudah berada pada tingkat kritis. Hal ini diduga dapat menjelaskan konsentrasi timah hitam pada organ hati yang tidak setinggi pada limfa.
Konsentrasi kedua tertinggi yaitu pada daging, diduga karena ikan alu-alu mengkonsumsi ikan-ikan kecil (prey), krustasea seperti kepiting, lobster, dan udang – yang notabene memiliki trofik level lebih rendah dari ikan alu-alu, dengan kandungan logam berat yang tinggi dalam tubuhnya. Terkait juga dengan rantai makanan yang ada, ikan alu-alu sebagai ikan predator karnivor dengan trofik level paling tinggi pada jenis ikan, tentunya akan mengakumulasi logam berat yang berasal dari mangsa-mangsanya yang berupa ikan-ikan kecil (Newman 1991). Hal tersebut sejalan dengan keberadaan logam berat Pb yang rendah pada perairan, dikarenakan menurut Newman (1991) apabila logam berat yang terkandung di dalam perairan rendah maka yang akan sangat berperan di dalam proses pengambilan (up-take) logam berat tersebut adalah melalui rantai makanan. Namun jika logam berat yang ada pada perairan tinggi, maka insang ikan akan dominan berperan di dalam proses pengambilan logam berat.
ekskretor (Hughes et al., 1973). Pola tingkah laku ikan alu-alu yang termasuk ke dalam ikan pelagis besar ini selalu bergerak cepat di kolam perairan laut yang luas, sehingga bukan tidak mungkin bagi ikan ini bergerak ke berbagai kolom perairan yang telah tercemar logam berat timah hitam me ngingat sangat kecilnya kandungan logam berat timah hitam di kolom perairan yang ada di beberapa stasiun yang diteliti. Proses pengambilan (up-take) logam berat dari perairan melalui insang sangat tergantung dari fungsi ventilation yaitu masuknya sejumlah air ke dalam insang sebagai akibat dari kontraksi otot filamen insang, dan juga kinerja mekanisme pompa operkulum yang akan menyedot air dari luar untuk masuk ke dalam rongga antara operkulum dan insang (Hughes et al., 1973). Namun ikan pelagis tidak memiliki fase pernafasan yang cepat, terkait juga dengan tingkah laku ikan alu-alu yang termasuk ikan perenang cepat. Besarnya volume air yang masuk akan sangat tergantung dari ukuran bukaan mulut ikan dan bukaan operkulum (Brown dan Muwir 1970 yang diacu da lam Hughes et al., 1973).
antidiuretic hormone (ADH). Proses selanjutnya adalah pengeluaran substansi
yang sudah tidak dapat dimanfaatkan melalui urin.
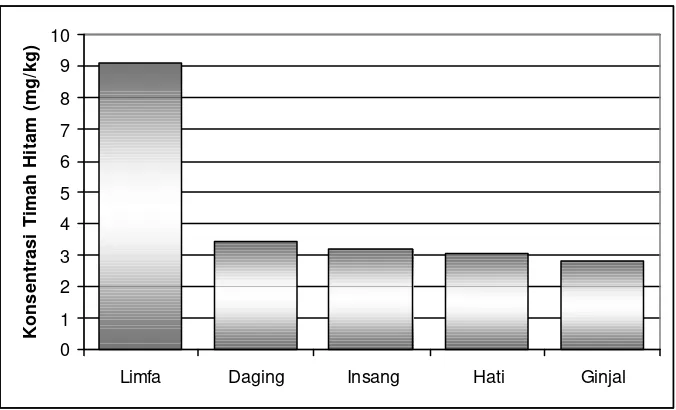
Perolehan data dari hasil analisa AAS sampel dari beberapa organ dalam pada ika n alu -alu menunjukkan bahwa ikan tersebut sudah tercemar oleh logam kadmium (Gambar 7).
Gambar 7. Kandungan logam Cd pada organ ikan alu-alu.
Kandungan logam berat kadmium pada ikan alu-alu dengan konsentrasi terbesar adalah pada organ hati yaitu sebesar 0.26 mg/kg, selanjutnya pada organ ginjal sebesar 0.1418 mg/kg, organ daging 0.1183 mg/kg, organ insang 0.1028 mg/kg, terakhir adalah organ limfa dengan jumlah konsentrasi terkecil diantara organ lainnya yaitu sebesar 0.0723 mg/kg.
dasarnya makhluk hidup tetap membutuhkan keberadaan logam berat di dalam menjalankan fungsi metabolisme tubuhnya, hanya saja dalam konsentrasi yang sangat sedikit. Jika kekurangan dalam jumlah yang cukup maka tubuh pun akan mengalami defisiensi, namun jika berlebihan dapat bersifat racun bagi tubuh (Owen 1985).
Organ ginjal menempati posisi kedua terbesar setelah organ hati yaitu dengan konsentrasi kadmium sebesar 0.1418 mg/kg. Fungsi ginjal itu sendiri adalah sebagai organ yang akan mengekskresikan zat-zat sisa metabolisme yang terbawa bersama darah lalu akan dikeluarkan dari tubuh dalam bentuk urin. Banyaknya zat-zat sisa yang harus dikeluarkan oleh ginjal pun akan meningkatkan kinerja ginjal itu sendiri. Namun menurut Heath (1987), proses ekskresi logam berat melalui organ ginjal tidak terjadi dalam waktu singkat melainkan akan diakumulasikan terlebih dahulu. Hal tersebut terkait dengan besar maupun berat molekul logam berat itu sendiri yang cenderung akan membuat kinerja ginjal meningkat (Banks 1986).
Pada daging terdapat konsentrasi logam kadmium sebesar 0.1183 mg/kg. Hal ini dikarenakan logam yang masuk ke dalam tubuh ikan melalui insang maupun melalui makanan akan dicerna di dalam saluran pencernaan untuk selanjutnya akan didistribusikan dan akan ikut ke dalam bentuk daging di seluruh bagian tubuh ikan, namun perlu diketahui bahwa logam berat tidak akan ikut terkonversi menjadi daging. Hal tersebut dikarenakan unsur dalam nutrisi yang mengalami metabolisme tubuh adalah unsur C (karbon), H (hidrogen), O (oksigen) dan N (nitrogen). Diniah (1995) mengatakan bahwa, logam berat akan banyak diakumulasikan dalam usus, kulit dan bagian ekor ikan. Sehingga menurutnya dianjurkan dalam mengkonsumsi ikan-ikan laut sebaiknya bagian tubuh tubuh tersebut tidak dimakan.
et al., 1973). Hal ini diduga ada hubungannya dengan sistem pernafasan
merupakan jaringan yang menghubungkan langsung antara ikan dengan lingkungan akuatik, dimana permukaannya hanya terdiri dari selapis tipis sel epitelium yang menjadi pembatas antara sistem sirkulasi darah ikan dengan air (Eller 1975 yang diacu dalam Mallins dan Jensen 1992). Namun seiring dengan produksi lendir terutama pada kulit akan memberi efek juga berupa pencegahan terabsorbsinya logam berat untuk masuk ke dalam tubuh melalui kulit. Hal ini dikarenakan lendir itu sendiri memiliki kerapatan massa jenis yang tinggi sehingga sukar untuk terjadinya pertukaran zat baik dari lingkungan ke dalam tubuh maupun sebaliknya, sehingga keberadaan lendir justru akan membuat logam berat menempel pada lendir yang lengket dan mengakumulasinya (Heath 1987). Logam berat yang banyak menempel pada lendir akan dengan sendirinya ikut terlepas bersamaan lepasnya le ndir dari kulit maupun insang ikan, dikarenakan ikan akan terus memproduksi lendir selama kondisi lingkungan masih terpapar logam berat (Heath 1987).
Pada dasarnya semua proses ekskresi tersebut terkait dengan “depuration rate” atau laju pemurnian yang merupakan lamanya waktu yang diperlukan dalam
berbanding lurus. Laju metabolisme ikan kecil lebih besar dari ikan-ikan yang memiliki ukuran tubuh besar, hal tersebut dikarenakan adanya perbedaan di dalam volume tubuh ikan (Schaepercalus 1933 yang diacu dalam Hoar et al., 1969). Sebagai perbandingan adalah ikan carper dengan berat 12 gram membutuhkan energi sebesar 24.48 kcal dalam waktu 24 jam/kg berat badan, sedangkan ikan dengan berat 600 gram hanya memerlukan energi sebesar 7.97 kcal. Konsumsi oksigen ikan kecil per unit berat badan yang tinggi juga membuktikan bahwa semakin besar juga kalori yang dikeluarkan (Schaepercalus 1933 yang diacu dalam Hoar et al., 1969).
Akumulasi logam berat timah hitam dan kadmium yang tinggi pada ikan alu-alu jika dikaitkan dengan keberadaannya pada rantai makanan yaitu sebagai ikan konsumen tingkat II pemakan daging atau dikenal sebagai ikan karnivora, tentunya dapat menjelaskan proses akumulasi yang terjadi. Gambar 8 berikut merupakan contoh rantai makanan dari logam berat merkuri (Hartung 1972 yang diacu dalam Forstner dan Wittman 1983).
Diawali dengan ikan-ikan herbivora kecil yang mengkonsumsi fitoplankton, zooplankton, maupun algae yang sudah tercemar logam berat timah hitam dalam sistem jaringannya sebagai akibat dari terpaparnya organisme di dalam perairan yang mengandung kontaminan logam berat. Selanjutnya ikan-ikan kecil tersebut akan dimakan oleh ikan-ikan karnivora yang trofik levelnya berada diatas ikan herbivora, demikian seterusnya hingga kemungkinan terjadinya biomagnifikasi - suatu penumpukkan biomassa logam berat dalam tubuh organisme yang terkait dengan adanya proses rantai makanan, adalah sangat besar. Organisme tingkat tinggi seperti manusia adalah yang paling dirugikan, hal ini terjadi karena manusia adalah rantai konsumen terakhir yang akan mendapatkan akumulasi logam berat terbesar dari keseluruhan rantai makanan yang ada.
Sebagai perbandingan, maka digunakan juga data kandungan logam berat pada ikan-ikan maupun organisme laut lainnya yang pernah diteliti di perairan Teluk Jakarta. Data tersebut dapat dilihat pada tabel-tabel berikut ini :
Tabel 12. Konsentrasi Pb (ppm) pada beberapa jenis ikan di Teluk Jakarta
Petek
Tabel 13. Konsentrasi Cd (ppm) pada beberapa jenis ikan di Teluk Jakarta
Tabel 14. Konsentrasi Pb dan Cd kerang hijau (Perna viridis) di Teluk Jakarta
Jenis logam Konsentrasi (ppm)
Hepatopankreas Pb 2.7709
Insang Pb 6.1350
Daging Pb 5.5351
Rataan 4.8136
Hepatopankreas Cd 0.2494
Insang Cd 0.2065
Daging Cd 0.5357
Rataan 0.3305
Sumber: Armanesa (2005)
Tabel 15. Konsentrasi Pb dan Cd ikan sokang (Triacanthus nieuhofii) di Teluk Jakarta
Stasiun Jenis logam Konsentrasi (ppm)
1 Pb 9.5565
2 Pb 4.5109
3 Pb 3.2883
Rataan 5.7852
1 Cd 0.2791
2 Cd 0.2517
3 Cd 0.0725
Rataan 0.2011
Sumber: Bangun (2005) dan Raditya (2005)
beberapa jenis ikan pelagis kecil seperti ikan petek (Leiognathus sp.) dan ikan sokang (Triacanthus nieuhofii), kandungan logam Pb dan Cd yang terdapat pada tubuhnya justru lebih besar dari kandungan logam serupa yang terdapat dalam ikan alu-alu. Begitu pula yang terjadi pada jenis kerang hijau (Perna viridis). Pada ikan-ikan pelagis kecil lainnya seperti ikan beloso (Saurida tumbil), ikan lidah (Cynoglossus sp.), ikan jenaha (Lutjanus sp.), serta jenis krustasea seperti kepiting (Scylla serrata) masing-masing memiliki kandungan logam kadmium yang lebih besar dari yang terakumulasi pada tubuh ikan alu-alu, namun ikan-ikan termasuk kepiting tersebut memiliki konsentrasi logam timah hitam yang lebih kecil dari ikan alu-alu. Akumulasi yang lebih besar lagi akan terjadi jika ikan-ikan pelagis kecil tersebut dimangsa oleh ikan-ikan dengan trofik level yang lebih tinggi. Dalam hal ini jika dilihat dari aspek biologis dan kebiasaan hidup ikan alu-alu yang akan memangsa ikan-ikan kecil maupun organisme jenis krustasea, dan cephalopoda, maka diduga ikan-ikan pelagis kecil tersebut maupun kepiting yang ada di perairan Teluk Jakarta merupakan mangsa (prey) ikan alu -alu yang menyebabkan akumulasi logam berat yang tinggi dalam tubuhnya.
Namun hal yang menjadi perhatian disini adalah kerang hijau (Perna viridis) - yang notabene merupakan organisme yang hidupnya menetap (sesille)
dan mempunyai sifat akumulasi terhadap substansi-substansi beracun termasuk di dalamnya logam berat, memiliki kandungan logam Pb maupun Cd yang tinggi pada organ-organ seperti hepatopankreas, insang, dan daging. Hal tersebut juga membuktikan kalau pencemaran yang terjadi di Teluk Jakarta memang sudah berada dalam kondisi memprihatinkan dan memerlukan penanganan yang lebih lanjut terhadap upaya pengendalian pencemaran yang terjadi.
4.4Respon Histopatologis Organ Dalam Ikan Alu-alu Terhadap Logam Berat Pb dan Cd
yang toksik karena adanya pencemaran dapat dilihat pertama kali dari analisa tingkat sel atau jaringan sebelum terlihat pada perubahan tingkah laku maupun penampakan dari luarnya. Gambar 9 berikut menunjukkan kerusakan dari jaringan daging ikan alu-alu yang ada di perairan Teluk Jakarta :
Gambar 9. Histopatologi daging ikan alu -alu (x 10); a) Degenerasi myofibril; b) Gumpalan retikulum sarkoplasmik; c) Myofibril yang sudah tidak berbentuk normal (Riani 2005).
Terlihat bahwa susunan myofibril pada organ daging tela h mengalami degenerasi yaitu mengalami perubahan bentuk seperti berliku-liku (A), terdapat beberapa retikulum sarkoplasmik yang tergabung menjadi satu sehingga terlihat berupa gumpalan putih (B), maupun susunan miofibril yang sudah tidak berbentuk (C). Sebagai perbandingan, berikut ditampilkan beberapa hasil penelitian dari Ferreira et al. (2003) yang ingin mengetahui pengaruh pencemaran logam berat merkuri (Hg) terhadap organ dalam hati dan daging ikan Hoplias malabaricus yang berasal dari 4 danau di daerah utara Rio de Janeiro, Brazil yaitu
Cima Lake, Campelo Lake, Feia Lake, dan Taquarucu Lake). Penelitian tersebut dilakukan Ferreira dikarenakan menurutnya pengaruh logam merkuri akan sangat berbahaya bagi ikan, yang pada akhirnya jika dikaitkan dengan proses rantai makanan, maka manusia akan menjadi sasaran terakhir bioakumulasi logam berat merkuri tersebut. Pada gambar histologi daging ikan Hoplias malabaricus yang terkontaminasi logam raksa (Hg) dibawah ini (Ferreira et al. 2003) menunjukkan struktur miofibril yang masih normal maupun yang sudah mengalami kelainan.
B B
A
Gambar 10. Histologi miofibril ikan Hoplias malabaricus; a) Histologi struktur miofibril normal (x 12000); b) Histopatologi miofibril akibat kontaminasi logam Hg (x 4400) (Ferreira et al. 2003).
Gambar 11. Histopatologi miofibril ikan Hoplias malabaricus; a) Histopatologi retikulum sarkoplasmik yang menggerombol (x 12000); b) Histopatologi retikulum sarkoplasmik yang menggabungkan diri (x 20000) (Ferreira et al. 2003).
Organ ginjal pada ikan alu-alu yang terpapar pada perairan yang sudah tercemar logam timah hitam dan kadmium jika dilihat secara histologis pun sudah mengalami kelainan struktur sel (histopatologis) seperti yang terlihat pada Gambar 12 di bawah ini:
A
B
Gambar 12. Histopatologi ginjal ikan alu-alu (x 40); a) Terjadi pembentukan rongga udara (vacuolation); b) Terjadi degenerasi inti sel (Riani 2005).
Gambar 13. Histopatologi ginjal ikan alu-alu (x 40). Panah menunjukkan sel-sel nefron yang mengalami peradangan (nephritis) (Riani 2005).
Pada Gambar 12 histologi ginjal alu-alu di atas, terlihat pengaruh kontaminasi logam berat pada ikan alu -alu berupa degenerasi inti sel (B), serta terjadi pembentukan rongga -rongga vakuola (vacuolation) (A). Sedangkan Gambar 13 menunjukkan sel-sel nefron yang mengalami peradangan - yang lebih dikenal dengan sebutan nephritis (Hibiya 1982), sebagai akibat dari adanya kontaminasi organ oleh senyawa atau substansi toksik yang meskipun keberadaannya sangat sedikit pada tubuh namun begitu mempengaruhi terhadap kerusakan organ. Namun menurut Tarmuzi (komunikasi pribadi 2005), vacuolation yang ada merupakan lemak yang terbentuk – berwarna putih
dikarenakan pewarnaan Hematoksisilin dan Eosin (H.E), denagn pembesaran yang lebih kuat lagi barulah dapat diketahui lemak tersebut ber-rongga atau tidak.
A
Sebagai data pembanding maka berikut juga akan ditampilkan hasil penelitian Bhuiyan et al. (2001) yang ingin mengetahui tingkat kerusakan di beberapa jaringan seperti hati, ginjal, dan ovarium ikan Channa punctatus sebagai akibat dari paparan sumithion (O, O-dimethyl-O-(3-methyl-4-nitrophenyl) phosphothionate) yang berasal dari limbah pestisida pertanian. Metode penelitian yang dilakukan Bhuiyan et al. adalah dengan cara melakukan bioassay. Hasil yang diperoleh menunjukkan bahwa paparan sumithion sangat mempengaruhi kerusakan pada jaringan organ dalam yang diamati. Berikut merupakan histologi ginjal ikan Channa punctatus yang terekspos sumithion (Gambar 14) (Bhuiyan et al. 2001).
Gambar 14. Histologi ginjal ikan Channa punctatus; a) Histologi ginjal normal (x 50); b) Histologi struktur ginjal yang mengalami kelainan akibat terekspos sumithion (x 50) (Bhuiyan et al. 2001).
Menurut hasil penelitian yang diperoleh Bhuiyan et al. (2001) bahwa jika dilihat dari struktur sel ginjal yang terkontaminasi sumithion, sel ginjal mengalami banyak perubahan seperti terjadinya pembentukan rongga-rongga (vacuolation), degenerasi tubuli ginjal dan sel-sel hematopoietic. Selain itu disebutkan juga terjadi nekrosis (kematian sel), pyknosis (penyusutan inti) dan hemorrhage (pendarahan) pada sel ginjal.
Organ hati ikan alu-alu yang terpapar logam berat pun mengalami kelainan yaitu berupa pendarahan (hemorrhage) atau yang lebih tepatnya adalah pembendungan sel-sel darah merah (congesti) (Tarmuzi, komunikasi pribadi 2005). Pada gambar hasil histologi yang didapat, yang terlihat adalah gumpalan-gumpalan sel-sel darah merah (eritrosit) yang terkonsentrasi disuatu tempat
(ditunjukkan oleh panah). Hal ini dapat dilihat dengan jelas pada Gambar 15 berikut:
Gambar 15. Histopatologi hati ikan alu -alu (x 20) (Riani 2005). Panah menunjukkan kelainan congesti.
Pada beberapa studi penelitian lainnya seperti hasil penelitian dari Bhuiyan et al. (2001), disimpulkan bahwa pada organ hati ikan Channa punctatus yang
terekspos sumithion menunjukkan kelainan-kelainan seperti pecahnya pembuluh darah, pyknosis, nekrosis ringan, dan pembentukan rongga-rongga (vacuolation). Disamping itu juga terjadi pendarahan (hemorrhage) sebagai akibat keluarnya sel-sel darah merah dari pembuluhnya yang sudah pecah. Gambaran jelasnya terlihat pada Gambar 17 berikut ini:
Gambar 17. Histopatologi hati ikan Channa punctatus (x 50) (Bhuiyan et al. 2001).
Penelitian yang dilakukan Ferreira et al. (2003) yang ingin melihat pengaruh kontaminasi logam raksa (Hg) terhadap perubahan histologi daging dan hati ikan spesies Hoplias malabaricus, terbukti bahwa logam raksa berpengaruh terhadap struktur sel mitochondria maupun retikulum endoplasmik. Secara umum mereka mengatakan telah terjadi perubahan seperti menyebarnya retikulum endoplasmik dan terdapatnya se jumlah kecil mitokondria yang terkonsentrasi di dekat nukleus. Berikut ini adalah gambar histologi organ hati ikan Hoplias malabaricus (Gambar 18):
Gambar 18. Histologi hati ikan Hoplias malabaricus; a) Histologi hati dengan pertumbuhan retikulum endoplasmik (x 7000); b) Retikulum endoplasmik (x 20000). N = nukleus; m = mitokondria; er = retikulum endoplasmik (Ferreira et al. 2003).