ii
PERBANDINGAN MUTU SEDIAAN SIMVASTATIN
TABLET
E-CATALOGUE
BPJS DAN NON
E-CATALOGUE
BPJS
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
YUNNICA SRI HAPSARI
1112102000054
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
iii
Skripsi ini adalah hasil karya saya sendiri,
dan semua sumber baik yang dikutip maupun dirujuk
telah saya nyatakan dengan benar.
Nama : Yunnica Sri Hapsari
NIM : 1112102000054
Tanda Tangan :
iv Nama : Yunnica Sri Hapsari
NIM : 1112102000054
Program Studi : Farmasi
Judul Skripsi : Perbandingan Mutu Sediaan Simvastatin Tablet E- Catalogue BPJS dan Non E-Catalogue BPJS
Disetujui oleh:
Pembimbing I Pembimbing II
Yuni Anggraeni, M. Farm., Apt Drs. Umar Mansur, M.Sc., Apt.. NIP. 19831028 200901 2 008 NIP. 1946 022 719 740 31001
Mengetahui,
Ketua Program Studi Farmasi Fakultas Kedokteran dan ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah
v Skripsi ini diajukan oleh :
Nama : Yunnica Sri Hapsari
NIM : 1112102000054
Program Studi : Farmasi
Judul Skripsi : Perbandingan Mutu Sediaan Simvastatin Tablet E- Catalogue BPJS dan Non E-Catalogue BPJS
Telah berhasil dipertahankan di hadapan Dewan Penguji dan diterima sebagai bagian persyaratan yang diperlukan untuk memperoleh gelar Sarjana Farmasi pada Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta
DEWAN PENGUJI
Pembimbing I : Yuni Anggraeni, M. Farm., Apt ( ) Pembimbing II : Drs. Umar Mansur, M. Sc., Apt. ( ) Penguji I : Ofa Suzanti Betha, M. Si., Apt. ( ) Penguji II : Lina Elfita, M. Si., Apt. ( )
vi Program Studi : Farmasi
Judul : Perbandingan Mutu Sediaan Simvastatin Tablet E- Catalogue BPJS dan Non E-Catalogue BPJS
Simvastatin adalah agen anti-hiperlipidemia yang banyak digunakan di seluruh dunia untuk pengobatan hiperkolesterolemia. Berbagai merek sediaan simvastatin beredar di masyarakat, sehingga perlu dilakukan uji perbandingan mutu sediaan. Penelitian ini bertujuan untuk membandingkan kualitas sediaan simvastatin tablet e-catalogue BPJS dan non e-catalogue BPJS. Dua obat e-catalogue BPJS dan dua obat non e-catalogue BPJS di uji kualitas fisik meliputi uji kekerasan dan uji waktu hancur, pengujian penetapan kadar dan uji keseragaman kandungan sesuai Farmakope Indonesia, serta uji profil disolusi menurut United States of Pharmacopeia XXXII (USP 32). Simvastatin yang terdisolusi diukur dengan spektrofotometer UV-vis. Hasil uji kualitas fisik yaknii uji kekerasan tablet dan uji waktu hancur tablet dari tablet e-catalogue BPJS dan tablet non catalogue BPJS telah memenuhi persyaratan. Hasil uji penetapan kadar untuk tablet e-catalogue BPJS sebesar 94,65% dan 87,90%, untuk tablet non e-e-catalogue BPJS sebesar 96,40% dan 94,73%, di mana terdapat satu merek tablet e-catalogue BPJS yang tidak memenuhi persyaratan. Hasil uji keseragaman kandungan untuk tablet e-catalogue BPJS dan tablet non e-catalogue BPJS telah memenuhi persyaratan. Hasil uji disolusi menunjukkan bahwa tablet e-catalogue BPJS dan non e-catalogue BPJS memenuhi rentang penerimaan persyaratan pelepasan metode disolusi tes satu yang tercantum dalam USP 32. Hasil analisa statistik data persentase kumulatif simvastatin yang terlepas dari simvastatin e-catalogue BPJS dan non e-catalogue BPJS menunjukkan bahwa terdapat perbedaan yang bermakna tetapi tidak memiliki arti karena semua sampel telah memenuhi persyaratan uji disolusi. Berdasarkan hasil parameter uji penetapan kadar, tablet simvastatin non e-catalogue BPJS memiliki mutu yang relatif lebih baik dibandingkan dengan tablet simvastatin e-catalogue BPJS.
vii Program Study : Pharmacy
Title : Quality Comparison of Simvastatin Tablet BPJS E-Catalogue and Non BPJS E-Catalogue
Simvastatin is an anti-hyperlipidemic agents which are widely used worldwide for the treatment of hypercholesterolemia. Various brands of simvastatin widely revolve, then quality comparisons is important to do. This study aimed to compare the quality of simvastatin tablet dosage BPJS catalog and non BPJS catalog. Two drug of BPJS e-catalog and two drug of non BPJS e-e-catalog had physical tested include by hardness test quality and disintegration test. The assay and uniformity of content is accordance Pharmacopoeia of Indonesia and the profiles of dissolution by the United States of Pharmacopeia XXXII (USP 32). Simvasatatin were dissolved was measured by UV-vis spectrophotometer. The physical test result of e-catalogue BPJS and non BPJS e-catalog tablets have fulfilled the requirements of physical testing ranges acceptance by Pharmacopeia of Indonesia. The test results of the assay for tablet e-catalog BPJS is 94.65% and 87,90%, meanwhile for non e-catalog tablet BPJS amounted to 96.40% and 94,73%, where there is one of e-catalog BPJS tablet that unfulfilled the requirements of assay testing. The results of tablet content uniformity testing for e-catalog BPJS and non BPJS e-catalog tablet have fulfilled the requirements ranges acceptance by Pharmacopeia of Indonesia. The dissolution testing results shows that the tablet of BPJS e-catalog and non-e-catalog BPJS have fulfilled the requirements ranges acceptance tests of the dissolution methods listed in USP 32. The results of the statistical analysis of data cumulative released percentage of simvastatin e-catalog BPJS and non BPJS e-catalog shows that there are significant differences but does not have meaning because all of the samples have fulfilled the requirements of dissolution testing. Based on the results of the test parameters of the assay, simvastatin tablets non BPJS e-catalog has a relatively better quality compared with simvastatin tablets BPJS e-catalog.
Keywords : simvastatin tablets of BPJS e-catalog, simvastatin tablet of
viii
melimpahkan berbagai macam nikmat, karunia serta kasih sayang-Nya sehingga penulis
dapat menyelesaikan penelitian dan penyusunan skripsi dengan judul “Perbandingan Mutu Sediaan Simvastatin Tablet e-catalogue BPJS dan Non e-catalogue BPJS”. Skripsi ini disusun untuk memenuhi salah satu syarat menyelesaikan program pendidikikan Strata 1 (S1) pada Program Studi Farmasi, Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
Dalam proses perkuliahan hingga penelitian dan penyusunan skripsi ini, penulis menyadari adanya beberapa pihak yang memberikan kontribusi kepada penulis. Oleh karena itu, penulis mengucapkan rasa terima kasih kepada :
1. Bapak Dr. Arief Sumantri, S.KM., M.Kes selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta. 2. Ibu Dr. Nurmeilis, M.Si., Apt. selaku ketua Program Studi Farmasi, Fakultas
Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
3. Ibu Nelly Suryani, Ph.D., Apt selaku sekertaris Program Studi Farmasi, Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
4. Ibu Yuni Anggraeni, M.Farm., Apt. selaku pembimbing pertama dan Bapak Drs. Umar Mansur, M.Sc., Apt. selaku pembimbing kedua, yang telah meluangkan waktu, pikiran dan tenaga serta memberikan ilmu terbaik yang dimiliki sehingga penulis dapat menyelesaikan skripsi ini.
5. Bapak dan Ibu staf pengajar yang telah memberikan ilmu pengetauan selama penulis menempuh pendidikan di Program Studi Farmasi, Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta. 6. Ibunda Alm. Prapti, ayahanda Hadi Suryanto tersayang, dan keluarga tercinta
yang selalu memberikan kasih sayang, semangat, dukungan, do’a dan nasihat tak
ix
keseharian penulis di laboratorium selama penelitian.
8. Teman seperjuangan penelitian, Resha dan Zainab atas kebersamaan, bantuan serta motivasinya sejak awal penelitian hingga akhir penyelesaian skripsi ini. 9. Temanku Mita, Amelia, Dian Mutia, Dwi Haryati, Hasna dan ‘Afniah yang telah
setia menemaniku selama di bangku perkuliahan, serta telah memberikan dukungan, motivasi, hiburan dan masukan kepada penulis selama pengerjaan skripsi dan selama masa perkuliahan.
10.Teman-teman Farmasi 2012, terima kasih atas persaudaraan dan kebersamaan kita dari awal masuk sampai akhir ini, semoga silahturahmi kita biasa tetap terjaga. 11.Semua pihak yang tidak dapat disebutkan satu persatu, yang turut memberikan
bantuan dan dukungan dalam penyelesaian skripsi.
Penulis sadar bahwa dalam penulisan skripsi ini masih banyak kelemahan dan kekurangan, kritik dan saran pembaca diharapkan penulis untuk memperbaiki kemampuan penulis. Semoga skripsi ini membawa manfaat bagi pengembangan ilmu.
Ciputat, Juli 2016
x
Sebagai sivitas akademik Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta, saya yang bertanda tangan di bawah ini:
Nama : Yunnica Sri Hapsari NIM : 1112102000054 Program Studi : Farmasi
Fakultas : Kedokteran dan Ilmu Kesehatan Jenis karya : Skripsi
Demi perkembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah saya, dengan judul :
PERBANDINGAN MUTU SEDIAAN SIMVASTATIN TABLET E-CATALOGUE BPJS DAN NON E-CATALOGUE BPJS
untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital Library Perpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta.
Demikian pernyataan persetujuan publikasi karya ilmiah ini saya buat dengan sebenarnya.
Dibuat di : Ciputat Pada Tanggal : 19 Juli 2016
Yang menyatakan,
xi
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI ... xi
DAFTAR ISI... xii
1.4 Hipotesis Penelitian ... 3
1.5 Manfaat Penelitian ... 3
BAB 2 TINJAUAN PUSTAKA... 4
2.1 Penggolongan Obat ... 5
2.2 Tablet ... 7
2.3 Monografi Simvastatin ... 10
2.3.1 Sifat Fisikokimia ... 10
2.3.2 Mekanisme Kerja ... 10
2.3.3 Efek Samping ... 11
2.4 Parameter Analisis Tablet ... 11
2.4.1 Keseragaman Bobot Tablet ... 11
2.4.2 Kekerasan Tablet ... 12
2.4.3 Kerapuhan Tablet ... 12
2.4.4 Waktu Hancur Tablet ... 13
2.4.5 Keseragaman Sediaan Tablet ... 13
2.4.6 Disolusi ... 14
2.5 Spektrofotometer UV-Vis ... 18
2.5.1 Teori Spektrofotometri ... 18
2.5.2 Komponen Spektrofotometri ... 19
2.5.3 Analisa Kualitatif ... 20
2.5.4 Analisa Kuantitatif ... 20
xii
3.3. Bahan ... 23
3.4 Prosedur Kerja ... 23
3.4.1 Pemilihan Sampel ... 23
3.4.2 Parameter Evaluasi Tablet ... 24
3.4.3 Penentuan Panjang Gelombang ... 24
3.4.4 Pembuatan Kurva Kalibrasi ... 25
3.4.5 Penetapan Kadar Tablet Simvastatin ... 25
3.4.6 Keseragaman Kandungan ... 26
3.4.7 Uji Laju Disolusi Tablet Simvastatin ... 26
3.4.8 Analisa Statistik ... 27
BAB 4 HASIL DAN PEMBAHASAN ... 28
4.1 Pengambilan sampel ... 28
4.2 Evaluasi Fisik Tablet ... 29
4.3 Penentuan Panjang Gelombang Maksimum simvastatin ... 31
4.4 Penentuan Kurva Kalibrasi ... 32
4.5 Penetapan Kadar Tablet Simvastatin ... 33
4.6 Keseragaman Kandungan ... 35
4.7 Uji Disolusi Tablet Simvastatin ... 36
4.8 Analisa Statistik ... 42
BAB 5 KESIMPULAN DAN SARAN ... 43
5.1 Kesimpulan ... 43
5.2 Saran ... 43
DAFTAR PUSTAKA ... 44
ii
iii
Tabel Halaman
2.1 Persyaratan Penyimpangan Bobot Tablet ... 12
4.1 Hasil Uji Kekerasan Tablet... 29
4.2 Hasil Uji Waktu Hancur ... 30
4.3 Hasil Uji Penetapan Kadar Tablet Simvastatin ... 34
4.4 Hasil Uji Keseragaman Kandungan ... 35
4.5 Data Persentase Kumulatif Pelepasan Simvastatin ... 38
4.6 Hasil Analisis Kesesuaian Pelepasan Simvastatin pada Menit ke-45 dari Empat Merek ... 41
iv
Lampiran Halaman
1. Bagan Alur Penelitian ... 47
2. Alat ... 48
3. Sertifikat Analisis Standar Simvastatin ... 49
4. Hasil Uji Kekerasan Tablet... 50
5. Hasil Uji Waktu Hancur Tablet. ... 50
6. Panjang Gelombang Maksimum Simvastatin dalam Metanol ... 51
7. Panjang Gelombang Maksimum Simvastatin dalam Dapar fosfat .. 51
8. Kurva Kalibrasi Simvastatin dalam Metanol ... 52
9. Kurva Kalibrasi Simvastatin dalam Dapar Fosfat pH 7,0 ... 52
10. Data Kurva Kalibrasi Simvastatin dalam Metanol ... 53
11. Data Kurva Kalibrasi dalam Medium Dapar Fosfat pH 7,0 ... 53
12. Data Uji Penetapan Kadar Tablet Simvastatin ... 53
13. Peritungan Persen Kadar pada Uji Penetapan Kadar... 54
14. Data Uji Keseragaman Kandungan Tablet Simvastatin Generik A. 56 15. Data Uji Keseragaman Kandungan Tablet Simvastatin Generik B. 56 16. Data Uji Keseragaman Kandungan Tablet Simvastatin merek X ... 57
17. Data Uji Keseragaman Kandungan Tablet Simvastatin merek Y ... 57
18. Perhitungan Persen Kadar pada Uji Keseragaman Kandungan... 58
19. Data Persentase Kumulatif Pelepasan Simvastatin ... 60
20. Perihitungan % Jumlah Kumulatif Simvastatin yang Terlepas ... 61
1 1.1 Latar Belakang
Simvastatin adalah agen anti-hiperlipidemia yang banyak digunakan di seluruh dunia untuk pengobatan hiperkolesterolemia dan meminimalkan tingkat keparahan pada penyakit jantung kronis (Scandinavian Simvastatin Survival Study Group. 1994). Berdasarkan hasil laporan IMS (Institute for Healthcare Informatics) pada tahun 2010 tablet generik simvastatin menempati peringkat kedua untuk obat yang paling banyak diresepkan yakni sebanyak 94,1 juta resep di seluruh dunia (Daniel J. DeNoon, 2011). Tablet simvastatin dalam perdagangan dijumpai dengan nama dagang dan generik, dimana obat dengan nama generik harganya jauh lebih murah dibanding dengan obat dengan nama dagang. Sementara masyarakat cenderung menilai bahwa kualitas obat identik dengan harga yang lebih tinggi, obat yang lebih mahal mutunya lebih baik daripada obat yang lebih murah harganya (Depkes RI, 1989).
Parameter persyaratan mutu antara lain kualitas fisik sediaan dan kadar yang dikandung harus memenuhi persyaratan kadar yang tercantum dalam literatur yang berlaku seperti Farmakope Indonesia maupun literatur lain yang berlaku (Depkes RI, 1989). Sementara, obat yang telah memenuhi persyaratan kekerasan, waktu hancur, keragaman bobot, dan penetapan kadar, belum dapat menjamin bahwa suatu obat memenuhi efek terapi. Oleh karena itu, uji disolusi harus dilakukan pada setiap tablet. Disolusi menggambarkan efek obat terhadap tubuh, jika disolusi memenuhi syarat maka diharapkan obat akan memberikan khasiat pada tubuh (Syukri, 2002).
Menurut sistem klasifikasi BCS (Biopharmaceutical Classification System), simvastatin termasuk golongan obat kelas II yaitu obat yang
UIN Syarif Hidayatullah Jakarta sebaiknya dilakukan uji laju disolusi yang merupakan tahap penentu kualitas terhadap bioavailabilitasnya (Sulaiman, 2007). Disolusi merupakan langkah penentu kecepatan onset of action dan aktivitas terapetik, oleh sebab itu uji disolusi perlu dilakukan untuk memastikan kualitas sediaan tablet simvastatin.
Jaminan kualitas produk farmasi adalah sebuah cakupan konsep yang luas mengenai semua isu yang secara individual atau kolektif dapat mempengaruhi kualitas suatu produk. Dalam hal ini, uji disolusi in-vitro sangat penting untuk mengevaluasi variasi berbagai merek-merek obat guna memastikan kualitas dan khasiat dari produk sediaan. Hal ini sangat penting untuk memastikan produk yang aman dan efektif untuk pasien ketika berbagai merek yang berbeda beredar di masyarakat dengan zat aktif yang sama. Produk generik mungkin memiliki perubahan tertentu dalam bahan formulasi, bahan baku zat aktif, proses manufaktur, teknologi manufaktur, ukuran batch dan scale-up dari proses manufaktur, sehingga evaluasi kualitas sediaan dari berbagai merek tersebut perlu dilakukan (Bonûlio, R., dkk, 2011)
Saat ini pemerintah sedang melaksanakan penjaminan kesehatan bagi masyarakat menengah ke bawah sebagai bagian dari pengembangan jaminan secara menyeluruh. Sistem jaminan kesehatan akan mendorong perubahan-perubahan mendasar seperti penataan standarisasi pelayanan, standarisasi tarif, penataan formularium dan penggunaan obat rasional, yang berdampak pada kendali mutu dan kendali biaya.
UIN Syarif Hidayatullah Jakarta 1.2 Rumusan Masalah
Bagaimana mutu sediaan simvastatin tablet e-catalogue BPJS dan non e-catalogue BPJS menurut persyaratan kualitas fisik yang sesuai dengan Farmakope Indonesia, serta kadar dan profil disolusinya menurut USP XXXII?
1.3 Tujuan Penelitian
Penelitian ini bertujuan untuk membandingkan kualitas Simvastatin tablet e-catalogue BPJS dan non e-catalogue BPJS dengan menggunakan metode yang ditetapkan oleh Farmakope Indonesia dan USP XXXII.
1.4 Hipotesis Penelitian
Simvastatin tablet catalogue BPJS dan simvastatin tablet non e-catalogue BPJS memiliki kualitas fisik, kadar, dan profil disolusi yang
sama.
1.5 Manfaat Penelitian
4 2.1 Penggolongan Obat
Dalam pemasarannya, selain obat bebas, obat bebas terbatas, obat keras terbatas dan psikotropika, dan obat narkotika. Obat juga dapat dikelompokkan menjadi 3 bagian berdasarkan nama mereknya, antara lain adalah :
a. Obat Paten
b. Obat Generik Bermerek /Bernama dagang c. Obat Generik
Obat paten atau specialité adalah obat milik perusahaan tertentu dengan nama khas yang diberikan produsennya dan dilindungi hukum, yaitu merek terdaftar (proprietary name). Dalam pustaka lain, obat paten adalah obat yang memiliki hak paten (Jas, 2007; Depkes, 2010).
UIN Syarif Hidayatullah Jakarta
Obat paten adalah obat yang mempunyai hak paten dan diberikan kepada industri farmasi pada obat baru yang ditemukannya berdasarkan riset. Industri farmasi tersebut diberi hak paten untuk memproduksi dan memasarkannya, setelah melalui berbagai tahapan uji klinis sesuai aturan yang telah ditetapkan secara internasional. Obat yang telah diberi hak paten tersebut tidak boleh diproduksi dan dipasarkan dengan nama generik oleh industri farmasi lain tanpa izin pemilik hak paten selama masih dalam masa hak paten.
b. Obat Generik Bermerek atau Bernama Dagang
Berdasarkan peraturan Menteri Kesehatan Republik Indonesia Nomor HK.02.02/Menkes/068/I/2010 obat generik bermerek bernama dagang adalah obat generik dengan nama dagang yang menggunakan nama milik produsen obat yang bersangkutan (Depkes, 2010).
UIN Syarif Hidayatullah Jakarta Dalam pustaka lain, terdapat istilah yang berbeda yaitu obat merek dagang (trademark). Obat merek dagang (trademark) adalah obat yang dibuat dengan mendapatkan lisensi dari pabrik lain yang obatnya telah dipatenkan (Jas, 2007).
Untuk obat generik me-too pertama harus memenuhi seluruh standar yang digunakan dalam identitas, kekuatan, kualitas, dan kemurniannya. Bahkan untuk obat generik me-too terdapat persaratan bioavailabilitas dan bioekivalensi dengan obat paten yang telah habis masa edarnya (Nanang, 2010) c. Obat Generik
Berdasarkan peraturan Menteri kesehatan Republik Indonesia Nomor HK.02.02/Menkes/068/I/2010 obat generik adalah obat dengan nama resmi International Non Propietary Names (INN) yang ditetapkan dalam Farmakope Indonesia atau buku standar lainnya untuk zat khasiat yang dikandungnya. Dalam pustaka lain, obat generik (generic name) adalah obat dengan nama umum tanpa melanggar hak paten obat bersangkutan (Jas, 2007).
Kebijakan obat generik adalah salah satu kebijakan untuk mengendalikan harga obat, di mana obat dipasarkan dengan nama bahan aktifnya.
Agar upaya pemanfaatan obat generik ini dapat mencapai tujuan yang diinginkan, maka kebijakan tersebut mencakup komponen-komponen berikut :
UIN Syarif Hidayatullah Jakarta 2. Pengendalian mutu obat generik secara ketat.
3. Distribusi dan penyediaan obat generik di unit-unit pelayanan kesehatan.
4. Peresapan berdasarkan atas nama generik, bukan nama dagang.
5. Penggantian (substitusi) dengan obat generik diusulkan diberlakukan di unit-unit pelayanan kesehatan.
6. Informasi dan komunikasi mengenai obat generik bagi dokter dan masyarakat luas secara berkesinambungan. 7. Pemantauan dan evaluasi penggunaan obat generik secara
berkala
(Informatorium Obat Nasional Indonesia, 2000). 2.2 Tablet
Tablet adalah sediaan padat kompak yang dibuat secara cetak, dalam tabung bentuk pipih atau sirkuler, kedua permukaannya atau cembung mengandung satu jenis obat atau lebih dengan atau tanpa zat tambahan (Anonim,1979).
Dengan kemajuan di bidang teknologi dan peningkatan pengetahuan serta adanya tuntutan untuk terus mengembangkan bentuk sediaan, tablet terus dikembangkan dari tablet standar menjadi berbagai jenis tablet yang lain yang menawarkan berbagai keunggulan dan keuntungan termasuk dalam hal peningkatan bioavailabilitas, format dosis tablet yang lebih efisien, serta kenyamanan dalam penggunaan (Saifullah, 2007).
Sediaan obat dalam bentuk tablet mempunyai keuntungan dibanding sediaan lain (Banker dan Anderson, 1986), yaitu:
a. Bentuk sediaan dengan ketepatan ukuran dan variabilitas kandungan yang paling rendah.
b. Ongkos pembuatan paling murah dan mudah diproduksi secara besar besaran.
UIN Syarif Hidayatullah Jakarta d. Tablet paling mudah ditelan.
e. Memiliki sifat pencampuran kimia, mekanik dan stabilitas mikrobiologi yang baik.
Selain berbagai keuntungan, tablet juga memiliki berbagai kelemahan, diantaranya (Saifullah, 2007) :
a. Bahan aktif dengan dosis yang besar dan tidak kompresibel sulit dibuat tablet karena tablet yang dihasilkan akan besar sehingga tidak acceptable
b. Terdapat kendala dalam memformulasi zat aktif yang sulit terbasahi dan tidak larut, serta disolusinya rendah
c. Kesulitan menelan pada anak-anak, orang sakit parah dan pasien lanjut usia
d. Pasien yang menjalani radioterapi tidak dapat menelan tablet.
Pada umumuya sediaan tablet mengalami suatu rangkaian proses untuk mendukung onset kerjanya. Proses tersebut meliputi :
1. Disintegrasi produk obat yang diikuti pelepasan obat dari zat pembawa.
Setelah tablet diminum, tablet akan mengalami proses disintegrasi di dalam lambung menjadi granul-granul kecil yang terdiri dari zat aktif dan bahan tambahan. Granul-granul akan pecah, dan zat aktif akan terlepas dari bahan tambahan yang kemudian akan terlarut pada larutan cerna. Bahan tambahan yang digunakan pada formulasi tablet sangat mempengaruhi kinetika pelarutan obat.
Contoh bahan tambahan yang digunakan dalam sediaan tablet adalah :
i. Bahan pengisi yakni ditambahkan untuk mendapatkan berat yang diinginkan, bahan tambahan harus bersifat inert.
UIN Syarif Hidayatullah Jakarta dengan ukuran yang sama dan bentuk speris setelah dipaksakan melewati ayakan.
iii. Bahan pengembang yakni digunakan untuk memecah tablet menjadi partikel kecil sehingga luas permukaan akan bertambah besar.
iv. Bahan pelicin yakni digunakan untuk meningkatkan daya alir granul-granul pada corong pengisi mencegah melekatnya massa pada punch dan die, mengurangi gesekan antara butir-butir granul dan mempermudah pengeluaran tablet dari die.
(Soekemi, 1987) 2. Pelarutan obat dalam media.
Obat akan dapat diabsorpsi bila dalam bentuk terlarut dalam media saluran cerna. Faktor-faktor yang mempengaruhi pelarutan obat adalah derajat kehalusan obat dan bentuk kristal zat aktif. Semakin kecil ukuran partikel obat maka semakin luas permukaan yang dimiliki untuk berinterakski dengan media saluran cerna. Dengan demikian, akan mempercepat proses pelarutan obat.
UIN Syarif Hidayatullah Jakarta 2.3 Monografi Simvastatin
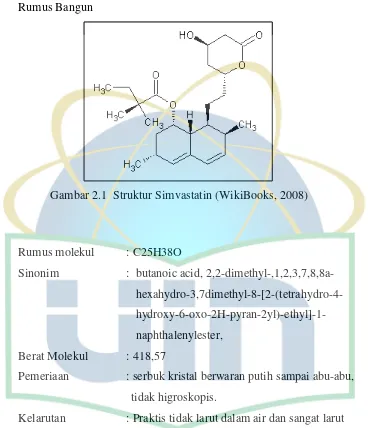
2.3.1 Sifat Fisikokimia Rumus Bangun
Gambar 2.1 Struktur Simvastatin (WikiBooks, 2008)
Rumus molekul : C25H38O
Sinonim : butanoic acid, 2,2-dimethyl-,1,2,3,7,8,8a- hexahydro-3,7dimethyl-8-[2-(tetrahydro-4- hydroxy-6-oxo-2H-pyran-2yl)-ethyl]-1- naphthalenylester,
Berat Molekul : 418,57
Pemeriaan : serbuk kristal berwaran putih sampai abu-abu, tidak higroskopis.
Kelarutan : Praktis tidak larut dalam air dan sangat larut dalam kloroform, metanol dan etanol. 2.3.2 Mekanisme Kerja
UIN Syarif Hidayatullah Jakarta menginduksi suatu peningkatan reseptor LDL dengan afinitas tinggi. Efek tersebut meningkatkan kecepatan ekstraksi LDL oleh hati, sehingga mengurangi simpanan LDL plasma (Katzung, 2002).
Simvastatin merupakan prodrug dalam bentuk lakton yang
harus dihidrolisis terlebih dulu menjadi bentuk aktifnya yaitu asam β -hidroksi di hati, lebih dari 95% hasil hidrolisisnya akan berikatan dengan protein plasma. Konsentrasi obat bebas di dalam sirkulasi sistemik sangat rendah yaitu kurang dari 5%, dan memiliki waktu paruh 2 jam. Sebagian besar obat akan dieksresi melalui hati.
Dosis awal pemberian obat adalah sebesar 5-10 mg/hari, dengan dosis maksimal 40 mg/hari. Pemberian obat dilakukan pada malam hari (Witztum, 1996).
2.3.3 Efek Samping
Efek samping dari pemakian Simvastatin adalah konstipasi, nausea, flatulen, diare, dispepsia, sakit perut, fatigue, nyeri dada dan angina, sstenia, miopathy, ruam kulit, rhabdomyolisis, hepatitis, angioneurotik edema terisolasi. Insiden terjadinya miopati cukup rendah (<1%). Akan tetapi, pada pada pasien dengan risiko tinggi terhadap gangguan otot, pemberian Simvastatin harus diperhatikan (Suyatna, 1995).
2.4 Parameter Analisis Tablet
Pemeriksaan kualitas tablet meliputi keseragaman bobot, kekerasan kerapuhan daya serap dan waktu hancur.
UIN Syarif Hidayatullah Jakarta kolom A dan tidak satu tablet pun yang bobotnya menyimpang lebih besar dari bobot rata-rata yang ditetapkan kolom B (Anonim, 1973).
Tabel 2.1 Persyaratan Penyimpangan Bobot Tablet (Anonim, 1995)
2.4.2 Kekerasan Tablet
Kekerasan merupakan parameter yang menggambarkan ketahanan tablet dalam melawan tekanan mekanik seperti goncangan, kikisan dan terjadi keretakan tablet selama pembungkusan dan pengangkutan. Faktor-faktor yang mempengaruhi kekerasan ini dipakai sebagai ukuran dari tekanan pengempaan, semakin besar tekanan yang diberikan saat pentabletan maka akan meningkatkan kekerasan tablet. Kekerasan tablet yang baik mempunyai kekerasan atara 4 - 8 kg (Parrott, 1971).
2.4.3 Kerapuhan Tablet
Kerapuhan tablet merupakan ketahanan tablet dalam melawan tekanan mekanik terutama goncangan dan pengikisan. Kerapuhan dinyatakan dalam persentase bobot yang hilang selama uji kerapuhan. Tablet yang baik mempunyai nilai kerapuhan tidak lebih dari 1% (Parrott, 1971). Kerapuhan tablet dapat dihitung dengan rumus % kerapuhan
Keterangan : f : Friabilitas a : berat tablet awal
UIN Syarif Hidayatullah Jakarta 2.4.4 Waktu Hancur Tablet
Waktu hancur tablet adalah waktu yang diperlukan untuk hancurnya tablet dalam waktu yang sesuai sehingga tidak ada bagian yang tertinggal diatas kasa. Waktu hancur dipengaruhi oleh sifat fisik granul dengan kekerasan (Banker dan Anderson, 1994). Waktu yang diperlukan untuk hancurnya tablet untuk medium yang sesuai kecuali dinyatakan lain tidak lebih dari 15 menit (Anonim, 1995).
2.4.5 Keseragaman Sediaan Tablet
Keseragaman sediaan dapat ditetapkan dengan salah satu dari dua metode, yairu keragaman bobot atau keragaman kandungan. Persyaratan keragaman bobot dapat diterapkan pada produk yang mengandung zat aktif berkisar 50 mg atau lebih yang merupakan 50% atau lebih dari bobot satuan sediaan.
Keseragaman dari zat aktif lain, jika dalam jumlah lebih kecil, ditetapkan dengan persyaratan keseragaman kandungan. Untuk penetapan sediaan dipih tidak kurang dari 30 satuan (Ditjen POM, 1995)
UIN Syarif Hidayatullah Jakarta 2.4.6 Disolusi
Disolusi atau pelarutan didefinisikan sebagai proses melarutnya suatu obat dari sediaan padat dalam medium tertentu (Wagner, 1971).
Gambar 2.2 Disolusi Obat dari Suatu Padatan Matriks (Martin, et al, 1993)
Selain itu disolusi juga dikatakan sebagai hilangnya kohesi suatu padatan karena aksi dari cairan yang menghasilkan suatu dispersi homogen bentuk ion (dispersi molekuler) sedangkan kecepatan pelarutan atau laju pelarutan adalah kecepatan melarutnya zat kimia atau senyawa obat ke dalam medium tertentu dari suatu padatan (Martin et. al,, 1993; Wagner, 1971). Proses disolusi obat dari suatu matrik ditunjukkan pada Gambar 2.2. Secara keseluruhan kecepatan disolusi dapat digambarkan oleh persamaan Noyes-Whitney :
dM/dt = (D S / h) (Cs - Cb) ... (2.1)
Keterangan :
dM/dt : Laju pelarutan obat pada waktu t
M : Jumlah massa terlarut (mg atau mmol) terhadap t waktu (detik)
D : Koefiesien laju disolusi (cm2/s) S : Luas permukaan partikel (cm2)
h : Ketebalan dari lapisan film cair (stagment layer) yang terbentuk
Cs : Konsentrasi obat (sama dengan kelarutan obat) dalam
stagment layer)
UIN Syarif Hidayatullah Jakarta yang mirip dengan hukum difusi Fick (Shargel, et al, 2 005). Hukum difusi Fick secara matematik dinyatakan sebagai berikut:
dM/dt = DSCs / h ... (2.2)
Persamaan Noyes-Whitney memperlihatkan bahwa pelarutan dalam labu dapat dipengaruhi oleh sifat fisikokimia obat, formulasi dan pelarut. Obat dalam tubuh, terutama dalam saluran cerna
dianggap mealrut dalam suatu lingkungan “aqueous”. Penetrasi obat melintasi dinding usus dipangaruhi oleh kemampuan obat berdifusi (D) dan partisi antar membran lipid. Suatu koefisien partisi yang mendukung (Kminyak/air) akan memindahkan absorpsi obat. Faktor-faktor yang mempengaruhi disolusi obat dari suatu bentuk sediaan oral padat meliputi (Shargel, Wu-Pong & Yu, 2005):
(1) Sifat fisika dan Kimia bahan obat aktif
Sifat-sifat fisikokimia obat yang mempengaruhi laju disolusi meliputi : kelarutan zat aktif, bentuk kristal, kompleksasi serta ukuran partikel. Sifat fisikokimia lain seperti kekentalan dapat menimbulkan masalah disolusi. (2) Sifat bahan tambahan
UIN Syarif Hidayatullah Jakarta pencetakan dihasilkan tablet dengan waktu hancur dan disolusi yang lama. Faktor formulasi yang mempengaruhi laju disolusi diantaranya : kecepatan disintegrasi, interaksi obat dengan eksipien (bahan tambahan) dan kekerasan. (3) Metode fabrikasi
Dari studi biofarmasetik memberi fakta yang kuat bahwa metode fabrikasi dan formulasi dengan nyata mempengaruhi kualitas dan bioavailabilitas obat tersebut. Sifat ruah (curah) serbuk farmasetis termasuk ukuran partikel, kerapatan, aliran, wettability, dan luas permukaan. Beberapa sifat tersebut penting dari pandangan proses pabrikasi (manufaktur), misalnya kerapatan dan aliran, sedangkan sifat lainnya dapat berpengaruh kuat pada laju disolusi produk obat (ukuran partikel, wettability, dan luas permukaan).
UIN Syarif Hidayatullah Jakarta Dari jenis alat, ada dua tipe alat uji disolusi sesuai dengan yang tertera dalam masing-masing monografi:
a) Alat 1 (Tipe Keranjang).
Alat terdiri dari wadah bertutup yang terbuat dari kaca, suatu batang logam yang digerakkan oleh motor dan wadah disolusi (keranjang) berbentuk silinder dengan dasar setengah
bola, tinggi 160 mm−175 mm, diameter 98 mm−106 mm dan
kapasitas nominal 1000 ml. Batang logam berada pada posisi sedemikian sehingga sumbunya tidak lebih dari 2 mm pada setiap titik dari sumbu vertikal wadah dan berputar dengan halus dan tanpa goyangan. Sebuah tablet diletakkan dalam keranjang saringan kawat kecil yang diikatkan pada bagian bawah batang logam yang digerakkan oleh motor yang kecepatannya dapat diatur. Wadah dicelupkan sebagian di dalam suatu tangas air yang sesuai sehingga dapat mempertahankan suhu dalam wadah pada ± C selama pengujian dan menjaga agar gerakan air halus dan tetap. Pada bagian atas wadah ujungnya melebar, untuk mencegah penguapan digunakan suatu penutup yang pas.
b) Alat 2 (Tipe Dayung).
UIN Syarif Hidayatullah Jakarta 2.5 Spektrofotometer UV-Visible
2.5.1 Teori Spektrofotometri
Spektrofotometri UV-Vis adalah pengukuran panjang gelombang dan intensitas sinar ultraviolet dan cahaya tampak yang diabsorbsi oleh sampel. Sinar ultraviolet dan cahaya tampak memiliki energi yang cukup untuk mempromosikan elektron pada kulit terluar ke tingkat energi yang lebih tinggi.
Spektrum UV-Vis mempunyai bentuk yang lebar dan hanya sedikit informasi tentang struktur yang bisa didapatkan dari spektrum ini. Tetapi spektrum ini sangat berguna untuk pengukuran secara kuantitatif. Konsentrasi dari analit di dalam larutan bisa ditentukan dengan mengukur absorban pada panjang gelombang tertentu dengan menggunakan hukum Lambert-Beer (Dachriyanus, 2004).
Sinar ultraviolet mempunyai panjang gelombang antara 200-400 nm, sementara sinar tampak mempunyai panjang gelombang 400-800 nm (Dachriyanus, 2004).
Ada beberapa hal yang harus diperhatikan dalam analisis dengan spektrofotometri ultraviolet yaitu:
1. Penentuan panjang gelombang serapan maksimum
Panjang gelombang yang digunakn untuk analisis kuantitatif adalah panjang gelombang dimana terjadi absorbansi maksimum. Untuk memperoleh panjang gelombang serapan maksimum dapat diperoleh dengan membuat kurva hubungan antara absorbansi dengan panjang gelombang dari suatu larutan baku dengan konsentrasi tertentu. Ada beberapa alasan mengapa harus menggunakan panjang gelombang maksimum, yaitu :
UIN Syarif Hidayatullah Jakarta b. Di sekitar panjang gelombang maksimal, bentuk kurva
absorbansi datar dan pada kondisi tersebut hukum Lamber-Beer akan terpenuhi
c. Jika dilakukan pengukuran ulang maka kesalahan yang disebabkan oleh pemasangan ulang panjang gelombang akan kecil sekali, ketika digunakan panjang gelombang maksimal.
2. Pembuatan kurva kalibrasi
Dilakukan dengan membuat seri larutan baku dalam berbagai konsentrasi kemudian asorbansi tiap konsentrasi di ukur lalu dibuat kurva yang merupakan hubungan antara absorbansi dengan konsentrasi. Kurva kalibrasi yang lurus menandakan bahwa kriteria regresi linier terpenuhi.
3. Pembacaan absorbansi sampel
Absorbansi yang terbaca pada spektrofotometer hendaknya antara 0,2 sampai 0,8. Anjuran ini berdasarkan anggapan bahwa kesalahan dalam pembacaan T adalah 0,005 atau 0,5 %. Hal ini disebabkan karena pada kisaran nilai absorbansi tersebut kesalahan fotometrik yang terjadi adalah paling minimal. (Rohman dan Sudjaji, 2007)
2.5.2 Komponen Spektrofotometri UV-Visible
Untuk mendapatkan hasil pengukuran yang optimum, setiap komponen dari instrumen yang dipakai harus berfungsi dengan baik. Komponen-komponen spektrofotometri UV-Vis meliputi sumber sinar, monokromator, dan sistem optik.
a. Sebagai sumber sinar; lampu deuterium atau lampu hidrogen untuk pengukuran UV dan lampu tungsten digunakan untuk daerah visibel.
UIN Syarif Hidayatullah Jakarta dilewatkan pada sampel sebagai scan instrumen melewati spektrum.
c. Optik-optik; dapat didesain untuk memecah sumber sinar sehingga sumber sinar melewati 2 kompartemen, dan sebagai mana dalam spektrofotometer berkas ganda (double beam), suatu larutan blanko dapat digunakan dalam satu kompartemen untuk mengkoreksi pembacaan atau spektrum sampel. Yang paling sering digunakan sebagai blanko dalam spektrofotometri adalah semua pelarut yang digunakan untuk melarutkan sampel atau pereaksi (Rohman, 2007).
2.5.3 Analisa Kualitatif
Spektrofotometer UV-Vis digunakan terutama untuk analisa kuantitatif, tetapi dapat juga digunakan untuik analisa kualitatif. Untuk analisis kualitatif yang diamati adalah (Hardjono, 1985) :
a. Membandingkan λ (panjang gelombang) maksimum b. Membandingkan serapan ( A ) , daya serap ( a ) c. Membandingkan bentuk spektrum serapannya.
2.5.4 Analisis Kuantitatif
Analisis kuantitatif spektrofotometri dapat dilakukan dengan dua metode yaitu:
1. Metode Regresi
UIN Syarif Hidayatullah Jakarta kalibrasi. Konsentrasi suatu sampel dapat dihitung berdasarkan kurva tersebut.
2. Metode Pendekatan
Analisis kuantitatif dengan cara ini dilakukan dengan membandingkan serapan standar yang konsentrasinya diketahui dengan serapan sampel.
Konsentrasi sampel dapat dihitung melalui rumus perbandingan
Hukum Lambert-Beer (Beer’s law) adalah hubungan linearitas antara absorban dengan konsentrasi larutan analit (Dachriyanus, 2004). Menurut hukum Lambert, serapan (A) berbanding lurus dengan ketebalan lapisan (b) yang disinari :
A= k. b
Dengan bertambahnya ketebalan lapisan, serapan akan bertambah. Menurut Hukum Beer, yang hanya berlaku untuk cahaya monokromatis dan larutan yang sangat encer, serapan (A) dan konsentrasi (c) adalah proporsional:
A= k. c
Jika konsentrasi bertambah, jumlah molekul yang dilalui berkas sinar akan bertambah, sehingga serapan juga bertambah.
UIN Syarif Hidayatullah Jakarta A= k . c. B
Umumnya digunakan dua satuan c (konsenterasi zat yang menyerap) yang berlainan, yaitu gram per liter atau mol per liter. Nilai tetapan (K ) dalam hukum Lambert-Beer tergantung pada sistem konsentrasi mana yang digunakan. Bila c dalam gram perliter, tetapan tersebut disebut dengan absorptivitas (a) dan bila dalam mol per liter tetapan tersebut adalah absorbtivitas molar (∈ ). Jadi dalam sistem yang direkombinasikan, Hukum Lambert-Beer dapat mempunyai dua bentuk: A= a. b. c g/liter atau A= ∈. b. c mol/liter ... (2.3) Keterangan : A = Serapan (tanpa dimensi)
a = absorptivitas (g-1 cm-1) b = ketebalan sel (cm) C = konsentrasi (g.I-1) ∈ = absorptivitas (M-1 cm-1)
Penandaan lain untuk a adalah ekstingsi spesifik, koefisien ekstingsi, dan absorbsi spesifik, sedangkan ∈ adalah koefisien ekstingsi molar (Day and Underwood, 1999).
Jadi, dengan Hukum Lambert-Beer konsentrasi dapat dihitung dari ketebalan sel serapan. Absorptivitas merupakan suatu tetapan dan spesifik untuk setiap molekul pada panjang gelombang dan pelarut tertentu.
Menurut Roth dan Blaschke (1981), absorptivitas spesifik juga sering digunakan sebagai ganti absorptivitas. Harga ini memberikan serapan larutan 1% (b/v) dengan ketebalan sel 1 cm, sehingga diperoleh persamaan :
A = A| . b. C ... (2.4) Keterangan : A| = absorptivitas spesifik (ml g-1 cm-1)
b = ketebalan sel (cm)
23
3.1 Lokasi dan Waktu Pelaksanaan Penelitian
Penelitian dilaksanakan di Labolatorium Formulasi Sediaan Padat dan Labolatorium Penelitian II Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta. Waktu yang diperlukan untuk penelitian ini terhitung sejak bulan April 2016 hingga Mei 2016.
3.2 Alat
Peralatan yang digunakan dalam penelitian ini meliputi seperangkat alat disolusi (Erweka), termometer (Erweka), pH-meter (Horiba), timbangan analitik (Kern), magnetic stirer (Nouvo stirer), micropipet (Bio Rad), spuit injeksi 10 mL (Terumo), syringe filter (Sartorius), seperangkat alat Spektrofotometer UV-Visible (Hitachi), Hardness tester (Erweka), dan alat-alat gelas skala labolatorium.
3.3 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah Baku standar simvastatin (PT. Kimia Farma), tablet simvastatin e-catalogue BPJS yaitu tablet Simvastatin generik A dan simvastatin generik B, serta dua merk tablet Simvastatin non e-catalogue BPJS yaitu merek X dan merek Y, serta aquades, Sodium dihidrogen fosfat (Merck), sodium hidroksida (Merck), Sodium lauril sulfat (Merck) dan metanol (Merck).
3.4 Prosedur Penelitian
3.4.1 Pemilihan Sampel
UIN Syarif Hidayatullah Jakarta Purposive Sampling. Dari setiap subpopulasi dipilih merek yang paling sering digunakan dan diresepkan (Sugiyono, 2007), kemudian diambil sebanyak 25% dari masing-masing subpopulasi (Balai POM, 2014)..
3.4.2 Parameter Evaluasi Tablet
3.4.2.1 Kekerasan Tablet
Diambil sampel obat yang akan diteliti masing-masing tablet sebanyak 10 tablet kemudian diuji kekerasannya menggunakan alat Hardness tester (Ditjen POM, 1995).
3.4.2.2 Uji Waktu Hancur
Diambil sampel obat yang akan diteliti masing-masing tablet sebanyak 6 tablet kemudian diuji waktu hancurnya menggunakan alat Disintegrasi Tester. Uji waktu hancur dilakukan dengan menghitung waktu hancur masing-masing 6 tablet dari masing-masing sampel dalam medium aquades sebanyak 900 mL dengan suhu ± 370 C selama 15 menit (Ditjen POM, 1995).
3.4.3 Penentuan Panjang Gelombang Simvastatin
Penentuan panjang gelombang maksimum simvastatin dilakukan dengan menggunakan membuat larutan induk 1000 μg/ml Simvastatin dengan melarutkan 100 mg sampel simvastatin dalam pelarut metanol sampai tanda batas labu ukur 100 mL (Asha Jyothi, dkk, 2013). Larutan ini selanjutnya disebut sebagai larutan induk.
Kemudian dari larutan induk ini, dibuat larutan 100 ppm dengan mengambil 10 mL dan diencerkan dengan pelarut metanol hingga 100 mL. Dari larutan 100 ppm lalu dibuat larutan 10 ppm dengan mengambil 1 mL diencerkan dengan pelarut metanol hingga 10 mL.
UIN Syarif Hidayatullah Jakarta 3.4.4 Pembuatan Kurva Kalibrasi
Dari larutan induk 1000 µg/mL yang telah dibuat pada metode kerja sebelumnya pada poin 3.4.3 kemudian dibuat larutan simvastatin 100 µg/mL dengan memipet 1 mL dari larutan induk lalu diencerkan dalam labu ukur 10 mL dan ditambahkan dengan metanol hingga tanda batas. (Asha Jyothi, dkk, 2013),
Kurva kalibrasi dibuat dengan larutan simvastatin dengan seri konsentrasi 2, 4, 6, 8, 10, dan 12 µg/ml yang dibuat dari larutan simvastatin 100 µg/mL kemudian diencerkan dengan metanol, yakni dari larutan induk 100 µg/mL simvastatin dipipet 0,2; 0,4; 0,6; 0,8; 1,0 ; 1,2 ml dan masing-masing dimasukkan ke dalam labu ukur 10 ml lalu dicukupkan dengan metanol sampai garis tanda sehingga diperoleh konsentrasi 2,0; 4,0; 6,0; 8,0; 10 dan 12 µg/mL.
Masing-masing larutan diukur serapannya dengan spektrofotometer UV-Visible pada panjang gelombang 238,5 nm, kemudian dibuat kurva regresi linear antara kadar simvastatin dan serapannya sehingga diperoleh persamaan regresi linear y = a + bx (Mariyam, R, 2011, telah dioleh kembali).
3.4.5 Penetapan Kadar Tablet Simvastatin
Uji penetapan kadar tablet Simvastatin dilakukan menggunakan alat Spektrofotometer UV-Visible dengan pelarut metanol.
UIN Syarif Hidayatullah Jakarta Simvastatin (± 10 ppm). Serapan larutan diukur dengan Spektrofotometer UV-Visible dengan panjang gelombang 238,5 nm (K. Naga Raju, 2012).
Kemudian hasil serapan dihitung kadarnya dengan menggunakan persamaan regresi linear yang telah didapatkan pada pembuatan kurva kalibrasi. Tiap simvastatin tablet mengandung tidak kurang dari 90,0 % dan tidak lebih dari 110,0 % dari Jumlah Simvastatin anhidrat yang tertera pada etiket (USP XXXII, NF 27, 2010)
3.4.6 Keseragaman Kandungan
Sebanyak 10 tablet Simvastatin ditetapkan kadarnya satu per satu dengan menggunakan prosedur penetapan kadar.
Persyaratan keseragaman sediaan dipenuhi, jika jumlah zat aktif 10 satuan sediaan seperti yang ditetapkan dari cara keragaman bobot atau dalam keseragaman kandungan terletak antara 85,0 % hingga 115,0 % yang tertera pada etiket dan simpangan baku relatif kurang dari atau sama dengan 6% atau jika kedua kondisi tidak dipenuhi, uji 20 satuan tambahan dilakukan. Persyaratan dipenuhi jika tidak lebih dari 1 satuan dari 30 terletak di luar rentang 75% hingga 125% dari yang tertera pada etiket dan simpangan baku relatif dari 7,8% (Ditjen POM, 1995).
3.4.7 Uji Laju Disolusi Tablet Simvastatin
Uji disolusi tablet Simvastatin dilakukan sesuai cara yang tercantum dalam The United States of Pharmacopeia XXXII (USP XXXII) berdasarkan uji 1, karena di dalam Farmakope Indonesia edisi IV belum tercantum prosedur uji disolusi tablet Simvastatin. Uji Disolusi tes 1 dilakukan menggunaan alat uji disolusi tipe 2 (tipe dayung) pada suhu 370 ± 0,50 C dengan kecepatan 50 rpm selama 60 menit. Uji disolusi dilakukan pada medium 900 mL larutan buffer fosfat pH 7,0.
UIN Syarif Hidayatullah Jakarta 6000 ml aquades dan pH diatur sampai 7,0 dengan 10% w/v NaOH (USP XXXII, NF 27, 2010)
Proses pengambilan cuplikan sampel dilakukan pada menit ke 5, 10, 15, 30, 45, dan 60 sebanyak 10 ml dengan menggunakan spuit yang telah dikalibrasi sebelumnya. Setelah pencuplikan sampel dilakukan penggantian medium disolusi, yaitu degnan menambahkan 10 mL medium disolusi ke dalam wadah disolusi. Sampel yang telah dicuplik disaring dengan memasang membran filter berukuran 0,45 µm ke spuit, sebanyak ±1 ml sampel awal dibuang dan sisanya ditampung di dalam tabung reaksi yang bersih (Sakina, 2013).
Masing-masing cuplikan kemudian diukur serapannya dengan Spektrofotometer UV-Visible pada panjang gelombang 238,8 nm.
3.4.8 Analisis Statistik
28 4.1 Pengambilan Sampel
Sampel yang digunakan dalam penelitian ini yaitu sediaan simvastatin tablet e-catalogue BPJS dan non e-catalogue BPJS. Metode pengambilan sampel yang digunakan adalah Purposive Sampling. Teknis Pengertian Purposive Sampling adalah teknik penentuan sampel dengan pertimbangan tertentu. Sampel digunakan untuk penelitian kualitatif atau penelitian yang tidak melakukan generalisasi (Sugiyono, 2007). Dari setiap subpopulasi dipilih merek yang paling sering digunakan dan diresepkan, informasi ini didapatkan dengan melakukan survei di 20 Apotek yang ada di Jakarta Timur. Sampel yang diperoleh dari beberapa apotek dikarenakan ketersediaan jenis merek di setiap apotek dengan mengambil sebanyak 25% dari masing-masing subpopulasi (Balai POM, 2014). Dari tablet e-catalogue BPJS terdapat 5 merek, sehingga 25% dari subpopulasi tablet e-catalogue diambil 2 merek, sementara untuk tablet non e-catalogue BPJS terdapat 8 merek, sehingga 25% dari subpopulasi tablet non e-catalogue BPJS diambil 2 merek.
Pada uji ini memilih simvastatin tablet generik A serta tablet generik B sebagai tablet catalogue dan merek X serta merek Y sebagai obat non e-catalogue BPJS yang masing-masing terkandung zat aktif simvastatin 10
UIN Syarif Hidayatullah Jakarta 4.2 Evaluasi Fisik Tablet
4.2.1 Kekerasan Tablet
Uji kekerasan tablet bertujuan untuk memperoleh gambaran tetang ketahanan tablet melawan tekanan mekanik (guncangan), tekanan pada saat pengemasan, distribusi, dan penyimpanan. Dilakukan pengujian terhadap 10 tablet dari masing-masing sampel (Ditjen POM, 1995). Alat yang digunakan pada pengujian ini adalah Hardness tester (ERWEKA) dengan unit kP (kilopound). Dan didapatkan hasil pada Tabel 4.1 yang telah di konversikan menjadi satuan kg dan data hasil uji kekerasan tablet terdapat pada Lampiran 4.
Tabel 4.1 Hasil Uji Kekerasan Tablet (Hardness Tester) Kekerasan (kg)
Tablet e-catalogue BPJS Non e-catalogue BPJS Generik A Generik B Merek X Merek Y
Rata-rata 6,18 ± 7,641 11,55 ± 9,606 8,01 ± 5,065 11,05 ± 13,71
UIN Syarif Hidayatullah Jakarta Pada umumnya tablet yang baik dinyatakan mempunyai kekerasan antara 4 - 8 kg (Parrot, 1971). Namun hal ini tidak mutlak, artinya kekerasan tablet dapat lebih kecil dari 4 atau lebih tinggi dari 8 kg. Kekerasan tablet kurang dari 4 kg masih dapat diterima dengan syarat kerapuhannya tidak melebihi batas yang diterapkan. Tetapi biasanya tablet yang tidak keras akan memiliki kerapuhan yang tinggi dan lebih sulit penanganannya pada saat pengemasan, dan transportasi. Kekerasan tablet lebih besar dari 10 kg masih dapat diterima, jika masih memenuhi persyaratan waktu hancur (disintegrasi) dan disolusi yang dipersyaratkan (Rhoihana, 2008).
4.2.2 Waktu Hancur
Uji waktu hancur dilakukan bertujuan untuk mengetetahui waktu yang dibutuhkan untuk hancurnya tablet menjadi partikel-partikel penyusunnya bila kontak dengan cairan. Waktu hancur tablet juga menggambarkan cepat lambatnya tablet hancur dalam cairan pencernaan. Dilakukan pengujian terhadap masing-masing enam tablet dari masing-masing sampel, pada medium akuades suhu ± 370 C (Ditjen POM, 1995). Hasil yang diperoleh tertera pada tabel 4.2 dan data hasil uji waktu hancur terdapat pada Lampiran 5.
Tabel 4.2 Hasil Uji Waktu Hancur (Disintegration Tester)
Waktu (Detik)
Tablet
e-catalogue BPJS Non e-catalogue BPJS
Generik A Generik B Merek X Merek Y
Rerata 47,17 ± 8,99 322,50 ± 10,67 55,17 ± 2,64 60,33 ± 2,73
UIN Syarif Hidayatullah Jakarta tablet. Waktu hancur adalah waktu yang dibutuhkan sejumlah tablet untuk hancur menjadi granul/partikel penyusunnya yang mampu melewati ayakan No.10 yang terdapat di bagian bawah alat uji. Alat yang digunakan adalah disintegration tester (ERWEKA), yang berbentuk keranjang, mempunyai 6 tube plastik yang terbuka di bagian atas, sementara di bagian bawah dilapisi dengan ayakan/screen No. 10 mesh.
Faktor-faktor yang mempengaruhi waktu hancur suatu sediaan tablet yaitu sifat fisik granul, kekerasan, porositas tablet, dan daya serap granul. Penambahan tekanan pada waktu pembuatan tablet menyebabkan penurunan porositas dan menaikkan kekerasan tablet. Dengan bertambahnya kekerasan tablet akan menghambat penetrasi cairan ke dalam pori-pori tablet sehingga memperpanjang waktu hancur tablet. Tablet simvastatin e-catalogue BPJS dan non e-catalogue BPJS yang telah diuji dalam penelitian ini telah memenuhi persyaratan untuk waktu hancur tablet, sedangkan untuk uji kekerasan terdapat beberapa tablet yang melebihi rentang persyaratan yang telah ditetapkan. Tablet yang tidak memenuhi persyaratan uji kekerasan masih dapat diterima apabila tablet tersebut memenuhi persyaratan uji waktu hancur dan uji disolusi (Yos Banne, et. al,, 2013)
4.3 Penentuan Panjang Gelombang Maksimum Simvastatin
Penentuan panjang gelombang maksimum simvastatin dilakukan dalam pelarut metanol. Pengukuran panjang gelombang dilakukan dengan cara scanning pada panjang gelombang 200-400 nm. Di antara rentang panjang gelombang tersebut dicari panjang gelombang dengan absorbansi yang paling hinggi.
UIN Syarif Hidayatullah Jakarta
Simvastatin pada pelarut metanol memiliki panjang gelombang 238 nm menurut USP XXXII tahun 2010. Berdasarkan hasil pengukuran yang diperoleh, panjang gelombang simvastatin mengalami pergeseran batokromik, yaitu pergeseran panjang gelombang ke arah lebih besar. Pergeseran panjang gelombang dapat terjadi karena adanya pengaruh dari pelarut dan pH pelarut, di mana pelarut sering memberikan pengaruh yang besar pada kualitas dan bentuk dari spektrum (Moffat, et. al, 2005)
4.4 Penentuan Kurva Kalibrasi
Kurva kalibrasi digunakan untuk penetapan kadar tablet simvastatin, yang kadarnya dapat dihitung melalui persamaan regresi liner. Kurva kalibrasi standar simvastatin dibuat menggunakan pelarut metanol yang kemudian diencerkan kembali menggunakan pelarut aquades. Dari pembuatan kurva kalibrasi simvastatin diperoleh persamaan regresi linier y = a + bx dan koefisien korelasi (r), di mana y menggambarkan absorbansi dan x menggambarkan konsentrasi. Persamaan regresi linier simvastatin adalah y = 0,06x + 0,0036 sedangkan data kurva kalibrasi yang lebih lengkap dapat dilihat pada Gambar 4.1
UIN Syarif Hidayatullah Jakarta Persamaan regresi linier tersebut kemudian digunakan untuk menetapkan kadar simvastatin dalam sampel. Berdasarkan data menunjukkan bahwa kurva kalibrasi simvastatin tersebut memiliki koefisien korelasi (r) yang memenuhi syarat linearitas yaitu r ≥ 0,999 (Snyder, Kirkland dan Glajch, 1997).
Pada kurva kalibrasi uji disolusi didapatkan persamaan regresi linier y = 0,0555x + 0,0124 sedangkan data kurva kalibrasi yang lebih lengkap dapat dilihat pada Gambar 4.2.
Gambar 4.2 Kurva Kalibrasi Standar Simvastatin dalam Dapar Fosfat pH 7,0
Persamaan regresi linier tersebut kemudian digunakan untuk menetapkan kadar simvastatin dalam pengujian disolusi tablet. Berdasarkan data menunjukkan bahwa kurva kalibrasi simvastatin tersebut memiliki
koefisien korelasi (r) yang memenuhi syarat linearitas yaitu r ≥ 0,999
(Snyder, Kirkland dan Glajch, 1997).
4.5 Penetapan Kadar Tablet Simvastatin
UIN Syarif Hidayatullah Jakarta Penetapan kadar dilakukan menggunakan spektrofotometer UV-Visible (Hitachi) dalam pelarut metanol. Penetapan kadar simvastatin dapat dilakukan dengan spektrofotometri karena memiliki gugus kromofor yang berupa ikatan rangkap terkonjugasi dan gugus auksokrom. Penggunaan pelarut metanol karena simvastatin mudah larut dalam metanol, selain itu juga didukung oleh literatur USP (United States Pharmacopeia) XXXII tahun 2010 yang menggunakan metanol sebagai
pelarut untuk penetapan kadar simvastatin. Hasil penetapan kadar obat tertera pada Tabel 4.3 dan data hasil uji penetapan kadar terdapat pada Lampiran 12.
Tabel 4.3 Hasil Uji Penetapan Kadar Tablet Simvastatin
Tablet
e-catalogue BPJS Non e-catalogue BPJS
Generik A Generik B Merek X Merek Y
Kadar (%)
95,06 87,23 96,90 95,40
94,23 88,56 95,90 94,06
Rerata (%) 94,65 87,90 96,40 94,73
SD (%) 0,589 0,942 0,707 0.942
RSD (%) 0,622 1,072 0,733 0,995
UIN Syarif Hidayatullah Jakarta sesuai dengan persyaratan maka dapat mempengaruhi jumlah kumulatif kadar terdisolusinya dan juga berdampak pada khasiat maupun farmakokinetik obat tersebut.
4.6 Keseragaman Kandungan
Keseragaman sediaan merupakan salah satu uji yang dipersyaratkan untuk suatu sediaan yang mengandung satu zat aktif dan sediaan mengandung dua atau lebih zat aktif. Keseragaman dapat ditetapkan dengan salah satu dari dua metode yaitu keragaman bobot atau keseragaman kandungan (Ditjen POM, 1995). Hal ini bertujuan untuk memastikan bahwa kandungan zat aktif pada sampel obat seragam. Pada penelitian ini, pengujian keseragaman sediaan yang dilakukan hanya keseragaman kandungan karena zat aktif yang terkadung dalam sediaan kurang dari 50 mg yaitu 10 mg. Sementara untuk keragaman bobot dilakukan apabila produk obat mengandung zat aktif berkisar 50 mg atau lebih (Ditjen POM, 1995).
Hasil uji keseragaman kandungan dapat dilihat pada Tabel 4.4 dan data selengkapnya dapat dilihat pada Lampiran 14, 15, 16, dan 17.
Tabel 4.4 Hasil Uji Keseragaman Kandungan
Tablet
Kandungan (%)
Simvastatin e-catalogue BPJS Simvastatin Non e-catalogue BPJS
Generik A Generik B Merek X Merek Y
Rerata (%) 93,31 91,78 101,75 94,38
SD (%) 4,276 3,463 2,280 2,512
RSD (%) 4,583 3,773 2,241 2,661
UIN Syarif Hidayatullah Jakarta Berdasarkan hasil uji keseragaman kandungan untuk simvastatin persyaratan dipenuhi jika mengandung simvastatin tidak kurang dari 85,0% dan tidak lebih dari 115,0% dari kadar yang tertera pada etiket dan simpangan baku relatifnya kurang dari sama dengan 6,0%. Dengan demikian semua merek uji telah memenuhi persyaratan keseragaman kandungan.
4.7 Uji Disolusi Tablet simvastatin
Penelitian ini bertujuan untuk membandingkan profil disolusi tablet simvastatin e-catalogue BPJS dan non e-catalogue BPJS sehingga dapat diketahui apakah profil disolusi sediaan tersebut memiliki persamaan dan telah sesuai dengan syarat yang ditentukan oleh USP XXXII dan melalui profil disolusi juga dapat diketahui mekanisme pelepasannya. Uji disolusi in vitro merupakan uji yang digunakan untuk mengetahui profil pelepasan obat yang dapat menggambarkan profil farmakokinetika obat dalam tubuh (Lachman, 1994), di mana laju pelepasan obat dalam cairan saluran cerna merupakan salah satu tahapan penentu (rate limiting step) absorpsi sistemik obat (Sutriyo, et. al,, 2005)
Uji disolusi dilakukan berdasarkan metode yang ditetapkan USP XXXII yaitu metode uji disolusi tes satu, yakni menggunakan alat disolusi tipe 2 (tipe dayung), sementara medium disolusi ialah cairan usus tiruan (dapar fosfat di adjust NaOH hingga pH 7,0) sebanyak 900 mL beserta surfaktan Natrium Lauril Sulfat yang bertujuan untuk membantu meningkatkan kelarutan simvastatin dengan menurunkan tegangan permukaan zat aktif sebab simvastatin termasuk dalam kategori BCS (Biopharmaceutical Classification Systems) kelas II, yaitu zat yang memiliki tingkat kelarutan
rendah namun tingkat permeabilitas tinggi. Selain medium yang digunakan menggambarkan fisiologis saluran cerna, sifat medium disolusi juga merupakan salah satu faktor yang dipertimbangkan dalam uji disolusi. Media yang digunakan tergantung sifat zat aktif obat dan lokasi di dalam saluran cerna di mana diperkirakan obat akan melarut.
UIN Syarif Hidayatullah Jakarta dieksresikan melalui empedu dan sisanya (5 - 20%) dieksresikan melalui urin (Katzung, 2009). Ileum atau usus penyerapan adalah bagian akhir dari usus kecil. Bagian ini memanjang dari jejunum, bagian tengah dari usus kecil, ke pangkal usus besar. Ileum memiliki pH antara 7 dan 8 (netral atau sedikit basa). Ileum melakukan beberapa fungsi penting yaitu menyerap kembali garam empedu dan membantu mempertahankan tingkat garam empedu bagi pencernaan dan penyerapan lemak di usus kecil (Haris, 1995). Empedu berperan penting dalam pelarutan simvastatin, karena struktur kimia empedu memberikan dua fungsi berbeda yaitu salah satu ujung dari molekul empedu menarik air dan ujung lainnya menolak air. Hal ini memberikan empedu kemampuan untuk bertindak sebagai deterjen yang memecah lemak menjadi molekul yang lebih kecil sehingga mudah dicerna oleh enzim lipase (Champbell, 2004). Oleh sebab itu, penggunaan natrium lauril sulfat sebagai detergen dapat digunakan untuk menggambarkan fisiologis saluran cerna. Penggunaan natrium lauril sulfat juga merupakan rujukan oleh literatur USP XXXII.
UIN Syarif Hidayatullah Jakarta Gambar 4.3 Profil Disolusi Simvastatin Empat Merek Obat
Hasil presentase pelepasan kumulatif simvastatin dapat dilihat pada tabel dibawah ini dan data selengkapnya dapat dilihat pada Lampiran 19.
Tabel 4.5 Data Persentase Kumulatif Pelepasan Simvastatin
Rata-rata kadar (%) simvastatin terdisolusi
Menit ke- e-catalogue BPJS Non e-catalogue BPJS
Generik A Generik B Merek X Merek Y
5 100,04 ± 5,32 22,55 ± 13,33 55,6 ± 5,19 57,36 ± 4,59
10 121,01 ± 3,78 72,50 ± 2,07 89,07 ± 2,89 90,12 ± 2,06
15 117,04 ± 4,94 88,58 ± 3,66 113,47 ± 2,90 101,42 ± 1,88
30 119,50 ± 5,06 102,66 ± 2,35 122,34 ± 2,73 116,88 ± 2,32
45 118,3 ± 2,68 96,28 ± 1,51 117,8 ± 3,63 113,25 ± 1,93
60 115,82 ± 2,67 89,99 ± 2,00 113,88 ± 2,52 106,55 ± 4,16
Keterangan : Nilai ± merupakan nilai SD dari masing-masing 6 tablet uji
UIN Syarif Hidayatullah Jakarta kadarnya dibandingkan dengan ketiga merek yang lain, sementara untuk simvastatin generik A dari awal menit kadarnya sudah terlampau tinggi. Sedangkan untuk simvastatin non e-catalogue BPJS profil disolusinya terlihat hampir setara untuk merek X dan Y keduanya terlihat berhimpitan.
Pada simvastatin generik B laju disolusinya lebih kecil dibandingkan dengan ketiga simvastatin lainnya, hal ini disebabkan oleh faktor pengikat dan disintegran, di mana bahan pengikat dan disintegran mempengaruhi kekuatan ikatan partikel-partikel dalam tablet tersebut sehingga mempengaruhi kemudahan cairan untuk masuk berpenetrasi ke dalam lapisan difusi tablet menembus ikatan-ikatan dalam tablet tersebut. Dalam hal ini pemilihan bahan pengikat dan disintegran dan bobot dari penggunaan bahan pengikat dan disintegran sangat berpengaruh terhadap laju disolusi. Selain itu penyebab lain yang mungkin adalah formulasi dari sediaan tablet yang kurang baik. Faktor formulasi yang mempengaruhi laju disolusi di antaranya kecepatan disintegrasi, interaksi obat dengan eksipien (bahan tambahan) dan kekerasan. Dapat terlihat pada Tabel 4.1 untuk uji kekerasan tablet generik B memiliki nilai rata-rata terbesar dibandingkan ketiga tablet simvastatin yang lain, sehingga faktor formulasi berkaitan erat dengan laju disolusi dari sebuat tablet. Selain itu, pada pengujian waktu hancur, tablet simvastatin generik B memiliki waktu hancur yang paling lama dan waktu hancur tablet terletak pada menit ke-5, sedangkan tablet simvastatin lainnya memeiliki waktu hancur kurang dari 5 menit, sehingga waktu hancur tablet simvastatin generik B yang terlampau lebih lama juga mempengaruhi laju disolusinya.
UIN Syarif Hidayatullah Jakarta partikel-partikel dan tebal lapisan difusi sehingga memperluas permukaan partikel yang kontak dengan pelarut. Oleh sebab itu, memberikan hasil yang fluktuatif di setiap menit pengambilan cuplikan.
Sementara pada simvastatin tablet non e-catalogue BPJS yakni merek X dan merek Y terlihat berhimpitan laju disolusinya meskipun pada pengujian kekerasan tablet dan pengujian waktu hancur keduanya memiliki hasil yang berbeda yakni untuk waktu hancur merek X lebih cepat dibandingkan merek Y, begitu juga pada uji kekerasan, Merek X lebih mudah hancur dibandingkan Merek Y tetapi pada laju disolusinya memberikan pelepasan obat yang tidak berbeda signifikan. Hal ini dapat dipengaruhi oleh faktor formulasi yang meskipun terdiri dari bahan pengikat dan tambahan yang berbeda-beda namun memberikan pelepasan atau laju disolusi yang terlihat sama. Pelepasan zat aktif dari suatu produk obat ini dipengaruhi oleh sifat fisikokimia zat aktif dan bentuk sediaan. Ketersediaan zat aktif ditetapkan oleh kecepatan pelepasan zat aktif dari bentuk sediaan, di mana pelepasan zat aktif ditentukan oleh kecepatan melarutnya dalam media sekelilingnya (Tjay, 2002).
Uji disolusi ini didesain untuk membandingkan kecepatan melarutnya suatu obat, yang ada di dalam suatu sediaan pada kondisi dan ketentuan yang sama dan dapat diulangi (Shargel, 1988). Terlihat dari kurva diatas bahwa kedua variabel saring berhimpitan akan tetapi simvastatin tablet non e-catalogue BPJS laju disolusinya lebih tinggi dibandingkan dengan simvastatin tablet e-catalogue BPJS. Adanya perbedaan profil disolusi dari masing-masing keempat obat dapat memberikan profil farmakokinetik dan efek terapi yang berbeda. Kecepatan disolusi sediaan sangat berpengaruh terhadap respon klinis dari kelayakan sistem penghantaran obat. Disolusi menjadi sifat sangat penting pada zat aktif yang dikandung oleh sediaan obat tertentu, di mana berpengaruh terhadap kecepatan dan besarnya ketersediaan zat aktif dalam tubuh, jika disolusi makin cepat, maka absorbsi makin cepat, sehingga efektivitas terapi juga lebih cepat dan optimal.
UIN Syarif Hidayatullah Jakarta persyaratan disolusi yang disyaratkan oleh USP XXXII metode disolusi tes satu. Hasil analisis keseusaian pelepasan obat dapat dilihat pada Tabel 4.6.
Tabel 4.6 Hasil Analisis Kesesuaian Pelepasan Pimvastatin pada Menit ke-45 dari Empat Merek
Berdasarkan dasil analisis diatas, dapat diketahui bahwa keenam tablet uji dari masing-masing merek telah memenuhi persyaratan disolusi tablet simvastatin menurut USP XXXII metode disolusi tes satu.
Tabel 4.7 Persyaratan Pelepasan Obat Simvastatin Berdasarkan USP XXXII, Tahun 2010
Persyaratan Disolusi
Jumlah tercantum dalam Etiket Menit Ketetapan Kecepatan disolusi
5 mg 30 menit Tidak kurang dari 70%
10 mg 45 menit Tidak kurang dari 70%
20 mg 45 menit Tidak kurang dari 70%
UIN Syarif Hidayatullah Jakarta 4.8 Analisa Statistik
Analisa statistik dilakukan dengan memasukkan data presentase simvastatin yang terdisolusi tiap waktu dari masing-masing sampel obat. Sebelum dilakukan uji statistik komparatif One Way ANOVA dilakukan uji normalitas Saphiro-Wilk untuk menilai distribusi data dan uji homogenitas dengan metode Levene’s Test untuk mengetahui variasi data antar kelompok, karena syarat dapat dilakukannya uji komparatif One Way ANOVA adalah data harus terdistribusi normal dan terdapat kesamaan varian antar kelompok.
Hasil uji normalitas Saphiro Wilk semua data menunjukkan nilai p>0,05 yang berarti bahwa semua data pada menit ke-5, 10, dan 15 memiliki data yang terdistribusi normal.
Untuk hasil uji homogenitas dengan metode Levene’s test menunjukkan nilai p>0,05 pada semua data yang menandakan bahwa terdapat kesamaan varian antar kelompok atau yang berarti semua data homogen.