SINTAS ISOLAT LOKAL Enterobacter sakazakii
(Cronobacter spp.) DALAM SUSU SKIM SELAMA
PENGERINGAN, PENYIMPANAN DAN REKONSTITUSI
FENNY LARASATI
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Sintas Isolat Lokal Enterobacter
sakazakii (Cronobacter spp.) dalam Susu Skim Selama Pengeringan,
Penyimpanan dan Rekonstitusi adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Februari 2012
Fenny Larasati NIM F251090091
FENNY LARASATI. Survival of Local Isolates of Enterobacter sakazakii (Cronobacter spp.) in Skim Milk during Spray Drying, Storage and Reconstitution. Under the direction of RATIH DEWANTI-HARIYADI and LILIS NURAIDA.
Enterobacter sakazakii (Cronobacter spp.) is an emerging opportunistic pathogen associated with necrotizing enterocolitis, septicemia, bacteremia, and meningitis in neonates, particularly those who are premature or immunocompromised. Contaminated powder infant formula (PIF) has been linked to such outbreaks. Cronobacter spp. is relatively more resistant to osmotic stress and desiccation than other Enterobacteriaceae. This pathogen is known to survive at least for two years in PIF having low water activity (aw). The objective of this
study was to determine the effects of spray drying and storage humidity (50%, 70%, and 90%) on the survival of a heat resistant local isolate Cronobacter spp. in skim milk and their viability upon reconstitution at various water temperatures. Survival of Cronobacter spp. during spray drying was determined by comparing the number of bacteria before and after spray drying. Viability of Cronobacter spp. in spray dried milk was observed for 3 month, during which Cronobacter spp. were periodically enumerated on TSA-YE agar. At the same intervals, spray dried milk containing Cronobacter spp. was reconstituted with water at room temperature (27 °C) and 50 °C. The number of Cronobacter spp. after reconstitution was enumerated and compared to the number of surviving Cronobacter spp. in milk prior to drying. In addition water activity (aw) and
moisture content of the dried skim milk were also determined. Spray drying process resulted in 4.19 log CFU/g reduction of Cronobacter sp.YRc3a. Decrease in aw of skim milk after drying and during storage resulted in an increased survival
of Cronobacter sp.YRc3a upon reconstitution at 50 °C. The logarithmic reduction of Cronobacter sp.YRc3a during reconstitution before drying were significantly higher (0.64 log) than after drying (0.35 log). Increase in survival upon reconstitution was also observed during storage at various humidity, ranging from 0.161 to 0.203 log. During 3 month storage period, Cronobacter sp. YRc3a survived better in dried skim milk at 70% humidity with only 0.21 log reduction in viable counts. Storage of dried skim milk at 50% and 90% humidity accelerated the rate of Cronobacter sp.YRc3a, resulting in decline of viable count for approximately 3 log cycles.
Keyword: Enterobacter sakazakii, spray drying, dry storage, aw, reconstitution
FENNY LARASATI. Sintas Isolat Lokal Enterobacter sakazakii (Cronobacter spp.) dalam Susu Skim Selama Pengeringan, Penyimpanan, dan Rekonstitusi. Dibimbing oleh RATIH DEWANTI-HARIYADI and LILIS NURAIDA.
Enterobacter sakazakii (Cronobacter spp.) merupakan merupakan patogen oportunistik dan emerging yang dilaporkan dapat menyebabkan radang otak (meningitis), radang usus (necroitizing enterocolitis), septicemia, serta kematian pada bayi beresiko tinggi. Selain pada bayi, infeksi Cronobacter spp. berpeluang terjadi pada kelompok lanjut usia dan orang dewasa dengan daya tahan tubuh rendah meskipun tidak menyebabkan kematian. Kasus keracunan Cronobacter spp. yang terjadi pada bayi dilaporkan karena konsumsi susu formula.
Cronobacter spp. memiliki ketahanan panas relatif lebih tinggi terhadap panas dibandingkan Enterobacteriaceae lain. Patogen ini juga diketahui dapat bertahan sampai 2 tahun pada susu formula bubuk dengan aktivitas air (aw)
rendah. Tujuan dari penelitian ini adalah untuk mengetahui pengaruh pengeringan dan RH penyimpanan (RH 50%, 70%, dan 90%) terhadap sintas isolat lokal Cronobacter spp. dalam susu skim sertas viabilitasnya saat rekonstitusi pada suhu air yang berbeda.
Untuk mendapatkan satu isolat Cronobacter sp. yang paling tahan panas dilakukan skrining cepat, dengan memanaskan Cronobacter spp. dalam medium TSB (Tryptose Sor Broth) pada suhu 50 °C selama 30 menit. Satu isolat Cronobacter spp. yang mengalami reduksi paling rendah selama pemanasan dipilih untuk penelitian tahap selanjutnya, yaitu sintasnya selama pengeringan, penyimpanan, dan rekonstitusi. Sintas Cronobacter sp. terpilih selama pengeringan semprot (suhu inlet 180 °C; outlet 82 °C) ditentukan dengan membandingkan jumlah bakteri sebelum dan setelah pengeringan semprot. Viabilitas dari Cronobacter sp. dalam susu skim hasil pengeringan semprot selama penyimpanan dievaluasi setiap minggunya selama 3 bulan, dengan penghitungan jumlah Cronobacter sp. pada media TSA-YE agar. Aktivitas air (aw)
dan kadar air dari susu skim bubuk dalam penelitian ini juga diukur. Pada interval waktu yang sama, susu skim bubuk yang mengandung Cronobacter sp. diuji ketahanannya saat rekonstitusi menggunakan air steril bersuhu 27 °C dan 50 °C . Jumlah Cronobacter sp. dalam susu skim bubuk yang disimpan setelah rekonstitusi tersebut dihitung dan dibandingkan dengan jumlah Cronobacter sp. dalam susu skim yang bertahan selama pengeringan semprot.
Isolat Cronobacter sp. asal susu formula (YRc3a) memiliki ketahanan panas paling tinggi terhadap pemanasan suhu 50 °C selama 30 menit pada medium TSB (Tryptose Sor Broth). Proses pengeringan semprot mengakibatkan penurunan viabilitas Cronobacter sp. YRc3a sebesar 4.19 log CFU/g. Penurunan aw susu skim setelah proses pengeringan dan selama penyimpanan meningkatkan
meningkatkan laju penurunan Cronobacter sp. rata-rata 3 siklus log. Viabilitas Cronobacter sp.paling rendah terjadi pada penyimpanan (RH) 90% dengan rata-rata penurunan jumlah sel sebesar 3,31 log CFU/g. Sedangkan pada penyimpanan RH 50% terjadi penurunan jumlah sel sebesar 3,13 log CFU/g. Pada penyimpanan RH 50%, rata-rata penurunan jumlah sel pada 1 bulan pertama sebesar 2.43 log CFU/g dan pada 2 bulan selanjutnya penurunan berkisar 0, 71 log CFU/g. Pada penyimpanan RH 90% pada 1 bulan pertama terjadi penurunan jumlah sel sebesar 0,57 log CFU/g, pada 2 bulan selanjutnya penurunan berkisar 2,74 log CFU/g.
Kata kunci : Enterobacter sakazakii, spray drying, penyimpanan kering, aw,
© Hak Cipta milik Institut Pertanian Bogor Tahun 2012
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak mengurangi kepentingan yang wajar IPB
SINTAS ISOLAT LOKAL Enterobacter sakazakii
(Cronobacter spp.) DALAM SUSU SKIM SELAMA
PENGERINGAN, PENYIMPANAN DAN REKONSTITUSI
FENNY LARASATI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Mayor Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Penelitian : Sintas Isolat Lokal Enterobacter sakazakii (Cronobacter spp.) dalam Susu Skim Selama Pengeringan, Penyimpanan dan Rekonstitusi
Nama : Fenny Larasati
NIM : F251090091
Program Studi : Ilmu Pangan (IPN)
Disetujui, Komisi Pembimbing
Dr. Ir. Ratih Dewanti-Hariyadi, M.Sc Dr. Ir. Lilis Nuraida, M.Sc Ketua Anggota
Diketahui,
Ketua Program Studi Ilmu Pangan Dekan Sekolah Pasca Sarjana,
Dr. Ir. Ratih Dewanti-Hariyadi, M.Sc Dr.Ir.Dahrul Syah, M.Sc.Agr
PRAKATA
Segala puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya karya ilmiah sebagai hasil tugas akhir dapat diselesaikan. Shalawat dan salam untuk Nabi Muhammad SAW, keluarga dan sahabat dan para pengikutnya. Tema penelitian yang dilaksanakan sejak April 2011 ini adalah keamanan pangan, dengan judul Sintas Isolat Lokal Enterobacter sakazakii (Cronobacter spp.) Selama Pengeringan Penyimpanan dan Rekonstitusi.
Penulis mengucapkan terima kasih kepada:
1. Ibu Dr. Ir. Ratih Dewanti-Hariyadi, M.Sc. dan Ibu Dr. Ir. Lilis Nuraida, M.Sc. selaku pembimbing yang telah memberikan semangat, arahan, masukan, dan saran selama penelitian dan penulisan karya ilmiah ini.
2. Bapak Prof. Dr. Ir. Purwiyatno Hariyadi M.Sc selaku penguji atas masukan dan saran dalam penulisan karya ilmiah ini
3. DP2M, Direktorat Jendral Pendidikan Tinggi yang telah mendanai penelitian ini melalui Hibah Pasca Sarjana, SEAFAST Center serta Departemen Ilmu dan Teknologi Pangan atas fasilitas yang mendukung penelitian ini.
4. Suamiku, Karyono yang tak henti-hentinya memberikan doa, semangat, kesabaran, dan kasih sayangnya selama ini
5. Orang tuaku, Ibu Hanik Rohaniwati, Bapak Sadjiran dan adikku Damai Rosanian atas doa, perhatian dan dukungannya selama ini.
6. Mas Yerris, Mbak Desty, Mbak Ari Bapak Nur, Bapak Karna, serta para teknisi baik di laboratorium SEAFAST Center dan laboratorium Departemen ITP atas bantuan selama penulis melaksanakan kegiatan penelitian.
7. Rekan-rekan seperjuangan IPN 2009, Ilul U, Hermawan , Bu Wida, Wanny H, Ryanti, Imel dan Dede yang telah berbagi pengetahuan dan pengalaman, 8. Seluruh pihak dan teman-teman lainnya yang tidak dapat disebutkan satu
persatu, atas kerjasama dan dukungan yang telah diberikan.
Semoga karya ilmiah ini bermanfaat.
RIWAYAT HIDUP
Penulis dilahirkan di Malang pada tanggal 23 Februari 1983 dari Ayah Sadjiran dan Ibu Hanik Rohaniwati. Penulis merupakan anak pertama dari dua bersaudara.
Tahun 2001 penulis lulus dari SMU Negeri I Tumpang Malang dan pada tahun yang sama lulus seleksi masuk Universitas Brawijaya melalui jalur PSB (Penerimaan Siswa Berprestasi). Penulis memilih Program Studi Teknologi Hasil Pertanian (yang sekarang bernama Teknologi Pangan dan Gizi), Fakultas Teknologi Pertanian.
Setelah berhasil menyelesaikan program S1 pada tahun 2005 penulis bekerja di beberapa perusahaan yang bergerak dalam industri pangan, antara lain sebagai staf Quality Assurance di PT Riau Sakti United Plantation, Riau (2005-2006), Kepala Bagian Quality Assurance di PT Etira Champimer Indonesia, Pasuruan (2007-2009), dan staf Quality Management System PT Futami Food and Beverage, Bogor (2009-2010).
DAFTAR ISI
2.2 Sumber Enterobacter sakazakii(Cronobacter spp.) ... 8
2.3Penyakit yang Disebabkan Oleh Enterobacter sakazakii (Cronobacter spp.) ... 9
2.4Pengeringan Semprot (Spray Drying) dalamPembuatan Susu Bubuk .... 11
2.5Karakteristik Ketahanan Panas Enterobacter sakazakii (Cronobacter spp.) ... 12
2.6Ketahanan Enterobacter sakazakii (Cronobacter spp.) terhadap Kondisi Kekeringan ... 15
4.2 SkriningCepat Ketahanan Panas Isolat Cronobacter spp. ... 34
4.3 Sintas Cronobacter sp. YRc3a dalam Susu Skim Selama Pengeringan Semprot dan Saat Rekonstitusi ... 37
4.3.1 Sintas Cronobacter sp. YRc3a dalam Susu Skim Selama Pengeringan Semprot ... 37
4.4 Sintas Cronobacter sp. YRc3a dalam Susu Skim Selama Penyimpanan
Pada RH Berbeda ... . 41
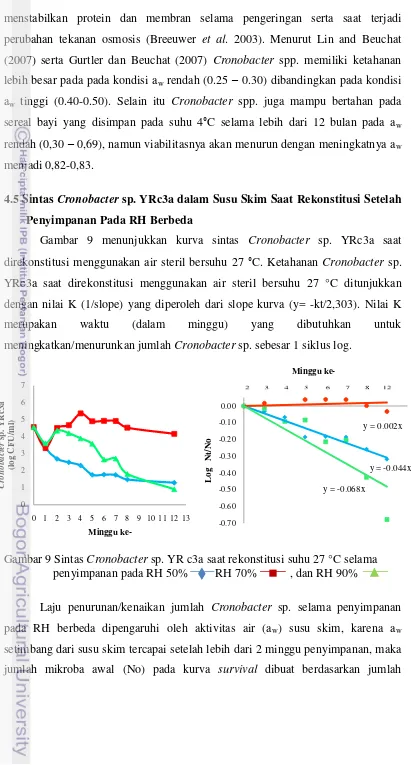
4.5 Sintas Cronobacter sp. YRc3a dalam Susu Skim Saat Rekonstitusi Setelah Penyimpanan Pada RH Berbeda... 49
5 SIMPULAN DAN SARAN 5.1 Simpulan ... 56
5.2 Saran... 57
DAFTAR PUSTAKA ... 58
DAFTAR TABEL
Halaman
Tabel 1 Waktu reduksi desimal dan nilai z (± standar deviasi) untuk
berbagai strain Enterobacter sakazakii (Cronobacter spp.) ... 13
Tabel 2 Nilai D (menit) dan Z (°C) isolat lokal Cronobacter spp. ... 14
Tabel 3 Daftar isolat Cronobacter spp. yang digunakan... 21
Tabel 4 Hasil Rekonfirmasi Isolat Cronobacter spp. ... 34
Tabel 5 Reduksi Cronobacter spp. setelahskrining cepat pada suhu 50 °C selama 30 menit dalam media TSB (Tryptose Soy Broth) ... 35
Tabel 6 Sintas Cronobacter sp. YR c3a dalam susu skim sebelum dan setelah proses pengeringan semprot suhu inlet 160 °C dan outlet82 °C……….……… 38
Tabel 7 Nilai K Cronobacter sp. YRc3a selama 3 bulan penyimpanan pada RH berbeda ………..……….…… 46
. Tabel 8 Nilai K Cronobacter sp. YRc3a selama 3 bulan penyimpanan pada RH berbeda saat rekonstitusi menggunakan air steril suhu 27 °C.………..… 50
Tabel 9 Nilai K Cronobacter sp. YRc3a selama 3 bulan penyimpanan pada RH berbeda saat rekonstitusi menggunakan air steril suhu 50 °C.………….……….……… 51
DAFTAR GAMBAR
Halaman Gambar 1. Enterobacter sakazakii ………………..... 6
Gambar 2. Morfologi sel Cronobacter spp. sebelum dan setelah terpapar
suhu heat shock……….………... 15
Gambar 3. Akumulasi osmolit/solut dalam sel ………..… 18
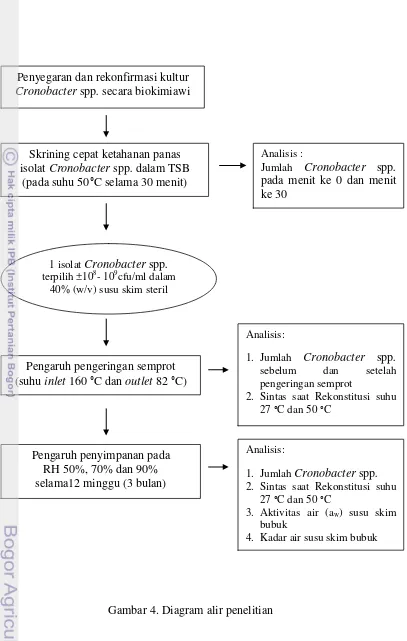
Gambar 4. Diagram alir proses penelitian ………... 23
Gambar 5. Sintas Cronobacter spp. selama rekonstitusi dalam susu skim sebelum dan setelah pengeringan semprot………... 39
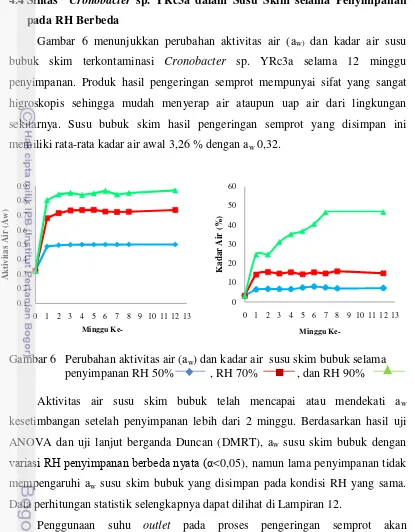
Gambar 6. Perubahan aktivitas air (aw) dan kadar air susu skim bubuk
selama penyimpanan pada RH 50%, 70%, dan 90%...…….. 41
Gambar 7. Kurva viabilitas Cronobacter sp. YRc3a selama penyimpanan pada RH 50%, 70%, dan 90%... 43
Gambar 8. Kurva survival pertumbuhan/penurunan Cronobacter sp. YRc3a selama penyimpanan pada RH 50%, 70%, dan 90%... 45
Gambar 9. Sintas Cronobacter sp. YRc3asaat rekonstitusi suhu 27 °C
selama penyimpanan padaRH 50%, 70%, dan 90% ………...… 49
Gambar 10. Sintas Cronobacter sp. YRc3a saat rekonstitusi suhu 50 °C
selama penyimpanan padaRH 50%, 70%, dan 90%... 51
Gambar 11. Kurva Sintas (Survival) Cronobacter sp. YRc3a saat
DAFTAR LAMPIRAN
Halaman Lampiran 1. Tahapan Penelitian, Tujuan dan Rancangan Percobaan ……. 66
Lampiran 2. Hasil Konfirmasi Isolat Cronobacter spp. ……….……..……... 68
Lampiran 3. Prosespengeringan Semprotdengan Spray Drier Suhu Inlet
±160 °C & Outlet ±82 °C………..…. 70
Lampiran 4 Hasil Perhitungan Sintas Cronobacter sp. YRc3a Selama
Proses Pengeringan Semprot……….……... 71
Lampiran 5. Peyimpanan Skim Milk Hasil Pengeringan Semprot ke dalam Desikator RH 50%, 70%, dan 90%……….…..... 73
Lampiran 6. Data Hasil SkriningCepat Ketahanan Panas…..... 74
Lampiran 7. Perhitungan Statistik Hasil SkriningCepat Isolat
Cronobacter spp. Pada Suhu 50° Selama 30 menit…..... 76
Lampiran 8. Hasil Analisa Sintas Cronobacter sp. YRc3a Sebelum dan
Setelah Pengeringan Semprot...... 77
Lampiran 9. Hasil Analisa Log Reduksi Cronobacter sp. YRc3a
Selama Penyimpanan Pada RH 50%,RH 70%, dan RH 90%.. 78
Lampiran 10. Perhitungan Statistik Log Reduksi (Log CFU/ml) Cronobacter sp. YRc3aSaat Rekonstitusi Pada
Berbagai Kondisi... 81
Lampiran 11. Data Aktivitas Air (aw) dan Kadar Air Susu Skim
Selama Penyimpanan ……….…………...... 82
Lampiran 12. Perhitungan Satistik Hasil Analisa Aktivitas Air (aw)
Susu Skim Bubuk yang Disimpan Pada RH Berbeda... 83
Lampiran 13. Perhitungan Satistik Hasil Analisa Kadar Air Susu
Skim Bubuk yang Disimpan Pada RH Berbeda........ 86
Lampiran 14. Viabilitas Cronobacter sp. YRc3a Selama Penyimpanan
Lampiran 15. Perhitungan Statistik Viabilitas Cronobacter sp. YRc3a
Selama Penyimpanan (log CFU/g)..... 92
Lampiran 16. Data Sintas (Survival) Cronobacter sp. YRc3a
Selama Penyimpanan Pada RH 50 %…………....... 95
Lampiran 17. Data Sintas (Survival) Cronobacter sp. YRc3a
Selama Penyimpanan Pada RH 70%………....... 98
Lampiran 18. Data Sintas (Survival) Cronobacter sp. YRc3a
Selama Penyimpanan Pada RH 90%………... 101
Lampiran 19. Perhitungan Statistik Sintas Cronobacter sp. YRc3a Saat Rekonstitusi Suhu 27°C Selama Penyimpanan
(log CFU/ml)………...... 104
Lampiran 20. Perhitungan Statistik Sintas Cronobacter sp. YRc3a Saat Rekonstitusi Suhu 50°C Selama Penyimpanan
(log CFU/ml)..………...... 107
Lampiran 21. Perhitungan Statistik Log Reduksi Cronobacter sp. YRc3a Saat Rekonstitusi Selama Penyimpanan (log CFU/ml)……... 110
Lampiran 22. Perhitungan Sintas Cronobacter sp. YRc3a Saat
Rekonstitusi Suhu 27 °C dan 50 °C Selama Penyimpanan
Pada RH Berbeda………. 113
Lampiran 23. Perhitungan Sintas Cronobacter sp. YRc3a Saat
Rekonstitusi dengan Medium Berbeda Selama Penyimpanan
1. PENDAHULUAN
1.1 Latar Belakang
Enterobacter sakazakii (Cronobacter spp.) merupakan patogen oportunistik dan emerging yang dilaporkan dapat menyebabkan radang otak (meningitis), radang usus (necrotizing enterocolitis), septisemia, serta kematian pada bayi berisiko tinggi, dengan angka mortalitas kejadian infeksi 40-80% (Himelright et al. 2002). Bayi yang berisiko tinggi terinfeksi Cronobacter spp. adalah bayi berumur kurang dari 28 hari, memiliki berat lahir rendah (<2000 g), lahir prematur (< 37 minggu) dan terlahir dari ibu yang mengidap AIDS (acquired immune deficiency syndrome). Kebanyakan anak-anak yang bertahan hidup, akan mengalami komplikasi pada saraf otak yang menyebabkan hidrosefalus, kelumpuhan dan keterbelakangan mental (Lai 2001). Selain pada bayi dan anak-anak, infeksi Cronobacter spp. juga bisa terjadi pada kelompok lanjut usia dan orang dewasa dengan daya tahan tubuh rendah meskipun tidak sampai menyebabkan kematian (Gurtler et al. 2005).
tinggi, Cronobacter spp. juga diisolasi dari peralatan yang digunakan dalam persiapan bubuk formula bayi (blender) dan lingkungan tempat persiapan (Block et al. 2002).
Susu formula bubuk merupakan produk hasil pengolahan dan pengawetan dengan cara menurunkan kadar air dari susu. Pengolahan susu formula bubuk dapat dilakukan secara basah (wet-mix process), secara kering (dry-mix process) maupun kombinasinya. Pengolahan secara basah dilakukan dengan pencampuran semua bahan baku mentah dalam bentuk cair, standarisasi, homogenisasi, pasteurisasi, pengeringan dan pengemasan. Pada proses secara kering, semua bahan diolah secara terpisah lalu dicampurkan dalam kondisi kering lalu dikemas (FSANZ 2006). Salah satu metode pengeringan susu formula bubuk yang sering digunakan adalah pengeringan semprot. Ketahanan Cronobacter spp. selama pengeringan semprot tergantung dari karakteristik ketahanan panas dan suhu yang diaplikasikan. Suhu outlet merupakan faktor penting yang mempengaruhi viabilitas dari Cronobacter spp. selama proses pengeringan semprot, suhu outlet lebih dari 90 °C dapat menyebabkan kematian sel karena terjadi denaturasi protein dan DNA (Wong et al. 2010). Kandungan total padatan dan lemak yang tinggi dalam susu formula bubuk dapat melindungi E. sakazakii, sehingga akan mempengaruhi laju inaktivasi E. sakazakii oleh panas (Nazarowec-White and Farber 1997).
Mikroorganisme dapat mengalami stres jika terpapar suhu yang lebih tinggi dari suhu pertumbuhannya tetapi suhu tersebut tidak cukup untuk membunuh mikroorganisme (sublethal temperature), fenomena ini di sebut heat shock response (Gurtler et al. 2005). E. sakazakii memiliki ketahanan yang tinggi terhadap panas dibandingkan Enterobacteriaceae lain yang mengkontaminasi susu formula bubuk, sehingga bakteri ini memiliki peluang bertahan selama proses pasteurisasi dan pengeringan sehingga terbawa ke produk akhir(Edelson-Mammel and Buchanan 2003). Proses pengeringan semprot dengan suhu inlet 180±1°C dan suhu outlet 80°C dapat menurunkan jumlah C. sakazakii dalam medium 40% susu skimsebesar 3-4 siklus log (Wan-Ling et al. 2009)
selama 12 bulan dalam produk sereal kering pada berbagai aw dan suhu
penyimpanan. Sel E. sakazakii memiliki ketahanan lebih baik pada aw rendah
(0.25–0.30) dan suhu rendah (4°C) dengan rata-rata penurunan populasi sel 1.86 log CFU/g dibandingkan pada aw tinggi (0.69–0.82) dan suhu tinggi (30°C).
Restaino et al. (2006) berhasil mengisolasi E. sakazakii pada 6 dari 18 sampel (33,3%) sereal bayi kering.
Susu formula bubuk memiliki aktivitas air (aw) sekitar 0.2, kemampuan
bertahan E. sakazakii pada kondisi kering tergantung dari kemampuannya merespon perubahan kondisi lingkungan tersebut (osmotic/dry stress resistance). Air berkontribusi dalam menstabilkan komponen biologi, hilangnya air akibat proses pengeringan menyebabkan perubahan yang bersifat irreversible terhadap integritas fungsional dan struktural membran serta protein bakteri.
Salah satu cara yang dilakukan oleh mikroorganisme untuk meningkatkan ketahanannya terhadap panas, dehidrasi, pembekuan, dan tekanan osmosis adalah dengan melakukan penumpukan solut/osmolit yakni dengan mengakumulasi komponen intraseluler, mulai dari ion K+ diikuti dengan solut seperti prolin, glisin, betain, aktoin, karnitin dan trehalosa di dalam sel (Breeuwer et al. 2003). Mekanisme perlindungannya adalah dengan menstabilkan membran selular, sehingga dapat mencegah denaturasi protein dan enzim intraseluler sesuai dengan teori water replacement, dimana komponen polihidroksil seperti trehalosa akan menstabilkan ikatan hydrogen dengan gugus polar phospholipid yang sebelumnya ditempati oleh air (Yi et al. 2010).
1.2 Identifikasi Masalah
Cronobacter spp. dapat mengkontaminasi susu formula bubuk dan memiliki kemampuan bertahan terhadap proses pengeringan semprot, Cronobacter spp. yang bertahan dalam susu formula bubuk setelah proses pengeringan tersebut mungkin bertahan saat dikemas dan disimpan pada kondisi kering. Untuk itu perlu dilakukan penelitian mengenai sintas (survival) Cronobacter spp. selama mengalami proses pengeringan semprot, penyimpanan pada RH yang berbeda, dan saat rekonstitusi.
1.3 Tujuan Penelitian
Tujuan umum dari penelitian ini adalah mengevaluasi sintas isolat lokal Cronobacter spp. selama pengeringan semprot, penyimpanan pada RH berbeda, dan saat rekonstitusi.
Tujuan khusus dari penelitian ini adalah:
a) Mempelajari pengaruh pengeringan semprot terhadap sintas Cronobacter spp.;
b) Mempelajari pengaruh pengeringan semprot terhadap sintas Cronobacter spp. saat direkonstitusi dengan air suhu 27 °C dan 50°C;
c) Mempelajari pengaruh RH dan lama penyimpanan terhadap sintas Cronobacter spp.;
d) Mempelajari pengaruh RH dan lama penyimpanan terhadap sintas Cronobacter spp. saat direkonstitusi dengan air suhu 27 °C dan 50 °C.
1.4 Manfaat Penelitian
Manfaat penelitian ini adalah untuk menambah informasi mengenai pengaruh pengeringan semprot, penyimpanan pada RH berbeda dan rekonstitusi terhadap sintas isolat lokal Cronobacter spp yang diisolasi dari beberapa produk pangan di Indonesia.
1.5 Hipotesis
dan (2) kinetika penurunan dan pertumbuhan Cronobacter spp. selama
penyimpanan pada RH berbeda diasumsikan mengikuti reaksi kinetika ordo 1.
2. TINJAUAN PUSTAKA
2.1 Enterobacter sakazakii (Cronobacter spp.)
Enterobacter sakazakii (Cronobacter spp.) merupakan bakteri gram negatif yang bersifat motil, tidak membentuk spora, berbentuk batang, fakultatif anaerob, oksidase negatif, katalase positif, sebelumnya diketahui sebagai E. cloacae yang dapat membentuk pigmen berwarna kuning. Secara biokimia E. sakazakii memiliki kemampuan mereduksi nitrat menjadi nitrit, memproduksi DNAse ekstraseluler, tahan terhadap kondisi asam, dan mampu menghasilkan gas dalam medium laktosa pada suhu 35 °C dan medium EC broth pada suhu 44,5 °C (Heuvelink et al. 2001). Gambar 1 menampilkan sel E. sakazakii yang diamati dengan mikroskop elektron.
Gambar 1 E. sakazakii (SEM x4800) (Kunkel 2009)
(BHI) broth pada suhu 47 °C (Breeuwer et al. 2003). Iversen at al. (2003) melaporkan bahwa pada suhu ruang atau 21 ºC, E. sakazakii mempunyai waktu generasi sekitar 75 menit pada susu formula yang direkonstitusi.
E. sakazakii juga dapat dibedakan karena kemampuannya memfermentasi sukrosa, rafinosa, dan β-methyl-d-glukosida, dan tidak memfermentasi d-sorbitol, dulsitol, adonitol, atau d-arabinol. Akan tetapi, baru-baru ini diketahui bahwa beberapa galur E. sakazakii menunjukkan kemampuannya memfermentasi D-sorbitol (Erickson & Kornacki 2002). Skladal et al. (1993) yang menginokulasikan 10-15 sel E. sakazakii ke dalam 500 ml susu UHT dalam karton dan menginkubasinya pada 30 ºC, menemukan bahwa medium ini sangat mendukung pertumbuhannya menjadi asam karena reduksi D-laktat. E. sakazakii memproduksi heteropolisakarida baru yang mengandung 29-32% asam glukuronat, 23-30% D-glukosa, 19-24% D-galaktosa, 13-22% D-fruktosa, dan 0-8% manosa (produksi optimumnya adalah dibawah kondisi pertumbuhan yang terbatas nitrogennya dengan rasio C/N 20:1). Kapsul bakteri ini digunakan untuk bertahan, sehingga memungkinkannya untuk bertahan dalam susu formula sampai 24 bulan (Iversen dan Forsythe 2003).
E. sakazakii tumbuh pada media yang digunakan untuk mengisolasi mikroba enteric seperti McConkey, eosin methylene blue, dan deoxycholate agar. Pada agar cawan bakteri ini dapat membentuk dua tipe koloni yaitu glossy (mengkilap) dan matt (tidak mengkilap) tergantung pada media yang digunakan dan galurnya. Seluruh galur tumbuh dengan cepat pada media tryptone soy agar dan membentuk koloni berdiameter 1,5 – 3 mm setelah 1-2 hari. Pertumbuhan E. sakazakii pada media tryptone soy agar pada 25°C mampu membentuk pigmen kuning yang tidak berdifusi. Di dalam tryptone soy broth, E. sakazakii mampu memproduksi banyak sedimen yang tampaknya terdiri dari gumpalan sel-sel dan massa amorf (Nazarowec-White et al. 2003).
Cronobacter merupakan nama genus baru yang diusulkan untuk menggantikan Enterobacter sakazakii berdasarkan studi yang dilakukan oleh Iversen et al. (2007) karena tingginya keragaman spesies dari E. sakazakii. Studi tersebut menggolongkan Cronobacter berdasarkan pendekatan taksonomi
fluorescent-amplified fragment length polymorphism (f-AFLP), hibridisasi DNA– DNA dan perbedaan profil fenotipik. Spesies dalam genus Cronobacter saat ini antara lain Cronobacter sakazakii, Cronobacter malonaticus sp., Cronobacter turicensis sp., Cronobacter muytjensii sp., Cronobacter dublinensis sp. Cronobacter genomospecies 1, dan tiga subspecies, yaitu Cronobacter dublinensis subsp. dublinensis, Cronobacter dublinensis subsp. lausannensis, dan Cronobacter dublinensis subsp. lactaridi (Iversen et al. 2008).
2.2Sumber Enterobacter sakazakii (Cronobacter spp.)
Infeksi yang terkait dengan E. sakazakii (Cronobacter spp.) dilaporkan melalui jalur transmisi susu formula bubuk. Beberapa peneliti telah berhasil mengisolasi E. sakazakii dari berbagai sumber, seperti lingkungan dan berbagai jenis produk pangan. Iversen dan Forsythe (2003) melaporkan E. sakazakii dapat diisolasi dari lingkungan seperti air, tanah, dan sayuran, kontaminasi bisa terjadi melalui nyamuk dan binatang pengerat. E. sakazakii juga diisolasi dari berbagai sumber makanan seperti susu UHT (Ultra High Temperature), keju, daging, sayuran, biji-bijian, roti dan minuman fermentasi (Shaker et al. 2007). Menurut Iversen dan Forsythe (2003) kapsul yang diproduksi oleh E. sakazakii dapat meningkatkan kemampuan untuk membentuk biofilm dalam permukaan peralatan. Iversen et al. (2004) juga mempelajari pembentukan biofilm E. sakazakii, bakteri ini memiliki kemampuan menempel pada silikon, lateks dan polikarbonat dan dalam jumlah besar pada stainless steel, sehingga direkomendasikan botol dan peralatan untuk menyiapkan susu formula bayi harus dibersihkan sesering mungkin untuk meminimalkan biofilm sebagai sumber infeksi.
pathogen dapat masuk ke bubuk susu dari lingkungan dan saat penambahan atau pencampuran dengan bahan lain (Gurtler et al. 2005).
Soriano et al. (2001) menemukan 1 isolat E. sakazakii dari 40 sampel selada mentah tetapi tidak memukan pada selada siap makan. Sedangkan Senzani (2011) berhasil mengisolasi Cronobcater spp.dari kubis mentah asal Indonesia. Cottyn et al. (2001) menganalisa beras yang dipanen dari berbagai area di Philippina, hasil penelitiannya menunjukkan 4 dari 9 lot biji terdapat E. sakazakii. Bakteri ini juga mengkontaminasi makanan yang berasal dari daging dan produk daging serta unggas, selain itu ditemukan juga mengkontaminasi, telur, susu mentah dan berbagai produk susu serta sedikit pada ikan. E. sakazakii juga dapat mengkontaminasi selama proses curing daging. E. sakazakii merupakan mikroorganisme yang membentuk histamin selama proses pematangan keju yang diisolasi dari whey keju (Dumen 2010).
Friedmann (2006) melaporkan bahwa makanan dapat tercemar oleh E. sakazakii baik ketika masih dalam keadaaan mentah maupun setelah mengalami proses pengolahan. Pangan olahan yang dapat terkontaminasi bakteri ini bukan hanya makanan kering, makanan segar, beku, siap saji, fermentasi, makanan matang, minuman dan air untuk mengolah makanan ternyata juga dapat terkontaminasi E. sakazakii.
Cronobacter spp. telah diisolasi dari 22,73 % formula lanjutan untuk bayi berumur kurang dari 6 bulan (dari 22 sampel) dan 40 % makanan bayi (dari 15 sampel) yang dipasarkan di Indonesia oleh Estuningsih et al. (2006). Laporan lain menyebutkan Cronobacter spp. juga diisolasi dari susu formula bubuk dan makanan bayi (Meutia 2008). Dewanti-Haryadi et al. (2011) juga mengisolasi Cronobacter spp. pada makanan bayi dan beberapa produk pangan kering lainnya.
2.3 Penyakit yang Disebabkan oleh Enterobacter sakazakii (Cronobacter spp.)
gram, dan bayi yang dilahirkan dari ibu yang mengidap HIV) dilaporkan akan menyebabkan radang otak (neonatal meningitis), radang usus (necrotizing enterocolitis/NEC), dan bacteremia yang mengancam hidup bayi. E. sakazakii menjadi perhatian karena menyebabkan infeksi dengan tingkat mortalitas yang tinggi (40-80%) pada bayi yang baru lahir (0-6 bulan) (Iversen & Forsythe 2003), jika pasien mampu bertahan biasanya akan mengalami komplikasi syaraf seperti kepala yang membesar (hydrocephalus), kelumpuhan (quadriplegia), dan infeksi jaringan otak (brain abscess) (Mullane et al. 2006).
The International Commission for Microbiological Specifications for Foods (ICMSF 2002) menempatkan E. sakazakii sebagai cemaran dengan tingkat bahaya parah, menyerang populasi terbatas, mengancam kehidupan atau menyebabkan dampak kronis lanjutan dan mempengaruhi hidup dalam jangka waktu lama. Mikroorganisme ini juga dianggap mempunyai peringkat yang sama dengan patogen konvensional pada makanan dan air seperti Listeria monocytogenes, Clostridium botulinum tipe A dan tipe B, serta Cryptosporodium parvum.
2.4Pengeringan Semprot (Spray Drying) dalam Pembuatan Susu Bubuk Pengeringan semprot atau spray drying adalah metode pengeringan yang mengkombinasikan proses pengeringan sekaligus proses pembentukan serbuk. Alat pengeringnya disebut pengering semprot atau spray dryer. Prinsip pengeringan semprot didasarkan pada proses penyemprotan produk dalam bentuk droplet cairan ke dalam suatu ruangan yang dihembus dengan udara panas sehingga tejadi proses pengeringan. Bahan masukan pada metode pengeringan semprot dapat berupa larutan, emulsi, atau suspensi cairan. Aliran udara panas akan menaikan suhu permukaan droplet sehingga air dalam droplet akan terevaporasi. Air yang terevaporasi akan keluar bersama aliran udara sedangkan droplet dengan kadar air rendah akan turun ke dasar chamber dengan bantuan siklon. Pengeringan semprot menghasilkan bubuk yang sangat halus (5-100 μm) dengan diameter rata-rata 20-60 μm. Pembentukan droplet pada pengeringan semprot dapat dilakukan dengan mengunakan atomizer sentrifugal (piringan berputar) atau nozzle (Walstra 1983).
Susu formula bubuk merupakan produk hasil pengolahan dan pengawetan dengan cara menurunkan kadar air susu.dari 87% (susu segar) menjadi 3% (susu bubuk) dengan cara pengeringan semprot. Pengolahan susu formula bubuk dapat dilakukan secara basah (wet-mix process), secara kering (dry-mix process) maupun kombinasinya. Pengolahan secara basah dilakukan dengan pencampuran semua bahan baku mentah dalam bentuk cair, standarisasi, homogenisasi, pasteurisasi, pengeringan dan pengemasan. Pada proses secara kering, semua bahan diolah secara terpisah lalu dicampurkan dalam kondisi kering lalu dikemas (FSANZ 2006). Salah satu metode pengeringan susu formula bubuk yang sering digunakan adalah pengeringan semprot. Sebelum proses pengeringan semprot susu cair dipasteurisasi pada suhu 71,6 oC selama 15 detik, atau 74,4 oC selama 25 detik untuk produk yang mengandung pati, dapat juga menggunakan panas yang lebih tinggi 105-125 oC selama kurang dari 5 detik.
formula bubuk dapat melindungi E. sakazakii, sehingga akan mempengaruhi laju inaktivasi E. sakazakii oleh panas (Nazarowec-White and Farber 1997).
Wan-Ling et al. (2009) melakukan pengujian survival E. sakazakii selama mengalami proses pengeringan semprot dengan suhu inlet 180±1°C dan suhu outlet 80°C, medium yang digunakan 40% susu skim dengan jumlah awal populasi sel 107-108 CFU/g dimana terjadi penurunan jumlah sel sebesar 4.81 ± 0.06 siklus log pada kultur yang tidak diberikan perlakuan heat shock. Penurunan sebesar 3.50±0.18 siklus log terjadi pada kultur yang diberikan perlakuan heat shock. Penelitian tentang ketahanan bakteri lainnya selama proses pengeringan semprot juga dilakukan oleh Chian-Lian et al. (2002), hasil penelitiannya menunjukkan jika medium susu skim bubuk menghasilkan jumlah survivor paling tinggi yaitu 63,21%-82,59% (suhu outlet pengering semprot 50°C-60°C) dibandingkan penggunakan medium lainnya seperti gum arab, gelatin dan soluble starch.
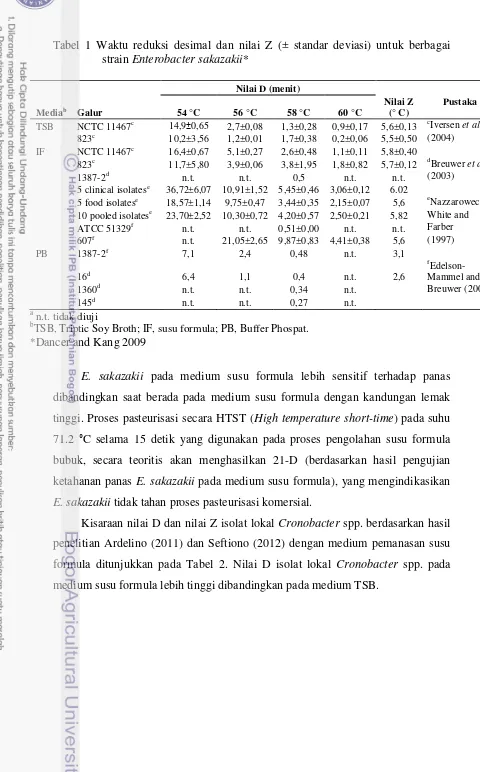
Tabel 1 Waktu reduksi desimal dan nilai Z (± standar deviasi) untuk berbagai
5 clinical isolatese 36,72±6,07 10,91±1,52 5,45±0,46 3,06±0,12 6.02
5 food isolatese 18,57±1,14 9,75±0,47 3,44±0,35 2,15±0,07 5,6 eNazzarowec- 10 pooled isolatese 23,70±2,52 10,30±0,72 4,20±0,57 2,50±0,21 5,82 White and ATCC 51329f n.t. n.t. 0,51±0,00 n.t. n.t. Farber
TSB, Triptic Soy Broth; IF, susu formula; PB, Buffer Phospat. *Dancer and Kang 2009
E. sakazakii pada medium susu formula lebih sensitif terhadap panas dibandingkan saat berada pada medium susu formula dengan kandungan lemak tinggi. Proses pasteurisasi secara HTST (High temperature short-time) pada suhu 71.2 °C selama 15 detik yang digunakan pada proses pengolahan susu formula bubuk, secara teoritis akan menghasilkan 21-D (berdasarkan hasil pengujian ketahanan panas E. sakazakii pada medium susu formula), yang mengindikasikan E. sakazakii tidak tahan proses pasteurisasi komersial.
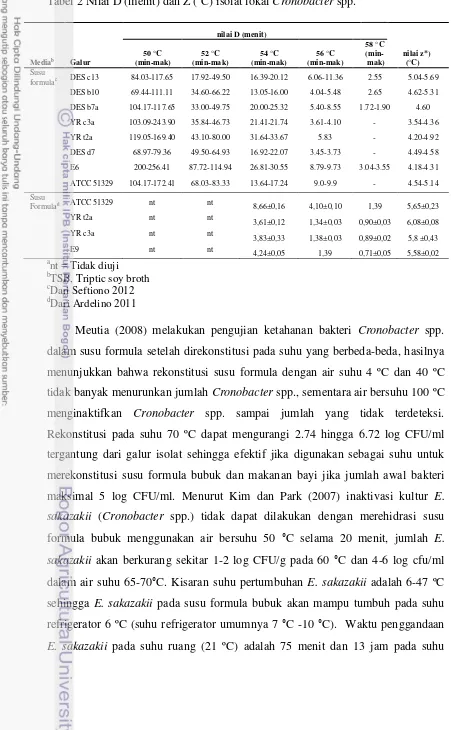
Tabel 2 Nilai D (menit) dan Z (°C) isolat lokal Cronobacter spp.
formulac DES c13 84.03-117.65 17.92-49.50 16.39-20.12 6.06-11.36 2.55 5.04-5.69
DES b10 69.44-111.11 34.60-66.22 13.05-16.00 4.04-5.48 2.65 4.62-5.31 DES b7a 104.17-117.65 33.00-49.75 20.00-25.32 5.40-8.55 1.72-1.90 4.60 YR c3a 103.09-243.90 35.84-46.73 21.41-21.74 3.61-4.10 - 3.54-4.36 YR t2a 119.05-169.40 43.10-80.00 31.64-33.67 5.83 - 4.20-4.92 DES d7 68.97-79.36 49.50-64.93 16.92-22.07 3.45-3.73 - 4.49-4.58 E6 200-256.41 87.72-114.94 26.81-30.55 8.79-9.73 3.04-3.55 4.18-4.31 ATCC 51329 104.17-172.41 68.03-83.33 13.64-17.24 9.0-9.9 - 4.54-5.14 Susu
Formulad ATCC 51329 nt nt 8,66±0,16 4,10±0,10 1,39 5,65±0,23
YR t2a nt nt
3,61±0,12 1,34±0,03 0,90±0,03 6,08±0,08 YR c3a nt nt
refrigerator, saat susu formula bubuk yang terkontaminasi E. sakazakii disimpan dalam refrigerator, sel akan menggandakan diri dan bisa menyebabkan infeksi jika jumlah sel telah mencapai dosis infeksi (dosis infeksi awal 103 sel) (Iversen et al. 2004).
Perlakuan panas dapat menyebabkan terjadinya kerusakan sel bakteri, proses pemanasan menyebabkan perubahan yang bersifat irreversible dari integritas fungsional dan struktur membran dan protein bakteri. Indikator dari kerusakan membran sel bakteri ditunjukkan dengan kebocoran komponen intraseluler dimulai dari keluarnya ion- ion seperti potassium dan phosphat yang diikuti dengan molekul berukuran besar seperti seperti asam nukleat (DNA/RNA), asam amino, protein dan enzim. Perlakuan heat shock terhadap sel E. sakazakii (Cronobacter spp.) pada suhu 48 °C selama 15 menit menyebabkan terjadinya kerusakan dan perubahan morfologi sel E. sakazakii. Gambar 2. di bawah ini menunjukkan perubahan bentuk sel E. sakazakii (di bawah Scanning Electron Microscopy)
Gambar 2 Morfologi sel E. sakazakii (Cronobacter spp.) sebelum (A) dan setelah (B) terpapar suhu heat shock (Chang et al. 2009)
2.6Ketahanan Enterobacter sakazakii (Cronobacter spp.) Terhadap Kondisi Kering (Dessiccation Resistance)
untuk menggunakan air suhu 70 °C saat merekonstitusi susu formula bubuk untuk menginaktivasi E. sakazakii yang kemungkinan ada dan bertahan pada produk susu formula bubuk.
Penelitian Lin dan Beuchat (2005) serta Gurtler dan Beuchat (2007) menunjukkan bahwa E. sakazakii mampu bertahan pada lebih dari 12 bulan pada produk formula dan sereal bayi. Pada kedua tipe produk tersebut E. sakazakii memiliki ketahanan lebih besar pada pada kondisi aw rendah (0.25 – 0.30) dan
penyimpanan pada suhu rendah (4 °C) dibandingkan pada kondisi aw tinggi
(0.40-0.50) dan penyimpanan suhu tinggi (21 °C dan 30 °C). Edelson-Mammel et al. (2005) melaporkan E. sakazakii dengan populasi awal 6 log CFU/g yang diinokulasikan dalam susu bubuk formula (aw 0.14-0.27) mengalami penurunan
populasi sel sebesar 2.4 log cfu/g pada penyimpanan suhu 20-22 °C selama 150 hari, selanjutnya terjadi kembali penurunan 1 siklus log setelah penyimpanan 534 hari. Caubilla-Barron dan Forsythe (2007) melaporkan bahwa Cronobacter spp yang disimpan pada kondisi kering selama 2.5 tahun, rata-rata penurunan jumlah sel pada 1 bulan pertama adalah 0,58 siklus log (antara 0.26 - 1.15 siklus log). Penurunan jumlah sel yang lebih besar terjadi pada 6 bulan pertama yaitu sebesar 3.34 siklus log, setelah 24 bulan total penurunan jumlah sel adalah sebesar 4.52 siklus log. Kemampuan E. sakazakii untuk bertahan pada kondisi kekeringan juga dilaporkan oleh Breeuwer et al. (2003), 3 jenis galur E. sakazakii yang disimpan pada suhu 25°C (RH 20,7%) selama 46 hari menunjukkan penurunan populasi sebesar 1-1.5 log CFU/ml, selanjutnya terjadi penurunan kurang dari 1 log CFU/ml selama penyimpanan sampai 18 bulan. Penurunan sebesar 1.5 sampai 3 log CFU/ml terjadi pada sel yang disimpan pada suhu 45°C.
Kemampuan bertahan dari Cronobacter spp dalam jangka waktu yang lama diduga karena kemampuannya mengakumulasi trehalosa dan membentuk kapsul (ekstraseluler polisakarida). Di bawah ini adalah beberapa mekanisme dan respon sel bakteri terhadap kondisi kering dan stres osmosis.
a. Akumulasi Trehalosa
meningkatkan tekanan osmosis di dalam selnya dengan mengakumulasi komponen intraseluler, dimulai dari ion K+ dan diikuti dengan solut seperti prolin, glisin, betain, aktoin, karnitin dan trehalosa. Trehalosa (1-α -D-glucopyranosyl-1,1-α-D-glucopyranoside) merupakan disakarida non reduksi dari glukosa yang umum ditemukan pada bakteri, kapang dan berbagai tanaman yang berperan dalam melindungi integritas membran plasma serta protein. Pada kondisi kekeringan jumlah trehalosa E. sakazakii dalam sel meningkat 5 kali lipat. Pada kondisi kering tanpa adanya air, sel membutuhkan perlindungan integritas selnya, trehalosa merupakan komponen polar yang sangat mudah terlarut, mampu menjaga tekanan osmosis sehingga dapat menstabilkan protein dan membran. Komponen polihidroksil seperti trehalosa dapat menggantikan posisi air disekitar makromolekul sehingga kerusakan sel dapat dicegah. Solut dalam sel akan meningkatkan volum & jumlah air bebas dalam sitoplasma sehingga denaturasi protein & kerusakan komponen dalam sel dapat dicegah serta sel bisa tetap melakukan aktivitas metabolismenya (Yance 2001). Saat organisme tersebut dikontakkan dengan air, akan terjadi pengembangan sel dengan cepat sehingga akan mulai terjadi aktivitas metabolisme (Gambar 3A)
Gambar 3 (A) Mekanisme ketahanan kekeringan dengan mengakumulasi solut untuk meningkatkan jumlah air bebas dalam sitoplasma dan (B) meningkatkan tegangan permukaan antara membran dengan cairan intraseluler (Yance 2001)
Penelitian tentang dasar genetika ketahanan dari E. sakazakii saat terpapar kondisi kering (aw 0,23) dilakukan oleh Breeuwer et a.l (2004). Pengeringan
menyebabkan induksi dari 7 gen dari heat shock regulon, 4 gen dari cyclic AMP receptor protein regulon, 6 gen yang terlibat dalam stringent response dan sejumlah gen yang terlibat dalam sintetis trehalosa serta biosintetis komponen yang berfungsi dalam dinding sel seperti lipid A dan lipopolisakarida. Sehingga dapat disimpulkan jika respon dari C. sakazakii terhadap kondisi dry stress adalah dengan melibatkan ekspresi berbagai gen.
Mekanisme ketahanan terhadap kondisi kekeringan dengan mengakumulasi trehalosa juga terjadi pada Eschericia coli. Bakteri ini dapat mensintetis trehalosa sebagai respon perubahan osmosis (osmotic stress), trehalosa disintesis oleh enzim trehalosa-6-phosphat synthase dan trehalosa- 6-phosphat phosphatase. Enzim pertama merubah glukosa dari UDP-glukosa menjadi glukosa-6-phosphat, sedangkan enzim kedua merubah trehalosa-6-phosphat internal trehalosa. Sintesis trehalosa dalam sel bakteri juga dapat diinduksi dengan menambahkan trehalosa pada medium pertumbuhannya sehingga sel bakteri akan memiliki ketahanan lebih baik pada kondisi kering dan stress osmosis, namun akumulasi intraseluler trehalosa tetap memberikan perlindungan lebih baik (Welsh & Herbet 1999).
b. Pembentukan Kapsul (Ekstraseluler Polisakarida)
tidak ditunjukkan adanya korelasi antara pembentukan kapsul dengan recovery sel. Akan tetapi setelah penyimpanan selama 2 tahun, 4 dari 5 strain E. sakazakii menunjukkan pembentukan kapsul, sedangkan setelah penyimpanan selama 2,5 tahun hanya 2 dari 25 strain yang membentuk kapsul. Pembentukan kapsul juga merupakan hal yang berperan penting dalam perlindungan sel K. oxytoca, E. vulneris, dan Pantoea spp. penyimpanan pada kondisi kering dalam jangka waktu lebih dari 2 tahun. Menurut Caubilla-Barron and Forsythe (2007) E. sakazakii dari jenis yang mampu membentuk kapsul, jumlah sel yang mengalami sublethally injured setelah mengalami kondisi kekeringan lebih sedikit dibandingkan sel E. sakazakii yang tidak mampu membentuk kapsul.
c. Perubahan Komposisi Asam Lemak Membran Sel
Perubahan komposisi asam lemak dari membran sel dapat digunakan sebagai alat untuk menentukan tahapan stres yang dialami oleh bakteri. Memodifikasi komposisi lipid merupakan cara bagi mikroorganisme untuk menjaga fungsi dari membran sehingga mampu menghadapi perubahan lingkungan. Penelitian mengenai perubahan komposisi asam lemak bakteri asam asetat strain yang tahan panas, akibat perubahan suhu menunjukkan bahwa dengan meningkatnya suhu terjadi peningkatan komposisi asam lemak jenuh dan penurunan asam lemak tidak jenuh. Komposisi asam lemak utama dari bakteri asam asetat adalah metil oleat (C18:1), metil meristat (C14:0), metil palmitat (C16:0), metil stearat (C18:0), metil linoleat (C18:2), dan metil linolenat (C18:3). Peningkatan suhu pertumbuhan menyebabkan terjadinya peningkatan sintetis asam lemak jenuh (C12:0, C14:0, C16:0, C17:0, C18:0, C20:0) dan penurunan asam lemak tidak jenuh, sintesis (mono dan poly) terutama C18:1 (Ndoye et al. 2007).
d. Oxidative Stress
Indikator biokimia dari stres oksidatifadalah reaksi redoks, yaitu level glutathione
dan lipid peroxidation. Gen utama yang terlibat adalah gen TRR1 dan GRX5 yang
berhubungan dengan dua sistem keseimbangan redoks utama, yaitu thioredoxin
dan glutathione/glutaredoxin. Peningkatan jumlah glutathione dan lipid
peroxidation yang signifikan merupakan indikasi stres oksidatif dari komponen
seluler (Garre et al. 2010)
e. Penurunan Suhu Transisi/Tm (Gel Menjadi Cair) Lipid Bilayer dengan Trehalosa
3. METODOLOGI PENELITIAN
3.1Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan April 2011 sampai bulan Oktober 2011 di Laboratorium Mikrobiologi dan Kimia SEAFAST CENTER, Pilot Plant PAU, dan Laboratorium Pengolahan Pangan ITP Institut Pertanian Bogor.
3.2 Isolat
Isolat yang digunakan dalam penelitian ini adalah Cronobacter spp. DES b7a dan DES b10 yang diisolasi dari makanan bayi, DES c13 yang diisolasi dari maizena, DES d3 yang diisolasi dari bubuk coklat (Dewanti-Hariyadi et al. 2011), YR t2a dan YR c3a yang diisolasi dari susu formula bayi (Meutia 2008), dan E6 yang diisolasi dari formula lanjutan bayi (Estuningsih et al. 2006). Isolat Cronobacter spp. yang digunakan dalam penelitian ini dapat dilihat pada Tabel 3.
Tabel 3. Daftar isolat Cronobacter spp. yang digunakan
No Nama Isolat Asal Isolat Nomor Akses Pustaka
1 DES b7a Makanan Bayi - Dewanti-Hariyadi et al.(2011) 2 DES b10 Makanan bayi JF800179 Dewanti-Hariyadi et al.(2011) 3 DES c13 Maizena JF800181 Dewanti-Hariyadi et al.(2011) 4 DES d3 Bubuk Coklat - Dewanti-Hariyadi et al.(2011) 5 YR t2a Susu Formula Bayi JF800182 Meutia (2008)
6 YR c3a Susu Formula Bayi JF800183 Meutia (2008) 7 E6 Formula Lanjutan Bayi AY624069 Estuningsih et al. (2006) 8 ATCC 51329 Klinis AY752937 Iversen et al. (2004)
3.3 Bahan
jenuh teknis K2CO3 (RH ±50%), Na(NO3)2 (RH ± 70%) dan BaCl2 (RH±90%)
yang diperoleh toko kimia Brataco Bogor.
3.4 Alat
Alat-alat utama yang digunakan pada penelitian ini adalah Buchi 190 Mini spray drier, timbangan digital, laminar flow, mikroskop binokuler, mikroskop polarisasi, gelas objek, autoclave, cawan petri, tabung reaksi bertutup, ose, spatula, termometer, sentrifuse 3000 rpm, plastik steril, pipet volum 5 dan 10 ml, pipet tetes, pipet mikro, tips, spatula, alumunium foil, waterbath shaker, inkubator suhu 37 ºC dan 55 ºC, penangas air, oven suhu 160-170 °C, oven suhu 105 °C, aw
meter, labu takar 50 ml, 100 ml, 500 ml, dan 1000 ml, erlenmeyer 250 ml dan 500 ml, gelas ukur 250 ml, wadah gelas bertutup, vortek, refrigerator, dan desikator.
3.5 Pelaksanaan Penelitian
Penelitian dilaksanakan dalam tiga tahap, tahap pertama adalah konfirmasi isolat dan skrining cepat ketahanan panas 8 isolat Cronobacter spp. dengan tujuan untuk mendapatkan isolat Cronobacter spp. yang paling tahan panas. Satu isolat terpilih digunakan untuk penelitian tahap selanjutnya yaitu pengujian ketahanannya terhadap proses pengeringan dan kekeringan. Tahapan pelaksanaan penelitian secara garis besar dapat dilihat pada Gambar 4 dan Lampiran 1.
3.6 Tahapan Penelitian
3.6.1 Persiapan Kultur untuk Skrining Cepat Ketahanan Panas a. Penyegaran Kultur Stok Cronobacter spp.
Gambar 4. Diagram alir penelitian Penyegaran dan rekonfirmasi kultur
Cronobacter spp. secara biokimiawi
Skriningcepat ketahanan panas isolat Cronobacter spp. dalam TSB
(pada suhu 50°C selama 30 menit)
Pengaruh pengeringan semprot (suhu inlet 160 °C dan outlet 82 °C)
Analisis:
1. Jumlah Cronobacter spp. sebelum dan setelah pengeringan semprot
2. Sintas saat Rekonstitusi suhu 27 °C dan 50 °C
Analisis:
1. Jumlah Cronobacter spp. 2. Sintas saat Rekonstitusi suhu
27 °C dan 50 °C
3. Aktivitas air (aw) susu skim
bubuk
4. Kadar air susu skim bubuk 1 isolat Cronobacter spp.
terpilih ±108- 109cfu/ml dalam 40% (w/v) susu skim steril
Pengaruh penyimpanan pada RH 50%, 70% dan 90% selama12 minggu (3 bulan)
Analisis :
dengan menginokulasikan satu ose koloni secara aseptik ke dalam BHI steril dan menginkubasinya pada suhu 37 ºC selama 24 jam.
b. Rekonfirmasi Isolat Cronobacter spp.
Kultur Cronobacter spp. yang telah disegarkan (DES b7a, DES b10, DES c13 DES d3, YR t2a, YR c3a, E-6 dan ATCC 51329) dikonfirmasikan terlebih dahulu untuk mengetahui kemurnian kultur yang digunakan. Konfirmasi meliputi pewarnaan Gram dan warna koloni pada media DFI serta TSA.
c. Perhitungan Jumlah Cronobacter spp. Isolat Cronobacter spp. yang disimpan pada media TSA miring diaktivasi
dengan menginokulasikan satu ose koloni secara aseptik ke dalam 10 ml BHI steril dan menginkubasinya pada suhu 37 ºC selama 16-17 jam sampai fase akhir log sehingga didapatkan kultur dengan populasi sel sekitar 108-109 CFU/ml (Permadi 2010). Untuk mendapatkan kultur dengan populasi sel sekitar 106-107 CFU/ml yang digunakan dalam skrining cepat ketahanan panas, sebanyak 1 ml kultur yang telah ditumbuhkan dalam media BHI diencerkan sedemikian rupa dalam 9 ml TSB steril.
3.6.2 Skrining Cepat Ketahanan Panas Isolat Cronobacter spp. pada Suhu 50 °C selama 30 menit pada Medium TSB (Modifikasi Iversen 2003). Skrining dilakukan sebagai tahap awal untuk memilih Cronobacter spp. yang paling tahan terhadap suhu 50 °C selama 30’. Isolat Cronobacter spp. yang paling tahan suhu 50 °C nantinya akan diuji ketahanan terhadap proses pengeringan dan kondisi kekeringan. Sebanyak 1 ml dari masing-masing kultur Cronobacter spp. hasil aktivasi pada langkah 3 (jumlah awal inokulum sekitar 106-107 CFU/ml) diinokulasikan ke dalam 9 ml TSB steril sebagai media pemanas, media tersebut terlebih dahulu dipanaskan dalam waterbath shaker hingga suhunya mencapai 50 oC. Suhu campuran (TSB + inokulum) dipertahankan selama 30 menit. Untuk memonitor suhu media pemanas selama pemanasan berlangsung, 1 tabung TSB kontrol dilengkapi dengan termometer.
Setelah proses pemanasan, tabung yang berisi campuran (TSB +
pemanasan. Untuk mencapai suhu sampel 0 C dapat dilakukan pendinginan dalam waktu 5-6 menit, suhu target umumnya dicapai dalam 2 menit. Setelah sampel mencapai 0 C, dilakukan langkah resusitasi pada suhu ruang (sekitar 27 C) dalam rentang waktu maksimal 60 menit (Lang & Smith 2008). Pada penelitian ini langkah resusitasi dilakukan selama 30-40 menit. Selanjutnya sebanyak 1 ml campuran (TSB+inokulum) dipipet dan kedalam 9 ml BPW steril untuk dilakukan serial pengenceran hingga 10-4 (diasumsikan terjadi penurunan populasi sel sebesar 2-3 siklus log) Tiga pengenceran terakhir dilakukan pencawanan dengan metode tuang.
Jumlah koloni awal dihitung dengan melakukan serial pengenceran kultur pada TSB hingga 10-5 dengan menggunakan pengencer BPW steril. Tiga pengenceran terakhir masing-masing dilakukan pencawanan dengan metode tuang. Selisih log10 antara jumlah koloni awal dan jumlah koloni setelah perlakukan merupakan besar penurunan jumlah koloni. Satu isolat dengan ketahanan panas tertinggi (penurunan log10 terkecil) dipilih untuk diuji ketahanannya selama proses pengeringan semprot dan penyimpanan pada RH berbeda.
3.6.3 Sintas Isolat Cronobacter sp. Terpilih Sebelum Proses Pengeringan Semprot dalam Susu SkimSaat RekonstitusiSuhu 27 °C dan 50 °C
a. Inokulasi Isolat Cronobacter sp. Terpilih dalam Susu Skim dengan
Air Bersuhu 27°C dan 50 °C
Cronobacter spp. (suhu optimum pertumbuhan 25 ºC sampai 45 ºC) sehingga pada suhu ini dianggap tidak ada penurunan populasi Cronobacter sp..Susu skim hasil rekonstitusi kemudian dilakukan pemupukan secara duplo pada media TSAYE untuk mengetahui jumlah Cronobacter sp. setelah direkonstitusi air suhu kamar (27 °C) dan 50 oC.
b. Pengamatan Morfologi Sel
Cronobacter sp. dalam sampel susu yang telah direkonstitusi dengan air bersuhu kamar (27 °C) dan 50 oC diamati morfologi selnya dengan menggunakan mikroskop cahaya dan mikroskop polarisasi serta bentuk koloni yang tumbuh pada media TSAYE.
3.6.4 Pengujian Pengaruh Proses Pengeringan Semprot dalam Medium Susu Skim (40% w/v) terhadap Sintas Cronobacter sp. Terpilih
a. Persiapan Kultur Cronobacter sp. untuk Proses Pengeringan Semprot
Persiapan inokulum bertujuan untuk mendapatkan biomassa sel maksimal, umumnya biomassa sel dihasilkan maksimal pada fase akhir lag atau saat awal fase stationer. Sebanyak 1 ose isolat Cronobacter sp. diinokulasikan dalam 100 BHI steril dan diinkubasi pada suhu 37 oC selama 16-17 jam, selanjutnya dilakukan pemanenan massa sel dengan cara melakukan sentrifugasi 45 ml kultur pada 3000 rpm selama 15 menit, pellet hasil sentrifugasi diresuspensikan ke dalam 2-3 ml BPW steril (kultur stok). Untuk menghitung jumlah mikroba awal, sebanyak 1 ml kultur di encerkan dalam BPW dengan berbagai seri pengenceran kemudian diplating (metode tuang) ke dalam media TSAYE secara duplo dan diinkubasi pada suhu 37 ºC selama 48 jam.
b. Proses Pengeringan Semprot
susu skim, sebanyak 1 ml sampel di encerkan dalam BPW dengan berbagai seri pengenceran kemudian diplating (metode tuang) ke dalam media TSAYE secara duplo dan diinkubasi pada suhu 37 ºC selama 48 jam.
Proses pengeringan semprot dilakukan dalam skala laboratorium, suhu udara inlet yang digunakan 160 ºC dan suhu udara outlet ±82 ºC didapatkan dengan mengatur flow rate selama skim milk dimasukkan (Permadi 2010). Sampel susu bubuk kering ditampung dalam botol steril yang tertutup rapat, diaduk dengan spatula steril dan disimpan pada suhu 4 ºC (Ling et al. 2010).
c. Sintas Cronobacter sp. setelah Pengeringan Semprot
Penghitungan viabilitas mikroorganisme dilakukan dengan memplating pada media TSAYE (media TSA yang suplementasi 0.6% yeast extract sebagai
Keterangan: S = penurunan jumlah koloni
N0 = Jumlah populasi mikroba sebelum proses termal
Nt = Jumlah mikroba setelah proses termal
Jumlah koloni sebelum dan setelah pengeringan hasil perhitungan pada media TSAYE yang diketahui dalam CFU/ml dikonversi dalam CFU/g untuk mengetahui jumlah Cronobacter sp. terpilih dalam susu skim bubuk kering.
d. Analisis Perubahan Sintas Cronobacter sp. dalam Susu Skim Bubuk Hasil Pengeringan Semprot Saat RekonstitusiSuhu 27 °C dan 50 °C Uji pengaruh rekonstitusi terhadap sintas Cronobacter sp. dalam susu bubuk skim hasil pengeringan semprotdilakukan dengan merekonstitusi sebanyak 2,2 gram sampel susu bubuk skim dengan menggunakan 15 ml akuades steril yang bersuhu kamar (27 °C) dan suhu 50 °C sekitar 1 menit. Jumlah Cronobacter sp. langsung dihitung dengan memplating pada medium TSAYE dan bentuk koloni yang tumbuh diamati. Dari sampel hasil rekonstitusi juga diamati
morfologi sel Cronobacter sp. setelah mengalami proses pengeringan semprot
dengan mikroskop cahaya dan mikroskop polarisasi
3.6.5 Pengaruh Penyimpanan pada RH Berbeda terhadap Sintas
Cronobacter sp. Produk susu bubuk hasil pengeringan semprot disimpan pada desikator yang
telah diatur kondisi RH nya pada RH 50%, 70% dan 90% dalam desikator yang telah diatur kelembapannya menggunakan K2CO3 (RH ±50%), Na(NO3)2 (RH ±
70%) dan BaCl2 (RH±90%). Penyimpanan dilakukan selama 3 bulan dan
pengujian sampel dilakukan setiap 1 minggu.
Analisis yang dilakukan pada susu bubuk skim selama penyimpanan meliputi viabilitas, perubahan aw dan kadar air susu bubuk, sedangkan analisis
setelah merekonstitusi susu bubuk dengan air steril suhu kamar (27°C) dan suhu 50°C meliputi : jumlah Cronobacter sp., penurunan logaritma populasi sel, morfologi sel serta bentuk koloni pada media TSAYE.
3.6.6 Pembuatan Kurva Perubahan Cronobacter sp. selama Penyimpanan dan Saat Rekonstitusi
Jumlah Cronobacter sp. selama penyimpanan dan saat rekonstitusi di dikonversi menjadi nilai log dan diplotkan pada kurva semilog dengan sumbu y menunjukkan koloni yang masih hidup setelah penyimpanan atau saat rekonstitusi (log CFU) dan sumbu x menunjukkan interval waktu (dalam minggu) berdasarkan RH penyimpanan yang diujikan. Kinetika inaktivasi/pertumbuhan mikroba selama penyimpanan pada RH konstan mengikuti reaksi ordo 1, dengan persamaan sebagai berikut :
Keterangan:
N = jumlah bakteri yang hidup
- k = konstanta laju reaksi (konstanta laju perubahan jumlah bakteri)
dengan jumlah mikroba awal (log Nt/No) pada sumbu y dan dan sumbu x menunjukkan interval waktu (dalam minggu). Selanjutnya dilakukan perhitungan nilai K dari slope kurva (y= -kt/2,303), K merupakan waktu dalam minggu yang dibutuhkan untuk meningkatkan/menurunkan jumlah Cronobacter sp. sebesar 1 siklus log. Slope kurva didapatkan dengan menggunakan persamaan dibawah ini :
Nilai slope 2,303/k , dinyatakan sebagai K (waktu penurunan desimal), sehingga :
Keterangan:
Nt = jumlah bakteri setelah penyimpanan t minggu N0 = jumlah awal bakteri
t = slope/kemiringan yang menunjukkan konstanta laju reaksi (konstanta laju perubahan jumlah bakteri)
(Hariyadi 2010)
Metode Analisis
a. Pengamatan Morfologis dengan Pewarnaan Gram (Fardiaz 1987)
Kemudian kultur ditetesi dengan Iugol dan dibiarkan selama 2 menit, dimiringkan dan selanjutnya dibilas dengan air, sisa warna yang masih ada dihilangkan dengan pemucat warna ethanol 95%, tetes demi tetes selama 10-20 detik sampai zat warna kristal tidak terlihat lagi mengalir dari kaca objek. Cuci kembali kaca objek dengan air mengalir lalu ditiriskan an selanjutnya ditetesi dengan larutan safranin selama 10-20 detik. Kaca objek kemudian dimiringkan dan kembali dibilas dengan air, tiriskan dan sisa air yang masih ada diserap dengan kertas serap. Selanjutnya preparat siap untuk diamati dibawah mikroskop.
Pengamatan dengan mikroskop (binokuler dan polarisasi) dilakukan dengan menggunakan lensa objektif minyak emersi (1000 x) dimulai dari pembesaran terendah dan berangsur-angsur diganti dengan pembesaran yang tinggi. Pengamatan dilakukan terhadap ukuran, bentuk dan cara pengelompokan (tunggal, berpasangan, rantai, bergerombol, dan sebagainya). Reaksi gram positif ditandai dengan warna sel ungu atau biru, sedangkan gram negatif berwarna merah muda. Berdasarkan keterangan sebelumnya, diketahui bahwa E. sakazakii merupakan bakteri gram negatif berbentuk batang.
b. Konfirmasi Isolat Cronobacter spp.
Konfirmasi isolat Cronobacter spp. dilakukan dengan menggoreskan 1 ose kultur dari agar miring TSA atau 1 ose kultur yang telah disegarkan dalam media BHI ke media DFI, kemudian menginkubasinya pada suhu 37 ºC selama 24 jam. Koloni yang positif Cronobacter spp. pada media DFI berwarna biru kehijauan, satu koloni terpisah yang tumbuh pada media DFI diambil 1 ose kemudian digores pada media TSA miring, koloni positif pada media TSA berwarna kuning.
c. Penghitungan Populasi dari Cronobacter spp.
N =
dimana ;
N = jumlah koloni per ml/gram C = jumlah koloni dari tiap –tiap petri
n1= jumlah petri dari pengenceran pertama yang dihitung
n2= jumlah petri dari pengenceran kedua
d = pengenceran pertama yang dihitung
d. Kadar Air
Perubahan kadar air dari susu bubuk kering selama penyimpanan diukur menggunakan metode oven. Cawan yang akan digunakan dikeringkan dalam oven selama 15 menit, selanjutnya sampel didinginkan dalam desikator dan ditimbang berat awal cawan kosong. Sampel ditimbang dengan cepat sebanyak 3 gram kemudian cawan beserta sampel dimasukkan dalam oven suhu 105 °C selama 6 jam. Cawan didinginkan dalam desikator selama 15 menit dan kemudian ditimbang. Cawan dan sampel dimasukkan kembali ke dalam oven sampai diperoleh berat konstan atau sampai perbedaan berat 0,2 mg. Kadar air dihitung dengan rumus :
Kadar Air (% b.k) = x 100%
(AOAC 1994)
e. Aktivitas Air (aw)
Pengukuran aw dilakukan menggunakan aw meter yang telah dikalibrasi.
Kalibrasi aw meter dengan menggunakan NaCl jenuh yang memiliki aw sebesar
0,75 dan BaCl2 pada aw 0,90. Setelah alat dikalibrasi, sampel susu bubuk kering
dimasukkan ke dalam wadah/chamber pada aw meter kemudian ditutup dan
ditunggu beberapa menit sampai muncul nilai aw sampel yang dianalisis (Nielsen
3.7 Rancangan Percobaan
Rancangan percobaan yang digunakan pada penelitian ini adalah
1. Rancangan Acak Lengkap (RAL) satu faktor (Anova Single Factor) dengan 2 kali ulangan dan tiap ulangan dilakukan secara duplo, untuk pengujian tahapan skrining cepat isolat Cronobacter spp., penurunan logaritma saat rekonstitusi Cronobacter spp. sebelum dan sesudah pengeringan semprot, dan selama penyimpanan diberbagai RH. Data yang diperoleh dianalisis dengan menggunakan Analysis of Variance (ANOVA) dan diuji lanjut berganda Duncan (Duncan Multiple Range Test/DMRT) . Model rancangan yang digunakan adalah sebagai berikut :
Keterangan:
Yij = Nilai pengamatan dari perlakuan ke-i dan ulangan ke-j µ = Nilai rataan umum populasi
τi = Pengaruh perlakuan ke-i
εij = Galat pengamatan atau percobaan pada perlakuan ke-i dengan
ulangan ke-j.
2. Rancangan Faktorial Acak Lengkap (RFAL) dengan 2 kali ulangan dan tiap ulangan dilakukan secara duplo, untuk pengujian tahapan penyimpanan pada berbagai kondisi RH. Data yang diperoleh dianalisis dengan menggunakan Analysis of Variance (ANOVA) dan diuji lanjut berganda Duncan (Duncan Multiple Range Test/DMRT). Model rancangan yang digunakan adalah sebagai berikut :
Keterangan:
Yijk = Nilai pengamatan dari perlakuan ke-i dan ulangan ke-j Yijk = µ + Ai + Bj + ABij+ +εijk
µ = Nilai rataan umum populasi Ai = Pengaruh faktor A level ke-i
Bi = Pengaruh faktor B level ke-j
ABij = Pengaruh interaksi faktor A dan B
εijk = Galat pengamatan atau percobaan pada perlakuan ke-i dengan
4. HASIL DAN PEMBAHASAN
4.1Rekonfirmasi Isolat Cronobacter spp.
Rekonfirmasi isolat Cronobacter spp. dilakukan berdasarkan pengamatan morfologi dan karakteristik biokimia. Cronobacter spp. merupakan bakteri Gram negatif yang berbentuk batang, setelah inkubasi pada suhu 37 °C selama 24 jam pada media BHI (Brain Heart Infusion) mampu membentuk endapan atau sedimen di bagian dasar tabung. Pada media kromogenik DFI (Druggan Forsythe Iversen) isolat Cronobacter spp. membentuk koloni berwarna hijau-biru yang berfluorosen, sedangkan pada media TSA (Tryptone Soy Agar) mampu membentuk koloni berwarna kuning berdiameter 1,5-3 mm. Hasil rekonfirmasi isolat Cronobacter spp. dapat dilihat pada Tabel 4. sedangkan gambar hasil konfirmasi dapat dilihat pada Lampiran 2.
Tabel 4. Hasil rekonfirmasi isolat Cronobacter spp.
No Karakteristik Hasil
Kemampuan tumbuh pada medium BHI (Brain Heart Infusion) pada suhu 37 °C selama 24 jam
Kemampuan tumbuh pada media DFI (Druggan Forsythe Iversen) Kemampuan tumbuh pada media TSA (Tryptone Soy Agar)
4.2Skrining Cepat Ketahanan Panas Isolat Cronobacter spp.