ABSTRAK
ISOLASI DAN IDENTIFIKASI ENZIM DARI Trichoderma koningii SEBAGAI PENGHAMBAT JAMUR PATOGENBUSUK BUAH KAKAO
OLEH
ARIYANTI
Produksi kakao di Indonesia terus menurun, yang disebabkan karena adanya penyakit busuk buah kakao. Pengendalian penyakit busuk buah dapat dilakukan dengan menggunakan mikroorganisme antagonis sebagai agen pengendali hayati, salah satunya dengan menggunakan jamur Trichodermakoningii. Hasil isolasi jamur patogen dari busuk buah kakao membenarkan sebagai Phytophthora palmivora. Uji antagonis Trichoderma koningii terhadap jamur patogen tersebut menunjukkan penghambatan sebesar 85,71%. Uji terhadap empat enzim, yaitu: selulase, amilase, protease, dan lipase, aktivitas amilase dan protease tidak teramati. Sedangkan aktivitas enzim selulase dan lipase teramati secara signifikan dengan aktivitas spesifik masing- masing sebesar 2,50 U/mg dan 1,22 U/mg. Pemurnian dilakukan terhadap enzim dominan selulase yang memiliki aktivitas spesifik tertinggi. Hasil pemurnian secara fraksinasi menggunakan ammonium sulfat, didapatkan fraksi 60-80%, menunjukkan aktivitas spesifik sebesar 2,92 U/mg. Uji antagonis enzim terhadap patogen menunjukkan bahwa ekstrak kasar enzim selulase lebih baik dalam menghambat patogen dibandingkan enzim hasil fraksinasi.
ABSTRACT
ISOLATION AND IDENTIFICATION OF ENZYMES FROM Trichoderma koningii WHICH INHIBITED PATHOGENIC FUNGUS ROTTEN OF
COCOA
By
Ariyanti
Cocoa production in Indonesia continues to decline, which is due to the cocoa pod disease. Control of fruit rot disease can be overcame by using antagonistic microorganisms as biological control agents, such as fungus Trichoderma koningii. A pathogenic fungi isolated from rotten fruit of the cocoa was justify as
Phytophthora palmivora. Antagonists test by using Trichoderma koningii against the pathogen showed inhibition for 85.71%. Enzymatic test of four enzymes from
Trichoderma koningiii: cellulase, amylase, protease, and lipase; nor activity of amylase and protease. While cellulase and lipase was observed significantly with each specific activity of 2.50 U / mg and 1.22 U / mg, respectively purification was carried out for the dominant cellulase as the enzyme with highest activity. Results of a purification using ammonium sulfate fractionation, fraction 60-80%, showed a specific activity of 2.92 U / mg. Antagonists test against the pathogen showed that the crude extract of cellulase enzyme is better at inhibiting pathogens compared with the fractionation extract.
ISOLASI DAN IDENTIFIKASI ENZIM DARI Trichoderma koningii SEBAGAI PENGHAMBAT JAMUR PATOGEN BUSUK BUAH KAKAO
Oleh
ARIYANTI
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA SAINS
pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas lampung
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
RIWAYAT HIDUP
Penulis merupakan putri dari pasangan Bapak Dasiman dan Ibu Budiati, yang dilahirkan di desa Banyumas Kabupaten Pringsewu pada tanggal 21 januari 1992. Penulis
merupakan anak keempat dari enam bersaudara dan diberi nama Ariyanti.
Penulis menempuh pendidikan Sekolah Dasar (SD) Negeri Tri Tunggal Jaya pada kelas satu sampai kelas dua pada tahun 1999, kemudian pindah dan
menyelesaikan pendidikan sekolah dasar di Sekolah Dasar (SD) Negeri 2 Banyumas pada tahun 2004, Sekolah Menengah Pertama (SMP) Negeri 1
Banyumas pada tahun 2007 dan Sekolah Menengah Atas (SMA) Negeri 1 Gedong Tataan pada tahun 2010. Penulis kemudian terdaftar sebagai mahasiswa Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung melalui jalur PKAB (Penelusuran Kemampuan Akademik dan Bakat) pada tahun 2010.
menjadi asisten praktikum Biokimia mahasiswa Kimia 2012, mahasiswa Biologi 2013, mahasiswa Kedokteran 2014 dan mahasiswa STIKES Muhammadiyah 2012 pada tahun ajaran 2013/2014, selanjutnya penulis menjadi asisten praktikum Biokimia Umum mahasiswa Teknik Pertanian 2014, mahasiswa Teknik Hasil Pertanian 2014, mahasiswa STIKES Muhammadiyah 2013 dan mahasiswa Kimia 2013 pada tahun ajaran 2014/2015. Selain itu, penulis pernah mengikuti beberapa organisasi mahasiswa. Berikut beberapa organisasi dan amanah yang
dipercayakan kepada penulis :
1. Anggota Muda Rohani Islam (Amar ROIS) FMIPA 2010-2011. 2. Kader Muda HIMAKI (KAMI) FMIPA pada tahun 2010-2011.
3. Himpunan Mahasiswa Kimia (HIMAKI) FMIPA sebagai anggota bidang Kesekretariatan pada tahun 2011-2012.
4. Badan Eksekutif Mahasiswa (BEM) FMIPA sebagai Anggota Departemen Kewirausahaan 2011-2012.
5. Badan Eksekutif Mahasiswa (BEM) FMIPA sebagai Sekretaris Departemen Kesekretaritan 2011-2012
6. Rohani Islam (ROIS) FMIPA sebagai Anggota biro Akademik pada tahun 2011-2012.
7. Himpunan Mahasiswa Kimia (HIMAKI) FMIPA sebagai anggota bidang Kesekretariatan pada tahun 2012-2013
8. Badan Eksekutif Mahasiswa (BEM) FMIPA sebagai Sekretaris Departemen Kewirausahaan 2012-2013
PERSEMBAHAN
Dengan mengharapkan ridho dan rahmat Allah SWT, ananda
persembahkan karya sederhana teruntuk...
Kedua orangtua, Bapak Dasiman dan Ibu Budiati
Terimakasih untuk doa, kasih sayang, dan pengorbanan yang tulus
selama mendidik dan membesarkan ananda
Bapak Mulyono, Ph.D. dan Bapak Ibu dosen Jurusan Kimia
Terimakasih atas ilmu dan dedikasinya selama ananda menempuh
pendidikan di Jurusan kimia
Kakak- kakak, mbak dan adik- adikku Terimakasih untuk semua
doa, dukungan, pengorbanan dan semangatnya
Paman ,Bibi, dan keluarga besar Terimakasih untuk doa,
dukungan, pengorbanan dan kesabarannya dalam mendidik
ananda.
MOTO
“Sesungguhnya orang
-orang yang berkata
“
Tuhan kami
adalah Allah,” kemudian mereka tetap istiqomah, tidak
ada rasa khawatir pada mereka, dan mereka tidak pula
bersedih hati. Mereka itulah para penghuni surga, kekal
di dalamnya; sebagai balasan atas apa yang telah
mereka kerjakan
” (QS.
Al-Ahqaf:13-14)
“
Wahai orang-orang yang beriman jika kamu menolong
(agama) Allah, niscaya Dia akan menolongmu dan
meneguhkan kedudukanmu” (QS. Muhammad: 7)
“
Barang siapa yang memudahkan urusan saudaranya di
dunia, niscaya Allah akan memudahkan urusannya didunia
dan di akhirat”
(HR. Muslim)
“
Hendaklah kalian berlaku jujur, karena kejujuran itu
menunjukkan kepada kebaikan, dan kebaikan itu
SANWACANA
Assalamualaikum Wr. Wb.
Segala puji bagi Allah, Rabb semesta alam atas rahmat-Nya, hidayah- Nya, nikmat- Nya dan kasih sayang- Nya yang tak terhingga. Shalawat serta salam senantiasa penulis haturkan kepada Nabi Muhammad SAW yang telah menyampaikan risalah dan menasihati umat semoga senantiasa menjadi suri tauladan bagi penulis. Kebersamaan dalam tali persaudaraan yang senantiasa terjaga hingga hari ini sehingga penulis dapat menyelesaikan skripsi yang berjudul Isolasi dan Identifikasi Enzim dari Trichoderma koningii Sebagai
Penghambat Jamur Patogen Busuk Buah Kakao.
Penyusunan skripsi ini tidak terlepas dari jasa baik segenap pihak baik moral maupun spiritual, baik berupa bimbingan, motivasi dan doa yang senantiasa berguna bagi penulis hingga saat ini dan di masa yang akan datang.
Teriring doa yang tulus, penulis mengucapkan terimakasih kepada:
1. Kedua orangtua, Bapak Dasiman dan Ibu Budiati tercinta yang senantiasa memberikan kasing sayang, cinta, doa, nasihat, kesabaran keikhlasan serta semua dedikasi dalam mendidik ananda. Semoga Allah membalas cintanya dengan Surga- Nya.
2. Bapak Mulyono, Ph.D. selaku dosen pembimbing penulis atas semua
diberikan dari awal penelitian hingga skripsi ini dapat terselesaikan. Semoga Allah membalas kebaikan beliau dengan kebaikan yang tidak ternilai. 3. Bapak Dr. Eng. Suripto Dwi Yuwono. M. T. selaku pembahas I yang telah
memberikan masukan, baik saran maupun kritik, serta nasihat dan kesabaran beliau dalam mendidik dan membimbing penulis, sehingga skripsi ini dapat terselesaikan. Semoga Allah membalas kebaikan beliau.
4. Ibu Dra. Aspita Laila, M. S. selaku pembahas II yang telah memberikan masukan, baik saran maupun kritik, serta nasihat dan kesabaran beliau dalam mendidik dan membimbing penulis, sehingga skripsi ini dapat terselesaikan. Semoga Allah membalas kebaikan beliau.
5. Bapak Dr. Eng. Suripto Dwi Yuwono, M.T. selaku Ketua Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam.
6. Ibu Noviany, S.Si., M.Si., Ph.D. selaku Pembimbing Akademik dalam menyelesaikan masa studi penulis di Jurusan Kimia.
7. Bapak Prof. Suharso, Ph.D., selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam.
8. Bapak Ibu Dosen Jurusan Kimia FMIPA Unila atas seluruh dedikasi dan ilmu yang diberikan selama penulis menempuh masa studi. Semoga Allah
melimpahkan baraakah kepada Bapak dan Ibu.
9. Kakanda – kakanda tercinta MasYuli, Mas Pawit, Mbak Ruri dan adindaku Sulis dan Edi, yang senantiasa mendukung memberikan doa serta
10.Paman Lan, Bibi Pon, Bibi Tum, Paman Mangun, Mbah Isah serta seluruh keluarga besar yang tidak dapat penulis sebutkan satu per satu, terimakasih untuk kasih sayang, bimbingan, didikkan, pengorbanan, keikhlasan dan kesabarannya, sehingga penulis dapat menyelesaikan skripsi ini.
11.Keponakan- keponakan tante, Bryan Nurhidayat, Calissta Nur Aprilia, Aqila Rihadatul Najwa, dan Bagas Prio Pambudi, serta sepupu- sepupu yang telah memberikan kecerian, kebersamaan dan semangat yang luar biasa.
12.Sahabat- sahabat terbaikku Pipin, K.Arina, Loli, Fafai, Sifa, Surti, dan Sisil, terimakasih untuk kebersamaan, kasih sayang, dukungan, keceriaan, kesabaran dan keikhlasan. Semoga Allah limpahkan baraakah.
13.Rekan kerja penelitian Adetia Fatmawati, Rani Anggraini, Ajeng Ayu Miranti, Ayu Berliana , Aziz, Bu Syamsinar, Bu Wiria Syaputri, dan Pak Iwan
terimakasih untuk kebersamaan, bantuan dan kerjasamanya
14.Keluarga besar kimia (HIMAKI), adik-adik, kakak-kakak serta teman-teman kimia 2010 Chemistry Imut (Chemut), Ely setiawati, Indah Aprianti, Funda Elisya, Leni Astuti, Nur Robiah, Wynda Dwi Anggraini, Faradilla Syani, Purniawati, Chintia Yolanda, Sevina Silvi, Chyntia Gustianda, Putri Heriyani, Rani Anggraini, Adetia Fatmawati, Martha Silvina, Rini Handayani, Rina Rachmawati Sutisna, Desi Meriyanti, Fauziyah Mu’Min Shiddiq, Lailatul
Hasanah, Widya Afriliani, Rahmat Kurniawan, M. Nurul Fajri, Agung
Supriyanto, Ruli Prayetno, serta teman kimia 2010 yang telah pindah jurusan, Yussi Fitria, Putri Rahmatika, Aditya Putra P., Ucep Saifulloh, Maria
15.Bapak dan Ibu S2 Biokimia, Bu Syamsinar, Bu Wiria Syaputri, Pak Iwan, Bu Nanik, Mbak Naris, Bu Nurhaeni, dan Pak Sigit, terimakasih untuk dukungan, pengalaman, doa dan semangat yang tak terhenti.
16.Teman- teman Laboratorium Biokimia Desi Meryanti, Rina Rachmawati, Mbak Putri, April, Uswa, dan Ana
17.Guru dan Saudari –saudari lingkaran cinta, terimakasih untuk dukungan, cinta, ilmu, dan kebersamaan yang tak ternilai.
18.Rekan- rekan BEM FMIPA Unila 2011- 2013, ROIS FMIPA Unila 2011-2012 dan seluruh Panitia KWI 2013 terimakasih untuk persaudaraan, keceriaan, kerjasama dan kebersamaan kita.
19.Teman-teman kosan lama Mbak Anna, dan Mbak Damay, kosan baru Cici, Riza, Sasa dan Hapin yang selalu bersama dan teman-teman Kuliah Kerja Nyata atas kekeluargaan dan kebersamaan selama ini.
20.Pak John Isman, Bu Yus, Mbak Nora, Mas Nomo, dan Pak Gani terimakasih atas seluruh bantuan yang diberikan kepada penulis.
21.Seluruh keluarga besar Jurusan Kimia angkatan 2008- 2015. 22.Almamater tercinta, Universitas Lampung
Semoga Allah SWT membalas atas kebaikan yang telah diberikan kepada penulis. Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan, akan tetapi penulis berharap semoga skripsi ini dapat berguna dan bermanfaat bagi kita semua. Aamiin
Wassalamualaikum Wr. Wb.
Bandar Lampung, November 2015
DAFTAR ISI
Halaman
DAFTAR TABEL ... iv
DAFTAR GAMBAR ... v
DAFTAR LAMPIRAN ... vi
I. PENDAHULUAN A. Latar Belakang ... 1
B. Tujuan Penelitian ... 3
C. Manfaat Penelitian ... 3
II. TINJAUAN PUSTAKA A. Penyakit Busuk Buah Kakao ... 4
B. Biopestisida ... 6
C. Trichoderma koningii ... 7
D. Mekanisme Antagonis Trichoderma koningii ... 10
E. Enzim ... 11
F. Enzim Selulase ... 16
G. Enzim Amilase ... 18
H. Enzim Protease ... 19
I. Enzim Lipase ... 19
J. Isolasi Enzim ... 20
III. METODE PENELITIAN A. Waktu dan Tempat Penelitian ... 22
B. Alat dan Bahan ... 22
ii
a. Pembuatan Medium ... 23
1. Pembuatan Medium Padat Saboraud Agar ... 23
2. Pembuatan Medium Cair ... 23
c. Isolasi Jamur Patogen Busuk Buah Kakao ... 25
d. Penumbuhan Jamur Antagonis ... 26
e. Uji antagonis Jamur Trichoderma terhadap Jamur Patogen ... 26
f. Produksi Enzim ... 27
5. UjiAktivitasEnzim Lipase ... 29
i. Pemurnian Enzim ... 30
j. Uji Antagonis Ekstrak Kasar Enzim ... 32
Diagram Alir Prosedur Penelitian ... 33
IV. Hasil dan Pembahasan A. Isolasi Jamur Patogen Busuk Buah Kakao ... 34
B. Penumbuhan Jamur ... 35
C. Uji Antagonis Jamur Trichoderma koningii ... 35
D. Penentuan Pertumbuhan Sel Jamur Trichoderma koningii ... 37
E. Uji Aktivitas Ekstrak Kasar Enzim ... 40
F. Uji Aktivitas Ekstrak Kasar Enzim Selulase ... 40
G. Uji Aktivitas Ekstrak Kasar Enzim Lipase ... 42
iii
I. Pemurnian Enzim Selulase ... 44 J. Uji Antagonis Enzim ... 46 V. SIMPULAN DAN SARAN
A. Simpulan ... 49 B. Saran ... 50
DAFTAR TABEL
Tabel Halaman
1. Pertumbuhan Sel Jamur Trichoderma koningii ... 38
2. Aktivitas unit, Spesifik dan Kadar Protein Enzim Selulase Hasil Sampling ... 40
3. Aktivitas unit, Spesifik dan Kadar Protein Enzim Lipase Hasil Sampling ... 42
4. Aktivitas Enzim Selulase Hasil Fraksinasi dengan Garam Ammonium Sulfat ... 45
5. Absorbansi BSA (Bovine Serum Albumine) ... 58
6. Absorbansi Hasil Pengukuran Kurva Standar Glukosa ... 60
DAFTAR LAMPIRAN
Lampiran Halaman
1. Hasil Uji Enzim Amilase ... 56
2. Kurva Standar BSA dan Glukosa ... 58
3. Hasil Uji Enzim Lipase ... 63
DAFTAR GAMBAR
Gambar Halaman
1. Gejala Penyakit Busuk Buah Kakao ... 5
2. Morfologi Koloni Phytophthora sp. pada PDA Umur 12 Hari ... 6
3. Hubungan Antara Suhu dan Aktivitas Enzim ... 14
4. Hubungan Kecepatan Reaksi dengan pH ... 14
5. Hubungan Laju Reaksi dengan Konsentrasi Enzim ... 15
6. Mekanisme Hidrolisis Selulosa oleh Enzim Selulase ... 17
7. Skema Pengendapan Protein Enzim dengan Ammonium Sulfat ... 32
8. Diagram Alir Prosedur Penelitian ... 33
9. Hasil Isolasi Jamur Patogen Busuk Buah Kakao ... 34
10. Hasil Uji Antagonis Jamur ... 36
11. Kurva Pertumbuhan Sel Jamur Trichoderma koningii ... 37
12. Aktivitas Unit dan Spesifik Enzim Selulase Hasil Sampling ... 40
13. Aktivitas Unit dan Spesifik Enzim Lipase Hasil Sampling ... 42
14. Hasil Pemurnian Menggunakan Garam Ammonium Sulfat ... 45
15. Hasil Uji Antagonis Ekstrak Kasar Enzim ... 46
16. Uji Antagonis Enzim Hasil Fraksinasi Tertinggi ... 47
17. Uji Enzim Amilase yang Tidak Memiliki Aktivitas ... 56
18. Hasil Uji Enzim Protease ... 57
19. Kurva Standar BSA ... 59
20. Kurva Standar Glukosa ... 60
21. Hasil Titrasi Enzim Lipase ... 63
I. PENDAHULUAN
A. Latar Belakang
Kakao (Theobroma cacao L.) adalah salah satu produk pertanian yang memiliki peranan yang cukup penting dan dapat diandalkan dalam mewujudkan program pembangunan pertanian. Produksi kakao Indonesia pada tahun 2010 mengalami peningkatan dari 809.583 ton pada tahun 2009 menjadi 844.626 ton target produksi kakao ini sebenarnya jauh dari ideal, jika dibandingkan dengan luas lahan perkebunan kakao di Indonesia yang sudah mencapai 1,5 juta hektar, dengan luas lahan sebesar itu seharusnya Indonesia mampu menghasilkan kakao sebanyak 1 juta ton di tahun 2011 dengan catatan lahan perkebunan dikelola dengan baik (BPTP, 2010). Namun, pada kenyataannya produksi kakao di Indonesia terus menurun. Hal ini disebabkan karena adanya penyakit busuk buah kakao yang disebabkan oleh jamur Phythopthora palmivora (Manti, 2009; Harmel dan Nasir, 2009).
2
Pengendalian patogen secara kimiawi cukup efektif, tetapi menimbulkan masalah baru yaitu menyebabkan pencemaran lingkungan dan mematikan organisme lain yang bermanfaat (Sukamto dan Pujiastuti, 2004). Menurut penelitian yang dilakukan oleh Sukamto dan Pujiastuti tahun 2004, pengendalian penyakit busuk buah dapat dilakukan dengan menggunakan mikroorganisme antagonis sebagai agen pengendali hayati, salah satunya dengan menggunakan jamur Trichoderma koningii. Pengendalian ini lebih efektif dibandingkan dengan penggunaan pestisida kimiawi karena tidak menyebabkan pencemaran lingkungan dan organism lain yang bermanfaat dapat tetap hidup.
Jamur Trichoderma koningii merupakan salah satu jamur saprofit tanah yang hidup bebas dan memiliki interaksi yang tinggi dalam sistem perakaran, dan tanah. Menurut penelitian yang dilakukan oleh Harman tahun 2004, Trichoderma koningii dapat digunakan sebagai agen hayati yang mampu mengendalikan
penyakit tanaman karena memiliki beberapa mekanisme antagonis seperti kompetisi, mikoparasitme, dan antibiosis. Selain itu, Trichoderma koningii juga dapat menghasilkan toksin, enzim serta mampu menghambat atau mendegradasi enzim yang sangat penting bagi jamur patogen tanaman. Trichoderma koningii
memiliki kemampuan sebagai agen pengurai sebab dapat menghasilkan enzim
chitinolitik dan selulase yang dapat menguraikan selulosa, hemiselulosa dan lignin menjadi senyawa yang lebih sederhana sehingga dapat menghambat pertumbuhan jamur patogen seperti jamur penyebab busuk buah kakao.
Oleh karena itu, pada penelitian ini telah dilakukan uji antagonis jamur
3
enzim yang dihasilkan oleh jamur Trichoderma koningii dan uji antagonis enzim terhadap jamur patogen.
B.Tujuan Penelitian
Tujuan dari penelitian ini adalah
a) Mengisolasi jamur penyebab busuk buah kakao.
b) Mengetahui daya antagonis jamur Trichoderma koningii terhadap
Phythopthora palmivora secara in vitro.
c) Mengetahui enzim yang dihasilkan oleh jamur Trichoderma koningii
dan pengaruhnya terhadap pertumbuhan jamur Phythopthora palmivora.
C.Manfaat Penelitian
Manfaat yang diperoleh dari penelitian ini adalah
a) Memberikan informasi mengenai jenis enzim dari Trichoderma koningii
dalam menghambat jamur patogen pada kakao.
II. TINJAUAN PUSTAKA
A.Penyakit Busuk pada Buah Kakao
Busuk buah adalah penyakit yang dominan dalam budidaya kakao di Indonesia. Besarnya kerugian, bervariasi antara 26 % dan 50 %. Penyakit busuk buah kakao disebabkan oleh jamur Phytophthora palmivora (Fauzan, 2013). Besarnya kerugian akibat penyakit busuk buah kakao disebabkan oleh kompleksnya epidemi penyakit tersebut. Phytophthora palmivora dapat menyerang semua organ atau bagian tanaman seperti akar, daun, batang, ranting, bantalan bunga, dan buah pada semua tingkatan umur (Opeke and Gorenz, 1974).
Pada serangan buah yang belum matang Phytophthora palmivora dapat
menginfeksi seluruh permukaan buah, namun bagian paling rentan adalah pangkal buah. Permukan buah yang terinfeksi patogen akan berwarna coklat kehitaman, menjadi busuk basah dan selanjutnya menyebar menutupi seluruh permukaan buah. Pada bagian yang menghitam akan muncul lapisan berwarna putih bertepung yang merupakan spora jamur sekunder dan juga sporangium
Phytophthora palmivora (Semangun, 2000).
5
perkembangan buah, kemudian bercak berkembang dengan cepat menutupi jaringan internal dan seluruh permukaan buah termasuk biji. Patogen menyerang jaringan internal buah dan menyebabkan biji kakao berkerut serta berubah warna, buah-buah yang sakit akhirnya menjadi hitam dan mumi. Gejala busuk buah dapat ditemukan dari ujung, pangkal, tengah, buah muda, tua, buah yang berada di bawah, di tengah maupun di atas pohon. Bila buah kakao terserang dibelah maka nampak biji- biji dan daging buah busuk berwarna cokelat. Pada infeksi lanjutan, biji kakao akan berubah warna dan berkerut (Bowers et al., 2001).
Penyebaran penyakit Phytophthora palmivoradapat melalui air, semut, tikus, tupai, dan bekicot yang dijumpai di perkebunan kakao. Selama daur hidupnya,
Phytophthora palmivora menghasilkan beberapa inokulum yang berperan dalam perkembangan penyakit pada kakao, yaitu miselium sporangium, oospore, dan klamidospora. Seperti disampaikan pada Gambar 1 (Rubiyo, 2013).
(a) (b) (c) (d)
6
Morfologi Phytophthora palmivora yaitu sporangium mempunyai panjang 35-40 µm dan lebar 23-28 µm, nisbah panjang/lebar 1,4-1,6 ukuran ini bervariasi sesuai dengan medium, inang, umur biakan, lengas, dan cahaya. Panjang pedikel 2-10 µm. Umumnya di alam sporangium menghasilkan 15-30 spora kembara.
Sporangium dapat pula menjadi sporangium sekunder atau konidium seperti pada Gambar 2 (Waterhouse, 1974).
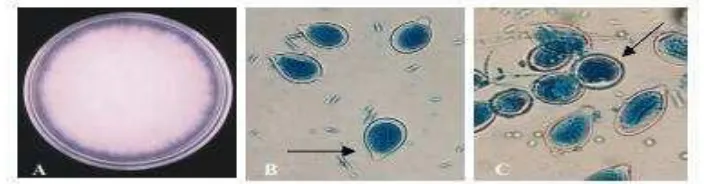
Gambar 2.A. Morfologi koloni Phytophthora sp. pada PDA umur 12 hari. B. Sporangia mempunyai papila yang jelas dengan tangkai pendek(panah). C. Klamidospora (panah). Perbesaran B dan C: 400x(Sumber: Umayah, 2006).
B. Biopestisida
Dewasa ini telah banyak diketahui secara parsial tentang pengendalian organisme pengganggu tanaman menggunakan biopestisida berupa pestisida nabati dan agens hayati, sedangkan pemupukan menggunakan pupuk hayati antara lain
pemanfaatan mikroorganisme efektif, baik berasal dari daerah subtropis maupun tropis, yang didalamnya mengandung beberapa macam mikroorganisme antara lain; bakteri selulotik, jamur selulotik, bakteri fotosintetik, bakteri asam laktat, bakteri pelarut fosfat, dan lain lain (Prabowo, 2008).
7
sementara. Disisi lain, dampak negatif yang ditimbulkan sangat besar karena dapat menyebabkan kerusakan sifat fisik, kimia, dan biologi tanah sehingga berimbas pada semakin luasnya lahan kritis di Indonesia. Hasil penelitian yang dilakukan oleh pusat penelitian tanah dan agroklimat menunjukkan bahwa akibat penggunaan pupuk anorganik yang berlebihan menyebabkan sebagian besar lahan pertanian di Indonesia kandungan C organiknya kurang dari 1%, artinya lahan tersebut meskipun nantinya di pupuk dengan pupuk anorganik berapapun besarnya, produksinya tidak akan meningkat (Prihandarini, 2000).
Trichoderma koningii merupakan jamur antagonis yang banyak terdapat di tanah dan banyak digunakan untuk mengendalikan jamur patogen tular tanah
(Nuryati, 2000). Dari hasil penelitian yang dilakukan Prabowo tahun 2008, diketahui bahwa penggunaan jamur antagonis Trichoderma koningii efektif mengendalikan penyakit tular tanah seperti Fusarium sp.
C. Trichoderma koningii
Menurut tinjauan umum Trichoderma koningii diklasifikasikan sebagai berikut. Divisi : Amastigomycota
Sub kelas :Deutromycetes
Ordo :Monoliales
Famili : Monoleaceae
Genus : Trichoderma
Spesies : Trichoderma koningii
8
hijau biru Trichoderma koningii juga berbentuk oval dan memiliki sterigma atau phialid tunggal dan berkelompok (Nurhaedah, 2002).
Morfologi Trichoderma koningii. Koloni Trichoderma koningii pada media agar pada awalnya terlihat berwarna putih selanjutnya miselium akan berubah menjadi kehijau-hijauan lalu terlihat sebagian besar berwarna hijau ada ditengah koloni dikeliling miselium yang masih berwarna putih dan pada akhirnya seluruh
medium akan berwarna hijau (Nurhayati, 2001). Koloni mencapai diameter lebih dari 5 cm dalam waktu 9 hari, semula berwarna hialin (transparan), kemudian menjadi putih kehijauan dan selanjutnya hijau redup terutama pada bagian yang menunjukkan banyak terdapat konidia. Konidia dapat bercabang menyerupai piramida yaitu pada bagian bawah cabang lateral yang berulang-ulang, sedangkan kearah ujung percabangan menjadi bertambah pendek. Mikroorganisme antagonis terutama Trichoderma koningii mempunyai kemampuan berkompetisi dengan patogen terbawa tanah terutama dalam mendapatkan nitrogen dan karbon. Selain itu, cendawan Trichoderma koningii mempunyai kemampuan untuk menghasilkan enzim hidrolitik β 1,3glukanase, kitinase, dan selulase. Enzim-enzim inilah yang
secara aktif merusak sel-sel jamur sehingga dengan mudah jamur Trichoderma koningii dapat melakukan penetrasi ke dalam hifa jamur inangnya (Ismail, 2008).
9
Pemanfaatan Trichoderma koningii sebagai agen pengendali hayati jamur patogen
Phytopthora infestans merupakan salah satu alternatif penting untuk
mengendalikan jamur patogen tersebut tanpa menimbulkan dampak negatif terhadap lingkungan (Purwantisari, 2009).
Trichoderma koningii adalah jamur saprofit tanah yang secara alami merupakan parasit yang menyerang banyak jenis jamur penyebab penyakit tanaman
(spektrum pengendalian luas). Jamur Trichoderma koningii dapat menjadi hiper parasit pada beberapa jenis jamur penyebab penyakit tanaman. Pertumbuhannya sangat cepat dan tidak menjadi penyakit untuk tanaman tingkat tinggi.
Mekanisme antagonis yang dilakukan adalah berupa persaingan hidup, parasitisme, antibiosis, dan lisis (Trianto dan Sumantri, 2003).
Aplikasi dapat dilakukan melalui tanah secara langsung, melalui perlakuan benih maupun melalui kompos. Selain itu, Trichoderma koningii sebagai jasad
antagonis mudah dibiakkan secara massal, mudah disimpan dalam waktu lama dan dapat diaplikasikan sebagai seed furrow dalam bentuk tepung atau granula/butiran.
Potensi jamur Trichoderma koningii sebagai jamur antagonis yang bersifat
preventif terhadap serangan penyakit tanaman menjadikan jamur tersebut semakin luas digunakan oleh petani dalam usaha pengendalian organisme pengganggu tumbuhan (OPT). Disamping karakternya sebagai antagonis diketahui pula bahwa
10
kesadaran petani akan arti penting perlindungan preventif perlahan telah tumbuh (Ismail, 2008).
D.Mekanisme Antagonis Trichoderma koningii
Mikroorganisme antagonis adalah mikroorganisme yang mempunyai pengaruh merugikan terhadap mikroorganisme lain yang tumbuh dan berasosiasi dengan mikroorganisme tersebut. Antagonis meliputi (a) kompetisi nutrisi atau sesuatu yang lain dalam jumlah terbatas tetapi tidak diperlukan oleh organisme
pengganggu tanaman, (b) antibiosis sebagai hasil dari pelepasan antibiotika atau senyawa kimia yang lain oleh mikroorganisme dan berbahaya bagi organisme pengganggu tanaman, dan (c) predasi, hiperparasitisme, dan mikroparasitisme atau bentuk yang lain dari eksploitasi langsung terhadap organisme pengganggu tanaman oleh mikroorganisme yang lain ( Gultom, 2008).
Trichoderma koningii merupakan salah satu jamur antagonis yang telah banyak diuji coba untuk mengendalikan penyakit tanaman. Sifat antagonis cendawan Trichoderma koningii telah diteliti. Inokulasi Trichoderma koningii ke dalam tanah dapat menekan serangan penyakit layu yang menyerang di
11
Menurut Harman (1998), mekanisme utama pengendalian patogen tanaman yang bersifat tular tanah dengan menggunakan cendawan Trichoderma koningi dapat terjadi melalui :
a.) Mikoparasit (memarasit miselium cendawan lain dengan menembus dinding sel dan masuk ke dalam sel untuk mengambil zat makanan dari dalam sel sehingga cendawan akan mati).
b.) Menghasilkan antibiotik seperti alametichin, paracelsin, trichotoxin yang dapat menghancurkan sel cendawan melalui pengrusakan terhadap permeabilitas membran sel dan enzim selulase yang dapat menyebabkan lisis dinding sel. c.) Mempunyai kemampuan berkompetisi memperebutkan tempat hidup dari
sumber makanan.
d.) Mempunyai kemampuan melakukan interfensi hifa. Hifa Trichoderma koningii akan mengakibatkan perubahan permeabilitas dinding sel.
Trichoderma koningii mempunyai sifat mikoparasitik.
Mikoparasitik adalah kemampuan untuk menjadi parasit cendawan lain. Sifat inilah yang dimanfaatkan sebagai biokontrol terhadap jenis-jenis cendawan fitopatogen.
E. Enzim
12
1. Klasifikasi enzim
Klasifikasi enzim dapat dibedakan sebagai berikut :
a. Berdasarkan tempat bekerjanya enzim dibedakan menjadi dua, yaitu: 1. Endoenzim, disebut juga enzim intraseluler, yaitu enzim yang bekerja
di dalam sel.
2. Eksoenzim, disebut juga enzim ekstraseluler, yaitu enzim yang bekerja di luar sel.
b. Berdasarkan cara terbentuknya dibedakan menjadi dua, yaitu:
1. Enzim konstitutif, yaitu enzim yang jumlahnya dipengaruhi kadar substratnya, misalnya enzim amilase.
2. Enzim adaptif, yaitu enzim yang pembentukannya dirangsang oleh adanya substrat, contohnya enzim amilase yang dihasilkan oleh bakteri amilolitik yang ditumbuhkan di dalam medium yang mengandung amilum.
c. Berdasarkan fungsinya enzim dapat dibedakan menjadi enam kelas dan tiap kelas mempunyai beberapa subkelas. Dalam tiap subkelas, nama resmi dan nomor klasifikasi dari tiap enzim melukiskan reaksi yang dikatalisis berdasarkan IUPAC yaitu :
1. Oksidoreduktase, mengkatalisis reaksi oksidasi-reduksi, meliputi reaksi pemindahan elektron, hidrogen atau oksigen.
13
3. Hidrolase, mengkatalisis pemutusan ikatan antara karbon dengan berbagai atom lain dengan adanya penambahan air.
4. Liase, mengkatalisis penambahan gugus fungsi dari suatu molekul tanpa melalui proses hidrolisis.
5. Isomerase, mengkatalisis reaksi isomerisasi.
6. Ligase, mengkatalisis reaksi penggabungan dua molekul dengan dibebaskannya molekul pirofosfat dari nukleosida trifosfat (Lehninger, 1982).
2 Faktor yang mempengaruhi aktivitas enzim
Faktor- faktor yang mempengaruhi aktivitas enzim antara lain: a. Suhu
Pengaruh suhu sangat menentukan aktivitas enzim pada waktu
mengkatalisis suatu reaksi. Seluruh enzim memerlukan jumlah panas tertentu untuk dapat aktif. Meningkatnya suhu akan semakin
14
Gambar 3. Hubungan antara suhu dan aktivitas enzim (Poedjiadi, 1994).
b. pH
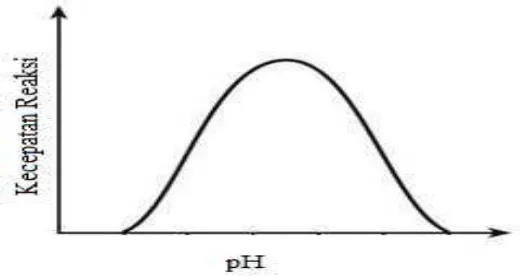
Enzim pada umumnya bersifat amfolitik, yang berarti enzim mempunyai konstanta disosiasi pada gugus asam maupun gugus basanya, terutama gugus terminal karboksil, dan gugus terminal amino. Perubahan kereaktifan enzim diperkirakan merupakan akibat dari perubahan pH lingkungan (Winarno, 1989). Hubungan kecepatan reaksi dengan pH ditunjukkan pada Gambar 2.
15
c. Konsentrasi Enzim
Konsentrasi enzim secara langsung mempengaruhi kecepatan laju reaksi enzimatik dimana laju reaksi meningkat dengan bertambahnya
konsentrasi enzim (Poedjiadi, 1994). Hubungan antara laju reaksi enzim dengan konsentrasi enzim ditunjukkan dalam Gambar 3.
Gambar 5. Hubungan laju reaksi dengan konsentrasi enzim (Reed, 1975).
d. Konsentrasi Substrat
Aktivitas enzim juga dipengaruhi oleh konsentrasi substrat. Pada konsentrasi substrat rendah, enzim tidak mencapai konversi maksimum akibat sulitnya enzim menemukan substrat yang akan direaksikan. Seiring dengan meningkatnya konsentrasi substrat, kecepatan reaksi juga akan meningkat akibat makin cepatnya substrat terikat pada enzim.
Peningkatan konsentrasi substrat pada titik jenuh tidak lagi dapat meningkatkan kecepatan laju reaksi (Pratiwi, 2008).
e. Aktivator dan Inhibitor
16
kofaktor. Kofaktor tersebut dapat berupa ion-ion anorganik seperti Zn, Fe, Ca, Mn, Cu, atau Mg atau dapat pula sebagai molekul organik kompleks yang disebut koenzim (Martoharsono, 1984). Menurut Wirahadikusumah (1989), inhibitor merupakan suatu zat kimia tertentu yang dapat
menghambat aktivitas enzim.
F. Enzim Selulase
Enzim selulase dapat diproduksi dari mikroba selulotik baik kapang maupun bakteri, kapang selulotik yang biasa digunakan dari jenis Trichoderma,
Aspergillus, dan Penicillium, sedangkan bakteri yang bisa menghasilkan selulase adalah Pseudomonas, Cellulomonas, Bacillus, Micrococcus, Cellovibrio,dan
Sporosphytophaga. Diantara semua jenis kapang selulotik, Trichoderma reesei
17
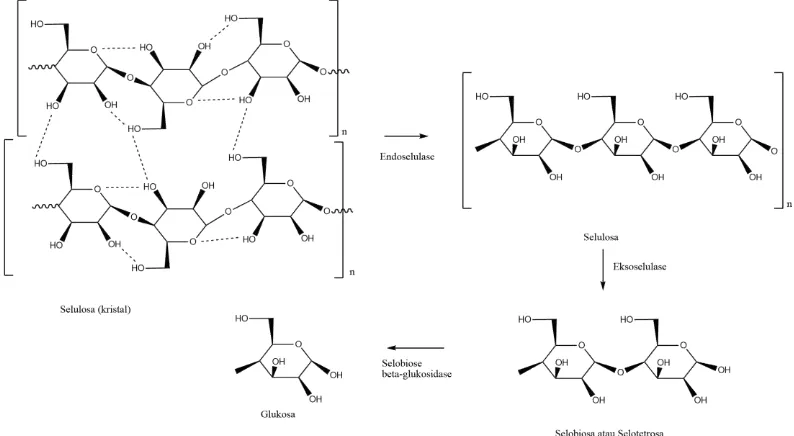
1. Ekso-β-(1,4)-glukanase dikenal sebagai faktor C1. Faktor ini diperlukan
untuk menghidrolisis selulosa dalam bentuk kristal.
2. Endo-β-(1,4)-glukanase dikenal sebagai faktor Cx. Faktor ini diperlukan
untuk menghidrolisis ikatan β-(1,4)-glukosida (selulosa amorf). 3. β-(1,4)-glukosidase menghidrolisis selobiosa menjadi glukosa
Gambar 6. Mekanisme hidrolisis selulosa oleh enzim selulase (Ikram, 2005).
Enzim selulase memiliki potensi dan aplikasi yang luas dalam bidang industri antara lain, industri makanan, pakan ternak, tekstil, bahan bakar, industri kimia, industri pulp dan kertas, pengolahan limbah, industri farmasi, produksi protoplas, dan teknik genetik. Saat ini penggunaan enzim selulase tidak hanya terbatas pada bidang industri, enzim selulase juga banyak dimanfaatkan dalam produksi
18
Pada dasarnya mekanisme pemotongan rantai ikatan oleh enzim selulase sangat kompleks karena melibatkan sinergitas kerja 3 komponen besar yaitu
endo-1,4-ß-D-glukanase yang berfungsi memutuskan ikatan selulosa secara random dengan memulai serangan acak pada sisi internal daerah amorf dari serat selulosa sehingga sisi yang terbuka dapat diserang oleh cellobiohydrolase.
Kemudian kerja dari ekso-ß-1,4-glukanase yang memotong ujung-ujung rantai individu selulosa. Ekso-ß-1.4-glukanase atau disebut cellobiohydrolase
menyerang bagian luar non-reducing dari selulosa sehingga dihasilkan selobiosa sebagai struktur utamanya. Selanjutnya adalah kerja dari ß-glukosidase yang berfungsi memotong selobiosa menjadi molekul-molekul glukosa (Kodri, 2013).
G. Enzim Amilase
Amilase (alfa, beta dan glukoamilase) merupakan enzim yang penting dalam bidang pangan dan bioteknologi. Amilase dapat diperoleh dari berbagai sumber seperti tanaman, binatang, dan mikroorganisme. Saat ini sejumlah enzim amilase telah diproduksi secara komersial. Penggunaan mikrobia dianggap lebih
prospektif karena mudah tumbuh, cepat menghasilkan dan kondisi lingkungan dapat dikendalikan. Enzim α-amilase (α-1,4-D-glukan-4-glukanohidrolase, EC 3.2.1.1) berperan dalam hidrolisis amilum dengan memecah ikatan α-1,4glikosida dan melewatkan ikatan α-1,6 untuk menghasilkan glukosa, maltosa, dan
19
Tiap aplikasi industri mensyaratkan sifat yang khas dari α-amilase terkait dengan spesifisitas, stabilitas, dan pengaruh suhu serta pH terhadap aktivitasnya
(Ginting, 2009).
H. Enzim Protease
Protease merupakan enzim proteolitik yang mengkatalisis pemutusan ikatan peptida pada protein. Protease dibutuhkan secara fisiologi untuk kehidupan organisme pada tumbuhan, hewan maupun mikroorganisme. Protease tidak hanya berperan dalam proses metabolisme seluler, namun juga dapat diaplikasikan dalam bidang industri. Enzim ini merupakan salah satu enzim skala industri dengan tingkat penjualan hingga 60% dari total penjualan enzim di dunia. Aplikasi enzim protease di antaranya pada industri pembuatan detergen,
industri penyamakan kulit, bahan aditif pada industri pangan, dan zat terapeutik pada bidang farmasi (Gupta dkk., 2002; Rao dkk., 1998).
Protease dapat dihasilkan oleh tumbuhan, hewan, dan mikroorganisme.
20
I.Enzim Lipase
Lipase merupakan enzim yang memiliki peran penting dalam bioteknologi modern. Lipase terkenal memiliki aktivitas yang tinggi dalam reaksi hidrolisis dan dalam kimia sintesis. Lipase dapat berperan sebagai biokatalis untuk reaksi- reaksi hidrolisis, esterifikasi,alkoholisis, asidolisis, dan aminolisis (Gandhi, 1997).
Lipase menghidrolisis trigliserida menjadi asam lemak bebas, gliserida parsial, dan gliserol. Trigliserida sebagai substrat terdiri dari asam lemak rantai panjang yang tidak larut dalam air (Shahani, 1975). Lipase menghidrolisis ikatan ester pada permukaan antara fase cair, dimana enzim terlarut dan fasa substrat tidak terlarut. Lipase biasanya diproduksi oleh pankreas babi dan sapi, ragi Candida,
Aspergillus, Rhizopus, dan Mucor sp. Dalam industri, lipase antara lain digunakan dalam industri farmasi dan untuk menghasilkan asam lemak dari minyak tidak stabilyang biasanya mengandung asam lemak tidak jenuh. Lipase dari Candida cylindracea digunakan untuk menghidrolisis minyak dalam pembuatan sabun. Selain bidang farmasi, lipase juga digunakan dalam industri kosmetik, kulit, makanan, parfum, dan sintesis bahan organik lain (Ghandi, 1997).
J. Isolasi Enzim
1. Sentrifugasi
21
mengendap pada dasar tabung. Pada proses sentrifugasi sebaiknya dilakukan pada suhu 2- 4°C untuk mencegah terjadinya denaturasi akibat panas yang ditimbulkan proses sentrifugasi (Cooper, 1997 dalam Sariningsih, 2000). 2. Fraksinasi dengan ammonium sulfat
Pemekatan protein dengan penambahan garam ke dalam larutan enzim
merupakan cara yang banyak dilakukan. Garam yang dapat digunakan berupa natrium klorida, natrium sulfat atau ammonium sulfat. Ammonium sulfat lebih sering digunakan karena memiliki beberapa kelebihan dibandingkan
garam- garam yang lain, yaitu mempunyai kelarutan yang tinggi, tidak mempengaruhi aktivitas enzim, mempunyai daya pengendapan yang efektif, mempunyai efek penstabil terhadap kebanyakan enzim, dapat digunakan pada berbagai pH dan harganya murah (Scopes, 1982).
Pada umumnya garam yang sering digunakan adalah amonium sulfat karena (1) kebanyakan enzim tahan terhadap garam ini, (2) memiliki kelarutan yang besar dalam air, (3) mempunyai daya pengendapan yang besar, dan(4) mempunyai efek penstabil terhadap kebanyakan enzim. Konsentrasi garam dapat mempengaruhi kelarutan enzim. Penambahan garam ini dalam larutan enzim akan
mempengaruhi kelarutan enzim. Pada konsentrasi garam rendah, kelarutan enzim dalam air bertambah. Peristiwa ini disebut dengan “salting in”. Sedangkan pada konsentrasi tinggi, dimana kandungan garam dalam jumlah banyak maka
kelarutan enzim akan turun, sehingga garam yang berlebih ini menyebabkan pengendapan enzim. Peristiwa ini disebut dengan “saltingout”
III. METODOLOGI PENELITIAN
A.Waktu dan Tempat Penelitian
Penelitian ini telah dilaksanakan pada bulan Maret – Agustus 2015 di Laboraturium Biokimia Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
B. Alat dan Bahan
Peralatan yang digunakan pada penelitian ini adalah autoclave (model S-90N),
laminar air flow (CURMA model 9005-FL), timbangan digital, inkubator, sentrifuga, magnetic stirer, tabung sentrifuga, mikropipet, waterbath, oven, shaker, spektrofotometer UV-Vis, inkubator, kasa, kapas, rak tabung, jarum ose, penangas, dan alat-alat gelas lain seperti tabung reaksi, cawan petri, erlenmeyer, beaker gelas, gelas ukur, labu ukur, pipet tetes, batang pengaduk, serta pemanas bunsen, dan kompor gas.
Bahan-bahan yang digunakan adalah Potato Dextrose Agar (PDA), agar bakteri, (NH4)2SO4, KH2PO4 CaCl2, MgSO4·7H2O, urea, FeSO4·7H2O, pepton, yeast
23
(dinitrosalisilic acid), fenol, NaOH, Na2SO4, CuSO4·5H2O, Na2CO3, HCl, KI, I2,
buffer fosfat, aseton, etanol, asam trikloroasetat, larutan kasein 1%, fenolftalein 1%, minyak zaitun, dan pati. Mikroorganisme yang akan digunakan adalah jamur
Trichodermakoningii yang diperoleh dari Laboratorium Hama dan Penyakit Jurusan Agroteknologi Fakultas Pertanian Universitas Lampung.
C. Prosedur Penelitian
a. Pembuatan Medium
1. Medium Padat Saboroud Agar
Prosedur pertama dalam pembuatan medium padat saboroud agar adalah dengan menimbang 40 g/L dektrosa, 20 g/L agar, dan 15 g/ L pepton. Kemudian dimasukkan semua bahan ke dalam Erlenmeyer 250 mL,
ditambahkan akuades sebanyak 100 mL dan dipanaskannya di atas kompor gas. Selanjutnya dilakukan sterilisasi dengan menggunakan autoclave pada suhu 121 ºC dengan tekanan 1 atm selama 15 menit. Setelah itu medium saboroud agar dituangkan ke beberapa tabung reaksi atau dimasukkan ke dalam cawan petri dilakukan di dalam laminar air flaw dan dibiarkan dalam posisi tabung miring hingga memadat pada suhu kamar.
2. Pembuatan Medium Cair
Medium cair starter digunakan untuk adaptasi awal pertumbuhan jamur pada medium cair, sedangkan untuk kultur digunakan medium cair dengan volume yang lebih besar. Prosedur pertama pembuatan medium cair dengan
24
(NH4)2SO4, 0,1 g/L CaCl2, 5 g/L pepton; 5 g/L CMC; dan 5 g/L yeast ekstrak .
Kemudian dimasukkan semua bahan ke dalam Erlenmeyer 250 mL, lalu ditambahkan akuades sebanyak 100 mL dan dipanaskannya di atas kompor gas. Selanjutnya disterilisasi dengan menggunakan autoclave pada suhu 121 ºC dengan tekanan 1 atm selama 15 menit. Didiamkan medium cair di dalam
laminar air flaw hingga mencapai suhu kamar kemudian jamur dapat
diinkulasi ke media cair. Untuk media cair starter di shaker dengan kecepatan 110 rpm selama 24 jam dan untuk kultur komposisinya sama hanya
volumenya lebih besar dan waktunya menyesuaikan dengan kurva pertumbuhannya.
b. Pembuatan Pereaksi 1. Pereaksi Lowry.
Pereaksi Lowry terdiri atas 4 macam, yang meliputi Pereaksi A, B, C, dan D. Masing-masing pereaksi tersebut dibuat dengan cara sebagai berikut: Pereaksi A: dilarutkan 2 g Na2CO3 dalam 100 mL NaOH 0,1 N; Pereaksi B:
ditambahkan 5 mL larutan CuSO4.5H2O 1% (w/v) ke dalam 5 mL larutan
Na(K)-tartarat 1% (w/v); Pereaksi C: ditambahakan 2 mL pereaksi B ke dalam 100 mL pereaksi A; dan Pereaksi D: diencerkan reagen Folin-Ciocelteau dengan akuades 1:1.
2. Pereaksi Mandels
25
1 mL Na/ K tartarat 40% dan dimasukkan dalam labu ukur 100 mL kemudian ditambahkan sedikit akuades kocok hingga larut dan ditambahkan akuades sampai batas miniskus.
3. Pereaksi Fuwa
Pereaksi Fuwa terdiri dari pembuatan larutan iodine dengan cara 2 g KI dilarutkan dalam 100 mL akuades; pembuatan larutan HCl 0,1 N ; dan pembuatan larutan pati sebagai substrat dengan 0,1 g pati dilarutkan dalam 100 mL akuades kemudian dipanaskan hingga larut.
4. Pereaksi Kunitz
Pereaksi kunitz terdiri dari larutan kasein 1% yaitu 1gr kasein dilarutkan dalam buffer fosfat pH 7 dan dipanaskan hingga larut, kemudian larutan TCA 5% yaitu 5 gr asam trikloroasetat (TCA) dilarutkan dalam 100 mL akuades, dan larutan standar yaitu sebanyak 5 mL tirosin dengan kadar 20-250 ppm.
5. Pereaksi Lipase
Pereaksi yang digunakan dalam penentuan aktivitas enzim lipase ini adalah buffer fosfat 0,05 M (pH: 8), aseton:etanol (1:1), fenolftalein 1%, NaOH 0,05 N, dan minyak zaitun sebagai substrat.
c. Isolasi Jamur Patogen (Phytophthora palmivora) pada Busuk Buah Kakao
26
terbesar di Lampung. Melakukan isolasi patogen dari buah kakao bagian yang sakit kurang lebih dipotong (0,5cm x 0,5cm), kemudian direndam ke dalam alkohol 70% selama ±3 menit, lalu dicuci dengan akuades steril dan diletakkan di atas kertas saring hingga sedikit kering kemudian ditanam atau diisolat di dalam media saboroud agar atau PDA, selanjutnya diletakkan isolat di inkubator selama 7- 9 hari, setelah itu dipindahkan hasil isolat ke media saboroud agar yang baru atau dimurnikan.
d. Penumbuhan Jamur Antagonis (Trichoderma koningii)
Menginokulasi jamur Trichoderma koningii pada media padat saboraud agar. Dilakukan inokulasi dengan metode tusuk ke dalam cawan petri ataupun tabung reaksi. Kemudian diinkubasi dalam inkubator selama ±2-3 hari hingga jamur yang diinginkan tumbuh dan tidak terkontaminasi dengan jamur lain.
e. Uji Antagonisitas Trichoderma koningii dalam Menekan Perkembangan Phytophthora palmivora pada Buah Kakao
Melakukan uji antagonisitas Trichodermakoningii terhadap Phytophthora palmivora dengan cara menyiapkan medium PDA steril dalam cawan petri
(diameter 9 cm), kemudian dua kertas bentuk bulatan masing- masing mempunyai diameter 4 mm (seperti yang dilakukan oleh Tondje, et al., 2007) masing-masing meletakkan di bagian pinggir cawan dengan arah berlawanan. Menginokulasi kertas bulatan yang pinggir sebelah kanan dengan suspensi konidia Trichoderma koningii sebanyak 0,1 mL dan kertas bulatan sebelah kiri dengan suspensi
27
Selanjutnya menginkubasi selama 5x24 jam, kemudian mengukur diameter koloni
Phytophthora palmivora masing-masing yang berdampingan dengan Trichoderma koningii, yang diberi simbol (Pt) dan kontrol (tanpa Trichodermakoningii) diberi simbol (Pk). Persentase antagonisitas Trichodermakoningii ditentukan dengan rumus:
Persentase antagonis :{( Pk – Pt) / Pk } x 100% Keterangan:
Pt : diameter koloni Phytophthora palmivora berdampingan dengan Trichoderma koningii (cm)
Pk : diameter kontrol (tanpa Trichodermakoningii) (cm) (Singh, et al., 2002).
f. Produksi Enzim
Melakukan produksi enzim dengan menyiapkan medium starter dan medium kultur. Starter disiapkan dengan menginokulasikan 2 ose isolat ke dalam 5 mL medium cair, kemudian diinkubasi pada shaker dengan kecepatan 110 rpm selama 24 jam. Starter selanjutnya akan digunakan untuk menginokulasikan ke dalam medium kultur. Medium kultur menggunakan medium yang mengandung CMC, pepton, yeast extract, KH2PO4, MgSO4·7H2O,CaCl2, urea, dan(NH4)2SO4.
28
g. Penentuan Pertumbuhan Sel
Penentuan pertumbuhan sel digunakan untuk mengetahui pertumbuhan dari sel bakteri dengan cara mengencerkan sampel kultur. Sebanyak 0,3 mL kultur dimasukan ke tabung reaksi, lalu menambahkan 2,7 mL akuades, dan mengukur serapannya menggunakan spektrofotometer UV-VIS pada panjang gelombang 600 nm.
h. Uji Aktivitas Ekstrak Kasar Enzim 1. Uji Kadar Protein Enzim
Menambahkan sebanyak 100 µL larutan enzim ke dalam 0,9 mL akuades dan ditambah 0,5 mL pereaksi D, kemudian diaduk dan didiamkan selama 30 menit pada suhu kamar, lalu absorbansinya diukur pada λmaks 750 nm. Untuk kontrol,
mengganti enzim dengan akuades. Selanjutnya diperlakukan sama seperti sampel.
2. Uji Aktivitas Enzim Selulase
29
3. Uji Aktivitas Enzim Amilase
Sebanyak 0,25 mL enzim, 0,25 mL pati kemudian diiinkubasi selama 10 menit dengan suhu 60 oC lalu ditambahkan 0,25 mL HCl 0,1 N, 0,25 mL I2 tambah 4
mL akuades diaduk dan diukur pada λ 600 nm ini untuk perlakuan pada sampel, sedangkan untuk kontrol sebanyak 0,25 mL enzim, 0,25 mL HCl 0,1 N kemudian diinkubasi selama 10 menit dengan suhu 60 oC lalu ditambahkan 0,25 mL pati , 0,25 mL I2 ditambahkan 4 ml akuades diaduk dan diukur pada λ
600 nm.
4. Uji Aktivitas Enzim Protease dengan Metode Kunitz
Larutan kasein (substrat) sebanyak 1 mL dengan 1 mL larutan enzim dalam tabung reaksi dan diinkubasi pada suhu 60 oC selama 30 menit. Kemudian tabung reaksi dikeluarkan dan ditambahkan 3 mL TCA, lalu diaduk dan didiamkan selama 30 menit pada suhu kamar hingga mengendap sempurna. Setelah itu dilakukan penyaringan atau sentrifugasi untuk memisahkan endapan. Filtrat diukur pada λ 280 nm. Membuat kontrol dengan menambahkan larutan TCA sebelum enzim, kemudian diinkubasi.
5. Uji Aktivitas Enzim Lipase
30
menggunakan campuran aseton: etanol (1:1) sebanyak 1 mL. Campuran tersebut ditambahkan 5 tetes fenolftalein 1% sebagai indikator dan dititrasi dengan menggunakan larutan NaOH 0,05 N. Titrasi dihentikan setelah campuran berubah menjadi merah muda (Nurhasanah dan Herasari, 2008). Aktivitas enzim lipase ditunjukkan dengan perubahan warna saat titrasi dari tidak berwarna menjadi berwarna merah muda. Perlakuan untuk kontrol dilakukan sama seperti perlakukan untuk uji aktivitas enzim dimana enzim digantikan oleh akuades. Aktivasi lipase dapat dihitung dengan cara sebagai berikut:
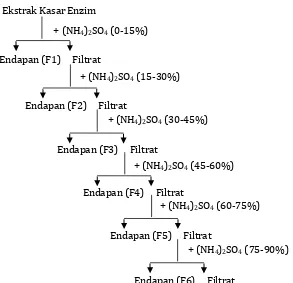
Pemurnian enzim dilakukan dengan fraksinasi menggunakan ammonium sulfat. Fraksinasi dengan ammonium sulfat [(NH4)2SO4] yaitu ekstrak kasar enzim yang
31
sambil diaduk dengan magnetik stirer pada suhu 4 oC. Endapan protein enzim
32
Gambar 7. Skema pengendapan protein enzim dengan ammonium sulfat.
j. Uji Antagonisitas Enzim yang Dihasilkan Trichoderma koningii dalam Menekan Perkembangan Phytophthora palmivora pada Buah Kakao
Uji ini dilakukan dengan menggunakan media cawan petri yang sudah ada jamur patogen penyebab busuk buah kakao kemudian di sebalah kiri dan kanan diberi kertas whartman yang mempunyai diameter 4 mm kemudian ditetesi ekstrak kasar enzim kemudian diamati dan usahakan kertasnya tidak boleh kering jadi harus selalu basah dengan ekstrak kasar enzim. Diamati pertumbuhan jamur patogen.
+ (NH4)2SO4 (0-15%)
+ (NH4)2SO4 (15-30%) Ekstrak Kasar Enzim
Endapan (F1) Filtrat
Endapan (F2) Filtrat
Endapan (F3) Filtrat
+ (NH4)2SO4 (30-45%)
Endapan (F4) Filtrat
+ (NH4)2SO4 (45-60%)
+ (NH4)2SO4 (60-75%)
Endapan (F5) Filtrat
Endapan (F6) Filtrat
33
Diagram Alir Prosedur Penelitian
316
Isolasi jamur p.palmivora
dari busuk buah kakao
Peremajaan isolat jamur Trichoderma koningii
Uji jamur antagonis terhadap jamur patogen
Penanaman jamur antagonis ke
dalam media cair (starter)
Inokulasi dari media starter ke
medium kultur Uji antagonis ekstrak kasar
enzim
Uji akt.enzim lipase
Uji akt. Enzim protease
Uji akt. Enzim amilase
Uji akt. Enzim selulase
Uji kadar protein
Permurnian dengan fraksinasi
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan hasil yang diperoleh dari penelitian yang telah dilakukan, diperoleh simpulan sebagai berikut :
1. Hasil isolasi pada busuk buah kakao menunjukkan bahwa patogen yang terdapat pada buah tanaman kakao adalah Phytophthora palmivora.
2. Berdasarkan uji antagonis jamur Trichoderma koningii menunjukkan adanya daya hambat sebesar 85,71% terhadap jamur patogen pada busuk buah kakao. 3. Berdasakan kurva pertumbuhan yang diperoleh menunjukkan pertumbuhan
tertinggi pada hari ke-9, sehingga dilakukan produksi enzim dan didapatkan AS enzim selulase sebesar 2,50 U/mg dan 1,22 U/mg untuk enzim lipase. 4. Hasil pemurnian dengan menggunakan ammonium sulfat didapatkan fraksi
tertinggi 60-80%, besarnya aktivitas spesifik 2,92 U/mg.
50
B. Saran
Dari hasil penelitian yang diperoleh, maka disarankan untuk mengidentifikasi enzim kitinase, mengisolasi antibiotik yang terdapat pada jamur Trichoderma koningii, mencari metode pemurnian lain yang dapat meningkatkan kemurnian enzim lebih baik, melakukan uji antagonis secara kuantitatif enzim hasil
DAFTAR PUSTAKA
Aeny, T.N, S. Juariyahdan T. Maryono. 2011. Potensi Antagonis Beberapa Isolat
Trichoderma terhadap Phytophthora Palmivora Penyebab Penyakit Busuk Buah Kakao. Fakultas Pertanian Universitas Lampung. Bandar Lampung. Alexander, M., D.A. Hopwood, B.H. Iglewski, and A.I. Laskin. 1992.
Encyclopedia of Microbiology. Academic Press, Inc. New York. Alexander, R.R. and J.M. Griffith.1993.Bacic Biochemical Methods.2nd
Edition.Wiley-Liss Inc. New York.
Bennett, C.P.A., G. Sitepu, O. Roboth&A. Lolong (1986). Pathogenicity of
Phytophthora palmivora (Butler) Butler Causing Premature Nut Fall Disease of Coconut (Cocosnucifera L.).Indon. J. Crop Sci.2: 59–70.
Bharat, R., R. S. Upadhayay and A. K.Srivastava. 1988. Utilizationof Cellulose and Gallic Acid by Litter Inhabiting Fungand Its Possible Implication in LitterDecomposition of A Tropical DeciduousForest, Pedobiologia.Dept. Bot. BanaesHindu University. Varanasi. India.
BPTP Lampung. 2010. Hama/ Penyakit Utama Pada Tanaman Kakao dan Teknik Pengendaliannya. Balai Pengkaji Teknologi Pertanian. Bandar Lampung. Bowers, J. H., B.A. Bailey, P.K. Hebbar, S. Sanogo,and R. Lumsden. 2001. The
Impact of Plant Diseases on World Chocolate Production. American Phytopathological Society. Feature Story.
Cook, R. J. and K. F. Baker. 1983. The Natureand Practice of Biological Control of Plant Pathogens. The American Phytopathol. Society, St. Paul MN.539. Coughlan, M. 1985. Celluloses: Production Properties and Applications.
Biochem. Soc. Trans. 13:405–406.
Darmono, T. W. 1997. Virulence and Genetic Integrity Among Isolate of
52
Duff, S.J.B and Murray, W.D.1996. Bioconvertion of Forest Products Industry Waste Cellulosics to Fuel Ethanol: A Review. Bioresour. Technol. 55: 1–33.
Dwidjoseputro. 1998. Dasar-Dasar Mikrobiologi. Djambatan. Malang.
Fauzan.A, Lahmudi. L.,dan Mukhtar. I.P., 2013 .Keparahan Penyakit Busuk Buah Kakao (P.palmivora) pada Beberapa Perkebunan Kakao. Jurnal online Agroteknologi USU.1 (3).
Fessenden, R.J dan Joan S.F. 1989.Kimia Organik Edisi 3. Erlangga. Jakarta. 353–354.
Fox, P.F. 1991. Food Enzymology. Elsevier Applied Science Ltd. New York. 1. Fuwa, H. 1954. A New Method for Microdeterminationof Amylase Activity by
TheUse of Amylase as The Substrate. J.Biochem. 41: 583–603.
Gandhi, N., 1997, Application of Lipases. Journal American Oil Chemist Society, 74(6):621–629.
Ginting, Y. 2009. Isolasi Bakteri dan Uji Aktivitas Enzim Amilase Kasar Thermofilik dari Sumber Air Panas Semangat Gunung. Kabupaten Karo, Sumatera Utara. (Tesis).Universitas Sumatera Utara. Medan.
Gultom, J.M., 2008. Pengaruh Pemberian Beberapa Jamur Antagonis dengan Berbagai Tingkat Konsentrasi untuk Menekan Perkembangan Jamur
Phytium sp. Penyebab Rebah Kecambah pada Tanaman Tembakau (Nicotiana tabaccum L.).
Gupta, R., Beg, Q.K., dan Lorenz, P. 2002. Bacterial Alkaline Proteases: Molecular Approaches and Industrial Application. Appl Microbiol Biotechnol. 59:15–32.
Harman, G. E. and A. Taylor. 1988. Improved Seedling Performance by Integration of Biological Control Agents at Favourable pH Levels with Solid Matrix Priming. Phytopatholgy.78: 520 – 525.
Harman, G.E., Howell, C.R., Viterbo, A., Chet, I. and Lorito, M. 2004.
Trichoderma Species Opportunistic, Avirulent Plant Symbionts. Nature Reviews Microbiology. 2: 43–56.
Harmel, R., and N. Nasir. 2008. Cacao in West Sumatra: Problem and Solution. Collaboration Report of Project Outzending Managers Netherland and Genta Ngo. Padang. 32.
53
Co-culture of Aspergillus niger and Trichoderma viride. Res. J. Agric & Biol. Sci. 1(3):241–245.
Ismail.N. dan Andi.T., 2008. Potensi Agens Hayati Trichoderma sebagai Agens Pengendali Hayati. BPTP. Sulawesi Utara.
Kodri, Bambang. D. A.,dan Rini.Y.,2013. Pemanfaatan Enzim Selulase dari
Trichoderma Reseei dan Aspergilus niger sebagai Katalisator Hidrolisis Enzimatik Jerami Padi dengan Pretreatment Microwave. Jurnal Bioproses KomoditasTropis. 1(1).
Kwon Y.D, Rhee J.S., (1986), A Simple and Rapid Colorimetric Method for Determination of Free Fatty Acids for Lipase Assay. JAOCS. 63: 89–92. Lehninger, A.L. 1982. Dasar-Dasar Biokimia. Erlangga. Jakarta.369.
Lowry, O. H., N. J., Rosebrough, A. L., Farr, R. J. Randall. 1951. Protein Measurement with The Folin Phenol Reagent. J. Biol. Chem.193: 265. Lynd, L.R., Weimer P.J., Van Zyl W.H., and Pretorius IS. 2002. Microbial
Cellulose Utilization: Fundamentals and Biotechnology.Microbiol. Mol.Biol. Rev.66: 506–577.
Mandels, M., A. Raymond, R. Charles. 1976. Measurement of Saccharifying Cellulose. Biotech. & Bioeng. Symp.John Wiley & Sons Inc.6.
Mandels, M. 1985. Applications of Cellulases. Biochemical Society Transactions. 13: 414 – 416.
Martoharsono, S. dkk.1984. Biokimia. UGM Press. Yogyakarta.91.
Nurhaedah, 2002. Pengaruh Aplikasi Trichoderma sp. dan Mulsa terhadap Persentase Serangan Penyakit Antraknosa pada Buah Tanaman Cabai Merah Besar (Capsicum annum L). Skripsi Fakultas Pertanian. UNTAD. Palu.
Nurhayati, H., 2001. Pengaruh Pemberian Trichoderma sp.terhadap Daya Infeksi dan Ketahanan Hidup Sclerotium roflsii pada Akar Bibit Cabai. Skripsi Fakultas Pertanian.UNTAD.Palu.
Opeke, L. K and A. M. Gorenz. 1974. Phytophthora Pod Rot: Symtoms and Economic Importance. Dalam:P.H. Gregory (Eds.). Phytophthora Disease of Cocoa.Longman, London. 117–124.
Pelczar, M. 2005. Dasar-dasar mikrobiologi. UI. Jakarta.
54
Poedjiadi, A.1994. Dasar- dasar Biokimia. Jakarta. UI-Press. 155:158–160. Prabowo.R, 2008. Kajian Biopestisida dan Pupuk Hayati dalam Mendukung
Pengelolaan Tanaman Tomat Secara Terpadu. Mediaagro. 4(1). Prihandarini, R. 2000. Prospek Pemanfatan Limbah Organik dalam
Pertanian Modern Akrab Lingkungan. Bulettin MAPORINA Pengurus Pusat MAPORINA. Fakultas Pertanian Brawijaya. Malang.
Purwantisari, S & R. B, Hastuti. 2009. Isolasi dan Identifikasi Jamur Indigenous Rhizosfer Tanaman Kentang dari Lahan Pertanian Kentang Organik Di Desa Pakis. Laboratorium Mikrobiologi Jurusan Biologi FMIPA Undip. Magelang.
Purwoko,T., (2007). Fisiologi Mikroba, Penerbit PT Bumi Aksara, Jakarta. Rao, M.B.,A. M. Tankasale, M.S.Gate, and V.V Desphande.1998. Molecular and
Biotecnology Aspects of Microbial Protease. Microbial and Molecular Biology Review. 62: 597 – 628.
Reed, G. 1975. Enzymes in Food Processing. Academic Press. New York. 212. Roberts, J.C. 1996.Chemistry of Paper. The Royal Society of Chemistry. Thomas
Graham House. Cambridge.
RubiyodanWidi. A., 2013. Ketahanan Tanaman Kakao terhadap Penyakit Busuk Buah. Perspektif. 12(1).
Said, M.I., danLikadja, J.C. 2012.Isolasi dan Identifikasi Bakteri yang Berpotensi sebagai Penghasil Enzim Protease pada Industri Penyamakan Kulit Pt. Adhi Satria Abadi (Asa). Yogyakarta. Makalah Ilmiah. Fakultas Peternakan. Universitas Hasanuddin. Makasar.
Salma, S dan L. Gunarto. 1999. Enzim Selulase dari Trichoderma spp. Buletin agribio (2). Balai Penelitian Bioteknologi Tanaman Pangan. Badan Penelitian dan Pengembangan Pertanian Bogor.
Sariningsih, R. 2000. Produksi Enzim Protease oleh Bacillus subtilis BAC-4. (Skripsi). Institut Teknologi Bandung. Bandung.
Scopes, R.K. 1982. Protein Purification. Springer Verlag. New York. Semangun, H. 2000. Penyakit-PenyakitTanaman Perkebunan Di Indonesia
Cet.Keempat (revisi). Gadjah Mada University Press. 382–385.
55
Singh, R., Singh, B. K., Upadhyay, R. S., Rai, Bharat dan Su Lee, Y. 2002.
Biological Control of Fusarium Wilt Disease of Pigeonpea. J. Plant Pathol 18 (5) : 279–283.
Sriwati.R. dan R. Muarif, 2012.Characteristic Symptoms of Phytophthora palmivora on Cocoa Leaves. Jurnal Natural. 12(2).
Susiana ,P, Rejeki S.F., dan Budi R. 2008. Pengendalian Penyakit Lodoh (Busuk) Umbi Kentang dengan Agen Hayati Jamur- Jamur Antagonis Lokal. Bioma 10 (2): 13–19.
Trianto dan Gunawan S., 2003. Pengembangan Trichoderma harzianum untuk Pengendalian OPT Pangan dan Hortikultura. Makalah. Lab. PHPT Wilayah Semarang.
Tondje, P. R., Robert, D. P., Bon, M. C., Widmer, T., Samuels, G. J., Ismaiel, A., Begoude, A. D., Tchana, T., Nyemb-Tshomb, Ndoumbe-Nkeng, M., Bateman, R., Fontem, D dan Hebbar, K. P. 2007. Biological
Control.43: 202–212.
Tunggala, S, Hasnah, N, dan Nunuk H.S.2010. Optimasi ProdukAEnzim Lipase dari Bakteri Sumber Air Panas Tamalatik. Mamasa. Sulawesi Barat. Universitas Hasanudin. Makassar.
Waterhouse,G.M. (1974a.) Phytophthora palmivora and Some Related Species. In Gregory P.H. (ed.). Phytophthora Disease of Cocoa. London. Longman. 51–70.
Winarno, F.G. 1986. Enzim Pangan dan Gizi. PT. Gramedia Pustaka Utama. Jakarta. 155.
Wirahadikusumah, M. 1989. Biokimia : Protein, Enzim dan Asam Nukleat. ITB Press. Bandung. 91.
Yuneta, R dan S.R. Putra. 2009. Pengaruh Suhu pada Lipase dari Bakteri