RINGKASAN
UMAR WIJAYANTO. D14204030. Analisis in vitro Toleransi Isolat Bakteri Asam Laktat asal Daging Sapi terhadap pH Lambung, pH Usus dan Garam Empedu sebagai Kandidat Probiotik. Skripsi. Program Studi Teknologi Hasil Ternak, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Irma Isnafia Arief, S.Pt, MSi
Pembimbing Anggota : Dr. Ir. Rarah Ratih Adjie Maheswari, DEA
Bakteri asam laktat merupakan mikroflora normal daging sehingga lebih sesuai bila dijadikan kultur starter untuk pengolahan produk fermentasi yang berasal dari daging. Syarat utama suatu isolat berpotensi sebagai probiotik adalah memiliki toleransi yang tinggi terhadap asam lambung dan garam empedu dalam saluran pencernaan. Kondisi kritikal yang harus dihadapi bakteri probiotik dalam saluran pencernaan manusia dimulai dari lambung, yaitu bakteri harus mampu bertahan terhadap pH yang sangat rendah (pH 2,0) selama minimal 90 menit. Bakteri probiotik selanjutnya memasuki saluran usus bagian atas (pH 7,2) yang merupakan tempat disekresikan garam empedu. Penelitian ini bertujuan untuk melakukan seleksi bakteri asam laktat hasil isolasi dari daging sapi dari pasar tradisional di kabupaten Bogor (Arief et al., 2006) untuk mendapatkan kandidat isolat probiotik yang mempunyai karakteristik pertumbuhan terbaik dalam kondisi lingkungan asam kuat HCl sesuai dalam lambung dan adanya garam empedu (0,3%) sesuai usus halus.
Penelitian menggunakan dua puluh delapan isolat bakteri asam laktat yang telah diisolasi dari daging sapi. Masing-masing dari isolat bakteri asam laktat diuji kemampuan pertumbuhannya dalam media pH 2,0 sesuai dengan kondisi keasaman pada lambung dan pada pH 7,2 yang sesuai dengan kondisi pH usus halus. Isolat bakteri asam laktat yang mampu tumbuh baik pada perlakuan pH berbeda dengan viabilitas mencapai minimal 5 log10 diuji lebih lanjut pertumbuhannya pada kondisi
sesuai dengan usus (pH 7,2) dengan kadar garam empedu 0,3%. Penelitian dilakukan dengan tiga kali ulangan dan pengambilan data secara duplo. Peubah yang diamati adalah jumlah kematian populasi isolat bakteri asam laktat yang diujikan. Populasi yang tinggi menunjukkan toleransi yang baik pada kondisi tersebut. Populasi bakteri asam laktat dihitung dengan metode pour plate pada media MRS-agar. Analisis data menggunakan rancangan acak lengkap pola searah dengan uji lanjut Duncan.
Kondisi pH lambung (pH 2,0) maupun pH usus (pH 7,2) nyata (P<0,05) mempengaruhi pertumbuhan isolat bakteri asam laktat asal daging sapi. Sebanyak sepuluh isolat bakteri asam laktat memiliki toleransi yang baik pada kondisi pH lambung (pH 2,0) dengan urutan sebagai berikut 2C12a, 1A5a, 2B2b, 2B4b, 1B1b, 1C4c, 1A2c, 1A32d, 2B1de, dan 2D1ef.Bakteri asam laktat yang mampu bertahan pada pH 2,0 dan pH 7,2 dengan kadar garam empedu 0,3% didapatkan sebanyak tiga isolat dengan urutan toleransi yang terbaik 1A5a, 2B4ab, dan 1B1abc. Ketiga isolat bakteri asam laktat asal daging sapi yaitu 1A5, 2B4, dan 1B1 yang memiliki toleransi paling baik pada kondisi lingkungan pH lambung dan pH usus halus dengan kandungan garam empedu 0,3 % berpotensi digunakan sebagai bakteri kandidat probiotik.
ABSTRACT
Lactic Acid Bacteria Isolated from Meat with Acid and Bile Salt Tolerance as Probiotics Candidate by in vitro Technique
Wijayanto, U., I. I. Arief, and R. R. A. Maheswari
Lactic acid bacteria have been reported to be useful as a health adjunct and are commonly added to food as delivery mechanism. As candidate for probiotic, lactic acid bacteria should have the ability to survive in the digestion process such as resistance towards gastrointestinal tract pH and bile salt concentrations. Lactic acid bacteria utilised in this research were isolated from meat. Twenty eight isolates of lactic acid bacteria selected for their resistancy towards gastric juice pH (pH 2,0) and small intestines pH (pH 7,2) with 0,3% bile salt under in vitro conditions. The result showed that all strains well grown in small intestines pH (pH 7,2), but only 10 isolates had good resistance to gastric juice pH. There were significant difference among theme (P<0,05). Bile salt 0,3% with pH 7,2 influenced significantly the growth of lactic acid bacteria selected at gastric juice condition showed that only three strains (1A5, 2B4, and 1B1) showed tolerance (P<0,05) could be used as probiotics candidate in further applications.
ANALISIS
in vitro
TOLERANSI ISOLAT BAKTERI ASAM
LAKTAT ASAL DAGING SAPI TERHADAP pH
LAMBUNG, pH USUS DAN GARAM EMPEDU
SEBAGAI KANDIDAT PROBIOTIK
UMAR WIJAYANTO
D14204030
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
PROGRAM STUDI TEKNOLOGI HASIL TERNAK FAKULTAS PETERNAKAN
ANALISIS
in vitro
TOLERANSI ISOLAT BAKTERI ASAM
LAKTAT ASAL DAGING SAPI TERHADAP pH
LAMBUNG, pH USUS DAN GARAM EMPEDU
SEBAGAI KANDIDAT PROBIOTIK
Oleh
UMAR WIJAYANTO
D14204030
Skripsi ini telah disetujui dan disidangkan di hadapan Komisi Ujian Lisan pada tanggal 25 Agustus 2009
Pembimbing Utama
Irma Isnafia Arief, S.Pt, MSi NIP. 19750304 199902 2 001
Pembimbing Anggota
Dr. Ir. Rarah R. A. Maheswari, DEA NIP. 19620504 198703 2 002
Dekan Fakultas Peternakan Institut Pertanian Bogor
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 19 Mei 1986 di Bogor Jawa Barat. Penulis
adalah anak pertama dari dua bersaudara dari pasangan Bapak Subagio dan Ibu
Lasiyem. Pendidikan dasar diselesaikan pada tahun 1998 di SDN Mekarwangi,
pendidikan lanjutan menengah pertama diselesaikan pada tahun 2001 di SMPN 6
Bogor dan pendidikan lanjutan menengah atas diselesaikan pada tahun 2004 di
SMUN 5 Bogor. Penulis diterima sebagai mahasiswa pada Program Studi Teknologi
Hasil Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas
Peternakan, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB
(USMI) pada tahun 2004.
Selama mengikuti pendidikan, penulis aktif di Himpunan Mahasiswa
Produksi Peternakan Institut Pertanian Bogor dan FAMM Al An’aam Fakultas
Peternakan, Institut Pertanian Bogor serta kepanitiaan kegiatan kampus lainnya.
Penulis pernah menjadi asisten praktikum untuk mata kuliah Ilmu dan Teknik
Pengolahan Daging ajaran 2007/2008.
Salah satu syarat untuk memperoleh gelar sarjana pada Fakultas Peternakan,
Institut Pertanian Bogor, penulis melakukan penelitian selama empat bulan dengan
judul “Analisis in vitro Toleransi Isolat Bakteri Asam Laktat asal Daging Sapi
terhadap pH Lambung, pH Usus dan Garam Empedu sebagai Kandidat
Probiotik“, dibawah bimbingan Irma Isnafia Arief, S.Pt., M.Si dan Dr. Ir. Rarah
KATA PENGANTAR
Assalamua’alaikum wr.wb.
Puji syukur kami panjatkan Kehadirat Allah SWT, karena berkat rahmat dan
hidayah-Nya penulis diberikan kesempatan untuk menyelesaikan skripsi dengan
judul Analisis in vitro Toleransi Isolat Bakteri Asam Laktat asal Daging Sapi
terhadap pH Lambung, pH Usus dan Garam Empedu sebagai Kandidat
Probiotik. Tidak lupa shalawat dan salam bagi junjungan kami Nabi besar Muhammad SAW yang selalu kita nantikan syafaatnya di hari akhir kelak.
Penelitian dalam skripsi ini bertujuan untuk mendapatkan kandidat probiotik
hasil isolat daging. Ada beberapa syarat bagi suatu isolat dapat dikatakan sebagai
probiotik, yaitu mampu tahan terhadap asam dan garam empedu. Mikroba-mikroba
yang umum digunakan dalam pembuatan makanan dan minuman probiotik terutama
berasal dari kelompok bakteri asam laktat (BAL). Bakteri asam laktat merupakan
mikroflora normal yang terdapat di dalam daging.
Kondisi lingkungan terutama sangat mempengaruhi kemampuan, ketahanan
dan kinerja dari masing-masing isolat. Oleh karena itu diperlukan seleksi pada
bakteri asam laktat yang terdapat di daging sehingga didapatkan isolat yang potensial
sebagai probiotik.
Demikian skripsi ini disusun, penulis menyadari masih banyak kekurangan
dalam penulisan skripsi ini. Kritik dan saran selalu kami harapkan dan semoga
bermanfaat bagi para pembaca.
Wassalamu’alaikum wr.wb.
Bogor, September 2009
DAFTAR ISI
Lambung, Hati dan Kandung Empedu Manusia ... 10
Toleransi Isolat Bakteri Asam Laktat terhadap Asam Lambung ... 12
Toleransi Isolat Bakteri Asam Laktat terhadap Garam Empedu ... 13
METODE ... 15
Toleransi Isolat Bakteri Asam Laktat terhadap pH Lambung (2,0) dan pH Usus (7,2) ... 17
Toleransi Isolat Bakteri Asam Laktat terhadap Garam Empedu ... 18
Peubah ... 20
HASIL DAN PEMBAHASAN ... 21
Toleransi Isolat Bakteri Asam Laktat terhadap pH lambung (2,0) dan pH Usus (7,2) ... 21
viii
KESIMPULAN ... 31
Kesimpulan ... 31
Saran.... ... 31
UCAPAN TERIMA KASIH ... 32
DAFTAR PUSTAKA ... 33
DAFTAR TABEL
Nomor Halaman
1. Mikroorganisme yang Digunakan dalam Produk Probiotik ... 10
2. Rataan Populasi Isolat Bakteri Asam Laktat asal Daging
Sapi pada pH 2,0 dan 7,2 ... 22
3. Rataan Populasi Isolat Bakteri Asam Laktat asal Daging
DAFTAR GAMBAR
Nomor Halaman
1. Skema Jalur Fermentasi Heksosa oleh Bakteri Asam Laktat ... 7
2. Bagian-bagian Lambung Manusia ... 11
3. Lokasi Hati, Lambung, dan Kandung Empedu dalam
Saluran Pencernaan Manusia ... 12
4. Tahapan Seleksi Bakteri Asam Laktat sebagai
Kandidat Probiotik ... 16
5. Diagram Alir Pengujian Toleransi Bakteri Asam Laktat
terhadap pH 2,0 dan 7,2 ... 18
6. Diagram Alir Pengujian Toleransi Bakteri Asam Laktat
terhadap Garam Empedu 0,3% ... 19
DAFTAR LAMPIRAN
Nomor Halaman
1. Hasil Sidik Ragam Jumlah Kematian Populasi 28 Isolat Bakteri
Asam Laktat pada pH Lambung (2,0) ... 39
2. Hasil Sidik Ragam Jumlah Kematian Populasi 28 Isolat Bakteri
Asam Laktat pada pH Usus (7,2) ... 39
3. Hasil Sidik Ragam Jumlah Kematian Populasi 10 Isolat Bakteri
PENDAHULUAN
Latar Belakang
Ilmu pengetahuan dan teknologi saat ini berkembang dengan pesat dan telah
membawa perubahan pada pola pikir masyarakat tentang diet dan kesehatan.
Pengetahuan gizi yang meningkat, mengakibatkan masyarakat semakin selektif
dalam menentukan bahan pangan yang akan dikonsumsinya. Salah satu makanan
kesehatan yang berkembang saat ini adalah pangan probiotik.
Istilah probiotik didefinisikan oleh Naidu dan Clemens (2000) sebagai
makanan atau minuman yang mengandung mikroba hidup yang memiliki pengaruh
menguntungkan bagi yang mengkonsumsinya dengan cara meningkatkan
keseimbangan mukosa usus. Salah satu prasyarat mikroorganisme probiotik agar
dapat memberikan dampak positif terhadap kesehatan adalah mempunyai viabilitas
yang tinggi atau ketahanan hidup mikroba probiotik setelah melalui saluran
pencernaan. Beberapa karakteristik yang diperlukan bagi suatu isolat berpotensi
sebagai probiotik adalah mampu melewati stress di lambung karena asam lambung
yang tinggi dan dapat bertahan terhadap garam empedu pada usus halus sehingga
mampu bertahan hidup dalam usus besar. Viabilitas sel bakteri yang menjadi
kandidat probiotik harus berkisar antara 107-109 agar mampu bertahan di saluran
pencernaan dan tentu saja kemampuan dari probiotik tersebut harus telah terbukti.
Menurut Fardiaz (1992) bakteri asam laktat merupakan mikroflora normal
yang terdapat di dalam daging atau dapat ditambahkan sebagai kultur starter untuk
memfermentasi produk-produk dengan karakteristik yang dikehendaki. Bakteri asam
laktat merupakan salah satu jenis bakteri yang dapat berfungsi sebagai bakteri
probiotik. Bakteri asam laktat sebagai probiotik memiliki mekanisme untuk
mempertahankan mikroflora saluran pencernaan sehingga dapat memperbaiki
gangguan saluran pencernaan pada inangnya. Mikroflora usus adalah ekosistem yang
kompleks, terdiri atas berbagai jenis bakteri dalam jumlah yang besar.
Penelitian terdahulu (Arief et al., 2006) telah berhasil melakukan isolasi terhadap bakteri asam laktat yang berasal dari daging sapi dari pasar tradisional di
kabupaten Bogor telah diaplikasikan sebagai kultur starter untuk pembuatan produk
2 probiotik menarik untuk dilakukan, sehingga akan diperoleh bakteri asam laktat yang
memiliki fungsi ganda.
Tujuan
Tujuan dari penelitian ini adalah untuk melakukan seleksi bakteri asam laktat
hasil isolasi dari daging sapi untuk mendapatkan kandidat isolat probiotik dengan
karakteristik pertumbuhan terbaik dalam kondisi lingkungan pH lambung (pH 2), pH
usus (pH 7,2) dan adanya garam empedu 0,3%. Toleransi bakteri asam laktat
kandidat probiotik akan menunjukkan pertumbuhan yang tinggi walaupun
ditumbuhkan pada kondisi yang kritis yaitu pH 2,0 dan pH 7,2 dengan kandungan
garam empedu 0,3%.
TINJAUAN PUSTAKA
Probiotik
Istilah probiotik pertama kali dicetuskan untuk mendeskripsikan senyawa
yang dihasilkan mikroorganisme yang dapat menstimulir pertumbuhan
mikroorganisme lain. Definisi probiotik digunakan pada pemberian pakan ternak
yang disuplementasi dengan mikroba pada tahun 1960 untuk membantu hewan
ternak khususnya dalam saluran pencernaannya. Fuller (1999) menyatakan bahwa
probiotik adalah mikroorganisme yang bila dikonsumsi, baik dalam bentuk sel
kering maupun produk fermentasi memberikan efek menguntungkan dengan
memperbaiki sifat mikroflora indigenous. Selanjutnya definisi probiotik berkembang
menjadi makanan suplemen berupa mikroba hidup yang memiliki keuntungan
kepada manusia khususnya dalam keseimbangan mikroflora usus (Shortt, 1999).
Definisi tersebut diperluas oleh para ahli dari Eropa dengan mempertimbangkan
mekanisme probiotik selain yang diperantarai mikroflora usus. Probiotik adalah
bahan pangan berupa mikroorganisme hidup yang mempunyai pengaruh
menguntungkan terhadap kesehatan manusia.
Definisi lain tentang probiotik adalah sediaan sel mikroba hidup atau
komponen dari sel mikroba yang memiliki pengaruh menguntungkan terhadap
kesehatan dan kehidupan inangnya (Salminen et al., 1999). Definisi tersebut
memiliki implikasi bahwa probiotik tidak selalu harus berupa sel hidup karena telah
terbukti bahwa probiotik dalam bentuk sel yang tidak hidup juga menunjukkan
pengaruh positif terhadap kesehatan inang (Ouwehand dan Salminen, 1998).
Probiotik sangat penting bagi tubuh karena menunjukkan peranan fisiologis yang
penting dalam menjaga keseimbangan mikroflora saluran pencernaan sehingga
terbentuk suatu ekosistem yang unik, yaitu terjadi interaksi yang kompleks yang
bekerja secara sinergis dan antagonistis tergantung dari strain yang terlibat, jumlah
dan aktivitas metaboliknya (Mattila-Sandholm et al., 1999)
Sejumlah peneliti juga mengungkapkan beberapa pengaruh positif bagi
kesehatan dari probiotik yaitu (a) meningkatkan ketahanan terhadap penyakit infeksi
terutama infeksi usus dan diare, (b) menurunkan tekanan darah/ antihipertensi, (c)
menurunkan konsentrasi kolesterol serum darah, (d) mengurangi resiko lactose
4 menurunkan resiko terjadinya tumor dan kanker kolon dan (h) bersifat antimutagenik
serta bersifat anti karsinogenik (Kusumawati, 2002).
Menurut Shortt (1999), ada beberapa kriteria yang perlu dipertimbangkan
untuk mendapatkan produk probiotik dengan pengaruh positif optimal bagi inangnya,
diantaranya adalah : (a) spesies bakteri probiotik sebaiknya tidak bersifat patogen,
(b) toleran terhadap asam dan garam empedu, (c) memiliki kemampuan menempel
dan mengkolonisasi usus, (d) memiliki kemampuan untuk bertahan selama proses
pengolahan dan selama waktu penyimpanan, (e) memiliki karakteristik sensor yang
baik, (f) memiliki sifat antagonistik terhadap mikroba patogen enterik, (g) terbukti
memiliki pengaruh menguntungkan bagi kesehatan inang, (h) produk probiotik
diharapkan memiliki jumlah sel hidup yang besar (107-109 cfu/ml) dan (i) total
konsumsi produk probiotik sekitar 300-400 gram per minggu. Dua alasan terakhir
diperlukan untuk memperkirakan bahwa tersedia cukup bakteri probiotik dalam
tubuh untuk memberi pengaruh positif (Tannock, 1999).
Efek probiotik dapat dipertahankan jika makanan pembawa mengandung
minimal organisme probiotik 106-108 cfu/ml (Svensson, 1999), atau 108-1010 cfu/gr
(preparat kering) (Vinderola et al., 2000). Konsumsi minimal per hari dianjurkan
oleh Gilliland (1989) adalah 106-109 sel. Konsumsi probiotik sebaiknya teratur
karena waktu kolonisasi dari mikroorganisme probiotik bersifat terbatas, ditambah
lagi adanya kompetisi dengan mikroorganisme intestinal patogen.
Bakteri Asam Laktat
Salah satu jenis bakteri yang umum terdapat di daging adalah bakteri asam
laktat. Bakteri asam laktat dicirikan sebagai bakteri Gram positif, tidak membentuk
spora, katalase negatif tetapi kadang-kadang terdeteksi katalase semu pada kultur
yang ditumbuhkan pada konsentrasi gula rendah, anaerob aerotoleran, tahan asam,
fermentatif, berbentuk batang dan bulat, habitatnya harus kaya nutrisi, dengan
komposisi basa DNA kurang dari 50% mol G+C (Axelsson, 1998; Adam dan Moss,
1995; Pot et al., 1994).
Fardiaz (1992) mengatakan bahwa bakteri asam laktat merupakan mikroflora
normal yang terdapat di dalam daging. Kultur starter untuk produk daging yang
pertama kali diproduksi secara komersial adalah Pediococcus cereviseae. Pengujian
5 komersialisasi karena bakteri ini tidak tahan lyofilisasi. Gilliland (1986) mengatakan
bahwa untuk kultur starter yang umum untuk produk-produk daging, isolat terbanyak
yang ditemukan dalam produk-produk fermentasi daging adalah berbagai varian dari
Lactobacillaceae. Menurut Hayakawa (1992), bakteri asam laktat adalah kelompok bakteri yang menguntungkan, mampu memfermentasi gula sebagai sumber energi
untuk memproduksi asam laktat dalam jumlah besar dan jika memecah protein, tidak
membentuk senyawa putrefaktif (senyawa yang berbau busuk).
Bakteri asam laktat sering digunakan dalam proses pengolahan pangan,
misalnya pada pengolahan susu seperti yogurt, kefir, keju; dalam fermentasi sayuran
seperti sauerkraut, pikel, kecap kedelai, miso; dalam fermentasi ikan seperti kecap
ikan dan pasta ikan; dalam pembuatan silase seperti bakteri E. faecium dan E.
faecalis; serta dalam pengolahan daging seperti sosis fermentasi, salami probiotik dan daging fermentasi. Klasifikasi bakteri asam laktat berdasarkan beberapa hal
yaitu: morfologinya, kemampuan memfermentasi glukosa, perbedaan tumbuh pada
suhu-suhu tertentu, konfigurasi produksi asam laktat, kemampuan untuk tumbuh
pada konsentrasi garam tinggi dan kemampuan toleransinya terhadap asam dan basa.
Jay (1996) mengatakan bahwa bakteri asam laktat bersifat mesofilik dan termofilik,
beberapa dapat tumbuh pada suhu 5oC dan tertinggi 45oC, dapat bertahan pada pH
3,2 dan pada pH yang lebih tinggi (9,6), beberapa hanya bisa tumbuh pada kisaran
pH yang sempit (4,0-4,5). Pot et al. (1994) menyatakan bahwa semula bakteri asam
laktat diklasifikasikan menjadi 4 genus yaitu Lactobacillus, Leuconostoc,
Streptococcus, Pediococcus, yang didasarkan pada ciri morfologi, tipe fermentasi, kemampuan tumbuh pada suhu yang berbeda, sifat stereospesifik (D atau L laktik),
serta toleransi terhadap asam dan basa. Klasifikasi bakteri asam laktat terus
berkembang, sehingga genus Lactobacillus menjadi Lactobacillus dan
Carnobacterium. Genus Streptococcus menjadi 4 yaitu Streptococcus, Lactococcus, Vagococcus dan Enterococcus. Genus Pediococcus menjadi Pediococcus, Tetratogenococcus dan Aerococcus. Sementara tidak ada perubahan pada genus
Leuconostoc. Klasifikasi yang baru tersebut dihasilkan dengan mempertimbangkan komposisi asam lemak pada membran sel, motilitas dan urutan rRNA, serta persen
guanin dan sitosin pada DNA. Klasifikasi spesies sering juga dicantumkan
6 konfigurasi produksi asam laktat. Berdasarkan pada perbedaan fenotip atau sifat
biokimia, bakteri asam laktat dibedakan dalam kemampuan memfermentasi
karbohidrat, menghidrolisis arginin, pembentukan asetoin, toleransi pada garam
empedu, kemampuan menghemolisis, produksi polisakarida ekstraseluler, keperluan
faktor pertumbuhannya, dihasilkannya beberapa enzim seperti β-galaktosidase dan β
-glukuronidase, karakteristik pertumbuhan dalam susu dan pembedaan dalam
serologinya (Axelsson, 1998; Pot et al., 1994). Karakterisasi lebih lanjut meliputi
pendekatan molekuler. Pendekatan ini meliputi perbedaan asam diamin dalam
peptidoglikan, adanya dan perbedaan asam teikoat, adanya dan perbedaan
menaquinon, rasio guanin + cytosin (G+C) dalam DNA, komposisi asam lemak dan
keaktifan elektroporesis dari laktat dehidrogenase (LDH).
Pengklasifikasian yang tidak kalah penting adalah perbedaannya dalam
memfermentasi glukosa yang dibagi dalam heterofermentatif dan homofermentatif
(Fardiaz, 1989). Bakteri asam laktat heterofermentatif yaitu memfermentasi glukosa
menjadi asam laktat melalui jalur fosfoketolase, etanol atau asam asetat dan CO2,
sedangkan homofermentatif mengubah keseluruhan glukosa menjadi asam laktat
melalui jalur glikolisis. Bakteri asam laktat yang bersifat homofermentatif misalnya:
Lactobacillus sp. dan Bacillus dextrolacticus. spesies Lactobacillus antara lain
Lactobacillus plantarum, Lactobacillus bulgaricus, Pediococcus cerevisae dan Streptococcus paecalis. Bakteri asam laktat yang bersifat heterofermentatif yaitu
Leuconostoc mesentroides dan Lactobacillus brevis (Fardiaz, 1992).
Jalur glikolisis (Embden-Meyerhof-Parnas) merupakan jalur yang digunakan
oleh seluruh bakteri asam laktat kecuali Leuconostoc, grup lactobacillus dengan
heterofermentasi obligat, oenococcus dan wissellas. Selain glukosa, bakteri asam
laktat juga mampu memfermentasi heksosa seperti manosa, galaktosa dan fruktosa.
(Salminen et al., 2004). Jalur fermentasi heksosa oleh bakteri asam laktat dapat
7 Glukosa
Fru-1,6P Fru-6P Glu-6P
Asetil-P + Eritrosa-4P 6P-Glukonat
Triose-3P Fru-6P
Homofermentasi (Heterofermentasi)
(Jalur Fosfoketolase)
Gambar 1. Skema Jalur Fermentasi Heksosa oleh Bakteri Asam Laktat (Kandler, 1983)
Bakteri Asam Laktat sebagai Probiotik
Bakteri asam laktat yang bersifat sebagai probiotik pada pencernaan manusia
merupakan mikroflora normal usus, terdiri atas Bifidobacteria dan Lactobacillus
acidophilus (Gomes dan Malcata, 1999). Selanjutnya Fuller (1992) mengatakan bahwa bakteri asam laktat digunakan sebagai probiotik karena mampu : (1)
menghasilkan asam laktat yang dapat menurunkan pH, (2) dalam kondisi aerob
memproduksi hidrogen peroksida, (3) memproduksi komponen penghambat yang
spesifik misalnya bakteriosin. Bakteri asam laktat memiliki peranan yang penting
pada kehidupan manusia, karena kemampuannya untuk menghasilkan makanan
fermentasi maupun kemampuannya untuk hidup di dalam saluran pencernaan.
Penelitian bakteri asam laktat yang berpotensi probiotik untuk kesehatan telah
banyak dilakukan contohnya adalah manfaat probiotik pada penyakit gangguan
saluran pencernaan.
Menurut Mitsuoka (1990), bakteri asam laktat dapat dibagi atas 4 grup,
berdasarkan keberhasilan hidupnya di dalam saluran pencernaan manusia, yaitu (1)
grup yang berhasil hidup di dalam lumen usus dan merupakan organisme yang paling
8
Bifidobacterium, (2) grup yang berhasil hidup di dalam lumen usus dan sering
ditemukan dalam spesimen usus manusia, contohnya Lactobacillus (Lactobacillus
acidophilus, Lactobacillus reuteri), (3) grup yang berhasil hidup di dalam lumen usus dan kadang-kadang ditemukan dalam spesimen usus manusia, contohnya
Lactobacillus (Lactobacillus casei, Lactobacillus brevis) dan (4) grup yang sering digunakan dalam pembuatan produk susu dan tidak dapat dijumpai dalam spesimen
usus manusia, contohnya Lactobacillus (Lactobacillus bulgaricus) dan Laktokoki
(Streptococcus thermophilus, Streptococcus cremoris).
Naidu dan Clemens (2000) menyatakan bahwa bakteri asam laktat dengan
aktivitas probiotiknya berperan penting dalam mengatur ekosistem saluran
pencernaan. Aktivitas probiotik terbagi atas 3 spektrum, yaitu nutrisi, fisiologi dan
efek antimikroba. Aspek nutrisi berupa penyediaan enzim untuk membantu
metabolisme komponen makanan (laktase), sintesis beberapa vitamin (K, folat,
piridoksin, pantotenat, biotin dan riboflavin) dan menghilangkan racun metabolit
komponen makanan di dalam usus. Aspek fisiologi meliputi kemampuan menjaga
keseimbangan komposisi mikroflora usus dan menstimulasi sistem kekebalan usus.
Efek antimikroba yang dimiliki oleh probiotik yaitu kemampuannya untuk
memperbaiki ketahanan terhadap bakteri patogen.
Pertumbuhan dan metabolisme dari spesies bakteri pada usus tergantung dari
substrat yang tersedia, yang umumnya berasal dari makanan yang dikonsumsinya.
Wright dan Salminen (1999) menyatakan kelebihan bakteri asam laktat adalah
kemampuannya untuk bertahan hidup mengkolonisasi usus, memproduksi asam
laktat, bakteriosin dan merangsang pembentukkan antibodi tubuh. Menurut
Evanikastri (2003), untuk bersifat sebagai probiotik maka bakteri asam laktat harus
memiliki beberapa syarat sebagai berikut : (1) tahan terhadap asam, terutama asam
lambung yang memiliki pH antar 1,5-2,0 sewaktu tidak makan dan pH 4,0-5,0
sehabis makan, sehingga mampu bertahan dan hidup lama ketika melalui lambung
dan usus, (2) stabil terhadap garam empedu dan mampu bertahan hidup selama
berada pada bagian usus kecil. Empedu disekresikan ke dalam usus untuk membantu
absorbsi lemak dan asam empedu yang terkonjugasi dan diserap dari usus kecil, (3)
memproduksi senyawa antimikroba seperti asam laktat, hidrogen peroksida dan
9 probiotik merupakan syarat untuk pengkolonisasian, aktivitas antagonis terhadap
patogen, pengaturan sistem daya tahan tubuh dan mempercepat penyembuhan
infeksi, (5) tumbuh baik dan berkembang dalam saluran pencernaan, sebagai
probiotik tentu saja kemampuan untuk tumbuh harus diperhatikan. Pada beberapa
genus bifidobakteria dan laktobasili dapat tumbuh baik pada saluran pencernaan
tanpa adanya oksigen, (6) koagregasi membentuk lingkungan mikroflora normal dan
seimbang, koagregasi juga mencerminkan kemampuan interaksi antar kultur untuk
saling menempel dan (7) aman digunakan oleh manusia. Uji secara in vivo
merupakan salah satu indikator bahwa probiotik tersebut dapat dikonsumsi oleh
manusia.
Fermented Milks and Lactic Acid Bacteria Association yang berkedudukan di
Jepang mensyaratkan jumlah minimal 1 x 107 bifidobacteria setiap g atau ml produk
makanan probiotik. Jumlah sel mikroba hidup yang harus terdapat pada produk
probiotik masih menjadi perdebatan, akan tetapi umumnya adalah sebesar 106-108
cfu/ml (Tannock, 1999). Ditambahkan pula oleh Charteris et al. (1998) yang
menyatakan bahwa jumlah minimal mikroorganisme probiotik dalam bioproduk
untuk dapat memberikan manfaat kesehatan adalah 109-1010 cfu/100g produk.
Penelitian mengenai bakteri asam laktat sebagai kandidat probiotik telah banyak
dilakukan pada bidang kesehatan, probiotik banyak diteliti berkaitan dengan
kemampuannya mengatasi gangguan pencernaan. Gill dan Guarner (2004)
mengatakan beberapa gangguan pencernaan dapat berupa inflamasi pada saluran
pencernaan. Selain itu juga sebagai penghasil antimikroba, bakteri asam laktat dapat
menghambat bakteri patogen sehingga dapat mencegah terjadinya diare dan infeksi
usus. Menurut Bernet et al. (1993) bakteri asam laktat dari genus Bifidobacteria dan
Lactobacillus telah terbukti memilki efek probiotik pada manusia. Keberadaan
Lactobacillus dalam saluran pencernaan dapat menjaga keseimbangan ekosistem mikroba dalam usus. Bakteri asam laktat juga dapat bersifat sebagai imunomodulator
untuk meningkatkan daya tahan tubuh (Erickson, 2000). Keuntungan lain dari
mengkonsumsi bakteri asam laktat adalah menstimulir pergerakan usus. Stimulasi
pergerakan usus ini terkait dengan waktu transit di dalam usus (lamanya transit). Jika
bakteri asam laktat mampu bertahan lama dalam usus maka akan menstimulir
10 Tabel 1. Mikroorganisme yang Digunakan dalam Produk Probiotik
Lactobacilli Bifidobacteria Bakteri Asam Laktat lainnya
Bukan Bakteri Asam Laktat
L. acidophilus B. animali E. faecium B. cereus
L. casei B. breve E. coli
L. johnsonii B. infantis S. boulardi
L. reuteri B. longum Cl. butyricum
L. salivarus B. adolescentis L. plantarum B. lactis
L. crispatus B. bifidum L. rhamnosus
Sumber : Shortt 1999.
Lambung, Hati dan Kandung Empedu Manusia
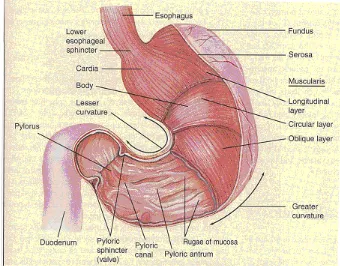
Lambung berbentuk seperti huruf J dan merupakan pembesaran dari saluran
pencernaan. Lambung dibagi oleh ahli anatomi menjadi empat bagian, yaitu bagian
fundus, kardiak, “body” atau badan dan pilorus. Bagian kardiak mengelilingi lower
esophageal sphincter. Bagian bulat yang terletak diatas dan disebelah kiri bagian kardiak adalah fundus. Di bawah fundus adalah bagian pusat yang terbesar dari
lambung, yang disebut dengan “body” atau badan lambung. Bagian yang menyempit,
pada daerah inferior adalah pilorus.
Sekresi dari getah lambung diatur oleh mekanisme syaraf dan hormonal.
Impuls parasimpatis yang terdapat pada medulla dihantarkan melalui syaraf vagus
dan merangsang gastric glands untuk mensekresikan pepsinogen, asam klorida,
mukus dan hormon gastrin. Asam klorida (HCl) terlibat dalam perubahan pepsinogen
menjadi enzim aktif yaitu pepsin dan faktor intrinsik, terlibat dalam penyerapan
vitamin B12 untuk produksi sel darah merah, yang diproduksi oleh sel parietal. HCl
juga memiliki fungsi mengasamkan makanan, sebagai antiseptik dan desinfektan dan
membuat suasana asam pada pepsinogen sehingga menjadi pepsin. Larutan ini adalah
11 Gambar 2. Bagian-Bagian Lambung Manusia
Hati dan kandung empedu terletak di perut kanan bagian atas dan keduanya
dihubungkan oleh suatu saluran yang dikenal sebagai duktus biliaris (saluran
empedu). Meskipun memiliki saluran penghubung dan keduanya berperan dalam
fungsi yang sama, tetapi hati dan kandung empedu sangat berbeda satu sama lain.
Hati berbentuk seperti baji dan merupakan pabrik kimia pada tubuh manusia.
Hati merupakan suatu organ kompleks yang melaksanakan berbagai fungsi vital,
mulai dari mengatur kadar bahan kimia dalam tubuh sampai menghasilkan zat-zat
pembekuan darah. Salah satu fungsi utamanya adalah menghancurkan zat-zat yang
berbahaya yang diserap dari usus atau dibuat di bagian tubuh lainnya, kemudian
membuangnya sebagai zat yang tidak berbahaya ke dalam empedu atau darah.
Kandung empedu berbentuk seperti buah pir dan merupakan tempat penyimpanan
empedu.
Empedu mengalir dari hati melalui duktus hepatikus kiri dan kanan, lalu
keduanya bergabung membentuk duktus hepatikus utama. Duktus hepatikus utama
bergabung dengan saluran yang berasal dari kandung empedu (duktus sistikus)
membentuk saluran empedu utama. Saluran empedu utama masuk ke usus bagian
atas pada sfingter Oddi, yang terletak beberapa sentimeter di bawah lambung. Unsur
12 pigmen empedu (terutama bilirubin terkonjugasi). Garam empedu penting untuk
pencernaan dan absorpsi lemak dalam usus halus. Oleh bakteri usus halus sebagian
besar garam empedu direabsorpsi dalam ileum, mengalami resirkulasi ke hati,
kemudian mengalami rekonjugasi dan resekresi. Garam empedu menyebabkan
meningkatnya kelarutan kolesterol, lemak dan vitamin yang larut dalam lemak,
sehingga membantu penyerapannya dari usus.
Gambar 3. Lokasi Hati, Lambung dan Kandung Empedu dalam Saluran Pencernaan Manusia
Toleransi Isolat Bakteri Asam Laktat terhadap Asam Lambung
Toleransi terhadap asam lambung merupakan syarat penting suatu isolat
untuk dapat menjadi probiotik. Hal ini disebabkan bila isolat tersebut masuk ke
dalam saluran pencernaan manusia, salah satu kondisi yang menekan adalah pada
saat di lambung, yang memiliki pH sekitar 2,5 sehingga bakteri asam laktat harus
mampu bertahan hidup (Jacobsen et al., 1999). Hasil sekresi dari lambung dikenal
dengan istilah getah lambung berupa cairan jernih berwarna kuning pucat yang
mengandung HCl 0,2-0,5% dengan pH sekitar 1,5 (bila lambung dalam kondisi
benar-benar kosong). Getah lambung terdiri atas air (97-99%), musin (lendir) serta
garam anorganik, enzim pencernaan (pepsin serta renin) dan lipase. Berrada et al.
(1991) menyatakan bahwa waktu yang diperlukan mulai saat bakteri masuk sampai
13 probiotik harus mampu bertahan dalam keadaan asam lambung selama sedikitnya 90
menit.
Booth dan Kroll (1989) menyatakan bahwa asam kuat seperti HCl
menyebabkan penurunan pH eksternal. Asam kuat menyebabkan enzim-enzim yang
terdapat pada permukaan sel terdenaturasi oleh pH rendah sehingga menurunkan pH
sitoplasma akibat peningkatan permeabilitas proton pada gradien pH yang besar.
Bakteri asam laktat adalah mikroorganisme fermentatif yang mampu tumbuh pada
kisaran pH yang luas. Diantara genus bakteri asam laktat, spesies-spesies dalam
laktobasili dikenal memiliki ketahanan yang baik dalam kondisi asam. Pertahanan
utama sel bakteri dari lingkungannya adalah membran seluler yang terdiri atas
struktur lemak dua lapis. Paparan sel bakteri dalam lingkungan yang sangat asam
dapat menyebabkan kerusakan pada membran sel tersebut dan keluarnya
komponen-komponen intraseluler yang mengakibatkan kematian sel. Bakteri yang toleran
terhadap asam, membran selnya lebih tahan terhadap kebocoran akibat pH rendah
dibandingkan dengan yang tidak tahan asam (Bender et al., 1986).
Tidak seperti bakteri netrofilik (hanya tumbuh pada kondisi pH mendekati
netral) yang menjaga pH intraselulernya mendekati netral, pada bakteri asam laktat
terjadi perubahan dinamis pH intraseluler seiring dengan terjadinya penurunan pH
ekstraseluler (Nannen dan Hutkins 1991; Siegumfeldt et al., 2000) sehingga tidak
terjadi gradien proton yang besar. Bakteri asam laktat tidak hanya tumbuh dengan
lambat pada pH rendah, tapi kerusakan akibat asam dan hilangnya viabilitas juga
dapat terjadi pada sel bakteri yang terpapar pada pH rendah. Tiap galur memiliki
ketahanan berbeda terhadap asam atau pH rendah. Ada beberapa kemungkinan
mekanisme bagaimana bakteri mengatur pH internal tetapi yang paling penting
adalah translokasi proton oleh enzim ATP-ase (Hutkins dan Nannen, 1993).
Parameter lain yang terlibat dalam pengaturan pH internal adalah permeabilitas
membran plasma terhadap proton.
Toleransi Isolat Bakteri Asam Laktat terhadap Garam Empedu
Toleransi isolat bakteri asam laktat terhadap garam empedu juga merupakan
syarat penting untuk probiotik. Bakteri asam laktat untuk dapat bertahan dan tumbuh
pada saluran pencernaan harus mampu melewati bagian atas saluran usus yang berisi
14 Asam empedu disintesa dalam hati dari kolesterol, menghasilkan senyawa
yang disebut asam empedu primer. Asam empedu utama ini berkonjugasi dengan
glisin atau taurin dan disekresikan ke dalam kantung empedu sebagai asam empedu
terkonjugasi. Asam empedu di dalam kantung empedu dilepaskan ke dalam lumen
duodenum dalam bentuk misel dengan asam lemak dan gliserol yang dihasilkan oleh
pencernaan lipase pankreatik. Sebanyak antara 5,500 sampai 35,500 mg asam
empedu terkonjugasi desekresikan ke dalam usus kecil manusia setiap, untuk
membantu absorpsi lemak makan, kolesterol, vitamin hidrofobik dan senyawa larut
lemak yang lain. Asam empedu terkonjugasi diserap dari usus kecil (sekitar 97%)
dan dikembalikan ke dalam hati melalui sirkulasi hati. Sebagian kecil dari asam
empedu (250-400 mg) yang tidak diserap hilang dari tubuh manusia sebagai asam
empedu bebas di feses. Mekanisme saat asam empedu diserap dalam usus kecil dan
kolon, disintesa kembali dan disekresikan lagi dikenal sebagai sirkulasi hati harinya
(Corzo dan Gilliland, 1999).
Seperti halnya ketahanan terhadap asam, menurut Zavaglia et al. (1998) dan
Jacobsen et al. (1999), semua mikroba yang berhasil hidup setelah ditumbuhkan
dalam MRSA yang ditambah 0,3% ox gall, dinyatakan bersifat tahan terhadap garam
empedu. Konsentrasi garam empedu sebesar 0,3% merupakan konsentrasi yang
kritikal, nilai yang cukup tinggi untuk menyeleksi isolat yang resisten terhadap
garam empedu. Laktobasili yang paling bersifat resisten terhadap garam empedu
terdapat pada bagian atas usus halus (jejunum). Hal ini juga dilaporkan oleh Ray
(1996) dan Drouault et al. (1999), bahwa jumlah bakteri asam laktat yang terdapat di
yeyunum lebih rendah dibanding ileum, sekum dan kolon. Hal ini disebabkan
konsentrasi garam empedu pada bagian yeyunum paling tinggi daripada ileum,
METODE
Lokasi dan Waktu
Penelitian ini dilaksanakan di Bagian Ilmu Produksi Ternak Ruminansia
Besar, Fakultas Peternakan Institut Pertanian Bogor. Penelitian ini dilakukan selama
lima bulan dari bulan Juli sampai Nopember 2008.
Materi
Bahan-bahan yang diperlukan untuk penelitian ini meliputi 28 isolat bakteri
asam laktat asal daging sapi (1A1, 1A2, 1A32, 1A4, 1A5, 1A6, 1B1, 1B2, 1C1, 1C3,
1C4, 1C6, 1D1, 1D2, 1D3, 2A1, 2A2, 2A3, 2B1, 2B2, 2B3, 2B4, 2C2, 2C12, 2D1,
2D2, 2D41, 2D42) yang diperoleh dari penelitian sebelumnya oleh Arief et al.
(2006). Kode ke-28 isolat ini diperoleh dari daging dengan masa penyimpanan
berbeda yaitu 12 jam (1) dan 34 jam (2), pasar berbeda yaitu pasar Anyar 1 (A),
pasar Cibeureum (B), pasar Ciampea (C), pasar Gunung Batu (D), pasar Anyar 2 (E)
dan bakteri ke-1 (1), ke-2 (2), ke-3 (3), dst. Isolat 1A1, 1A4, 2B1, 2B3, 1D2, 2D1
dan 2D2 memiliki morfologi bentuk bulat sedangkan ke-21 isolat lainnya memiliki
morfologi bentuk batang (Firmansyah, unpublished). Media yang digunakan adalah
Buffer Pepton Water (BPW), Posphat Buffer Salin (PBS), de Man Rogosa Sharp Broth (MRSB), Bacteriological Agar (BA), Yeast Extract (YE), dan Ox gall.
Bahan-bahan kimia yang digunakan adalah aquadestilata, buffer pH 4 dan 7, HCl 0,1N,
NaOH 0,1N, alkohol 70%, dan teepol.
Peralatan yang diperlukan untuk penelitian ini adalah cawan Petri, pemanas
Bunsen, pipet volumetrik (1 ml, 5 ml, dan 10 ml), mikropipet (0,1 ml, 1 ml dan 5
ml), tabung reaksi, vorteks, autoklaf, mikroskop, stopwatch, botol Schott, inkubator,
alumunium foil, kompor, panci, gelas ukur, alat gelas lainnya dan alat-alat tulis.
Rancangan
Penelitian ini menggunakan rancangan acak lengkap pola searah sebanyak 28
isolat diuji pada pH dan garam empedu dengan tiga kali ulangan. Perlakuan yang
diberikan meliputi kemampuan hidup isolat pada media berbeda yaitu dengan pH 2
dan pH 7,2 dengan kadar garam empedu 0,3%. Sidik ragam dilakukan untuk setiap
parameter pengujian. Apabila hasil sidik ragam menunjukkan respon yang berbeda
16 rancangan percobaan yang digunakan mengacu pada Steel dan Torrie (1995) sebagai
berikut:
Yij = μ + τi + εij
Keterangan:
Yijk. = Respon yang didapat (jumlah bakteri) dari pengaruh perlakuan.
µ = Nilai rataan umum
τi = Pengaruh perlakuan pH (2,0 dan 7,2) dan garam empedu 0,3%
Εij = Galat percobaan untuk taraf ke-i dan ulangan ke-j
Peubah yang diamati selama penelitian ini ialah jumlah populasi bakteri asam
laktat yang mati dari masing-masing isolat kultur bakteri asam laktat untuk
menentukan isolat yang mempunyai toleransi tertinggi terhadap kondisi lambung (pH
2,0) dan kondisi usus (pH 7,2) dengan kadar garam empedu 0,3% . Jumlah populasi
bakteri asam laktat yang mati digunakan sebagai dasar penentu bakteri asam laktat
sebagai kandidat probiotik.
Prosedur
Penelitian ini dilakukan melalui dua tahap yaitu (1) seleksi isolat bakteri asam
laktat asal daging sapi terhadap lingkungan dengan kondisi yang berbeda yaitu pH 2
dan pH 7,2. Pada tahap 2 isolat bakteri asam laktat yang tahan terhadap pH 2
diseleksi kembali dalam media dengan garam empedu 0,3 % ox gall. Tahapan
prosedur dapat dilihat pada Gambar 4.
17
Gambar 4. Tahapan Seleksi Bakteri Asam Laktat sebagai Kandidat Probiotik
Penyegaran dan Penghitungan Populasi Awal (Lin et al., 2006)
Penyegaran dilakukan setiap kali sebelum pengujian ketahanan bakteri
terhadap asam maupun terhadap garam empedu. Penyegaran dilakukan dengan cara
isolat induk bakteri asam laktat sebanyak 1% dari masing-masing 28 isolat bakteri
asam laktat murni diinokulasikan ke dalam media MRS-broth 9 ml untuk kemudian
di inkubasi pada suhu 37oC selama 24 jam untuk mendapatkan kultur kerja. Setelah
diinkubasi dilakukan penghitungan populasi awal dengan cara sebelumnya
diencerkan pada media BPW (10-7, 10-8,10-9), selanjutnya dipupukkan dalam media
MRS-agar dengan metode pour plate.
Toleransi Isolat Bakteri Asam Laktat asal Daging pada pH Lambung dan pH Usus (Lin et al., 2006)
Uji toleransi terhadap pH lambung dan pH usus dilakukan dengan cara 28
isolat kerja bakteri asam laktat diinokulasikan masing-masing sebanyak 1% dengan
jumlah populasi awal minimal 108cfu/ml ke dalam media PBS untuk diatur pada pH
2,0 dan 7,2 menggunakan HCl 0,1N untuk menurunkan pH atau NaOH 0,1N untuk
menaikkan pH. Selanjutnya isolat diinkubasi pada suhu 37oC selama 3 jam. Setelah
Penyegaran dalam media MRS-broth + yeast ekstrak
Uji ketahanan pada garam empedu (bile salt 0,3% dengan pH 7,2) selama 24 jam (UJI 2)
Uji ketahanan pada pH lambung (pH 2,0) selama 3 jam (Uji 1)
Seleksi isolat bakteri asam laktat yang mampu hidup pada uji 1 dan 2
(Jika didapatkan lebih dari 3 isolat, maka dipilih hanya 3 isolat dengan toleransi pertumbuhan tertinggi, jika didapatkan ≤ 3 isolat, maka dipilih isolat tersebut)
Uji ketahanan pada pH Usus (pH 7,2) selama 3 jam (Uji 1)
18
itu dilakukan pemupukan untuk pnentuan jumlah populasi akhir dengan metode pour
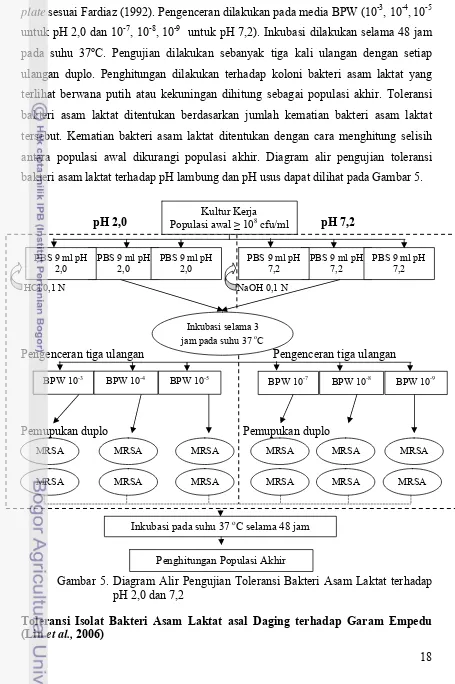
plate sesuai Fardiaz (1992). Pengenceran dilakukan pada media BPW (10-3, 10-4,10-5
untuk pH 2,0 dan 10-7, 10-8,10-9 untuk pH 7,2). Inkubasi dilakukan selama 48 jam
pada suhu 37oC. Pengujian dilakukan sebanyak tiga kali ulangan dengan setiap
ulangan duplo. Penghitungan dilakukan terhadap koloni bakteri asam laktat yang
terlihat berwana putih atau kekuningan dihitung sebagai populasi akhir. Toleransi
bakteri asam laktat ditentukan berdasarkan jumlah kematian bakteri asam laktat
tersebut. Kematian bakteri asam laktat ditentukan dengan cara menghitung selisih
antara populasi awal dikurangi populasi akhir. Diagram alir pengujian toleransi
bakteri asam laktat terhadap pH lambung dan pH usus dapat dilihat pada Gambar 5.
pH 2,0 pH 7,2
HCl 0,1 N NaOH 0,1 N
Pengenceran tiga ulangan Pengenceran tiga ulangan
Pemupukan duplo Pemupukan duplo
Gambar 5. Diagram Alir Pengujian Toleransi Bakteri Asam Laktat terhadap pH 2,0 dan 7,2
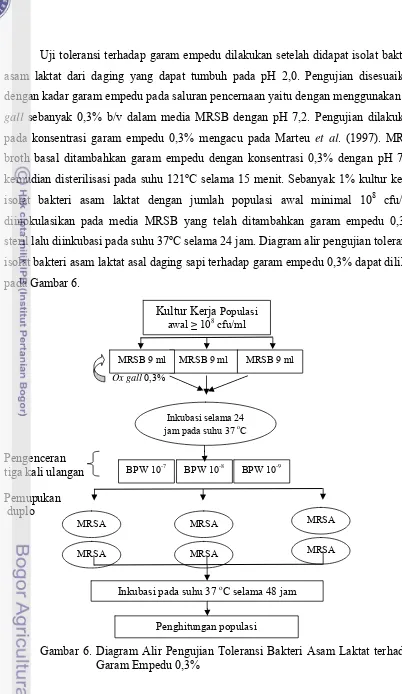
Toleransi Isolat Bakteri Asam Laktat asal Daging terhadap Garam Empedu (Lin et al., 2006)
Inkubasi pada suhu 37 oC selama 48 jam
19 Uji toleransi terhadap garam empedu dilakukan setelah didapat isolat bakteri
asam laktat dari daging yang dapat tumbuh pada pH 2,0. Pengujian disesuaikan
dengan kadar garam empedu pada saluran pencernaan yaitu dengan menggunakan ox
gall sebanyak 0,3% b/v dalam media MRSB dengan pH 7,2. Pengujian dilakukan
pada konsentrasi garam empedu 0,3% mengacu pada Marteu et al. (1997).
MRS-broth basal ditambahkan garam empedu dengan konsentrasi 0,3% dengan pH 7,2,
kemudian disterilisasi pada suhu 121oC selama 15 menit. Sebanyak 1% kultur kerja
isolat bakteri asam laktat dengan jumlah populasi awal minimal 108 cfu/ml
diinokulasikan pada media MRSB yang telah ditambahkan garam empedu 0,3%
steril lalu diinkubasi pada suhu 37oC selama 24 jam. Diagram alir pengujian toleransi
isolat bakteri asam laktat asal daging sapi terhadap garam empedu 0,3% dapat dilihat
pada Gambar 6.
Gambar 6. Diagram Alir Pengujian Toleransi Bakteri Asam Laktat terhadap Garam Empedu 0,3%
Kultur Kerja Populasi
awal ≥ 108 cfu/ml
Inkubasi pada suhu 37 oC selama 48 jam
20
Setelah diinkubasi pada suhu 37oC selama 24 jam, isolat diencerkan dengan
media BPW untuk selanjutnya dipupukkan dalam media MRSA pada cawan petri
dengan metode pour plate. Inkubasi dilakukan pada suhu 37oC selama 48 jam,
pengujian dilakukan sebanyak 3 kali. Populasi bakteri asam laktat yang dapat
bertahan hidup diamati dengan cara menghitung jumlah koloni yang berwarna putih
atau kekuningan sebagai populasi akhir. Toleransi bakteri asam laktat ditentukan
berdasarkan jumlah kematian bakteri asam laktat tersebut. Kematian bakteri asam
laktat ditentukan dengan cara menghitung selisih antara populasi awal dikurangi
HASIL DAN PEMBAHASAN
Toleransi Isolat Bakteri Asam Laktat asal Daging pada pH Lambung dan pH Usus
Menurut Havenaar et al. (1992), dalam pengembangan galur probiotik baru,
perlu dilakukan seleksi secara in vitro yang meliputi sensitivitas terhadap pH rendah,
cairan lambung, asam empedu, pankreas dan kemampuannya menekan pertumbuhan
mikroba patogen lain. Pada penelitian ini, 28 galur isolat bakteri asam laktat (1A1,
1A2, 1A32, 1A4, 1A5, 1A6, 1B1, 1B2, 1C1, 1C3, 1C4, 1C6, 1D1, 1D2, 1D3, 2A1,
2A2, 2A3, 2B1, 2B2, 2B3, 2B4, 2C2, 2C12, 2D1, 2D2, 2D41, 2D42) diuji secara in
vitro kemampuan tumbuh pada pH lambung dan pH usus untuk mengetahui
karakteristik probiotiknya, meliputi uji ketahanan terhadap pH rendah dan bile salt
(garam empedu). Kondisi yang kritikal bagi bakteri asam laktat pertama kali terjadi
pada saat sel bakteri memasuki saluran pencernaan, yaitu terpapar pada asam
lambung. Asam lambung memiliki pH yang sangat rendah, yaitu sekitar 2. Uji
ketahanan bakteri asam laktat pada pH rendah merupakan salah satu sifat yang paling
penting dalam menentukan karakteristik dari mikroorganisme probiotik. Hasil
pengujian ketahanan isolat daging bakteri asam laktat terhadap pH 2 dan 7,2 dapat
dilihat pada Tabel 2.
Uji ketahanan isolat bakteri asam laktat asal daging sapi terhadap pH rendah
(pH 2) selama 3 jam ditetapkan berdasarkan rataan ketahanan pertumbuhan dari
masing-masing isolat. Uji ketahanan isolat bakteri asam laktat terhadap pH 7,2 juga
dilakukan karena di dalam usus yang terdapat garam empedu memiliki pH yang
hampir mendekati netral, yaitu 7,2. HCl 0,1N pada PBS (media pertumbuhan)
ditambahkan untuk mendapatkan kondisi yang mendekati lambung. HCl adalah asam
kuat yang mudah terdisosiasi menghasilkan proton, menyebabkan penurunan pH
medium di luar sel atau pH ekstraseluler. Asam ini menghambat pertumbuhan sel
melalui efek denaturasi enzim-enzim yang ada di permukaan sel, kerusakan
lipopolisakarida, dan membran luar serta penurunan pH sitoplasma melalui
peningkatan permeabilitas membran terhadap proton pada gradien pH yang sangat
besar. HCl digunakan karena memiliki karakteristik yang mirip dengan asam
22 Tabel 2. Rataan Populasi Isolat Bakteri Asam Laktat asal Daging Sapi pada
pH 2 dan pH 7,2
1B2 5,58±0,51 fgh 0,1±0,03cdef
2D42 5,58±0,13 fgh 1,2±0,10 m
Keterangan : Tanda superskrip yang berbeda pada kolom yang sama menunjukan perbedaan yang nyata ( P < 0,05 )
23
Media PBS digunakan sesuai dengan penelitian Conway et al. (1987) yaitu
sebagai larutan penyangga yang mampu mempertahankan pH lingkungan bakteri
asam laktat untuk seleksi sebagai probiotik pada kondisi asam. Waktu inkubasi
selama 3 jam disesuaikan dengan waktu transit makanan dalam lambung manusia
berkisar antara 2-6 jam. Beberapa bakteri probiotik tumbuh hingga mencapai
populasi maksimum setelah 3 jam mengkonsumsi pangan probiotik (Oozer et al.,
2006). Hasil analisis ragam pada Tabel 2, menunjukkan bahwa terdapat perbedaan
nyata (P<0,05) pada ketahanan isolat-isolat yang diuji untuk tumbuh pada pH 2.
Bakteri asam laktat asal daging sapi yang mampu bertahan hidup dengan baik pada
pH 2 didapatkan sebanyak sepuluh isolat yaitu 2C12a, 1A5a, 2B2b, 2B4b, 1B1b, 1C4c,
1A2c, 1A32d, 2B1de, dan 2D1ef. Pemilihan isolat bakteri asam laktat berdasarkan
pada kemampuan tumbuhnya pada pH 2 dan mempertahankan populasinya minimal
5 log10 cfu/ml selama 3 jam sesuai Mitsuoka (1990)
Pengujian pada pH 7,2 selama 3 jam juga dilakukan untuk melihat ketahanan
isolat bakteri asam laktat asal daging sapi dalam usus halus yang memiliki pH
hampir mendekati netral. Hasil analisis ragam menunjukkan bahwa terdapat
perbedaan toleransi yang nyata (P<0,05) dari ke 28 isolat yang diuji pada pH 7,2
selama 3 jam. Keseluruhan isolat dapat tumbuh dengan tingkat kematian kurang dari
3 log sehingga dapat dikatakan bahwa seluruh isolat merupakan isolat yang tahan
pada kondisi usus (pH 7,2). Hal ini terjadi karena sifat bakteri asam laktat yang
cenderung tumbuh pada kisaran pH mendekati netral. Jay (1996) mengatakan bahwa
bakteri asam laktat bersifat mesofilik dan termofilik, beberapa dapat tumbuh pada
suhu 5oC dan tertinggi 45oC, dapat bertahan pada pH 3,2 dan pada pH yang lebih
tinggi yaitu pH 9,6, beberapa hanya bisa tumbuh pada kisaran pH yang sempit
4,0-4,5,
Isolat bakteri asam laktat mampu beradaptasi pada pH 2 karena memiliki
sistem regulasi pada pH internal sel (pHi). Hal ini dapat dicapai dengan sintesis
enzim-enzim baru dan mengeluarkan proton (H+) dari dalam sel yang
pengeluarannya terjadi melalui proses hidrolisis ATP (H+-ATPase). Casiano-Colon
dan Marquis (1998) berpendapat bahwa bakteri asam laktat bertahan dari kerusakan
asam karena adanya enzim histidin dekarboksilase dan enzim arginin deiminasi.
24 dapat melewati saluran lambung yang bersifat asam. Toleransi bakteri asam laktat
terhadap asam cukup tinggi disebabkan kemampuannya mempertahankan pH
sitoplasma lebih basa daripada pH ekstraseluler (Hutkins dan Nannen, 1993).
Pertahanan utama sel bakteri dari lingkungannya adalah membran seluler yang terdiri
atas struktur lemak dua lapis. Bila sel bakteri terpapar dalam kondisi asam, maka
membran sel dapat mengalami kerusakan dan berakibat hilangnya
komponen-komponen intraseluler, seperti Mg, K, dan lemak dari sel, biasanya kerusakan ini
menyebabkan kematian sel. Mekanisme bakteri untuk mengatur pH internalnya
adalah melalui translokasi proton oleh enzim ATP-ase, Enzim yang terikat pada
membran sel bertindak sebagai pompa yang akan memindahkan ion dan reaksinya
bersifat reversible. Enzim tersebut juga akan mengkatalisis gerakan proton
menyeberangi membran sel sebagai akibat dari hidrolisis dan sintesis ATP. Berbeda
dengan bakteri yang tidak tahan asam, bakteri yang tahan asam memiliki pH optimal
enzim yang lebih rendah dibandingkan dengan bakteri yang kurang tahan asam.
Bakteri asam laktat untuk mempertahankan pH sitoplasma supaya lebih basa sel
harus memiliki barrier terhadap aliran proton, barrier ini umumnya adalah membran
sitoplasma. Membran sitoplasma bakteri terdiri atas 2 lapis fosfolipid (lipid bilayer)
yang pada masing-masing permukaan lapisan tersebut melekat pada protein dan
glikoprotein. Lipid bilayer bersifat semipermeabel yang akan membatasi gerakan
senyawa yang keluar masuk antara sitoplasma dengan lingkungan luar.
Sebanyak 18 isolat bakteri asam laktat asal daging sapi lainnya didapatkan
tidak tahan terhadap asam lambung. Hal ini ditunjukkan dengan pertumbuhannya
yang tidak mampu mencapai hingga 5 log10. Kematian sel pada pH rendah
diakibatkan terjadinya pengasaman dinding sel. Paparan pada kondisi yang sangat
asam juga dapat mengakibatkan kerusakan membran dan lepasnya komponen
intraseluler yang mampu menyebabkan kematian. Kebanyakan bakteri asam laktat
tidak hanya tumbuh lebih lambat pada pH rendah, tetapi mungkin juga mengalami
kerusakan, terjadi penurunan viabilitas jika selnya berada pada kondisi pH rendah.
Toleransi relatif dari mikroorganisme terhadap lingkungan asam bergantung dari
jenis isolat tersebut. Perbedaan kerentanan membran sitoplasma inilah yang
menentukan toleransi bakteri tersebut pada pH rendah. Gradien proton yang besar
25 menggunakan banyak energi (Kobayashi, 1985) dan bakteri anaerobik mendapatkan
energi dari metabolisme gula yang jauh lebih kecil dibandingkan dengan bakteri
aerobik. Gradien proton yang besar juga mengakibatkan akumulasi anion asam
organik dalam sitosol yang bersifat racun bagi sel tersebut (Russel, 1992).
Komposisi asam lemak penyusun membran sitoplasma beragam diantara
spesies bakteri yang keragamannya tersebut mempengaruhi karakteristik dan
permeabilitasnya. Beberapa protein dalam membran secara spesifik juga
memfasilitasi pergerakan senyawa melewati membran. Komposisi dan struktur
protein yang berbeda pada membran sitoplasma juga menentukan karakteristik dan
permeabilitas membran tersebut. Keragaman asam lemak dan protein pada membran
sitoplasma diduga juga mempengaruhi keragaman ketahanan bakteri terhadap pH
rendah. Pada beberapa bakteri Gram positif terjadi peningkatan sintesis asam amino
fosfolipid (Booth et al., 1989) yang bermuatan positif jika ditumbuhkan pada media
yang ber-pH rendah. Perubahan ini diduga karena ionisasi asam amino pada pH
rendah menyebabkan permukaan membran bermuatan positif sehingga dapat
bertindak sebagai barrier proton. Selain itu, bakteri yang tahan asam memiliki enzim
yang lebih tahan terhadap pH rendah (asam), faktor lain seperti kapasitas buffering
sitoplasma kurang berpengaruh bagi pengaturan pH intraseluler (Bender et al., 1986).
Cotter dan Hill (2003) menambahkan bahwa pertahanan bakteri Gram positif
terhadap asam juga terjadi karena adanya pompa proton oleh ATP-ase, adanya
mekanisme perubahan membran sel bakteri dan dekarboksilasi asam amino.
Chou dan Weimer (1999) menyatakan bahwa enzim dapat mempengaruhi
pertumbuhan dari bakteri asam laktat pada pH rendah. Enzim-enzim yang
mempengaruhi ketahanan bakteri asam laktat pada pH rendah adalah enzim protease.
Diungkapkan bahwa semakin tinggi enzim protease yang dimiliki oleh suatu isolat
dapat meningkatkan ketahanannya pada kondisi asam. Salah satu enzim protease
yaitu aminopeptidase dapat mempengaruhi adaptasi dan pertumbuhan dari isolat
bakteri asam laktat pada kondisi asam (De Angelis et al., 2001). Enzim protease
dibutuhkan oleh bakteri asam laktat untuk pertumbuhan dan menghasilkan asam
dalam proses pembuatan produk fermentasi.
Berdasarkan hasil pengujian pertumbuhan bakteri asam laktat dalam media
26 laktat asal daging sapi dengan toleransi dan viabilitas tinggi. Selanjutnya 10 isolat
bakteri asam laktat asal daging sapi diuji toleransinya terhadap kondisi usus halus
dengan pH 7,2 dengan kandungan garam empedu 0,3%.
Toleransi Isolat Bakteri Asam Laktat asal Daging terhadap Garam Empedu
Bakteri asam laktat sebagai isolat probiotik untuk dapat bertahan dan tumbuh
pada saluran pencernaan harus mampu melewati berbagai kondisi lingkungan yang
menekan, salah satunya adalah pada saat bakteri memasuki bagian atas saluran usus
yang merupakan tempat empedu disekresikan ke dalam usus. Cairan empedu
merupakan campuran dari asam empedu, kolesterol, asam lemak, fosfolipid, pigmen
empedu, dan sejumlah xenobiotik terdetoksifikasi. Sekresi pankreas juga
mengandung serangkaian enzim pencernaan, yaitu tempat enzim yang bersifat
lipolitik diaktifkan oleh karakteristik aktif dari empedu. Kombinasi tersebut bersifat
bakterisidal bagi mikroorganisme komensal dalam tubuh manusia kecuali bagi
beberapa genus penghuni usus yang tahan garam empedu (Hill, 1995). Hasil
pengujian ketahanan isolat daging bakteri asam laktat terhadap garam empedu 0,3%
dapat dilihat pada Tabel 3.
Uji ketahanan isolat bakteri asam laktat asal daging sapi terhadap garam
empedu (bile salt) merupakan pengujian tahap lanjutan terhadap isolat yang telah
terlebih dahulu diseleksi pada pH 2 dan 7,2 sebagai kandidat probiotik. Sebanyak 10
isolat bakteri asam laktat asal daging sapi terpilih diuji pada garam empedu 0,3%.
Konsentrasi garam empedu sebesar 0,3% merupakan konsentrasi yang kritikal dan
merupakan nilai yang cukup tinggi untuk melakukan seleksi isolat yang resisten
terhadap garam empedu (Gilliland et al., 1984). Pengujian dilakukan dengan cara
penumbuhan isolat dalam media MRS-broth dengan pH 7,2 yang telah ditambahkan
garam empedu sebesar 0,3% selama 24 jam. Hasil analisis ragam dan uji lanjut
menunjukkan bahwa isolat yang berasal dari sumber sejenis yaitu daging sapi tidak
memberikan karakteristik ketahanan terhadap garam empedu yang sama. Sebanyak
tiga isolat bakteri asam laktat asal daging sapi didapatkan memiliki toleransi yang
tinggi terhadap garam empedu yaitu 1A5a, 2B4ab, dan 1B1abc dan secara statistik
tidak berbeda. Hasil ini menunjukkan bahwa ketiga isolat bakteri asam laktat ini
27 yang ditunjukkan dengan jumlah kematian paling sedikit dan secara statistik
menunjukkan hasil yang sama dengan 2B4 dan 1B1.
Tabel 3. Rataan Populasi Isolat Bakteri Asam Laktat asal Daging Sapi pada Garam Empedu 0,3%
Isolat Jumlah Sel Mati
---(Log10 cfu/ml)---
Keterangan : Tanda superskrip yang berbeda pada kolom yang sama menunjukan perbedaan yang nyata (P < 0,05)
Isolat bakteri asam laktat 2D1 memiliki ketahanan yang paling rendah
dibandingkan dengan isolat-isolat lainnya pada garam empedu 0,3% ditunjukkan
dengan jumlah kematian yang paling tinggi diantara kesembilan isolat bakteri asam
laktat terpilih lainnya. Toleransi yang baik terhadap garam empedu ini diduga karena
peranan polisakarida sebagai salah satu komponen penyusun dinding sel bakteri
Gram positif, tetapi mekanisme yang terlibat di dalamnya belum diketahui dengan
jelas. Bakteri asam laktat yang tidak mampu bertahan dan tumbuh dengan baik dalam
kondisi usus halus dapat disebabkan oleh perubahan permeabilitas seluler dan
kebocoran materi intraseluler yang dialami lebih besar sehingga menyebabkan
lisisnya sel dan menyebabkan kematian. Hasil ini sesuai dengan penelitian-penelitan
lain (Kusumawati, 2002; Kimoto et al., 1999; Ngatirah et al., 2000) yang juga
menunjukkan bahwa bakteri asam laktat memiliki ketahanan terhadap garam empedu
yang beragam. Chou dan Weimer (1999) juga mendapatkan bahwa diantara
galur-galur bakteri asam laktat dari spesies yang sama serta diisolasi dari sumber yang
28 Cairan garam empedu bersifat sebagai senyawa aktif permukaan sehingga
dapat menembus dan bereaksi dengan sisi membran sitoplasma yang bersifat
lipofilik, menyebabkan perubahan dan kerusakan struktur membran. Sifat aktif
permukaan dari cairan garam empedu juga mengakibatkan aktifnya enzim lipolitik
yang disekresikan pankreas (Hill, 1995). Enzim tersebut juga mungkin bereaksi
dengan asam lemak pada membran sitoplasma bakteri menyebabkan perbedaan
permeabilitas dan karakteristiknya sehingga dapat mempengaruhi ketahanannya
terhadap garam empedu. Menurut Smet et al. (1995) beberapa Lactobacillus
memiliki enzim bile salt hydrolase dengan aktivitas untuk menghidrolisis garam
empedu. Enzim ini mampu mengubah kemampuan fisik dan kimia yang dimiliki oleh
garam empedu, sehingga tidak bersifat racun bagi bakteri asam laktat. Hal inilah
yang memungkinkan menjadi penyebab beberapa isolat bakteri asam laktat tahan
terhadap keadaan garam empedu.
Semakin tinggi konsentrasi garam empedu, maka jumlah sel Lactobacillus
yang mati juga akan meningkat. Hal ini disebabkan peningkatan aktivitas enzim β
-galaktosidase terhadap garam empedu, sehingga meningkatkan permeabilitas
membran sel. Bila permeabilitas sel meningkat maka banyak materi intraseluler yang
keluar dari dalam sel. Bila hal ini berlangsung terus menerus akan menyebabkan lisis
bakteri. Enzim β-galaktosidase merupakan enzim intraseluler dari bakteri.
Kusumawati (2002) melaporkan bahwa isolat bakteri asam laktat yang diisolasi dari
makanan fermentasi asal Indonesia menunjukkan perbedaan ketahanan untuk tumbuh
pada lingkungan yang mengandung garam empedu 1% dan 5%, perbedaan tersebut
bersifat beragam untuk masing-masing galur. Ngatirah et al. (2000) menguji
ketahanan isolat bakteri asam laktat yang diisolasi dari makanan fermentasi dan feses
bayi terhadap garam empedu. Pengujian dilakukan pada MRSB yang mengandung
garam empedu 10% selama 24 jam. Ketahanan terhadap garam empedu dihitung
berdasarkan selisih unit OD (Optical Density) pada panjang gelombang 660 nm yang
dicapai setelah inkubasi 24 jam dengan OD pada awal inkubasi yang hasilnya
berkisar antara 1,16-2,34. Penelitian tersebut mampu mengungkap bahwa isolat yang
diisolasi dari sumber yang sama memiliki ketahanan terhadap garam empedu yang
beragam atau ketahanan terhadap garam empedu bersifat strain dependent. Wirawati
29 garam empedu 0,3% berkisar antara 34,8%-100%. Berdasarkan kisaran tersebut
terlihat bahwa isolat bakteri asam laktat asal tempoyak relatif tahan terhadap garam
empedu, bahkan isolat To 8 tidak menunjukkan penurunan selama inkubasi 24 jam.
Hasil penelitian ini mendapatkan sebanyak 3 dari 28 (10,7%) isolat bakteri
asam laktat asal daging sapi yang diseleksi mampu bertahan terhadap kondisi yang
menekan yaitu 1A5, 2B4 dan 1B1. Ketiga kandidat probiotik ini memiliki morfologi
berbentuk batang, susunan tunggal maupun rantai pendek dan Firmansyah
(unpublished) menambahkan bahwa isolat 1A5, 2B4 dan 1B1 merupakan bakteri
mesofil (Buckle, 1987) yaitu bakteri yang memiliki pertumbuhan 15 oC – 45 oC
dengan suhu optimum pertumbuhan 37 oC.
1A5 2B4 1B1
Gambar 7. Morfologi Isolat Bakteri Asam Laktat Kandidat Probiotik
Selanjutnya ketiga isolat ini juga memiliki karakteristik katalase negatif dan
merupakan bakteri Gram positif. Sesuai dengan Axellson (1998) yang menyatakan
bahwa bakteri asam laktat dicirikan sebagai bakteri Gram positif dan katalase negatif
tetapi kadang-kadang terdeteksi katalase semu pada kultur yang ditumbuhkan pada
konsentrasi gula rendah. Identifikasi yang diteliti secara terpisah (Arief, unpublished)
berhasil mengidentifikasi 1B1 dan 1A5 adalah Lactobacillus plantarum sedangkan
2B4 merupakan Lactobacillus fermentum. L. plantarum secara taksonomi berasal
dari famili Lactobacillaceae dan genus Lactobacillus. Ciri lain dari bakteri asam
laktat ini adalah bakteri homofermentatif yang tumbuh pada suhu optimal 37oC.
Kemampuan bertahan yang baik dimiliki oleh Lactobacillus plantarum dalam
kondisi menekan seperti di lambung dengan pH 2 dan usus yang memiliki pH 7,2
dengan kadar garam empedu 0,3% seperti dinyatakan oleh Anukam dan Koyama
(2007) bahwa Lactobacillus plantarum pada pH 2-3 yang diuji ketahanan selama 24
jam berkurang sebanyak 2 log10, sedangkan pada pH antara 4-6,5 terjadi peningkatan
30 25% penghambat pertumbuhan pada kadar garam empedu 2% dan 68% penghambat
pertumbuhan saat kadar garam empedu 4%. L. plantarum mampu merombak
senyawa kompleks menjadi senyawa yang lebih sederhana dengan hasil akhirnya
yaitu asam laktat. Menurut Buckle et al. (1987) asam laktat dapat menghasilkan pH
yang rendah pada substrat sehingga menimbulkan suasana asam. L. plantarum dapat
meningkatkan keasaman sebesar 1,5 sampai 2,0% pada substrat. Isolat 2B4
merupakan bakteri Lactobacillus fermentum yang memiliki ketahanan yang cukup
baik dalam pH lambung dan garam empedu seperti dikatakan oleh Klayraung et al.
(2008) bahwa Lactobacillus fermentum mampu tumbuh baik pada kisaran pH 2-3
KESIMPULAN
Kesimpulan
Isolat bakteri asam laktat asal daging sapi yang berbeda mempunyai toleransi
yang berbeda pula terhadap kondisi keasaman lambung dengan pH 2,0 dan kondisi
usus dengan pH 7,2 serta kandungan garam empedu 0,3%. Sebanyak sepuluh dari
dua puluh delapan isolat (35,71%) mampu bertahan tumbuh pada kondisi keasaman
lambung dengan pH 2,0 dan hanya didapatkan tiga dari sepuluh (30%) isolat bakteri
asam laktat tersebut mampu tumbuh dan berkembang di dalam kondisis usus halus.
Ketiga kandidat probiotik yang didapat adalah 1A5, 2B4 dan 1B1.
Saran
Terbatasnya bakteri asam laktat asal daging sapi yang diperoleh sebagai
kandidat probiotik (10,71%), memungkinkan untuk memanfaatkan sumber-sumber
bakteri asam laktat asal daging jenis lainnya. Pengujian lebih lanjut terkait dengan
karakteristik probiotik dalam saluran pencernaan manusisa dapat dilakukan meliputi
uji kemampuan penempelan bakteri asam laktat terpilih pada sel epitel usus.
Pengujian keamanan dan sifat toksikologi dari bakteri asam laktat asal terpilih perlu
dilakukan untuk membuktikan bahwa bakteri asam laktat asal daging sapi yang telah
diperoleh aman dikonsumsi oleh manusia.
UCAPAN TERIMAKASIH
Puji dan syukur penulis panjatkan Kehadirat Allah SWT dengan segala
rahmat dan karuniaNya yang telah melimpahkan nikmat dan kemudahan sehingga
skripsi ini dapat terselesaikan. Shalawat serta salam tak lupa penulis sampaikan
kepada Nabi SAW beserta keluarga dan para sahabatnya.
Penulis mengucapkan terimakasih kepada kedua orang tua Subagio dan
Lasiyem yang telah memberi kasih sayang, materi, motivasi, bimbingan dan doa-doa
yang tiada henti baik secara langsung maupun tidak langsung. Terima kasih untuk
adik tersayang Dewi Yuliarti yang selalu memberikan dukungan dan motivasi yang
sangat berarti bagi penulis. Terima kasih juga untuk seluruh anggota keluarga yang
selalu memberikan dukungan kepada penulis.
Penulis mengucapkan terimakasih kepada dosen Irma Isnafia Arief, S.Pt.,
M.Si dan Dr. Ir. Rarah R. A. Maheswari, DEA. yang telah membimbing,
mengarahkan, memotivasi, dan membantu mendampingi penyusunan proposal
hingga tahap akhir penulisan skripsi. Terimakasih kepada Ir. B.N. Polii, SU selaku
pembimbing akademik, yang telah membimbing penulis selama masa perkuliahan.
Penulis juga ingin mengucapkan terimakasih kepada Ir. Hj. Komariah M.Si dan Ir.
Abdul Djamil H. M.Si yang telah memberikan banyak masukan dan sumbangan
pemikiran dalam penulisan ini.
Ucapan terima kasih juga kepada tim satu penelitian Dudi Firmansyah, M.
Tito Grandisa, Helmi Nursirwan, Cahyanto dan Rahmadani Puspitasari yang telah
berjuang bersama selama penelitian menyelesaikan tugas akhir dengan baik. Terima
kasih juga disampaikan kepada Edit Lessa Aditya, S.Pt, Bramada W.P. S.Pt, Cucu
Diana A.Md dan Eko Prasetyo A.Md yang telah membantu serta memberikan nasihat
dan bimbingan selama penelitian. Terima kasih kepada Novara Rahmat, Rindu Dara
dan rekan-rekan THT 41 lainnya atas doa, dukungan dan kerjasamanya. Terima kasih
kepada M. Arif Setiawan, Satriyo, dan Edi Setiawan yang telah memberikan
kontribusi selama penulisan skripsi. Terima kasih juga kepada adik kelas Gina Citra
Dewi Gozali yang telah memberikan motivasinya dan bantuannya selama
penyusunan penulisan skripsi. Terakhir, penulis ucapkan terima kasih kepada seluruh
civitas akademika Fakultas Peternakan, Institut Pertanian Bogor. Semoga skripsi ini
dapat bermanfaat.
Bogor, September 2009