I .
METODE LAPARdTOMl
DAN GAMBARAN PERSEMBUHAN
PASCA
BEDAH
REPRODUKSI UNTUK KOLEKSl OOSlT
DALAM
UPAYA PRODUKSI EMBRIO IN
VllRO
PADA
KUCING
LOKAL
(Felis domestica)
Oleh
:
GUNANTI
SVT
965684
FAKULTASPASCASARJANA
IMSTITUT PERTANllAN BOGQR
GUNANTI. Metode Laparotomi dan Gambaran Persembuhan Pasca Bedah Reproduksi untuk Koleksi Oosit dalam Upaya Produksi Ernbrio In l'itro pada Kucing Lokal (Fells domesficn). (Dibawah bimbingan Mozes R. Toelihere sebagai Ketua, Masduki Partadireja (alm), Sunarja Prawiradisastra, Arief Boediono dan I Wayan Teguh Wibawarl sebagai Anggota).
Kucing lokal ( f i l i s domesticn) merupakan salah satu jenis hewan kesayangan yang sering digemari dan dipelihara orang. Jenis kucing ras tertentu seperti ras Persian, Anggora, Chincila dan Abyssinian mempunyai nilai ekonomis tersendiri. Populasi kucing Iokal sangat banyak dan mudah didapat khususnya di Indonesia, daya adaptasinya cukup baik dan memiliki kemampuan reproduksi yang cukup tinggi (multipara). Hewan ini tergolong ke dalam Ordo Carnivora dan Famili Fellidae seperti harimau. Bentuk fisik, fisiologi dan biologi reproduksinya mempunyai banyak kesamaan sehingga dapat. dipakai sebagai hewan model dalam upaya penelitian sebagai salah satu upaya ke arah konservasi satwa langka. Harimau, khususnya hariniau Sumatera merupakan satwa langka yang dilindungi pemerintah. Ui Indonesia ada tiga Sub Spesies harimau (Panthera tigris) yaitu Panthem tzgris Ncrlicn di Bali, I'cnzthern figris So~zclnica di Jawa dan Panthera figris Sumnfera di sumatera. Harimau di Bali dan Jawa sekarang sudah tidak dapat diketemukan lagi (punah), hamya di Sumatera yang masih dapat hidup (PHPA 1994).
Koleksi oosii melalui bedah pada hewan hidup dapat dilakukan beberapa kali, sehingga dari satu hewan, dapat dihasilkan cukup banyak oosit. Penerapan teknologi bedah reproduksi dalam upaya pemanfaatan oosit seperti ini dapat diterapkan baik pada ternak atau hewan langka yang dilindungi. Untuk mengetahui sejauh mana terjadi persembuhan pasca bedah sehingga produksi oosit melalui bedah dapat dilakukan kembali, maka diperlukan evaluasi terhadap pemeriksaan klinis, gambaran darah termasuk dalam ha1 ini adalah konsentrasi glukosa dan gambaran histopatologi persembuhan luka pasca bedah.
Koleksi oosit dengan beberapa metode bedah (laparotomi medianus dan paramedianus) telah dilakukan dalam penelitian ini serta pemakaian serum dalam media kultur (bktcrl Bovine Sel-urn dan C a f serzrnz) untuk maturasi, fe~tilisasi dan kultur embrio in v i h o dalam rangka produksi embrio.
Sulitnya mendapatkan bahan-bahan biologis seperti F~ILIZ Rolfilw Senmi
(FBS) merupakan kendala dalam melakukan penelitian di bidang bioteknologi reproduksi khususnya pada fertilisasi in vifro (FIV). Penggunaan serum asal kucing
(C.'ut Semm/CS) yang diproduksi sendiri merupakan alternatif teknologi untuk menghindari ketergantungan akan bahan kimia asal pabrik.
Untuk mendapatkan oosit kucing dalam jumlah banyak dengan kualitas baik digunakan metode induksi hormonal yaitu dengan menyuntikkan kombinasi hormon FSH + hCG dan eCG + hCG.
pasca bedah reproduksi pada koleksi oosit melalui pemeriksaan klinis, gambaran
darah dan konsentrasi ylukosa darah dan gambaran histopatologi.
( 3 )
mengetahui
metode induksi hormonal pada kucing,
(4)
mengetahui pengaruh induksi mekanik
terhadap tingkat folikel ovulasi dan (5) mengetahui tingkat keberhasilan kematangan
inti oosit, fertilisasi dan perkembangan embrio secara
in vitro
di dalam medium
dengan suplementasi
FBS
atau
CS.
Penelitian dilakukan di Laboratotium Bedah Bagian Klinik Veteriner,
Laboratorium Embriologi Bagian Anatomi dan Laboratorium Patologi Bagbn
Parasitologi dan Patologi Fakultas Kedokteran Hewan lnstitut Pertanian Bogor
selama
20
bulan dari bulan April
1999sampai Februari 2001.
Percobaan ini menggunakan kucing lokal dewasa umur (dua sampai tiga)
tahun, dengan berat badan
2
sampai 3,5 kg. Sebelum penelitian, hewan diadaptasikan
selama sebulan terhadap perlakuan penelitian dan memperoleh pakan segar berupa
campuran nasi, hati sapi dan ikan tongkol. Hewan dikandangkan secara individu di
dalam kandang yang berukuran 45 x 60 cm serta memperoleh minum
nu'libitum
dan
pengobatan profilaktik terhadap parasit cacing. Untuk mengetahui kucing betina tidak
bunting maka dilakukan pemeriksaan palpasi dan Ultra Sono Grafi
(USG).
Untuk mengetahui proses persembuhan pasca bedah laparotomi paramedianus
dibandingkan dengan medianus digunakan
36
ekor kucing betina lokal yang
dikelompokkan menjadi empat kelompak perlakuan masing-masing sembilan ekor
yaitu,
(1)laparotomi medianus dengan ovariektomi, (2) laparotomi medianus tanpa
ovariektomi,
(3)laparamedianus dengan ovariektomi dan (4) laparamedianus tanpa
ovariektomi. Parameter yang diamati meliputi a) pemcriksaan klinis; a) gambaran
darah; c) glukosa darah dan d) gambaran histopatologi persembuhan jahitan kulit.
Untuk mengetahui ovulasi akibat perlakuan induksi mekanik menggunakan
metode
vagztzaI smear
pada kucing yang mendapat perlakuan dengan atau tanpa
induksi hormonal akibat perlakuan kombinasi hormon digunakan 24 ekor h c i n g
yang dikelompokkan menjadi enam kelompok perlakuan masing-masing empat ekor
sebagai berikut
: (1)induksi hormonal dengan
FSH
+
hCG dengan induksi mekanik,
( 2 )
induksi hormonal dengan
FSH
+
hCG tanpa induksi mekanik,
(3)induksi
hormonal dengan eCG +
hCG dengan induksi mekanik, (4) induksi hormonal dengan
eCG
+ hCG tanpa induksi mekanik, (5) tanpa induksi hormonal dengan induksi
mekanik, dan
( 6 )
tanpa induksi hormonal dan tanpa induksi mekanik. Parameter
yang diamati untuk mengetahui pengaruh pengarh induksi mekanik adalah folikel
ovulasi dan corpus luteum.
Untuk mengetahui pengaruh induksi hormonal terhadap kualitas oosit,
kematangan 'oosit, fertilisasi dan perkembangan embrio in
v i m ,
digunakan
24
ekor
kucing yang dikelompokkan ke dalam tiga kelompok perlakuan masing-masing
terdiri atas delapan ekor sebagai berikut
:(1) induksi hormonal dengan
FSH
+
hCG;
Spermatozoa yang digunakan untuk fertilisasi berasal dari kircing ,jantan lokal urnur dua ttthun dcngan bcrat badan 3 kg. Sper~~latozoa diperoleli dari testes hasil kastrasi dengan metode tertutup.
Untuk mengetahui pertumbuhan oosit dan perkembangan embrio kucing secara in vitro di dalam Tissue Culture Medium (TCM) 199 dan C R l a a yang disuplementasi dengan Fetal Bovine Serum(FBS) dibandingkan dengan C a t Serum (CS) digunakan oosit dari masing-masing kelompok perlakuan ovulasi. Parameter yang diamati untuk mengetahui kualitas setiap tahap kematangan inti oosit adalah a) Germinal Vesicle (GV), b) Ger~ninaf Veszcb Break D o w n (GVBD); c) Metafase-I (M-I) dan d) Metafase-I1 (M-11). Sedangkan parameter yang diamati untuk menentukan keberhasilan fertilisasi adalah dengan adanya dua pronukleus atau lebih. Adapun parameter yang diamati untuk mengetahui tingkat keberhasilan perkembangan embrio secara i j r vitro adalah dengan mengetahui jurnlah perkembangan sel dan terbentuknya morulafblastosis.
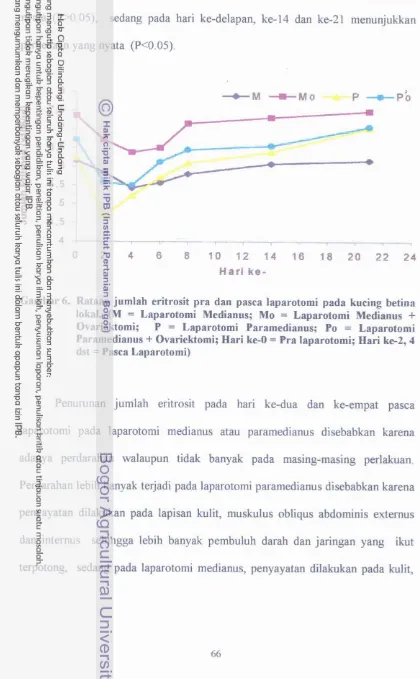
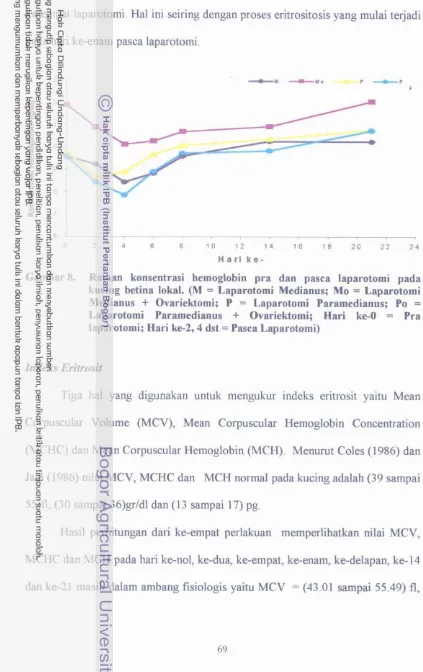
Hasil pemeriksaan klinis yang meliputi keadaan luka jahitan, frekuensi nafas, frekuensi nadi dan suhu tubuh pra dan pasca laparotomi medianus dengan atau tanpa ovariektomi dan paramedianus dengan atau tanpa ovariektomi secara umum tidak menunjukkan perbedaan yang nyata (P>0.05), variasi terjadi pada hari ke-dua dan ke-empat pasca laparotomi walaupun masih berada pada arnbang fisiologis. Gambaran klinis tersebut kembali ke kondisi awal pada hari ke-delapan pasca laparotomi medianus dengan atau tanpa ovariektomi dan paramedianus dengan atau tanpa ovariektomi. Gambaran darah yang meliputi jumlah eritrosit total, nilai hematokrit, konsentrasi hemoglobin, indeks eritrosit, jumlah leokosit total, diferensiasi leukosit dan konsentrasi glukosa darah pra dan pasca laparotomi medianus dengan atau tanpa ovariektomi dan paramedianus dengan atau tanpa ovariektomi secara umum tidak menunjukkan perbedaan yang nyata (P>0.05), variasi t e j a d i pada hari ke-dua dan ke-empat pasca laparotomi walaupun masih dalam ambang fisiologis. Gambaran darah tersebut kembali ke kondisi awal pada hari ke- 14. Dilihat dari gambaran histopatologi persembuhan luka baik pada laparotomi medianus atau paramedianus tidak berbeda, variasi terjadi pada jumlah buIuh darah, akumulasi sel radang, neokapiler dan jaringan yang mengalami nekrosa lebih banyak ditemukan pada laparotomi paramedianus dibandingkan medianus dengan hasil yang berbeda nyata (P(0.05). Secara umum persembuhan luka pasca bedah jika dilihat dari gambaran histopatologi kembali ke kondisi awal pada hari ke-14 baik pada laparotomi medianus atau paramedianus.
Folikel ovuiasi dapat diperoleh hanya dengan induksi mekanik pada folikel yang sudah matang (hasil induksi hormonal) baik pada induksi hormonal dengan kombinasi hormon FSH + hCG atau eCG + hCG dengan hasil yang berbeda nyata (P<O.05).
Folikel yang berdiameter lebih dari 5 mm, oosit kualitas A dan B lebih banyak diperoleh dari ovarium kucing yang diinduksi secara hormonal dengan kombinasi FSH
+
hCG dibandingkan dengan kombinasi eCG dan hCG.LAPAROTOMY METHODS AND RECOVERY CONDITION OF POST
REPRODUCTIVE OPERATION FOR
oocyte
COLLECTION
IN
IN
VITRO EMBRYO
PRODUCTION
OF
DOMESTIC CAT
(Felis
dontesticu)Gunanti
1o:iilcr the superrision of Prof Dr. Mozcs R 'l'oelihere. as chaimian of the advisory committc, I'n~t' Ih. drh. EI.
M a u l u h i Pafldireja (ahn), Ih. &h. 11. Sun+ Pra\virn&sasira MVSc, Dr. drh. Aricf I3ocdio11o, Ih. drli. I Wayan Teguli Wih;l\\,im MS as co-i~dvia~rs)
Thirty six female domestic cats two to three years of age weighing 2 to
3,5
kg were
grouped and treated as follows: (I) median laparotomy with ovariectomy (Mo), (2)
median laparotomy without ovariectomy
(M),
(3)
paraniedian laparotomy with
ovariectomy (Po),
(4)mcdian laparotomy without ovariectomy (P), consisted of
9animals each. Parameters used to evaluate the recovery process of post operation
.were clinical examination (injury repair, respiratory frequency, pulse rate and body
temperature), blood examination (number of total erythrocytes, hematocryte,
hemoglobin concentration, number of total leukocytes, neutrophils, lymphocytes and
hystopathological examination.
Observations were conducted before and after
operation
on day 2, 4, 6, 8, 14 and 21. The effect of hormonal treadment treatments
were examined in 24 female domestic cats, two to three years of age weighing 2 to
3.5
kg. They were grouped and treated as follows: (1) injection of Follicle
Stimulating Hormone (FSH) followed by Chorionic Gonadotrophine (hCG),
( 2 )injection of equine Chorionic Gonadotrophine (eCG) followed by hCG and
(3)control. Each group consisted of
8animals.
Parameters used to study the
influence of the hormonal treatments were follicle development and oocyte quality.
Maturation, fertilization and development rates were observed after
in
vitroincubation in the media supplemented with different sera
(Fetal
BovirzeScntm/FBS
and
Cht
Serunt'CS).
Twenty four female cats, two to three years of age weighing
2
to 3.5 were.grouped and treated as follows: (1) injection of
FSH
and
hCG
with
mechanical induction,
(2)injection of FSH and hCG without mechanical induction,
blood pictures returned to initial condition on day 8 and hystopathological condition
returned to normal on day 1.1 post operative. The number of developed follicles and
oocytes with
A
and B quality were higher (P<0,05) in group treated with
FSH
followed by hCG compared with group treated with eCG followed by hCG or without
hormonal treatment. The maturation rate of cat oocyte cultured in medium
supplemented with
CS
was higher (P4.05) than in medium supplemented with
FBS.
METODE LAPAROTOMI DAN GAMBARAN PERSEMBUHAN
PASCA BEDAH REPRODUKSI UNTUK KOLEKSI OOSlT
DALAM UPAYA PRODUKSI EMBRIO
IN
VlTRO
PADA KUCING LOKAL
(Felis domesfica)
Oleh
:
GUNANTI
SVT 965084
Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Doktor pada Program Pascasarjana, lnstitut Pertanian Bogor
FAKULTAS PASCASARJANA
INSTITUT PERTANIAN BOGOR
-
Judul Disertasi Metode la pa rot om^ clan Gambaran Persembuhan Pasca Bedah Reproduksi Untuk Koleksi Oosit dalam Upaya Produksi Embrio In Yitro pada Kucing Lokal (Felis Domestics)
Nomor Pokok : SVT965084
Menyetujui
1. Komisi Penasehat
f l
Prof. Dr. drh. Mozes R Toelihere MSe. Ketua
D *
Anggota Anggota
Anggota
2 . Ketua Program Studi Sains Veteriner
wd-
%
Penulis dilahirkan pada tanggal 2 Januari 1962 di Banyuwangi, putri keenam
dari tujuh bersaudara dari Bapak Hardjowijono (alm) dan Ibu Rodinah (alm)
Pcndidikan Dasar di sekolah Dasar Sumberayu 11 di Banyuwangi. Sekolah
Menengah Pertama PlRI 11 di Yogyakarta dan pada tahun 1980 lulus dari Sekolah
hqenengah Atas Negeri Vl di Yogyakarta. Pada tahun yang sama penulis melanjutkan
studi ke Fakultas Kedokteran Ilewan Institut I'crtanian Bogor dan lulus sebagai
Dokter Hewan pada tahun 1987
Pada tahun 1987 penulis diangkat sebagai staf pengajar di Fakultas
Kedokteran Hewan Institut Pertanian Bogor dan melanjutkan ke Sekolah
Pascasarjana I P S pada program studi Sains Veteriner (SVT) dan lulus dengan gelar
Magister Sains (MS) pada tahun 1992.
Pada tahun 1996 penulis melanjutkan ke pro&?-am studi Doktor (53) pada
Program Pascasarjana I P S dan lulus pada bulan Juni 2001.
Penulis menikah dengan l r Soeyono Karwondo pada tanggal 14 Juli 1983 dan
dikaruniai tiga orang putri yaitu Annisaa, Fitria dan Aini dan seorang putra yaitu Ali
K A T A PENGANTAR
Puji dan syukur penulis panjatkan k e hadirat Allah SWT, karena hanya
dengan pertolongan-Nya penulis mampu menyelesaikan disertasi ini.
Terima kasih yang tulus dan ikhlas serta penghargaan yang setinggi-tingginya
penulis sampaikan kepada yang terhormat Bapak Prof Dr. Mozes R Toelihere selaku
ketua Komisi Pembimbing, Bapak Prof. Dr. drh.. H. Masduki Partadireja (alm),
Bapak Dr. H. Sunarja Prawiradisastra MVSc, Bapak Dr. I Wayan Teguh Wibawan
dan Bapak Dr. Arief Boediono, masing-masing selaku anggota Komosi Pembimbing,
Bapak Prof Dr. H. Juhara Sukra yang telah membimbing, menasehati, memberikan
dorongan semangat dan kemudahan-kemudahan lain yang telah diberikan dengan
penuh keikhlasan dan tanggung jawab
Terima kasih dan penghargaan yang setinggi-tingginya juga disampaikan
kepada Direktorat Jenderal Pendidikan Tinggi yaitu Beasiswa Program Pendidikan
Pascasarjana (BPPS) dan Proyek Hibah Team (URGE) periode tahun 1999-2001,
Kepada Bapak Ketua Bagian Klinik Veteriner, Bapak Ketua Bagian Anatomi, Bapak
Ketua Bagian Parapat dan semua staf FKH IPB yang teiah memberikan fasilitasnya.
Ucapan terimakasih yang sedalam-dalamnya juga disampaikan kepada
ayahanda dan ibunda tercinta Bapak Hardjowijono (alm) dan lbu Rodinah (alrn),
Bapak Karwondo dan Ibu Dalinah (alm) dan saudara kandung dan ipar semua.
Akhirnya ucapan terimakasih dan penghargaan yang sangat dalam saya
sampaikan kepada suamiku tersayang Soeyono Kanvondo dan putra-putriku tercinta
mendampingi, mendoakan, memberi semangat dan dorongan hingga disertasi ini
dapat diselesaikan.
Penulis menyadari sepenuhnya bahwa karya ilmiah ini masih jauh dari
kesempurnaan, oleh karena itu penulis akan berterimakasih kepada pembaca untuk
memberikan saran-saran demi kesempurnaan karya ilmiah ini. Semoga karya ilmiah
ini bermanfaat bagi yang memerlukannya.
Bogor, Mei 200 1
Penulis
DAFTAR IS I
RINGKASAN ...
ABSTRACT ... ...
RTWAYAT AIDUP
KATA PENGANTAR ...
DAFTAR IS1 ...
DAFTAR GAMBAR ...
DAFTAR TABEL ...
DAFTAR LAMPlRAN ...
PENDAHULUAN
Latar Belakang ...
. .
Tujuan Penel~ttan ...
. .
Manfaat P e n e l ~ t ~ a n ...
Hipotesis ...
Pendekatan Masalah ...
TINJAUAN PUSTAKA
Klasifikasi Kucing ...
... Kondisi Kesehatan ... ...
Metode Laparotomi dan Gambaran Persembuhan Pasca Bedah
Reproduksi ...
Metode Bedah Reproduksi ...
Keberhasilan Pembedahan ...
. .
...
Pemeriksaan Klrms
... Suhu Yilbuh
... Respirnsi @erncrpnscrn)
...
Sisfem Karu'ovaskuler
Darah ...
I
v
vi i ...
V l l l X
...
XI11
xiv
Gambaran Histopatologi ... 22
...
Produksi Embrio Secara ZPI Yitro 25
Anatomi dan Fisiologi Reproduksi ... 25 Induksi Hormonal ... 3 0
Koleksi Ovarium ... 31
Koleksi dan Maturasi Oosit ... 32
Koleksi dan Kapasitasi Spermatozoa ... 37
. . .
...
Fertil~sasi I n Vitro 49
M A T E R l DAN METODE PENELITIAN
Tempat dan Waktu Penelitian ...
. .
Materi Penelit~an ...
. .
... Metode Penel~tlan
1 . Metode Laparoto~ni dan Gambaran Persembuhan Pasca Bedah
Reproduksi ...
Perlakuan Percobaan ...
Rancangan Percobaan ...
...
Evaluasi
. .
Analls~s Data ...
I1 . Produksi Embrio Secara Zir Vifro
...
Perlakuan Percobaan ...
...
Rancangan Percobaan
... EvaIuasi
.
.
Anal~sls Data ...
HASlL DAN PEMBAHASAN
I . Metode Laparotomi dan Gambaran Persembuhan Pasca Bedah
Reproduksi ... 60
Frekuensi Pernat'asan ...
Frekuensi Nadi ... ... Suhu Tubuh
Pemeriksaan Darah ...
Konsentrasi Glukosa Darah ...
Pengamatan Histopatologi ...
.
11 Produksi Embrio Secara In Vitro ...
Induksi Mekanik ...
Induksi Hormonal dan Koleksi Oosit ...
Maturasi Oosit 111 Vitro ...
. . .
Fertllisasi In Vitro ...
Kultur Embrio In Vjtt-0 ...
KESLMF'ULAN DAN SARAN
...
Kesirnpulan 99
Saran ... 100
DAFTAR PUSTAKA ... 1 0 1
DAFTAR G A M B A R
Gambar Halaman
I . Gambaran luka jahitan kulit pada hari ke-dua pasca bedah ... 59 2 Gambaran luka jahitan kulit pada hari ke-empat pasca bedah ... 59 3 . Rataan fiekuensi nafas pra dan pasca laparotomi pada
kucing betina lokal ... 6 0
4
.
Rataan frekuensi nadi pra dan pasca laparotomi pada kucing betina lokal ... 62 5.
Rataan suhu tubuh pra dan pasca laparotomi pada kucing betinalokal ... 64 6 . Rataan jumlah eritrosit pra dan pasca laparotomi pada
kucing betina lokal ... 66 7 . Rataan nilai hematokrit pra dan pasca laparotomi pada
...
kucing betina lokal 68
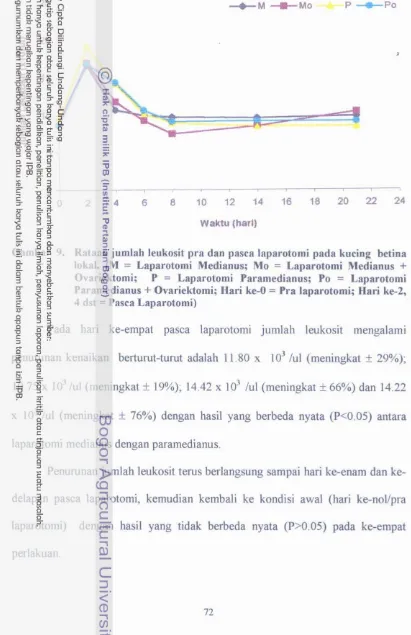
8 . Rataan konsentrasi hemoglobin pra dan pasca laparo-tomi Pada kucing betina lokal ... 69 9 . Rataan jumlah leukosit pra dan pasca laparotomi pada
kucing betina lokal ... 72 10 . Rataan jumlah neutrofil pra dan pasca laparotomi pada
...
kucing betina lokal 74
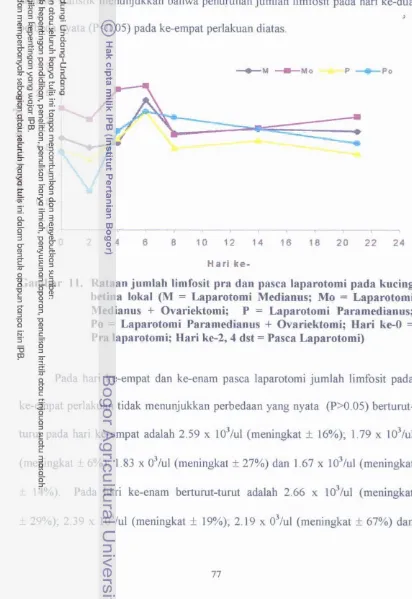
11 . Rataan jumlah limfosit pra dan pasca Iaparotomi pada kucing betina lokal ... 77 12
.
Rataan konsentrasi glukosa darah pra dan pasca laparotomi padakucing betina lokal ... 84
13 . Gambaran histopatologi potongan kulit pada hari ke-dua pasca bedah ... 86
14 . Gambaran histopatologi potongan kulit pada hari ke-empat .. ...
pasca bedah .'. 8 7
15
.
Gambaran histopatologi potongan kulit pada hari ke-14 pasca ...bedah 87
16
.
Oosit hasil koleksi dari ovarium kucing ... 92 ....
17 Oosit hasil maturasi dari ovarium kucing 94
...
.
18 Perkernbangan embrio kucing pada kultur in vifro 97
I
DAFTAR TABEL
Halaman Tabel
6 . Hasil pengamatan nilai median histopatologi potongan kulit pasca laparotomi medianus dan paramedianus ... 89
7. Pengaruh induksi mekanik terhadap tingkat ovulasi pada kucing lokal ... 90
[image:164.522.44.464.70.572.2]8. Pengaruh induksi hormonal terhadap jumlah folikel per ovarium ...
dan kualitas oosit pada kucing lokal 91
9. Tingkat kematangan oosit in vitro pada berbagai waktu inkubasi dalam medium T C M 199 dengan suplementasi 10% FBS atau 10%
10 Tingkat fertilisasi oosit in ~ d t r o setelah 18 jam fertilisasi di dalam medium C R l aa dengan suplementasi 10% FBS atau 10% CS ... 9 6 11. Tingkat perkembangan embrio in vitro dalam medium CRIaa
dengan suplementasi 5% FBS atau 5% CS ... 96
DAFTAR LAMPIRAN
Halaman Lampiran
[image:165.517.48.454.72.572.2]Skema klasifikasi ordo karnivora ... 109 Mekanisme sekresi angiotensin, katekolamin, anti diuretic
...
hormon dan aldosteron 1 10
Skerna proses diferensiasi hernatopoietik dan produksi seI-se1 darah ... 11 1
Mekanisme sistemik stress dan peradangan terhadap peningkatan jumlah neutrofil ... 1 12 Mekanisme sekresi cortisol, hormon perturnbuhan dan epineprin terhadap produksi glukosa ... 1 13
...
Periode siklus berahi pada kucing ...
.
.
114Tabel 1 . Rataan Frekuensi nafas, frekuensi nadi dan suhu tubuh
...
pra dan pasca laparotomi pada kucing betina lokal 1 15
Tabel 2. Rataan jumlah eritrosit total, nilai hematokrit dan konsentrasi hemoglobin pra dan pasca Iaparotomi pada kucing betina lokal ... 1 16 Tabel 3. Rataan nilai MCV,MCHC dan MCH pra dan pasca laparotomi pada kucing betina lokal ... 1 17
Tabel 4. Rataan jumlah leukosit total dan nilai absolut diferensiasi leukosit pra dan pasca laparotomi pada kucing betina lokal ... 1 18
PENDAHULUAN
t a t a r Belakang
Kucing lokal ( I + t l / . s Jomr.slica) rnerupakan salah satu jenis hewan
kesayangan yang digemari dan dipelihara orang. Beberapa jenis kucing ras
tertentu mempunyai nilai ekonomis tersendiri (Persian, Anggora, Chinchila dan
Abyssinian). Populasi kucing lokal sangat banyak dan mudah didapat, khususnya
di Indonesia, daya adaptasinya cukup baik dan memiliki kemampuan reproduksi
yang cukup tinggi (multipara). Setiap kali beranak dapat rnenghasilkan dua
sampai delapan ekor dan selama satu tahun dapat beranak dua sampai tiga kali.
Berbeda dengan kucing ras yang mempunyai daya adaptasi dan kemampuan
reproduksi rendah. Hewan ini tergolong ke dalam Ordo Carnivora dan Famili
Fellidae seperti harimau, dan mempunyai banyak kesamaannya dengan harimau
baik fisiknya maupun biologi reproduksinya sehingga dapat dipakai sebagai
hewan model dalam upaya penelitian sebagai salah satu upaya konservasi sahva
Ian*.
Harimau, khususnya harimau Sumatera merupakan satwa Iangka yang
dilindungi oleh pemerintah sehingga kelestarian satwa ini hams dijaga. Data dari
Direktorat Jenderal Perlindungan Hutan dan Pelestarian Alam (PHPA)
Departemen Kehutanan (1994) menunjukkan bahwa populasi harirnau Sumatera
pada tahun 1970 mencapai 1000 ekor sedangkan pada tahun 1987 menurun
hingga tinggal 660 ekor. Untuk mendukung program yang telah dicanangkan oleh
pemerintah dalam konservasi satwa langka yang dilindungi, maka perlu dilakukan
salah satu alternatif hewan model, mengingat populasinya sangat banyak, mudah
di dapat dan mudah pemeliharaannya.
Sejalan dengan perkembangan bioteknologi reproduksi, telah banyak
usaha yang dilakukan untuk mengoptimalisasi bidang reproduksi hewan, baik
untuk tujuan komersial maupun pelestarian satwa langka.
Di negara maju seperti Arnerika Serikat dan Jepang, penelitian mengenai
produksi embrio pada kucing dan harimau sudah mulai dikembangkan, akan tetapi
di Indonesia yang mempunyai popuIasi kucing sangat banyak kurang mendapat
perhatian. Oleh karena itu salah satu tujuan penelitian ini adalah untuk
memanfaatkan kucing lokal sebagai hewan model untuk pengembangan teknologi
di bidang biologi reproduksi baik dalam upaya penyediaan kucing ras maupun
pelestarian (konservasi) satwa langka Famili Fellidae.
Usaha konservasi melalui bantuan perkembangan biteknologi reproduksi
seperti maturasi, fertilisasi. perkembangan embrio, transfer embrio (TE) dan
criopreservasi berkembang cepat selama 10 tahun terakhir pada kucing lokal
sebagai model penelitian untuk Famili Fellidae lainnya (Farstad 2000).
Produksi embrio in vitro pada umumnya diawali dengan koleksi sel telur
(oosit) dari ovarium pada hewan hidup atau hewan yang baru saja mati, kemudian
dilakukan maturasi oosit dan fertilisasi in vitro yang dilanjutkan dengan kultur embrio in vitro yang dapat ditransfer langsung ke hewan resipien atau dibekukan
untuk disimpan lama sampai dapat ditransfer kepada hewan resipien dikemudian
hari. Pada hewan seperti kucing dan sejenisnya, koleksi oosit dapat dilakukan
melalui pembedahan laparotomi yang memberi akses ke ovarium di dalam rongga
laparoskopi dan dengan jarum khusus melalui aspirasi oosit dari folikel ovarium
tanpa melalui pembedahan (laparotomi).
Koleksi sel telur (oosit) melalui bedah laparotomi pada hewan hidup dapat
dilakukan beberapa kali sehingga dari satu hewan dapat dikoleksi cukup banyak
oosit. Penerapan teknologi bedah reproduksi dalam upaya pemanfaatan sel garnet
seperti ini dapat diterapkan baik pada hewan ternak ?tau hewan langka yang
dilindungi. Untuk mengetahui proses persembuhan luka pasca bedah reproduksi
dari bedah satu ke berikutnya dalam upaya koleksi oosit, diperlukan evaluasi
pemeriksaan klinis, pemeriksaan darah, konsentrasi glukosa darah dan
histopatologi persembuhan luka pasca bedah.
Dalam proses pematangan dan fertilisasi oosit in vitro maupun dalam kultur embrio in v i m diperlukan berbagai macarn media yang ditambahkan bahan-bahan biologis berupa serum untuk optimalisasi perkembangan embrio.
Sulitnya untuk mendapatkan bahan-bahan biologis seperti Feral Bovine Serum (FBS) yang diperlukan untuk produksi embrio in vitro dan banyak dijual secara komersial merupakan kendala dalam melakukan penelitian bidang
bioteknologi reproduksi, telah mendorong peneliti untuk mendapatkan serum asal
kucing ( Cat Serum ) yang diproduksi sendiri sebagai aIternatif.
Dalam penelitian ini koleksi oosit dilakukan dengan rnetode:
a) laparotomi medianus dan b) laparotomi paramedianus. Setelah oosit dikultur,
selanjutnya produksi embrio secara in vitro dilakukan melalui serangkaian proses maturasi, fertilisasi dan kultur in vitro. Serum yang digunakan pada proses produksi embrio in vitro adalah: a) Fetal Bovine S e m (FBS) dan b) Cat S e m
dengan penerapan teknologi superovulasi menggunakan beberapa kombinasi
hormon.
Tujuan Penelitian
Penelitian ini bertujuan untuk memperoleh infonnasi mengenai:
1 Metode laparotomi yang mudah dilakukan dengan sedikit efek samping
selama persernbuhan luka pasca bedah dalam upaya koleksi oosit pada
kucing;
2. Proses persembuhan luka pasca bedah reproduksi untuk koleksi oosit melalui ,
evaluasi pemeriksaan klinis, darah, konsentrasi glukosa darah dan
histopatologi selama proses persembuhan luka pasca bedah;
3. Metode superowlasi pada kucing;
4. Pengaruh induksi mekanik terhadap tingkat folikel ovulasi; dan
5 . Tingkat keberhasilan pematangan, fertilisasi dan perkembangan embrio pada
medium yang ditambahkan Fetal Bovine Serum (FBS) atau Cat Serum (CS).
Manfaat Penelitian
Penelitian ini bermanfaat untuk :
1. Memperoleh oosit melalui metode laparotomi yang mudah dan aman
2. Mengetahui lama persembuhan luka pasca bedah reproduksi
3 . Memanfaatkan kucing lokal yang populasinya banyak sebagai hewan model
untuk produksi embrio kucing ras atau satwa langka Farnili Fellidae yang
dilindungi
4. Produksi embrio kucing melalui tahapan induksi hormonal, maturasi,
fertilisasi dan kultur embrio in vitro.
5. Memberikan informasi penting dari hasil penelitian ini untuk ilmu
pengetahuan dan penelitian lebih lanjut.
Hipotesis
1. Laparotomi paramedianus lebih baik dibandingkan dengan laparotomi
medianus pada proses persembuhan luka pasca bedah untuk koleksi oosit.
2. Pemberian kombinasi FSH
+
hCG Iebih baik dari pada kombinasi eCG +hCG dalam perolehan oosit pada kucing.
3. Penggunaan kultur medium dengan suplementasi serum kucing (Cat Senrrn)
lebih baik dibandingkan dengan Fetal Bovine Serum VBS) pada proses
pertumbuhan oosit dan perkembangan embrio secara in vitro pada kucing
Pendekatan Masalah
Secara umum sebelum dibedah, hewan harus dalam keadaan sehat.
Kondisi hewan pra bedah sangat menentukan keberhasilan pembedahan,
persembuhan luka pasca bedah dan secara tidak langsung mempengaruhi h a l i t a s
oosit yang diperoleh sebagai tujuan dari pembedahan ini. Beberapa ha1 yang perlu
diperhatikan dalam kondisi hewan pra bedah adalah gejaIa klinis yang meliputi:
suhu tubuh, kerja paru-paru, jantung, ginjal dan gambaran radiologi organ penting
di dalam tubuh harus dalam keadaan baik (Plessis 1976). Bright (1986)
menambahkan bahwa untuk pembedahan ringan minimal gambaran darah
(eritrosit, leukosit, hematokrit, hemoglobin dan diferensiasi leukosit) harus dalam
keadaan normal. Penyimpangan gambaran darah ini dapat disebabkan karena
banyak darah yang keluar atau tejadi infeksi kuman baik yang bersifat akut
dollgat1 baik disampiny pemeriksaan klinis dan pemeriksaan darah, gambaran
histopatotogi luka pasca bedah harus diperhatikan, sehingga periode koleksi oosit
untuk tahap berikutnya dapat dilakukan.
Persembuhan luka pasca bedah adalah proses penggantian jaringan mati
oleh jaringan yang sehat. Michael dalam Robert dan Paul (1992) mengatakan
bahwa ada tiga fase yang terjadi di dalam proses persembuhan luka, yaitu fase
peradangan, fase proliferasi dan fase persembuhan. Jones (1996) menambahkan
bahwa fase ketiga disertai dengan perampingan jaringan.
Fertilisasi i r ~ vifro (FIV) rnerupakan alternatif produksi embrio yang murah. Keberhasilan FIV pada hewan kesayangan (kucing sebagai hewan model)
tergantung pada kualitas oosit dan spermatozoa, maturasi oosit yang sempurna
dan ketepatan waktu fertilisasi. Salah satu %or lain yang sangat menentukan
adalah medium kultur yang digunakan (William et al. 1994)
Sebagai sumber protein, hormon dan faktor petumbuhan lainnya, serum di
dalam media kultur sering digunakan sebagai suplemen. Banyak peneliti yang
menggunakan serum baik yang berasal dari fetus atau induk (Dresser ef al. 1988;
Johnston et al. 1991; William el al. 1994; Boediono et al. 1994 ). Serum ini
dijual dengan harga komersial dengan harga yang cukup mahal. Oleh karena itu
pemakaian serum yang diproduksi sendiri (Cat Serum) merupakan salah satu
TlNJAUAN PUSTAKA
7
Klasifikasi Kucing
Kucing termasuk hewan pemakan daging (Carnivora). Ordo Carnivora ini
dibagi atas dua Sub Ordo yaitu Sub Ordo Feloidea (Aeloroidea) dan Conoidea
I
(Arctoidea). Sub Ordo Feloidea terbagi atas lima Famili yaitu Famili conidae,
ursidae, procydae, ailuridae dan mustelidae. Sub Ordo Canoidea terbagi atas tiga
Famili yaitu Famili virridae, hyaeridae dan felidae. Kucing piaraan (lokal)
termasuk Famili Felidae dan Sub Famili felinae. Klasifikasi Ordo Carnivora
dapat dilihat pada Lampiran
I
(Fowler 1993).
Angela (1977) membagi Carnivora ini menjadi dua Genus/Sub Famili
yaitu Sub Famili panthera termasuk disini adalah
lion, leopard
dan
panther;
acrinonyc seperti
cheetah
dan
felis
yang digolongkan menjadi jenis besar seperti
puma,
lyn
dan jenis kecil seperti
Felis Mica, Felis catus
dan
Felis domestica
Ordo Carnivora yang terdapat di Asia Tenggara, khususnya di Indonesia
terbagi menjadi lima Famili, yaitu Famili canidae, ursidae, ailuridae, mustelidae
dan felidae. Yang termasuk dalam Famili Felidae adalah
Panthera figris
Tiger,
Leopard Felis temmznchi, Felis hengolensis, Felis viverrina, Felis planiceps,
Felis rzcbiginosa, Felis chatus
dan
Felis domestica
(Fowler 1993)
Harimau termasuk dalam Famili Felidae dan Sub Famili panthera (Angela
1977 dan Fowler 1993). Di Indonesia ada tiga Sub Spesies harimau
(Panthera
tigris)
yaitu
Panthera tign's
Balica di Bali,
Panthera tigris
Sondaica di Jawa dan
Panthera tlgris
Sumatera di Sumatera. Harimau di Bali dan Jawa sekarang sudah
tidak dapat diketemukan lagi (punah), hanya di Sumatera yang masih dapat hidup
ketahanan hidup yang tinggi (Charles dan Sukohadi 1985). Charles dan
Suprahman (1985) menyatakan bahwa harimau mempunyai banyak kesamaanya
dengan kucing yaitu ovulasinya tidak spontan; ovulasi terjadi jika ada kopulasi
atau rangsangan lainnya. Kopulasi ini terjadi beberapa hari, yaitu sekitar 106 kali %
dalam empat hari dan estrus berlangsung selama Iima hari, lama kebuntingan 98
sampai 109 hari, rata-rata 103 hari.
Kondisi Kesehatan
Kondisi kesehatan kucing prabedah sangat menentukan keberhasilan
pembedahan dan persembuhan luka pasca bedah (Signs et al. 1993). Beberapa ha1 yang perlu diperhatikan dalam kondisi prabedah adalah hewan hams dalam
keadaan sehat. Ulrike (1994) menyatakan bahwa pada kucing yang sehat akan
terlihat mata dan anus bersih; respirasi tenang dan teratur; bulu halus bercahaya
dan bersih; kulit kering dan lembut; kelenjar getah bening tidak ada
pembengkakan dan simetris; hidung sedikit basah dan bersih; telinga tidak ada
kotoran; pulsus teratur; gigi putih tanpa flak dan gusi bemama merah muda dan
cerah. Menurut Smith dan Soesanto (1987), suhu tubuh (rektal) 37,2"C-39,9"C;
frekuensi pernafasan 20-30 per menit; detak jantung 110-240 per menit.
Bright (1986) menyatakan bahwa untuk pembedahan ringan paling sedikit
gambaran darah (eritrosit, leukosit, hematokrit, hemoglobin dan diferensiasi
leukosit) harus dalam keadaan tidak menyimpang. Penyimpangan dari gambaran
darah ini dapat disebabkan karena banyak darah yang keluar atau infeksi kuman
baik bersifat akut atau kronis.
Coles (1986) memberikan gambaran darah kucing normal adalah erirosit:
per dl, Mean Corp~~sci~lnr Volume (MCV). (39-55)fl, Mcan Corpuscular
Hemoglobin (MCH): (1 3-1 7)pg, Mean Corpuscular Hemoglobin Concentration
(MCHC): (3 1 -34)gr per dl, leukosit: (5.5-9.0) x 10' per ul darah, band neutrofil:
(0 sampai 4)%, segmen neutrofil: (35-75)%, limfosit: (20- 55)%, monosit: (1
sarnpai 4)%, eosinofil: (2 sampai lo)% dan basofil jarang.
Metode Laparotomi dan Garnbaran Persembuhan
Pasca Bedah Reproduksi
Metode Bedab Reproduksi
Koleksi oosit pada hewan betina dapat dilakukan dengan metode
laparoskopi dan laparotomi (Terri et ad. 1994; Wolf dan. Wiltd 1996). Metode laparoskopi dilakukan tanpa pernbedahan sedang metode laparotomi dilakukan
dengan pernbedahan (tindakan cyrorgis). Laparotomi, berasal dari kata laparo dan
tomi. Laparo artinya ruang abdominal/peritoneal dan tomi artinya
penyayatadpembukaadpembedahan, jadi laparotomi adalah pembukaan/
penyayatadpembedahan di ruang peritoneaYabdomina1 (Charles et al. 1981). Tujuan laparotomi adalah untuk pernbedahan saluran uroginetal, pencemaan, hati
dan pankreas (Karl et al. 1981). Ditinjau dari lokasi sayatan bedah, secara garis besar laparotorni dibedakan menjadi tiga, yaitu laparotomi medianus (sayatan
tepat di daerah linea alba yaitu pada aponeurose muskulus obliqus abdorninis
externus dan internus), paramedianus (sayatan beberapa cm di sebelah kanan dan
kiri linea alba yaitu pada muskulus obliqus abdominis externus dan internus) dan
laparotomi flank (sayatan tepat di daerah legok lapar) (Karl ef al. 1981).
catgut plain (Lyofil Germany, 3/0) untuk jahitan peritoneum dan atau otot
sedangkan NC silk (B. Braun, Melsungen, 2/0) untuk kulit. Menurut Manakhly
dan Sayed (1995) benang catgut chromic diabsorbsi paling cepat, kemudian
diikuti oleh vicryl (polygalactin) dan dexon (polyglicolic acid). Efek reaksi
jaringan oleh sel leukosit akibat adanya benang bertumt-turut dari yang paling
ringan adalah polydioxanon (F'DS), prolene (polypropylene), vicryI (polygalactin)
dan dexon (polyglicolic acid).
Menurut Karen el al. (1989); Howard et al. (1992) dan Roth et al (1994) pembedahan untuk koleksi oosit dilakukan setelah hewan teranestesi. Anestesi
dilakukan dengan kombinasi ketamine hidrokloride (ketalar) dengan dosis 18.0
sampai 20.0 mg per kg berat badan dan acepromazine dengan dosis 0.2 mg per kg
berat badan.
Koleksi sel garnet jantan (spermatozoa) dilakukan dari kauda epididimis
melalui sayatan dan dari vas deferens meialui pencucian Wushing) setelah kucing
dikastrasi Anestesi dilakukan dengan menggunakan kombinasi seperti pada
koleksi oosit (Lengwinat et ad. 1992).
Keberhasilan Pembedahan
Keberhasilan pembedahan ditentukan oleh kondisi hewan prabedah,
macam bedah dan lama persembuhan pasca bedah. Banyaknya darah yang keluar
(hemoragi), perubahan neuroendokrin dan tersedianya glukosa sebagai sumber
energi sangat mempengaruhi persembuhan pasca bedah (Rossin dalam Bojrab
1981). Untuk mengetahui persembuhan pasca bedah dapat dilakukan melalui
evaluasi hasil pemeriksaan klinis, gambaran darah, konsentrasi glukosa darah dan
Pemeriksam~~ Klinis
Salah satu cara untuk mengetahui kesehatan hewan pasca pembedahan
diperlukan pemeriksaan klinis yang meliputi frekuensi nafas, frekuensi nadi,
suhu tubuh dan luka bekas jahitan.
Suhr tubuh
Di dalam tubuh terjadi pembentukan dan pengeluaran panas secara
berkesinambungan. Pusat pengatur suhu tubuh terletak di hipotalamus (preoptik
hipotalamus) pada susunan syaraf pusat. Hipotdamus mernpunyai suhu kritis
(suhu set point), dimana di atas atau di bawah suhu tersebut mekanisme
pengeluaran dan pembentukan panas akan bekerja (Anderson 1997). Mekanisme
pembentukan dan pengeluaran panas tersebut melalui termoreseptor perifer yang
meliputi reseptor panas dan dingin yang kemudian dihantarkan oleh simpul syaraf
ke hipotalamus. Syaraf di hipotalamus akan berintegrasi untuk menghasilkan
signal eferen akhir yaitu pembentukan atau pengeluaran panas (Cardielhacc I991
dan Ganong 1983).
Beal et al. (2000) menyatakan bahwa selama pernbedahan akan t e j a d i
penurunan suhu tubuh. Penurunan suhu tubuh ini (hipothermia) disebabkan oleh
pengaruh pemberian anestesi. Lamanya pemberian anestesi dan lamanya waktu
pembedahaa merupakan faktor penentu resiko tejadinya infeksi walaupun
pembedahan dilakukan secara aseptis.
Braund dalam Bojrab (1981) rnenyatakan bahwa hypothermia lokal terjadi
mulai awal pembedahan sarnpai lebih kurang empat jam pasca pernbedahan.
Kondisi seperti ini merangsang pembentukan norepineprin pada jaringan yang
hipotaiamus, yang kemudian mengadakan integrasi untuk menghasilkan signal
eferen yaitu pembentukan panas.
Infiltrasi leukosit (neutrofil) di dalam jaringan yang rusak, akan
meningkatkan total leukosit secara keselumhan, yang kemudian akan diikuti
dengan peningkatan suhu tubuh secara umum. Hal ini mulai terjadi 24 jam pasca
pembedahan (Bojrab 198 1).
Respirasi @ernafasan)
Fungsi utama respirasi adalah untuk menyediakan oksigen (02) di dalam
darah dan mengambil karbondioksida (COz) dari dalarn darah dan menjaga suhu
tubuh tetap dalam keadaan normal. Ada dua macam mekanisme respirasi yaitu
inspirasi dan ekspirasi. lnspirasi adalah gerakan udara masuk ke dalam paru-paru,
sedang ekspirasi adalah gerakan udara keluar dari paru-paru. Pada saat inspirasi
oksigen di bawa oleh darah dan berdihsi ke jaringan untuk proses oksidasi seluler
(respirasi internal). Karbon dioksida hasil oksidasi kembali berdifusi ke dalam
darah kemudian dikeluarkan dari dalam tubuh meIalui proses ekspirasi (respirasi
eksternal) (Franson 1996). Menurut Guyton (1996) tujuan akhir respirasi adalah
untuk mempertahankan konsentrasi oksigen, karbondioksida dan ion hidrogen
tetap konstan di dalam cairan tubuh sehingga fbngsi jaringan terus berlangsung.
Sebagai akibat dari penurunan jumlah sel darah merah (erihosit) oIeh
perdarahan (hemoragi) maka terjadi penurunan konsentrasi hemoglobin. Adanya
hemoglobin ini berkaitan dengan kemampuan darah membawa oksigen. Sehingga
tubuh akan berusaha untuk memperoleh oksigen yang lebih banyak dengan
Sistem kardiuvccsku[er
Sistem kardiovaskuler meliputi jantung, sistern pembuluh darah dan
pembuluh limfa. Jantung mamalia terdiri atas empat ruangan yaitu dua atrium dan
dua ventrikel yang merupakan sistem pompa. Sistem pembuluh darah terdiri atas
arteri dan vena. Arteri adalah sistem pembuluh yang mengedarkan darah dari
jantung ke seluruh bagian tubuh termasuk jaringan, sedang vena adalah membawa
darah menuju ke jantung. Pembuluh limfa membawa cairan jaringan atau cairan
limfa menuju vena-vena besar (Franson 1996).
Satu denyut lengkap dalam siklus jantung mencakup dua periode yaitu
diastole dan sistole. Diastole adalah relaksasi suatu bilik jantung tepat sebelum
dan selama pengisian bilik tersebut. Hal ini dapat tejadi pada bilik kanan
maupun kiri. Sistole adalah kontraksi suatu bilik jantung dalam proses
pengosongan parsial bilik tersebut. Pada saat darah masuk ke d d a m atrium kanan
dari sirkulasi sistemik tubuh dan atrium kiri dari paru-paru, volume dan tekanan
di dalam atrium meningkat (terjadi selama diastole). Ketika tekanan arterial
melampaui tekanan ventrikular, katup atrium ventrikel terbuka, memungkinkan
darah mengalir ke dalam ventrikel yang sedang rileks sehingga ventrikel terisi
darah (* 70%) dan tejadi sebelum kontraksi atrial. Atrial kemudian mengalami
depolarisasi dan kontraksi yang kemudian menekan sisa darah arterial menuju ke
ventrikel sehingga meningkatkan tekanan dan volume ventrikular. Tekanan
ventrikular yang besar mamaksa katup atrium ventrikel tertutup (suara jantung
pertarna). Meningkatnya tekanan ventrikular yang melampaui tekanan arterial,
menyebabkan katup semilunare pulmoner dan aorta terbuka. Darah dipancarkan
Kamudian tibalah fase protodiastol dimana tekanan ventrikuker menurun yang
diikuti dengan kenaikan tekanan arterial sehingga menyebabkan arus balik darah
sebagai akibat elastisitas dinding arteri yang menutup katup-katup semilunar
pulmoner dan aorta (suara jantung kedua) (Franson 1996).
Sebagai reaksi adanya perlukaan dan penurunan volume darah oleh
pembedahan (hemoragi akut) akan merangsang sekresi angiotensin, katekolamin,
Atlti Diuretic Hormone (ADH) dan aldosteron. Sekresi angiotensin dan
katekolamin akan meningkatkan tekanan darah dan cardiac output. Sekresi ADH
oleh hipotalamus dan aldosteron sebagai akibat adanya angiotensin I1 akan
meningkatkan reabsorbsi natrium (Na) pada tubuli ginjal sehingga meningkatkan
volume plasma. Untuk mengatasi ha1 tersebut jantung h a s bekerja lebih kuat
lagi. Adapun gejala klinis yang terlihat adalah adanya paningkatan frekuensi
denyut jantung (tachicardia). Mekanisme sekresi angiotensin, katekolamin, Anti
Diuretic Normon dan aldosteron dapat dilihat pada lampiran 2 (Bojrab 1981).
Darah
Di dalam darah terdapat kumpulan elemen dalam bentuk suspensi atau
kumpulan sel yang terendam dalam plasma darah (William 1987). Adapun fingsi
darah dalam sirkulasi adalah
I . membawa gas oksigen ( 0 2 ) dari pa=-paru ke dalam jaringan dan membawa
karbon dioksida ( C O z ) dari jaringan ke dalam paru-paru, 2. membawa sari-sari makanan dari saiuran pencernaan,
3 . membawa sisa-sisa metabolisme dari jaringan perifer ke ternpat eksresi
4. mengantar enzim dan hormon ke dalam jaringan spesifik
6 lllulawiri~ lolisi~~ dan trlellccr.lla b a h i ~ i ~ antigen darlgan lneinbawa sel darah
putih untuk bermiyrasi ke dalam jarinyan perifer (Phillis 1976; Martini cf rrl.
1992).
Komponen darah adalah sel-sel darah dan plasma yang merupakan
medium cairan darah. Ada tiga rnacam sel darah yaitu sel darah merah (eritrosit),
sel darah putih (leukosit) dan trombosit (platelet) (Phillis 1976; Martini el aZ.
1992).
Eritropoiesis adalah proses pembentukan sel darah merah (eritrosit) pada
mamalia yang tejadi dari stem cell di dalam sumsum tulang belakang, sedang
leukopoiesis adalah poses pembentukan sel darah putih (leukosit) (Martini, et a/. 1992). Stem cell rnempakan sel progenitor yang dapat membentuk Colony Forming Unit (CPU) dan mampu rnemproduksi sel-sel darah. Colony Forming Unit-Erythrocyte ( C P U - E ) merupakan unit pembentuk eritrosit, Colony Forming iJn~t-Granulocyte Monocyte (CFU-GM) merupakan unit pembentuk monosit dan neutrofil, Colony Forming Unit-Eosinophl (CFU-Eos) sebagai unit pembentuk eosinofil & Colony Forming Unit BasophiZ (CFU-Bas) merupakan unit pembentuk basofil.
Sel progenetor bagi sel lirnfosit texdapat di dalam thymus yaitu prekursor
sel-T yang bertanggung jawab pada pembentukan limfosit T dan di bursa
Fabricius yaitu prekursor sel-B yang bertanggung jawab pada pembentukan sel
limfosit B (Meyer et al. 1992; Jain 1993).
Meyer e f al. (1992); Tortora dan Anagnostakos (1990) rnenyatakan bahwa jaringan mieloid akan memproduksi sel darah merah (eritrosit), sel darah putih
darah yaitu megakarrioblast yang akan menjadi platelet, rubriblast yang akan
menjadi eritrosit matang, monoblast yang akan menjadi monosit-makrofag,
rnieloblast y ang akan menjadi sel leukosit granulosit matang y aitu neutrofil,
eosinofil, basofil dan limfoblast yang akan menjadi sel limfosit T dan sel
limfosit B. Rangkaian proses pembentukan sel-sel darah dapat dilihat pada
lampiran 3 (Jain 1993).
Faktor-faktor yang mempengaruhi kerja Eryfhrocyife Burst Forming Unit (BFU-E), Granulocyte Macrophage Colony Forming Unit (CFU-GM) &n Megaka7yocyte Colony Forming Unit (CFU-Meg) untuk memproduksi sel eritrosit, platelet dan sel leukosit granulosit adalah interleukin-3, interleukin-l
dan Granulocyte Macrophage Colony Stimulating Factor (GM-CSF). Produksi sel-sel ini akan mengalami peningkatan pada kasus anemia, infeksi bakteri,
adanya antigen dan endotoksemia (Jain 1993; Meyer et al. 1992). Penyebab anemia adalah terjadinya pendarahan (hemoragi). kerusakan eritrosit (hemolisis)
dan penurunan produksi eritrosit.
Pada umumnya eritrositosis diikuti dengan kenaikan Packet Cell Volume
/PCV/ hemakrit yang diiringi dengan kenaikan kosentrasi hemoglobin (Meyer e f al. 1992). Adanya hemoglobin dalam darah berkaitan dengan kemampuan darah membawa oksigen (Svandson 1974). Eritrositosis merupakan proses yang
kontinyu yang setara dengan tingkat kerusakan darah. Hal ini diatur oleh sistem
umpan balik yang di hambat oleh suatu peningkatan jumlah eritrosit dan
dirangsang oleh anemia (Swenson 1984; Swandson 1974). Untuk mengetahui
macam anemia yang terjadi pada hemoragi akut akibat pembedahan perlu
hemoglobin tiap eritrosit, konsentrasi hemoglobin dan hematokrit. Indeks eritrosit
ada tiga macam, yaitu (1) Mean Corpr~scrdar VoZz4me ( M C V ) , menyatakan volume rata-rata tiap eritrosit; (2) Mean (Turptrsczrlar Hemoglobin Cunsenir~rtio~i
(MCHC), menyatakan konsentrasi hemoglobin dalam eritrosit atau perbandingan
berat hemoglobin dengan volume sel darahnya dan (3) Mean Corpuscular Hemoglobin ( M C H ) , menyatakan jumlah hemoglobin dalam satuan berat di dalam eritrosit. Pada keadaan anemia akibat hemoragi akut atau subakut, nilai MCV dan
MCHC adalah normal (normocytic normochromic). Jika sumsum tulang memberi
reaksi baik nilai MCV dan MCHC meningkat (macrocytic). Nilai normal MCH
dan MCHC pada kucing berturu-turut (39-55)fl dengan rata-rata 45fl dan (30-
36)% dengan rata-rata 33% (Jain 1986).
Coles (1980) menyatakan bahwa hemoragi akut biasanya diikuti dengan
pembentukan retikulosit yang merupakan tahap akhir pembentukan eritrosit.
Kenaikan jumlah retikulosit tejadi pada empat sampai tujuh hari setelah hemoragi
dan kembali ke tingkat normal dalam tiga sampai lima minggu setelah hemoragi.
Menurut Robinson dan Huxtable (1988) penurunan sel darah merah perifer
akibat adanya hemoragi atau disebabkan karena penurunan daya hidup sel darah
merah tersebut. Gejala klinis yang terlihat adalah adanya anemia. Secara umum
dalam keadaan anemia kadar hemoglobin dan hematokrit menurun, frekuensi
respirasi rneningkat dan jantung mengalami tachycardia
Darah sebagai media transformasi leukosit akan membawa sel-sel ini
menuju lokasi invasi mikroorganisme atau perlukaan di dalam jaringan. Adanya
peningkatan permiabilitas dinding pembuluh darah akan menyebabkan sel-sel
leukosit berrnigrasi ke dalam jaringan yang mengalami perlukaan (Martini
Kalaimothi dan Rajendran (1994) menyatakan bahwa leukosit akan
bermigrasi darr rnenfagositosis di daerah yang terdapat antigen tertentu. Leukosit
granulosit dan sel monosit merupakan sel yang mengandung enzim Iisosim yang
mampu menghancurkan material asing di dalam tubuh seperti mikroorganisme
atau jaringan yang rusak (Berne dan Levy 1990).
Peningkatan leukosit merupakan respons fisiologis untuk melindungi
tubuh dari serangan mikroorganisme sebagai respons terhadap adanya infeksi
(Baldy 1984). Pada infeksi akut oleh bakteri, leukosit khususnya sel neutrofil akan
meningkat untuk memenuhi kebutuhan jaringan tubuh yang rusak (Jain 1993).
Penurunan jumlah leukosit di dalam sirkulasi, pada umumnya disebabkan oleh
penurunan neutrofil atau limfosit dan pada umumnya akibat gangguan yang
bersifat patologis seperti hypoplasia sumsum tulang, penyakit viral dan infeksi
yang berat (Doxey 197 1; Jain 1993).
Menurut Jain (1993) peningkatan jumlah leukosit (leukositosis) terjadi
baik secara fisiologis atau patologis. Secara fisiologis tejadi akibat adanya
peningkatan jumlah sel neutrofil dan atau sel limfosit di dalam sirkulasi dan
menyebabkan peningkatan jumlah leukosit total dan atau nilai absolut kedua sel
tersebut. Peningkatan sekresi epineprin dan kortikosteroid yang terjadi pada
kondisi stress baik secara fisik atau emosional dapat menyebabkan peningkatan
jumlah leukosit, sedang secara patologis, peningkatan leukosit dalam sirkulasi
darah disebabkan karena leukosit alctif melawan mikroorganisme (Doxey 197 1).
tiba sehinyga menyebabkan leukositosis atau pseudo leukositosis. Fenomena yang
sama terjadi saat kecepatan aliran darah meningkat. Jain (1993), menyatakan
bahwa waktu yang diperlukan untuk pelepasan granulosit ke dalam sirkulasi darah
sekitar enam sampai 14 jam.
Sebagai garis pertahanan pertama di dalam proses peradangan akut dan
perlukaan, sel neutrofil berperan penting dalam meIakukan fagositosis (Jain 1993;
Tizard 1982). Neutrofil akan merekat di sepanjang dinding endotelial pembuluh
darah dan berimigrasi ke dalam jaringan. Kemampuan kemotoktiknya di
pengaruhi oleh subtansi yang dilepaskan oleh jaringan yang rusak akibat
perlukaan dan produk mikroorganisme. Faktor-faktor ini akan menyebabkan
peningkatan akumulasi neutrofil ke dalam lokasi perlukaan (Swenson 1984). Jain
(1993)