KARAKTERISASI DNA
BARCODE
PADA LIMA JENIS
POHON LANGKA DI PT. RESTORASI EKOSISTEM
INDONESIA (JAMBI)
LILY NOVIANTY
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul “Karakterisasi DNA
Barcode pada Lima Jenis Pohon Langka di PT. Restorasi Ekosistem Indonesia (Jambi)” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2016
Lily Novianty
RINGKASAN
LILY NOVIANTY. Karakterisasi DNA Barcode pada Lima Jenis Pohon Langka di PT. Restorasi Ekosistem Indonesia (Jambi). Dibimbing oleh ISKANDAR Z. SIREGAR dan SRI RAHAYU.
Deforestasi dan degradasi hutan telah mengakibatkan berkurangnya populasi tumbuhan dan hewan yang mengarah ke status terancam punah dari beberapa spesies penting. Restorasi ekosistem hutan merupakan salah satu strategi yang dipilih untuk meningkatkan ukuran populasi dengan cara re-introduksi spesies penting. Re-introduksi spesies masih menghadapi tantangan dalam hal identifikasi spesies yang benar, pengadaan bibit berkualitas. Pengembangan alat baru untuk melengkapi identifikasi tradisional yaitu menggunakan barcode DNA. Identifikasi spesies masih sangat bergantung pada pengetahuan dan pengalaman pengenal pohon yang terlatih atau para-ahli taksonomi. Tujuan dari penelitian ini adalah untuk menguji aplikasi barcode DNA untuk identifikasi lima jenis pohon yang terancam punah dengan membandingkan pemeriksaan langsung di lapangan, verifikasi herbarium, database kesamaan barcode DNA. ITS2, matK dan rbcL
digunakan sebagai calon barcode menunjukkan amplifikasi dan urutan hasil yang baik.
Hasil perbandingan metode identifikasi spesies menegaskan bahwa akurasi tinggi ditemukan pada tingkat genus, sementara pada tingkat spesies masih menunjukkan akurasi yang sangat rendah karena pada kelima jenis belum tersedia data sekuen secara lengkap pada pangkalan data GenBank maupun pada BOLD System sebagai referensi. Nilai rata-rata jarak interspesifik lebih besar daripada jarak intraspesifik pada kelima jenis berdasarkan model K2P. Rekonstruksi pohon filogeni dengan menggunakan metode Neighbor Joining (NJ) bootstrap 100X menunjukkan penanda yang akurat dalam mendeskriminasi spesies adalah matK
dan rbcL. ITS2 belum menunjukkan penanda yang akurat dalam mendiskriminasi spesies karena spesies yang berbeda masih dikelompokkan dalam satu clade.
SUMMARY
LILY NOVIANTY. Characterization of DNA Barcodes on Five Endangered Tree Species in Harapan Rainforest (Jambi) Supervised by ISKANDAR Z. SIREGAR and SRI RAHAYU.
Deforestation and forest degradation have resulted in reduced population size of plants and animals leading to endangered status of several important species. Restoration of forest ecosystem is one of the strategy chosen to increase population size by means of re-introduction of species of interests. Re-introduction of the species still faces challenges in terms of correct species identification, planting stock production etc. New tool has been developed to complementary support traditional identification using DNA barcode. Species identification is still heavily relied on the knowledge and experiences of field workers or para-taxonomist. The objective of the research was to test applicability of DNA barcode for species indentification of five endangered tree species by comparing with direct field examination, herbaria verification, similarity databases of DNA barcodes. ITS2, matK and rbcL were used as candidate barcodes showing good amplification and sequence results.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Silvikultur Tropika
KARAKTERISASI DNA
BARCODE
PADA LIMA JENIS
POHON LANGKA DI PT. RESTORASI EKOSISTEM
INDONESIA (JAMBI)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Karakterisasi DNA Barcode pada Lima Jenis Pohon Langka di PT. Restorasi Ekosistem Indonesia (Jambi)
Nama : Lily Novianty
NIM : E451124081
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Iskandar Z. Siregar, MForSc Ketua
Dr Ir Sri Rahayu, M Si Anggota
Diketahui oleh
Ketua Program Studi Silvikultur Tropika
Prof Dr Ir Sri Wilarso Budi R, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji syukur kehadirat Allah SWT atas rahmatNya hingga tesis yang berjudul “Karakterisasi DNA Barcode pada Lima Jenis Pohon Langka di PT. Restorasi Ekosistem Indonesia (Jambi)” dapat diselesaikan. Shalawat dan salam semoga selalu tercurah kepada nabi besar Muhammad SAW.
Pada kesempatan ini penulis mengucapkan terimakasih dan penghargaan kepada Prof Dr Ir Iskandar Z.Siregar, MForSc dan Dr Ir Sri Rahayu, M Si selaku komisi pembimbing, atas arahan dan bimbingannya.Ucapan terimakasih dan penghargaan juga kami sampaikan kepada Direktorat Jenderal Pendidikan Tinggi (DIKTI) yang telah memberikan Dana kegiatan Penelitian Kerjasama Luar Negeri dan Publikasi Internasional kepada penulis untuk tahun anggaran 2013-2014 sesuai MAK 2013.109.521213.
Terimakasih penulis sampaikan kepada Laswi Irmayanti, S.Hut. M.Si. dan Fifi Gus Dwiyanti,S. Hut, M.Agr, Ph.D yang telah memberikan ide dan masukan-masukan dalam penelitian. Kepada sahabat dan rekan-rekan di Laboratorium Genetik, Departemen Silvikultur (Asep Mulyadiana, S.Hut, M.Si.; Jeprianto Manurung, S.Hut, M.Si; Arniana Anwar, S.Hut, M.Si; Rajjitha Handayani, SP; Faujiyah S.Hut; Ahmad Baiquni Rangkuti S.Hut; Ir Zainal Muttaqin, MP; Arina Nur Faidah S.Hut; Tri yanto S.Hut; dan Laura Florensia S.Hut) terimakasih atas bantuan dan dukungannya. Terimakasih kepada Hutami Indah Pertiwi, SP; Yossi Liturmas, S.Hut; Lathif Al Anshari, S.Hut dan Inggar Damayanti, S. Hut serta rekan-rekan di Universitas Nahdathul Ulama Sumatera Utara atas motivasi yang diberikan kepada penulis. Ungkapan terima kasih juga disampaikan kepada bapak, ibu, adik-adik serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Penulis juga mengucapkan terimakasih kepada semua pihak yang telah membantu baik secara langsung maupun tidak langsung selama perencanaan, pelaksanaan, sampai tesis ini dapat diselesaikan. Semoga Allah memberi balasan yang berlipat. Amiin.
Penulis menyadari bahwa tesis ini masih jauh dari sempurna. Namun penulis selalu berharap semoga hasil penelitian ini dapat bermanfaat bagi penulis dan para pembaca.
Bogor, Februari 2016
DAFTAR ISI
DAFTAR ISI vi
DAFTAR TEBEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
METODE 2
Waktu dan Tempat Penelitian 2
Alat dan Bahan 3
Prosedur 4
Analisis Data 9
HASIL DAN PEMBAHASAN 9
Karakteristik Morfologi Daun 9
Identifikasi jenis menggunakan penanda molekuler 11
Hasil amplifikasi dan sequencing 11
Analisis DNA dan komposisi basa nukleotida 11
Barcoding gap 12
Analisis filogenetik 16
SIMPULAN 21
DAFTAR PUSTAKA 21
LAMPIRAN 27
DAFTAR TABEL
1 Daftar sampel yang digunakan untuk identifikasi jenis 3
2 Daftar alat dan bahan penelitian 4
3 Urutan nukleotida primer yang digunakan untuk amplifikasi DNA 8 4 Empat komponen bahan yang digunakan dalam reaksi PCR 8 5 Panjang sekuen basa (bp) pada ketiga penanda genetik 11 6 Nilai rata-rata jarak intraspesifik dan interspesifik dihitung
menggunakan model K2P 12
7 Akurasi identifikasi tiga penanda menggunakan BLAST 16
DAFTAR GAMBAR
1 Peta lokasi pengambilan sampel penelitian PT. REKI di Provinsi Jambi 3
2 Pengukuran karakteristik morfologi daun 5
3 Bentuk ujung daun dan bentuk pangkal daun (Ellis et al. 2009) 5 4 Kandidat gen yang disarankan untuk identifikasi tanaman (Chen et al. 2010) 7
5 Region ITS (Mansfield & Kang 2008) 7
6 Deskripsi morfologi daun karakter dimensi dan variabel yang diamati 9 7 Deskripsi morfologi daun variabel yang dihitung dan dikalkulasikan 10 8 Distribusi intra dan interspesifik K2P pada lokus matK 13 9 Distribusi intra dan interspesifik K2P pada lokus rbcL 14 10 Distribusi intra dan interspesifik K2P pada lokus ITS2 15 11 Pohon filogeni lokus rbcL pada kelima genus 17 12 Pohon filogeni lokus matK pada kelima genus 18 13 Pohon filogeni lokus ITS2 pada kelima genus 19
DAFTAR LAMPIRAN
1 Dokumentasi morfologi daun 27
2 Dokumentasi pengukuran morfologi daun 28
3 Hasil pengurutan basa nukleotida (sequencing) pada lokus rbcL 29 4 Hasil pengurutan basa nukleotida (sequencing) pada lokus matK 35 5 Hasil pengurutan basa nukleotida (sequencing) pada lokus ITS2 36
6 Data hasil analisis morfologi 37
PENDAHULUAN
Latar Belakang
Deforestasi dan degradasi hutan mengakibatkan laju penurunan populasi yang mempercepat proses kelangkaan jenis. IUCN (2009) melaporkan jumlah jenis terancam punah yang ada di Indonesia adalah sebanyak 386 spesies dengan komposisi sebagai berikut: 204 spesies yang termasuk dalam kategori rentan (Vulnerable), 69 dalam kategori genting (Endangered) dan 113 kritis (Critically Endangered). Konservasi sumber daya genetik dari jenis-jenis tersebut perlu segera dilakukan. Pemahaman yang baik diperlukan untuk mendukung program konservasi genetik pohon dan pemanfaatannya. Aspek taksonomi serta informasi mengenai karakteristik biologis merupakan salah satu dasar penting dari aktivitas konservasi atau restorasi jenis (Schmeller et al. 2008). Kesalahan identifikasi jenis cukup sering terjadi yang berakibat kurang baik jika dikaitkan dengan kegiatan pemuliaan pohon dan pengadaan bibit berkualitas dalam rangka program restorasi (Soberon & Medellin 2007).
Proses pengambilan sampel tanaman hutan pada fase anakan di lapangan umumnya mengalami kesulitan dalam proses pengenalan jenis. Identifikasi jenis umumnya mengandalkan pengenal pohon yang terlatih dimana sering juga menghadapi kesulitan dalam hal pengenalan secara tepat (Lahaye et al. 2008). Karakter morfologi yang telah lama digunakan dalam penelitian filogenetik sangat mudah dipengaruhi oleh faktor lingkungan dan data bersifat subjektif. Sisi lain karakter DNA diketahui konsisten dibandingkan karakter morfologi.
Penanda molekuler merupakan fragmen sekuen DNA yang berhubungan dengan bagian genom pembawa gen yang bertanggung jawab terhadap suatu karakter tertentu (Bagali et al. 2010). Penggunaan DNA menjadi pilihan dan telah diaplikasikan pada berbagai jenis tumbuhan. Perkembangan ilmu pengetahuan dan teknologi, mulai diaplikasikan DNA barcoding sebagai penanda untuk identifikasi yang cepat dan akurat (Gomes et al. 2002). DNA barcoding adalah penggunaan
region DNA standar berukuran pendek sebagai penanda untuk identifikasi spesies yang cepat dan akurat (Valentini 2009). Keunggulan teknik DNA barcoding yaitu dapat digunakan untuk identifikasi dan karakterisasi berbagai spesies yang tidak dapat dibedakan secara morfologi (Tudge 2000). Data dan informasi DNA
barcode masih belum tersedia cukup baik pada pangkalan data GenBank (http://ww.ncbi.nlm.nih.gov) maupun BOLD System (http://boldsystems.org/).
DNA barcode memiliki fungsi-fungsi aplikatif misalnya untuk survei ekologi (Dick & Kress 2009), identifikasi takson kriptik dan konfirmasi sampel tanaman obat (Xue & Li 2011). Penggunaan penanda morfologi dan genetik secara komplementer untuk proses identifikasi jenis yang lebih akurat masih jarang dijumpai pada tanaman kehutanan khususnya jika dikaitkan dengan kepastian jenis untuk usaha konservasi, restorasi dan sebagai alat untuk membantu verifikasi prosedur lacak balak. Studi barcode lokus tanaman umumnya menggunakan region rbcL (ribulase-1, 5-biphosphate carboxylase) dan matK
2
ITS (internal transcribed spacer) pada tumbuhan karena sekuennya berpotensi untuk penanda filogenetik dikaitkan dengan tingkat evolusi yang lebih tinggi, memiliki salinan yang banyak di dalam genom inti dan berukuran pendek.
Berkaitan dengan permasalahan di atas, perlu dilakukan penelitian lebih lanjut terkait potensi marka rbcL, matK dan ITS yang digunakan pada tumbuh an langka di Indonesia sebagai kandidat DNA barcode. Penelitian ini bertujuan untuk menguji daya aplikasi DNA barcode dalam identifikasi lima jenis pohon langka yang telah diidentifikasi oleh PT. REKI maupun hasil identifikasi di herbarium referensi dengan membandingkan hasil pengenalan di lapangan.
Perumusan Masalah
Identifikasi tumbuhan terancam kepunahan dapat dilakukan dengan bantuan metode identifikasi molekuler berdasarkan potongan DNA pendek yang disebut
“barcode DNA” untuk melengkapi keahlian taksonomi tradisional dalam upaya konservasi tumbuhan di Indonesia (Herbert et al. 2008). Penelitian ini dilaksanakan dalam rangka menjawab beberapa pertanyaan sebagai berikut : 1. Apakah region rbcL, matK dan ITS dapat digunakan untuk identifikasi jenis. 2. Bagaimana variasi morfologi daun beberapa jenis non Dipterocarpaceae yang
terancam kepunahan.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk:
Menguji daya aplikasi DNA barcode dalam identifikasi lima jenis pohon langka yang telah diidentifikasi oleh PT. REKI maupun hasil identifikasi di herbarium referensi dengan membandingkan hasil pengenalan di lapangan.
METODE
Waktu dan Tempat Penelitian
(http://www.uni-3 goettingen.de), PT. Genetika Science Indonesia di Singapura (http://www.ptgenetika.com) dan Macrogen Co, Korea(http://dna.macrogen.com).
Gambar 1 Peta lokasi pengambilan sampel penelitian PT. REKI di Provinsi Jambi
Alat dan Bahan
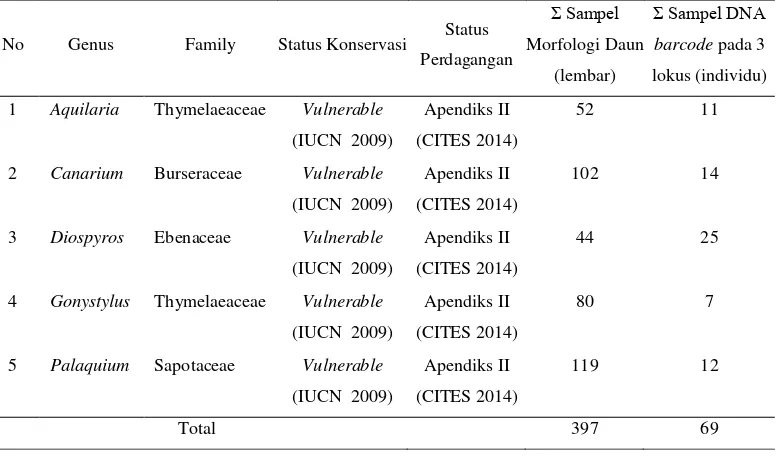
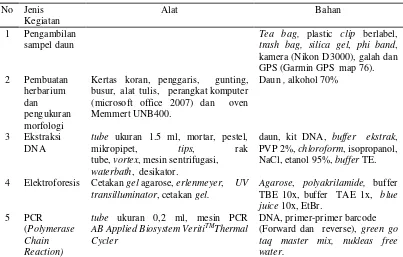
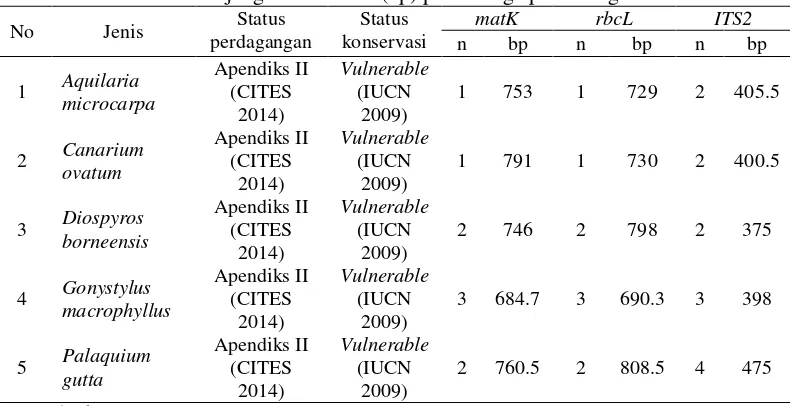
Alat dan bahan yang digunakan dalam penelitian ini terdiri atas peralatan dan bahan yang umum digunakan untuk: 1) pengambilan daun, 2) pembuatan herbarium, 3) pengukuran variabel daun, 4) ekstraksi DNA, 5) uji kualitas DNA, dan 6) PCR (Polymerase Chain Reaction). Bahan yang digunakan pada penelitian ini berupa daun fase semai dari 5 jenis langka, seperti disajikan pada Tabel 1. Daftar alat dan bahan yang digunakan dalam penelitian disajikan pada Tabel 2.
Tabel 1 Sampel yang digunakan untuk identifikasi jenis
No Genus Family Status Konservasi Status Perdagangan 1 Aquilaria Thymelaeaceae Vulnerable
(IUCN 2009)
Apendiks II (CITES 2014)
52 11
2 Canarium Burseraceae Vulnerable
(IUCN 2009)
Apendiks II (CITES 2014)
102 14
3 Diospyros Ebenaceae Vulnerable
(IUCN 2009)
Apendiks II (CITES 2014)
44 25
4 Gonystylus Thymelaeaceae Vulnerable
(IUCN 2009)
Apendiks II (CITES 2014)
80 7
5 Palaquium Sapotaceae Vulnerable
(IUCN 2009)
Apendiks II (CITES 2014)
119 12
4
Tabel 2 Daftar alat dan bahan penelitian
No Jenis kamera (Nikon D3000), galah dan GPS (Garmin GPS map 76). tube, vortex, mesin sentrifugasi,
waterbath, desikator.
daun, kit DNA, buffer ekstrak, PVP 2%, chloroform, isopropanol, NaCl, etanol 95%, buffer TE.
4 Elektroforesis Cetakan gel agarose, erlenmeyer, UV transilluminator, cetakan gel.
Agarose, polyakrilamide, buffer TBE 10x, buffer TAE 1x, blue
AB Applied Biosystem VeritiTMThermal Cycler
Sub Penelitian 1. Karakteristik Morfologi Daun
Pembuatan Herbarium
Persiapan koleksi yang baik di lapangan merupakan aspek penting dalam praktek pembuatan herbarium. Koleksi objek perlu diperhatikan kelengkapan organ tubuhnya, pengawetan dan penyimpanannya. Koleksi objek harus memperhatikan pula kelestarian objek tersebut. Pembatasan pengambilan objek (Aththorick dan Siregar 2006). Prosedur pembuatannya merujuk pada Tjirosoepomo (1993) dan Suyitno (2004). Langkah utama yang digunakan dalam pembuatan herbarium yaitu, pengumpulan spesimen, pengeringan dan penempelan herbarium. Pengumpulan spesimen dilakukan di lapangan, sedangkan dua langkah lainnya yaitu proses pengeringan spesimen dan penempelan dilakukan di laboratorium Silvikultur Fakultas Kehutanan IPB.
Pengukuran Variabel Morfologi Daun
5 1) Variabel yang dihitung yaitu jumlah tulang daun sekunder (JT)
2) Karakter dimensi yang diukur meliputi daun panjang lamina (PL), panjang tangkai daun (PT), lebar daun terlebar (LD) dan panjang lebar daun terlebar ke pangkal daun (LP). Karakter dimensi dan variabel yang dihitung secara lengkap ditampilkan pada Gambar 2.
Gambar 2 Pengukuran karakteristik morfologi daun (a): Gonystylus macrophyllus, (b):
Canarium ovatum, (c): Aquilaria microcarpa., (d): Palaquium gutta dan (e):
Diospyros borneensis. (f) karakter yang diukur.
3) Variabel yang diamati: Bentuk ujung daun (AS) dan bentuk pangkal daun (BS), diamati dengan penilaian (1 - 8) berdasarkan Gambar 3.
Gambar 3 (a) Bentuk ujung daun dan (b) bentuk pangkal daun (Ellis et al.2009)
a
A bA
c A
d A
e
A fA
LD
LP PL
PT
a
6
4) Variabel yang dikalkulasi:
Luas daun (LS) dihitung menggunakan rumus luas elips: ½ × (3.14) × (LD × PL)
Keliling daun (KL) dihitung menggunakan rumus keliling elips: ½ × (3.14) × (LD + PL)
Aspect ratio (AR) adalah rasio dari panjang dan lebar daun. Digunakan untuk memperkirakan bentuk helai daun. Jika bernilai kurang dari 1, bentuk helai daun tersebut melebar. Jika nilainya lebih dari 1, bentuk helai tersebut memanjang. Aspect ratio dihitung dengan rumus:
Form factor (FF) mendeskripsikan bentuk dari daun dan mengetahui seberapa bundar bentuk helai daun tersebut. Form factor dihitung dengan rumus:
Perimeter ratio of diameter (PR) adalah ciri untuk mengukur seberapa lonjong daun tersebut. Perimeter ratio of diameter dihitung dengan rumus:
Sub Penelitian 2. Identifikasi Jenis menggunakan Primer ITS, matK dan rbcL
Ekstraksi DNA
Analisis molekular dilakukan menggunakan sampel daun anakan kelima genus (Tabel 2.1) dengan total daun sebanyak 69 daun dari 69 individu. Ekstraksi DNA dari daun dilakukan dengan dengan metode CTAB (Cetyl Trimethyl Ammonium Bromide) (Weising et al. 2005 dan Aritonang et al. 2007) yang telah dimodifikasi dan metode kit (DNA Plant Mini Kit) dari Qiagen (http://www.qiagen.com) dengan nomor katalog 6235. Langkah pertama dari metode CTAB adalah sampel daun dipotong dengan ukuran 2 cm x 2 cm, kemudian digerus dalam pestel yang bersih dengan penambahan 500 µl buffer ekstrak dan 100 µl PVP 1%. Campuran dimasukkan dalam tube berukuran 1.5 mL.
Langkah selanjutnya dilakukan proses inkubasi dalam waterbath selama 1 jam pada suhu 65 oC. Selama inkubasi setiap 15 menit tube diangkat dan dikocok. Jika proses inkubasi telah selesai maka tube diangkat dan didinginkan ± 15 menit. DNA dimurnikan dengan menambahkan kloroform 500 µl, selanjutnya campuran tersebut dikocok agar menjadi homogen dan disentrifugasi pada kecepatan 10.000 rpm selama 10 menit. Proses sentrifugasi dilakukan untuk memisahkan bahan-bahan kimia atau fase organik dari fase air berupa supernatan. Supernatan merupakan cairan yang mengandung DNA. Langkah selanjutnya fase air dipisahkan dari fase organik dengan menggunakan mikropipet, kemudian fase air dipindahkan ke dalam tube baru (Suharsono et al. 2012).
7 disentrifugasi pada kecepatan 10.000 rpm selama 10 menit dan cairan dalam tube
dibuang. Kemudian dilakukan proses pencucian DNA dengan penambahan etanol 95% sebanyak 300 µl, lalu disentrifugasi dan cairan dalam tube dibuang. Proses tersebut dilakukan 2 kali. Pelet DNA yang ada di tube dikeringkan dengan cara disimpan dalam desikator selama 15 menit dengan posisi tube terbalik agar silica gel dalam desikator dapat menyerap cairan yang ada dalam tube.
Uji Kualitas DNA
Pengujian kualitas DNA dilakukan dengan menyiapkan gel agarose 1% (0.33 g agarose dalam 33 ml buffer TAE). Proses elektroforesis, ditambahkan
buffer TE 50 μl pada pellet DNA lalu disentrifugasi, dan diambil 3 μl DNA
ditambahkan 2 μl BJ (Blue Juice) dan dielektroforesis selama 45 menit. Hasil elektroforesis direndam dalam larutan EtBr (Etidium Bromida) selama 15 menit dan difoto pada UV transiluminator model TFX-20.LM (Aritonang et al. 2007).
Polymerase Chain Reaction (PCR) dengan ITS, matK dan rbcL
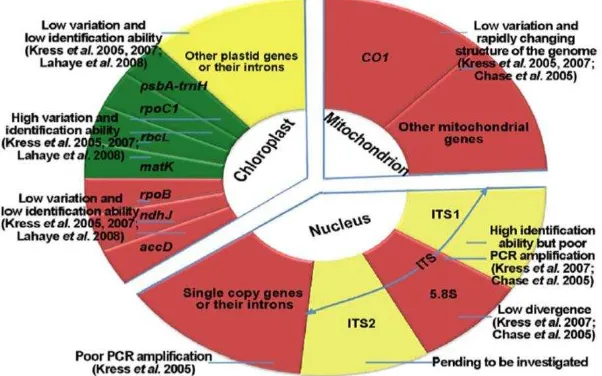
ITS berasal dari DNA ribosom (rDNA). yang disebut rDNA dan memiliki 3 jenis yang berukuran besar, yaitu 26S, 18S, dan 5.8S yang disandi oleh satu unit transkripsi tunggal (Gambar 4). Sekuen yang menyandi ketiga rDNA tersebut dipisahkan dalam unit-unit transkripsi ITS, ITS-1 terletak di antara 18S gen dan 5,8S gen dan ITS-2 terletak di antara 5,8S dan 28S gen (Gambar 5) (Soltis et al.
1998). Region ini banyak digunakan untuk menyimpulkan suatu filogenetik dan berukuran kecil yaitu kurang lebih 420 bp (Chen et al. 2010).
Gambar 4 Kandidat gen yang disarankan untuk identifikasi tanaman (Chen et al. 2010)
8
Gen matK dan rbcL dibuat berdasarkan DNA kloroplas (cpDNA) cocok untuk mempelajari evolusi dan filogenetik suatu tumbuhan, dikarenakan cpDNA merupakan komponen yang cukup melimpah pada keseluruhan DNA pada tumbuhan sehingga sangat mendukung dalam ekstraksi DNA beserta analisisnya. (Soltis et al. 1998). Gen matK banyak digunakan dalam DNA barcode karna memiliki keunggulan yaitu mudah diamplifikasi, mudah disekuensing dan efektif dalam membedakan antar spesies (Hollingsworth et al. 2009). Region rbcL
memiliki tingkat keberhasilan amplifikasi yang tinggi untuk banyak spesies serta mudah untuk disekuensing (Hollingsworth et al. 2011). Primer yang digunakan untuk amplifikasi DNA. Urutan nukleotida untuk masing-masing primer yang digunakan dalam penelitian disajikan pada Tabel 3.
Tabel 3 Urutan nukleotida primer yang digunakan untuk amplifikasi DNA No Region Primer Sequence(5’-3’) Arah Sumber 1 ITS1 AB101 ACGAATTCATGGTCCGGTGAAGTGTTCG F Sun et al. (1994) AB102 TAGAATTCCCCGGTTCGCTCGC GTTAC R Sun et al. (1994) ITS2 ITS-S2F ATGCGATACTTGGTGTGAAT F Chen et al. (2010)
ITS4 TCCTCCGCTTATTGATATGC R Chen et al. (2010) 2 rbcL rbcLaF ATGTCACCACAAACAGAGACTAAA F (Kress & Erickson 2007)
rbcLaR GTAAAATCAAGTCCACCRCG R (Kress & Erickson 2007) 3 matK matK-3F CGTACAGTACTTTTGTGTTTACGAG F (Hollingsworth et al. 2009)
matK-1R ACCCAGTCCATCTGGAAATCTTGGTTC R (Hollingsworth et al. 2009)
DNA hasil ekstraksi diamplifikasi menggunakan mesin PCR AB Applied Biosystem Veriti TM Thermal Cycler (http://appliedbiosystem.com). PCR diawali dengan pengenceran DNA dan primer. DNA hasil ekstraksi diencerkan 100 kali
menggunakan aquabides. Perbandingan antara DNA dan aquabides yaitu 99 μl aquabides dan 1 μl DNA. Pengenceran primer dilakukan dengan cara mengambil
primer pekat sebanayak 10 μl, kemudian ditambahkan nuclease free water sebanyak 90 μl. Komposisi bahan untuk reaksi PCR disajikan pada Tabel 4.
Tabel 4 Empat komponen bahan yang digunakan dalam reaksi PCR
No. Nama Bahan Sampel Reaksi
1 H2O 2.5 μl
2 Green Go Taq Master Mix 7.5 μl
3 Primer F dan R 1.5 μl 4 DNA encer 2 μl
Perunutan (sequencing)
Sekuensing DNA adalah metode untuk menentukan urutan basa nukleotida dalam DNA (Randi dan Lucchini 1998). DNA hasil amplifikasi bersama primer yang telah digunakan dalam proses amplifikasi dilanjutkan ke proses sekuensing. Pengumpulan data tambahan berupa sekuen DNA barcode masing-masing jenis dilakukan pada region ITS, matK dan rbcL. Data ini diambil dari database
9 Analisis Data
Hasil perunutan nukleotida yang diedit secara manual berdasarkan kromatogram, sequence alignment, selanjutnya dilakukan analisis BLAST pada
database NCBI. BLAST (Basic Local Alignment Search Tools) dengan memasukkan data sekuens setiap spesies ke dalam kolom yang terdapat pada laman web BLAST yang kemudian akan terverifikasi persen kekerabatan suatu spesies. Sekuen tersebut dianalisis panjang basa (bp) dan barcoding gap (Nei dan Kumar 2000).
Konstruksi pohon filogeni dan jarak genetik menggunakan program MEGA 6 (Tamura et al. 2013). Program MEGA memiliki tools yang mampu bekerja dalam pembacaan urutan DNA, analisis statistik DNA baik urutan basa nukleotida maupun protein, dan penjajaran urutan satu sampel dengan sampel lainnya menggunakan ClustalW (Kumar et al. 2008). Analisis morfologi daun dengan statistik sederhana disajikan berupa boxplot menggunakan software Minitab 15 (Minitab Inc 2007).
HASIL DAN PEMBAHASAN
Karakteristik Morfologi Daun
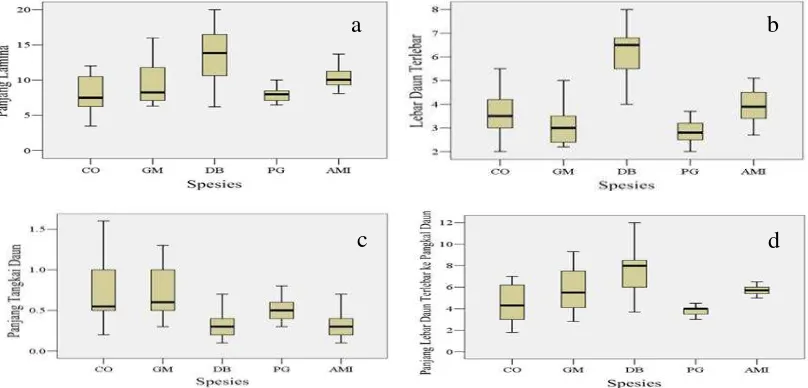
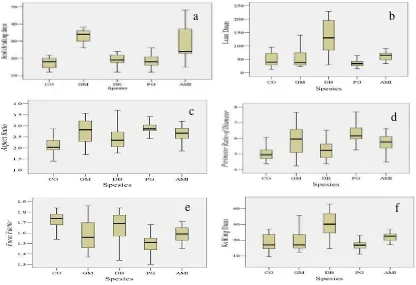
Karakter morfologi sangat penting untuk mengenal identitas spesies. Karakteristik ini dapat diamati pada organ vegetatif tumbuhan, seperti daun, batang, dan cabang, serta pada organ generatif tumbuhan, seperti bunga dan buah. Kedua organ tumbuhan ini memiliki perbedaan waktu observasi. Organ generatif tumbuhan hanya dapat diamati pada waktu tertentu, sedangkan organ vegetatif tumbuhan cenderung tersedia sebagai sumber pengamatan sepanjang waktu. Sebaran dari sepuluh variabel pada kelima jenis disajikan pada Gambar 6.
Gambar 6 Deskripsi morfologi daun karakter dimensi dan variabel yang diamati pada kelima jenis,(a) panjang lamina, (b) lebar daun terlebar, (c) panjang tangkai daun, (d) panjang lebar daun terlebar ke pangkal daun. Keterangan : (CO): C. ovatum, (GM): G. macrophyllus, (DB): D. borneensis, (PG): P. gutta dan (AMI): A. microcarpa.
a b
10
Karakter awal yang digunakan untuk pengelompokan sampel daun dilakukan dengan dengan karakter jumlah tulang daun, pangkal daun, ujung daun, panjang daun, lebar daun, lebar daun terlebar, luas daun dan keliling daun (Zein & Prawiradilaga 2013). Karakterisasi morfologi dapat digunakan untuk identifikasi pendugaan keragaman genetik (Rimoldi et al. 2010).
Hasil analisis menunjukkan bahwa perbedaan variabel yang diukur dari masing-masing daun kelima jenis secara nyata belum mampu mengklasifikasikan kelima jenis berdasarkan perbedaan. Variabel perimeter ratioof diameter pada jenis G. macrophyllus memiliki sebaran data yang luas yang dikategorikan keragaman tinggi. Pengukuran karakter dimensi yaitu variabel lebar daun terlebar menunjukkan bahwa D. borneensis memiliki sebaran data yang luas. Sebaran dari variabel yang diamati dan dihitung pada kelima jenis disajikan pada Gambar 7.
Gambar 7 Deskripsi morfologi daun karakter dimensi dan variabel yang diamati pada kelima jenis, (a) jumlah tulang daun, (b) luas daun, (c) aspect ratio, (d)
perimeter ratio of diameter, (e) form factor, (f) keliling daun. Keterangan : (CO): C. ovatum, (GM): G. macrophyllus, (DB): D. borneensis, (PG): P. gutta dan (AMI): A. microcarpa.
Hasil pengukuran jumlah tulang daun menunjukkan sebaran data A. microcarpa yang luas. P. gutta dan C. ovatum juga memiliki sebaran data yang luas berturut–turut pada variabel form factor dan panjang tangkai daun. Semakin kecil sebaran data akan memudahkan para pengenal pohon dalam mengidentifikasi jenis pada fase anakan. Karakterisasi sifat morfologi merupakan cara determinasi yang sering digunakan untuk klasifikasi taksonomi tanaman (Li
et al. 2009). Identifikasi secara morfologi memiliki keterbatasan yaitu hanya dapat mengidentifikasi ketika spesimen dalam bentuk lengkap (daun, bunga, buah dan
a b
c d
11 akar) (Godfray 2002). Hartati et al. (2007) menyatakan bahwa proses evolusi dan adaptasi suatu populasi pada lingkungan spesifik yang merupakan habitatnya akan menyebabkan masing-masing populasi mengembangkan karakter dan ciri spesifik secara morfologis dan genetik yang berbeda dengan populasi lainnya.
Identifikasi Jenis menggunakan Penanda Molekular
Hasil Amplifikasi dan Sequencing
Gen ITS2, rbcL dan matK berhasil diamplifikasi dengan kualitas yang baik. Pada beberapa sampel baik dari REKI maupun dari KRB sebagai referensi dilakukan optimasi suhu. Suhu optimum annealing yang disarankan Stoeckle et al.
(2011) untuk rbcL, matK dan ITS adalah 56 oC, 52 oC dan 55 oC. Hasil terbaik dari optimasi suhu berturut-turut adalah 55 oC, 52 oC dan 56 oC menunjukkan pita yang jelas sehingga dapat dilanjutkan untuk proses sequencing. Primer ITS1
menunjukkan bahwa DNA yang dihasilkan kurang baik karena tidak adanya pita. Ketidakmunculan pita amplifikasi pada beberapa sampel diduga karena urutan basa nukleotida dari primer tersebut bukan merupakan komplemen dari basa nukleotida pada cetakan DNA (Chen et al. 2010).
Analisis DNA dan Komposisi Basa Nukleotida
Teknik DNA barcoding dapat digunakan untuk identifikasi suatu organisme walaupun DNA dari organisme tersebut tidak dalam bentuk murni atau utuh, bahkan DNA yang sudah mengalami degradasi dan proses pengolahan pun dapat digunakan untuk analisis DNA barcoding (Hajibabaei2006). Hasil sequence alignment pada penelitian ini digunakan untuk melihat evolusi dari nenek moyang yang sama (common ancestor) dari lima jenis yang diteliti (Brinkman & Leipe 2001). Ukuran wilayah (region) rbcL, matK dan ITS2 berturut-turut adalah berkisar 879 bp, 709 bp dan 400 bp (Tabel 5). Secara detail, data sekuen masing-masing penanda disajikan pada Lampiran 3, 4 dan 5.
Tabel 5 Panjang sekuen basa (bp) pada ketiga penanda genetik
12
Tabel 5 diketahui bahwa penanda ITS2 memiliki rata-rata panjang sekuen lebih kecil dibanding kedua penanda lainnya. Penanda rbcL memiliki panjang sekuen basa paling besar diantara penanda lainnya. Analisis yang dilakukan setelah penyejajaran sekuen adalah perhitungan perbedaan basa antara keempat anggota genus. Perbedaan panjang sekuen bermanfaat sebagai identifikasi awal perbedaan spesies (Dick & Kress 2009).
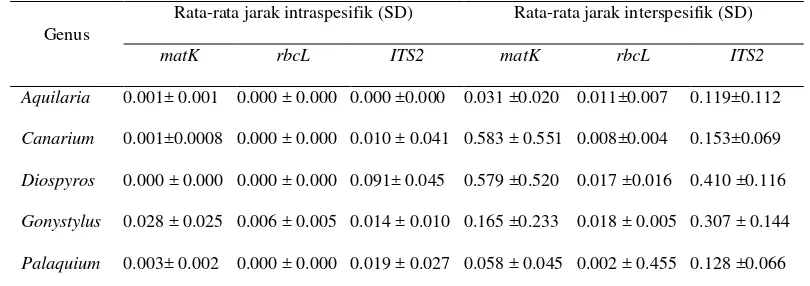
Barcoding Gap
Idealnya adanya gap adalah celah barcode (yaitu divergensi interspesifik yang jelas lebih besar dari variasi intraspesifik) akan muncul. Tabel 6 menunjukkan bahwa nilai rata-rata jarak interspesifik lebih besar dari intraspesifik (Kress et al. 2005). Lokus ITS2 memiliki nilai rata-rata jarak intra maupun interspesifik lebih besar dari kedua lokus lainnya (Tabel 6). Hal ini dimungkinkan data sekuen yang didapatkan sedikit, sehingga tidak dapat membedakan secara signifikan.
Pada total sekuen penelitian ini terdapat gap berupa garis putus-putus yang dapat disebabkan variasi karena adanya insersi atau delesi. Perbedaan sekuen harus diperkirakan dengan model evolusi yang sesuai pada level variasi itu (K2P :
Kimura Two Parameter). Jarak genetik lebih efektif untuk barcoding
menggunakan model Kimura-2-parameter (K2P) karena mempertimbangkan tingkat substitusi transisi dan transversi. Variasi intra dan interspesifik harus dibandingkan tergantung pada lokus gen barcode yang dipilih (Tamura et al. 2011).
Tabel 6 Nilai rata-rata jarak intraspesifik dan interspesifik dihitung menggunakan model K2P
Genus
Rata-rata jarak intraspesifik (SD) Rata-rata jarak interspesifik (SD)
matK rbcL ITS2 matK rbcL ITS2
Aquilaria 0.001± 0.001 0.000 ± 0.000 0.000 ±0.000 0.031 ±0.020 0.011±0.007 0.119±0.112
Canarium 0.001±0.0008 0.000 ± 0.000 0.010 ± 0.041 0.583 ± 0.551 0.008±0.004 0.153±0.069
Diospyros 0.000 ± 0.000 0.000 ± 0.000 0.091± 0.045 0.579 ±0.520 0.017 ±0.016 0.410 ±0.116
Gonystylus 0.028 ± 0.025 0.006 ± 0.005 0.014 ± 0.010 0.165 ±0.233 0.018 ± 0.005 0.307 ± 0.144
Palaquium 0.003± 0.002 0.000 ± 0.000 0.019 ± 0.027 0.058 ± 0.045 0.002 ± 0.455 0.128 ±0.066
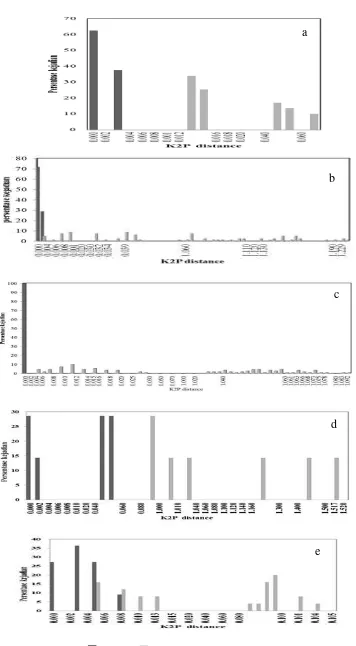
Hasil analisis dengan menghitung jarak intra maupun inter, terlihat gap pada beberapa sampel dengan menggunakan ketiga lokus gen barcode (Gambar 8, 9 dan 10). Hasil barcode matK menunjukkan adanya gap yaitu pada genus
Gonystylus, Diospyros dan Aquilaria (Gambar 8). Barcode pada rbcL terlihat adanya gap yaitu pada genus Aquilaria, Canarium, Diospyros dan Palaquium
13
Gambar 8 Distribusi intra dan interspesifik kimura 2-parameter (K2P) pada lokus
matK (a) Aquilaria; (b) Canarium; (c) Diospyros; (d) Gonystylus dan (e)
Palaquium.
a
b
d
14
Gambar 9 Distribusi intra dan interspesifik kimura 2-parameter (K2P) pada lokus
rbcL (a) Aquilaria; (b) Canarium; (c) Diospyros; (d) Gonystylus dan (e)
Palaquium.
a
b
c
15
Gambar 10 Distribusi intra dan interspesifik kimura 2-parameter (K2P) pada lokus ITS2 (a) Aquilaria; (b) Canarium; (c) Diospyros; (d) Gonystylus dan (e) Palaquium.
a
d
e b
16
Hasil analisis barcoding gap diketahui bahwa variasi interspesifik barcode rbcL dan matK memiliki kemampuan pembeda yang lebih baik untuk identifikasi sampel dalam penelitian ini dapat terlihat dari adanya gap. Semakin banyak terjadi tumpang tindih antara interspesifik dengan intraspesifik maka lokus
barcode yang dipilih kurang efektif menjadi calon barcode (Liu et al. 2011). Karena syarat gen dapat menjadi barcode yaitu DNA harus memiliki variasi intraspesies yang lebih kecil dari variasi interspesies. DNA harus standar sehingga dengan daerah DNA yang sama dan dapat digunakan sebanyak mungkin untuk taksa yang berbeda. Daerah DNA target mempunyai informasi filogeni sehingga memudahkan taksa tersebut dalam pengelompokannya. Kemudian gen tersebut sebaiknya mempunyai tingkat amplifikasi yang tinggi serta ukurannya pendek sehingga dapat digunakan untuk menguji DNA yang sudah terpotong atau rusak (Herbert et al. 2003; Meyer dan Paulay 2005)
.
Analisis Filogenetik
Tingkat kesamaan (homologi) yang diperoleh dari analisis BLAST memiliki hasil yang bervariasi untuk masing-masing jenis (70-90%). Kelima jenis (nama latin sudah accepted pada daftar Plant List (http://www.theplantlist.org)) belum tersedia data sekuen secara lengkap pada pangkalan data GenBank maupun pada BOLD System, terutama di daerah tropika dimana masih sedikit penelitian DNA barcode sebagai referensi. Berdasarkan hasil analisis barcode
ditemukan adanya perbedaan dengan hasil identifikasi karakteristik morfologi pada beberapa sampel (Tabel 7). Hasil identifikasi jenis oleh pakar botani di LIPI dengan mencocokkan daun dengan koleksi herbarium disajikan pada Lampiran 6. Secara detail, data informasi nomor acession GenBank disajikan pada Lampiran 7. Filogenetik dari masing-masing genus seperti disajikan pada Gambar 11, 12 dan 13.
Tabel 7 Akurasi identifikasi tiga penanda menggunakan BLAST
17
Gambar 11 Pohon filogeni lokus rbcL pada Genus (a) Aquilaria; (b) Canarium; (c)
Diospyros; (d) Gonystylus dan (e) Palaquium berdasarkan metoda Neighbor-Joining (NJ) tree. JAMBI: sampel lapangan yang digunakan dari REKI, KRB: sampel koleksi jenis dari Kebun Raya Bogor, GB: GenBank dan OG: Out group.
e
c a
b
18
Gambar 12 Pohon filogeni lokus matK pada Genus (a) Aquilaria; (b) Canarium; (c)
Diospyros; (d) Gonystylus dan (e) Palaquium berdasarkan metoda Neighbor-Joining (NJ) tree. JAMBI: sampel lapangan yang digunakan dari REKI, KRB: sampel koleksi jenis dari Kebun Raya Bogor, GB: GenBank dan OG: Out group.
a
b
c
d
19
Gambar 13 Contoh pohon filogeni lokus ITS2 pada Genus (a) Aquilaria; (b) Canarium; (c) Diospyros; (d) Gonystylus dan (e) Palaquium berdasarkan metoda Neighbor-Joining (NJ) tree. JAMBI: sampel lapangan yang digunakan dari REKI, KRB: sampel koleksi jenis dari Kebun Raya Bogor, GB: GenBank dan OG: Out group.
a
b
c
d
20
Sampel anakan yang sebelumnya diduga jenis G. macrophyllus
berdasarkan penanda ITS2 ternyata memiliki nilai homologi 80% dengan
Thymelaea microphylla setelah dilakukan analisis barcode. Sama halnya dengan anakan yang sebelumnya diduga C. ovatum memiliki homologi sebesar 82% dengan Santiria griffithii. D. borneensis memiliki hubungan kekerabatan yang dekat dengan Carissa carandas setelah dilakukan analisis BLAST dengan penanda ITS2. Hal ini dimungkinkan menjadi salah satu sebab kekeliruan identifikasi morfologi terutama pada fase anakan karena kedua spesies termasuk dalam famili yang sama (Godfray 2002).
Kehandalan teknik DNA barcoding untuk mendeskriminasi jenis dapat juga dilihat dengan analisis filogenetik bersama sekuen dari satu family yang berkerabat dekat dan diperlukan sekuen out group sebagai pembanding dalam menentukan spesies (Herbert et al. 2003). Spesies out group diperoleh dari gene bank dengan memilih taksa yang paling jauh dengan jenis yang dieteliti.
Gambar 11, 12 dan 13 menunjukkan bahwa kelompok antar genus dengan nilai bootstrap melebihi 40 hingga 100 terhadap tingkat kesamaan jenis yang tinggi dengan database yang ada. Jarak genetik terkecil pada penanda matK
adalah 0,000 yang dapat membedakan A. microcarpa dan G. macrophyllus. Pada lokus barcoderbcL jarak genetik terkecil adalah 0,00 terlihat dari filogenetik yang dapat membedakanA.microcarpa dan C. ovatum. Dari hasil yang didapat tersebut mengindikasikan bahwa penanda matK dan rbcL efektif untuk membedakan jenis dengan baik karena nilai jarak genetik yang kurang dari 0,05 banyak ditemukan. Penanda ITS2 nilai jarak genetik bervariasi dan banyak ditemukan nilai jarak genetik lebih dari 0,05. Perbedaan nukleotida dan jarak genetik antar spesies membuktikan bahwa spesies yang semula diidentifikasi berdasarkan morfologi saja masih mungkin terdapat kesalahan(Campbell et al. 2003).
Akurasi hasil morfologi dengan hasil barcode menggunakan lokus rbcL dan
matK dapat membedakan sampel pada tingkat spesies dan genus. Lemahnya kemampuan diskriminasi barcode rbcL telah ditunjukkan oleh beberapa publikasi sebelumnya (Hollingsworth et al. 2009). Namun, barcode rbcL memiliki tingkat keberhasilan amplifikasi yang tinggi untuk banyak spesies dan mudah disekuensing. Kelemahan matK adalah sulit diamplifikasi tetapi akurasi dalam membedakan spesies tinggi(Koch et al. 2008).
Taksonomi atau identifikasi serta informasi mengenai karakteristik biologis merupakan salah satu dasar penting dari aktifitas konservasi atau restorasi spesies. Pelaksanaan konservasi bertujuan agar biodiversitas tidak mengalami kerusakan yang mengakibatkan rusaknya suatu ekosistem ataupun punahnaya suatu spesies.
21 SIMPULAN
Hasil barcoding gap menunjukkan bahwa pada tiga lokus nilai rata-rata jarak interspesifik lebih besar dari intraspesifik. Lokus gen barcode matK dan
rbcL bisa menjadi calon barcode yang baik dalam membedakan jenis pada penelitian ini. Aplikasi barcode rbcL dan matK mampu membedakan kelima jenis yaitu pada tingkat spesies dan genus. Penanda ITS2 pada kelima jenis tanaman langka menghasilkan akurasi pada tingkatan genus dan family. Oleh karena itu, diharapkan hasil penelitian ini mampu mengisi kekosongan daftar sekuen pada NCBI dan dapat dijadikan database dasar dalam usaha konservasi.
DAFTAR PUSTAKA
Anwar A. 2015. Variasi morfologi daun dan sekuens ITS2 pada Jelutung Darat (Dyera costulata (Miq.)Hook.f) dan Jelutung Rawa (Dyera polyphylla
(Miq.) Steenis) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Aritonang KV, Siregar IZ, Yunanto T. 2007. Manual Analisis Genetik Tanaman Hutan di Laboratorium Silvikultur Fakultas Kehutanan Institut Pertanian Bogor. Bogor (ID): Fakultas Kehutanan IPB.
Aththorick, T.A, Siregar E.S. 2006. Taksonomi Tumbuhan. Medan (ID): Departemen Biologi FMIPA USU.
Bagali PG, Prabhu PDAH, Raghaedra K, Hittalmani S, Vadivelu JS. 2010. Application of Molecular Markers in Plant Tissue Culture. Asia-Pacific Journal of Molecular Biology and Biotechnology 18 (1): 85-87.
Brinkman F, Leipe D. 2001. Phylogenetic Analysis. In : Baxevanis AD, Oulette BFF. (eds). A Practical Guide to the Analysis of Gene and Protein.
Bioinformatics. P: 323-358.
Campbell NA, Reece JB, Mitchell LG. 2003. Biologi Jilid 2 Edisi 5. Jakarta (ID): Erlangga.
Chen S, Yao H, Han J, Liu C, Song J, Shi L, Zhu Y, Ma X, Gao T, Pang X, et al.
2010. Validation of the ITS2 region as a novel DNA barcode for identifying medicinal plant species. J Plos One. 5(1):1-8. doi:10.1371/journal.pone. 0008613.
Dick C W, Kress WJ. 2009. Dissecting tropical plant diversity with forest plots and a molecular toolkit. Bioscience. 59:745-755.
Ellis B, Douglas CD, Leo JH, Kirk RJ, John DM, Peter W, Scott LW. 2009.
Manual of Leaf Architecture. United States of Amerika (US): Cornell University.
Godfray J. 2002. Challenges for taxonomy. Nature. 417:17-18.
Gomes EA, Kasaya MC, deBarros EG, Borgs AC, Araujo EF. 2002. Polymorphism in the internal transcribed spacer (ITS) of the ribosomal DNA of 26 isolates of ectomycorrhizal fungi. Genet Mol Biol. 25(4): 477-483.
22
Hartati D, Rimbawanto A, Taryono, Sulistyaningsih, Widyatmoko. 2007. Pendugaan keragaman genetic di dalam dan antar provenan Pulai (Alstonia scholaris (L.) R. Br.) menggunakan penanda RAPD. Jurnal Pemuliaan Tanaman Hutan 2 : 89-98
Herbert PDN, Cywinska A, Ball SL. 2003. Biological identifications through DNA barcodes. SoCL and B Bio. 270: 313-321.
Hollingsworth PM, Forrest LL, Spouge JL, Hajibabaei M, Ratnasingham R. 2009. A DNA barcode for land plants. Proc Natl Acad Sci. 106: 12794-12797. Hollingsworth PM, Graham SW, Little DP. 2011. Choosing and using a plant
DNA barcode. Plos One. 5(6): e19254.
IUCN. 2009. IUCN Red List of Threatened Species: Version 2009 (2) [Int ernet].[diunduh 2014 Juni 02]. Tersedia pada: http:www.iucnredlist.org. Kumar S, Nei M, Dudley J, Tamura K. 2008. MEGA: a biologistcentric software
for evolutionary analysis of DNA and protein sequences. Brief Bioinform. 9:299–306.
Koch MA, Calonje M, Gong W. 2008. Non-Coding Nuclear DNA Markers In Phylogenetics Reconstrucion. Plant Syst Evol. 282:257-280.
Kremer A, Dupouey JL, Deans JD, Cottrell J, Csaikl U, Finkeldey R, Espinel S, Jensen J, Kleinschmit J, Dam BV et al. 2001. Leaf morphological differentiation between Quercus robur and Quercus petraeais stable across western European mixed oak stands. J For Sci. 59:777–787.
Kress WJ, Wurdack KJ, Zimmer EA. 2005. Use of DNA barcodes to identify flowering plants. Proc Natl Acad Sci. 102: 8369–8374.
Kress WJ, Erickson DL. 2007. A two-locus global DNA barcode for land plants: the coding rbcL gene complements the non-coding trnH-psbA spacer region.
PLos One 2:e508. doi: 10.1371/journal.pone.0000508.
Lahaye R, Van der Bank M, Bogarin D, Warner J, Pupulin F, Gigot G, Maurin O, Duthoit S, Barraclough TG, Savolainen V. 2008. DNA barcoding the floras of biodiversity hotspots. Proc Nat Acad Sci. 105(8): 2923-2928.
Liu J, Moller M, Gao LM, Zhang DQ, Li DJ. 2011. DNA barcoding for the discrimination of Eurisian yews (Taxus L. Taxaceae) and discovery of cryptic species. Molecular Biology Resources. doi: 10.1111/j.1755-0998.2010.02907.
Li P, Yunwen P, Sun X, Han J. 2009. Using microsatellite (SSR) and morphological markers to assess the genetic diversity of 12 falcata (Medicagosativa spp. falcata) population from Eurasia. J Biotechnol. 8(10): 2102-2108.
Mansfield MA, Kang S. 2008. Molecular Identification of Phytophthora Isolates Using a DNA Sequence Based Approach. USA: Penn State University. Meyer CP, Paulay G. 2005. DNA barcoding: error rate based on comprehensive
sampling. PLoS Biol 3:2229 –2238.
Minitab Inc. 2007. Meet Minitab 15 for Windows. USA (US): Minitab Inc
Nei M, Kumar S. 2000. Molecular evolution and phylogenetics. New York: Oxford Univ Pr.
23 Schmeller S, Bauch B, Gruber B, Juskaitis R, Budrys E, Babij V, Lanno K, Sammul M, Varga Z, Henle K. 2008. Determination of conservation priorities in region with multiple political jurisdictions. Biodiversity Conservation. 17: 3623- 3630.
Suharsono, Utut W. 2012. Penuntun Praktikum Pelatihan Teknik Dasar Pengklonan Gen. Bogor (ID): Pusat Penelitian Sumberdaya Hayati dan Bioteknologi Institut Pertanian Bogor.
Sun Y, Skinner DZ, Liang GH, Hulbert SH. 1994. Phylogenetic analysis of sorghum and related taxa using Internal Transcribed Spacers of nuclear ribosomal DNA. Theor Appl Gen. 89:26-32.
Soltis PS, Soltis DE, Doyle JJ. 1998. Molecular Systematics of Plants. New York: International Thomson Puslishing.
Stoeckle MY, Gamble CC, Kirpekar R, Young G, Ahmed S, Little DP. 2011. Commercial teas highlight plant DNA barcode identification successes and obstacles. Sci Rep. 1(42): 1-7.
Suyitno, A.L.2004. Penyiapan Specimen Awetan Objek Biologi. Yokyakarta(ID): Jurusan Biologi FMIPA UNY.
Soberon J, Medellin RA. 2007. Categorization System of Threatened Species,
Conservation Biology. 21(5): 1366-1367.
Randi E, Lucchini V. 1998. Organization and evolution of the mitochondrial DNA control region in the avian genus Alectoris. Journal of Molecular Evolution.
47, 449-462
Tamura K, Dudley J, Nei M, Kumar S. 2011. MEGA4: Molecular evolutionary Genetics analysis (MEGA) Software version 4.0. Mol Biol Evol. 24:1596-1599.
Tamura K, Stecher G, Peterson D, Filipski A, and Kumar S. 2013. MEGA6: Molecular Evolutionary Genetics Analysis Version 6.0. Mol Biol Evol. 30: 2725-2729.
Tudge C. 2000. The Variety Of Life. New York: Oxford University Press.
Valentini A, Pompanon F, Taberlet P. 2009. DNA Barcoding for Ecologists.
Trends in Ecology and Evolution. (24)2:110-117.
Weising K, Nybon H, Wolff K, Kahl G. 2005. DNA Fingerprinting in Plants: Principles, Methods, and Aplications. Amerika Serikat (US): CRC Press Taylor & Francis Group.
Xue CY, Li DZ. 2011. Use of DNA barcode sensu lato to identify traditional Tibetan medicinal plant Gentianopsis paludosa (Gentianaceae). J Sys Evol.
49(3): 267-270.
27 Lampiran 1 Dokumentasi morfologi daun
Dokumentasi morfologi daun, A: Gonystilus macrophyllus; B: Palaquium gutta;
C: Aquilaria microcarpa; D: Canarium ovatum dan E: Diospyros borneensis.
a
b
c
d
28
Lampiran 2 Dokumentasi pengukuran morfologi daun
29 Lampiran 3 Hasil pengurutan basa nukleotida (sequencing) pada lokus rbcL
#AM 1-2 (JAMBI)
GAAACCAAAGATACTGATATCTTGGCAGCATTCCGAGTAACTCCTCACCTGGAGTTCC GCCTGAGGAAGCAGGGGCTGCGGTAGCTGCTGAATCTTCTACTGGTACATGGACAAC TGTGTGGACCGACGGGCTT---
#Aquilaria beccariana (Kebun Raya Bogor)
TCCCCCCTCAACAGAGATAAAGCAAGTGTTGGATTCAAAGCTGGTGTTAAAGAGTAT
# Aquilariamalaccensis (Kebun Raya Bogor)
TTCCAACGCATAAATGGTTGGGAGTTCACATTCTCATCATCTTTGGTAAAATCAAGTC CACCACGTAGACATTCATAAACCGCTCTACCGTAGTTTTTAGCGGATAACCCCAATTT AGGTTTAATAGTACATCCCAA---
#Aquilariasinensis gi874512062 (GenBank)
AAAGCTGGTGTTAAAGAGTATAAATTGACTTATTATACTCCTGAATATGAAACCAAAG ATACTGATATCTTGGCAGCATTCCGAGTAACTCCTCAACCTGGAGTTCCGCCTGAGGA AGCAGGGGCTGCGGTAGCTG---
# Aquilaria yunnanensis gi874512064 (GenBank)
AGAGTATAAATTGACTTATTATACTCCTGAATATGAAACCAAAGATACTGATATCTTG GCAGCATTCCGAGTAACTCCTCAACCTGGAGTTCCGCCTGAGGAAGCAGGGGCTGCG GTAGCTGCTGAATCTTCTACTG---
# Aquilaria beccariana gi2654348 (GenBank)
AAAGAGTACAAATTGACTTATTATACTCCTGAATATGAAACCAAAGATACTGATATCT TGGCAGCATTCCGAGTAACTCCTCAACCTGGAGTTCCGCCTGAGGAAGCAGGGGCTG CGGTAGCTGCTGAATCTTCTACT---
# Aquilaria malaccensis gi747154682 (GenBank)
GATTCAAAGCTGGTGTTAGAGAGTATAAATTGACTTATTATACTCCTGAATATGAAAC CAAAGATACTGATATCTTGGCAGCATTCCGAGTAACTCCTCAACCTGGAGTTCCGCCT GAGGAAGCAGG---
# Gonystilus macrophyllus gi2654350 (Out Group)
AAGTGTTGGATTCAAAGCTGGTGTTAAAGAGTATAAATTGACTTATTATACTCCTGAA TATGAAACCAAAGATACTGATATCTTGGCAGCATTCCGAGTAACTCCTCAACCTGGAG TTCCACCTGAGGAAGCAG---
# Gonystilusconfusus gi667480351 (Out Group)
30
#Canarium acutifolium (Kebun Raya Bogor)
CCCCCCCAACAGAGACTAAAGCAAGTGTTGGATTCAAAGCCGGTTGTTAAAGAGTAT
#Canarium littorale rbcL (Kebun Raya Bogor)
AAACAGAGACTAAAGCAAGTGTTGGATTCAAAGCCGGTGTTAAAGACTATAAATTGA CTTATTATACTCCTGACTATGTAACCAAAGATACTGATATCTTGGCAGCATTCCGAGT AACTCCTCAACCCGGAGTTCCACCCGAGGAAGCGGGGGCCGCGGTAGCTGCGGAATC TTCTACTGGTACATGGACAACTGTGTGGACCGATGGGCTTACC---
#Canarium acutifolium rbcL gi354619980(GenBank)
GAGTATAAATTGACTTATTATACTCCTGAATATCCAACAAAAGATACTGATATCTTGG CAGCATTCCGAGTAACTCCTCAACCCGGAGTTCCACCCGAGGAAGCGGGGGCCGCGG TAGCTGCGGAATCTTCTACTGGTACATGGACAACTGTGTGGACCGATGGGCTTACCAG CCTTGATCGTTACAAAGGACGATGCTACAACATCGAGCCCGTTGCTGGAGAAGAAAA TCAATATATATGTTATGTAGCTTACCCTTTAGACCTTTTTGA---
#Canarium acutifolium rbcL gi354619400 (GenBank)
GAGTATAAATTGACTTATTATACTCCTGAATATCCAACAAAAGATACTGATATCTTGG CAGCATTCCGAGTAACTCCTCAACCCGGAGTTCCACCCGAGGAAGCGGGGGCCGCGG TAGCTGCGGAATCTTCTACTGGTACATGGACAGCTGTGTGGACCGATGGGCTTACCAG CCTTGATCGTTACAAAGGACGATGCTACAACATCGAG---
#Canarium acutifolium rbcL gi354618808 (GenBank)
GAGTATAAATTGACTTATTATACTCCTGAATATCCAACAAAAGATACTGATATCTTGG CAGCATTCCGAGTAACTCCTCAACCCGGAGTTCCACCCGAGGAAGCGGGGGCCGCGG TAGCTGCGGAATCTTCTACTGGTACATGGACAGCTGTGTGGACCGATGGGCTTACCAG CCTTGATCGTTACAAAGGACGATGCTACAACATCGAGCC---
#Canarium pulchrebracteatum rbcL gi938507043 (GenBank)
ACAAAAGATACTGATATCTTGGCAGCATTCCGAGTAACTCCTCAACCCGGAGTTCCAC CCGAGGAAGCGGGGGCCGCGGTAGCTGCGGAATCTTCTACTGGTACATGGACAACTG TGTGGACCGATGGGCTTACCAGCCTTGATCGTTACAAAGGACGATGCTACAACATCGA GCCCGTTGCTGGAGAAGAAAATCAATATATATGTTATGTAGC---
#Canarium pulchrebracteatum rbcL gi938507041 (GenBank)
ACAAAAGATACTGATATCTTGGCAGCATTCCGAGTAACTCCTCAACCCGGAGTTCCAC CCGAGGAAGCGGGGGCCGCGGTAGCTGCGGAATCTTCTACTGGTACATGGACAACTG TGTGGACCGATGGGCTTACCAGCCTTGATCGTTACAAAGGACGATGCTACAACATCGA GCCCGTTGCTGGAGAAGAAAATCAATATATATGTTATGTA---
#Canarium ovatum rbcL gi938507029 (GenBank)
31
#Canarium multiflorum rbcL gi938507027 (GenBank)
ACAAAAGATACTGATATCTTGGCAGCATTCCGAGTAACTCCTCAACCCGGAGTTCCAC CCGAGGAAGCGGGGGCCGCGGTAGCTGCGGAATCTTCTACTGGTACATGGACAACTG TGTGGACCGATGGGCTTACCAGCCTTGATCGTTACAAAGGACGATGCTACAACATCGA GCCCGTTGCTGGAGAAGAAAATCAATATATATGTTATGTAGCTTA---
#Canarium multiflorum rbcL gi938507021 (GenBank)
ACAAAAGATACTGATATCTTGGCAGCATTCCGAGTAACTCCTCAACCCGGAGTTCCAC CCGAGGAAGCGGGGGCCGCGGTAGCTGCGGAATCTTCTACTGGTACATGGACAACTG TGTGGACCGATGGGCTTACCAGCCTTGATCGTTACAAAGGACGATGCTACAACATCGA GCCCGTTGCTGGAGAAGAAAATCAATATATATGTTATGTAGCTTACCCTTTAGACCTT TTTGAAGAAGGTTCTGTTACTAACATGTTTACTTCC---
#Canarium acutifolium rbcL gi874512349 (GenBank)
GAGTATAAATTGACTTATTATACTCCTGAATATCCAACAAAAGATACTGATATCTTGG CAGCATTCCGAGTAACTCCTCAACCCGGAGTTCCACCCGAGGAAGCGGGGGCCGCGG TAGCTGCGGAATCTTCTACTGGTACATGGACAACTGTGTGGACCGATGGGCTTACCAG CCTTGATCGTTACAAAGGACGATGCTACAACATCGAGCCCGTTGCT---
#Canarium subulatum rbcL gi874512346 (GenBank)
ACTTATTATACTCCTGAATATCCAACAAAAGATACTGATATCTTGGCAGCATTCCGAG TAACTCCGCAACCCGGAGTTCCACCCGAGGAAGCGGGGGCCGCGGTAGCTGCGGAAT CTTCTACTGGTACATGGACAACTGTGTGGACCGATGGGCTTACCAGCCTTGATCGTTA CAAAGGACGATGCTACAACATCGAGCCCGTTGCTGGAGAAGAAAATCAATATA---
#Canarium subulatum rbcL gi874512340 (GenBank)
AATTGACTTATTATACTCCTGAATATCCAACAAAAGATACTGATATCTTGGCAGCATT CCGAGTAACTCCGCAACCCGGAGTTCCACCCGAGGAAGCGGGGGCCGCGGTAGCTGC GGAATCTTCTACTGGTACATGGACAACTGTGTGGACCGATGGGCTTACCAGCCTTGAT CGTTACAAAGGACGATGCTACAACATCGAGCCCGTTGCTGG---
#Canarium album rbcL gi874512324 (GenBank)
AAAGCCGGTGTTAAAGAGTATAAATTGACTTATTATACTCCTGAATATCCAACAAAAG ATACTGATATCTTGGCAGCATTCCGAGTAACTCCGCAACCCGGAGTTCCACCCGAGGA AGCGGGGGCCGCGGTAGCTGCGGAATCTTCTACTGGTACATGGAC---
#Canarium album rbcL gi874512322 (GenBank)
AAAGCCGGTGTTAAAGAGTATAAATTGACTTATTATACTCCTGAATATCCAACAAAAG ATACTGATATCTTGGCAGCATTCCGAGTAACTCCGCAACCCGGAGTTCCACCCGAGGA AGCGGGGGCCGCGGTAGCTGCGGAATCTTCTACTGGTACATGGACA---
#Canarium album rbcL gi874512326 (GenBank)
AAAGCCGGTGTTAAAGAGTATAAATTGACTTATTATACTCCTGAATATCCAACAAAAG ATACTGATATCTTGGCAGCATTCCGAGTAACTCCGCAACCCGGAGTTCCACCCGAGGA AGCGGGGGCCGCGGTAGCTGCGGAATCTTCTACTGGTACATGGACAACTGTGTGGAC CGATGGGCTTACCAGCCTTGATCGTTACAAAGGACGATGCTACAA---
#Canarium album rbcL gi657171897(GenBank)
GCAAGTGTTGGATTCAAAGCCGGTGTTAAAGAGTATAAATTGACTTATTATACTCCTG AATATCCAACAAAAGATACTGATATCTTGGCAGCATTCCGAGTAACTCCGCAACCCGG AGTTCCACCCGAGGAAGCGGGGGCCGCGGTAGCTGCGGAATCTTCT---
#Dacryodes nitens rbcl gi387768149 (Out Group)
32
#Diospyros borneensis_rbcL (JAMBI)
TGAAACCAAAGATACTGATATCTTGGCAGCATTCCGAGTAACTCCTCAACCTGGAGTT CCACCGGAAGAAGCAGGGGCCGCGGTAGCTGCCGAATCTTCTACTGGTACATGGACA ACTGTGTGGACCGATGGACTTACTAGTCTTGATCGTTACAAAGGGCGA---
#Diospyros celebica rbcL (Kebun Raya Bogor)
GGAGAAGAAAGTCAATTTATTGCTTATGTAGCTTATCCTTTAGACCTTTTTGAAGAAG GTTCTGTTACTAACATGTTTACTTCCATTGTGGGTAATGTATTTGGGTTCAAAGCCCTG CGCGCTCTACGTCTGGAAGATTTGCGAATCCCTACTTCGTATGTTAAAACTTTCCAAG GACCACCTCATGGTATCCAAGTTGAAAGAGATAAATTGAACAA---
#Diospyros blancoi rbcL (Kebun Raya Bogor)
GGAGAAGAAAGTCAATTTATTGCTTATGTAGCTTATCCTTTAGACCTTTTTGAAGAAG GTTCTGTTACTAACATGTTTACTTCCATTGTGGGTAATGTATTTGGGTTCAAAGCCCTG CGCGCTCTACGTCTGGAAGATTTGCGAATCCCTACTTCGTATGTTAAAACTTTCCAAG GACCACCTCATGGTATCCAAGTTGAAAGAGATAAATTGAACAAG---
#Diospyros buxifolia rbc (Kebun Raya Bogor)
GGAGAAGAAAATCAATATATTGCTTATGTAGCTTATCCTTTAGACCTTTTTGAAGAAG GTTCTGTTACTAACATGTTTACTTCCATTGTGGGTAATGTATTTGGGTTCAAAGCCCTG CGCGCTCTACGTCTGGAAGATTTGCGAATCCCTACTTCGTATGTTAAAACTTTCCAAG GACCACCTCATGGTATCCAAGTTGAAAGAGATAAATTGAACAAGTAT---
#Diospyros cauliflora rbcL (Kebun Raya Bogor)
GGAGAAGAAAATCAATATATTGCTTATGTAGCTTATCCTTTAGACCTTTTTGAAGAAG GTTCTGTTACTAACATGTTTACTTCCATTGTGGGTAATGTATTTGGGTTCAAAGCCCTG CGCGCTCTACGTCTGGAAGATTTGCGAATCCCTACTTCGTATGTTAAAAC---
#Diospyros andamanica rbcL (Kebun Raya Bogor)
GGAGAAGAAAATCAATATATTGCTTATGTAGCTTATCCTTTAGACCTTTTTGAAGAAG GTTCTGTTACTAACATGTTTACTTCCATTGTGGGTAATGTATTTGGGTTCAAAGCCCTG CGCGCTCTACGTCTGGAAGATTTGCGAATCCCTACTTCGTATGTTAAAACTTTCCAAG GACCACCTCATGGTATCCAAGTTGAAAGAGATAAATTGAACAAGTATGGTCGTCCCCT GTTGGGATGTACTATTAAACCGAAATTGGGGTTATCTGCTAAAAAC---
#Diospyros diepenhorstii rbcL (Kebun Raya Bogor)
GATATCTTGGCAGCATTCCGAGTAACTCCTCAACCTGGAGTTCCACCGGAAGAAGCAG GGGCCGCGGTAGCTCGCCGAATCTTCTACTCGGTACATGGACAACTCGTGTGGACCGA TGGACTTACTAGTCTTGATCGTTACAAAGGGCGATGCTACCACATCGAGCCCGTTGCT-GGAGAAGAAAATCAATATATTGCTTATGTAGCTTATCCTTTAGACCTTTTTGAAGAAG GTTCTGTTACTAACATGTTTACTTCCATTGTGGGTAATGTA---
#Diospyros frustescens rbcL (Kebun Raya Bogor)
GGAGAAGAAAGTCAATTTATTGCTTATGTAGCTTATCCTTTAGACCTTTTTGAAGAAG GTTCTGTTACTAACATGTTTACTTCCATTGTGGGTAATGTATTTGGGTTCAAAGCCCTG CGCGCTCTACGTCTGGAAGATTTGCGAATCCCTACTTCGTATGTTAAAACTTTCCAAG GACCACCTCATGGTATCCAAGTTGAAAGAGATAAATTGAACAAGTATGGTCGTCCCCT GTTGGGATGTACTATTAAACCGAAATTGGGGTTATCCGCTA---
#Diospyros macrophylla rbcL (Kebun Raya Bogor)
33
#Diospyros maritima rbcL (Kebun Raya Bogor)
GGAGAAGAAACTCAATTTATTGCTTATGTAGCTTATCCTTTAGACCTTTTTGAAGAAG GTTCTGTTACTAACATGTTTACTTCCATTGTGGGTAATGTATTTGGGTTCAAAGCCCTG CGCGCTCTACGTCTGGAAGATTTGCGAATCCCTACTTCGTATGTTAAAACTTTCCAAG GACCACCTCATGGTATCCAAGTTGAAAGAGATAAA ---
#Diospyros malabarica rbcL (Kebun Raya Bogor)
GTGTGGACCGATGGACTTACTAGTCTTGATCGTTACAAAGGGCGATGCTACCACATCG AGCCCGTTGCTGGAGAAGAAAATCAATATATTGCTTATGTAGCTTATCCTTTAGACCT TTTTGAAGAAGGTTCCGTTACTAACATGTTTACTTCCATTGTGGGTAATGTATTTGGGT TCAAAGCCCTGCGCGCTCTACGTCTGGAAGATT ---
#Diospyros malabarica rbcL gi221078474 (GenBank)
GTGTGGACCGATGGACTTACTAGTCTTGATCGTTACAAAGGGCGATGCTACCACATCG AGCCCGTTGCTGGAGAAGAAAATCAATATATTGCTTATGTAGCTTATCCTTTAGACCT TTTTGAAGAAGGTTCCGTTACTAACATGTTTACTTCCATTGTGGGTAATGTATTTGGGT TCAAAGCCCTGCGCGCTCTACGTCTGGAAGATTTGCGAATCCCTT---
#Diospyros sumatrana rbcL gi221078568 (GenBank)
GGAGAAGAAAATCAATATATTGCTTATGTAGCTTATCCTTTAGACCTTTTTGAAGAAG GTTCTGTTACTAACATGTTTACTTCCATTGTGGGTAATGTATTTGGGTTCAAAGCCCTG CGCGCTCTACGTCTGGAAGATTTGCGAATCCCTACTTCGTATGTTAAAACTTTCCAAG GACCACCTCATGGTATCCAAGTTGAAAGAGATAAATT ---
#Diospyros rigida rbcL gi221078546 (GenBank)
GGAGAAGAAAATCAATATATTGCTTATGTAGCTTATCCTTTAGACCTTTTTGAAGAAG GTTCTGTTACTAACATGTTTACTTCCATTGTGGGTAATGTATTTGGGTTCAAAGCCCTG CGCGCTCTACGTCTGGAAGATTTGCGAATCCCTACTTCGTATGTTAAAACTTTCCAAG GACCACCTCATGGTATCCAAGTTGAAAGAGATAAATTG---
#Diospyros rhombifolia rbcL gi221078542 (GenBank)
GGAGAAGAAAGTCAATTTATTGCTTATGTAGCTTATCCTTTAGACCTTTTTGAAGAAG GTTCTGTTACTAACATGTTTACTTCCATTGTGGGTAATGTATTTGGGTTCAAAGCCCTG CGCGCTCTACGTCTGGAAGATTTGCGAATCCCTACTTCGTATGTTAAAACTTTCCAAG GACCACCTCA---
#Diospyros malabarica rbcL gi452090382 (GenBank)
ATTGACTTATTATACTCCTGAATATGAAACCAAAGATACTGATATCTTGGCAGCATTC CGAGTAACTCCTCAACCTGGAGTTCCACCGGAAGAAGCAGGGGCCGCGGTAGCTGCC GAATCTTCTACTGGTACATGGACAACTGTGTGGACCGATGGACTTACTAGTCTTGATC GTTACAAAGGGCGATGCTACCACATCGAGCCCGTTGCTGGAGAAGAAAAT---
#Diospyros buxifolia rbcL gi667480233 (GenBank)
AAGTGTTGGATTCAAAGCTGGTGTTAAAGATTACAAATTGACTTATTATACTCCTCAA TATGAAACCAAAGATACTGATATCTTGGCAGCATTCCGAGTAACTCCTCAACATGGAA TTCCACCGGAAGAAGCAGGGGCCGCGGTAGCTGCCGAATCTTCTACTGGTACATGGA CAACTGTGTGGACCGATGGACTTACTAGTCTTGATCGTTACAAAGG---
#Diospyros buxifolia rbcL gi221078376 (GenBank)
GTTGGATTCAAAGCTGGTGTTAAAGATTACAAATTGACTTATTATACTCCTCAATATG AAACCAAAGATACTGATATCTTGGCAGCATTCCGAGTAACTCCTCAACCTGGAGTTCC ACCGGAAGAAGCAGGGGCCGCGGTAGCTGCCGAATCTTCT---
#Diospyros rhombifolia rbcL gi325111645 (GB)
34
# Gonystylus macrophyllus (Kebun Raya Bogor)
AGCTGGTGTTAGAGAGTATAAATTGACTTATTATACTCCTGAATATGAAACCAAAGAT ACTGATATCTTGGCAGCATTCCGAGTAACTCCTCAACCTGGAGTTCCACCTGAGGAAG CAGGGGCCGCGGTAGCTGCTGAATCTTCTACTGGTACATGGACAAC---
#G. macrophyllus rbcL gi2654350 (GenBank)
AGCTGGTGTTAAAGAGTATAAATTGACTTATTATACTCCTGAATATGAAACCAAAGAT ACTGATATCTTGGCAGCATTCCGAGTAACTCCTCAACCTGGAGTTCCACCTGAGGAAG CAGGGGCCGCGGTAGCTGCTGAATCTTCTACTGGTACATGGACAACTGTGTGGACCGA CGGGCTTACCAGCCTTGATCGTTACAAAGGGCGATGCTACCACATCGAGCCCGTTGCT GGGGAAGAAAATCAATATATATGTTATGTAGCTTATCCCTTAGA---
#Aquilaria sinensis rbcL gi874512060 (Out Group)
AGCTGGTGTTAAAGAGTATAAATTGACTTATTATACTCCTGAATATGAAACCAAAGAT
#Palaquium amboinense rbcL (Kebun Raya Bogor)
ATGAAACCAAAGATACTGATATCTTGGCAGCATTCCGAGTAACTCCTCAACCTGGAGT TCCACCTGAAGAAGCAGGGGCCGCGGTAGCTGCCGAATCTTCTACTGGTACATGGAC AACTGTGTGGACCGATGGACTTACTAGCCTTGATCGTTA---
#Palaquium clarkeanum rbcL (Kebun Raya Bogor)
TGACTTATGAAACCAAAGATACTGATATCTTGGCAGCATTCCGAGTAACTCCTCAACC TGGAGTTCCACCCGAAGAAGCAGGGGCCGCGGTAGCTGCCGAATCTTCTACTGGTAC ATGGACAACTGTGTGGACCGATGGACTTACTAGCCTTGATCGTTACAAAGGGCGATGC TACCACATCGAGCCCGTTGCTGGAGAAGAAAATCAATATATTGCTTATGTAGCTTATC CTTTAGACCTTTTTGAAGAAGGTTCTGTTACTAATAT---
#Palaquium gutta rbcL (Kebun Raya Bogor)
ATGAAACCAAAGATACTGATATCTTGGCAGCATTCCGAGTAACTCCTCAACCTGGAGT TCCACCTGAAGAAGCAGGGGCCGCGGTAGCTGCCGAATCTTCTACTGGTACATGGAC AACTGTGTGGACCGATGGACTTACTAGCCTTGATCGTTACAAAGGGCGATGCTACCAC ATCGAGCCCGTTGCTGGAGAAGAAAATCAATATATTGCTTATGTAGCTTATCCTTTAG ACCTTTTTGAAGAAGGTTCTGTTACTAATATGTTTAC---
#Palaquium pseudocalophyllum rbcL (KRB)
35 Lampiran 4 Hasil pengurutan basa nukleotida (sequencing) pada lokus matK
#AM1-2 matK (JAMBI)
TCTCATATATGTGAGTGCGAATTCATTTTCCTTTTTTCTCCGTAACCAATCCTATCATTTACGA TCAACATCTTCTGCAATCTTTCTTGAACGGATCTATTTCTATGGAAAAATCGAACATCTTGTAG AAGTCTTTTCTAATGATTT---
# Aquilariabeccariana (Kebun Raya Bogor)
AAATCGGTCGATAATATCAGAATCTGATGAATCGACCCAAGTTGGCTTACTAATAGGA TGACACGATGCGTTACAAAAATTCGCTTTAGACAATGATCCAATCAGAGAAATCATTG GAATTTTTGTATCTAGCTTTTTAATAGTATTATCTATTAGAAAGA---
# Aquilariahirta (Kebun Raya Bogor)
AAATCGGTCGATAATATCAGAATCTGATGAATCGACCCAAGTTGGCTTACTAATAGGA TGACACGATGCGTTACAAAAATTCGCTTTAGACAATGATCCAATCAGAGAAATCATTG GAATTTTTGTATCTAGCTTTTTAATAGTATTATCTATTAGAAAGA---
# Aquilariamalaccensis (Kebun Raya Bogor)
AAATCGGTCGATAATATCAGAATCTGATGAATCGACCCAAGTTGGCTTACTAATAGGA TGACACGATGCGTTACAAAAATTCGCTTTAGACAATGATCCAATCAGAGAAATCATTG GAATTTTTGTATCTAGCTTTTTAATAGTATTATCTATTAGAA---
# Aquilariabeccariana gi222139026 (GenBank)
ACGGATCTATTTCTATGGAAAAATCGAACATCTTGTAGAAGTCTTTTCTAATGATTTTC AGAACAACCTATGCTTGTTCAAGGATCCCTTCATACATTTTGTTAGATATCAAGGAAA ATCTATTCTTGCTTCAAATGATACGCCTCTTCTGATGAATAAGTG---
# Aquilariamalaccensis gi747154750 (GenBank)
TATATGTGAGTGCGAATTAATTTTCCTTTTTCTCCGTAACCAATCCTATCATTTACGAT CAACATCTTCTGCAATCTTTCTTGAACGGATCTATTTCTATGGAAAAATCGAACATCTT GTAGAAGTTTTTTCTAATGATTTTCAGAACAACCTA---
# Aquilariasinensis gi756773611(GenBank)
CCTCTTTTTTGCATTTATTACGGTTTTTTTTCTACGAGTATTTGAATTTGAAGAGTCTTA TTACTTCAAAGAAATCCATTTCTATTTTGAATTTGAATCCAAGATTCTTTTTTTTCCTAT ATAATTCTCATATATGTGAGTGCGAATTAATTTTCCTTTTTCTCCGT---
# Aquilariasinensis gi331704493(GenBank)
TACCTCACCCCATCCATTTTGAAATCTTGGTTCAAGCCTTTCGCTGCTGGTTAAAAGAT GCCTCTTTTTTGCATTTATTACGGTTTTTTTTCTACGAGTATTTGAATTTGAAGAGTCTT ATTACTTCAAAGAAATCCATTTCTATTTTGAATTTGAATCCAAG---
#Gonystylus confusus gi672917617 (Out Group)
GAGTATTGTAATTTGAAGAGTCTTATTACTCCAAAGAAATCCATTTCTATTTTGAATCC AAAATTCTTCTTGTTCCTATATAATTCTCATATATGTGAATGCGAATTCATTTTCCTTTT TCTCCGTAACCAATCCTATCATTTACGATCAACATTTTCTGGA---
#Gonystylus confusus gi672917615 (Out Group)
36
Lampiran 5 Hasil pengurutan basa nukleotida (sequencing) pada lokus ITS2
#AM11_2__ITS 2 Jambi
#Aquilaria malaccensis (Kebun Raya Bogor)
AAGGAACTTTATGCGATACTTGGTGTGAATTGCAGAATCCGGTGGGTACTCGAGTTTT TGGACGCAAGTTGCGCCCCAAGCCTTTGGGCCGAGGGCACGTCTGCCTGGGTGTCACG CATTGTAGCCCCCCCACCCTCGTGGTAATGTCTGTGAGGGCTGTG---
#Aquilaria rugosa gi59939386 (GenBank)
AAGGAACTTAATGCGATACTTGGTGTGAATTGCAGAATCCCGTGAACCATCGAGTCTT TGAACGCAAGTTGCGCCCCAAGCCTTTGGGCCGAGGGCACGTCTGCCTGGGTGTCACG CATTGTAGCCCCCCCACCCTCGTGGTAATGTCTGTGAGGGCTGTG---
#Aquilaria yunnanensis gi150416598 (GenBank)
AAGGAACTTAATGCGATACTTGGTGTGAATTGCAGAATCCCGTGAACCATCGAGTCTT TGAACGCAAGTTGCGCCCCAAGCCTTTGGGCCGAGGGCACGTCTGCCTGGGTGTCACG CATTGTAGCCCCCCCACCCTCGTGGTAATGTCTGTGAGG---
#Aquilaria malaccensis gi747154894 (GenBank)
AAGGAACTTAATGCGATACTTGGTGTGAATTGCAGAATCCCGTGAACCATCGAGTCTT TGAACGCAAGTTGCGCCCCAAGCCTTTGGGCCGAGGGCACGTCTGCCTGGGTGTCACG CATTGTAGCCCCCCCACCCTCGTGGTAATGTCTGTGAGGGCTGTG---
#Aquilaria malaccensis gi747154914 (GenBank)
AAGGAACTTAATGCGATACTTGGTGTGAATTGCAGAATCCCGTGAACCATCGAGTCTT TGAACGCAAGTTGCGCCCCAAGCCTTTGGGCCGAGGGCACGTCTGCCTGGGTGTCACG CATTGTAGCCCCCCCACCCTCGTGGTAATGTCTGTGAGGGCT---
#Dirca palustris gi281485733 (Out Group)
AAGGAATTAAATGCGATACTTGGTGTGAATTGCAGAATCCCGTGAACCATCGAGTCTT TGAACGCAAGTTGCGCCCCAAGCCTTCGGGCCGAGGGCACGTCTGCCTGGGCGTCAC GCATCGTAGCCCTCCACCCAATGTGGCAATGTTCACAGGAGTTGTATG---
#Dirca palustris gi281485731 (Out Group)
AAGGAATTAAATGCGATACTTGGTGTGAATTGCAGAATCCCGTGAACCATCGAGTCTT TGAACGCAAGTTGCGCCCCAAGCCTTCGGGCCGAGGGCACGTCTGCCTGGGCGTCAC GCATCGTAGCCCTCCACCCAATGTGGCAATGTTCACAGGAGTTGTA---
#Dirca decipiens gi281485724 (Out Group)
38
BLAST Result Accession code (NCBI)
matK Aquilaria sinensis HQ415244.1
ITS2 Aquilaria
matK Canarium album KJ510921.1
ITS2 Canarium album JF421482.1
3 rbcL
ITS2 Carissa carandas HQ386688.1
39 RIWAYAT HIDUP
Penulis lahir di Medan, Sumatera Utara pada tanggal 14 Oktober 1990. Terlahir sebagai anak pertama dari tiga bersaudara di keluarga Ahmad Zaini dan Khadijah. Pada tahun 2008, penulis lulus dari SMA Negeri 12 Medan, dimana pada tahun yang sama lulus seleksi melanjutkan pendidikan sarjana di Universitas Negeri melalui jalur UMB-SPMB dan diterima di Jurusan Biologi. Studi ini
diselesaikan pada tahun 2012 dengan skripsi berjudul “Hubungan motivasi Belajar terhadap Hasil Belajar BiologiSiswa pada Materi Pokok Pencemaran Lingkungan di Kelas X” dibawah bimbingan Dr Ir Tri Harsono, MSi. Pada tahun 2013 penulis terdaftar sebagai mahasiswa Pascasarjana IPB program studi Silvikultur Tropika.
Saat masih mahasiswa, penulis juga aktif mengikuti berbagai pelatihan dan seminar nasional maupun internasional baik. Seminar yang diikuti adalah Seminar Nasional Silvikultur II tahun 2014 di Universitas Gadjah Mada Yogyakarta, pada International Conference on Bioscience tahun 2015 di International Convention Center Bogor sebagai. Penulis pernah terlibat dalam kegiatan penelitian, diantaranya: dan Practical Application of DNA Barcoding in Conservation of Endangered Tree Species (2014).
Guna memperoleh gelar Magister Sains IPB, penulis menyelesaikan tesis