PENAMBAHAN SELENIUM ORGANIK TERHADAP
KINERJA PERTUMBUHAN DAN STATUS KESEHATAN
IKAN LELE
Clarias
sp
HASRAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Penambahan Selenium Organik terhadap Kinerja Pertumbuhan dan Status Kesehatan Ikan Lele Clarias sp adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
HASRAH. Penambahan Selenium Organik terhadap Kinerja Pertumbuhan dan Status Kesehatan Ikan Lele Clarias sp. Dibimbing oleh MUHAMMAD AGUS SUPRAYUDI dan NUR BAMBANG PRIYO UTOMO.
Ikan lele Clarias sp merupakan salah satu jenis ikan air tawar cukup menjanjikan untuk dibudidayakan, karena kebutuhan konsumsi ikan yang meningkat setiap tahunnya. Salah satu langkah yang dapat dilakukan untuk memenuhi kebutuhan tersebut dengan melakukan intensifikasi budidaya. Intensifikasi budiaya ikan berkorelasi dengan kebutuhan pakan, karena pakan merupakan komponen biaya terbesar dari total biaya produksi. Peningkatan efisiensi pakan dalam rangka menekan biaya produksi dapat dilakukan dengan penambahan selenium organik. Selenium organik ditemukan menjadi bagian integral dari enzim antioksidan yakni glutation peroksidase yang dapat menghancurkan peroksida-peroksida yang terbentuk, sehingga diharapkan mampu meningkatkan kinerja pertumbuhan dan status kesehatan ikan Clarias sp.
Penelitian ini bertujuan untuk mengevaluasi pengaruh penambahan selenium organik terhadap kinerja pertumbuhan dan status kesehatan ikan lele. Penelitian ini terdiri dari empat perlakuan dan tiga ulangan yaitu dengan dosis 0, 1, 4 dan 8 g Se/kg pakan dengan kadar selenium pakan 0,30, 0,79, 2,26, dan 5,79 mg Se/kg. Ikan uji yang digunakan dengan bobot rata‒rata 5,97+0,06 g dipelihara dalam 12 bak beton bervolume 300 liter dengan kepadatan 150 ekor per bak selama 56 hari. Ikan diberi pakan 3% dari bobot tubuh sebanyak 3 kali sehari pada pukul 07.00, 14.00 dan 20.00 WIB. Parameter yang diamati terdiri dari biomassa ikan, laju pertumbuhan spesifik, tingkat kelangsungan hidup, jumlah konsumsi pakan, efisiensi pakan, retensi protein, retensi lemak, retensi selenium, dan keragaman ukuran ikan. Parameter biokimia darah terdiri dari kolesterol, trigliserida, HDL‒kolesterol dan LDL‒kolesterol, kadar selenium darah, prorein darah dan glukosa darah, serta parameter kesehatan seperti jumlah sel darah merah, jumlah sel darah putih, kadar hematokrit dan kadar hemoglobin.
Hasil penelitian menunjukkan bahwa penambahan selenium organik sebanyak 4 g Se/kg pakan dengan kadar selenium pakan 2,26 mg Se/kg pakan adalah perlakuan terbaik dengan total biomassa akhir 2569,7 g, efisiensi pakan 69,9%, retensi protein 34,8%, retensi lemak 63,9%, retensi selenium 28,6%, kadar glukosa darah 88 mg/dL, kadar hemoglobin 7,93 g%, dan jumlah sel darah putih 1,60 sel/mm3×105. Parameter yang memberikan hasil yang berbeda nyata adalah parameter kadar selenium darah (0,63 mg/kg) dan kadar protein darah (14,67%) pada perlakuan penambahan selenium organik pada pakan dengan dosis 8 g Se/kg pakan dengan kadar selenium pakan 5,79 mg Se/kg pakan. Parameter yang tidak berbeda nyata adalah laju pertumbuhan spesifik, tingkat kelangsungan hidup, total kolesterol, trigliserida, HDL‒kolesterol dan LDL‒kolesterol, jumlah sel darah merah dan kadar hematokrit. Kesimpulan dari penelitian ini yaitu penambahan selenium organik pada pakan sebanyak 4 g Se/kg pakan dengan kadar selenium pakan 2,26 mg Se/kg merupakan perlakuan terbaik yang dapat meningkatkan kinerja pertumbuhan dan status kesehatan ikan lele Clarias sp.
SUMMARY
HASRAH. Additional of Organic Selenium on Growth Performance and Health Status of Catfish Clarias sp. Supervised by MUHAMMAD AGUS SUPRAYUDI and NUR BAMBANG PRIYO UTOMO.
Catfish Clarias sp. is one of the freshwater fish which have promising profit to culture because the consumption demand is increasing in every year. So that the production must be increasing to fulfill the demand and can be done by intensification. Intensification of Clarias sp culture are related to feed demand, where feed is the biggest component that consume high cost from total production costs. Increasing feed efficiency to supress production costs can be performed with additional of organic selenium. Organic selenium is an integral part of antioxidant enzyme glutathione peroxidase which could destroy forming peroxides, hopefully could increasing Clarias sp. growth performance and health status.
This research aimed to evaluate the effect of additing organic selenium on growth performance and health status of Clarias sp. The research consists of four treatment and three replication which is additing the organic selenium with dose 0, 1, 4, and 8 g Se/kg of diet with the selenium content in the diet was 0.30, 0.79, 2.26, and 5.79 mg Se/kg respectively. Experimental fish used has initial weight of 5.97+0.06 g maintained in 300 litre of 12 tanks with densitiy of 150 fish per tanks during 56 days. Fish was fed 3% from its body weight three times a day in 07.00, 14.00 and 20.00. Parameter inspected consist of weight gain, specific growth rate, survival rate, amount of feed were consumed, feed efficiency, protein retention, fat retention, selenium retention and fish size variance. Blood biochemical parameters were total cholesterol, triglyceride, HDL‒cholesterol and
LDL‒cholesterol, blood selenium content, blood protein content and blood glucose content whereas health status parameter were leucocytes, eritrocytes, hematocrit concentration, and hemoglobin concentration.
Result of this research indicated that the addittion of organic selenium dose 4 g Se/kg diet with selenium content in the diet was 2.26 mg Se/kg diet was the best treatment, which was total weight gain 2569.7 g, feed efficiency 69.9%, protein retention 34.8%, fat retention of 63.9%, selenium retention 28.6%, blood glucose content 88 mg/dL, haemoglobin concentration 7.93 g%, and total leucocyte 1.60 sel/mm3×105. Parameters blood selenium content (0.63 mg/kg) and protein blood content (14.67%) gave significant result in the addition of organic selenium dose 8 g Se/kg diet with selenium content 5.79 mg Se/kg compared to control. Parameters with not significant result between treatment was spescific growth rate, survival rate, total cholesterol, triglyceride, HDL‒cholesterol and
LDL‒cholesterol, total ertrocytes and hematoctrit concentartion. The conclution of this research was the addittion of organic selenium dose 4 g Se/kg diet with selenium content in the diet 2.26 mg Se/kg diet was the best treatment that can increase growth performance and health status of Clarias sp.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
PENAMBAHAN SELENIUM ORGANIK TERHADAP
KINERJA PERTUMBUHAN DAN STATUS KESEHATAN
IKAN LELE
Clarias
sp
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Penambahan Selenium Organik terhadap Kinerja Pertumbuhan dan Status Kesehatan Ikan Lele Clarias sp
Nama : Hasrah NIM : C151130321
Disetujui oleh Komisi Pembimbing
Dr Ir Muhammad Agus Suprayudi, MSi Ketua
Dr Ir Nur Bambang Priyo Utomo, MSi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, Msi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2015 ini ialah penambahan zat aditif pada pakan ikan, dengan judul Penambahan Selenium Organik terhadap Kinerja Pertumbuhan dan Status Kesehatan Ikan Lele Clarias sp dan Karya ilmiah dengan judul yang sama telah submit pada Jurnal Iktiologi Indonesia.
Terima kasih penulis ucapkan kepada Bapak Dr Ir Muhammad Agus Suprayudi, MSi dan Bapak Dr Ir Nur Bambang Priyo Utomo, MSi selaku pembimbing yang telah banyak memberi saran, arahan dan bimbingannya. Terima kasih kepada Ibu Dr Julie Ekasari, SPi MSc sebagai dosen penguji tamu dan dan Ibu Dr Ir Mia Setiawati, MSi sebagai komisi program studi yang telah memberikan saran dalam ujian sidang tesis ini. Penghargaan penulis sampaikan atas bantuan dana pendidikan magister yang diperoleh dari Beasiswa Pendidikan Pascasarjana Dalam Negeri (BPPDN), Direktorat Jendral PendidikanTinggi. Selanjutnya kepada seluruh dosen dan segenap pegawai Departemen Budidaya Perairan khususnya Laboratorium Nutrisi Ikan (Pak Wasjan, Mba Retno, Bang Yosi) atas bimbingan, dukungan dan bantuannya.
Ungkapan terima kasih yang tidak terhingga juga disampaikan kepada, ayahanda Malinggang, ayahanda Muhammad Arief, ibunda Hafisah dan ibunda Siti Atmawati, kakakku tersayang Hasidah AMk, Abdul Salam dan adikku Abdul Malik, keponakanku Muhammad Amal Aden Salam, serta seluruh keluarga, atas segala doa, kasih sayang, dan motivasi. Sahabat-sahabat (kak Puji, kak ibha, kak Ais, kak Sophi, kak Mutha, teteh Sheny, Erni, Tira, Tiara, Wiwik, Ika, Orin, Windu, Herja, Ardien, Andre, Didi serta seluruh AKU 2013, dan winning eleven) atas kebersamaan, kasih sayang, dan semangatnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
2 METODE 3
Waktu dan Tempat Penelitian 3
Pakan Uji 3
Pemeliharaan Ikan 4
Analisis Kimia 5
Analisis Data 5
Parameter yang Diamati 5
3 HASIL DAN PEMBAHASAN 9
Hasil 9
Pembahasan 12
4 SIMPULAN DAN SARAN 15
Simpulan 15
Saran 15
DAFTAR PUSTAKA 15
LAMPIRAN 18
DAFTAR TABEL
1 Komposisi formulasi pakan dan hasil proksimat pakan uji 4 2 Total biomassa ikan (Bt), jumlah komsumsi pakan (JKP), retensi
protein (RP), retensi lemak (RL), retensi selenium (RSe), efisiensi pakan (EP), laju pertumbuhan spesifik (LPS), dan tingkat kelansungan
hidup (TKH) 10
3 Kadar selenium darah, kadar protein darah dan kadar glukosa darah 11
4 Kadar kolesterol, trigliserida, HDL‒kolesterol, dan LDL‒kolesterol 11
5 Jumlah sel darah merah (SDM), sel darah putih (SDP), hemoglobin
dan hematokrit ikan lele 12
DAFTAR LAMPIRAN
1 Prosedur analisis kadar selenium 19
2 Prosedur analisis proksimat 20
1
PENDAHULUAN
Latar Belakang
Ikan lele Clarias sp merupakan jenis ikan air tawar yang cukup menjanjikan untuk dibudidayakan karena kebutuhan konsumsi terus meningkat. Berdasarkan Direktorat Jenderal Perikanan Budidaya (2014) bahwa produksi ikan lele tahun 2010-2014 dengan peningkatan produksi rata-rata 26,43% per tahun. Pakan merupakan komponen biaya tertinggi pada budidaya ikan lele yakni berkisar antara 80-85% dari total biaya produksi (Suprayudi 2010). Oleh karena itu peningkatan efisiensi pakan melalui pemenuhan kebutuhan nutrien sangat dibutuhkan dalam rangka menekan biaya produksi. Salah satu nutrien dalam pakan ikan adalah mineral (Suprayudi et al. 2013).
Mineral berperan penting dalam berbagai proses metabolisme tubuh. Selenium sebagai unsur penting enzim glutation peroksidase berfungsi sebagai antioksidan intraseluler dan sistem imun ikan, dengan cara mengkatalisis hidrogen peroksida dan asam lemak hidrosiperoksida menjadi air dan asam lemak alkohol. Selenium juga terlibat sebagai pengkatalis hormon tiroksin menjadi bentuk aktif hormon triiodotironin dalam sistem endokrin yakni reaksi enzim iodothironin deiodinase (DI) untuk pertumbuhan dan fungsi sistem imun (Brown dan Arthur 2001, Arthur dan Beckett 2005).
Bentuk umum selenium adalah bentuk organik dan anorganik. Kelebihan bentuk selenium organik dibandingkan selenium bentuk anorganik yaitu memiliki tingkat bioavailabilitas yang lebih tinggi, toksisitas lebih rendah dan lebih mudah diserap oleh tubuh karena dapat bergabung dengan protein tubuh sehingga dapat disimpan dan dapat dilepas ketika dibutuhkan. Pemberian selenium harus sesuai dengan yang dibutuhkan oleh setiap jenis ikan, kelebihan maupun kekurangan kadar selenium dapat menimbulkan penyimpangan dari kondisi normal. Kelebihan dosis selenium akan menjadi racun yang pada akhirnya akan menyebabkan kelainan pertumbuhan bahkan kematian pada ikan. Kekurangan selenium dapat mengakibatkan penurunan aktivitas enzim glutation peroksidase, respon imun ikan, menyebabkan pertumbuhan yang abnormal dan efisiensi pakan rendah (Hamzah et al. 2012c; Suprayudi et al. 2013). Penelitian yang menunjukkan suplementasi selenium organik pada ikan nila merah (Oreochromis sp) memperlihatkan kinerja pertumbuhan terbaik pada penambahan selenium organik dengan dosis 4 g Se/kg pakan dengan kadar selenium pakan 1,42 mg Se/kg pakan (Suprayudi et al. 2013) dan pada juvenil ikan kerapu malabar (Epinephelus malabaricus) dengan penambahan selenometionin sebesar 0,5-0,6 mg Se/kg pakan dengan kadar selenium pakan 0,77- 0,79 mg Se/kg pakan (Lin & Shiau 2005). Pengaruh penambahan selenium dengan sumber berbeda (selenometionin dan sodium selenit) dengan dosis penambahan yang sama yaitu 0,5 mg Se/kg pakan dengan kadar selenium pakan 0,55 dan 0,57 mg Se/kg pakan dapat meningkatkan pertumbuhan, aktivitas glutation peroxidase pada Crucian carp (Carassius auratus gibelio) (Wang et al. 2007).
2
pakan dengan kadar selenium pakan 3,67 mg Se/kg pakan memberikan pertumbuhan terbaik, meningkatkan efisiensi pakan, dan menurunkan mortalitas larva pada ikan lele (Clarias gariepinus) yang terpapar tembaga (Cu) dari lingkungan. Dosis selenium anorganik (sodium selenit) sebanyak 0,05 mg Se/kg dengan kadar selenium pakan 0,07 mg Se/kg pakan memperlihatkan kinerja pertumbuhan dan daya tahan tubuh kerapu bebek yang terpapar cekaman lingkungan (Crumileptes altivelis) dengan meningkatkan aktivitas GPx plasma (Hamzah et al. 2012a). Pengaruh penggunaan selemetionin dengan dosis 1,6 mg Se mg/kg dengan kadar selenium pakan 1,63 mg Se/kg pakan pada juvenil kerapu malabar (E. malabaricus) yang memakan tembaga (Cu) dengan konsentrasi tinggi dapat menurunkan stres oksidatif dan meningkatkan respons imun (Lin dan Shiau 2007). Penelitian tentang penambahan selenium organik untuk pembesaran ikan lele belum banyak dikaji, sehingga belum diketahui kadar selenium organik yang dapat mempengaruhi pertumbuhan dan status kesehatan ikan lele Clarias sp.
Perumusan Masalah
Intensifikasi budidaya dalam pemenuhan kebutuhan ikan yang terus meningkat berkorelasi dengan peningkatan kebutuhan pakan. Pakan merupakan salah komponen biaya terbesar dari total biaya produksi, selain itu dapat menurunkan pertumbuhan, munculnya berbagai serangan penyakit dan penurunan kualitas air, sehingga dapat menyebabkan kerugian. Kecukupan nutrien dari pakan seperti protein, lemak, karbohidrat, vitamin dan mineral sangatlah penting untuk mendukung pertumbuhan dan kesehatan ikan. Salah satu mikromineral seperti selenium dapat meningkatkan pertumbuhan dan status kesehatan ikan dengan menjadi bagian integral dari enzim antioksidan yang dapat melindungi sel dari kerusakan oksidatif akibat radikal bebas dan sebagai pengkatalis hormon tiroksin pada sistem endokrin. Terkait peranannya, selenium organik memiliki tingkat bioavailabilitas lebih tinggi, toksisitas lebih rendah dan lebih mudah diserap oleh tubuh karena dapat bergabung dengan protein tubuh sehingga dapat disimpan dan dapat dilepas ketika dibutuhkan. Oleh karena itu, penambahan selenium organik pada pakan perlu diteliti lebih lanjut untuk melihat kinerja pertumbuhan dan status kesehatan ikan lele Clarias sp.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi pengaruh penambahan selenium organik dengan dosis berbeda pada pakan terhadap kinerja pertumbuhan dan status kesehatan ikan lele Clarias sp.
Manfaat Penelitian
3 Hipotesis
Penambahan selenium organik dengan dosis tertentu pada pakan dapat meningkatkan kinerja pertumbuhan dan status kesehatan pada ikan lele Clarias sp.
2
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Maret 2015 hingga Mei 2015 yang bertempat di Kolam Percobaan Babakan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Analisis proksimat dilakukan di Laboratorium Nutrisi Ikan, analisis gambaran darah dilakukan di Laboratorium Kesehatan Ikan dan analisis kualitas air dilakukan di Laboratorium Lingkungan, Departemen Budidaya Perairan. Analisis selenium dilakukan di Laboratorium PT. Saraswanti Indo Genetech (SIG), Bogor dan analisis kimia darah dilakukan di Laboratorium Fisiologi, Fakultas Kedokteran Hewan, Intitut Pertanian Bogor.
Pakan Uji
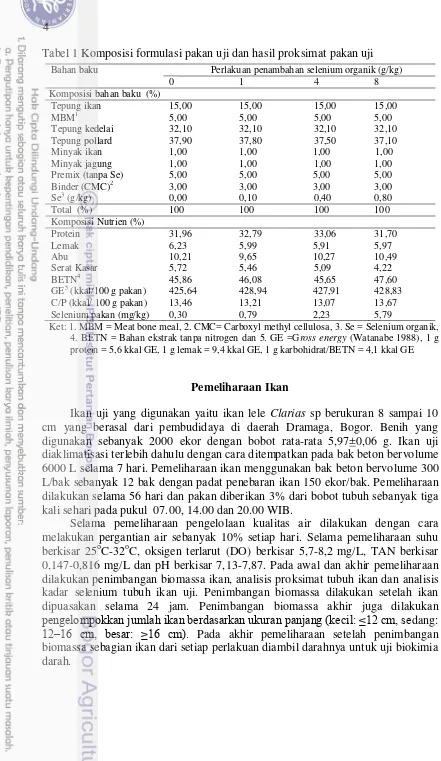
Pakan uji yang digunakan adalah pakan yang diformulasikan untuk ikan lele yang dicampur selenium organik dengan dosis berbeda. Setiap perlakuan terdiri dari tiga ulangan. Selenium organik yang digunakan berupa selenium berbentuk bubuk dan berwarna merah. Dosis penambahan selenium organik yaitu 0 (kontrol), 1, 4 dan 8 g Se/kg pakan. Pakan mengandung isoprotein 32,38% dan isoenergi 427,84 kkal/100 g pakan. Perlakuan selengkapnya pada penelitian ini adalah sebagai berikut:
1) Pakan + selenium organik 0 g/kg pakan 2) Pakan + selenium organik 1 g/kg pakan 3) Pakan + selenium organik 4 g/kg pakan 4) Pakan + selenium organik 8 g/kg pakan
Selenium organik dicampurkan kedalam bahan baku pakan lainnya, selanjutnya dihomogenkan hingga rata dengan menggunakan mixer kemudian dicetak. Pakan yang telah menjadi pellet dikeringkan dalam oven pada suhu 35oC selama 24 jam. Pakan uji yang telah dibuat, dilakukan analisa proksimat untuk mengetahui kadar nutrien dan analisa selenium untuk mengetahui kadar selenium pakan. Komposisi bahan baku pakan dan hasil proksimat pakan uji dalam bobot kering serta kadar selenium pakan tercantum dalam Tabel 1.
4
Tabel 1 Komposisi formulasi pakan uji dan hasil proksimat pakan uji
Bahan baku Perlakuan penambahan selenium organik (g/kg)
0 1 4 8
Ket: 1. MBM = Meat bone meal, 2. CMC= Carboxyl methyl cellulosa, 3. Se = Selenium organik, 4. BETN = Bahan ekstrak tanpa nitrogen dan 5. GE =Gross energy (Watanabe 1988), 1 g protein = 5,6 kkal GE, 1 g lemak = 9,4 kkal GE, 1 g karbohidrat/BETN = 4,1 kkal GE
Pemeliharaan Ikan
Ikan uji yang digunakan yaitu ikan lele Clarias sp berukuran 8 sampai 10 cm yang berasal dari pembudidaya di daerah Dramaga, Bogor. Benih yang digunakan sebanyak 2000 ekor dengan bobot rata-rata 5,97±0,06 g. Ikan uji diaklimatisasi terlebih dahulu dengan cara ditempatkan pada bak beton bervolume 6000 L selama 7 hari. Pemeliharaan ikan menggunakan bak beton bervolume 300 L/bak sebanyak 12 bak dengan padat penebaran ikan 150 ekor/bak. Pemeliharaan dilakukan selama 56 hari dan pakan diberikan 3% dari bobot tubuh sebanyak tiga kali sehari pada pukul 07.00, 14.00 dan 20.00 WIB.
Selama pemeliharaan pengelolaan kualitas air dilakukan dengan cara melakukan pergantian air sebanyak 10% setiap hari. Selama pemeliharaan suhu berkisar 25oC-32oC, oksigen terlarut (DO) berkisar 5,7-8,2 mg/L, TAN berkisar 0,147-0,816 mg/L dan pH berkisar 7,13-7,87. Pada awal dan akhir pemeliharaan dilakukan penimbangan biomassa ikan, analisis proksimat tubuh ikan dan analisis kadar selenium tubuh ikan uji. Penimbangan biomassa dilakukan setelah ikan dipuasakan selama 24 jam. Penimbangan biomassa akhir juga dilakukan
pengelompokkan jumlah ikan berdasarkan ukuran panjang (kecil: ≤12 cm, sedang:
12‒16 cm, besar: ≥16 cm). Pada akhir pemeliharaan setelah penimbangan
5 Analisis Kimia
Analisis kimia meliputi analisis kadar selenium dan proksimat. Analisis kadar selenium pakan dan tubuh ikan menggunakan metode ICP-OES (Lampiran 1) dan analisis kadar selenium darah menggunakan metode HG-AAS (Lampiran 1). Analisis proksimat meliputi bahan baku pakan uji, pakan uji, tubuh ikan awal dan akhir penelitian (Lampiran 2). Analisis yang dilakukan berupa pengukuran kadar air dengan pemanasan dalam oven (105-110oC), protein dengan metode Kjeldahl, lemak dengan metode Soxhlet untuk pakan dan Folch untuk tubuh ikan, kadar abu dengan pemanasan dalam tanur (400-600oC) dan serat kasar diukur dengan pelarutan dalam asam dan basa kuat serta pemanasan berdasarkan metode Takeuchi (1988). Parameter yang diamati yaitu biomassa awal ikan uji, biomassa akhir ikan uji, jumlah konsumsi pakan, laju pertumbuhan spesifik, tingkat kelangsungan hidup, efisiensi pakan, retensi protein, retensi lemak, retensi selenium, keragaman ukuran ikan, total kolesterol, trigliserida, HDL‒kolesterol,
LDL‒kolesterol, kadar glukosa darah, kadar selenium tubuh dan kadar selenium darah, serta gambaran darah.
Analisis Data
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) dengan 4 perlakuan dan 3 ulangan. Data yang diperoleh ditabulasi dengan program MS. Office Excel 2013 dan untuk uji ANOVA dianalisis dengan menggunakan program SPSS 18,0. Perlakuan yang berbeda nyata akan diuji lanjut dengan uji lanjut Tukey.
Parameter yang Diamati
Jumlah konsumsi pakan
Jumlah konsumsi pakan ditentukan dengan cara jumlah (berat) pakan awal dikurangkan dengan jumlah (berat) sisa pakan.
Laju pertumbuhan spesifik (LPS)
Laju pertumbuhan spesifik ikan dihitung berdasarkan persamaan berikut:
Keterangan:
6
Tingkat kelangsungan hidup (TKH)
Tingkat kelangsungan hidup dihitung menggunakan rumus sebagai berikut: TKH =
Keterangan :
TKH = Tingkat kelangsungan hidup (%)
Nt = Jumlah ikan pada akhir pemeliharaan (ekor) No = Jumlah ikan pada awal pemeliharaan (ekor) Efisiensi pakan
Efisiensi pakan dihitung menggunakan persamaan sebagai berikut (Takeuchi 1988):
EP = x 100 Keterangan:
EP = Efisiensi pakan (%)
Wt = Biomassa ikan pada akhir pemeliharaan (g)
W0 = Biomassa ikan pada awal pemeliharaan (g)
Wd = Biomassa ikan yang mati selama pemeliharaan (g)
F = Jumlah pakan yang diberikan selama penelitian (g) Retensi protein
Retensi protein dihitung melalui analisis proksimat protein tubuh ikan uji pada awal dan akhir pemeliharaan. Rumus perhitungan retensi protein adalah sebagai berikut (Takeuchi 1988):
RP = x 100 Keterangan:
RP = Retensi protein (%)
F = Jumlah protein ikan pada akhir pemeliharaan (g) I = Jumlah protein ikan pada awal pemeliharaan (g) P = Jumlah protein yang dikonsumsi ikan (g)
Retensi lemak
Retensi lemak dihitung melalui analisis proksimat lemak tubuh ikan uji pada awal dan akhir pemeliharaan. Rumus perhitungan retensi lemak adalah sebagai berikut (Takeuchi 1988):
RL = x 100 Keterangan:
RL = Retensi lemak (%)
7 Retensi Selenium
Retensi selenium dihitung melalui analisis tubuh ikan dan diuji pada awal dan akhir penelitian. Rumus perhitungan retensi selenium sebagai berikut:
RSe = x 100 Keterangan:
RSe = Retensi Selenium (%)
F = Jumlah selenium ikan pada akhir pemeliharaan (mg/kg) I = Jumlah selenium ikan pada awal pemeliharaan (mg/kg) Se = Jumlah selenium yang dikonsumsi ikan (mg/kg)
Glukosa darah
Kadar glukosa darah menggunakan alat test glukosa yaitu GlucoDr
AGM‒2100 dengan kit berupa GlukoDr strip Code 8. Gambaran darah
Darah diambil dari vena caudalis dekat ekor ikan. Syringe dibilas dengan antikoagulan heparin. Sampel darah ikan diambil dari belakang anal kearah tulang belakang hingga jarum syringe menyentuh tulang. Sampel darah dihisap perlahan sebanyak 1 mL, kemudian dipindahkan kedalam tabung mikrotub yang telah dibilas dengan heparin.
Total sel darah merah (SDM/Eritrosit)
Pemeriksaan total eritrosit bertujuan untuk mengetahui kondisi kesehatan ikan dengan cara menghitung total eritrosit dalam darah. Cara pengambilan sampel darah dihisap dengan pipet berskala sampai 0,5 selanjutnya larutan Hayem dihisap sampai skala 101, pipet digoyangkan membentuk angka delapan selama 3-5 menit agar bercampur homogen. Tetesan pertama dibuang, tetesan berikutnya diteteskan ke dalam hemositometer dan ditutup dengan kaca penutup (Blaxhall dan Daisley 1973). Penghitungan dilakukan pada lima kotak kecil hemositometer dan jumlahnya dihitung dengan rumus:
SDM =
Total sel darah putih (SDP/ Leukosit)
Cara penghitungan total leukosit sama seperti penghitungan total eritrosit, yang membedakan hanya pada larutan yang digunakan, yaitu larutan Turk’s. Jumlah leukosit total dinyatakan dengan n x 105/mm3.
SDP =
Kadar hematokrit (Ht)
8
selama 15 menit. Pembacaan dilakukan dengan membandingkan bagian darah yang mengendap dengan seluruh bagian darah yang ada didalam tabung mikro hematokrit, menggunakan mikro hematokrit skala dan hasilnya dinyatakan dalam persen (%) (Anderson dan Siwicki 1993).
Kadar hemoglobin (Hb)
Konsentrasi hemoglobin diukur menggunakan metode Sahli dengan Sahlinometer. Sampel darah ikan diambil dengan pipet Sahli sampai skala 20 mm3.
Ujung pipet yang digunakan dibersihkan dari sisa-sisa darah dengan kertas tissue. Darah dipindahkan ke dalam tabung Sahli yang telah diisi dengan HCl 0.1 N sampai angka 10 (garis skala paling bawah pada tabung Sahli). Kemudian tabung tersebut ditempatkan diantara 2 tabung yang berisi warna standar. Akuades ditambahkan ke dalam tabung Sahli sedikit demi sedikit menggunakan pipet, sampai warnanya sama dengan warna standar dan didiamkan selama 3 menit, dan hasilnya dinyatakan dalam g % (Wedemeyer dan Yasutake 1977).
Analisis kadar total kolesterol, trigliserida, dan HDL‒kolesterol dan LDL‒kolesterol darah
Tiga ikan dari setiap perlakuan diambil secara acak pada akhir penelitian. Sampel darah ikan diambil dari pembuluh vena pada pangkal sirip ekor menggunakan syringe yang telah dibilas dengan antikoagulan (3,8% natrium sitrat) dan kemudian darah dimasukkan ke dalam tabung mikro 1,5 mL. Plasma darah dipisahkan dengan sentrifugasi pada 3.000 rpm selama 15-20 menit, kemudian plasma dapat langsung dianalisis atau disimpan pada suhu -20oC hingga digunakan.
Total kolesterol
Kadar total kolesterol diukur menggunakan metode CHOD-PAP (enzymatic colorimetric test for cholesterol with lipid clearing factor) dengan kit CHOLESTEROL liquicolor Human mbH, Jerman. Rumus yang digunakan untuk menghitung kandungan kolesterol adalah sebagai berikut:
K = Keterangan:
K = Kandungan kolesterol (mg/dL) Au = Absorbansi sampel
9 Trigliserida
Kadar trigliserida diukur menggunakan metode CHOD-PAP (enzymatic colorimetric test for triglyserida with lipid clearing factor) dengan kit TRIGLYSERIDA liquicolormono Human mbH, Jerman. Rumus yang digunakan untuk menghitung kandungan trigliserida adalah sebagai berikut:
TG = Keterangan:
TG = Kandungan trigliserida (mg/dL) Au = Absorbansi sampel
Cs = Konsentrasi standar trigliserida As = Absorbansi standar trigliserida High density lipoprotein (HDL)
Kadar HDL‒koletserol diukur menggunakan metode CHOD-PAP dengan
kit HUMAN CHOLESTEROL liquicolor Precipitant and Standar Human mbH, Jerman. Rumus yang digunakan untuk menghitung kandungan HDL adalah sebagai berikut:
HDL = Keterangan:
HDL = Kandungan kolesterol‒HDL (mg/dL) Au = Absorbansi sampel
Cs = Konsentrasi standar HDL As = Absorbansi standar HDL Low density lipoprotein (LDL)
Pengukuran low density lipoprotein (LDL) menggunakan metode CHOD-PAP. Rumus yang digunakan untuk menghitung kandungan LDL adalah sebagai berikut:
LDL (mg/dL) = Kolesterol total-Kolesterol HDL-
3
HASIL DAN PEMBAHASAN
Hasil
10
Se/kg pakan dengan kadar selenium 2,26 mg Se/kg pakan juga memberikan pengaruh berbeda nyata terhadap total biomassa ikan, retensi lemak dan retensi selenium. Hal ini, diikuti peningkatan efisiensi pakan pada ikan perlakuan yang sama lalu menurun pada ikan perlakuan penambahan selenium organik 8 g Se/kg pakan dengan kadar selenium pakan 5,79 mg Se/kg pakan. Namun peningkatan retensi dan efisiensi pakan tidak diikuti peningkatan laju pertumbuhan spesifik serta tidak memberikan pengaruh yang berbeda nyata terhadap tingkat kelangsungan hidup ikan lele pada semua perlakuan. Hasil keragaman ukuran ikan lele yang diberi perlakuan penambahan selenium organik pada pakan disajikan pada Gambar 1. Jumlah keragaman ukuran ikan setiap perlakuan lebih baik pada perlakuan dengan penambahan selenium organik sebanyak 4 g Se/kg pakan dengan kadar selenium 2,26 mg Se/kg pakan.
Tabel 2 Total biomassa ikan (Bt), jumlah komsumsi pakan (JKP), retensi protein (RP), retensi lemak (RL), retensi selenium (RSe), efisiensi pakan (EP), laju pertumbuhan spesifik (LPS), dan tingkat kelansungan hidup (TKH).
Parameter Uji Kadar selenium pakan (mg/kg)
Ket : Huruf yang berbeda pada baris yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (p<0,05). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku.
Gambar 1. Jumlah ikan berdasarkan keragaman ukuran ikan lele yang diberi perlakuan penambahan selenium organik selama 56 hari
11 Analisis kadar selenium darah, kadar protein darah dan kadar glukosa darah ikan lele selama pemeliharaan 56 hari disajikan pada Tabel 3. Hasil analisis menunjukkan bahwa kadar selenium darah ikan lele memberikan pengaruh yang berbeda nyata serta meningkat secara linier hingga perlakuan penambahan selenium organik sebanyak 8 g Se/kg pakan dengan kadar selenium 5,79 mg Se/kg pakan (p<0,05). Penambahan selenium organik sebanyak 8 g Se/kg pakan dengan kadar selenium 5,79 mg Se/kg pakan memberikan pengaruh yang berbeda nyata dan lebih tinggi pada parameter kadar protein darah ikan lele dibandingkan perlakuan lainnya (p<0,05). Kadar glukosa darah meningkat secara linier hingga perlakuan dengan penambahan selenium organik 4 g Se/kg pakan dengan kadar selenium 2,26 mg Se/kg pakan kemudian menurun pada penambahan selenium organik 8 g Se/kg pakan dengan kadar selenium 5,79 mg Se/kg pakan.
Tabel 3 Kadar selenium darah, kadar protein darah dan kadar glukosa darah ikan lele
Parameter Uji Kadar selenium pakan (mg/kg)
0,30 0,79 2,26 5,79 Selenium darah (mg/kg) 0,27±0,01c 0,35±0,04bc 0,43±0,05b 0,63±0,06a Protein darah (%) 10,00±0,4b 11,07±1,3b 10,36±0,5b 14,67±1,5a Glukosa darah (mg/dL) 51±1,4b 56±4,6b 88±2,8a 57±10,1b Ket : Huruf yang berbeda pada baris yang sama menunjukkan pengaruh perlakuan yang berbeda
nyata (p<0,05). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku.
Hasil analisis kimia darah meliputi total kolesterol, trigliserida,
HDL‒kolesterol, dan LDL‒kolesterol disajikan pada Tabel 4. Perlakuan dengan penambahan selenium organik 0, 1, 4, 8 g Se/kg pakan dengan kadar selenium masing-masing pakan yaitu 0,30, 0,79, 2,26 dan 5,79 mg Se/kg pakan tidak memberikan pengaruh berbeda nyata terhadap semua parameter kimia darah ikan lele (P>0,05).
Tabel 4. Total kolesterol, trigliserida, HDL‒kolesterol, dan LDL‒kolesterol
Parameter Uji Kadar selenium pakan(mg/kg)
0,30 0,79 2,26 5,79 Kolesterol (mg/dL) 128,5+6,7a 119,8±17,6a 122,7±27,2a 101,0±18,6a Trigliserida (mg/dL) 127,5±61,9a 105,3±28,0a 105,3±16,8a 88,1±10,1a
HDL‒kolesterol (mg/dL) 83,4±4,5a 81,9±11,9a 82,9±9,1a 74,8±12,9a
LDL‒kolesterol (mg/dL) 19,5±3,1a 16,8±1,0a 18,7±14,8a 8,5±6,7a Ket: Huruf yang berbeda pada baris yang sama menunjukkan pengaruh perlakuan yang berbeda
nyata (p<0,05). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku.
12
nyata (p<0,05). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku.
Pembahasan
Hasil penelitian penambahan selenium organik terhadap kinerja pertumbuhan ikan lele disajikan pada Tabel 2. Hasil penelitian menunjukkan bahwa jumlah konsumsi pakan dengan penambahan selenium organik tidak memberikan pengaruh yang berbeda nyata dengan ikan perlakuan kontrol (p>0,05). Hal itu menunjukkan bahwa penambahan selenium organik hingga 8 g Se/kg pakan dengan kadar selenium 5,79 mg Se/kg pakan tidak mempengaruhi palatabilitas pakan terhadap ikan. Hasil yang sama dengan penelitian Hamzah et al. (2012b) yakni penambahan selenometionin hingga 16 mg Se/kg pakan dengan kadar selenium pakan 13,93 mg Se/kg pakan pada ikan kerapu tidak berpengaruh terhadap jumlah konsumsi pakan ikan. Hasil yang sama juga dilaporkan oleh Suprayudi et al. (2013) pada ikan nila. Akan tetapi penambahan seleniun anorganik dalam bentuk sodium selenit menurunkan palatabilitas dan menyebabkan kematian ikan pada dosis 0,05 mg Se/kg pakan dengn kadar 0,63 mg Se/kg pakan (Hamzah et al. 2012 c)
Pakan yang diberikan dimakan, dicerna, diserap dan dibawa oleh darah ke hati untuk selanjutnya didistribusikan ke seluruh tubuh. Hasil analisis kadar selenium darah dan kadar protein darah meningkat secara linier seiring dengan peningkatan penambahan selenium organik pada pakan (Tabel 3). Penambahan selenium organik hingga 4 g Se/kg pakan dengan kadar 2,26 mg Se/kg meningkatkan kadar selenium darah sebesar 59% dan retensi selenium sebesar 150% dibandingkan perlakuan ikan kontrol (perlakuan tanpa penambahan selenium organik dengan kadar selenium pakan 0,3 mg/kg pakan). Hal itu juga diikuti dengan peningkatan retensi protein, retensi lemak dan peningkatan biomassa tubuh ikan (Tabel 2). Hal ini menunjukkan bahwa penambahan selenium organik pada pakan dapat meningkatkan pemanfaatan energi dari non protein yakni dari karbohidrat dan lemak (Protein sparring effect). Kemampuan ikan memanfaatkan energi non protein ini diduga terkait dengan peranan selenium yaitu selenoprotein ID (Iodotironin deiodinase) berperan dalam meningkatkan hormon tiroid yang akan memicu sekresi insulin (Brown dan Arthur 2001, Zairin 2003).
13 sebagian glukosa darah diubah menjadi lemak. Peningkatan selenium selain memicu sekresi insulin juga memicu peningkatan glukosa darah diikuti terjadi glikogenesis yang menyebabkan terjadinya penyimpanan cadangan energi dalam bentuk glikogen dalam tubuh. Hasil yang sama juga terjadi pada ikan lele oleh (Tawwab et al. 2007) dan pada ikan nila (Suprayudi et al. 2013). Hal ini mendukung terjadinya peningkatan efisiensi pakan sebesar 69,9 % pada ikan lele.
Penambahan selenium organik dalam pakan tidak memberikan pengaruh yang berbeda nyata terhadap laju pertumbuhan spesifik dan tingkat kelangsungan hidup (p>0,05). Hal ini diduga karena ikan akhir memiliki variasi keragaman yang tinggi karena nilai standar deviasi yang tinggi pada ulangan dalam satu perlakuan, sehingga menyebabkan laju pertumbuhan dan tingkat kelangsungan hidup ikan tidak berbeda. Hal ini sesuai dengan hasil penelitian oleh Wang et al. (2007) bahwa penambahan sodium selenit dan selenometionin sebanyak 0,5 mg Se/kg dengan kadar kadar selenium maisng-masing 0,55 dan 0,57 mg Se/kg pakan yang diberikan selama 30 hari tidak memberikan pengaruh yang berbeda terhadap laju pertumbuhan dan tingkat kelangsungan hidup pada ikan Crucian carp. Hasil yang sama dilaporkan juga oleh Zhou et al. (2009) menggunakan nano‒selenium dan selenometionin dengan dosis yang sama selama 30 hari. Hasil berbeda dilaporkan oleh Tawwab et al. (2007) bahwa penambahan Sel-Plex® 0,3 g Sel-Plex®/kg pakan dengan kadar selenium 3,67 mg Se/kg pakan dapat meningkatkan laju pertumbuhan spesifik pada juvenil ikan lele. Berdasarkan hal tersebut bahwa setiap spesies ikan membutuhkan dosis selenium yang berbeda-beda.
Penambahan selenium organik dalam pakan sebanyak 8 g Se/kg pakan dengan kadar selenium 5,79 mg Se/kg menurunkan retensi lemak dan retensi selenium. Hal ini diduga disebabkan oleh kadar selenium yang berlebih dalam tubuh ikan lele. Ketersediaan energi yang cukup berasal dari kadar glukosa dan lemak dibutuhkan untuk meredam hal tersebut. Homeostasis selenium dalam tubuh tidak diatur oleh jumlah selenium pakan yang dimakan oleh ikan tetapi melalui regulasi ekskresi selenium tubuh. Kadar selenium yang berlebih dapat menyebabkan pro-oksidan. Pro-oksidan menghasilkan radikal bebas (superoksida, hidroperoksida dan lain-lain) yang dapat bereaksi dengan molekul disekitarnya seperti protein, lemak, karbohidrat dan DNA. Pembentukan radikal bebas akan dinetralisir oleh antioksidan endogen dalam jumlah normal, namun jika berlebih maka akan menyebabkan stres oksidatif yang pada akhirnya menyebabkan kerusakan lokal, disfungsi organ dan kematian pada ikan (Hamzah et al. 2012c). Namun dosis penambahan selenium organik tertinggi yakni 8 g Se/kg pakan dengan kadar selenium 5,79 mg Se/kg pakan masih dapat ditolerir oleh tubuh ikan, terbukti dengan tingkat kelangsungan hidup ikan lele mencapai tertinggi 98%.
14
Pengukuran kimia darah ini dilakukan terkait peranan selenium dalam tubuh membentuk selenoprotein seperti ID (Iodotironin deiodinase) sebagai pengkatalisis hormone tiroid yang akan memicu sekresi insulin yang pada akhirnya mengarah kepada peningkatan sintesis protein dan lemak. Beberapa faktor yang mempengaruhi perbedaan pertumbuhan diantaranya habitat yang berbeda, kebiasaan makan, aktifitas ikan dan musim (Mutmainnah 2013) serta tingkat kepadatan ikan (Tawwab 2012). Keragaman ukuran ikan diduga disebabkan karena tidak dilakukan pemilahan berdasarkan ukuran ikan selama pemeliharaan. Hasil keragaman ukuran ikan berdasarkan jumlah ikan diperoleh pada perlakuan penambahan selenium organik 4 g Se/kg pakan dengan kadar selenium 2,26 mg Se/kg pakan yang disajikan pada Gambar 1. Hal ini sejalan dengan parameter pertumbuhan lainnya seperti biomassa ikan akhir, retensi protein, retensi lemak dan retensi selenium dan efisiensi pakan.
15
4
SIMPULAN DAN SARAN
Simpulan
Penambahan selenium organik sebanyak 4 g Se/kg pakan dengan kadar selenium pakan 2,26 mg Se/kg dapat meningkatkan biomassa ikan, retensi protein, retensi lemak, retensi selenium dan efisiensi pakan serta meningkatkan status kesehatan ikan lele.
Saran
Perlu dilakukan penelitian lebih lanjut mengenai dosis penambahan selenium organik yang optimal pada pakan untuk pembesaran ikan lele agar diketahui efektivitas dosis tersebut terhadap kinerja pertumbuhan dan status kesehatan ikan lele. Hal ini karena penambahan selenium organik 4 g Se/kg pakan belum optimal sedangkan dosis penambahan 8 g Se/ kg pakan sudah berlebih, sehingga perlu dicari dosis penambahan antara 4 g Se/kg pakan hingga dibawah dosis penambahan 8 g Se/kg pakan. Penelitian untuk pembesaran ikan perlu peningkatan bobot benih ikan yang digunakan serta penyesuaian jumlah pakan yang diberikan berdasarkan ukuran ikan.
DAFTAR PUSTAKA
Anderson DP, Siwicki AK. 1993. Basic hematology dan serology for fish health programs. Paper presented in second symposium on diseases in asean
aquaculture”Aquatic animal health and the environmental. Phuket,
Thailand. 25-29th October 1993.17p.
Affandi R, Tang UM. 2002. Fisiologi Hewan Air. Riau: Penerbit Unri Press. hal: 58-90.
Arthur JR, Becket GJ. 2005. Selenium and endocrine system: a review. Journal of Endocrinology. 184: 455-456.
Blaxhall PC, Daisley KW. 1973. Routine hematological methods for us with fish blood. Journal Fish Biology. 5: 577-581.
Brown KM, Arthur JR. 2001. Selenium selenoproteins and human heatlh: a review. Public Health Nutrition. 4: 539-599.
Colpo A. 2005. LDL cholesterol: bad cholesterol or science cholesterol. Journal of American Physicans and Surgeons. 10: 83-89
Direktorat Jenderal Perikanan Budidaya. 2014. Laporan Kinerja Direktorat Produksi. Jakarta. hal: 33-34.
Erhunmwunse NO, Ainerua MO. 2013. Characterization of some blood parameters of African catfish (Clarias gariepinus). American-Eurasian Journal of Toxicological Sciences. 5(3): 72-76.
16
mendapatkan tambahan selenium dan terpapar cekaman lingkungan. Jurnal Iktiologi Indonesia. 12(2): 173-183.
Hamzah M, Suprayudi MA, Utomo NBP, Manalu W. 2012b. Pertumbuhan dan daya tahan tubuh juvenil ikan kerapu bebek (Cromileptes altivelis) yang diberi pakan dengan penambahan selenometionin. Agriplus. 22: 241-248 Hamzah M, Suprayudi MA, Utomo NBP, Manalu W. 2012c. Pertumbuhan dan
daya tahan tubuh juvenil ikan kerapu bebek (Cromileptes altivelis) yang diberi suplemen selenium anorganik dan organik. Jurnal Akuakultur Indonesia. 11(2):141-152.
Hastuti S, Subandiyono. 2011. Performa hematologis ikan lele dumbo”
Sangkuriang” (Clarias gariepinus, Burch) yang diberi pakan mengandung
kromium-organik. Jurnal Saintek Perikanan. 7(1): 56-62.
Lin YH, Shiau SY. 2005. Dietary selenium requirement of juvenil grouper Ephinephelus malabaricus. Aquaculture. 250: 356-363
Lin YH, Shiau SY. 2007. The effects of dietary selenium on the oxidative stress of grouper, Epinephelus malabaricus, fed high copper. Aquaculture. 267:38-43
Mlay PS, Seth M, Balthazary ST, Chibunda RT, Phiri ECJH, Balemba OB. 2007. Total plasma proteins and hemoglobin levels as affected by worm burden in freshwaterfish in Morogoro, Tanzania. Livestock Research for Development. 19 (2).
Muthmainnah D. 2013. Hubungan panjang berat dan faktor kondisi ikan gabus (Channas striata Bloch,1793) yang dibesarkan di rawa lebak, Provinsi Sumatra Selatan. Depik. 2 (3): 184-190
Osman AGM, Koutb M, Sayed AEDH. 2010. Use of hematological parameters to assess the effiency of quince (Cydonia oblonga Miller) leaf extract in alleviation of the effect of ultraviolet-a radiation on African catfish Clarias gariepinus (Burchell, 1822). Journal of Photochemistry and Photobiology. 99:1-8
Purwanti SC, Suminto, Sudaryono A. 2014. Gambaran profil darah ikan lele dumbo (Clarias gariepinus) yang diberi pakan dengan kombinasi pakan buatan dan cacing tanah (Lumbricus rubellus). Journal of Aquaculture Management and Technology. 3(1):53-69.
Suprayudi MA. 2010. Pengembangan penggunaan bahan baku local untuk pakan ikan atau udang: status terkini dan prospeknya. Makalah disajikan pada Semi Loka Nutrisi dan teknologi pakan ikan atau udang. Bogor, 26 Oktober 2010. Badan Litbang Kelautan dan Perikanan, KKP bekerja. Suprayudi MA, Faisal B, Setiawati M. 2013. Pengaruh suplementasi selenium
organik dengan dosis berbeda dalam pakan terhadap kinerja pertumbuhan ikan nila merah (Oreochromis Sp). Jurnal Akuakultur Indonesia. 12(4):52-58.
Takeuchi T. 1988. Laboratory Work Chemical Evaluation of Dietary Nutrients, In: Fish Nutrition and Mariculture, Watanabe T (ed). Tokyo University of Fisheries: Department of Aquatic Bioscience. p 179-225.
17 Tawwab MA. 2012. Effects of dietary protein levels and rearing density on growth performance and stress response of Nila tilapia, Oreocrhromis niloticus (L). International Aquatic Research 4(3): 2-13.
Wang Y, Han J, Li W, Xu Z. 2007. Effect of different selenium on growth performances, glutation peroxidase activities, muscle composition and selenium concentration of allogynogenetic cruciap carp (Carassius auratus gibelio). Animal Feed Science and Technology. 134:243-251. Watanabe T. 1988. Fish Nutrition and Mariculture. Tokyo University of
Fisheries: Department of aquatic Bioscience. p 233.
Wedemeyer GA, Yasutake WT. 1977. Clinical methods for the assessement of the effect enviromental stress on fish health. Technical Papers of The U.S. Fish and Wildlife Service. U.S. Depart. of the Interior 89: 1-17.
Zairin MJr. 2003. Endokrinologi dan peranannya bagi masa depan perikanan Indonesia [Orasi Ilmiah]. Bogor. Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
18
19 Lampiran 1 Prosedur analisis kadar selenium
Metode ICP‒OES untuk selenium pakan dan selenium tubuh ikan
1) Timbang 0,5 gram sampel, tambahkan 10 ml HNO3
2) Destruksi selama 20 menit pada suhu 190º C 3) Masukkan ke dalam labu ukur berukuran 50 mL 4) Dihimpitkan dengan aquabides, selanjutnya disaring
5) Diukur oleh ICP‒OES pada panjang gelombang masing masing
6) Buat kurva Kalibrasi
Hitung kadar logam mineral dengan rumus:
Kandungan logam/ mineral (µg/g) = Keterangan:
V = volume pelarutan (ml) m = bobot sampel (g) w = bobot simplisia awal.
Metode HG-AAS untuk selenium darah ikan
1) Sampel dihaluskan sampel dan dihomogenkan, ditimbang 10 gram dan dimasukkan ke dalam Erlenmeyer 250 ml
2) Tambahkan HNO3 (p) sebanyak 30 ml selanjutnya destruksi sampai uap nitrat berkurang dan diamkan hingga dingin
3) Tambahkan HClO4 (p) sebanyak 30 ml, destruksi sampai muncul uap putih dan larutan jernih, dinginkan, kemudian masukkan ke labu ukur 50 ml, tambahkan ddH2O
4) Saring dengan kertas saring, pipet 10 ml filtrate ke labu ukur 50 ml, tambahkan 10 ml HCl (p)
5) Panaskan di penangas air 100oC selama 30 menit, dinginkan kembali dan tambahkan HCl 1:1 sampai tanda batas
6) Diukur dengan HG-AAS
Perhitungan kandungan logam dan mineral selenium dengan rumus: ug Se/Kg sampel = C spl x Fp
20
Lampiran 2 Prosedur analisis proksimat Kadar Air
1) Cawan dipanaskan dalam oven pada suhu 105oC-110oC selama 1 jam dan kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X1).
2) Bahan ditimbang 2-3 g (A).
3) Cawan dan bahan dipanaskan dalam oven pada suhu 105oC-110oC selama 4 jam kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X2).
Kadar air (%) = X 100 Kadar Abu
1) Cawan dipanaskan dalam oven pada suhu105oC-110oC selama 1 jam dan kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X1).
2) Bahan ditimbang 2-3 g (A).
3) Cawan dan bahan dipanaskan dalam tanur pada suhu 600oC sampai menjadi abu kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X2). 1,5 N sebanyak 25 mL ditambahkan ke dalam erlenmeyer dan dipanaskan kembali selama 30 menit.
4) Larutan dan bahan yang telah dipanaskan kemudian disaring dalam corong Buchner dan dihubungkan pada vacuum pump untuk mempercepat filtrasi. 5) Larutan dan bahan yang ada pada corong Buchner kemudian dibilas secara
berturut-turut dengan 50 mL air panas, 50 mL H2SO4 0,3 N, 50 mL air
panas dan 25 mL aseton.
6) Kertas saring dan isinya lalu dimasukkan ke dalam cawan porselin dan kemudian dipanaskan dalam oven 105-110oC selama 1 jam kemudian didinginkan dalam desikator 5-15 menit dan ditimbang (X2).
7) Setelah itu dipanaskan dalam tanur 600oC hingga berwarna putih atau abu-abu (+ selama 4 jam). Kemudian dimasukkan dalam oven 105-110oC selama 15 menit, didinginkan dalam desikator selama 5-15 menit dan ditimbang (X3).
21
dan dimasukkan ke dalam labu Kjeldahl.
3) Sebanyak 10 mL H2SO4 pekat ditambahkan ke dalam labu Kjeldahl dan
kemudian labu tersebut dipanaskan dalam rak oksidasi pada suhu 400oC selama 3-4 jam sampai terjadi perubahan warna cairan dalam labu menjadi hijau bening.
4) Larutan didinginkan lalu ditambah 100 mL air destilasi. Kemudian larutan dimasukkan ke dalam labu takar dan diencerkan dengan akuades sampai volume larutan mencapai 100 mL. Larutan sampel siap untuk didestilasi. Tahap Destilasi
1) Beberapa tetes H2SO4 dimasukkan ke dalam labu, sebelumnya labu diisi
setengahnya dengan Aquades untuk menghindari kontaminasi oleh ammonia lingkungan. Kemudian didihkan selama 10 menit
2) Erlenmeyer diisi 10 mL H2SO4 0.05 N dan ditambahkan 2 tetes indicator
methyl red diletakkan di bawah pipa pembuangan kondensor dengan cara dimiringkan sehingga ujung pipa tenggelam dalam cairan.
3) Sebanyak 5 mL larutan sampel dimasukkan ke dalam tabung destilasi melalui corong yang kemudian dibilas dengan aquades dan ditambahkan 10 mL NaOH 30% lalu dimasukkan melalui corong tersebut dan ditutup. 4) Campuran alkalin dalam labu destilasi disuling menjadi uap air selama 10
menit hingga terjadi pengembunan pada kondensor.
5) Labu erlenmeyer diturunkan hingga ujung pipa kondensor berada di leher labu pada permukaan larutan. Kondensor dibilas dengan aquades selama 1-2 menit.
Tahap Titrasi
1) Larutan hasil destilasi dititrasi dengan larutan NaOH 0,05 N. 2) Volume hasil titrasi lalu dicatat.
3) Prosedur yang sama juga dilakukan pada blanko
Kadar protein = Keterangan:
Vb = volume hasil titrasi blanko (mL) Vs = volume hasil titrasi sampel (mL) S = bobot sampel (g)
* = 1 mL 0,05 NaOh ekuivalen dengan 0,0007 g nitrogen ** = faktor nitrogen
Kadar Lemak
Metode ekstraksi Soxhlet
22
2) Sampel ditimbang sebanyak 3-5 g (A), dan dimasukkan ke dalam selongsong tabung filter dan dimasukkan ke dalam soxhlet dan diletakkan pemberat di atasnya.
3) N-hexan 100-150 mL dimasukkan ke dalam soxhlet hingga selongsong terendam dan sisa N-hexan dimasukkan ke dalam labu.
4) Labu yang telah dihubungkan dengan soxhlet dipanaskan di atas water bath hingga cairan yang merendam sampel di dalam soxhlet berwarna bening.
5) Labu lalu dilepaskan dan tetap dipanaskan hingga N-hexan menguap. 6) Labu dan lemak yang tersisa dipanaskan dalam oven selama 15-60 menit,
kemudian didinginkan dalam desikator selama 15-30 menit dan ditimbang (X2).
Metode Folch
1) Labu silinder dioven terlebih dahulu pada suhu 105oC-110oC selama 1 jam, lalu didinginkan dalam desikator selama 30 menit kemudian ditimbang (X1).
2) Sampel ditimbang sebanyak 2-3 g (A) dan dimasukkan ke dalam gelas homogen dan ditambahkan larutan kloroform/methanol (20 x A), sebagian disisakan untuk membilas pada saat penyaringan.
3) Sampel dihomogenkan selama 5 menit lalu disaring dengan vacuum pump. 4) Sampel yang telah disaring tersebut dimasukkan ke dalam labu pemisah yang telah diberi larutan MgCI2 0,03 N (0,2 x C) lalu dikocok dengan kuat
minimal selama 1 menit kemudian ditutup dengan aluminium foil dan didiamkan selama 1 malam.
5) Lapisan bawah yang terdapat dalam labu pemisah disaring ke dalam labu silinder kemudian dievaporator sampai kering. Sisa kloroform/methanol yang terdapat dalam labu ditiup dengan menggunakan vacuum lalu ditimbang (X2).
23 Lampiran 3 Komposisi mineral dan vitamin pakan
Komposisi mineral (1 kg pakan) terdiri dari CaCL2: 12.46 g, MgSO4.7H2O: 4,06 g, KH2PO4: 14,50 g, NaH2PO4.2H2O: 4,07 g, CuSO4.5H2O: 0,02 g, KIO3: 0,002 g, FeSO4: 0,08 g, MnSO4: 0,01 g, ZnSO4.7H2O: 0,09 g (NRC 2011).
24
RIWAYAT HIDUP
Penulis dilahirkan di Malaysia, pada tanggal 30 Oktober 1989 dari Bapak Malinggang dan Ibu Hafisah. Penulis merupakan anak kedua dari tiga bersaudara (Hasidah dan Abdul Malik). Penulis menyelesaikan pendidikan akademik di SDN 212 Palampeng, SMPN 1 Lappadata, SMAN 1 Sinjai Tengah, dan diterima di UNM melalui jalur PMDK tahun 2008, Jurusan Biologi Sains, Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA), Universitas Negeri Makasar.
Pada tahun 2013 penulis berkesempatan melanjutkan kembali jenjang pendidikan ke Program Pascasarjana pada Program Studi Ilmu Akuakultur Institut Pertanian Bogor melalui program Beasiswa Pendidikan Pascasarjana Dalam Negeri (BPPDN) oleh Direktorat Jenderal Pendidikan Tinggi (DIKTI) Kementrian Pendidikan dan Kebudayaan (KEMENDIKBUD).