LAMA WAKTU PERKEMBANGAN LARVA DAN
POTENSI TUMBUH PASCALARVA UDANG GALAH
LENNY STANSYE SYAFEI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi “Pengaruh Beban Kerja Osmotik Terhadap Kelangsungan Hidup, Lama Waktu Perkembangan Larva dan Potensi Tumbuh Pascalarva Udang Galah”, adalah karya saya sendiri dan belum pernah diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
sungan Hidup, Lama Waktu Perkembangan Larva dan Potensi Tumbuh Pascalarva Udang Galah. Dibimbing oleh RIDWAN AFFANDI, M. SRI SAENI, KARDIYO PRAPTOKARDIYO dan BAMBANG KIRANADI.
LENNY STANSYE SYAFEI. Effect of osmotic load on survival, larval development time, and growth potential of freshwater giant prawn post-larvae. Under the direction of RIDWAN AFFANDI, SRI SAENI, KARDIYO PRAPTOKARDIYO and BAMBANG KIRANADI
©
Hak cipta milik Institut Pertanian Bogor, tahun 2006
Hak cipta dilindungi
LAMA WAKTU PERKEMBANGAN LARVA DAN
POTENSI TUMBUH PASCALARVA UDANG GALAH
LENNY STANSYE SYAFEI
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Ilmu Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama : Lenny Stansye Syafei
NRP : 995134
Disetujui, Komisi Pembimbing
Dr. Ir. Ridwan Affandi Prof. Dr. Ir. Muchammad Sri Saeni, MS Ketua Anggota
Dr. Ir. Kardiyo Praptokardiyo Drs. Bambang Kiranadi, MSc. PhD Anggota Anggota
Diketahui,
Ketua Program Studi Ilmu Perairan Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Enang Harris, MS Dr. Ir. Khairil Anwar Notodiputro, MS
Tidak terbayangkan sebelumnya bahwa penelitian yang terkendala oleh berbagai faktor ini mampu dirampungkan; dan hal ini hanya mungkin terjadi berkat rahmat dan karunia Tuhan YMK. Oleh karenanya, mengawali tulisan ini penulis memanjatkan Puji dan Syukur atas seluruh perkenanNya.
Tulisan ini merupakan hasil penelitian yang diwujudkan dalam bentuk suatu disertasi. Gambaran substansi tulisan meliputi: latar belakang, identifikasi masalah, kerangka pemikiran, perumusan konsepsi, tujuan dan manfaat penelitian; kerangka teoritis yang merangkum pemikiran dasar dan pendalaman suatu teori melalui penelusuran tinjauan pustaka; bahan dan metode sebagai penuntun pelaksanaan penelitian; hasil dan pembahasan; serta kesimpulan.
Bilamana disertasi ini terlihat telah memenuhi kerangka umum sebagaimana layaknya suatu disertasi; dapat penulis sampaikan bahwa hal itu terwujud berkat bimbingan yang terarah dari Komisi Pembimbing: Dr. Ir. Ridwan Affandi, selaku Ketua; dengan anggota: Prof. Dr. Ir. Muchammad Sri Saeni, MS; Dr. Ir. Kardiyo Praptokardiyo serta Drs. Bambang Kiranadi, MSc. PhD. Karena itu, pada kesempatan ini penulis mengucapkan terima kasih yang tulus. Tetapi bilamana masih terdapat kekurangan, pertanda penulis belum mampu menyerap secara utuh bimbingan yang telah diberikan dan karenanya penulis mengharapkan kritik dan saran yang membangun.
Kepada berbagai pihak yang telah memberikan bantuan dan dukungan, mulai dari perencanaan, persiapan, pelaksanaan, pengolahan data serta perampungan penulisan penelitian ini, penulis menyampaikan penghargaan dan ucapan terima kasih.
Semoga disertasi ini bermanfaat.
Bogor, Agustus 2006
Penulis dilahirkan di Ujung Pandang pada tanggal 29 September 1952 sebagai anak terakhir dari enam orang anak pasangan M. Syafei Dg Mambani (almarhum) dan Chatarina Johana Jonas (almarhumah). Pendidikan sarjana ditempuh di Program Studi Budidaya Perairan, Fakultas Perikanan IPB, lulus pada tahun 1979. Pada tahun 1987, penulis diterima sebagai mahasiswa program magister sain pada Program Studi Ilmu Perairan, Program Pascasarjana IPB dan menamatkannya pada tahun 1990. Beasiswa pendidikan magister sain diperoleh dari Departemen Pertanian Republik Indonesia. Kesempatan untuk melanjutkan studi untuk program doktor pada perguruan tinggi dan program studi yang sama diperoleh pada tahun 1999.
Penulis bekerja sebagai Tenaga Pengajar sejak tahun 1981 dan ditempatkan di Sekolah Tinggi Penyuluhan Pertanian Bogor; Jurusan Penyuluhan Perikanan. Selama menjadi Tenaga Pengajar, penulis juga ditugaskan pada institusi pendidikan tersebut sebagai Kepala Unit Penelitian dan Pengabdian kepada Masyarakat antara tahun 1985-1987. Kemudian pada tahun 1989-1990, penulis ditugaskan sebagai Kepala Pusat Pengkajian dan Penerapan Teknologi Perikanan pada institusi pendidikan yang sama.
Halaman
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... v
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1
Latar Belakang ... 1
Identifikasi Masalah ... 3
Tujuan dan Manfaat Penelitian ... 6
Kerangka Pemikiran ... 6
Konsep Pemecahan Masalah ... 6
Prinsip Dasar ... 8
Faktor Penentu ... 9
Perumusan Konsepsi ... 9
Hipotesis... 9
TINJAUAN PUSTAKA ... 10
Karateristik Media... 10
Kapasitas Regulasi Osmotik ... 14
Perkembangan Stadia ... 19
Pertumbuhan Pascalarva ... 21
METODOLOGI ... 26
Percobaan Pengaruh Beban Kerja Osmotik Terhadap Perkembangan Larva Tahap Awal dan Tahap Lanjut ... 29
Tujuan Percobaan ... 29
Metode dan Disain Rancangan Percobaan ... 29
Variabel yang Dipantau dan Variabel Kerja ... 32
Bahan, Alat, Metode dan Pelaksanaan Percobaan ... 34
Teknik Pengumpulan Data ... 42
Analisis Data ... 44
Percobaan Pengaruh Beban Kerja Osmotik Terhadap Laju Konsumsi Oksigen Larva Udang Galah ... 45
Tujuan Percobaan ... 45
Metode dan Disain Rancangan Percobaan ... 45
Variabel yang Dipantau dan Variabel Kerja ... 48
Teknik Pengumpulan Data ... 51
Analisis Data ... 51
Percobaan Pengaruh Beban Kerja Osmotik Terhadap Potensi Tumbuh Pascalarva Udang Galah ... 53
Tujuan Percobaan ... 53
Metode dan Disain Rancangan Percobaan ... 53
Variabel yang Dipantau dan Variabel Kerja ... 54
Bahan, Alat, Metode dan Pelaksanaan Percobaan ... 55
Teknik Pengumpulan Data ... 57
Analisis Data ... 58
HASIL PENELITIAN... 59
Kondisi Kualitas Air ... 59
Kualitas Air pada Tahap Eksplorasi... 59
Kualitas Air pada Tahap Adaptasi dan Perkembangan Akhir 62
Kemampuan Regulasi dan Beban Osmotik ... 65
Perkembangan Larva... 70
Lama Waktu Perkembangan Stadia ... 71
Lama Waktu Keberadaan Stadia... 79
Produksi Kelimpahan Larva... 81
Sintasan dan Laju Kematian... 81
Produksi Kelimpahan ... 82
Potensi Pertumbuhan... 83
Potensi Pertumbuhan Larva ... 83
Tingkat Konsumsi Pakan Harian ... 83
Tingkat Konsumsi Oksigen... 85
Potensi Tumbuh Larva ... 87
Potensi Pertumbuhan Pascalarva ... 90
Tingkat Konsumsi Pakan Harian ... 90
Tingkat Konsumsi Oksigen... 91
Potensi Tumbuh Pascalarva ... 92
PEMBAHASAN ... 97
Hubungan antara Lama Waktu Perkembangan Larva, Sintasan dengan Beban Kerja Osmotik ... 97
Hubungan antara Potensi Pertumbuhan dengan Beban Kerja Osmotik serta Dampak Lanjut terhadap Potensi Pertumbuhan Pascalarva ... 103
SIMPULAN DAN SARAN ... 111
DAFTAR PUSTAKA ... 113
Halaman
1. Tahap Perkembangan Larva sampai Pascalarva Udang Galah... 21 2. Komposisi Pakan Buatan untuk Mendukung Pertumbuhan
Pascalarva Macrobrachium rosenbergii …... 25 3. Parameter Kualitas Air dan Metoda Peneraan yang Digunakan... 36 4. Perkiraan Jumlah Air Laut dan Tawar Terpakai pada Percobaan.... 41 5. Jadual Pemberian Pakan Harian Berdasarkan Stadia Larva………. 42 6. Rataan dan Simpangan Baku Parameter Fisika-Kimia Air serta
Tolok Ukur setiap Perlakuan pada Sistem Produksi Tahap
Eksplorasi... 59 7. Rataan dan Simpangan Baku Parameter Fisika-Kimia Air serta
Tolok Ukur pada Sistem Produksi Tahap Adaptasi dan Tahap
Perkembangan Akhir... 63 8. Kemampuan Regulasi Osmotik (OH/OM) Larva Udang Galah
setiap Perlakuan pada Tahap Eksploratif, Adaptasi dan
Perkembangan Akhir... 66 9. Beban Kerja Osmotik [1-(OH/OM)] Larva Udang Galah setiap
Perlakuan pada Tahap Eksploratif, Adaptasi dan Perkembangan
Akhir... 68 10. Deskripsi Tahapan Perkembangan Larva sampai dengan
Pascalarva Udang Galah selama Penelitian... 71 11. Lama Waktu Perkembangan Stadia Larva Udang Galah setiap
Perlakuan... 71 12. Lama Waktu Keberadaan Stadia Larva Udang Galah setiap
Perlakuan... 79 13. Tampilan Kondisi Rekrutmen, Lost dan Sintasan Larva Udang
Galah pada Tahap Eksplorasi, Adaptasi dan Perkembangan Akhir
Setiap Perlakuan... 82 14. Produksi Larva dan Pascalarva Udang Galah pada Akhir Sistem
Produksi Tahap Potensi Tumbuh PL ... 82 15. Tingkat Konsumsi Energi Pakan Harian (Artemia salina) Larva
setiap perlakuan pada tahap eksploratif, adaptasi dan
16. Konsumsi Energi Basal per Bobot Larva Udang Galah setiap Perlakuan pada Tahap Eksploratif, Adaptasi dan Perkembangan
Akhir... 85 17. Konsumsi Energi Basal Larva Udang Galah (kalori /larva per hari)
setiap Perlakuan ... 87 18. Potensi tumbuh larva udang galah (kalori /larva per hari) setiap
perlakuan... 87 19. Tampilan Aktual Bobot Larva Udang Galah setiap Perlakuan pada
Tahap Eksploratif, Adaptasi dan Perkembangan Akhir... 88 20. Tingkat Konsumsi Energi Pakan Harian (Daphnia sp.) Pascalarva
sebagai Respon dari Perlakuan Tekanan Osmotik saat
Pemeliharaan Larva... 91 21. Konsumsi Energi Basal Pascalarva Udang Galah sebagai Respon
dari Perlakuan Tekanan Osmotik saat Pemeliharaan Larva... 92 22. Konsumsi Energi Basal Pascalarva Udang Galah (kalori /PL per
hari) sebagai Respon dari Perlakuan Tekanan Osmotik ... 92 23. Potensi Tumbuh Pascalarva Udang Galah (kalori /PL per hari)
sebagai Respon dari Perlakuan Tekanan Osmotik... 93 24. Tampilan Aktual Pertambahan Bobot Pascalarva Udang Galah
Setiap Perlakuan... 93 25. Sintasan Pascalarva Udang Galah pada Akhir Percobaan Setiap
Perlakuan... 95 26. Kompilasi Nilai Rataan Variabel Kerja pada Tahap Eksploratif…. 100 27. Kompilasi Nilai Rataan Variabel Kerja pada Tahap Adaptasi…… 101 28. Kompilasi Nilai Rataan Variabel Kerja pada Tahap Perkembangan
Akhir………. 102
29. Kompilasi Nilai Rataan Variabel Kerja untuk Potensi Tumbuh
pada Tahap Eksploratif……....………. 104 30. Kompilasi Nilai Rataan Variabel Kerja untuk Potensi Tumbuh
pada Tahap Adaptasi………….……...………... 106 31. Kompilasi Nilai Rataan Variabel Kerja untuk Potensi Tumbuh
pada Tahap Perkembangan Akhir……….………… 107 32. Kompilasi Nilai Rataan Variabel Kerja untuk Potensi
Tumbuh PL-1... 109
33. Kompilasi Nilai Rataan Variabel Kerja untuk Potensi
Tumbuh PL-7……… 109
34. Kompilasi Nilai Rataan Variabel Kerja untuk Potensi
Tumbuh PL-14………... 110
Halaman
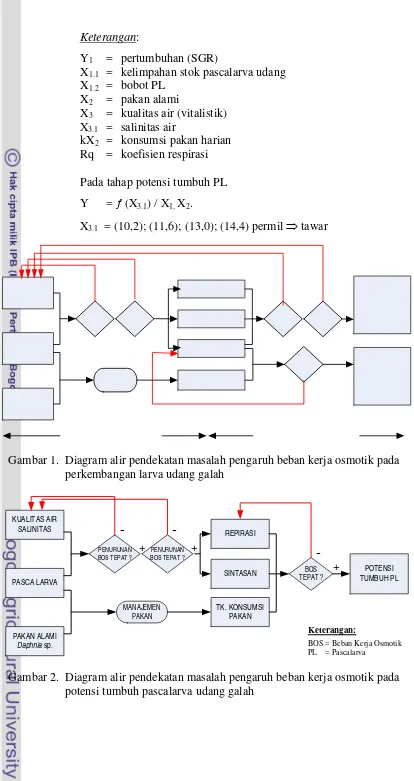
1. Diagram Alir Pendekatan Masalah Pengaruh Beban Kerja Osmotik
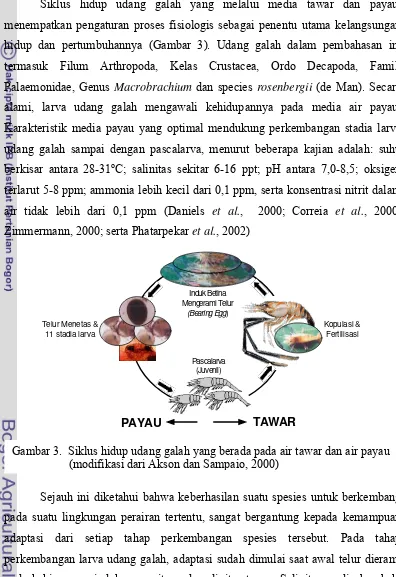
pada Perkembangan Larva Udang Galah... 5 2. Diagram Alir Pendekatan Masalah Pengaruh Beban Kerja Osmotik
pada Potensi Tumbuh Pascalarva Udang Galah... 5 3. Siklus Hidup Udang Galah yang Berada pada Air Tawar dan Air
Payau (modifikasi dari Akson dan Sampaio, 2000)………. 10 4. Grafik Osmotik Krustase Tipikal Osmokonformer dan Osmoregulator
(Sumber: Anonimous, 1997)... 16 5. Ilustrasi Mekanisme Kerja Pompa Natrium-Kalium Organisme Air
Tawar (Sumber: Anonimous, 2003)……….... 17 6. Perubahan Aktivitas Enzim Na+/K+-ATPase selama Periode
Metamorfosa Larva Macrobrachium rosenbergii Menjadi Pascalarva (Huong et al, 2004) ... 19 7. Proses Perkembangan Telur Udang Galah sampai Fase Embrionik
(Sumber: Romanova, 2000)... 20 8. Grafik Pertumbuhan Pascalarva Macrobrachium rosenbergii pada
Berbagai Nilai pH Media (Sumber: Chen dan Chen, 2003)... 23 9. Tampilan Perubahan Osmolalitas Hemolymph Macrobrachium
rosenbergii pada Beberapa Konsentrasi Kelarutan Oksigen Media
(Cheng et al., 2003)... 24 10. Mekanisme Runut Kegiatan Penelitian pada Sistem Produksi dari
Tahap Perkembangan Larva sampai Tahap Potensi Tumbuh
Pascalarva... 27 11. Pola Perlakuan Perubahan Salinitas Media pada Sistem Produksi
Tahap Perkembangan Larva dan Tahap Potensi Tumbuh Pascalarva... 28 12. Wadah Percobaan dalam Bentuk Akuarium berukuran (40x80x30)cm 31 13. Bagan Penempatan Satuan Percobaan yang Dilakukan secara Acak.... 31 14. Deskripsi Perkembangan Stadia Larva Udang Galah (Sumber: Uno
17. Visualisasi Instrumen Konsumsi Oksigen yang Digunakan... 47
18. Rincian Percobaan Pengukuran Respirasi Larva... 49
19. Tahapan Pengukuran Tekanan Osmotik Larva Udang Galah ... 51
20. Visualisasi Tahapan Pengukuran Tekanan Osmotik Larva... 51
21. Beban Kerja Osmotik Larva Udang Galah tiap Perlakuan pada Tahap Eksploratif, Adaptasi dan Perkembangan Akhir………... 69
22. Kondisi Keragaman Stadia Larva Udang Galah pada Tahap Eksploratif……… 72
23. Hubungan Lama Waktu Perkembangan Stadia dengan Beban Osmotik pada Tahap Eksplorasi... 75
24. Hubungan Lama Waktu Perkembangan Stadia dengan Beban Osmotik Pada Tahap Adaptasi ... 76
25. Hubungan Lama Waktu Perkembangan Stadia dengan Beban Osmotik Pada Tahap Perkembangan Akhir ... 77
26. Pola Konsumsi Energi Pakan Harian Larva Udang Galah Setiap Perlakuan pada Tahap Eksploratif, Adaptasi dan Perkembangan Akhir………... 84
27. Pola Energi Basal Udang Galah Setiap Perlakuan Pada Tahap Eksploratif dan Tahap Adaptasi ……... 86
28. Kurva Pertumbuhan Pascalarva sebagai Respon dari Perlakuan Tekanan Osmotik saat Pemeliharaan Larva……… 94
Halaman
1. Nilai Parameter Kualitas Air setiap Perlakuan selama Penelitian...
120
2. Kemampuan Regulasi Osmotik (OH/OM) Larva Udang Galah
setiap Perlakuan selama Penelitian... 123 3. Hasil Analisis Keragaman Kemampuan Regulasi Osmotik Larva
setiap Perlakuan selama Penelitian...…... 124 4. Beban Kerja Osmotik [1-(OH/OM)] Larva Udang Galah setiap
Perlakuan selama Penelitian... 126 5. Hasil Analisis Keragaman Beban Kerja Osmotik Larva setiap
Perlakuan selama Penelitian... 127 6. Visualisasi Tahap Perkembangan Larva sampai Pascalarva Udang
Galah... 129 7. Lama Waktu Perkembangan Stadia Larva sampai Pasca Larva
Udang Galah setiap Perlakuan selama Penelitian... 130 8. Hasil Analisis Keragaman Lama Waktu Perkembangan Stadia Larva
sampai Pasca Larva Udang Galah setiap Perlakuan selama Penelitian 131 9. Lama Waktu Keberadaan Stadia Larva sampai Pasca Larva Udang
Galah setiap Perlakuan selama Penelitian... 137 10. Hasil Analisis Keragaman Lama Waktu Keberadaan Stadia Larva
sampai Pasca Larva Udang Galah setiap Perlakuan selama
Penelitian... 139 11. Hasil Perhitungan Rekrutmen, Lost dan Sintasan Larva Udang Galah
setiap Perlakuan selama Penelitian ... 145 12. Hasil Analisis Keragaman Perhitungan Rekrutmen, Lost dan
Sintasan Larva Udang Galah setiap Perlakuan selama Penelitian... 148 13. Hasil Pengukuran Produksi Larva dan Pascalarva Udang Galah pada
Akhir Sistem I dan II ………..………. 150 14. Hasil Analisis Keragaman Produksi larva dan Pascalarva Udang
15. Tingkat Konsumsi Energi Pakan Harian (Artemia salina) Larva (kalori/larva/hari) setiap Perlakuan pada Tahap Eksploratif,
Adaptasi dan Perkembangan Akhir ... 154 16. Hasil Analisis Keragaman Tingkat Konsumsi Energi Pakan harian
(Artemia salina) Larva (Kalori/larva/hari) setiap Perlakuan pada
Tahap Eskploratif, Adaptasi dan Perkembangan Akhir... 155 17. Konsumsi Oksigen Basal per Bobot Larva Udang Galah Setiap
Perlakuan pada Tahap Eksploratif, Adaptasi dan Perkembangan Akhir (kalori O2/mg per bobot basah larva per jam) (a s/d g) ...
157 18. Hasil Analisis Keragaman Pengukuran Konsumsi Oksigen Larva
Udang Galah Setiap Perlakuan Selama Penelitian (a s/d b) ... 163 19. Potensi tumbuh larva udang galah setiap perlakuan (kalori /mg
bobot larva per hari) ... 167 20. Hasil Analisis Keragaman Potensi Tumbuh Larva Udang Galah
Setiap Perlakuan ...
168 21. Hasil pengukuran Bobot Stadia Larva antar Perlakuan Selama
Penelitian ... 170 22. Hasil Analisis Keragaman Bobot Stadia Larva antar Perlakuan
selama Penelitian ………..………... 171 23. Tingkat Konsumsi Energi Pakan Harian (Daphnia sp.) Pascalarva
sebagai Respon dari Perlakuan Tekanan Osmotik saat Pemeliharaan Larva………...
173 24. Hasil Analisis Keragaman Tingkat Konsumsi Energi Pakan Harian
(Daphnia sp.) Pascalarva setiap Perlakuan selama Penelitian... 174 25. Konsumsi Oksigen Basal Pascalarva Udang Galah sebagai Respon
dari Perlakuan Tekanan Osmotik saat Pemeliharaan Larva (mg/l per mg bobot basah PL) (a s/d g) ...
176 26. Hasil Analisis Keragaman Pengukuran Konsumsi Energi Oksigen
Pascalarva Udang Galah setiap Perlakuan selama Penelitian ... 183 27. Potensi Tumbuh Pascalarva Udang Galah setiap Perlakuan
(kalori/mg bobot PL per hari) ... 187 28. Hasil Analisis Keragaman Potensi Tumbuh Pascalarva Udang
Galah setiap Perlakuan... 188
29. Hasil pengukuran Bobot (aktual) Pascalarva antar Perlakuan
selama Penelitian ... 190 30. Hasil analisis keragaman bobot (aktual) pascalarva antar perlakuan
selama penelitian ... ... 191
Latar Belakang
Udang galah, Macrobrachium rosenbergii de Man adalah jenis udang yang hidup di perairan tawar. Udang ini merupakan udang dengan ukuran terbesar dalam famili Palaemonidae, dan bernilai ekonomis penting sehingga menarik banyak kalangan untuk melakukan budidaya.
Sejauh ini budidaya udang galah mulai marak dilaksanakan di kalangan pembudidaya, baik dalam skala kecil berkelompok maupun dalam skala menengah. Aplikasi teknologi budidayanya yang terjangkau, sederhana dan tepat-guna sejak dari sekuensi pembenihan sampai ke pembesaran, menjadikan komoditas ini sebagai pilihan alternatif yang berdaya saing. Oleh karena itu, melalui berbagai upaya dicoba untuk dikembangkan dalam skala besar; sehingga pada beberapa tahun terakhir ini, udang galah mulai diperhitungkan sebagai komoditas unggulan yang memberi harapan bagi masa depan perikanan budidaya. Selaku komoditas unggulan penting, bagi pembangunan perekonomian Indonesia, kekuatan utama berusaha di bidang ini adalah tergolong komoditas yang ditangani rakyat banyak. Dengan demikian, upaya pengembangan budidaya udang galah akan memberikan dampak yang besar dan positif bagi perekonomian rakyat. Terlebih bila diingat bahwa budidaya udang galah dapat dilakukan dalam skala kecil bahkan mikro.
secara nyata, terutama di Asia, serta di Amerika Utara dan Amerika Selatan. Tercatat selama 10 tahun terakhir (1992-2001) produksi dunia udang galah hasil budidaya meningkat dari sekitar 40.000 mt (metriks ton) menjadi sekitar 215.000 mt atau meningkat sekitar lima kali (New, 2002; New, 2005).
Peningkatan produksi udang galah memang harus terus diupayakan mengingat permintaan pasar terus meningkat. Upaya peningkatan melalui penangkapan udang dalam jangka panjang tidak dapat diandalkan. Terdapat kaidah umum bahwa pada batas tertentu hasil tangkapan yang terus ditingkatkan akan menurunkan potensi reproduktif udang, karena keterbatasan stok udang dewasa. Belum lagi hal tersebut ditambah adanya kerusakan lingkungan di habitat alami udang galah karena kegiatan antropogenik. Jawaban dari persoalan ini adalah peningkatan produksi melalui budidaya. Namun di pihak lain, selama ini produksi usaha pembesaran udang galah masih rendah, akibat kendala terbatasnya ketersediaan kualitas dan kuantitas benih. Upaya-upaya penyediaan benih telah dilakukan dengan penyediaan panti-panti pembenihan.
Kegiatan panti pembenihan udang galah di Indonesia telah dimulai sejak awal tahun 1970-an. Selama kurun waktu itu, telah banyak penguasaan teknologi pembenihan udang galah diterapkan; dua di antaranya adalah ketersediaan induk melalui pematangan gonad serta pengadaan pakan alami. Pada teknologi perawatan larva, khususnya manajemen kualitas air dan pengaturan salinitas, masih didasarkan atas pengalaman empirikal yang bersifat eksplorasi agar sesuai dengan kondisi alami. Sebagaimana siklus hidup di alam, larva udang galah memulai tahapan hidupnya di muara sungai saat menetas dari telur dengan kondisi media berair payau. Secara bertahap, larva udang galah melewati seluruh tahapan stadianya yang berjumlah sebelas stadia pada air payau dan saat pascalarva, juvenil muda ini mulai beruaya ke arah hulu sungai untuk hidup, tumbuh dan berkembang di perairan tawar. Dengan masih adanya fluktuasi penguasaan teknologi pengelolaan pengaturan salinitas air, produksi larva masih labil.
lingkungan yang mempengaruhi perkembangan larva, pertumbuhan dan kelangsungan hidup udang galah. Penelitian yang dilakukan oleh Shinn-Pyng et al. (2005) serta Al-Harbi dan Uddin (2004), menunjukkan bahwa terdapat sejumlah penyebab tingginya mortalitas pada pembenihan udang galah, baik karena senyawa kimia di perairan; penyakit mikrobal; maupun karena kemampuan regulasi ionik terhadap perubahan salinitas media. Namun penelitian lebih ditujukan pada ukuran juvenil dan pada ukuran dewasa (Wilder et al., 1998 dan Huong et al., 2001). Sejauh ini meski kondisi perkembangan awal (early development) sangat menentukan bagi perkembangan/pertumbuhan selanjutnya, namun penelitian dan percobaan tentang bagaimana kondisi larva berkaitan dengan salinitas belum dilakukan,
Sehubungan dengan masalah tersebut, maka dipertimbangkan perlu dilakukan pengkajian pengaruh beban kerja osmotik terhadap kelangsungan hidup, perkembangan dan pertumbuhan larva udang galah yang dipelihara pada media dengan kondisi kualitas air yang layak serta dukungan pemberian pakan yang memadai.
Identifikasi Masalah
Hasil kelimpahan dan potensi tumbuh pascalarva (PL) berdasarkan aplikasi dari usaha pembenihan udang galah ternyata belum mencapai target yang diharapkan. Kondisi PL yang belum mencapai target tersebut di atas, terjadi berkenaan dengan lambatnya perkembangan larva yang diikuti oleh mortalitas dan respirasi yang meningkat. Lama waktu perkembangan dan sintasan dari stadia larva tersebut menjadi penentu tingkat keberhasilan perkembangan larva menjadi PL.
beban osmotik larva yang mendadak sehingga potensial menghambat proses metamorfosis, berakibat lanjut pada kematian.
Untuk mengatasi masalah tersebut, pengaturan salinitas media pemeliharaan larva dilakukan secara bertahap sesuai dengan kemampuan kerja regulasi osmotik larva, melalui penerapan prinsip adaptasi. Selain pengatur salinitas media tersebut, larva udang diberi pakan alami yang bermutu serta kualitas air yang diupayakan mantap layak bagi kelangsungan hidup larva. Diagram alir permasalahan perkembangan larva dapat dilihat pada Gambar 1 dan diagram alir permasalahan potensi tumbuh pascalarva dapat dilihat pada Gambar 2. Berdasarkan kontinyuitas sistem dengan adanya perubahan salinitas media, maka secara matematis fungsi produksi dari penerapan sistem teknologi pembenihan udang galah adalah sebagai berikut:
Tahap perkembangan larva
Y1 = ƒ (X1, X2, X3) Y2 = ƒ (X3.1, X3.2 ) / X1, X2
Proses Biologis: Y1.1(respirasi) = ƒ (X3.1)
Keterangan:
Y1 = lama waktu perkembangan stadia survival setiap stadia Y2 = sintasan ditentukan Y1
X1 = stok larva udang X2 = pakan alami X3.1 = salinitas
X3.2 = kualitas air (vitalistik) Pada tahap eksplorasi:
Y = ƒ (X3.1, X3.2) / X1, X2
X3.1 = (6,0) ⇒ (10,2); (11,6); (13,0); (14,4) per mil Pada tahap adaptasi dan perkembangan akhir: Y = ƒ (X3.1, X3.2) / X1, X2
X3.1 = (10,2); (11,6); (13,0); (14,4) per mil; salinitas statis Tahap potensi tumbuh pascalarva
Y1 = ƒ (X1.1, X1.2, X2, X3)
Keterangan:
Y1 = pertumbuhan (SGR)
X1.1 = kelimpahan stok pascalarva udang X1.2 = bobot PL
X2 = pakan alami
X3 = kualitas air (vitalistik) X3.1 = salinitas air
kX2 = konsumsi pakan harian Rq = koefisien respirasi
Pada tahap potensi tumbuh PL Y = ƒ (X3.1) / X1, X2.
X3.1 = (10,2); (11,6); (13,0); (14,4) permil ⇒ tawar
Gambar 1. Diagram alir pendekatan masalah pengaruh beban kerja osmotik pada perkembangan larva udang galah
Gambar 2. Diagram alir pendekatan masalah pengaruh beban kerja osmotik pada potensi tumbuh pascalarva udang galah
KUALITAS AIR SALINITAS
PASCA LARVA
PAKAN ALAMI
Daphnia sp.
PENURUNAN BOS TEPAT ?
MANAJEMEN PAKAN
REPIRASI
SINTASAN
TK. KONSUMSI PAKAN PENURUNAN
BOS TEPAT ?
BOS TEPAT ?
+ +
+
-POTENSI TUMBUH PL
Keterangan:
Tujuan dan Manfaat Penelitian
Penelitian pengaruh beban kerja osmotik terhadap perkembangan dan pertumbuhan udang galah bertujuan untuk memahami perilaku osmotik yang potensial berperan bagi keberhasilan kelangsungan hidup, perkembangan larva dan potensi tumbuh pascalarva udang galah.
Manfaat pengkajian pengaruh beban kerja osmotik udang galah ini berupa rekomendasi terhadap perbaikan paket teknologi yang dilakukan di panti pembenihan udang galah, khususnya manajemen pengaturan salinitas media. Untuk selanjutnya, konsep teknologi baru yang dihasilkan dapat dimasyarakatkan. Diharapkan penelitian ini dapat berfungsi sebagai upaya pengembangan teknologi baru dalam menerapkan dan menciptakan rekayasa kualitas lingkungan pada bidang pembenihan udang galah.
Kerangka Pemikiran
Konsep Pemecahan Masalah
Keberhasilan perkembangan larva, tercermin dari lama waktu perkembangan dan sintasan stadia larva udang galah. Hal ini juga ditentukan oleh kelayakan kualitas air, beban osmotik larva serta energi dan materi bagi proses metamorfosis dan pertumbuhan larva. Apabila beban kerja osmotik besar, maka jumlah energi materi yang dipergunakan untuk memenuhi kebutuhan energi bagi metabolisme, respirasi dan atau pertukaran ionik osmotik menjadi mengecil. Sehubungan dengan kerangka pemecahan tersebut, maka diajukan suatu konsep pemecahan masalah yaitu meminimalkan beban keja osmotik larva agar sebagian besar energi dan materi dari pakan yang dicerna dan diabsorbsi dapat dimanfaatkan bagi perkembangan dan pertumbuahan stadia larva.
isoosmotik, maka kebutuhan energi yang digunakan dalam regulasi ionik relatif rendah. Lebih lanjut diharapkan, akan tersedia lebih banyak energi untuk perkembangan larva serta pertumbuhan pascalarva udang galah. Pada kondisi hiperosmotik atau hipoosmotik, lama waktu terjadinya tekanan dapat mengakibatkan rentannya kepekaan larva maupun juvenil terhadap perubahan lingkungan. Untuk memahami antiseden-konsekuensi serta memecahkan masalah pengaturan salinitas media sebagai penentu beban kerja osmotik larva udang galah, perlu dilakukan pendekatan masalah terhadap sistem produksi akuakultur dan kausal-komparatif-kondisional, sebagai berikut:
(1) Sistem produksi akuakultur. Berdasarkan pola pengaturan salinitas media pada panti-panti pembenihan udang galah serta kesamaan penggunaan input, maka pengkajian dilakukan terhadap dua sistem produksi, yaitu:
- Sistem produksi larva tahap awal dan tahap lanjut
Penetasan telur dilakukan pada media 6 ppt. Pemeliharaan larva stadia 1 sampai dengan stadia 11, berada pada tiga tahapan. Tahap eksplorasi, yaitu saat dilakukan perubahan salinitas media dari 6 ppt menjadi 10,2; 11,6; 13; dan 14,4 ppt selama 7 hari. Tahap adaptasi dan perkembangan akhir, yaitu media berada dalam keadaan statis pada salinitas 10,2; 11,6; 13; dan 14,4 ppt. Pakan yang diberikan selama percobaan ini adalah pakan alami Artemia sp.
- Sistem produksi pascalarva
Tampilan potensi tumbuh pascalarva sebagai dampak lanjut perubahan salinitas media, dipantau melalui respon potensi tumbuh pada pola penurunan salinitas masing-masing dari salinitas 10,2; 11,6; 13; dan 14,4 ppt, menjadi 0 ppt selama 7 hari. Pakan yang diberikan pada percobaan ini adalah pakan alami Daphnia sp.
Untuk pendekatan kausal-komparatif, dirancang suatu penelitian guna membandingkan output sebagai konsekuensi adanya hubungan sebab-akibat (kausal). Sumber penyebab ditetapkan salinitas media pada setiap sistem produksi tersebut. Pengupayaan salinitas media bertingkat tersebut dimaksudkan sebagai faktor penentu output. Salinitas media diarahkan agar dapat menciptakan kondisi hiperosmotik, hipoosmotik dan isoosmotik terhadap tekanan osmotik cairan tubuh udang. Berdasarkan konsepsi tersebut di atas, maka pada pendekatan kausal-komparatif-kondisional dievaluasi melalui dua pendekatan, yaitu: (1) kajian pengaruh beban kerja osmotik pada kelangsungan hidup dan perkembangan larva mulai dari larva awal sampai dengan larva tahap lanjut, dan (2) kajian pengaruh beban kerja osmotik pada tampilan potensi tumbuh pascalarva yang dihasilkan dari larva yang diadaptasi pada berbagai salinitas.
Prinsip Dasar
Prinsip dasar yang menjadi landasan penentuan dalam peramalan, penerapan serta pengendalian sistem pembenihan udang galah ini dilihat dari permasalahan yang ada dapat dikelompokkan pada dua hal, yaitu adaptasi dan efisiensi pemanfaatanenergi pakan.
Prinsip adaptasi dilakukan dengan meminimalisasi stres melalui cara penyediaan media isoosmotik yang didukung dengan kualitas air yang layak. Dari sini, diharapkan akan diperoleh kelangsungan hidup dan perkembangan larva udang yang cukup tinggi. Penggunaan prinsip efisiensi pemanfaatan energi pakan, dilakukan dengan menetapkan kesesuaian pakan/kebutuhan pakan. Peramalan yang akan terjadi dengan prinsip ini adalah membatasi kehilangan energi akibat kegiatan respirasi pada tingkat seluler. Dengan demikian maka yang terjadi adalah:
jika isoosmotik ⇒ d regulasi ionik / dt <∑ energi / dt jika isoosmotik ⇒ dw/dt = (PR) – (T) – (E)
Faktor Penentu
Kualitas larva, kualitas air, pengaturan salinitas, beban kerja osmotik, pengelolaan pakan sesuai dengan perkembangan larva, serta sintesis kerangka teori yang dikembangkan.
Perumusan Konsepsi
Meminimalkan beban kerja osmotik larva melalui penerapan prinsip adaptasi dan efisiensi agar sebagian besar energi dan materi dipergunakan untuk menunjang proses metamorfosis dan pertumbuhan.
Hipotesis
Karakteristik Media
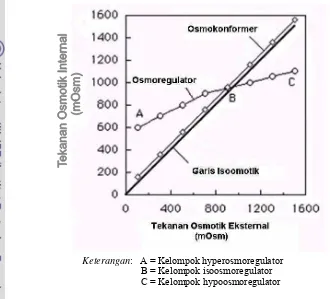
Siklus hidup udang galah yang melalui media tawar dan payau,
menempatkan pengaturan proses fisiologis sebagai penentu utama kelangsungan
hidup dan pertumbuhannya (Gambar 3). Udang galah dalam pembahasan ini
termasuk Filum Arthropoda, Kelas Crustacea, Ordo Decapoda, Famili
Palaemonidae, Genus Macrobrachium dan species rosenbergii (de Man). Secara
alami, larva udang galah mengawali kehidupannya pada media air payau.
Karakteristik media payau yang optimal mendukung perkembangan stadia larva
udang galah sampai dengan pascalarva, menurut beberapa kajian adalah: suhu
berkisar antara 28-31oC; salinitas sekitar 6-16 ppt; pH antara 7,0-8,5; oksigen
terlarut 5-8 ppm; ammonia lebih kecil dari 0,1 ppm, serta konsentrasi nitrit dalam
air tidak lebih dari 0,1 ppm (Daniels et al., 2000; Correia et al., 2000;
Zimmermann, 2000; serta Phatarpekar et al., 2002)
Kopulasi & Fertilisasi Induk Betina
Mengerami Telur (Bearing Egg) Telur Menetas &
11 stadia larva
Pascalarva (Juvenil)
TAWAR PAYAU
Gambar 3. Siklus hidup udang galah yang berada pada air tawar dan air payau (modifikasi dari Akson dan Sampaio, 2000)
Sejauh ini diketahui bahwa keberhasilan suatu spesies untuk berkembang
pada suatu lingkungan perairan tertentu, sangat bergantung kepada kemampuan
adaptasi dari setiap tahap perkembangan spesies tersebut. Pada tahap
perkembangan larva udang galah, adaptasi sudah dimulai saat awal telur dierami
pada saat memasuki perairan payau, tepatnya pada saat telur menetas. Proses
adaptasi pada kondisi ini merupakan tahapan yang paling sensitif dan kompleks
dalam siklus hidup larva udang galah. Tingkat kompleksitas pengaturan salinitas
media semakin tinggi, bila pemeliharaan larva dilakukan pada unit pembenihan
dengan manajemen pakan alami, Artemia salina. Agar Artemia salina sebagai
pakan alami masih dapat bertahan hidup untuk beberapa saat, dibutuhkan kisaran
salinitas dan suhu tertentu. Menurut Ritar et al. (2002), kista Artemia salina dapat
ditetaskan dengan baik pada salinitas 33-35 ppt dengan suhu optimum 25-28 oC.
Karenanya diperlukan kombinasi terbaik antara salinitas dan suhu media yang
merupakan faktor abiotik penting dalam mendukung pertumbuhan larva udang
galah dan memaksimalkan kemampuannya untuk hidup dan berkembang secara
optimal.
Menurut Spivak (2000), kondisi optimal yang dibutuhkan untuk
mendukung pertumbuhan tiap spesies sangat spesifik dan juga berbeda pada setiap
tahap dari siklus hidupnya. Hal ini terlihat pada stadia nauplius dari Penaeus
merguensis yang memperlihatkan toleransi lebih rendah terhadap perubahan
salinitas dibanding pada stadia mysis (Zacharia dan Kakati, 2004; serta Kumlu et
al., 2000). Sementara hasil kajian Phatarpekar et al. (2002), memperlihatkan
bahwa larva udang galah stadia-1 berkembang dengan optimum pada salinitas 7
ppt dan suhu 30oC. Pada stadia-2 sampai stadia-4, berkembang dengan optimum
pada salinitas 12 ppt dan suhu 31oC. Kondisi salinitas sekitar 12 ppt tetap optimal
sampai dengan pascalarva, dengan suhu media menurun pada nilai 30oC.
Mengikuti saran Zimmermann (2000), kombinasi antara salinitas dengan suhu
untuk pemeliharaan larva udang galah dengan pakan Artemia salina, adalah:
salinitas 6 ppt saat penetasan telur dan suhu media selama pemeliharaan pada
kisaran 28-30oC, dengan salinitas lebih besar dari 10 ppt. Sedangkan Valenti dan
Daniels (2000) menyatakan bahwa untuk pemeliharaan larva udang galah pada
unit pembenihan dengan air payau buatan, diharapkan salinitas berkisar antara
12-16 ppt dengan suhu di bawah 33oC. Hal ini terkait dengan kandungan garam yang
seharusnya ada dalam perbandingan memadai, sedangkan suhu di atas 33oC dapat
yang dapat digunakan pada pemeliharaan larva sejak penetasan telur adalah
28-31oC dengan kisaran salinitas 6 ppt sampai16 ppt.
Perolehan nilai kelarutan oksigen saturasi secara teoritis dengan
menggunakan formula Knudsen, didapatkan nilai kelarutan oksigen antara 7,0
ppm sampai dengan 7,5 ppm; untuk media dengan suhu minimal 28 dan maksimal
31oC serta pada salinitas 16 ppt. Berdasarkan proses yang sama, terlihat
kecenderungan terjadinya penurunan kelarutan oksigen saturasi dengan naiknya
suhu dan salinitas media. Pengaruh perubahan suhu terhadap kelarutan oksigen
saturasi dalam air jauh lebih besar, dibanding pengaruh perubahan salinitas.
Melihat kondisi saturasi kelarutan oksigen pada suhu dan salinitas yang
disarankan, maka dapat dikatakan bahwa persyaratan media dengan kandungan
oksigen terlarut di atas 5 ppm akan terpenuhi. Berdasarkan hasil kajian
Phatarpekar et al. (2002), kandungan oksigen terlarut pada media pemeliharaan
larva udang galah disarankan berada pada kisaran nilai 6,5 ppm. Sementara Law
et al. (2002) menyatakan bahwa untuk pemeliharaan larva udang galah yang
optimal, maka kandungan oksigen terlarut dalam media sebaiknya lebih besar dari
5 ppm. Lebih lanjut, dikemukakan oleh Cheng et al. (2003), bahwa rendahnya
kandungan oksigen terlarut dapat menyebabkan kondisi hipoksia pada Krustase,
yang pada gilirannya akan mendorong mekanisme adaptasi spesifik, misalnya
penurunan laju metabolisme, modifikasi keseimbangan asam-basa dari hemolim,
terjadinya perubahan pada kemampuan mengikat hemosianin, osmolaritas
hemolim dan perubahan konsentrasi ion dalam tubuh. Karena itu, Cheng et al.
(2003) menyatakan bahwa kandungan oksigen terlarut yang optimal berkisar
antara 4,75 ppm sampai 7,75 ppm. Menyimak kajian yang ada, maka dapat
dikemukakan bahwa konsentrasi oksigen terlarut untuk mendukung optimalisasi
perkembangan larva udang galah berkisar antara 5 ppm sampai 8 ppm.
Perubahan pH yang drastis terhadap organisme yang hidup di perairan
payau, akan menyebabkan terganggunya perkembangan embrio, tingkat penetasan
telur dan perubahan struktur morfologi. Untuk udang galah, hal ini mulai
berpengaruh pada saat penetasan telur. Walaupun rata-rata pH air laut 8,3, tetapi
penetasan telur udang galah yang optimal berada pada media dengan pH 7,07
galah, akan sangat berpengaruh terhadap kemampuan melakukan adaptasi
terhadap lingkungan. Menurut Chen dan Chen (2003), nilai pH mempengaruhi
jumlah pakan yang dikonsumsi oleh udang galah. Lebih lanjut disebutkan bahwa
nilai pH media terendah yang dapat ditoleransi oleh udang galah adalah 7,4. Di
pihak lain hasil kajian Cheng et al. (2003) menunjukkan bahwa terjadi penurunan
pH hemolim udang galah dari 7,4 menjadi 7,34, bilamana kandungan oksigen
terlarut pada media menurun dari 4,30 ppm menjadi 2,14 ppm. Dengan demikian
dari berbagai kajian yang ada, dapat dikatakan bahwa nilai pH yang optimal bagi
media pemeliharaan larva udang galah adalah berkisar antara 7,0-8,5.
Ammonia adalah produk ekskretori utama pada hewan akuatik. Keracunan
ammonia merupakan salah satu penyebab kematian pada masa pemeliharaan larva
yang menggunakan manajemen terkontrol. Ammonia sebagai penyebab stres
dalam perairan ini, terbagi atas dua bentuk yaitu dalam bentuk ion (NH4+) dan
bukan ion (NH3) yang hadir bersama dalam keseimbangan yang diatur oleh pH
(Chen dan Kou, 1992). NH3 bebas berdifusi memasuki membran sel berkaitan
dengan gradien tekanannya (Chen dan Lei, 1990; Chen dan Lee, 1997). Senyawa
amonia yang beracun, berada dalam bentuk ammonia bukan ion. Oleh karena itu
jika kadar ammonia dalam air meningkat, maka ekskresi ammonia menurun dan
kadar ammonia dalam darah serta jaringan lain meningkat. Kondisi ini
mengakibatkan suatu elevasi pH darah dan menimbulkan efek merugikan pada
stabilitas membran dan reaksi katalisasi enzim (Tomasso, 1994), yang
menyebabkan kematian. Berdasarkan fenomena ini, Cavalli et al. (2000)
menyarankan uji toksisitas ammonia sebagai kriteria evaluasi kualitas larva.
Ammonia dalam air antara lain dapat menekan laju pertumbuhan, konsumsi
oksigen (Chen dan Lin, 1992), kapasitas osmoregulasi (Young-Lai et al., 1991)
bahkan dapat menyebabkan kematian (Tomasso, 1994). Kandungan ammonia
bukan ion yang berada dalam media pemeliharaan larva udang galah harus
diusahakan lebih kecil dari 0,1 ppm (Boyd dan Zimmermann, 2000)
Senyawa nitrit merupakan salah satu jenis polutan yang sering ditemukan
pada sistem perairan budidaya. Sebagaimana diketahui, kehadiran nitrit dalam
media budidaya adalah hasil antara dari proses oksidasi ammonia dengan bantuan
menyatakan bahwa kandungan nitrit yang tinggi dalam media budidaya udang
dapat menjadi pemicu stress, mempengaruhi metaemosianin, menyebabkan
hipoksia pada jaringan tubuh dan menganggu keseimbangan metabolisme (Chen
dan Kou, 1992; serta Wang et al., 2004). Disamping itu, Chen dan Lee (1997)
mengemukakan bahwa dosis letal (LC50 pada 96 jam) senyawa nitrit untuk
Macrobrachium rosenbergii sebesar 8,54 ppm. Berdasarkan beberapa kajian
pakar pada Penaeus monodon dinyatakan bahwa modus aksi dari senyawa nitrit
adalah dengan cara berdifusi ke dalam hemolim, sehingga mengakibatkan naiknya
tekanan oksigen; yang sekaligus mengindikasikan turunnya afinitas terhadap
oksigen. Lebih lanjut disebutkan, terjadi penurunan yang signifikan dari
oksihemosianin (oxyhemocyanin) dan meningkatkan deoksihemosianin Penaeus
monodon selama 6 jam terpapar dalam media dengan kandungan nitrit tinggi.
Dalam studi ini, reactive oxygen intermediate (ROIs) meningkat dengan
meningkatnya konsentrasi nitrit (Chen dan Cheng, 1995; Cheng dan Chen, 1999;
Moullac dan Haffiner, 2000). Sebagaimana diketahui, ROIs dan aktivitas mikroba
mempengaruhi mekanisme kekebalan tubuh organisme perairan. Upaya proteksi
terhadap mekanisme ROIs dilakukan melalui enzim antioksidan dan pemakan
bangkai (scavenngers) (Winston dan di Giulio, 1991; serta Peters dan
Livingstone, 1996). Untuk meminimalkan keracunan yang diakibatkan oleh
keberadaan nitrit dalam media pemeliharaan larva udang galah, harus diupayakan
agar mengandung nitrit tidak lebih dari 0,1 ppm (Akson dan Sampaio, 2000; serta
Boyd dan Tucker,1998).
Kapasitas Regulasi Osmotik
Umumnya pada fase perkembangan dari larva ke pascalarva, terjadi
mortalitas tinggi. Penyebab tingginya tingkat mortalitas, diduga sebagai akibat
tidak dilewatinya secara optimal tahap penyesuaian di tingkat larva ke pascalarva;
terutama yang berhubungan dengan kemampuan respons fisiologis. Namun
demikian masalah keseimbangan osmotik terhadap perubahan media merupakan
hal utama yang herus diperhatikan. Adapun perubahan kondisi media yang terjadi
(1) Perubahan salinitas media mengganggu keseimbangan osmotik. Dalam
upaya mempertahankan keseimbangan osmotik dan regulasi ionik ini larva
udang galah membutuhkan sejumlah energi, di luar energi metabolisme
dasar. Bahasan beberapa hasil penelitian memperlihatkan adanya
hubungan yang linier antara osmolalitas hemolim dan osmolalitas media
(Chen dan Lin, 1995). Karenanya pengaturan regulasi ionik yang berada
sedikit di bawah titik isoosmotik dipandang menjawab permasalahan.
(2) Rentang fluktuasi pH air di perairan tawar yang lebar (6 satuan pH di pagi
hari dan 10 satuan pH di malam hari), jarang terjadi pada perairan payau
yang memiliki sistem penyangga. Kajian Chen dan Kou (1996),
menyatakan bahwa naiknya nilai pH, akan menurunkan ekskresi
ammonia-N dan hal ini mengindikasikan terjadi penurunan pertukaran
aktif kation NH4+ untuk Na+ pada nilai pH relatif tinggi. Karenanya perlu
diketahui ion mana dalam larutan hemolim yang memegang peranan
penting dalam proses ini.
(3) Perubahan suhu air dan kelarutan oksigen yang terjadi pada kolam
budidaya lebih berfluktuasi, dibanding media perawatan larva dalam
unit-unit pembenihan yang lebih terkontrol. Hasil penelitian memperlihatkan
bahwa konsumsi oksigen akan meningkat pada media dengan salinitas
(menjadi) rendah; dan kondisi ini diduga menekan pertumbuhan udang
(Chen dan Lai, 1993). Karenanya penetapan kondisi lingkungan optimal
dipandang dapat mendukung pertumbuhan udang.
Menyimak ruaya larva udang galah dari perairan payau ke perairan tawar,
dapat dikatakan bahwa mekanisme pengaturan tekanan osmotik internal dan
eksternal larva udang galah di alam, mengikuti tipikal organisme osmoregulator.
Di alam, jarang ditemukan larva stadia 1 sampai dengan stadia 8 pada perairan
tawar. Sebagaimana diketahui, fenomena pengaturan tekanan osmotik ini
mengelompokkan organisme dengan tipikal osmokonformer yang tidak mampu
mempertahankan tekanan osmotik internal dan tipikal osmoregulator yang
memperlihatkan kemampuan organisme berusaha mempertahankan tekanan
osmotik internalnya. Karenanya, strategi yang dilakukan oleh organisme
osmotik internalnya. Strategi ini diperlihatkan dengan sangat jelas pada ruaya
pertumbuhan larva udang galah. Anonimous (1997) menggambarkan tampilan
osmotik osmokonformer dan osmoregulator dari krustase dalam bentuk grafik,
seperti terlihat pada Gambar 4.
[image:35.595.121.451.164.463.2]
Keterangan: A = Kelompok hyperosmoregulator B = Kelompok isoosmoregulator C = Kelompok hypoosmoregulator
Gambar 4. Grafik osmotik krustase tipikal osmokonformer dan osmoregulator (Sumber: Anonimous, 1997)
Sampai saat ini masalah yang belum diketahui dengan pasti/jelas adalah
bagaimana pengaturan tekanan osmotik larva udang galah saat berada pada media
terkontrol, seperti di panti-panti pembenihan. Upaya berupa strategi ruaya tidak
dapat dilakukan, karenanya efektivitas manajemen salinitas media, menjadi faktor
input yang berpengaruh terhadap kelangsungan hidup larva dan pascalarva yang
kuat dan sehat. Untuk mengetahui sejauh mana proses adaptasi larva pada setiap
stadia perkembangannya, diperlukan kejelasan mekanisme pengaturan kerja
osmotik pada organisme yang bersangkutan.
Kejelasan rangkaian kerja osmotik ini lebih jauh, dapat diuraikan sebagai
berikut: konsep osmoregulasi adalah suatu regulasi ionik pada tingkat molekuler.
Proses seluler ini terjadi pada lapisan jaringan kulit dan diikuti dengan kontrol
hemolim pada krustase dapat terjadi pada permukaan sel epitel yang terdapat pada
insang, integumen, antena-gland dan saluran pencernaan. Bagi udang galah yang
tergolong organisme air tawar, proses regulasi ionik di tingkat sel diatur melalui
mekanisme pompa natrium-kalium. Udang galah, dalam ukuran induk maupun
larva yang berada pada media payau, akan melakukan pelepasan ion natrium
sebagai upaya mempertahankan konsentrasi ion pada hemolim yang hipoionik
terhadap konsentrasi ion pada media. Untuk pengaturan regulasi ini diperlukan
sejumlah energi sesuai dengan rentang beda konsentrasi ion pada media, seperti
terlihat dari mekanisme pompa natrium-kalium yang membutuhkan sejumlah
adenosin trifosfat (ATP) dan melepas adenosin difosfat (ADP) pada
mekanismenya (Gambar 5).
Gambar 5. Ilustrasi mekanisme kerja pompa natrium-kalium organisme air tawar
Pompa Na+/K+
[K+] Tinggi [Na+] Rendah [Na+] Tinggi
[K+] Rendah
Lapisan lemak
Dalam sel Luar sel
(Sumber: Anonimous, 2003)
Sebagaimana dijelaskan, dalam kerja osmotik ini mengedepankan kegiatan
regulasi ionik yang terjadi antar ion-ion yang terlarut dalam media dan ion yang
ada dalam cairan hemolim. Menurut kajian Duerr dan Ahearn (1996) transport ion
dalam regulasi media ke cairan hemolim krustase, meliputi beberapa kation, yaitu
(Cl-) dan ion bikarbonat (HCO3-). Organisme seperti pascalarva udang galah, yang
melakukan ruaya pada salinitas yang lebih rendah, akan berupaya menahan
kehilangan ion Na+ dan Cl- dengan cara transport aktif mengambil Na+dari media
melalui aktivitas Na+/K+-ATPase. Menurut Kamaruddin (1994) dan Morohashi
et al. (1991), aktivitas enzim Na+/K+-ATPase ditentukan oleh ketersediaan asam
lemak bebas (FFA). Selain itu, menurut Palacios et al. (2004), FFA ini
meningkatkan aktivitas Na+/K+-ATPase dalam upaya menekan stres salinitas.
Upaya menjaga pasokan FFA ini, berdasarkan kajian Pan et al. (1991),
ketersediaannya dapat dipenuhi oleh pakan alami Artemia salina yang sekaligus
berkontribusi sebagai exogenous enzim pencernaan untuk membantu sistem
pencernaan larva yang pada umumnya belum sempurna. Pemberian Artemia
salina yang baru ditetaskan dari kista dengan jumlah ad libitum sebagai pakan
alami untuk larva pada penelitian ini, dipandang mencukupi.
Kajian beberapa pakar menunjukkan bahwa pada umumnya dalam
pemeliharaan larva Macrobrachium rosenbergii, disarankan menggunakan
nauplii Artemia salina. sebagai pilihan pakan (Deru, 1990; Lavens et al., 2000;
dan van Stappen, 2004). Mengikuti saran yang dikemukakan oleh Baros dan
Valenti (2003), jumlah pemberian nauplii Artemia salina untuk larva
Macrobrachium rosenbergii stadia 1 sampai dengan stadia 4 adalah 40
nauplii/larva per hari. Bila dilakukan perhitungan konversi energi, seperti yang
dikemukakan oleh Lavens et al. (2000), maka nilai kalori dari 40 nauplii/larva per
hari adalah sebesar 5,17 kalori/larva per hari. Sebagai pembanding, energi pakan
berupa nauplii Artemia salina yang diberikan dalam penelitian ini berkisar antara
0,26-5,82 kalori/larva per hari, dipandang cukup memadai.
Untuk mengetahui aktivitas enzim Na+/K+-ATPase pada larva
Macrobrachium rosenbergii stadia 1 sampai dengan stadia 11 dan bahkan sampai
dengan pascalarva hari ke-lima atau PL-5, Huong et al. (2004a) dan Huong et al.
(2004b) melakukan penelitian tentang hal ini. Hasil yang diperoleh dari penetasan
telur pada salinitas 12 ppt dan pemeliharaan larva berada pada salinitas 12 ppt,
didapatkan pemahaman aktivitas Na+/K+-ATPase larva Macrobrachium
rosenbergii seperti terlihat pada Gambar 6. Secara rinci Huong et al. (2004a)
stadia 1 diawali sebesar 3,1 ± 0,1 μmol ADP/mg protein per jam, kemudian
meningkat secara nyata pada saat larva stadia 2 sebesar 4,4 ± 0,4 μmol ADP/mg
protein per jam. Antara stadia-2 dan seterusnya ke stadia-4 menunjukkan bahwa
aktivitas Na+/K+-ATPase larva menurun. Saat stadia larva mencapai 6 terlihat
perubahan yang sangat nyata dengan kenaikan sebesar 3,9 ± 0,1 μmol ADP/mg
protein per jam. Perubahan aktivitas Na+/K+-ATPase larva secara nyata
berikutnya terlihat pada stadia 10, yaitu sebesar 2,9 ± 0,1 μmol ADP/mg protein
per jam. Tingginya aktivitas enzim Na+/K+-ATPase pada larva stadia awal,
menurut kajian Wilder et al. (2000) disebabkan belum sempurnanya sistem
osmoregulasi larva.
Gambar 6. Perubahan aktivitas enzim Na+/K+-ATPase selama metamorfosa larva
Macrobrachium rosenbergii menjadi pascalarva (Huong et al, 2004)
Perkembangan stadia
Pada tahapan awal pembenihan udang galah, keberhasilan perkembangan
stadia larva serta pertumbuhan pascalarva udang galah sangat ditentukan oleh
kualitas telur. Ketergantungan perolehan telur yang berkualitas terletak pada
tingkat keberhasilan proses vitelogenesis. Vitelogenesis sendiri merupakan
tahapan pada proses reproduksi krustase dengan hasil akhir adalah akumulasi
Pada proses internal dalam ovari akan terbentuk senyawa ‘protein spesifik
female’ yang berada dalam hemolim dan disebut vitellogenin. Selanjutnya, saat
vitelogenin memasuki oosit, senyawa protein ini disebut vitelin atau lipovitelin
yang merupakan bagian terbesar pendukung kuning telur dalam bentuk senyawa
lipo-glyco-carotenoprotein. Senyawa carotenoid ini memberi bias warna ‘jingga
terang’ pada kuning telur secara menyeluruh. Warna ini juga yang
mengindikasikan kesiapan kematangan telur atau sebagai tahap awal penentu
keberhasilan perolehan telur bermutu. Proses vitelogenesis yang memberi bias
warna jingga (penentu keberhasilan mutu telur) sampai fase embrionik telur udang
[image:39.595.98.490.88.777.2]galah dapat dilihat pada Gambar 7.
Gambar 7. Proses perkembangan telur udang galah sampai fase embrionik (Sumber: Romanova, 2000)
Larva udang galah mulai melepaskan diri dari telur, setelah 48 jam sejak
saat telur dilepaskan dari induk. Selama 25-35 hari masa pertumbuhannya, larva
udang galah melewati 11 tahap perkembangan sebelum mencapai bentuk
sempurna sebagai udang muda atau pascalarva. Tahap perkembangan larva udang
Tabel 1. Tahap perkembangan larva sampai pascalarva udang galah
Stadia Umur (hari) Keterangan Pertumbuhan
I 1 – 2 Mata sesil dan belum bertangkai – telson masih polos
II 2 – 4 Mata sudah bertangkai – uropoda pada telson mulai tampak
III 4 – 7 Kaki jalan depan sudah mulai memanjang – pertumbuhan
eksopoda dan endopoda pada uropoda sudah mulai tampak IV 7 – 12 Dua gerigi rostrum sudah mulai tampak – uropoda dan telson
sudah berkembang menyerupai kipas
V 12 – 16 Pertumbuhan eksopoda dan endopoda pada uropoda sudah
hampir sama panjang dengan telson
VI 16 – 18 Tunas pada pleopoda sudah mulai terlihat
VII 18 – 21 Pleopoda sudah mulai bercabang dua
VIII 21 – 25 Kaki jalan mulai terlihat lengkap – uropoda lebih
berkembang dan telson lebih menyempit – pleopoda pada cabang luar mulai berambut
IX 25 – 28 Pleopoda lebih berkembang dengan pertambahan ruas dan
rambut
X 28 – 31 Pleopoda lebih berkembang – ada rambut di antara duri pada gerigi rostrum
XI 31 – 35 Uropoda telah berkembang penuh – pleopoda berkembang
sempurna – gerigi rostrum telah berjumlah sembilan buah
Pasca-larva
35 – 41 Rostrum telah tumbuh dengan 11 gerigi atas dan 3-5 gerigi bawah serta dua helai rambut
Sumber: Hasil olahan dari data Uno dan Soo (1969)
Pertumbuhan Pascalarva
Sebagaimana bentuk udang galah dewasa, maka pascalarva udang galah
sudah memiliki bentuk tubuh sebagai udang muda yang mempunyai eksoskeleton
cukup tebal serta rigid yang merupakan ciri khas kelas krustase. Kehadiran
eksoskeleton ini memberi tekanan tertentu pada optimalisasi proses pertumbuhan
udang, termasuk pascalarva udang galah. Secara umum, dapat dikatakan proses
tumbuh pada individu udang, diekspresikan melalui pertambahan panjang, volume
dan bobot yang dinamik dengan waktu. Khusus ekspresi volume dan bobot, untuk
organisme yang melakukan ganti kulit (molting) menjadi agak sulit, karena
berlangsung diskontinyu. Hanya proses pertambahan panjang yang dapat
berlangsung kontinyu.
Beberapa hasil kajian memperlihatkan bahwa pertumbuhan udang pada
kondisi hiperosmotik, seperti pada udang galah yang melakukan ruaya untuk
berkorelasi langsung dan dipengaruhi oleh tingkat kemampuan adaptasi terhadap
salinitas media. Menurut Wang et al. (2003) kondisi salinitas media perairan
yang memberi tekanan hiperosmotik sedikit di atas isoosmotik hemolim tubuh
udang Macrobrachium nipponense, tercatat meningkatkan pertambahan bobot
tubuh secara nyata. Kondisi isoosmotik Macrobrachium nipponense sebesar 450
mOsm; sedangkan pada Macrobrachium rosenbergii, kondisi isoosmotik tercatat
lebih tinggi yaitu sekitar 485 mOsm. Menurut Sang dan Fotedar (2004), titik
isoosmotik pada masing-masing udang bergantung pada stadia larva dan ukuran
udang. Untuk mendukung pertumbuhan udang yang optimal dalam kondisi stres
hiperosmotik, asam amino bebas (free amino acid) dengan total asam amino
dalam ratio yang proporsional sehingga mempercepat pembentukan jaringan
tubuh (Bishop dan Burton, 1993; Okuma dan Abe, 1994). Dengan demikian,
dapat dikatakan sensitivitas Na+/K+-ATPase, khususnya dalam mekanisme
transport aktif senyawa-senyawa garam melalui sistem osmoregulasi; berpengaruh
langsung terhadap pertumbuhan udang (Wang et al., 2003; Huong dan Wilder,
2001)
Pengaruh faktor suhu terhadap pertumbuhan yang diperlihatkan dari
beberapa hasil kajian mengindikasikan bahwa pertumbuhan udang muda pada
tahap awal sangat ditentukan oleh suhu perairan media. Untuk pascalarva udang
windu, tercatat kecepatan tumbuh dalam ukuran panjang, dua kali lebih cepat pada
suhu 300C dibanding pada suhu 220C (Kumlu et al., 2000; Kumlu dan Jones,
1993; Chen, 1990; Parado-Estepa, 1998; Chavez Justo et al., 1991). Hubungan
antar suhu dan pertumbuhan ini juga dipengaruhi oleh seberapa besar prosentase
ganti kulit yang terjadi. Secara umum, semakin tinggi suhu; maka pertumbuhan
udang akan semakin cepat. Hal ini sejalan dengan kajian titik optimal kegiatan
ganti kulit yang juga terjadi pada suhu tinggi. Sehingga dapat dipastikan, pada
bulan-bulan tertentu laju pertumbuhan udang jauh lebih besar dibanding pada
bulan atau waktu lainnya, saat suhu media cenderung rendah. Frekuensi ganti
kulit pada pascalarva udang galah ternyata juga dipengaruhi oleh pH media
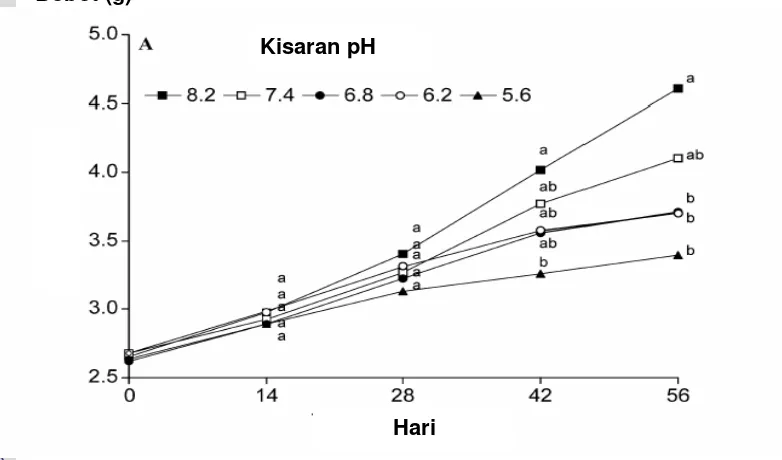
perairan. Hasil penelitian Chen dan Chen (2003) menunjukkan bahwa pascalarva
Macrobrachium rosenbergii melakukan ganti kulit rata-rata 3,56 kali per-individu
2,82 kali per-individu dalam 56 hari pada pH 5,6. Peningkatan frekuensi ganti
kulit pascalarva udang galah, diikuti dengan kecepatan tumbuh yang
divisualisasikan melalui pertumbuhan bobot tubuh seperti terlihat pada Gambar 8.
Bobot (g)
Kisaran pH
[image:42.595.118.509.167.397.2]Hari
Gambar 8. Grafik pertumbuhan pascalarva Macrobrachium rosenbergii pada
berbagai nilai pH media (Sumber: Chen dan Chen, 2003)
Kelarutan oksigen dalam air, termasuk salah satu parameter yang
mempengaruhi pertumbuhan krustase di perairan tawar; akibat besarnya
perbedaan konsentrasi kelarutan oksigen antara siang dan malam. Kondisi
hipoksia yang berlebih ini, akan mempengaruhi proses fisiologis udang, melalui
penekanan frekuensi ganti kulit dan memperlambat pertumbuhan, bahkan tidak
jarang menimbulkan kematian (Allan dan Magurire, 1991). Upaya adaptasi
dengan kondisi ini, dilakukan melalui reduksi kecepatan metabolisme, modifikasi
keseimbangan asam-basa hemolim, osmolalitas hemolim dan konsentrasi ion-ion
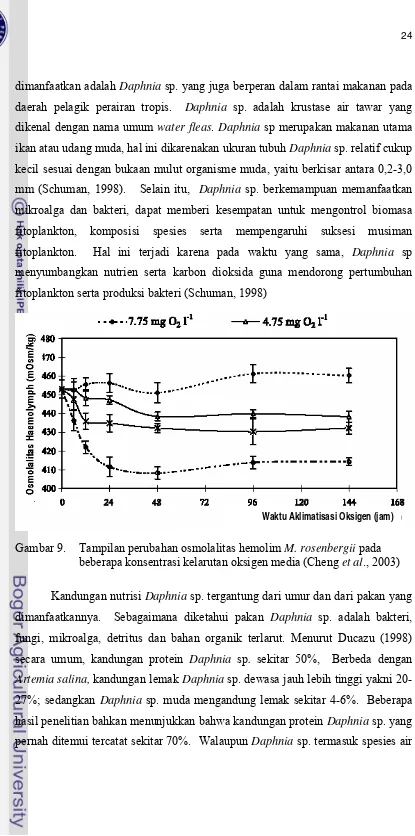
terlarut, seperti terlihat pada Gambar 9. (Morris dan Butler, 1996; Hill et al.,
1991; Cheng et al., 2003).
Hubungan pakan dan pertumbuhan pada udang, terlihat dari beberapa hasil
kajian yang menunjukkan bahwa penurunan jumlah pakan akan menurunkan laju
pertumbuhan. Sebagai pakan awal disarankan agar diberikan pakan alami.
dimanfaatkan adalah Daphnia sp. yang juga berperan dalam rantai makanan pada
daerah pelagik perairan tropis. Daphnia sp. adalah krustase air tawar yang
dikenal dengan nama umum water fleas. Daphnia sp merupakan makanan utama
ikan atau udang muda, hal ini dikarenakan ukuran tubuh Daphnia sp. relatif cukup
kecil sesuai dengan bukaan mulut organisme muda, yaitu berkisar antara 0,2-3,0
mm (Schuman, 1998). Selain itu, Daphnia sp. berkemampuan memanfaatkan
mikroalga dan bakteri, dapat memberi kesempatan untuk mengontrol biomasa
fitoplankton, komposisi spesies serta mempengaruhi suksesi musiman
fitoplankton. Hal ini terjadi karena pada waktu yang sama, Daphnia sp
menyumbangkan nutrien serta karbon dioksida guna mendorong pertumbuhan
fitoplankton serta produksi bakteri (Schuman, 1998)
[image:43.595.98.513.6.842.2]Waktu Aklimatisasi Oksigen (jam)
Gambar 9. Tampilan perubahan osmolalitas hemolim M. rosenbergii pada beberapa konsentrasi kelarutan oksigen media (Cheng et al., 2003)
Kandungan nutrisi Daphnia sp. tergantung dari umur dan dari pakan yang
dimanfaatkannya. Sebagaimana diketahui pakan Daphnia sp. adalah bakteri,
fungi, mikroalga, detritus dan bahan organik terlarut. Menurut Ducazu (1998)
secara umum, kandungan protein Daphnia sp. sekitar 50%, Berbeda dengan
Artemia salina, kandungan lemak Daphnia sp. dewasa jauh lebih tinggi yakni
20-27%; sedangkan Daphnia sp. muda mengandung lemak sekitar 4-6%. Beberapa
hasil penelitian bahkan menunjukkan bahwa kandungan protein Daphnia sp. yang
tawar, tetapi dapat juga dimanfaatkan sebagai pakan bagi organisme laut; karena
mengandung asam emak esensial. Disamping itu, Daphnia sp. memiliki enzim
pencernaan yang cukup banyak, seperti: proteinase, peptidase, amilase, lipase dan
juga selulase; yang dapat berfungsi sebagai ekso-enzim dalam lambung larva ikan
atau larva udang (Shell, 1998). Alternatif pakan buatan yang disarankan oleh
[image:44.595.124.467.250.427.2]Tacon (1993) guna mendukung pertumbuhan pascalarva terlihat pada Tabel 2.
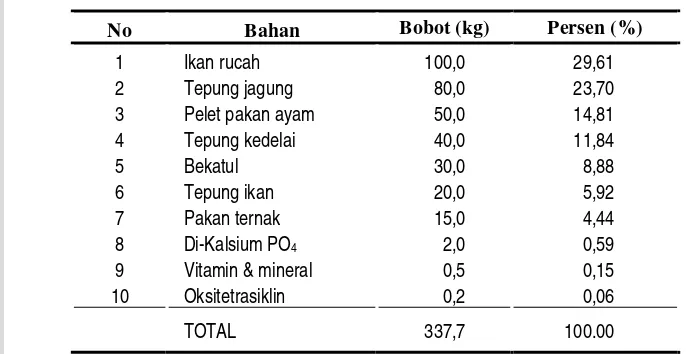
Tabel 2. Komposisi pakan buatan untuk mendukung pertumbuhan pascalarva
Macrobrachium rosenbergii
No Bahan Bobot (kg) Persen (%)
1 Ikan rucah 100,0 29,61
2 Tepung jagung 80,0 23,70
3 Pelet pakan ayam 50,0 14,81
4 Tepung kedelai 40,0 11,84
5 Bekatul 30,0 8,88
6 Tepung ikan 20,0 5,92
7 Pakan ternak 15,0 4,44
8 Di-Kalsium PO4 2,0 0,59
9 Vitamin & mineral 0,5 0,15
10 Oksitetrasiklin 0,2 0,06
TOTAL 337,7 100.00
METODOLOGI
Tempat dan Waktu Penelitian
Penelitian pendahuluan dilakukan di Laboratorium Pusat Percobaan
Limnologi LIPI Cibinong selama empat bulan (Mei-Agustus 2002). Penelitian
utama dilakukan di Laboratorium Fisiologi Hewan Air Fakultas Perikanan dan
Ilmu Kelautan, Institut Pertanian Bogor (IPB), Lingkungan Budidaya
FPIK-IPB, Limnologi FPIK-FPIK-IPB, Biologi Hewan Pusat Studi Ilmu Hayati FPIK-IPB,
Embriologi Fakultas Kedokteran Hewan IPB serta Hidrobiologi FPIK Universitas
Diponegoro (Agustus 2003- Januari 2004; Juni-Agustus 2004) selama kurang
lebih sembilan bulan.
Ruang Lingkup Penelitian
Ruang lingkup penelitian “Pengaruh Beban Kerja Osmotik terhadap
Kelangsungan Hidup, Lama Waktu Perkembangan Larva dan Potensi Tumbuh
Pascalarva” ini meliputi:
(1) Perkembangan larva sampai dengan pascalarva
(2) Konsumsi oksigen pada perkembangan larva sampai pascalarva
(3) Potensi tumbuh pascalarva
Ruang lingkup penelitian didasari atas pemikiran bahwa dalam upaya
pengkajian kausal-komparatif-kondisional pada setiap sistem produksi diupayakan
agar tingkat salinitas media menciptakan kondisi hipertonik, hipotonik dan
isotonik terhadap osmotik cairan tubuh larva udang galah. Pengaruh lanjut dan
perbedaan kondisi osmotik tersebut dicerminkan dari: (1) Beban kerja osmotik,
(2) Efisiensi pemanfaatan pakan; dan (3) Tingkat konsumsi oksigen.
Pendekatan pengkajian di atas memberi arahan bahwa masalah
kelangsungan hidup, perkembangan larva serta potensi tumbuh pascalarva udang
galah dapat dievaluasi sebagai konsekuensi perbedaan beban kerja osmotik akibat
pengaturan salinitas media. Keterkaitan antara antiseden dan konsekuen tersebut
diperjelas ketergantungannya dengan pertukaran ion sebagai kinerja beban
efisiensi pemanfaatan pakan merupakan bentuk konsekuensi dari beban
pertukaran ion. Penelitian dilakukan untuk setiap sistem produksi pemeliharaan
larva sampai pascalarva. Hasil penelitian setiap sistem, dijadikan dasar bagi
perencanaan percobaan sistem selanjutnya. Hasil percobaan sistem produksi tahap
potensi tumbuh pascalarva merupakan bentuk keberhasilan proses adaptasi yang
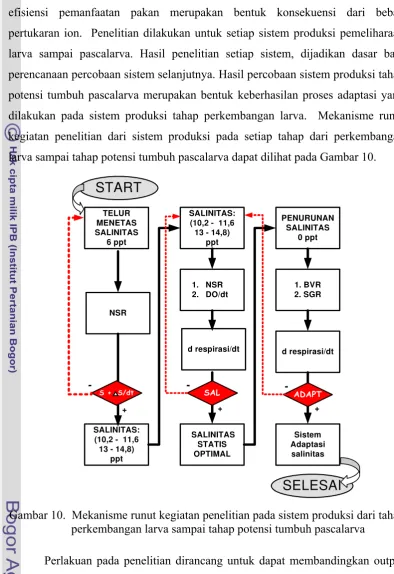
dilakukan pada sistem produksi tahap perkembangan larva. Mekanisme runut
kegiatan penelitian dari sistem produksi pada setiap tahap dari perkembangan
larva sampai tahap potensi tumbuh pascalarva dapat dilihat pada Gambar 10.
TELUR MENETAS SALINITAS
6 ppt
SALINITAS: (10,2 - 11,6 13 - 14,8)
ppt
PENURUNAN SALINITAS
0 ppt
NSR
1. NSR 2. DO/dt
1. BVR 2. SGR
d respirasi/dt d respirasi/dt
SALINITAS: (10,2 - 11,6 13 - 14,8)
ppt
SALINITAS STATIS OPTIMAL
Sistem Adaptasi
salinitas ADAPT
S + S/dt SAL
SELESAI
START
+ + +
- -
-Gambar 10. Mekanisme runut kegiatan penelitian pada sistem produksi dari tahap perkembangan larva sampai tahap potensi tumbuh pascalarva
Perlakuan pada penelitian dirancang untuk dapat membandingkan output
sebagai konsekuensi adanya hubungan sebab akibat (kausal). Sumber penyebab
ditetapkan adalah salinitas media. Kualitas air dan ketersediaan pakan alami
diupayakan memadai (kondisional). Salinitas media dirancang pada sistem
produksi tahap perkembangan larva dengan tiga tipe, yaitu: hiperosmotik,
[image:46.595.105.500.80.655.2]ppt. Selama masa pemeliharaan larva, salinitas media diupayakan berada pada
kisaran salinitas dengan catatan salah satu diantara titik salinitas merupakan titik
isoomotik larva stadia tahap awal. Untuk memperoleh respon adaptasi yang sama,
maka dirancang kenaikan salinitas untuk media pemeliharaan larva adalah dengan
delta salinitas 0,6 ppt; 0,8 ppt; 1,0 ppt; dan 1,2 ppt. Diharapkan dengan rancangan
perubahan salintas tersebut, dalam kurun waktu 7 hari akan dicapai salinitas
media pemeliharaan larva: 10,2 ppt; 11,6 ppt; 13,0 ppt; dan 14,4 ppt. Setelah 7
hari, sistem produksi masuk ke dalam tahap adaptasi serta perkembangan akhir
yang statis. Setelah itu, pemantauan dilakukan terhadap potensi tumbuh
pascalarva pada salinitas media yang diturunkan dengan tingkat penurunan
salinitas/waktu yang sama sehingga menjadi tawar. Penurunan salinitas dilakukan
saat semua larva telah menjadi pascalarva. Gambaran pola perubahan salinitas
dalam penelitian seperti uraian di atas, dapat dilihat pada Gambar 11.
TAHAP
PERKEMBANGAN LARVA
TAHAP POTENSI TUMBUH PL
6,0 10,2 11,6 ,0 ,4
13 14
Salinitas Naik
Hari ke-7
Salinitas Statis Salinitas Turun Tawar
PL-7 PL-14
Stadia 1
Stadia 2
Stadia 3 PL
PL PL
EKSPLORASI ADAPTASI dan PERKEMBANGAN AKHIR
0
Salin
itas (ppt)
Gambar 11. Pola perlakuan perubahan salinitas media pada sistem produksi tahap perkembangan larva dan tahap potensi tumbuh pascalarva
À Tahap Adaptasi dan Perkembangan Akhir Larva, dalam penelitian ini disebut sebagai percobaan larva tahap lanjut. Pada tahap ini dilakukan pemantauan perkembangan stadia larva yang berada pada salinitas statis: 10,2 ppt; 11,6 ppt; 13,0 ppt; dan 14,4 ppt. Tahap ini dimulai dari hari ke-8 sampai dengan semua larva telah menjadi pascalarva.
À Tahap Potensi Tumbuh Pascalarva, dalam penelitian ini dipantau kemampuan adaptasi pascalarva sebagai dampak lanjut dari perlakuan berbagai tingkatan salinitas tahap sebelumnya. Tahap ini dimulai saat salinitas media diturunkan menjadi salitas air tawar selama 7 hari. Kemudian dilanjutkan dengan memantau potensi tumbuh pascalarva pada media air tawar selama 7 hari berikutnya.
Percobaan Pengaruh Beban Kerja Osmotik terhadap Perkembangan Larva Tahap Awal dan Tahap Lanjut
Tujuan Percobaan
Tujuan khusus percobaanperkembangan larva tahap awal dan tahap lanjut
adalah untuk menentukan salinitas optimal bagi perkembangan larva dengan
mortalitas terendah. Larva ditetaskan pada media dengan salinitas 6 ppt,
kemudian ditingkatkan dari 0,6 ppt/hr; 0,8 ppt/hr; 1,0 ppt/hr dan 1,2 ppt/hr,
sehingga masing-masing salinitas tersebut dalam waktu 7 hari mencapai salinitas:
10,2 ppt; 11,6 ppt; 13,0 ppt; dan 14,4 ppt.
Metode dan Disain Rancangan Percobaan
Metode Percobaan. Metode percobaan yang dilakukan adalah kausal-komparatif-kondisional. Sedangkan disain percobaan menggunakan disain
rancangan acak lengkap dengan empat perlakukan salinitas dan tiga ulangan.
Model rancangan percobaan mengacu pada model linier aditif dengan bentuk
persamaan sebagai berikut:
Keterangan : i = perlakuan 1, 2, 3, dan 4 j = ulangan 1, 2, 3
Yij = pengamatan perlakuan ke i, ulangan ke j
μ = rataan umum
τ
i = pengaruh perlakuan ke iε
ij = pengaruh acak pada perlakuan ke i ulangan ke jHipotesis yang ditegakkan adalah:
H0:
τ
1 = ... =τ
i (perlakuan tidak berpengaruh terhadap respon yang diamati)H1: paling sedikit ada satu i dimana
τ
i≠ 0Penjelasan Perlakuan adalah:
- Perlakuan 1, salinitas media statis 10,2 ppt - Perlakuan 2, salinitas media statis 11,6 ppt - Perlakuan 3, salinitas media statis 13,0 ppt - Perlakuan 4, salinitas media statis 14,4 ppt
Disain Perlakuan. Disain perlakuan mengikuti sistem produksi akuatik yang dikembangkan, yaitu disain perlakuan pada sistem produksi tahap
perkembangan larva atau pada percobaan pengaruh beban kerja osmotik terhadap
perkembangan larva udang galah, baik pada tahap awal maupun pada tahap lanjut,
adalah sebagai berikut:
(a) Dua hari sebelum telur menetas, media dirancang berada pada
salinitas 6 ppt. Induk dengan telur siap tetas telah berada pada media
ini. Indikasi warna telur siap tetas: coklat keabu-abuan.
(b) Setelah seluruh telur menetas dalam waktu 12-24 jam, induk
dipisahkan dan larva dipindahkan ke dalam wadah percobaan dengan
mengatur kenaikan salinitas media. Pengaturan kenaikan salinitas
dirancang dalam kurun waktu tujuh hari. Pada akhir hari ke-7, media
pemeliharaan larva telah mengikuti model rancangan linier aditif,
acak lengkap; dengan empat perlakuan salinitas: 10,2 ppt; 11,6 ppt;
13,0 ppt; dan 14,4 ppt dengan tiga ulangan.
(c) Selama kurang lebih 23 hari, media