KARAKTERISTIK NATA DE COTTONII DENGAN
PENAMBAHAN DIMETIL AMINO FOSFAT (DAP) DAN
ASAM ASETAT GLASIAL
Oleh :
Amatun Nur
C34101057
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
RINGKASAN
AMATUN NUR. C34101057. Karakteristik Nata de Cottonii dengan Penambahan Dimetil Amino Fosfat (DAP) dan Asam Asetat Glasial. Dibawah bimbingan UJU dan AGOES M JACOEB.
Tujuan penelitian adalah untuk mempelajari pembuatan nata de cottonii dengan bahan baku Eucheuma cottonii serta untuk mengetahui pengaruh penambahan DAP dan asam asetat glasial terhadap mutu nata de cottonii. Penelitian ini terdiri dari dua tahap, yaitu penelitian tahap pertama dan penelitian tahap kedua. Penelitian tahap pertama bertujuan untuk menentukan perbandingan rumput laut dan air serta jumlah starter yang ditambahkan dalam pembuatan nata de cottonii. Perbandingan yang dijadikan sebagai perlakuan adalah 1:50, 1:60, 1:70 (w/v) (rumput laut : air) dan jumlah starter masing-masing 5% (v/v) dan 10 % (v/v) dengan ulangan sebanyak dua kali. Penelitian tahap kedua bertujuan untuk mempelajari pengaruh konsentrasi DAP sebagai sumber nitrogen bagi pertumbuhan Acetobacter xylinum dan asam asetat glasial yang berfungsi untuk membuat kondisi media fermentasi asam terhadap mutu nata de cottonii. Perlakuan konsentrasi DAP adalah 0,25 %, 0,5 % dan 0,75 (w/v) sedangkan perlakuan asam asetat glasial adalah 0,75 %, 1% dan 1,25 % (v/v) dengan ulangan tiga kali.
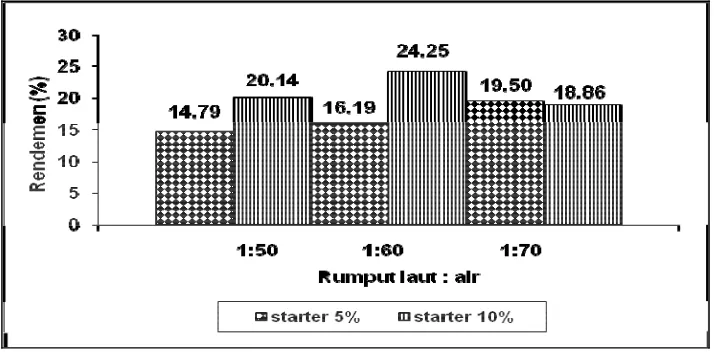
Perbandingan rumput laut dan air yang terbaik pada penelitian tahap pertama ditentukan berdasarkan nilai rendemen tertinggi. Hasil penelitian tahap pertama menunjukan bahwa ketiga perbandingan rumput laut dan air tidak memberikan pengaruh yang berbeda nyata. Nilai rendemen tertinggi terdapat pada perbandingan 1:60 dan jumlah starter 10 % yang menghasilkan rendemen sebesar 24,25 %.
Analisis ragam hasil penelitian tahap kedua menunjukan bahwa konsentrasi DAP dan asam asetat glasial berbeda nyata terhadap rendemen, ketebalan, kekenyalan, derajat putih, serat makanan larut air, serat makanan tidak larut air, total serat makanan dan kadar air nata de cottonii.
Nata de cottonii mengandung total serat makanan sebesar 3,11 - 4,02 %, sehingga sesuai dengan kadar serat makanan nata berdasarkan standar mutu nata dalam kemasan yaitu maksimum 4,5 %. Berdasarkan hasil tersebut maka nata de cottonii dapat dijadikan sebagai pangan sumber serat.
Hasil uji Kruskal – Wallis nata de cottonii menunjukan bahwa terdapat perbedaan tingkat penerimaan panelis terhadap parameter penampakan dan tekstur. Parameter warna, rasa dan aroma tidak terdapat perbedaan penerimaan panelis. Panelis cenderung menyukai nata dengan konsentrasi DAP 0,25% (w/v) dan konsentrasi asam asetat glasial 0,75% (v/v).
Nata de cottonii yang disukai oleh panelis ini memiliki ketebalan 0,28 cm, rendemen 15,82 %, kekenyalan 430,05 g/mm, derajat putih 37,90 %, serat makanan larut air 0,79 %, serat makanan tidak larut air 2,32 %, total serat makanan 3,11 % dan kadar air 94,77 %.
KARAKTERISTIK NATA DE COTTONII DENGAN
PENAMBAHAN DIMETIL AMINO FOSFAT (DAP) DAN
ASAM ASETAT GLASIAL
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
Oleh :
Amatun Nur
C34101057
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
JUDUL : KARAKTERISTIK NATA DE COTTONII DENGAN PENAMBAHAN DIMETIL AMINO FOSFAT (DAP) DAN ASAM ASETAT GLASIAL
Nama : Amatun Nur NRP : C34101057
Menyetujui,
Pembimbing I Pembimbing II
Uju S.Pi, M.Si Dr. Ir. Agoes M Jacoeb
NIP. 132282668 NIP. 131578852
Mengetahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Ir. Indra Jaya M.Sc NIP. 131578799
PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi ‘Karakteristik Nata de
Cottonii dengan Penambahan Dimetil Amino Fosfat (DAP) dan Asam Asetat Glasial’ adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber
informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Bogor, Januari 2009
Amatun Nur
RIWAYAT HIDUP
Amatun Nur dilahirkan di Jakarta pada tanggal 2 Oktober 1982 dari pasangan Bapak Abdur Rahim Gani (alm) dan Ibu Salma. Penulis adalah anak kedua dari dua bersaudara.
Penulis mengawali pendidikan di SDN 03 pagi Jakarta Pusat dan melanjutkan pendidikan menengah pertama di SLTP 39 Jakarta Pusat dan lulus pada tahun 1997. Pada tahun 2000 penulis menyelesaikan pendidikan di SMU Negeri 4 Jakarta Pusat. Pada tahun 2001 penulis diterima sebagai mahasiswa IPB melalui jalur SPMB pada Fakultas Perikanan dan Ilmu Kelautan, Jurusan Teknologi Hasil Perikanan.
Selama menjadi mahasiswa THP, penulis mendapatkan beasiswa dari Yayasan Dompet Dhuafa Republika dan Supersemar selama 4 tahun. Penulis pernah menjadi asisten mata kuliah Komoditi Hasil Perikanan (2003/2004). Penulis juga aktif dalam organisasi intra kampus, yaitu HIMASILKAN dan THP English Club.
Prestasi yang pernah diraih penulis semasa perkuliahan antara lain menjadi finalis lomba PKM (Program Kreativitas Mahasiswa) tingkat IPB pada tahun 2005, lomba membuat paper mengenai bidang akuakultur tingkat fakultas dan lolos seleksi menjadi presenter dalam program WAS (World Aquaculture for Student) pada tahun 2005 dengan judul makalah “The Prospect of Pearl Culture In Indonesia” di Bali International Convention Center.
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala karunia dan rahmatnya, sehingga penulis dapat menyelesaikan skripsi dengan judul
'Karakteristik Nata de Cottonii dengan Penambahan Dimetil Amino Fosfat (DAP) dan Asam Asetat Glasial'. Adapun tujuan dari penyusunan skripsi ini adalah sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
1. Bapak Uju, S.Pi, M.Si dan Bapak Dr. Ir. Agoes M Jacoeb sebagai pembimbing skripsi yang telah memberikan bimbingan, arahan, saran kepada penulis selama menyelesaikan skripsi ini.
2. Ibu Ir. Nurjanah, MS dan Bapak Dr. Ir. Ruddy Suwandi, MS, MPhil sebagai dosen penguji atas arahan dan saran yang sangat berharga.
3. Bapak Ir. Djoko Poernomo BSc sebagai pembimbing akademik yang telah
membimbing penulis selama menjalani studi di Departemen THP.
4. Bapak Dr. Ir. Agoes M Jacoeb sebagai Komisi Pendidikan di Departemen THP yang telah banyak membantu selama sebelum penelitian sampai akhir sidang. Terima kasih atas segala perhatiannya, pengorbanannya, kepercayaan yang begitu besar kepada saya, nasihat-nasihat dan motivasi dari bapak sehingga saya bisa bangkit kembali di saat-saat ‘kritis’serta segala bentuk dukungan yang dengan tulus diberikan kepada saya, suami dan anak selama ini.
5. Seluruh staf TU dan pegawai di THP, terima kasih atas bantuannya kepada penulis.
6. Kepada Pak Wahid, dari teknisi Laboratorium Fateta, IPB atas bantuannya. Pak Toro teknisi Laboratorium Kimia, Balai Besar Pengembangan dan Pengendalian Hasil Perikanan (BBP2HP), Muara Baru, Jakarta Utara. Mba Diana, Pak Dwi dan seluruh staf-staf Laboratorium Pengolahan dan Organoleptik Balai Besar Pengembangan dan Pengendalian Hasil Perikanan (BBP2HP).
vi
8. Kepada kakak-kakak-ku tercinta yang telah banyak berkorban secara materil yang tidak terhitung jumlahnya dan bekerja keras demi keberhasilan studi penulis : Saidah dan Uni, Uda dan keluarga
9. Kepada keluarga di Sumedang yang selalu ada di saat-saat susah dan rela berkorban apapun demi keberhasilan penulis di saat-saat susah maupun senang. Terima kasih yang tak terkira atas segala ketulusan dan kebaikannya selama ini kepada : Ibu, Teteh dan keluarga, Adi dan keluarga. Tiada kata-kata lagi yang bisa terungkap untuk kebaikan mereka. 10.My Lovely : Suamiku, anakku Naweed, dan ‘my baby’ yang masih dalam kandungan yang selalu setia menemani dari awal ‘perjuangan’ sampai terakhir yang penuh dengan ‘rintangan’. Terima kasih atas segala pengorbanan-mu, selalu ada di saat-saat penulis putus asa dan menyerah, dalam susah, sakit dan senang bersama-sama. Alhamdulillah..
11.Kepada keluarga paman suamiku (Pak Wawan) atas bantuan finansial dan dukungan serta perhatiannya selama ini kepada penulis dan keluarga. 12.Kepada Bapak Misgiyarta (peneliti nata dari Balai Besar Penelitian dan
Pengmbangan Pasca Panen Pertanian, Bogor, bagian mikrobiologi pangan) atas segala bantuan, kebaikan dan ilmu-ilmu yang diberikan kepada penulis selama penelitian.
13.Kepada teman-teman THP 38 tercinta yang masih setia memberikan perhatian dan dukungannya kepada penulis : Ojan, Apit, Meti, Ashan, Yanti dan yang lain. Zaki, Tyas, Saeful, Ari THP 41 dan seluruh Mahasiswa THP yang telah banyak membantu penulis.
14.Kepada Ibu Hasina (aunty) dan Pak Hidayatullah atas doa dan dukungannya selama ini.
15.Kepada Ibu Kery dari Rektorat, bagian Beasiswa atas segala kebaikannya kepada penulis selama menjadi mahasiswa penerima beasiswa Supersemar selama kuliah.
Bogor, Januari 2009
DAFTAR ISI
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xi
1. PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Tujuan Penelitian ... 3
2. TINJAUAN PUSTAKA 2.1 Rumput Laut ... 4
2.1.1 Biologi Eucheuma cottonii ... 5
2.1.2 Manfaat dan kandungan Eucheuma cottonii ... 6
2.2 Definisi Nata ... 8
2.2.1 Nata rumput laut ... 9
2.2.2 Bahan-bahan pembuatan nata rumput laut ... 9
(a) Rumput laut Eucheuma cottonii ... 9
(b) Sukrosa ... 9
(c) Dimetil Amino Phospat (DAP) ... 10
(d) Asam asetat glasial ... 11
(e) Starter nata ... 11
2.2.3 Bakteri pembentuk nata... 12
2.2.4 Tahap pembuatan nata... 13
2.2.5 Kondisi dan media pertumbuhan nata. ... 14
2.2.6 Kandungan gizi nata agar , nata de coco dan nata komersial ... 16
2.3 Serat Nata ... 17
2.4 Serat Makanan ... 18
3. METODOLOGI 3.1. Waktu dan Tempat Penelitian ... 20
3.2. Alat dan Bahan ... 20
vii
3.3.1 Penelitian tahap pertama ... 21
3.3.2 Penelitian tahap kedua... 24
3.4 Metode Analisis ... 24
3.4.1 Uji organoleptik ... 24
3.4.2 Analisis sifat fisik ... 25
3.4.3 Analisis sifat kimia ... 26
A. Analisis filtrat rumput laut ... 26
B. Analisis kimia nata ... 28
3.5 Rancangan Percobaan dan Analisis Data ... 30
3.5.1 Rancangan percobaan penelitian tahap pertama ... 30
3.5.2 Rancangan percobaan penelitian tahap kedua... 31
4. HASIL DAN PEMBAHASAN 4.1. Pengaruh Pengenceran dan Penambahan Starter ... 32
4.2. Pengaruh Penambahan DAP pada Pembuatan Nata de Cottonii ... 33
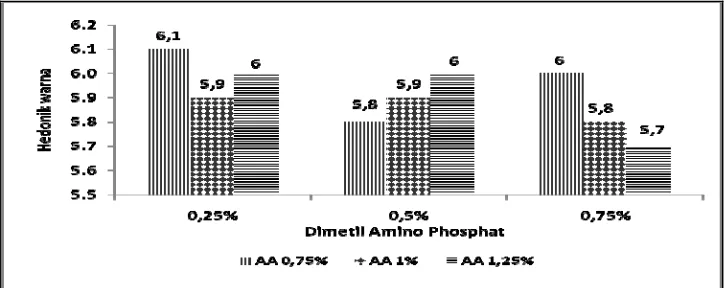
4.2.1 Uji hedonik ... 34
(a) hedonik warna ... 34
(b) hedonik penampakan ... 35
(c) hedonik tekstur ... 35
(d) hedonk rasa ... 36
(e) hedonik aroma ... 37
4.2.2 Sifat fisik ... 37
(a) Rendemen ... 37
(b) Ketebalan ... 38
(c) Kekenyalan ... 40
(d) Derajat putih ... 41
4.2.3 Sifat kimia ... 42
(a) Serat makanan ... 42
1) Serat makanan larut air ... 42
2) Serat makanan tidak larut air ... 43
3) Total serat makanan ... 44
KARAKTERISTIK NATA DE COTTONII DENGAN
PENAMBAHAN DIMETIL AMINO FOSFAT (DAP) DAN
ASAM ASETAT GLASIAL
Oleh :
Amatun Nur
C34101057
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
RINGKASAN
AMATUN NUR. C34101057. Karakteristik Nata de Cottonii dengan Penambahan Dimetil Amino Fosfat (DAP) dan Asam Asetat Glasial. Dibawah bimbingan UJU dan AGOES M JACOEB.
Tujuan penelitian adalah untuk mempelajari pembuatan nata de cottonii dengan bahan baku Eucheuma cottonii serta untuk mengetahui pengaruh penambahan DAP dan asam asetat glasial terhadap mutu nata de cottonii. Penelitian ini terdiri dari dua tahap, yaitu penelitian tahap pertama dan penelitian tahap kedua. Penelitian tahap pertama bertujuan untuk menentukan perbandingan rumput laut dan air serta jumlah starter yang ditambahkan dalam pembuatan nata de cottonii. Perbandingan yang dijadikan sebagai perlakuan adalah 1:50, 1:60, 1:70 (w/v) (rumput laut : air) dan jumlah starter masing-masing 5% (v/v) dan 10 % (v/v) dengan ulangan sebanyak dua kali. Penelitian tahap kedua bertujuan untuk mempelajari pengaruh konsentrasi DAP sebagai sumber nitrogen bagi pertumbuhan Acetobacter xylinum dan asam asetat glasial yang berfungsi untuk membuat kondisi media fermentasi asam terhadap mutu nata de cottonii. Perlakuan konsentrasi DAP adalah 0,25 %, 0,5 % dan 0,75 (w/v) sedangkan perlakuan asam asetat glasial adalah 0,75 %, 1% dan 1,25 % (v/v) dengan ulangan tiga kali.
Perbandingan rumput laut dan air yang terbaik pada penelitian tahap pertama ditentukan berdasarkan nilai rendemen tertinggi. Hasil penelitian tahap pertama menunjukan bahwa ketiga perbandingan rumput laut dan air tidak memberikan pengaruh yang berbeda nyata. Nilai rendemen tertinggi terdapat pada perbandingan 1:60 dan jumlah starter 10 % yang menghasilkan rendemen sebesar 24,25 %.
Analisis ragam hasil penelitian tahap kedua menunjukan bahwa konsentrasi DAP dan asam asetat glasial berbeda nyata terhadap rendemen, ketebalan, kekenyalan, derajat putih, serat makanan larut air, serat makanan tidak larut air, total serat makanan dan kadar air nata de cottonii.
Nata de cottonii mengandung total serat makanan sebesar 3,11 - 4,02 %, sehingga sesuai dengan kadar serat makanan nata berdasarkan standar mutu nata dalam kemasan yaitu maksimum 4,5 %. Berdasarkan hasil tersebut maka nata de cottonii dapat dijadikan sebagai pangan sumber serat.
Hasil uji Kruskal – Wallis nata de cottonii menunjukan bahwa terdapat perbedaan tingkat penerimaan panelis terhadap parameter penampakan dan tekstur. Parameter warna, rasa dan aroma tidak terdapat perbedaan penerimaan panelis. Panelis cenderung menyukai nata dengan konsentrasi DAP 0,25% (w/v) dan konsentrasi asam asetat glasial 0,75% (v/v).
Nata de cottonii yang disukai oleh panelis ini memiliki ketebalan 0,28 cm, rendemen 15,82 %, kekenyalan 430,05 g/mm, derajat putih 37,90 %, serat makanan larut air 0,79 %, serat makanan tidak larut air 2,32 %, total serat makanan 3,11 % dan kadar air 94,77 %.
KARAKTERISTIK NATA DE COTTONII DENGAN
PENAMBAHAN DIMETIL AMINO FOSFAT (DAP) DAN
ASAM ASETAT GLASIAL
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
Oleh :
Amatun Nur
C34101057
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
JUDUL : KARAKTERISTIK NATA DE COTTONII DENGAN PENAMBAHAN DIMETIL AMINO FOSFAT (DAP) DAN ASAM ASETAT GLASIAL
Nama : Amatun Nur NRP : C34101057
Menyetujui,
Pembimbing I Pembimbing II
Uju S.Pi, M.Si Dr. Ir. Agoes M Jacoeb
NIP. 132282668 NIP. 131578852
Mengetahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Ir. Indra Jaya M.Sc NIP. 131578799
PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi ‘Karakteristik Nata de
Cottonii dengan Penambahan Dimetil Amino Fosfat (DAP) dan Asam Asetat Glasial’ adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber
informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Bogor, Januari 2009
Amatun Nur
RIWAYAT HIDUP
Amatun Nur dilahirkan di Jakarta pada tanggal 2 Oktober 1982 dari pasangan Bapak Abdur Rahim Gani (alm) dan Ibu Salma. Penulis adalah anak kedua dari dua bersaudara.
Penulis mengawali pendidikan di SDN 03 pagi Jakarta Pusat dan melanjutkan pendidikan menengah pertama di SLTP 39 Jakarta Pusat dan lulus pada tahun 1997. Pada tahun 2000 penulis menyelesaikan pendidikan di SMU Negeri 4 Jakarta Pusat. Pada tahun 2001 penulis diterima sebagai mahasiswa IPB melalui jalur SPMB pada Fakultas Perikanan dan Ilmu Kelautan, Jurusan Teknologi Hasil Perikanan.
Selama menjadi mahasiswa THP, penulis mendapatkan beasiswa dari Yayasan Dompet Dhuafa Republika dan Supersemar selama 4 tahun. Penulis pernah menjadi asisten mata kuliah Komoditi Hasil Perikanan (2003/2004). Penulis juga aktif dalam organisasi intra kampus, yaitu HIMASILKAN dan THP English Club.
Prestasi yang pernah diraih penulis semasa perkuliahan antara lain menjadi finalis lomba PKM (Program Kreativitas Mahasiswa) tingkat IPB pada tahun 2005, lomba membuat paper mengenai bidang akuakultur tingkat fakultas dan lolos seleksi menjadi presenter dalam program WAS (World Aquaculture for Student) pada tahun 2005 dengan judul makalah “The Prospect of Pearl Culture In Indonesia” di Bali International Convention Center.
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala karunia dan rahmatnya, sehingga penulis dapat menyelesaikan skripsi dengan judul
'Karakteristik Nata de Cottonii dengan Penambahan Dimetil Amino Fosfat (DAP) dan Asam Asetat Glasial'. Adapun tujuan dari penyusunan skripsi ini adalah sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
1. Bapak Uju, S.Pi, M.Si dan Bapak Dr. Ir. Agoes M Jacoeb sebagai pembimbing skripsi yang telah memberikan bimbingan, arahan, saran kepada penulis selama menyelesaikan skripsi ini.
2. Ibu Ir. Nurjanah, MS dan Bapak Dr. Ir. Ruddy Suwandi, MS, MPhil sebagai dosen penguji atas arahan dan saran yang sangat berharga.
3. Bapak Ir. Djoko Poernomo BSc sebagai pembimbing akademik yang telah
membimbing penulis selama menjalani studi di Departemen THP.
4. Bapak Dr. Ir. Agoes M Jacoeb sebagai Komisi Pendidikan di Departemen THP yang telah banyak membantu selama sebelum penelitian sampai akhir sidang. Terima kasih atas segala perhatiannya, pengorbanannya, kepercayaan yang begitu besar kepada saya, nasihat-nasihat dan motivasi dari bapak sehingga saya bisa bangkit kembali di saat-saat ‘kritis’serta segala bentuk dukungan yang dengan tulus diberikan kepada saya, suami dan anak selama ini.
5. Seluruh staf TU dan pegawai di THP, terima kasih atas bantuannya kepada penulis.
6. Kepada Pak Wahid, dari teknisi Laboratorium Fateta, IPB atas bantuannya. Pak Toro teknisi Laboratorium Kimia, Balai Besar Pengembangan dan Pengendalian Hasil Perikanan (BBP2HP), Muara Baru, Jakarta Utara. Mba Diana, Pak Dwi dan seluruh staf-staf Laboratorium Pengolahan dan Organoleptik Balai Besar Pengembangan dan Pengendalian Hasil Perikanan (BBP2HP).
vi
8. Kepada kakak-kakak-ku tercinta yang telah banyak berkorban secara materil yang tidak terhitung jumlahnya dan bekerja keras demi keberhasilan studi penulis : Saidah dan Uni, Uda dan keluarga
9. Kepada keluarga di Sumedang yang selalu ada di saat-saat susah dan rela berkorban apapun demi keberhasilan penulis di saat-saat susah maupun senang. Terima kasih yang tak terkira atas segala ketulusan dan kebaikannya selama ini kepada : Ibu, Teteh dan keluarga, Adi dan keluarga. Tiada kata-kata lagi yang bisa terungkap untuk kebaikan mereka. 10.My Lovely : Suamiku, anakku Naweed, dan ‘my baby’ yang masih dalam kandungan yang selalu setia menemani dari awal ‘perjuangan’ sampai terakhir yang penuh dengan ‘rintangan’. Terima kasih atas segala pengorbanan-mu, selalu ada di saat-saat penulis putus asa dan menyerah, dalam susah, sakit dan senang bersama-sama. Alhamdulillah..
11.Kepada keluarga paman suamiku (Pak Wawan) atas bantuan finansial dan dukungan serta perhatiannya selama ini kepada penulis dan keluarga. 12.Kepada Bapak Misgiyarta (peneliti nata dari Balai Besar Penelitian dan
Pengmbangan Pasca Panen Pertanian, Bogor, bagian mikrobiologi pangan) atas segala bantuan, kebaikan dan ilmu-ilmu yang diberikan kepada penulis selama penelitian.
13.Kepada teman-teman THP 38 tercinta yang masih setia memberikan perhatian dan dukungannya kepada penulis : Ojan, Apit, Meti, Ashan, Yanti dan yang lain. Zaki, Tyas, Saeful, Ari THP 41 dan seluruh Mahasiswa THP yang telah banyak membantu penulis.
14.Kepada Ibu Hasina (aunty) dan Pak Hidayatullah atas doa dan dukungannya selama ini.
15.Kepada Ibu Kery dari Rektorat, bagian Beasiswa atas segala kebaikannya kepada penulis selama menjadi mahasiswa penerima beasiswa Supersemar selama kuliah.
Bogor, Januari 2009
DAFTAR ISI
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xi
1. PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Tujuan Penelitian ... 3
2. TINJAUAN PUSTAKA 2.1 Rumput Laut ... 4
2.1.1 Biologi Eucheuma cottonii ... 5
2.1.2 Manfaat dan kandungan Eucheuma cottonii ... 6
2.2 Definisi Nata ... 8
2.2.1 Nata rumput laut ... 9
2.2.2 Bahan-bahan pembuatan nata rumput laut ... 9
(a) Rumput laut Eucheuma cottonii ... 9
(b) Sukrosa ... 9
(c) Dimetil Amino Phospat (DAP) ... 10
(d) Asam asetat glasial ... 11
(e) Starter nata ... 11
2.2.3 Bakteri pembentuk nata... 12
2.2.4 Tahap pembuatan nata... 13
2.2.5 Kondisi dan media pertumbuhan nata. ... 14
2.2.6 Kandungan gizi nata agar , nata de coco dan nata komersial ... 16
2.3 Serat Nata ... 17
2.4 Serat Makanan ... 18
3. METODOLOGI 3.1. Waktu dan Tempat Penelitian ... 20
3.2. Alat dan Bahan ... 20
vii
3.3.1 Penelitian tahap pertama ... 21
3.3.2 Penelitian tahap kedua... 24
3.4 Metode Analisis ... 24
3.4.1 Uji organoleptik ... 24
3.4.2 Analisis sifat fisik ... 25
3.4.3 Analisis sifat kimia ... 26
A. Analisis filtrat rumput laut ... 26
B. Analisis kimia nata ... 28
3.5 Rancangan Percobaan dan Analisis Data ... 30
3.5.1 Rancangan percobaan penelitian tahap pertama ... 30
3.5.2 Rancangan percobaan penelitian tahap kedua... 31
4. HASIL DAN PEMBAHASAN 4.1. Pengaruh Pengenceran dan Penambahan Starter ... 32
4.2. Pengaruh Penambahan DAP pada Pembuatan Nata de Cottonii ... 33
4.2.1 Uji hedonik ... 34
(a) hedonik warna ... 34
(b) hedonik penampakan ... 35
(c) hedonik tekstur ... 35
(d) hedonk rasa ... 36
(e) hedonik aroma ... 37
4.2.2 Sifat fisik ... 37
(a) Rendemen ... 37
(b) Ketebalan ... 38
(c) Kekenyalan ... 40
(d) Derajat putih ... 41
4.2.3 Sifat kimia ... 42
(a) Serat makanan ... 42
1) Serat makanan larut air ... 42
2) Serat makanan tidak larut air ... 43
3) Total serat makanan ... 44
viii 5. KESIMPULAN
5.1 Kesimpulan ... 47
5.2 Saran ... 47
DAFTAR PUSTAKA ... 48
ix
DAFTAR TABEL
No. Halaman
1. Komposisi kimia rumput laut jenis Eucheuma cottonii ... 7 2. Kondisi optimum untuk memproduksi nata pada media air kelapa ... 15 3. Standar mutu produk nata dalam kemasan (SNI 01-4317-1996) ... 16 4. Komposisi gizi nata komersial ... 17 5. Kandungan nutrisi nata agar dan nata de coco ... 17 6. Hasil analisa filtrat rumput laut pada pengenceran 1:60 (dalam 750 ml
x
DAFTAR GAMBAR
No. Halaman
1. Jenis alga merah Eucheuma cottonii ... 5 2. Diagram alir pembuatan nata de cottonii tahap pertama ... 22 3. Diagram alir pembuatan nata de cottonii tahap kedua ... 23 4. Nilai rata-rata rendemen nata de cottonii dengan perlakuan pengenceran
filtrat dan jumlah starter ... 32 5. Nilai hedonik rata-rata parameter warna nata de cottonii ... 34 6. Nilai hedonik rata-rata parameter penampakan nata de cottonii ... 35 7. Nilai hedonik rata-rata parameter tekstur nata de cottonii ... 36 8. Nilai hedonik rata-rata parameter rasa nata de cottonii ... 36 9. Nilai hedonik rata-rata parameter aroma nata de cottonii ... 37 10. Nilai rata-rata rendemen nata de cottonii dengan pelakuan DAP dan
asam asetat glasial ... 38 11. Nilai rata-rata ketebalan nata de cottonii dengan pelakuan DAP dan
asam asetat glasial ... 39 12. Nilai rata-rata kekenyalan nata de cottonii dengan pelakuan DAP dan
asam asetat glasial ... 40 13. Nilai rata-rata derajat putih nata de cottonii dengan pelakuan DAP dan
asam asetat glasial ... 41 14. Nilai rata-rata serat makanan larut air nata de cottonii dengan pelakuan
DAP dan asam asetat glasial ... 43 15. Nilai rata-rata serat makanan tidak larut air nata de cottonii dengan
pelakuan DAP dan asam asetat glasial ... 44 16. Nilai rata-rata total serat makanan nata de cottonii dengan pelakuan
DAP dan asam asetat glasial ... 45 17. Nilai rata-rata kadar air nata de cottonii dengan pelakuan DAP dan
asam asetat glasial ... 46
xi
DAFTAR LAMPIRAN
No. Halaman
1. Bahan dan alat pembuatan nata de cottonii ... 51 2. Alat-alat membuat nata de cottonii ... 53 3. Proses fermentasi fata de cottonii ... 54 4. Analisis ragam dan uji lanjut Duncan nata de cottonii hasil penelitian
tahap pertama ... 55 5. Analisis ragam dan uji lanjut Duncan nata de cottonii hasil penelitian
1.
PENDAHULUAN
1.1 Latar Belakang
Selama ini pembuatan nata menggunakan bahan baku air kelapa. Air kelapa berfungsi sebagai media pertumbuhan bakteri pembentuk nata karena nutrisinya baik, relatif lengkap dan sesuai dengan pertumbuhan bakteri. Rumput laut mempunyai kesamaan dengan air kelapa sebagai media pembuatan nata karena kandungan karbohidratnya sebagai sumber karbon bagi pertumbuhan bakteri Acetobacter xylinum. Rumput laut jenis Eucheuma cottonii merupakan
salah satu alternatif yang dapat digunakan dalam pembuatan nata yaitu sebagai media bagi pertumbuhan bakteri pembentuk nata. Seperti halnya industri nata de coco, maka industri nata rumput laut ini dapat diterapkan juga pada skala kecil, karena proses dan teknologi yang digunakan sederhana dan tidak mahal.
Nata adalah suatu produk yang dihasilkan dari proses fermentasi oleh bakteri Acetobacter xylinum. Nata terapung di permukaan medium yang mengandung gula dan asam hasil fermentasi dengan bantuan mikroba Acetobacter xylinum. Nata yang dihasilkan dari rumput laut jenis Eucheuma cottonii dikenal dengan nata agar (Isti 2005). Jenis rumput laut lain yang telah berhasil diolah menjadi produk nata adalah jenis Gracillaria Sp. Nata agar ini telah berhasil dibuat pada tahun 2004-2006 di Balai Pengembangan dan Pengujian Mutu Hasil Perikanan (BPPMHP). Faktor-faktor suhu, pH, cahaya, oksigen, kondisi lingkungan, mineral dan vitamin, sumber karbon dan sumber nitrogen mempengaruhi keberhasilan pembuatan nata yang berkualitas dilihat dari segi fisika, kimia serta organoleptik. Perbaikan aspek fisika-kimia dan perbaikan proses produksi diharapkan bisa meningkatkan pemanfaatan rumput laut sebagai bahan pembuatan nata.
Beberapa perlakuan yang telah diberikan dalam pembuatan nata agar tersebut adalah pengenceran filtrat (1:40) sebagai media fermentasi serta penambahan sukrosa (5 % dan 10 %) dan ammonium sulfat (0,5 % dan 1 %)
2
senyawa organik lain. Penggunaan ammonium sulfat dan urea sebagai bahan tambahan makanan dinilai kurang aman karena memiliki efek samping bagi kesehatan. Berbeda dengan ammonium sulfat, sejak tahun 2006, FAO sudah tidak merekomendasikan lagi penggunaan ammonium sulfat sebagai bahan tambahan makanan. Berdasarkan hal tersebut maka diperlukan sumber nitrogen lain yang dinilai aman sebagai bahan pangan dan ekonomis. Penggunaan DAP pada penelitian ini adalah sebagai pengganti ammonium sulfat maupun urea yang biasa dipakai dalam pembuatan nata dan lebih aman. Banyaknya urea yang ditambahkan dalam membuat nata de coco adalah 5 g urea untuk setiap 1 liter air kelapa (suaramerdeka.com). Penggunaan asam asetat glasial pada penelitian ini adalah untuk mengkondisikan media nata sedemikian rupa agar sesuai dengan kondisi optimum pertumbuhan bakteri Acetobacter xylinum. Penggunaan asam asetat glasial dibandingkan dengan jenis asam organik lain adalah karena kepekatannya yang tinggi (99,8 %) sehingga tidak membutuhkan jumlah yang besar untuk menurunkan pH media dan lebih ekonomis dibandingkan dengan jenis asam yang lain. Banyaknya asam asetat glasial yang ditambahkan dalam
pembuatan nata de coco adalah 10 ml untuk setiap 1 liter air kelapa (suaramerdeka.com). Asam asetat glasial mengandung unsur karbon yang juga diperlukan untuk metabolisme mikroba. Semakin tinggi konsentrasi, semakin pekat larutan asam asetat glasial, semakin besar jumlah karbon yang dimilikinya.
3
Mengingat potensi rumput laut di Indonesia yang cukup besar dan keterbatasan produsen dalam menghasilkan nata yang berkualitas serta pentingnya nata sebagai sumber serat, maka perlu dilakukan kajian lebih lanjut pada rumput laut sebagai bahan pembuatan nata.
1.2 Tujuan Penelitian
Tujuan umum penelitian ini adalah mempelajari pembuatan nata de cottonii dengan bahan baku Eucheuma cottonii yang memberikan hasil terbaik dari segi fisika kimia dan disukai oleh panelis. Sedangkan tujuan khususnya adalah :
1) Menentukan perbandingan rumput laut dan air, serta jumlah starter bakteri yang dapat menghasilkan nata dengan nilai rendemen tertinggi.
2) Mengetahui pengaruh penambahan DAP dan asam asetat glasial pada pembuatan nata de cottonii terhadap mutu nata (rendemen, ketebalan, derajat putih, kekenyalan, kadar air dan kandungan serat).
2. TINJAUAN PUSTAKA
2.1 Rumput Laut
Rumput laut secara biologi termasuk salah satu anggota alga yang merupakan tumbuhan berklorofil. Rumput laut terdiri dari satu atau banyak sel, berbentuk koloni, hidupnya bersifat bentik di daerah perairan yang dangkal, berpasir, berlumpur atau berpasir dan berlumpur, daerah pasut, jernih dan biasanya menempel pada karang mati baik terbentuk secara alamiah atau buatan. Alga mempunyai bentuk bermacam-macam, seperti benang atau tumbuhan tinggi.
Ciri utamanya adalah tidak mempunyai akar, batang, dan daun yang dinding selnya dilapisi lendir. Alga bersifat autotrof, yaitu dapat hidup sendiri tanpa tergantung makhluk lain. Proses pertumbuhan rumput laut sangat bergantung pada sinar matahari untuk melakukan proses fotosintesis. Rumput laut dikelompokan menjadi empat kelas berdasarkan pigmen yang dikandungnya yaitu Chlorophyceae (ganggang hijau), Rhodophyceae (ganggang merah), Paeophyceae (ganggang coklat), dan Chrysophyceae (ganggang keemasan) (Winarno 1990).
Rumput laut terutama ganggang merah dan ganggang coklat merupakan komoditas yang sangat penting karena zat-zat yang dikandungnya. Zat kimia yang terkandung dalam alga merah adalah agar, karaginan dan alginat. Jenis rumput laut yang ada di Indonesia selain mengandung agar dan karaginan juga mengandung pigmen fikobilin. Pigmen ini terdiri dari fikoeritrin dan fikosianin yang merupakan cadangan makanan berupa karbohidrat (Indriani dan Emi 1999).
Rumput laut banyak mengandung trace element khususnya iodium yang konsentrasinya lebih tinggi dari tumbuhan. Rumput laut juga mengandung serat yang telah dimanfaatkan sebagai bahan pangan alamiah, karbohidrat, protein, sedikit lemak, abu dan mineral seperti natrium dan kalsium (Winarno 1990).
Rumput laut sebagai bahan pangan merupakan komoditas yang dapat dikembangkan karena ekosistem di daratan tidak dapat memenuhi kebutuhan makanan bagi populasi manusia yang pesat pertambahannya dari tahun ke tahun.
5
2.1.1 Biologi Eucheuma cottonii
Sinonim untuk Eucheuma cottonii adalah Kappaphycus alvarezii, namun Eucheuma cottonii lebih dikenal dalam dunia perdagangan nasional maupun internasional. Jenis ini mulanya didapat dari Perairan Sabah (Malaysia) dan Kepulauan Sulu (Filipina) kemudian dikembangkan ke berbagai negara sebagai tanaman budidaya. Di Indonesia seluruh produksinya berasal dari budidaya, antara lain dikembangkan di Jawa, Bali, NTB, Sulawesi dan Maluku (DKP 2006) Gambar 1 menyajikan salah satu jenis Eucheuma yang sudah lama dibudidayakan oleh para nelayan di pesisir.
Gambar 1. Jenis alga merah Eucheuma cottonii (images.google.co.id)
Ciri-ciri fisik dari Eucheuma sp adalah mempunyai thallus, kasar, agak pipih dan bercabang dua atau tiga, ujung-ujung percabangan ada yang runcing dan tumpul dengan permukaan bergerigi, agak kasar dan berbintil Noor (1991). Adapun warna dari rumput laut ini biasanya hijau, kuning kecoklatan hingga merah ungu (Afrianto dan Liviawati 1993).
6
Klasifikasi Eucheuma cottonii menurut Atmadja et al. (1996) adalah sebagai berikut.
Divisi : Thallophyta Kelas : Rhodophyceae
Ordo : Floridiophycidae Famili : Gigartinales
Genus : Selieriaceae
Spesies : Eucheuma cottonii
2.1.2 Manfaat dan kandungan Eucheuma cottonii
Jenis rumput laut yang sering dipakai dalam industri pangan Eucheuma cottonii dan Eucheuma spinosum. Eucheuma cottonii mengandung karaginan
(kappa karaginan) dan Eucheuma spinosum menghasilkan iota karaginan. Rumput laut dapat dijadikan sebagai sumber gizi karena mengandung serat, mineral, vitamin, protein, karbohidrat, lemak dan komposisi kimia lainnya yang diperlukan oleh tubuh dalam mempertahankan kesehatannya.
Rumput laut Eucheuma cottonii dapat digunakan sebagai bahan baku dalam pembuatan nata karena mengandung senyawa polisakarida/hidrokoloid yang bermanfaat untuk kesehatan dan serat yang tinggi dibandingkan dengan jenis rumput laut lain (69,3 g/100 g berat kering). Pemanfaatan hidrokoloid rumput laut ini dari tahun ke tahun bertambah bahkan terjadi kecenderungan perubahan dari pemanfaatan senyawa hidrokolid lain ke senyawa hidrokoloid dari rumput laut. Fungsi utama polisakarida rumput laut dalam formulasi produk pangan dan non pangan adalah sebagai emulsifier, pensuspensi, pengental dan stabilisator. Kemampuannya dalam membentuk gel yang baik karena kandungan polisakarida yang dimilikinya yaitu karaginan (kappa karaginan). Kappa karaginan mempunyai kemampuan membentuk gel pada saat larutan panas mendingin. Proses ini bersifat reversibel, artinya gel mencair pada pemanasan dan cairan membentuk gel kembali pada pendinginan (Glicksman 1983). Nata rumput laut yang dihasilkan dari rumput laut tidak mempunyai nilai gizi yang berarti karena
7
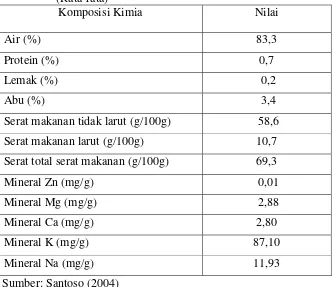
[image:31.595.147.480.244.531.2]Sumbangan gizi yang cukup bermakna dari rumput laut terutama dari jenis alga merah dan alga coklat adalah kandungan mineralnya (makro dan mikro). Alga merah dan alga coklat tersebut banyak mengandung mineral seperti natrium, kalium, serat, dan magnesium dengan komposisi yang sangat baik untuk kesehatan tubuh. Komposisi kimia rumput laut jenis Eucheuma cottonii dapat dilihat pada Tabel 1.
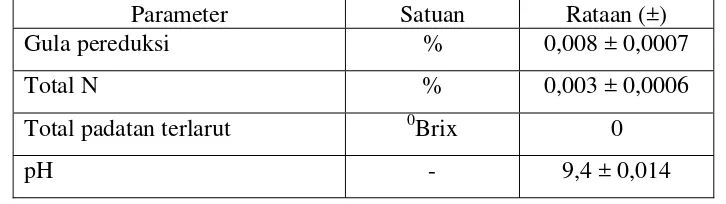
Tabel 1. Komposisi kimia rumput laut jenis Eucheuma cottonii. (Rata-rata)
Komposisi Kimia Nilai
Air (%) 83,3
Protein (%) 0,7
Lemak (%) 0,2
Abu (%) 3,4
Serat makanan tidak larut (g/100g) 58,6 Serat makanan larut (g/100g) 10,7 Serat total serat makanan (g/100g) 69,3
Mineral Zn (mg/g) 0,01
Mineral Mg (mg/g) 2,88
Mineral Ca (mg/g) 2,80
Mineral K (mg/g) 87,10
Mineral Na (mg/g) 11,93
Sumber: Santoso (2004)
8
2.2 Definisi Nata
Istilah nata berasal dari Bahasa Spanyol yang diterjemahkan ke dalam Bahasa Latin sebagai natare, yang berarti terapung-apung. Makanan olahan dari sari kelapa ini mulai diperkenalkan di Indonesia sekitar tahun 1987. Teknologi pengolahan produk ini berasal dari Fillipina. Nata dapat dibuat dari air kelapa, santan kelapa, tetes tebu (molases), limbah cair tahu, atau sari buah (nanas, melon, markisa, pisang, jeruk, jambu biji, dan lain-lain). Pemberian nama nata tergantung dari bahan baku yang digunakan (Saragih 2004).
Nata adalah biomassa yang sebagian besar terdiri dari selulosa, berbentuk agar dengan lapisan berwarna putih. Lapisan ini adalah massa mikroba berkapsul dari selulosa. Lapisan nata mengandung sisa media yang sangat asam. Rasa dan bau masam tersebut dapat dihilangkan dengan perendaman dan perebusan dengan air. Nata adalah produk fermentasi oleh bakteri Acetobacter xylinum pada substrat yang mengandung sukrosa. Bakteri tersebut membutuhkan nitrogen untuk melakukan aktivitasnya. Acetobacter xylinum yang ditumbuhkan pada media dengan kadar sukrosa tinggi akan menggunakan sebagian glukosa untuk
aktivitas metabolisme dan sebagian lagi diuraikan menjadi suatu polisakarida yang dikenal dengan extracellular sellulosa berbentuk gel. Polisakarida itulah yang disebut nata. Nata merupakan komoditi ekspor ke negara-negara Eropa, makanan ini juga membantu penderita diabetes sebagai makanan berkalori rendah (keluargamustafa.wordpress.com).
9
membentuk jaringan yang secara terus-menerus menjadi nata (Thimann dan Kenneth 1964).
2.2.1 Nata rumput laut
Nata de cottonii adalah produk yang dibuat dari rumput laut Eucheuma cottonii. Rumput laut ini merupakan rumput laut penghasil karaginan yang mempunyai fungsi sebagai bahan baku industri farmasi, tekstil, cat dan lain-lain selain diolah menjadi berbagai produk pangan seperti cendol, sirup, dodol, manisan, dan puding. Modifikasi produk yang dapat menyajikan bentuk yang lain dari bahan bakunya adalah nata. Rumput laut jenis Eucheuma cottonii merupakan salah satu alternatif yang dapat digunakan sebagai media bagi pertumbuhan bakteri pembentuk nata (Acetobacter xylinum). Komponen sukrosa yang terdapat di dalam media akan diubah menjadi substansi yang menyerupai gel dan terbentuk di permukaan media oleh bakteri tersebut. Seperti halnya industri nata de coco, maka industri nata rumput laut ini dapat diterapkan pada skala kecil karena peralatan, proses dan teknologi yang sederhana sehingga terjangkau. Nata de cottonii mempunyai kandungan nutrisi yang lebih baik dari nata de coco seperti
kandungan lemak 0,23 % dan protein 0,57 % serta serat makanan 4,5 % (Isti 2005). Sebagai sumber serat makanan, nata de cottonii mempunyai kadar total serat makanan yang cukup tinggi. Nata rumput laut yang sudah pernah dibuat dari jenis yang lain adalah nata Gracillaria oleh Apit pada tahun 2007.
2.2.2 Bahan-bahan pembuatan nata rumput laut (a) Sukrosa
Sukrosa atau gula merupakan senyawa organik yang paling ekonomis digunakan dan mudah dicerna di dalam tubuh sebagai kalori. Selain itu sukrosa juga berfungsi sebagai pengawet makanan. Sukrosa merupakan senyawa kimia disakarida yang tergolong ke dalam karbohidrat, mempunyai rasa manis dan larut dalam air (Winarno 1991).
Sukrosa yang dipakai dalam pembuatan nata pada umumnya adalah gula pasir yang berfungsi sebagai sumber karbon (energi). Banyaknya sukrosa yang
10
baik digunakan bagi pertumbuhan dan perkembangan bibit nata. Adapun dari segi warna yang paling baik digunakan adalah sukrosa putih. Sukrosa yang berwarna coklat akan mempengaruhi penampakan nata sehingga kurang menarik. Sukrosa yang berwarna putih akan menghasilkan nata berwarna putih bersih. Saat pembuatan bibit nata de coco, jumlah sukrosa yang ditambahkan adalah 30 g per liter air kelapa yang digunakan (Saragih 2004) dan 10 % pada pembuatan nata rumput laut, sedangkan dalam pembuatan makanan, sukrosa dapat menghambat pertumbuhan mikroorganisme dan menurunkan aktivitas air dalam bahan pangan (Buckle et al. 1985). Selama pemanasan, sebagian sukrosa akan terurai menjadi glukosa dan fruktosa (Winarno 1991).
Penambahan sukrosa yang berlebih dalam pembuatan nata dapat menyebabkan terganggunya aktivitas bakteri, mengakibatkan banyak sukrosa yang diubah menjadi asam, penurunan pH secara drastis, dan merugikan industri nata. Semakin banyak sukrosa yang ditambahkan, akan semakin banyak sukrosa yang mengalami browning, sehingga warna media semakin gelap karena terperangkap dalam struktur serat nata yang transparan. Penambahan sukrosa yang
terlalu sedikit menyebabkan bibit nata menjadi tidak tumbuh normal dan nata yang terbentuk tidak dapat dihasilkan secara maksimal (Pambayun 2002).
(b)Dimetil amino fosfat (DAP)
11
(c) Asam asetat glasial
Asam asetat atau asam cuka digunakan untuk menurunkan pH atau meningkatkan keasaman air kelapa. Asam asetat yang baik adalah asam asetat glasial 99,8 %. Asam asetat dengan konsentrasi rendah dapat digunakan dalam pembuatan nata, namun untuk mencapai tingkat keasaman yang diinginkan yaitu pH 4-5 dibutuhkan jumlah yang banyak sehingga tidak ekonomis.
Dosis penggunaan asam asetat dalam pembuatan nata de coco sekitar 5 ml/liter air kelapa hingga diperoleh pH 4,0-4,5 (Saragih 2004). Pembuatan nata agar menggunakan asam asetat glasial sebanyak 0,75 % (w/v) (BPPMHP 2005). Digunakannya asam asetat glasial (cuka biang) karena apabila digunakan cuka dengan konsentrasi lebih rendah, maka asam cuka yang ditambahkan harus lebih banyak sehingga terjadi penambahan volume yang cukup besar.
(d) Starter nata
Acetobacter xylinum merupakan starter yang lebih produktif dari jenis starter lainnya. Starter dengan konsentrasi 5-10 % (v/v) merupakan konsentrasi yang ideal dalam pembuatan nata. Dianjurkan volume starter tidak kurang dari
5 % volume media nata (goarticles.com). Starter nata adalah bibit nata yang telah diinokulasikan sehingga siap digunakan dalam pembuatan nata. Pemakaian starter yang terlalu banyak tidak dianjurkan karena tidak ekonomis. Umumnya starter disiapkan dalam botol sirup yang berwarna jernih sehingga mutu starter dapat di lihat dengan mudah. Biasanya starter siap pakai setelah di inkubasi selama 4-7 hari, tergantung pada kondisi bibit. Bibit yang dipakai adalah biakan bakteri Acetobacter xylinum dalam media air kelapa. Penggunaan biang cair hendaknya hanya lima sampai enam kali peremajaan.
12
pertumbuhannya (Thimann dan Kenneth 1964). Asam yang dihasilkan oleh salah satu mikroba selama fermentasi biasanya akan menghambat perkembangbiakan mikroba lain. Penurunan nilai pH medium kultur bakteri nata berperan terhadap daya hambat pertumbuhan mikroba pembusuk.
Bakteri nata sangat sensitif terhadap pencemaran mikroba. Kontaminan yang kerap mengganggu pertumbuhan bakteri nata adalah kapang (terutama Famili Aspergillus dan Penicillum), bakteri batang (Famili Bacillus) dan kapang berwarna merah. pencemaran mikroba dapai dicegah apabila semua peralatan produksi, bahan dan lingkungan unit usaha dijaga kebersihannya (Saragih 2004).
2.2.3 Bakteri pembentuk nata
Bakteri yang digunakan dalam pembuatan nata pada umumnya adalah Acetobacter xylinum. Acetobacter xylinum mempunyai ciri-ciri antara lain gram negatif, obligat aerobik, berbentuk batang (media asam), membentuk kapsul (media basa), bersifat nonmotil dan tidak membentuk spora (Widia 1984). Pertumbuhan bakteri ini dipengaruhi oleh faktor-faktor antara lain pH, suhu, sumber nitrogen dan sumber karbon. Sumber karbon dapat berupa sukrosa dari
berbagai macam jenis seperti glukosa, sukrosa, fruktosa, dan lainnya. Asam asetat glasial digunakan untuk menurunkan pH media yang akan dipakai (Herman 1979). Sel Acetobacter xylinum dalam media asam berbentuk batang sedangkan dalam media alkali berbentuk oval (Alaban 1962).
Bakteri Acetobacter xylinum dapat tumbuh dan berkembang membentuk nata karena adanya kandungan air sebanyak 91,23 %, protein 0,29 %, lemak 0,15 %, karbohidrat 7,27 % serta abu 1,06 % di dalam air kelapa. Selain itu terdapat juga nutrisi-nutrisi berupa sukrosa, dekstrase, fruktose dan vitamin B kompleks yang terdiri dari asam nikotinat 0,01µg, asam patrotenat 0,52 µg, biotin 0,02 µg, riboflavin 0,01 µg, dan asam folat 0,003 µg per ml. Nutrisi-nutrisi tersebut merangsang pertumbuhan Acetobacter xylinum untuk membentuk nata de coco (Palungkun 1998).
13
polisakarida berlendir membentuk suatu jalinan yang terus menebal menjadi lapisan nata (Thimann dan Kenneth 1964).
Karakteristik fisiologi Acetobacter xylinum antara lain tidak mampu mencairkan gelatin, tidak memproduksi H2S, pada suhu 65–70 0C bersifat thermal death point. Sifat khas Acetobacter xylinum apabila ditumbuhkan pada medium yang mengandung sukrosa dan asam akan membentuk lapisan selulosa yang dikenal sebagai nata (Alaban 1962).
Pertumbuhan Acetobacter xylinum membutuhkan vitamin-vitamin tertentu dari vitamin B kompleks atau campuran asam-asam amino yang cukup dilengkapi dengan zat organik, nitrogen, dan vitamin. Acetobacter xylinum memperoleh energi dengan cara mengoksidasi sukrosa dan alkohol dengan dissimilasi anaerob (yaitu proses penguraian zat untuk membebaskan energi tanpa adanya oksigen). Energi yang timbul dari proses perombakan sukrosa oleh Acetobacter xylinum kemudian digunakan untuk menjalankan metabolisme dalam sel bakteri tersebut (Soeseno 1984). Beberapa spesies dari Acetobacter seperti Acetobacter capsulatus dan Acetobacter viscosus dapat menghasilkan polisakarida, tetapi bukan selulosa
melainkan tergolong semacam dekstran (Dimaguilla 1967).
2.2.4 Tahap pembuatan nata
Fermentasi nata terdiri dari tiga tahap, yaitu pemeliharaan biakan murni Acetobacter xylinum, pembuatan starter, fermentasi. Tahap fermentasi dilakukan pada media cair yang telah diinokulasikan dengan starter. Fermentasi berlangsung pada kondisi aerob. Fermentasi dilangsungkan sampai nata yang terbentuk cukup tebal. Ukuran tersebut tercapai setelah 10 hari. Proses fermentasi diakhiri pada hari ke-15 (keluargamustafa.wordpress.com).
14
ditutup kemudian didinginkan sampai mencapai suhu ruang selama semalam (Pambayun 2002).
Tanda awal pertumbuhan bakteri nata pada medium cair yang mengandung gula adalah timbulnya kekeruhan setelah inkubasi selama 24 jam pada suhu kamar. Setelah 36-48 jam, suatu lapisan tembus cahaya terbentuk dipermukaan medium dan secara bertahap akan menebal membentuk lapisan yang lebih kompak (Lapuz et al 1967). Ketebalan nata disebabkan karena meningkatnya produksi selulosa dengan daya peningkatan jumlah glukosa dalam media (Yoneda 2003). Selama fermentasi berlangsung wadah tidak boleh diganggu atau digoyang karena pertumbuhan nata akan terganggu. Bila fermentasi di goyang, maka akan menghasilkan nata dengan bentuk yang berlapis-lapis dan saling terpisah.
Pemanenan dilakukan setelah fermentasi berlangsung selama 14 hari. Lembaran nata yang sudah bersih kemudian direndam dalam air selama 2-3 hari untuk menghilangkan asam dan setiap hari diganti dengan air baru (Astawan dan palupi 1991).
2.2.5 Kondisi dan media pertumbuhan nata
Kualitas nata yang baik akan terpenuhi apabila media yang digunakan memenuhi standar kualitas bahan nata dan prosesnya dikendalikan dengan cara yang benar berdasarkan faktor-faktor yang mempengaruhi pertumbuhan dan aktivitas Acetobacter xylinum yang digunakan. Rasio antara karbon dan nitrogen yang diatur secara optimal dan prosesnya terkontrol dengan baik, maka semua cairan yang dipakai akan berubah menjadi nata tanpa meninggalkan residu sedikitpun (atmajaya.ac.id)
Syarat media nata antara lain mempunyai sumber karbon dapat berupa gula, sumber nitrogen dapat berupa penambahan urea/ZA, mineral dan vitamin yang mendukung pertumbuhan bakteri Acetobacter xylinum. kondisi lingkungan juga sangat berpengaruh karena bakteri Acetobacter xylinum memiliki kondisi optimum lingkungannya untuk tumbuh dengan baik, yaitu suhu, pH, cahaya dan oksigen (one.indoskripsi.com)
15
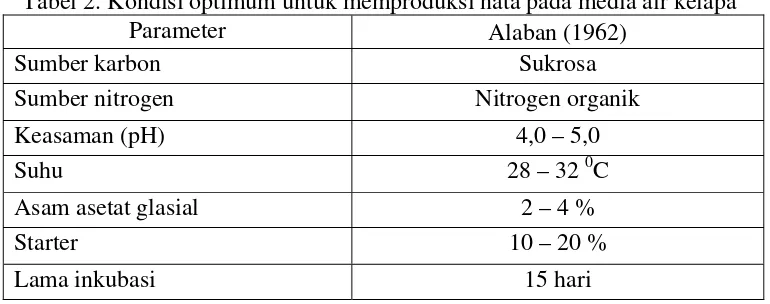
[image:39.595.120.505.207.359.2]mengandung senyawa nitrogen, vitamin dan mineral. Derajat keasaman (pH) yang paling baik untuk pertumbuhannya adalah 4–4,5 dengan suhu ruangan tempat fermentasi berkisar 28–30 0C (Saragih 2004). Berikut adalah parameter yang digunakan dalam memproduksi nata agar dapat menghasilkan keadaaan yang optimum. Kondisi optimum pertumbuhan nata disajikan pada Tabel 2.
Tabel 2. Kondisi optimum untuk memproduksi nata pada media air kelapa
Parameter Alaban (1962)
Sumber karbon Sukrosa
Sumber nitrogen Nitrogen organik
Keasaman (pH) 4,0 – 5,0
Suhu 28 – 32 0C
Asam asetat glasial 2 – 4 %
Starter 10 – 20 %
16
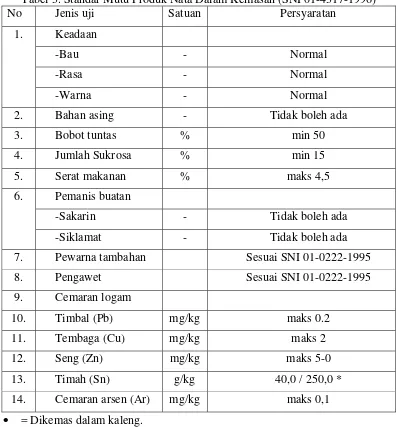
[image:40.595.113.511.167.594.2]Badan Standarisasi Nasional 01-4317-1996 menetapkan kriteria-kriteria mutu yang harus dipenuhi dalam produksi nata dalam kemasan sebagaimana disajikan pada Tabel 3.
Tabel 3. Standar Mutu Produk Nata Dalam Kemasan (SNI 01-4317-1996)
No Jenis uji Satuan Persyaratan
1. Keadaan
-Bau - Normal -Rasa - Normal
-Warna - Normal
2. Bahan asing - Tidak boleh ada
3. Bobot tuntas % min 50
4. Jumlah Sukrosa % min 15
5. Serat makanan % maks 4,5
6. Pemanis buatan
-Sakarin - Tidak boleh ada
-Siklamat - Tidak boleh ada
7. Pewarna tambahan Sesuai SNI 01-0222-1995
8. Pengawet Sesuai SNI 01-0222-1995
9. Cemaran logam
10. Timbal (Pb) mg/kg maks 0.2
11. Tembaga (Cu) mg/kg maks 2
12. Seng (Zn) mg/kg maks 5-0
13. Timah (Sn) g/kg 40,0 / 250,0 *
14. Cemaran arsen (Ar) mg/kg maks 0,1 • = Dikemas dalam kaleng.
2.2.6 Kandungan gizi nata agar, nata de coco dan nata komersial
Nilai gizi nata sangat rendah sekali karena kandungan terbesarnya adalah air yang mencapai 98 %. Produk ini dapat dipakai sebagai sumber makanan rendah energi untuk keperluan diet. Nata juga mengandung serat (dietary fiber) yang sangat dibutuhkan tubuh dalam proses fisiologi. Produk ini dapat membantu
17
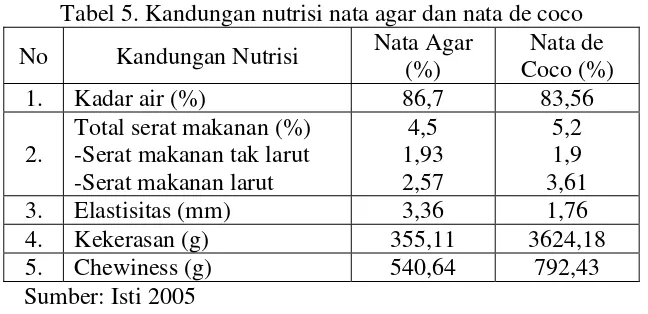
[image:41.595.165.465.188.317.2]tambahan yang dapat menjaga kesehatan tubuh manusia. Berikut ini adalah kandungan gizi dari nata rumput laut dan nata de coco yang dianalisis oleh BPPMHP tahun 2005 serta kandungan gizi nata komersil. Komposisi gizi ketiga produk nata tersebut dapat dilihat pada Tabel 4 dan Tabel 5.
Tabel 4. Informasi nilai gizi nata de coco (takaran saji 180 g)
Kandungan Gizi % AKG
Lemak total 0 g 0 %
Protein 0 g 72 g
Total karbohidrat 35 g 11 %
Serat pangan 2 g 8 %
Sodium / natrium 5 mg 1 %
Sumber: Inaco, nata de coco 2009
Tabel 5. Kandungan nutrisi nata agar dan nata de coco
No Kandungan Nutrisi Nata Agar (%)
Nata de Coco (%)
1. Kadar air (%) 86,7 83,56
2.
Total serat makanan (%) -Serat makanan tak larut -Serat makanan larut
4,5 1,93 2,57 5,2 1,9 3,61
3. Elastisitas (mm) 3,36 1,76
4. Kekerasan (g) 355,11 3624,18
5. Chewiness (g) 540,64 792,43
Sumber: Isti 2005
2.3 Serat Nata
Sebagian besar kandungan nata adalah serat berupa selulosa. Selulosa nata tersebut diproduksi oleh bakteri. Serat yang dihasilkan oleh bakteri pada umumnya sama dengan serat yang terbentuk di dalam dinding sel tanaman, hanya terbentuknya tidak di dalam dinding sel bakteri, tetapi di luar sel tersebut (Sri 1992). Selulosa membentuk massa yang bergumpal pada permukaan medium. Sel menerima molekul-molekul glukosa, bergabung dengan lemak membentuk penyokong yang terdapat pada membran sel, lalu keluar bersama-sama enzim yang menggabungkan sisa heksosa menjadi serat. Pembentukan serat ini terlihat
[image:41.595.151.475.331.488.2]18
Kelebihan serat dari bakteri adalah mempunyai sifat fisika kimia yang relatif tetap dan dapat diproduksi dalam jumlah yang besar tanpa tergantung pada musim. Kelebihan serat nata adalah dapat diproduksi baik dengan kultur diam maupun kocok, tergantung dari sifat serat yang diinginkan. Serat-serat selulosa kebanyakan tidak mengandung fitat sehingga cocok untuk digunakan sebagi produk dietary supplement, karena fitat dapat mengganggu proses penyerapan vitamin dan mineral dalam usus. Nata terbentuk karena sel-sel bakteri menggabungkan molekul-molekul glukosa dengan asam lemak membentuk prekursor pada membran sel. Prekursor ini selanjutnya dikeluarkan dalam bentuk ekskresi dan dengan bantuan enzim mempolimerisasikan glukosa menjadi selulosa di luar sel bakteri (kapsul). Pembentukan kapsul oleh bakteri biasanya terjadi karena kondisi lingkungan yang ekstrim seperti keasaman media (Laily et al. 2003).
2.4 Serat Makanan
Serat adalah makanan berbentuk karbohidrat kompleks yang banyak terdapat pada dinding sel tanaman pangan. Serat makanan adalah bagian dari
bahan pangan yang tidak dapat dihidrolisis oleh enzim-enzim pencernaan. Serat makanan ini terdiri dari dinding sel tanaman yang sebagian besar mengandung tiga macam polisakarida yaitu selulosa, zat pektin dan hemiselulosa, selain itu juga mengandung zat yang bukan karbohidrat yaitu lignin. Mutu serat makanan dapat dilihat dari komposisi komponen serat makanan. Komponen serat makanan terdiri dari komponen yang larut (soluble dietary fiber) dan komponen yang tidak larut (total dietary fiber). Sepertiga dari serat makanan total adalah serat makanan yang larut, sedangkan kelompok terbesarnya merupakan serat yang tidak larut (Irwansyah 2003)
19
besar untuk menghidrolisis komponen-komponen makanan dibandingkan dengan enzim pencernaan (Sulaeman et al. 1993).
Serat dalam makanan digolongkan menjadi dua golongan, yaitu tidak larut seperti selulosa dan hemiselulosa yang terdapat hampir di semua jenis bahan pangan nabati khususnya buah dan sayuran. Serat yang larut adalah pektin yang banyak terdapat dalam buah-buahan (Siagian 2003)
3.
METODOLOGI
3.1 Waktu dan Tempat Penelitian
Penelitian pendahuluan (tahap 1) ini dilakukan dari Bulan Agustus sampai dengan September 2008, bertempat di Balai Besar Pengembangan dan Pengendalian Hasil Perikanan (BBP2HP), Muara Baru, Jakarta Utara. Penelitian utama (tahap 2) dilakukan pada bulan Oktober hingga November 2008 dan analisis laboratorium dilakukan di Laboratorium Biokimia Pangan, Departemen ITP, FATETA, IPB, Bogor.
3.2 Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini terdiri dari alat pembuat nata rumput laut dan alat untuk menganalisis mutu produk yang dihasilkan. Alat yang
digunakan dalam pembuatan nata de cottonii terdiri dari toples plastik (ukuran 1 kg), timbangan analitik, panci, blender, saringan, kompor gas, gunting, pisau, beaker glass, gelas ukur, pipet, plastik, koran, karet, sendok, pengaduk dan mangkuk kecil.
Peralatan yang digunakan untuk analisis fisik dan kimia nata de cottonii terdiri dari pH meter, refraktometer, dan Luff Schrool, tekstur analyzer, whitenessmeter Keitt tipe E1 (Jepang), timbangan analitik, mikrometer sekrup, pipet, gelas ukur, labu erlenmeyer, Iodimetri, desikator, inkubator dan alat analisis kimia lainnya seperti cawan, oven, thermocouple dan Rh meter serta alat untuk uji organoleptik.
21
3.3 Metode Penelitian
3.3.1 Penelitian tahap pertama
Penelitian tahap pertama diawali dengan perlakuan pengenceran filtrat rumput laut dan volume starter dengan dua kali ulangan. Pengenceran dilakukan terhadap rumput laut yang telah diblender dengan perbandingan 1:50, 1:60, 1:70 (rumput laut basah (g) : air (ml)) dan 1:40 sebagai kontrol, yang telah diaplikasikan dalam pembuatan nata agar oleh BPPMHP. Perlakuan volume starter yang digunakan, yaitu 5 % (v/v) dan 10 % (v/v). Proses ekstraksi dilakukan dengan merebus rumput laut yang telah diblender selama dua jam, kemudian disaring. Media yang sudah terisi filtrat ditambahkan gula 10 % (w/v), DAP 0,5 % (w/v) dan asam asetat glasial 0,75 % (v/v), dan didiamkan selama semalam hingga suhu mencapai suhu kamar. Penambahan starter ke dalam media dilakukan setelah suhu media mencapai suhu ruang.
Tahap pertama ini dipilih kombinasi pengenceran dan volume starter yang terbaik, yaitu yang memberikan rendemen nata terbaik. Filtrat dari kombinasi perlakuan tersebut kemudian dilanjutkan dengan analisis pH, total padatan
22
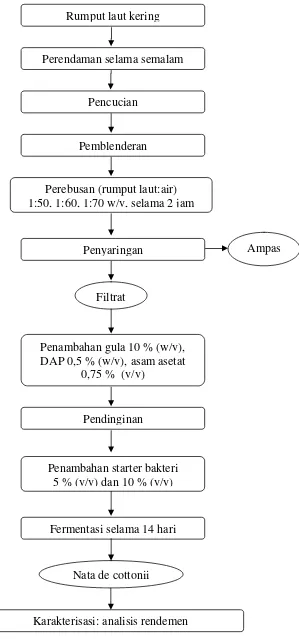
Gambar 2. Diagram alir proses pembuatan nata de cottonii tahap pertama (BPPMHP 2005)
Perebusan (rumput laut:air) 1:50, 1:60, 1:70 w/v, selama 2 jam
Penyaringan
Penambahan gula 10 % (w/v), DAP 0,5 % (w/v), asam asetat
0,75 % (v/v)
Ampas
Filtrat
Penambahan starter bakteri 5 % (v/v) dan 10 % (v/v)
Pencucian
Pemblenderan Rumput laut kering
Nata de cottonii
Perendaman selama semalam
Pendinginan
Fermentasi selama 14 hari
23
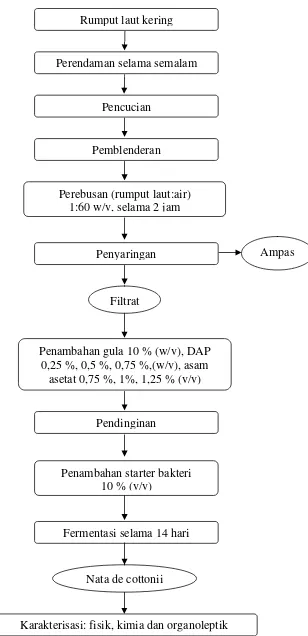
Gambar 3. Diagram alir proses pembuatan nata de cottonii tahap kedua (BPPMHP 2005)
Perebusan (rumput laut:air) 1:60 w/v, selama 2 jam
Penyaringan
Penambahan gula 10 % (w/v), DAP 0,25 %, 0,5 %, 0,75 %,(w/v), asam
asetat 0,75 %, 1%, 1,25 % (v/v)
Ampas
Filtrat
Penambahan starter bakteri 10 % (v/v)
Pencucian
Pemblenderan Rumput laut kering
Nata de cottonii
Perendaman selama semalam
Pendinginan
Fermentasi selama 14 hari
24
3.3.2 Penelitian tahap kedua
Perbandingan rumput laut dan air yang menghasilkan nata dengan nilai rendemen tertinggi pada tahap pertama dipilih untuk pembuatan nata tahap kedua.
Selanjutnya untuk mengetahui pengaruh DAP dan asam asetat glasial terhadap mutu nata, pada filtrat dengan perbandingan terbaik tersebut diberikan perlakuan DAP dalam 3 taraf yaitu 0,25 % (w/v), 0,5 % (w/v) dan 0,75 % (w/v). Perlakuan konsentrasi asam asetat glasial terdiri dari 3 taraf yaitu 0,75 % (v/v), 1 % (v/v) dan 1,25 %(v/v). Penelitian tahap kedua ini dilakukan dengan tiga kali ulangan.
Keseluruhan nata yang dihasilkan kemudian diuji secara fisik, yang meliputi berat, tebal, rendemen, derajat putih dan kekenyalan serta uji kimia yang meliputi kadar air dan serat makanan dan uji organoleptik yaitu uji hedonik.
3.4 Metode Analisa 3.4.1 Uji organoleptik
Uji organoleptik bertujuan untuk mengetahui apakah produk ini dapat diterima oleh masyarakat dan sejauh mana daya terimanya. Uji organoleptik yang dilakukan adalah Uji Hedonik. Skala hedonik yang digunakan berkisar antara 1-7, yakni (1) sangat tidak suka, (2) tidak suka, (3) kurang suka, (4) biasa/netral, (5) agak suka, (6) suka, dan (7) sangat suka (Soekarto 1990). Uji Hedonik bertujuan untuk melihat pengaruh perlakuan pada pembuatan nata terhadap kesukaan panelis dari segi warna, penampakan, tekstur, rasa dan aroma. Uji hedonik yang dilakukan terhadap nata de cottonii ini dilakukan oleh 10 orang panelis terlatih yang berasal dari Balai Besar Pengembangan dan Pengendalian Hasil Perikanan (BBP2HP), Jakarta Utara. Panelis terlatih adalah orang yang mempunyai kepekaan tinggi terhadap spesifikasi mutu suatu produk dan mempunyai pengetahuan dan pengalaman tentang cara-cara menilai organoleptik yang berasal dari Laboratorium Organoleptik Balai Pengembangan dan Pengujian Mutu Hasil Perikanan (BPPMHP), Muara Baru, Jakarta Utara. Parameter yang diuji adalah warna, tekstur, aroma, penampakan dan rasa. Penilaian rata-rata panelis secara
25
3.4.2 Analisis sifat fisik
Analisis sifat fisik meliputi berat, tebal, rendemen, derajat putih dan
chewiness (kekenyalan).
(a) Analisis rendemen (AOAC 1979 diacu dalam Arsatmojo 1996 )
Rendemen pada nata ini diukur dengan metode gravimetri dan dinyatakan dalam berat per volume media cair yang digunakan. Rendemen ini diukur setelah fermentasi selama 14 hari. Secara umum rumusnya adalah sebagai berikut.
Rendemen = Berat akhir yang diperoleh (g) x 100 % Berat awal bahan baku (g)
Keterangan : Berat media adalah berat larutan filtrat Eucheuma cottonii (air + Eucheuma cottonii + DAP + asam asetat glasial ).
(b) Uji ketebalan nata (Hubeis 1985)
Ketebalan nata diukur dengan menggunakan micrometer sekrup. Nilai ketebalan yang didapat merupakan rata-rata dari pengukuran lima tempat yang berbeda.
(c) Kekenyalan
kekenyalan pada nata rumput laut diukur dengan menggunakan alat Tekstur Analyzer. Kekenyalan dinyatakan dalam satuan gram force (gf). Nilai yang diperoleh merupakan hasil rata-rata pengukuran pada lima bagian nata yang berbeda. Sewaktu sample dimasukkan ke dalam Tekstur Analyzer, hasil pengukuran terhadap kekenyalan akan terlihat langsung di saat yang sama
secara bersamaan.
(d) Derajat putih (Arsatmodjo 1996)
26
dapat dilihat langsung pada skala yang terdapat pada whitenessmeter. Derajat putih contoh yang diukur mempunyai nilai antara 0-100 %.
3.4.3 Analisis sifat kimia
Analisis kimia nata rumput laut terdiri dari analisis filtrat rumput laut dan analisis nata de cottonii. Analisis filtrat terdiri dari pH, total padatan terlarut, gula pereduksi dan total N. Analisis nata de cottonii terdiri dari serat makanan dan kadar air.
A. Analisis filtrat rumput laut 1) Pengukuran pH (AOAC 1995 )
Pengukuran nilai pH dengan menggunakan pH meter adalah sebagai berikut :
(a) pH meter diputar ke arah buffer ke arah on, lalu dinetralkan dengan larutan buffer pH dan buffer pH 7. Sampel ditimbang sebanyak 10 g lalu dimasukan ke dalam gelas piala untuk diblender dan ditambahkan air destilat sebanyak 10 ml lalu diaduk selama 2 menit.
(b) Kemudian diukur pH-nya dengan pH meter. Nilai pH merupakan hasil
percobaan jarum petunjuk pada pH meter selama 1 menit sampai angka digitalnya tidak berubah lagi.
2) Total padatan terlarut
Pengukuran total padatan terlarut menggunakan alat refraktometer. Larutan yang akan dikur disaring, kemudian diteteskan pada prisma refraktometer. Nilai pada skala yang terbaca pada batas gelap dan terang menunjukan besarnya total padatan terlarut dalam satuan 0Brix.
3) Gula pereduksi (Slamet et al. 1997)
Analisis gula pereduksi dilakukan dengan metode Luff Schoorl. Tahapan-tahapannya adalah sebagai berikut :
27
larutan Pb-asetat. Penambahan bahan penjernih ini diberikan tetes demi tetes sampai penetesan dari Reagensia tidak menimbulkan pengaruh lagi. Ditambahkan akuades sampai tanda dan disaring.
(b) Filtrat ditampung dalam labu takar 200 ml. Kelebihan Pb dapat dihilangkan dengan penambahan Na2CO3 anhidrat atau K/Na-oksalat anhidrat atau larutan Na-fosfat 8 % secukupnya, kemudian ditambahkan akuades sampai tanda, dikocok dan disaring. Filtrat bebas Pb bila ditambahkan K/Na-oksalat atau Na-fosfat atau Na2CO3 tetap jernih.
(c) Diambil 25 ml filtrat bebas Pb yang diperkirakan mengandung 15-60 mg gula reduksi dan ditambahkan 25 ml larutan Luff-Schoorl dalam erlenmeyer. (d) Dibuat pula perlakuan blanko, yaitu 25 ml larutan Luff-Schoorl dengan 25
ml akuades.
(e) Setelah ditambah beberapa butir batu didih, erlenmeyer dihubungkan dengan pendingin balik kemudian didihkan. Diusahakan 2 menit sesudah mendidih. Pendidihan larutan dipertahankan selama 10 menit.
(f) Selanjutnya cepat-cepat didinginkan dan ditambahkan 15 ml KI 20 % serta
25 ml H2SO4 26,5 % secara hati-hati.
(g) Yodium yang dibebaskan dititrasi dengan larutan Na-thiosulfat 0,1 N memakai indikator pati sebanyak 2-3 ml. Untuk memperjelas perubahan warna pada akhir titrasi maka sebaiknya pati diberikan pada saat titrasi hampir berakhir.
(h) Perhitungan :
Dengan mengetahui selisih antara titrasi blanko dan titrasi contoh, kadar gula reduksi dalam bahan dapat dicari dengan menggunakan tabel khusus, yaitu tabel jumlah total gula reduksi yang dibutuhkan untuk mereduksi 10 ml Reagensia soxhlet pada penentuan gula reduksi menurut cara Lane-Eynon.
4) Total N (Slamet et al 1997)
Analisis total kandungan N dilakukan dengan metode Semi-mikro-Kjeldahl. Tahapannya adalah sebagai berikut :
28
(b) 10 ml dari laruan ini dimasukkan ke dalam labu kjeldahl 500 ml dan ditambahkan 10 ml H2SO4 (93-98 % bebas N). Ditambahkan 5 g campuran Na2SO4-HgO (20:1) untuk katalisator.
(c) Labu Kjeldahl beserta isinya di didihkan sampai jernih dan dilanjutkan sampai 30 menit lagi. Dinding dalam labu kjeldahl dicuci dengan akuades setelah dingin dan didihkan lagi selama 30 menit
(d) Setelah dingin ditambahkan 140 ml akuades dan ditambahkan 35 ml larutan NaOH-Na2S2O3 dan beberapa butir zink
(e) Kemudian dilakukan destilasi, destilat ditampung sebanyak 100 ml dalam erlenmeyer yang berisi 25 ml larutan jenuh asam borat dan beberapa tetes indikator metil merah.
(f) Larutan yang diperoleh dititrasi dengan 0,02 HCl. (g) Total N atau presentasi protein dihitung dalam contoh. (h) Perhitungan jumlah total N :
Jumlah N total : ml HCl X N HCl X 14,008 X f mg/ml ml larutan contoh
f = faktor pengenceran (besarnya 10)
B.Analisis kimia nata
1) Serat Makanan metode enzimatis (Sulaeman et al. 1993)
Sampel basah dihomogenisasi dan diliofilisasi, kemudian ditepungkan dan diayak dengan saringan 0,3 mm. Sampel diekstrak lemaknya dengan petroleum eter pada suhu kamar selama 15 menit, jika kadar lemaknya melebihi 6-8 %. Kemudian sampel ditimbang sebanyak 1 g, dimasukkan ke dalam erlenmeyer dan ditambahkan 25 ml 0,1 M buffer natrium fosfat 0,1 M pH 6,0 dan disuspensikan. Setelah itu tambahkan 100 µl termamyl, erlenmeyer ditutup, di inkubasi dalam penangas air 40 oC dan diagitasi selama 60 menit. Kemudian ditambah 20 ml air destilata dan pH-nya diatur menjadi 6,8 dengan NaOH. elektroda dibilas dengan 5 ml air. Ditambahkan 100 mg pankreatin, erlenmeyer ditutup dan diinkubasi dalam penangas 40 oC dan diagitasi selama 60 menit. Kemudian pH diatur menjadi 4,5 dengan penambahan HCl. Setelah
29
mengandung 0,5 g celite kering (berat tepat diketahui) kemudian dicuci dengan 2 x 10 ml air destilata.
a. Residu (serat makanan tidak larut)
Pertama-tama sampel dicuci dengan 2x10 ml etanol 95 % dan 2x10 ml aseton. Setelah itu, dikeringkan pada suhu 105 oC sampai berat tetap (sekitar 12 jam), kemudian setelah didinginkan dalam desikator (D1) ditimbang. Setelah itu diabukan dalam tanur 150 oC selama paling sedikit 5 jam. setelah didinginkan dalam desikator (I1) ditimbang.
b. Filtrat (serat makanan larut)
Pertama-tama volume filtrat diatur dengan air sampai 100 ml. Kemudian ditambahkan 400 ml etanol 95 % hangat (60 oC) dan didiamkan mengendap selama 1 jam. Setelah itu, disaring dengan ”crucible” kering (porositas 2) yang mengandung 0,5 gram celite. Selanjutnya dicuci dengan 2x10 ml etanol 78 %, 2x10 ml etanol 95 % dan 2x10 ml aseton. Kemudian dikeringkan pada suhu 105 oC selama semalam dan ditimbang setelah didinginkan dalam desikator (D2). Berikutnya diabukan dalam tanur 550 oC selama paling sedikit 5 jam dan
ditimbang setelah didinginkan dalam desikator (I2). c. Blanko
blanko untuk serat makanan larut dan tidak larut diperoleh dengan cara yang sama, tetapi tanpa sampel (B1 dan B2). Nilai blanko sekali-kali perlu diperiksa ulang, apalagi kalau menggunakan enzim dari kemasan baru.
Perhitungan ;
% serat makanan tidak larut = 1 1 1x100 W
B I
D − −
% serat makanan yang larut = 2 2 2 x100 W
B I
D − −
Keterangan : W = berat sampel (g)
30
2) Kadar air (metode oven AOAC 1995)
Prosedur penentuan kadar air adalah sebagai berikut:
Cawan kosong yang bersih dikeringkan pada suhu 100 0C-102 0C selama 15 menit, didinginkan dalam desikator kemudian ditimbang (b). Contoh sebanyak 5g (a) dimasukan dalam cawan, kemudian dioven pada suhu 100 - 102 0C selama 6 jam atau sampai berat konstan. Cawan berisi contoh didinginkan dalam desikator, kemudian ditimbang (c).
Perhitungan kadar air adalah sebagai berikut :
3.5 Rancangan percobaan dan analisis data
Rancangan percobaan yang digunakan dalam penelitian ini terdiri dari dua rancangan, yaitu Rancangan Acak Lengkap faktor tunggal dan menggunakan uji lanjut Duncan untuk menentukan beda nyata tiap perlakuan yang diberikan. Rancangan percobaan yang digunakan pada penelitian lanjutan adalah Rancangan Acak Lengkap faktorial dengan tiga kali ulangan dan menggunakan uji lanjut Duncan. Model rancangan percobaannya adalah sebagai berikut.
3.5.1 Rancangan percobaan penelitian tahap pertama :
Yij = µ +
Ai+
ε
ijKeterangan :
Yij = nilai pengamatan nata rumput laut yang dibuat dengan perlakuan faktor pengenceran sebesar i pada ulangan ke-j
µ
= nilai rata-rata umumAi = taraf ke-i perlakuan
ε
ij = pengaruh kesalahan percobaan karena perlakuan ke-i ulangan ke-ji = 1,2,3,4 (jenis formulasi) j = 1,2,3
Kadar air (% bb) x 100% a
b) (c a− − =
Kadar air (% bk) x 100% b)
-(c
31
3.5.2 Rancangan percobaan penelitian tahap kedua : Yijk = µ + Ai + Bj + (AB)ij + Єijk
Yijk = Nilai pengamatan pada rendemen dan mutu nata de cottonii dengan kombinasi perlakuan taraf ke-i dan taraf ke-j
µ = Nilai tengah rendemen dan mutu nata de cottonii
Ai = Pengaruh sumber nitrogen pada taraf ke-i.
Bj = Pengaruh konsentrasi sumber nitrogen pada taraf ke-j.
(AB)ij = Pengaruh interkasi sumber nitrogen pada taraf ke-i dan konsentrasi sumber nitrogen pada taraf ke-j.
Єijk = Pengaruh galat dari rendemen dengan kombinasi perlakuan ij.
Data yang diperoleh dari analisis sifat fisik dianalisa secara statistik dengan ANOVA dan untuk mengetahui ada atau tidaknya perbedaan yang nyata dilakukan uji Tukey. Data hasil uji organoleptik diuji dengan uji statistik non parametrik Kruskal Wallis. Uji kruskal Wallis ini bertujuan untuk mengetahui apakah antara perlakuan berbeda nyata dalam hal rankingnya. Apabila hasil analisis menunjukkan adanya pengaruh nyata maka dilanjutkan dengan uji lanjut Tukey yang bertujuan untuk mengetahui perlakuan yang memberikan pengaruh yang berbeda nyata terhadap parameter yang diukur.
<