ANALISIS ION KALIUM (K
+), ION NATRIUM (Na
+),
DAN PROTEIN DARI AIR KELAPA VARIETAS
KELAPA DALAM DAN KELAPA HIBRIDA
SKRIPSI
EFAN EFENDI
100822053DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
ANALISIS ION KALIUM (K
+), ION NATRIUM (Na
+),
DAN PROTEIN DARI AIR KELAPA VARIETAS
KELAPA DALAM DAN KELAPA HIBRIDA
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar sarjana sains
EFAN EFENDI
100822053DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
PERSETUJUAN
Judul : ANALISIS ION KALIUM (K+), ION NATRIUM
(Na+), DAN PROTEIN DARI AIR KELAPA
VARIETAS KELAPA DALAM DAN KELAPA HIBRIDA
Kategori : SKRIPSI
Nama : EFAN EFENDI
Nomor Induk Mahasiswa : 100822053
Program Studi : SARJANA (S1) – KIMIA EKSTENSI
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM UNIVERSITAS SUMATERA UTARA
Disetujui : Medan, Juli 2013
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Drs. Saut Nainggolan Drs. Ahmad Darwin,
M.Sc
NIP. 194701251974031001 NIP.
195211161980031001
Diketahui/Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
ANALISIS ION KALIUM (K+), ION NATRIUM (Na+), DAN PROTEIN DARI AIR KELAPA VARIETAS KELAPA DALAM DAN KELAPA
HIBRIDA
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juli 2013
PENGHARGAAN
Segala puji dan syukur hanya bagi Allah SWT yang telah melimpahkan rahmat dan karunia-Nya kepada penulis sehingga penulis dapat menyelesaikan skripsi ini sebagai salah satu persyaratan untuk meraih gelar Sarjana Kimia pada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara. Adapun judul skripsi ini adalah “ANALISIS ION KALIUM (K+), ION NATRIUM (Na+), DAN PROTEIN DARI AIR KELAPA VARIETAS KELAPA DALAM DAN KELAPA HIBRIDA.
Dengan diselesaikannya skripsi ini, penulis menyampaikan penghargaan dan rasa terima kasih kepada Ayahanda tercinta Alm. Yasri dan ibunda tercinta Yurnalis yang telah mendidik, merawat, memberikan kasih sayang dan doa yang tulus untuk keberhasilan penulis dalam menyelesaikan pendidikan. Pada kesempatan ini penulis juga ingin mengucapkan terima kasih kepada :
1. Bapak Drs. Ahmad Darwin, M.Sc selaku dosen pembimbing I dan Bapak Drs. Saut Nainggolan selaku dosen pembimbing II yang telah banyak memberi pengarahan dan bimbingan hingga skripsi ini dapat diselesaikan.
2. Ibu Dr. Rumondang Bulan Nst, M.S selaku Ketua Departemen Kimia dan Bapak Drs. Albert Pasaribu, M.Sc selaku sekretaris Jurusan Kimia FMIPA USU yang telah mengesahkan skripsi ini.
3. Dekan dan Pembantu Dekan Fakultas Matematika dan Ilmu pengetahuan Alam Universitas Sumatera Utara
4. Kepada Om penulis Ir. Haiyun Majid beserta istri Yasmiati, S.Pd, M.Pd dan seluruh keluarga yang telah mendidik memberikan semangat baik moril, materil, serta doa yang tulus untuk keberhasilan penulis dalam menyelesaikan pendidikan
5. Seluruh staf pengajar serta pegawai Program Studi Kimia Ektensi FMIPA USU.
6. Rekan- rekan Mahasiswa Kimia Ekstensi angkatan 2010 atas kerjasama yang baik selama perkuliahan.
Penulis menyadari bahwa skripsi ini masih kurang sempurna, oleh karena itu penulis mengharapkan kritik dan saran dari pihak pembaca demi kesempurnaan skripsi ini. Akhirnya semoga skripsi ini bermanfaat bagi penelitian dan kemajuan ilmu pengetahuan untuk yang akan datang.
Medan, Juli 2013
ABSTRAK
ANALYSIS OF POTASSIUM ION (K +), SODIUM ION (Na +), AND PROTEIN FROM DALAM COCONUT VARIETIES WATER
AND HYBRID COCONUT
ABSTRACT
DAFTAR ISI
PERSETUJUAN i
PERNYATAAN ii
PENGHARGAAN iii
ABSTRAK iv
ABSTRACT v
DAFTAR ISI vi
DAFTAR TABEL ix
DAFTAR GAMBAR x
DAFTAR LAMPIRAN xi
BAB I PENDAHULUAN 1
1.1 Latar Belakang 1
1.2 Permasalahan 3
1.3 Pembatasan Masalah 3
1.4 Tujuan Penelitian 3
1.5 Lokasi Penelitian 4
1.6 Manfaat Penelitian 4
1.7 Metodologi Penelitian 4
BAB II TINJAUAN PUSTAKA 5
2.1 Kelapa 5
2.1.1 Jenis - Jenis Kelapa 6
2.1.2 Air Kelapa 7
2.1.3 Manfaat Air Kelapa 9
2.2 Mineral 10
2.2.1 Kalium 10
2.2.2 Natrium 11
2.2.3 Preparasi Sampel Untuk Penentuan Kadar Mineral 12
2.3 Protein 13
2.3.1 Uji Kualitatif Protein 14
2.3.1 Penentuan Jumlah Protein Total 14
2.4 Spektrofotometri Serapan Atom 17
BAB III METODOLOGI PENELITIAN 19
3.1 Bahan - Bahan 19
3.2 Alat - Alat 19
3.3 Prosedur Penelitian 20
3.3.1 Pengambilan Sampel 20
3.3.2 Pembuatan Pereaksi 21
3.3.2.1 Pembuatan Larutan H3BO3 3% 21
3.3.2.2 Pembuatan Larutan NaOH 3O% 21
3.3.2.4 Pembuatan Larutan Na2CO3 0,1 N 21
3.3.2.5 Pembuatan Larutan HCl 0,1 N 21
3.3.3 Pengujian Kualitatif Untuk Ion Kalium, Ion Natrium, dan
protein 21
3.3.3.1 Uji Kualitatif Ion Kalium 21
3.3.3.2 Uji Kualitatif Ion Natrium 22
3.3.3.3 Uji Xantoprotein 22
3.3.4 Penentuan Kadar Ion Kalium (K+) Dengan Metode
Spektrofotometri Serapan Atom (SSA) 22
3.3.4.1 Pembuatan Larutan Seri Standar Kalium 100 ppm 22 3.3.4.2 Pembuatan Larutan Seri Standar Kalium 10 ppm 22 3.3.4.3 Pembuatan Larutan Seri Standar Kalium 0,0; 0,5;
1,0; 1,5; 2,0; 2,5 dan 3,0 ppm 22
3.3.4.4 Pembuatan Kurva Standar Kalium 23 3.3.4.5 Penentuan Kadar Ion Kalium (SNI 01-2427-1991) 23 3.3.5 Penentuan Kadar Ion Natrium (Na+) Dengan Metode
Spektrofotometri Serapan Atom (SSA) 23
3.3.5.1 Pembuatan Larutan Seri Standar Natrium 100 ppm 23 3.3.5.2 Pembuatan Larutan Seri Standar Natrium 10 ppm 24 3.3.5.3 Pembuatan Larutan Seri Standar Natrium 0,0; 0,1;
0,2 0,3; 0,4; dan 0,5 ppm 24
3.3.5.4 Pembuatan Kurva Standar Natrium 24 3.3.5.5 Penentuan Kadar Ion Natrium (SNI 01-2428-1991) 24 3.3.6 Penentuan Kadar Protein Dengan Metode Kjeldhal 25
3.3.6.1 Standarisasi HCl 0,1 N 25
3.3.6.2 Penentuan Kadar Protein (SNI 01-2891-1992) 25
3.4 Bagan Penelitian 26
3.4.1 Proses Pengambilan Sampel 26
3.4.2 Penentuan Kadar Ion Kalium (SNI 01-2427-1991) 27 3.4.3 Penentuan Kadar Ion Natrium (SNI 01-2428-1991) 28 3.4.4 Penentuan Kadar Protein (SNI 01-2891-1992) 29
BAB IV HASIL DAN PEMBAHASAN 30
4.1 Hasil 30
4.1.1 Hasil Penentuan Uji Kualitatif Ion Kalium, Ion Natrium,
dan Protein Dalam Sampel Air Kelapa 30
4.1.2 Hasil Penentuan Konsentrasi Ion Kalium Dalam Sampel
Air Kelapa 30
4.1.2.1 Perhitungan Penetapan Garis Regresi Untuk
Larutan Standar Kalium 31
4.1.2.2 Perhitungan Konsentrasi Ion Kalium Pada
Sampel Air Kelapa 33
4.1.3 Hasil Penentuan Konsentrasi Ion Natrium Dalam Sampel
Air Kelapa 36
4.1.3.1 Perhitungan Penetapan Garis Regresi Untuk
4.1.3.2 Perhitungan Konsentrasi Ion Natrium Pada
Sampel Air Kelapa 39
4.1.4 Hasil Penentuan Kadar Protein Pada Sampel Air Kelapa 42 4.1.4.1 Perhitungan Standarisasi Larutan HCl 0,1 N 42 4.1.4.2 Perhitungan Kadar Protein Pada Sampel Air
Kelapa 43
4.2 Pembahasan 45
BAB V KESIMPULAN DAN SARAN 46
5.1. Kesimpulan 46
5.2. Saran 46
DAFTAR PUSTAKA 47
DAFTAR TABEL
2.1 Kandungan Mineral Pada Air Kelapa 9
4.1 Hasil Uji Kualitatif Sampel Air Kelapa 30
4.2 Kondisi Alat SSA Tipe AA-7000F Pada Pengukuran Konsentrasi
Ion Kalium 30
4.3 Data Hasil Pengukuran Absorbansi Larutan Standar Kalium
Dengan Metode Spektrofotometri Serapan Atom 31 4.4 Data Perhitungan Persamaan Garis Regresi Untuk Larutan Standar
Kalium 32
4.5 Data Pengukuran Absorbansi Untuk Penentuan Konsentrasi Ion
Kalium Pada Sampel 33
4.6 Data Pengukuran Konsentrasi Ion Kalium Pada Sampel 34 4.7 Data Perhitungan Konsentrasi Ion Kalium Pada Sampel Air Kelapa 35 4.8 Kondisi Alat SSA Tipe AA-7000F Pada Pengukuran Konsentrasi
Ion Natrium 36
4.9 Data Hasil Pengukuran Absorbansi Larutan Standar Natrium
Dengan Metode Spektrofotometri Serapan Atom 36 4.10 Data Perhitungan Persamaan Garis Regresi Untuk Larutan Standar
Natrium 37
4.11 Data Pengukuran Absorbansi Untuk Penentuan Konsentrasi Ion
Natrium Pada Sampel 39
DAFTAR GAMBAR
2.1 Reaksi Uji Xantoprotein 14
2.2 Skematis Instrumentasi Spektrofotometri Serapan Atom 17
4.1 Kurva Kalibrasi Larutan Standar Kalium 31
DAFTAR LAMPIRAN
Tabel 1 Data Lengkap Hasil Pengukuran Kadar Protein Dalam Sampel Air Kelapa
50
Tabel 2 Data Pengukuran Volume Blanko Kadar Protein 50
Tabel 3 Nilai t 51
Gambar 1 Kelapa Hibrida 52
ABSTRAK
ANALYSIS OF POTASSIUM ION (K +), SODIUM ION (Na +), AND PROTEIN FROM DALAM COCONUT VARIETIES WATER
AND HYBRID COCONUT
ABSTRACT
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Tanaman kelapa (Cocos nucifera L.) merupakan salah satu tanaman yang umumnya terdapat di daerah tropis dan telah menjadi bagian penting bagi kehidupan masyarakat Indonesia pada umumnya. Hampir semua tanaman ini dapat dimanfaatkan untuk memenuhi kebutuhan ekonomi, sosial, dan budayanya. Disamping itu, arti penting tanaman ini tercermin dari luasnya areal perkebunan rakyat yang mencapai 98% dari total 3,74 juta ha luas areal kelapa dan melibatkan lebih dari 3 juta rumah tangga petani dalam pengelolaan tanaman ini (Novrianto, 2005).
Tanaman kelapa ini dimanfaatkan hampir semua bagiannya oleh manusia sehingga dianggap tanaman serba guna. Tanaman kelapa terdiri atas batang, akar, daun, bunga dan buah. Buah kelapa terdiri atas kulit luar, kulit dalam, kulit biji, putih lembaga, dan air (Suhadirman, 1998).
Air kelapa merupakan salah satu produk dari tanaman kelapa yang belum
banyak dimanfaatkan padahal air kelapa banyak mengandung kalori, protein dan mineral yang sangat dibutuhkan oleh tubuh. Karena pemanfaatannya masih terbatas maka sering kali air kelapa ini dibuang begitu saja, baik ke sungai atau parit pembuangan (Sarmidi, 2009). Padahal air kelapa dapat diolah menjadi nata de coco, asam cuka, jelly, saus, alkohol, sirup, kecap, gula kelapa, minuman ringan seperti isotonik dan sebagainya (Rindengan dan Allorerung, 2004).
Beberapa penelitian terdahulu telah banyak dilakukan tentang air kelapa untuk pengembangan dan pemanfaatan dari air kelapa ini, seperti penelitian
(2004) yang meneliti tentang pengaruh suhu dan lama penyimpanan air kelapa terhadap produksi Nata De Coco. Wijayanti (2006) melakukan pembuatan kecap manis menggunakan air kelapa sekaligus mempelajari karakterisasi fisik dan pH nya.
Sedangkan Runtunuwu (2011) yang menganalisis kandungan kimia daging
dan air buah kelapa tua sepuluh buah kelapa Dalam, dimana 9 buah kelapa Dalam berasal dari kebun percobaan Balai Penelitian Tanaman Kelapa dan Palma Lain (BALITKA) Mapanget yang berada di daerah dataran rendah Manado, Sulawesi Utara dengan bibitnya masing-masing berasal dari daerah yang berbeda antara lain yaitu Mapanget, Tenga, Bali, Palu, Sawarna, Jepara, Lubuk Pakam, Kima Atas, dan Banyuwangi. Serta satu buah kelapa Dalam berasal dari kebun PTPN XIV desa Boyong Atas, kecamatan Tenga, kabupaten Minahasa Selatan, Sulawesi Utara yang berada di daerah dataran tinggi di dekat kaki gunung Lolombulan dimana dari hasil penelitiannya untuk air buah kelapa varietas Dalam memiliki kadar ion kalium sebesar 233,3 – 285,7 mg/100 mL dan ion natrium sebesar 27 – 59,3 mg/100 mL. Berbeda halnya dengan data dari Departemen Perindustrian dan Perdagangan (1986) yang menunjukkan bahwa kandungan mineral pada air kelapa dengan kadar ion kalium sebesar 312 mg/100 mL dan ion natrium 105 mg/100 mL. Menurut Tenda (1992) kadar protein sebesar 0,13% untuk kelapa muda dan 0,29% untuk kelapa tua. Hasil yang berbanding terbalik dengan data LIPI (1999) bahwa kadar protein pada air kelapa muda sebesar 0,20% dan air kelapa tua sebesar 0,14%.
sebanyak 2000 mg/hari dan ion natrium sehari adalah 500 mg/hari. Sedangkan protein yang terdapat dalam makanan berfungsi sebagai zat utama dalam pembentukan dan pertumbuhan tubuh bagi manusia. (Poedjiadi, 2006).
Secara umum jenis kelapa dapat digolongkan menjadi tiga bagian yaitu Kelapa Dalam, Kelapa Genjah dan Kelapa Hibrida. Kelapa Dalam berbuah 6 - 7 tahun atau lebih, buahnya lebih besar dari pada kelapa yang lain. Kelapa Genjah berbuah lebih kurang 3-4 tahun, warna kuning kehijauan, bulat dan kecil. Sedangkan Kelapa Hibrida diperoleh dari hasil persilangan antara varietas Genjah dengan varietas Dalam. Hasil persilangan itu merupakan kombinasi sifat-sifat yang baik dari kedua jenis varietas asalnya (Nurul, 2007).
Dari tiga jenis kelapa tersebut, kelapa varietas Dalam dan varietas Hibrida memiliki kelebihan dibanding kelapa varietas Genjah. Dimana dua varietas kelapa ini tingkat produksinya lebih tinggi dan lebih tahan terhadap penyakit dibandingkan kelapa varietas Genjah. Dengan adanya berbagai jenis kelapa kemungkinan kandungan ion kalium (K+), ion natrium (Na+), dan proteinnya mempunyai kadar yang berbeda. Berdasarkan uraian diatas, maka peneliti tertarik untuk menganalisis kadar ion kalium, ion natrium dan kadar protein pada air kelapa varietas kelapa Dalam dan kelapa Hibrida.
1.2 Permasalahan
Berapakah kadar ion kalium, ion natrium dan protein dari air kelapa varietas kelapa Dalam dan kelapa Hibrida.
1.3 Pembatasan Masalah
1. Penelitian ini dibatasi pada penentuan kadar ion kalium, ion natrium dan
kadar protein dari air kelapa.
kelapa Hibrida di daerah Kebun Kelapa desa Deli Tua Barat Kecamatan Deli Tua, Kabupaten Deli Serdang, Sumatera Utara.
1.4 Tujuan Penelitian
Penelitian ini bertujuan untuk menentukan kadar ion kalium, ion natrium, dan kadar protein yang terkandung dalam air kelapa varietas kelapa Dalam dan kelapa Hibrida.
1.5 Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Biokimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara Medan. Analisis dengan Spektrofotmeter Serapan Atom (SSA) dilakukan di Laboratorium Instrumen Balai Riset dan Standardisasi (Baristand) Departemen Perindustrian Medan.
1.6 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat menjadi informasi tambahan bagi masyarakat mengenai kadar ion kalium, ion natrium, dan kadar protein pada air kelapa varietas kelapa Dalam dan kelapa Hibrida.
1.7 Metodologi Penelitian
Penelitian ini bersifat eksperimen laboratorium, percobaan dilakukan tiga kali. Penelitian ini dilakukan dalam beberapa tahapan yaitu :
1. Sampel diambil di daerah kebun kelapa desa Deli Tua Barat kecamatan Deli Tua dengan teknik sampling yaitu rancangan acak sederhana.
2. Penentuan konsentrasi ion kalium (K+) dan ion natrium (Na+) dengan metode Spektrofotometri Serapan Atom (SSA).
BAB 2
TINJAUAN PUSTAKA
2.1 Kelapa
Kelapa merupakan salah satu dari tanaman perkebunan atau industri dengan batang
tanaman yang lurus dan tinggi. Ada dua pendapat mengenai asal usul kelapa, yaitu dari
Amerika Selatan menurut D.F. Cook, Van Martius Beccari dan Thor Herjerdahl, dan dari
Asia atau Indopasific menurut Berry, Werth, Mearil, Mayurathan, Lapesma, dan
Pureseglove. Kata coco pertama kali digunakan oleh Vasco da Gama, atau dapat juga
disebut nux indica, al-djanz al-kindi, ganz-ganz, nargil, narli, tenga, temuai, atau
coconut. Kelapa juga disebut sebagai pohon kehidupan (Anonim, 2013b).
Kelapa (Cocos nucifera L) merupakan salah satu anggota tanaman palmae yang
paling dikenal dan banyak tersebar di daerah tropis. Daunnya panjang dapat mencapai
sekitar 3-4 meter lebih dengan sirip-sirip lidi yang menopang pada tiap helaian. Dalam
taksonomi tumbuh-tumbuhan, maka tanaman kelapa dimasukkan ke dalam klasifikasi
sebagai berikut :
- Kingdom : Plantae (tumbuh-tumbuhan)
- Divisio : Spermatophyta (tumbuhan berbiji)
- Sub-divisio : Angiospermae (berbiji tertutup)
- Kelas : Monocotyledonae (biji berkeping satu)
- Ordo : Palmales
- Famili : Palmae
- Genus : Cocos
- Spesies : Cocos nucifera L (Nurul, 2007)
Tanaman kelapa mempunyai nilai ekonomi tinggi dan tumbuh baik di daerah
dataran tinggi. Pohon kelapa ini dapat tumbuh dan berbuah dengan baik di daerah
dataran rendah dengan ketinggian 0 - 450 m dari permukaan laut. Pada dataran tinggi
dengan ketinggian antara 450 - 1000 m dari permukaan laut, walaupun pohon ini dapat
tumbuh, waktu berbuahnya lebih lambat, produksinya lebih sedikit dan kadar
minyaknya rendah (Amin dan Sarmidi, 2009).
2.1.1 Jenis-Jenis Kelapa
Jenis tumbuhan kelapa terbagi atas tiga varietas yaitu :
1. Kelapa Varietas Dalam
Kelapa varietas dalam ini mempunyai ciri-ciri memiliki batang tinggi dan besar, bisa mencapai 30 meter atau lebih. Kelapa ini mulai berbuah agak lambat, berumur antara 6-8 tahun setelah tanam. Umurnya bahkan dapat mencapai 100 tahun lebih. Adapun Keunggulan varietas ini adalah produksi kopranya lebih tinggi, yaitu sekitar 1 ton kopra/ha pertahun pada umur 10 tahun dengan produktivitas sekitar 90 butir perpohon pertahun, daging buahnya tebal dan keras
dengan kadar minyak yang tinggi, serta lebih tahan terhadap hama dan penyakit. Kelapa varietas Dalam terdiri atas beberapa jenis kelapa antara lain yaitu viridis (kelapa hijau), rubescens (kelapa merah), macrocorpu (kelapa kelabu), sakarina (kelapa manis).
2. Kelapa Varietas Genjah
Kelapa varietas genjah ini mempunyai ciri batang besar tetapi tidak terlalu tinggi, Varietas ini memiliki kelebihan berbuah lebat tetapi mudah dipengaruhi fluktuasi iklim, dan peka terhadap keadaan lingkungan yang kurang baik. Serta ukuran buah relatif kecil dengan kadar kopra rendah, yakni sekitar 130 gram per
3. Kelapa Varietas Hibrida
Kelapa varietas hibrida diperoleh dari hasil persilangan antara varietas Genjah dengan varietas Dalam. Hasil persilangan itu merupakan kombinasi sifat-sifat yang baik dari kedua jenis varietas asalnya. Dengan keunggulan yang dimiliki oleh kelapa varietas Hibrida adalah :
- Lebih cepat berbuah, sekitar 3-4 tahun setelah tanam.
- Produksi kopra tinggi, sekitar 6-7 ton/ha/tahun pada umur 10 tahun dengan produktivitas sekitar 140 butir/pohon/tahun.
- Produktivitas tandan buah, sekitar 12 tandan, dan berisi sekitar 10 - 20 butir buah kalapa, daging buahnya keras dan tebal dengan ketebalan sekitar 1,5 cm, serta kandungan minyaknya tinggi (Anonim, 2011a).
2.1.2 Air Kelapa
Air kelapa merupakan salah satu produk dari tanaman kelapa yang belum banyak
dimanfaatkan. Air kelapa muda merupakan minuman yang sangat popular dan air kelapa dari buah yang tua juga telah dikembangkan sebagai produk industri namun pemasarannya masih terbatas.
Air kelapa jumlahnya berkisar antara 25 persen dari komponen buah kelapa. Secara umum, air kelapa mengandung 4,7 persen total padatan, 2,6 persen gula, 0,55 persen protein, 0,74 persen lemak, serta 0,46 persen mineral. Kandungan gula terbanyak sewaktu masih muda, sehingga airnya terasa manis dan makin tua kelapa tersebut rasa manis airnya tersebut makin berkurang. Jumlah air kelapa makin berkurang sesuai dengan pertambahan umur buahnya, yaitu 18 gram setiap buah sebelum buah berdaging, 30 gram setiap buah muda dan 8-10 gram setiap buah yang sudah tua. Demikian pula warna airnya, makin tua airnya
akan makin keruh (Suhardiman, 1999).
komponen utama dalam air kelapa, dan karbohidrat sebagai komponen gizi terbesar setelah air, dan setelahnya adalah komponen mineral yang didalamnya terdapat ion kalium dan ion natrium.
Sementara itu untuk kadar protein dalam air kelapa persentasenya sangat sedikit, sama halnya dengan kadar lemak. Menurut Tenda (1992) bahwa air kelapa untuk kelapa muda mengandung kadar protein sebesar 0,13 %, sedangkan untuk kelapa tua mengandung kadar protein sebesar 0,29%. Berdasarkan data dari LIPI (1992) bahwa kadar protein pada air kelapa untuk kelapa muda sebesar 0,20%, sedangkan untuk kelapa tua sebesar 0,14%. Disamping zat gizi tersebut, air kelapa juga mengandung berbagai asam amino bebas. Setiap butir kelapa dalam dan hibrida mengandung air kelapa masing-masing sebanyak 300 dan 230 ml dengan berat jenis rata-rata 1,02 kg dan pH agak asam (Anonim, 2013c).
Kadar mineral terbanyak dalam air kelapa adalah ion kalium dengan kandungan 730 mg per 100 gram air kelapa muda, yang cukup banyak magnesium, dan klorida, sedangkan ion natrium jumlahnya sangat sedikit. Komposisi minuman dengan rasio ion kalium terhadap ion natrium yang tinggi sangat menguntungkan bagi kesehatan karena ion kalium dan ion natrium bekerjasama dalam mengatur keseimbangan muatan elektrolit cairan tubuh dengan cara menyesuaikan jumlah asupan ion kalium dari makanan dan jumlah ion kalium yang dibuang. Selanjutnya dikemukakan oleh Oslon bahwa mengkonsumsi ion kalium yang tinggi dapat menurunkan hipertensi. Dengan cara menyeimbangi kadar ion natrium sehingga tekanan darah kita terjaga (Anonim, 2011c).
meningkat. Pada tahapan berikutnya terjadi peningkatan kandungan pada daging buah kelapa dan gravitasi spesifikasinya menurun (Sison, 1977).
Kandungan mineral dalam air kelapa cukup tinggi terutama pada ion kalium, dan ion natrium. Kandungan beberapa mineral pada air kelapa disajikan seperti pada Tabel 2.1 berikut.
Tabel 2.1 Kandungan Mineral Pada Air Kelapa Mineral Kandungan (mg/100 mL)
Kalium (K) 312
Natrium (Na) 105
Kalsium (Ca) 29
Magnesium (Mg) 30
Besi (Fe) 0.10
Tembaga (Cu) 0.04
Fosfor (P) 37
Sulfur (S) 24
Klorida (Cl) 184
Sumber : Departemen Perindustrian dan Perdagangan (1986)
2.1.3 Manfaat Air Kelapa
Air kelapa memiliki banyak manfaat bagi kesehatan tubuh manusia, berikut beberapa manfaat dari air kelapa :
- Air kelapa muda dapat mengobati demam berdarah apabila diminum secara teratur, dengan menambahkan perasan jeruk nipis.
- Air kelapa dengan penambahan sedikit sari jeruk dapat mengobati cacingan pada anak-anak.
- Air kelapa muda juga dapat mengatasi susah atau keseringan buang air kecil karena air kelapa muda mampu membersihkan saluran kemih dan menjaga fungsi pencernaan dalam tubuh,
- Air kelapa muda juga sangat baik dikonsumsi bagi orang yang sedang hamil karena mereka sangat membutuhkan banyak cairan, juga dapat mengatasi mual-mual dan muntah.
- Air kelapa muda mengandung anti bakteri, anti virus dan anti jamur yang sama khasiatnya dengan air susu ibu.
- Air kelapa dipercaya mampu memecah batu ginjal, karena air kelapa akan melunakkan kerak atau lendir yang terbentuk dalam ginjal.
- Air kelapa muda merupakan cairan isotonik. Bahkan sudah banyak minuman yang berbahan utama air kelapa muda yang bagus untuk kebugaran tubuh sehingga dapat menghilangkan rasa kelelahan dan les
2.2 Mineral
Mineral adalah zat anorganik yang diperlukan tubuh walau dalam jumlah yang tidak banyak. Zat anorganik ini terdapat pada makhluk hidup yang diperlukan dalam proses metabolisme manusia. Mineral ini harus selalu terdapat pada
makanan yang dikonsumsi, hal ini sangat perlu untuk menjaga kesehatan tubuh, sesuai dengan fungsinya sebagai zat pengatur. Mineral yang kita butuhkan terdiri atas ion kalium, natrium, kalsium, zat besi, zat kapur, yodium, fosfor, dan klorida (Anonim, 2011b).
Berdasarkan kebutuhan didalam tubuh mineral dapat digolongkan menjadi
dua kelompok utama yaitu mineral makro dan mineral mikro. Mineral makro adalah
mineral yang dibutuhkan dengan jumlah lebih dari 1000 mg/hari, sedangkan mineral
mikro mineral yang dibutuhkan kurang dari 100 mg/hari (Kartasapoetra, 2008).
2.2.1 Kalium
Kalium adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang K dan nomor atom 19; berat atom 39,102; titik lebur 36.38 oC; dan titik didih 759 o
sangat reaktif terutama dalam air , dan secara kimiawi memiliki sifat yang mirip dengan natrium (Vogel, 1985).
Garam-garam kalium mengandung kation monovalen K+. Garam-garam kalium ini biasanya larut dan membentuk larutan yang tidak berwarna, kecuali bila anionnya berwarna. Adanya ion kalium dapat diuji menggunakan larutan natrium heksanitritokobaltat (III) Na[Co(NO)2)6], dimana apabila direaksikan dengan larutan tersebut akan menghasilkan suatu endapan kuning kalium heksanitritokobaltat (III), dengan persamaan reaksi sebagai berikut :
3K+ + Na3[Co(NO)2)6] → K3[Co(NO)2)6]↓ + 3Na+ Endapan Kuning
Endapan kuning tersebut tidak larut dalam asam asetat encer. Jika ada natrium dalam jumlah lebih banyak (atau jika reagensia ditambahkan secara berlebihan) maka akan terbentuk suatu garam campuran K2Na[Co(NO2)6]. Endapan terbentuk dengan segera dalam larutan-larutan pekat, dan lambat dalam larutan encer; pengendapan dapat dipercepat dengan pemanasan. Garam-garam amonium memberi endapan serupa dan tak boleh ada. Dalam larutan yang basa, kita memperoleh endapan coklat atau hitam, yaitu kobalt (III) hidroksida Co(OH)3. Iodida dan zat pereduksi yang lain mengganggu, maka harus dihilangkan sebelum menguji (Vogel, 1979).
Unsur kalium di dalam tubuh merupakan unsur anorganik yang penting bagi sistem saraf dan kontraksi otot. Kalium juga dimanfaatkan oleh sistem saraf
otonom (SSO) yang merupakan pengendali detak jantung, fungsi otak, dan proses fisiologi penting lainnya. Kalium ditemukan hampir diseluruh tubuh dalam bentuk elektrolit dan banyak terdapat pada saluran pencernaan. Sebagian besar ion kalium terdapat dalam sel dan sebagian lagi di luar sel. Di dalam tubuh ion kalium bekerja sama dengan ion natrium dalam mengatur keseimbangan muatan elektrolit cairan tubuh dengan cara menyesuaikan jumlah asupan ion kalium dari makanan dan jumlah ion kalium yang dibuang.
berdenyut. Kekurangan ion kalium mengakibatkan gangguan fungsi ini sehingga kerjanya melemah, demikian juga pada keadaan kelebihan, jantung mengalami hambatan untuk memompa darah keseluruh tubuh. Pada orang sehat, ginjal merupakan organ yang membuang ion kalium yang berlebihan. Kalium adalah mineral yang terdapat dalam sayur dan buah-buahan (Kartasapoetra, 2008).
2.2.2 Natrium
Natrium adalah unsur kimia dalam tabel periodik yang memiliki simbol Na dan nomor atom 11. Natrium adalah logam reaktif yang lunak keperakan dan seperti lilin, yang termasuk ke logam alkali yang banyak terdapat dalam senyawa alam. Dia sangat reaktif, apinya berwarna kuning, beroksidasi dalam udara dan bereaksi kuat dengan air sehingga harus disimpan di dalam minyak.
Karena sangat reaktif, natrium hampir tidak pernah ditemukan dalam bentuk unsur murni. Natrium merupakan logam putih perak yang lunak, yang melebur pada 97,5ºC. Natrium teroksidasi dengan cepat dalam udara lembab.
Seperti logam alkali lainnya, natrium adalah unsur reaktif yang lunak, ringan, dan putih keperakan yang tak pernah berwujud sebagai unsur murni di alam. Natrium mengapung di air terurai menjadi gas hidrogen dan ion hidroksida. Natrium akan meledak di dalam air secara spontan. Namun biasanya tidak meledak di udara bersuhu di bawah 388 K. Natrium juga bila dalam keadaan berikatan dengan ion hidroksil (OH) maka akan membentuk basa kuat yaitu NaOH (Vogel, 1985).
Garam-garam natrium mengandung kation monovalen Na+. Garam-garam natrium ini biasanya membentuk larutan yang tidak berwarna, kecuali jika anionnya berwarna. Hampir semua garam natrium larut dalam air. Adanya ion natrium dapat diuji menggunakan larutan kalium hidrogen antimonat KH2SbO4, dimana apabila direaksikan dengan larutan tersebut akan menghasilkan suatu
endapan putih kalium hidrogen antimonat KH2SbO4. Dengan persamaan reaksi sebagai berikut :
Sumber natrium adalah makanan seperti ikan asin, daging, udang, keju, seledri, telur juga mengandung ion natrium dalam jumlah besar. Fungsi ion natrium antara lain adalah berperan dalam menghasilkan tekanan osmotik yang mengatur pertukaran cair an antara sel dan cair an disekitarnya, untuk mempertahankan keseimbangan tubuh. Di dalam tubuh manusia, ion natrium bekerjasama dengan ion kalium dalam mengatur keseimbangan muatan elektrolit cairan tubuh. (Budianto, 2009).
2.2.3 Preparasi Sampel Untuk Penentuan Kadar Mineral
Untuk menentukan kandungan mineral sampel terlebih dahulu didestruksi . Cara yang biasa dilakukan yaitu pengabuan kering (dry ashing) dan pengabuan basah (wet digestion). Pemilihan cara tersebut tergantung pada sifat zat organik dalam bahan, mineral yang akan dianalisis serta sensitivitas cara yang digunakan.
Cara pengabuan basah memberikan beberapa keuntungan. Suhu yang digunakan tidak dapat melebihi tititk didih larutan dan pada umumnya karbon lebih cepat hancur dari pada menggunakan cara pengabuan kering. Cara pengabuan basah pada prinsipnya adalah penggunaan asam nitrat untuk mendestruksi zat organik pada suhu rendah dengan maksud meghindari kehilangan mineral akibat penguapan.
2.3 Protein
Kata protein berasal dari protos atau proteos yang berarti pertama atau utama. Protein merupakan komponen penting atau komponen utama sel hewan atau manusia. Oleh karena itu sel itu merupakan pembentuk tubuh kita, maka protein yang terdapat dalam makanan dapat berfungsi sebagai zat utama dalam pembentukan dan pertumbuhan tubuh.
Dalam kehidupan protein memegang peranan yang penting pula. Proses kimia dalam tubuh dapat berlangsung dengan baik karena adanya enzim, suatu protein yang berfungsi sebagai biokatalis. Disamping itu hemoglobin dalam butir-butir darah merah atau eritrosit yang berfungsi sebagai pengangkut oksigen dari paru-paru keseluruh bagian tubuh, adalah salah satu jenis protein. Protein juga berfungsi sebagai pembawa vitamin dan CO2 plus peranan struktural, kinetik, katalitik serta pembentukan sinyal.
Kebutuhan akan protein dapat diperoleh dari makanan yang berasal dari
hewan atau tumbuhan. Protein yang berasal dari hewan disebut protein hewani, sedangkan yang berasal dari tumbuhan disebut protein nabati. Beberapa makanan sumber protein ialah daging, telur, susu, ikan beras, kacang, kedelai, gandum, jagung, dan buah-buahan (Pudjiadi, 2006).
2.3.1 Uji Kualitatif Protein
Suatu bahan makanan atau minuman dapat ditentukan kadar proteinnya dengan tes warna, dimana ada beberapa pengujian secara kualitatif untuk mengetahui adanya protein, antara lain uji Biuret, uji Ninhidrin, uji Millon’s, uji Hopkins-Cole, dan uji Xantoprotein.
Untuk pengujian xantoprotein, yaitu dilakukan dengan cara menambahkan
Gambar 2.1 Reaksi Uji Xantoprotein (Bahl, 2003)
2.3.2 Penentuan Jumlah Protein Total
Dalam keadaan asli di alam, protein merupakan senyawa, bermolekul besar dan kompleks yang tersusun dari unsur- unsur C, H, O, N, S dan dalam keadaan kompleks ada unsur P. Untuk penentuan jumlah protein secara empiris yang
umum dilakukan adalah dengan menentukan jumlah Nitrogen (N) yang terkandung oleh suatu bahan.
Cara penentuan kadar protein ini dikembangkan oleh Kjeldhal, seorang ahli ilmu kimia Denmark pada tahun 1883. Seharusnya hanya Nitrogen yang berasal dari protein saja yang ditentukan, akan tetapi secara teknis sukar dilakukan dan mengingat jumlah kandungan senyawa lain selain protein dalam bahan biasanya sangat sedikit, maka penentuan jumlah N total ini tetap dilakukan dengan mewakili jumlah protein yang ada. Kadar protein yang ditentukan berdasarkan cara Kjeldhal ini dengan demikian sering disebut sebagai kadar
protein kasar.
dipakai. Misalnya faktor perkalian yang telah diketahui adalah 5,70 untuk protein gandum, 6,38 untuk protein susu, dan 5,55 untuk gelatin (Poedjiadi, 2006).
Analisis protein dengan metode Kjeldhal ini, pada dasarnya dapat dibagi menjadi tiga tahapan, yaitu tahapn proses destruksi, tahapan proses destlasi dan tahapan titrasi. Dengan penjelasan tiap tahapan adalah sebagai berikut :
1. Tahap Destruksi
Pada tahap ini sampel dipanaskan dalam asam sulfat pekat sehingga terjadi destruksi menjadi unsur-unsurnya. Elemen karbon, hidrogen teroksidasi menjadi CO, CO2, H2O. Sedangkan Nitrogen (N) akan berubah menjadi (NH4)2SO4. Untuk mempercepat proses destruksi sering ditambahkan katalisator berupa campuran campuran Na2SO4 dan HgO (20:1). Dengan penambahan bahan katalisator tersebut titik didih asam sulfat akan dipertinggi sehingga destruksi berjalan lebih cepat. Suhu untuk destruksi berkisar antara 370-410 oC. selain katalisator yang telah disebutkan tadi, kadang-kadang juga diberikan Selenium. Selenium dapat
mempercepat proses oksidasi karena zat tersebut selain menaikkan titik didih juga mudah mengadakan perubahan dari valensi tinggi ke valensi rendah atau sebaliknya.
Penggunaan Selenium lebih reaktif dibandingkan Merkuri dan Kupri Sulfat tetapi Se mempunyai kelemahan yaitu karena sangat cepatnya oksidasi maka Nitrogennnya justru mungkin ikut hilang. Hal ini dapat diatasi dengan pemakaian Se yang sangat sedikit yaitu kurang dari 0,25 gram. Proses destruksi sudah selesai apabila larutan menjadi jernih atau tidak berwarna. Agar supaya analisa lebih tepat maka tahap destruksi ini dilakukan pula perlakuan blanko yaitu untuk koreksi adanya senyawa N yang berasal dari reagensia yang digunakan. Proses reaksi yang terjadi pada tahap destruksi ini adalah:
2. Tahap Destilasi
Ammonium Sulfat dipecah menjadi ammoniak (NH3) dengan penambahan NaOH sampai alkalis dan dipanaskan. Agar selama destilasi tidak terjadi superheating ataupun pemercikan cairan atau timbulnya gelembung gas yang besar, maka dapat ditambahkan logam Zink (Zn). Ammoniak yang dibebaskan selanjutnya akan ditangkap oleh larutan asam standar. Asam standar yang digunakan adalah asam klorida atau asam borat 3% dalam jumlah yang berlebihan.
Untuk mengetahui asam dalam jumlah yang berlebihan maka akan diberi indikator misalnya indikator campuran (indikator metil merah dan indikator metil biru) atau indikator Fenolptalein (PP), dan proses destilasi diakhiri apabila sudah semua ammoniak terdestilasi sempurna dengan ditandai destilat tidak memberikan warna lagi. Adapun reaksi yang terjadi dalam tahap destilasi adalah:
(NH4)2SO4 + 2NaOH → Na2SO4 + 2 NH4OH NH4OH → NH3(g) + H2O (l)
3. Tahap Titrasi
Apabila penampung destilat digunakan asam borat maka banyaknya asam borat yang bereaksi dengan ammoniak dapat diketahui dengan metode titrasi menggunakan asam klorida 0,1 N dan indikator campuran (indikator metil merah dan indikator metil biru). Pada akhir titrasi ditandai dengan terjadinya perubahan warna larutan dari biru menjadi merah muda. Selisih jumlah titrasi sampel dan blanko merupakan jumlah ekivalen Nitrogen. Untuk menghitung %N dengan menggunakan persamaan berikut :
100 x 14,008 x
HCl N x (mg) Sampel Berat
Blanko)
-(Sampel HCl
Setelah diperoleh %N, selanjutnya dihitung kadar proteinnya dengan mengalikan suatu faktor. Besarnya faktor perkalian N menjadi protein ini tergantung pada persentase N yang menyusun protein dalam suatu bahan.
Konversi Faktor
x N % %Protein =
Dengan berpedoman pada kadar Nitrogen sebesar 16%, dapat dilakukan penentuan kandungan protein dalam suatu bahan makanan atau minuman. Unsur nitrogen ditentukan secara kuantitatif, misalnya dengan cara Kjeldhal, yaitu dengan cara destruksi dengan asam – asam pekat. Untuk berat protein yang ditentukan ialah 6,25 kali berat unsur Nitrogen (Sudarmadji, S, 1992).
2.4 Spektrofotometri Serapan Atom
Spektrofotometri Serapan Atom didasarkan adanya adsorbsi gelombang elektromagnetik oleh atom-atom. Atom mempunyai dua keadaaan tingkat energi, yaitu energi keadaaan dasar (ground state) dan energi keadaan tereksitasi (excited state). Atom-atom menyerap cahaya tersebut pada panjang gelombang tertentu, tergantung pada sifat unsurnya. Cahaya dengan panjang gelombang ini mempunyai cukup energi untuk mengubah tingkat elektronik suatu atom. Transisi elektronik suatu unsur bersifat spesifik. Dengan adsorpsi energi berarti memperoleh lebih banyak energi, suatu atom pada keadaan dasar dinaikkan tingkat energinya ke tingkat eksitasi. Tingkat eksitasinya pun bermacam-macam (Khopkhar, 2001).
[image:33.595.107.533.636.731.2]Ada dua tipe instrumen Spektrofotometri Serapan Atom, yaitu nyala berkas tunggal (singel beam) dan nyala berkas ganda (double beam). Umumnya instrumen SSA terdiri dari :
Keterangan :
1) Lampu katoda berongga, dimana lampu katoda ini berfungsi sebagai sumber radiasi yang memancarkan spektrum atom dari unsur yang ditentukan. Lampu katoda berongga terdiri dari dua elektroda dalam sebuah tabung silinder gelas yang mempunyai jendela yang transparan pada letak yang berlawanan dengan
katoda.
2) Chopper (pembagi cahaya), dimana cahaya dari lampu katoda dibagi oleh alat pembagi untuk diteruskan ke ruangan contoh disebut sinar contoh dan bagian lain sinar referen yang diteruskan ke sekeliling ruangan contoh.
3) Unit Pengatoman Analit (atomizer) berfungsi untuk mengubah larutan yang akan diuji menjadi atom-atom dalam bentuk gas. Oleh karena itu sistem ini sering disebut sebagai atomizer. Berdasarkan kerjanya atomizer mempunyai dua komponen utama : pengembun (nebulizer) dan pembakar (burner).
4) Monokromator berfungsi untuk mengontrol pancaran cahaya yang datang dari lampu katoda berongga dan memisahkan garis spektrum yang lain yang menganggu pengamatan. Kemampuan untuk menyeleksi suatu panjang gelombang yang berbeda merupakan suatu karakteristik monokromator yang sangat penting.
5) Detektor berfungsi untuk menangkap dan mengatur sinar yang ditransmisikan serta memberikan sinyal sebagai respon terhadap sinar diterima.
6) Rekorder berfungsi untuk menerima dan merekam sinyal yang disampaikan oleh detektor dan menyampaikannya ke sistem read-out.
BAB 3
METODOLOGI PENELITIAN
3.1 Bahan - Bahan - Aquades
- Etanol (l) p.a Merck
- HCl (l) p.a Merck
- HNO3 pekat (l) p.a Merck
- H2SO4 pekat (l) p.a Merck
- H3BO3(s) p.a Merck
- Indikator Metil Merah (l) p.a Merck - Indikator Metil Biru (l) p.a Merck - Indikator Metil Jingga (l) p.a Merck
- KH2SbO4 (l) p.a Merck
- Larutan Standar Na+, K+ 1000 ppm p.a Merck
- NaOH(s) p.a Merck
- Na2CO3 (s) p.a Merck
- Na3[Co(NO)2)6] (l) p.a Merck - Sampel Air Kelapa
- Selenium (s) pa Merck
3.2 Alat - Alat
- Alat Destilasi Gerhardt Bonny
- Alat Tanur Fisher
- Buret 50 mL Pyrex
- Cawan Porselin - Corong
- Desikator
- Gelas Beaker 100 mL Pyrex - Gelas Ukur 10 mL, 25 mL, 50 mL Pyrex - Labu Destilasi
- Labu Kjeldhal
- Labu Takar 50 mL, 100 mL, 1000 mL Pyrex
- Neraca Analitis Sartorius
- Pipet Volumetrik 5 ml, 10 mL, 25 mL Pyrex
- Oven Gallenkamp
- Spektrofotometer Serapan Atom AA-7000F - Tabung Reaksi
- Kertas Saring Whatman No. 42
3.3 Prosedur Penelitian 3.3.1 Pengambilan Sampel
3.3.2 Pembuatan Pereaksi
3.3.2.1Pembuatan Larutan H3BO3 3%
Ditimbang sebanyak 3 g kristal H3BO3, lalu dimasukkan ke dalam labu takar 100 mL, dilarutkan dengan aquades, diencerkan hingga garis tanda, dan dihomogenkan.
3.3.2.2Pembuatan Larutan NaOH 30%
Ditimbang sebanyak 30 g kristal NaOH, lalu dimasukkan ke dalam labu takar 100 mL, dilarutkan dengan aquades, diencerkan hingga garis tanda, dan dihomogenkan.
3.3.2.3Pembuatan Indikator Campuran
Dimasukkan 2 bagian indikator metil biru 0,1% (b/v) ke dalam gelas beaker yang berisi etanol, lalu ditambahkan 1 bagian indikator metil merah 0,2%.
3.3.2.4Pembuatan Larutan Na2CO3 0,1 N
Ditimbang sebanyak 0,53 g kristal Na2CO3, lalu dimasukkan ke dalam labu takar 100 mL, dilarutkan dengan aquades, diencerkan hingga garis tanda, dan dihomogenkan.
3.3.2.5Pembuatan Larutan HCl 0,1 N
Dimasukkan 8,3 mL HCl 37% ke dalam labu takar 1000 mL, diencerkan dengan aquades hingga garis tanda, dan dihomogenkan.
3.3.3 Pengujian Kualitatif Untuk Ion Kalium, Ion Natrium, dan Protein 3.3.3.1 Uji Kualitatif Ion Kalium
Sampel dimasukkan ke dalam tabung reaksi, kemudian ditambahkan
3.3.3.2 Uji Kualitatif Ion Natrium
Sampel dimasukkan ke dalam tabung reaksi, kemudian ditambahkan dengan larutan kalium hidroantimonat KH2SbO4, dan terbentuk endapan putih NaH2SbO4 yang menunjukkan adanya ion natrium.
3.3.3.2 Uji Xantoprotein
Sampel dimasukkan ke dalam tabung reaksi, kemudian ditambahkan dengan larutan HNO3 pekat, dan terbentuk endapan kuning yang menunjukkan adanya protein di dalam sampel.
3.3.4 Penentuan Kadar Ion Kalium (K+) Dengan Metode Spektrofotometri Serapan Atom (SSA)
3.3.4.1Pembuatan Larutan Seri Standar Kalium 100 ppm
Larutan standar kalium 1000 ppm dipipet sebanyak 10 mL, lalu dimasukan kedalam labu takar 100 ml kemudian diencerkan dengan aquades sampai dengan
garis tanda, dan dihomogenkan sehingga diperoleh larutan standar kalium 100 ppm.
3.3.4.2Pembuatan Larutan Seri Standar Kalium 10 ppm
Larutan standar kalium 100 ppm dipipet sebanyak 10 ml, lalu dimasukan kedalam labu takar 100 ml kemudian diencerkan dengan aquades sampai dengan
garis tanda, dan dihomogenkan sehingga diperoleh larutan standar kalium 10 ppm.
3.3.4.3Pembuatan Larutan Seri Standar Kalium 0,0; 0,5; 1,0; 1,5; 2,0; 2,5 dan 3,0 ppm.
3.3.4.4Pembuatan Kurva Standar Kalium
Larutan seri standar kalium 0,0; 0,5; 1,0; 1,5; 2,0; 2,5 dan 3,0 ppm tersebut dianalisis menggunakan alat spektrofotometer serapan atom pada panjang gelombang 766,5 nm untuk ion kalium. Pengukuran dengan SSA dilakukan sebanyak 3 kali perulangan.
3.3.4.5Penentuan Kadar Ion Kalium (SNI 01-2427-1991)
Sampel air kelapa sebanyak 5 mL ditempatkan ke dalam cawan porselen, lalu dimasukkan ke dalam oven pada suhu 110 oC selama 1 jam. Kemudian dihidupkan alat tanur dan diatur kenaikan suhunya 100 oC setiap 15 menit. Setelah suhu menjadi 550 oC sampel dimasukan kedalam tanur selama 5 jam. Setelah 5 jam alat tanur dimatikan. Kemudian sampel didiamkan selama 24 jam dan setelah itu sampel dikeluarkan dari alat tanur.
Selanjutnya kedalam sampel ditambahkan 2 mL HNO3 pekat, dan aquades, kemudian disaring dengan kertas saring Whatman No. 42. Filtrat kemudian dimasukan kedalam labu takar 50 mL, dan ditambahkan dengan aquades sampai garis tanda, dan dihomogenkan. Kemudian dipipet sebanyak 1 mL larutan tersebut dan dimasukkan ke dalam labu takar 100 mL, lalu ditambahkan dengan aquades sampai dengan garis tanda, dan dihomogenkan. Larutan tersebut dianalisis menggunakan alat spektrofotometer serapan atom pada panjang gelombang 766,5 nm untuk ion kalium. Pengukuran dengan SSA dilakukan sebanyak 3 kali perulangan.
3.3.5 Penentuan Kadar Ion Natrium (Na+) Dengan Metode Spektrofotometri Serapan Atom (SSA)
3.3.5.1Pembuatan Larutan Seri Standar Natrium 100 ppm
3.3.5.2Pembuatan Larutan Seri Standar Natrium 10 ppm
Larutan standar natrium 100 ppm dipipet sebanyak 10 ml, lalu dimasukan kedalam labu takar 100 ml kemudian diencerkan dengan aquades sampai dengan garis tanda, dan dihomogenkan sehingga diperoleh larutan standar natrium 10 ppm.
3.3.5.3Pembuatan Larutan Seri Standar Natrium 0,0; 0,1; 0,2 0,3; 0,4; dan 0,5 ppm.
Larutan standar natrium 10 ppm berturut-turut dipipet 0,0, 0,5; 1,0; 1,5; 2,0; dan 2,5 ml lalu masing-masing dimasukan kedalam labu takar 50 ml kemudian diencerkan dengan aquades sampai garis tanda, dan dihomogenkan sehingga diperoleh larutan seri standar natrium 0,0; 0,1; 0,2 0,3; 0,4; dan 0,5 ppm.
3.3.5.4 Pembuatan kurva standar Natrium
Larutan seri standar natrium 0,0; 0,1; 0,2 0,3; 0,4; dan 0,5 ppm tersebut dianalisis menggunakan alat spektrofotometer serapan atom pada panjang gelombang 589 nm untuk ion natrium. Pengukuran dengan SSA dilakukan sebanyak 3 kali perulangan.
3.3.5.5Penentuan Kadar Ion Natrium (SNI 01-2428-1991)
Sampel air kelapa sebanyak 5 mL ditempatkan ke dalam cawan porselen, lalu dimasukkan ke dalam oven pada suhu 110 oC selama 1 jam. Kemudian dihidupkan alat tanur dan diatur kenaikan suhunya 100 oC setiap 15 menit. Setelah suhu menjadi 550 oC sampel dimasukan kedalam tanur selama 5 jam. Setelah 5 jam alat tanur dimatikan. Kemudian sampel didiamkan selama 24 jam dan setelah itu sampel dikeluarkan dari alat tanur.
garis tanda, dan dihomogenkan. Larutan tersebut dianalisis menggunakan alat spektrofotometer serapan atom pada panjang gelombang 589 nm untuk ion natrium. Pengukuran dengan SSA dilakukan sebanyak 3 kali perulangan.
3.3.6 Penentuan Kadar Protein Dengan Metode Kjeldhal 3.3.6.1Standarisasi Larutan HCl 0,1 N
Sebanyak 10 mL larutan HCl 0,1 N dipipet dan dimasukkan ke dalam gelas erlenmeyer 100 mL, dan diitambahkan 3 tetes indikator metil jingga. Selanjutnya dititrasi dengan Na2CO3 0,1 N hingga larutan berubah menjadi warna jingga, kemudian dicatat volume titran yang diperoleh. Perlakuan yang sama dilakukan sebanyak 3 kali perulangan.
3.3.6.2Penentuan Kadar Protein (SNI 01-2891-1992)
3.4 Bagan Penelitian
3.4.1 Proses Pengambilan Sampel
15 Buah Kelapa Muda Dari Kebun Kelapa
Diberi penomoran pada setiap buahnya
Dipilih 3 buah secara acak sederhana
Diambil masing-masing air kelapanya
Dimasukkkan ke dalam botol plastik
Dibawa langsung ke laboratorium
Dianalisis
Hasil
3 Buah Kelapa Muda Yang Dipilih Secara Acak
3.4.2 Penentuan Kadar Ion Kalium (SNI 01-2427-1991)
5 mL Sampel Air Kelapa
Ditempatkan ke dalam cawan porselen
Hasil
Ditambahkan 2 mL HNO3 pekat dan aquades
Disaring dengan kertas saring Whatman No. 42
Filtrat Residu
Dianalisis dengan SSA pada λ = 766,5 nm Dimasukkan ke dalam labu takar 100 mL Dihomogenkan
Ditambahkan dengan aquades sampai garis tanda
Dihomogenkan
Ditambahkan dengan aquades sampai garis tanda Dimasukkan ke dalam labu takar 50 mL
Dipipet 1 mL
Ditanur pada suhu 550 oC selama 5 jam
Didiamkan selama 24 jam
Dipanaskan dalam oven pada suhu 110 oC selama 1 jam
3.4.3 Penentuan Kadar Ion Natrium (SNI 01-2428-1991)
5 mL Sampel Air Kelapa
Ditempatkan ke dalam cawan porselen
Hasil
Ditambahkan 2 mL HNO3 pekat dan aquades
Disaring dengan kertas saring Whatman No. 42
Filtrat Residu
Dianalisis dengan SSA pada λ = 589 nm Dimasukkan ke dalam labu takar 100 mL Dihomogenkan
Ditambahkan dengan aquades sampai garis tanda Dihomogenkan
Ditambahkan dengan aquades sampai garis tanda Dimasukkan ke dalam labu takar 50 mL
Dipipet 1 mL
Ditanur pada suhu 550 oC selama 5 jam Didiamkan selama 24 jam
Dipanaskan dalam oven pada suhu 110 oC selama 1 jam
3.4.4 Penentuan Kadar Protein (SNI 01-2891-1992)
2 g Sampel Air Kelapa
Dimasukkan ke dalam labu Kjeldhal
Ditambahkan 0,2 gr Selenium
Ditambahkan 25 mL H2SO4 pekat
Didestruksi hingga sampel jadi larutan bening
Larutan Bening
Dimasukkan ke dalam labu takar 100 mL Diencerkan dengan aquades sampai garis tanda
Dihomogenkan Dipipet 50 mL
50 mL Larutan Bening
Ditambahkan 30 mL NaOH 30%
Didestilasi
Destilat
Ditambah 30 mL H3BO3 3%
Ditambahkan 3 tetes indikator campuran Dititrasi dengan HCl 0,0930 N sampai terjadi perubahan warna menjadi ungu
Dicatat volume titran
Hasil
Ditentukan kadar proteinnya
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil
4.1.1 Hasil Penentuan Uji Kualitatif Ion Kalium, Ion Natrium, dan Protein Dalam Sampel Air Kelapa
[image:46.595.101.523.350.418.2]Hasil penentuan uji kualitatif untuk ion kalium, ion natrium, dan protein dalam air kelapa dapat dilihat pada Tabel 4.1 berikut ini.
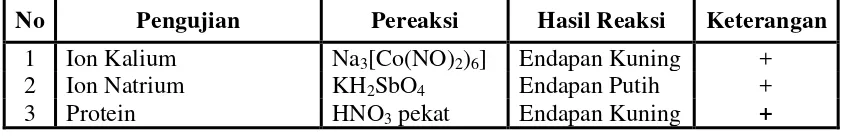
Tabel 4.1 Hasil Uji Kualitatif Sampel Air Kelapa
No Pengujian Pereaksi Hasil Reaksi Keterangan 1 Ion Kalium Na3[Co(NO)2)6] Endapan Kuning +
2 Ion Natrium KH2SbO4 Endapan Putih +
3 Protein HNO3 pekat Endapan Kuning +
4.1.2 Hasil Penentuan Konsentrasi Ion Kalium Dalam Sampel Air Kelapa Penentuan konsentrasi ion kalium (K+) pada sampel air kelapa varietas Dalam dan varietas Hibrida mengacu pada SNI 01-2427-1991 tentang metode pengujian kalium dalam air dengan alat Spektrofotometer Serapan Atom (SSA).
Pengujian konsentrasi ion kalium ini diawali dari tahap preparasi sampel, tahap pengenceran, dan tahap analisis dengan SSA. Kondisi SSA untuk pengukuran konsentrasi ion kalium dapat dilihat pada Tabel 4.2 berikut ini.
Tabel 4.2 Kondisi Alat SSA Tipe AA-7000F Pada Pengukuran Konsentrasi Ion Kalium
No Parameter K+
1 Panjang Gelombang (nm) 766,5
2 Tipe Nyala Udara - C2H2
3 Kecepatan Aliran Gas Pembakar (L/min) 2,0
4 Kecepatan Aliran Udara (L/min) 15,0
5 Lebar Celah (nm) 0,7
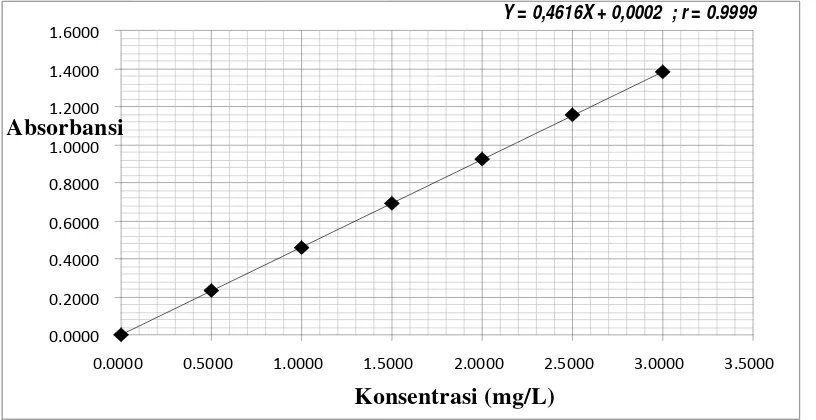
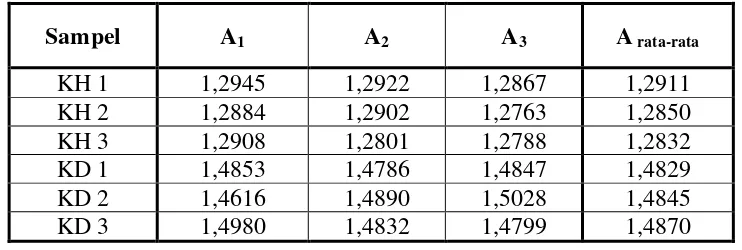
[image:46.595.139.484.640.751.2]Sebelum pengujian sampel dengan SSA, dilakukan pengukuran untuk kurva kalibrasi dari larutan seri standar kalium. Berikut data hasil pengukuran absorbansi dari larutan seri standar kalium menggunakan SSA seperti pada Tabel 4.3.
Tabel 4.3 Data Hasil Pengukuran Absorbansi Larutan Standar Kalium Dengan Metode Spektrofotometri Serapan Atom
Konsentrasi (mg/L) Absorbansi
0.0000 0,0002
0.5000 0,2295
1.0000 0,4618
1.5000 0,6917
2.0000 0,9241
2.5000 1,1532
3.0000 1,3851
[image:47.595.116.524.465.675.2]Dari Tabel 4.3 tersebut, diperoleh grafik seperti pada Gambar 4.1 yang menyajikan hubungan antara absorbansi dengan konsentrasi larutan standar kalium yang dinyatakan dalam satuan mg/L (ppm).
Gambar 4.1 Kurva Kalibrasi Larutan Standar Kalium
0.0000 0.2000 0.4000 0.6000 0.8000 1.0000 1.2000 1.4000 1.6000
0.0000 0.5000 1.0000 1.5000 2.0000 2.5000 3.0000 3.5000
Konsentrasi (mg/L) Absorbansi
4.1.2.1 Perhitungan Penetapan Garis Regresi Untuk Larutan Standar Kalium
Hasil pengukuran absorbansi dari suatu larutan seri standar ion kalium diplotkan terhadap konsentrasi larutan standar ion kalium sehinggga diperoleh suatu kurva kalibrasi berupa garis lurus seperti yang disajikan pada Gambar 4.1. Persamaan
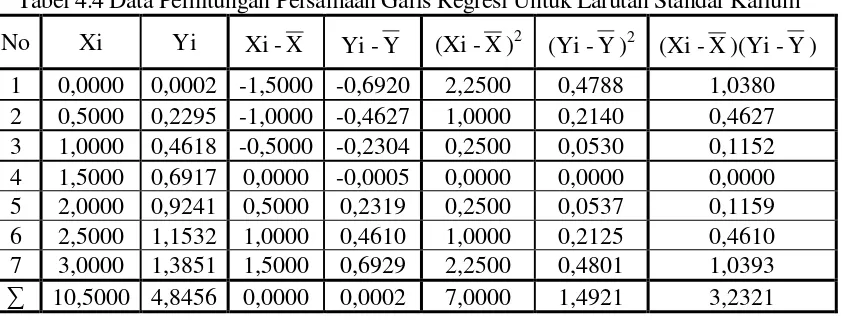
[image:48.595.105.526.265.425.2]garis regresi untuk kurva kalibrasi ini dapat diturunkan dengan menggunakan metode Least Square seperti pada Tabel 4.4.
Tabel 4.4 Data Perhitungan Persamaan Garis Regresi Untuk Larutan Standar Kalium No Xi Yi Xi -X Yi -Y (Xi -X )2 (Yi -Y)2 (Xi -X )(Yi -Y)
1 0,0000 0,0002 -1,5000 -0,6920 2,2500 0,4788 1,0380 2 0,5000 0,2295 -1,0000 -0,4627 1,0000 0,2140 0,4627 3 1,0000 0,4618 -0,5000 -0,2304 0,2500 0,0530 0,1152 4 1,5000 0,6917 0,0000 -0,0005 0,0000 0,0000 0,0000 5 2,0000 0,9241 0,5000 0,2319 0,2500 0,0537 0,1159 6 2,5000 1,1532 1,0000 0,4610 1,0000 0,2125 0,4610 7 3,0000 1,3851 1,5000 0,6929 2,2500 0,4801 1,0393
∑ 10,5000 4,8456 0,0000 0,0002 7,0000 1,4921 3,2321
Dimana harga : 1,5000
7 5000 , 10 n Xi
X = ∑ = =
0,6922
7 8456 , 4
Y=
∑
= =n Yi
Persamaan garis regresinya dapat diturunkan dari persamaan garis : Y=aX +b
Dimana : a = slope, dan b = intersept
Selanjutnya harga slope dapat ditentukan dengan mensubstitusikan
nilai-nilai pada Tabel 4.4 tersebut ke dalam persamaan berikut :
(
)(
)
(
)
0,46167 2321 , 3
a 2 = =
− − − =
∑
∑
X Xi Y Yi X Xi 0002 , 0 ) 5 , 1 ( 4616 , 0 6922 , 0b=Y −aX = − =
Untuk koefisien korelasi dapat dihitung menggunakan persamaan berikut :
(
)(
)
y x S S n Y Yi X Xi . .r=∑ − −
Dimana :
(
)
1 7 7 S 2 = = ∑ − = n X Xix dan
(
)
4616 , 0 7 4921 , 1 S 2 = = ∑ − = n Y Yi yKoefisien korelasi dapat ditentukan dengan mensubstitusikan nilai-nilai tersebut
ke dalam persamaan berikut :
(
)(
)
0,99994616 . 0 1 7 2321 . 3 . .
r = ∑ − − = =
x x S S n Y Yi X Xi y x
4.1.2.2 Perhitungan Konsentrasi Ion Kalium Pada Sampel Air Kelapa
Data pengukuran absorbansi untuk penentuan konsentrasi ion kalium pada sampel air kelapa menggunakan SSA disajikan pada Tabel 4.5 berikut ini.
Tabel 4.5 Data Pengukuran Absorbansi Untuk Penentuan Konsentrasi Ion Kalium Pada Sampel
Sampel A1 A2 A3 A rata-rata
KH 1 1,2945 1,2922 1,2867 1,2911
KH 2 1,2884 1,2902 1,2763 1,2850
KH 3 1,2908 1,2801 1,2788 1,2832
KD 1 1,4853 1,4786 1,4847 1,4829
KD 2 1,4616 1,4890 1,5028 1,4845
KD 3 1,4980 1,4832 1,4799 1,4870
Keterangan :
- Untuk sampel KH 1, KH 2, dan KH 3 yaitu sampel air kelapa varietas Hibrida - Untuk sampel KD 1, KD 2, dan KD 3 yaitu sampel air kelapa varietas Dalam - A1, A2, dan A3 merupakan nilai absorbansi untuk perlakuan 1, 2 dan 3.
[image:49.595.126.497.452.577.2]Sebagai contoh, untuk perhitungan konsentrasi ion kalium pada sampel air kelapa KH 1 perlakuan 1, dimana diketahui nilai absorbansinya sebesar 1,2945A. Jadi, konsentrasi dari ion kalium adalah sebagai berikut :
mL mg X L mg X X 100 / 2804 , 0 / 8039 , 2 0002 , 0 4616 , 0 2945 , 1 = = + =
Dalam 5 mL air kelapa yang diencerkan menjadi 50 mL :
mL mg X mL mg x mL mL X 100 / 0200 , 14 100 / 2804 , 0 1 50 = =
Dalam 100 mL sampel air kelapa :
mL mg X mL mg x mL mL X 100 / 3943 , 280 100 / 0200 , 14 5 100 = =
Berdasarkan perhitungan tersebut maka konsentrasi ion kalium pada sampel air kelapa disajikan pada Tabel 4.6 sebagai berikut :
Tabel 4.6 Data Pengukuran Konsentrasi Ion Kalium Pada Sampel
Sampel C1 (mg/100 mL)
C2 (mg/100 mL)
C3 (mg/100 mL)
C rata-rata (mg/100 mL)
KH 1 280,3943 279,8960 278,7045 279,6649
KH 2 279,0728 279,4627 276,4515 278,3290
KH 3 279,5927 277,2747 276,9931 277,9535
KD 1 321,7288 320,2773 321,5988 321,2016
KD 2 316,5945 322,5303 325,5199 321,5482
KD 3 324,4801 321,2738 320,5589 322,1043
Keterangan :
[image:50.595.108.516.485.608.2]Untuk menghitung rata-rata konsentrasi ion kalium dari air kelapa tiap sampel, maka dapat diolah secara statistik yaitu dengan standar deviasi (S) menggunakan persamaan berikut ini :
1 ) ( S 2 − ∑ − = n C Ci Keterangan :
Ci = Konsentrasi ion kalium (mg/100 mL);
C= Konsentrasi rata-rata ion kalium (mg/100 mL); dan n = Jumlah perlakuan.
Sebagai contoh, untuk perhitungan konsentrasi pada sampel air kelapa KH 1 diketahui C1 = 280,4 mg/100 mL, C2 = 279,9 mg/100 mL, dan C3 = 278,7 mg/100 mL, maka rata-rata konsentrasi ion Kalium adalah :
mL mg/100 ,6649 279 3 mL mg/100 278,7045 279,8960 280,3943 ( Ci
C= ∑ = + + =
n 5078 , 1 ) C -i (C 9224 , 0 ) 6649 , 279 7045 , 278 ( ) C -i C ( 0534 , 0 ) 6649 , 279 8960 , 279 ( ) C -(Ci 5319 , 0 ) 6649 , 279 280,3943 ( ) C -i C ( 2 2 2 2 2 2 2 = ∑ = − = = − = = − =
Jadi, standar deviasinya adalah 0,8683
2 5078 , 1 1 ) ( S 2 = = − ∑ − = n C Ci
Dari harga standar deviasi (S) yang diperoleh, dapat dihitung konsentrasi ion Kalium sampel air kelapa KH1 dengan batas kepercayaan melalui persamaan berikut :
( )
n tS C + = µ Keterangan :μ = Populasi Rata-Rata
C = Konsentrasi Rata-Rata (%) t = Harga Distribusi t
Dari data harga distribusi t untuk n = 3, derajat kepercayaan (dk) = 3 - 1 untuk derajat kepercayaan 95% (p = 0,05), dan nilai t = 2,920, sehingga diperoleh :
(
)
3 ) 8683 , 0 ( 920 , 2 6649 ,
279 +
=
µ
µ =
(
279,6649)
+1,4638mg/100mL(
279,7)
+1,4638mg/100mL=
µ
[image:52.595.104.520.356.491.2]Hal yang sama juga dilakukan untuk menghitung rata-rata konsentrasi ion Kalium pada semua sampel yang hasil penghitungannya dapat dilihat pada Tabel 4.7 berikut.
Tabel 4.7 Data Perhitungan Konsentrasi Ion Kalium Pada Sampel Air Kelapa
Sampel Konsentrasi Ion Kalium (mg/100 mL)
Konsentrasi Ion Kalium Rata-Rata (mg/ 100 mL)
KH 1 279,7 + 1,4638
278,7 + 1,4984 mg/100 mL
KH 2 278,3 + 2,7608
KH 3 277,9 + 2,4050
KD 1 321,2 + 1,3539
321,6 + 0,7726 mg/100 mL
KD 2 321,5 + 7,6590
KD 3 322,1 + 3,5206
Keterangan :
- Untuk sampel KH 1, KH 2, dan KH 3 yaitu sampel air kelapa varietas Hibrida - Untuk sampel KD 1, KD 2, dan KD 3 yaitu sampel air kelapa varietas Dalam.
4.1.3 Hasil Penentuan Konsentrasi Ion Natrium Dalam Sampel Air Kelapa
Penentuan konsentrasi ion kalium (Na+) pada sampel air kelapa varietas Dalam dan varietas Hibrida mengacu pada SNI 01-2428-1991 tentang metode pengujian natrium dalam air dengan alat Spektrofotometer Serapan Atom (SSA).
Tabel 4.8 Kondisi Alat SSA Tipe AA-7000F Pada Pengukuran Konsentrasi Ion Natrium
No Parameter Na+
1 Panjang Gelombang (nm) 589,0
2 Tipe Nyala Udara - C2H2
3 Kecepatan Aliran Gas Pembakar (L/min) 1,8
4 Kecepatan Aliran Udara (L/min) 15,0
5 Lebar Celah (nm) 0,2
6 Ketinggian Tungku (mm) 7,0
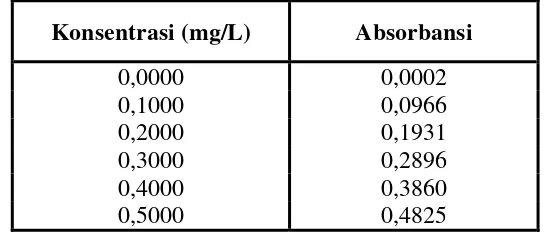
Sebelum pengujian sampel dengan SSA, dilakukan pengukuran untuk kurva kalibrasi dari larutan seri standar natrium. Berikut data hasil pengukuran
[image:53.595.174.447.415.531.2]absorbansi dari larutan seri standar natrium menggunakan SSA seperti pada Tabel 4.9.
Tabel 4.9 Data Hasil Pengukuran Absorbansi Larutan Standar Natrium Dengan Metode Spektrofotometri Serapan Atom
Konsentrasi (mg/L) Absorbansi
0,0000 0,0002
0,1000 0,0966
0,2000 0,1931
0,3000 0,2896
0,4000 0,3860
0,5000 0,4825
Gambar 4.2 Kurva Kalibrasi Larutan Standar Natrium
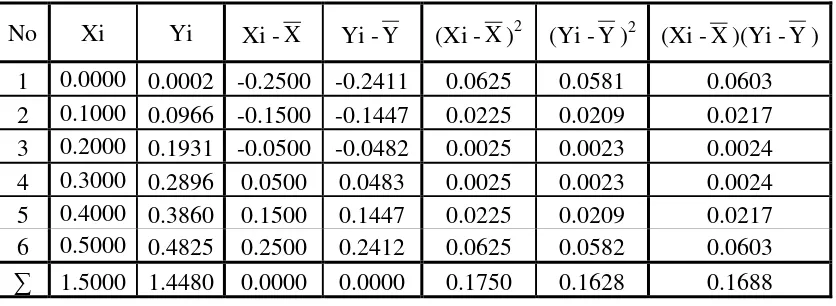
4.1.3.1 Perhitungan Penetapan Garis Regresi Untuk Larutan Standar Natrium Hasil pengukuran absorbansi dari suatu larutan seri standar ion Na+ diplotkan terhadap konsentrasi larutan standar sehinggga diperoleh suatu kurva kalibrasi berupa garis lurus seperti pada Gambar 4.2. Persamaan garis regresi untuk kurva kalibrasi ini dapat diturunkan dengan menggunakan metode Least Square seperti pada Tabel 4.10 berikut.
Tabel 4.10 Data Perhitungan Persamaan Garis Regresi Untuk Larutan Standar Natrium
No Xi Yi Xi - X Yi -Y (Xi - X )2 (Yi -Y)2 (Xi -X )(Yi -Y) 1 0.0000 0.0002 -0.2500 -0.2411 0.0625 0.0581 0.0603 2 0.1000 0.0966 -0.1500 -0.1447 0.0225 0.0209 0.0217 3 0.2000 0.1931 -0.0500 -0.0482 0.0025 0.0023 0.0024 4 0.3000 0.2896 0.0500 0.0483 0.0025 0.0023 0.0024 5 0.4000 0.3860 0.1500 0.1447 0.0225 0.0209 0.0217 6 0.5000 0.4825 0.2500 0.2412 0.0625 0.0582 0.0603
∑ 1.5000 1.4480 0.0000 0.0000 0.1750 0.1628 0.1688
0.0000 0.1000 0.2000 0.3000 0.4000 0.5000 0.6000
0.0000 0.1000 0.2000 0.3000 0.4000 0.5000 0.6000
Konsentrasi (mg/L) Absorbansi
[image:54.595.105.523.578.731.2]Dimana harga : 0,2500 6 5000 , 1 n Xi
X = ∑ = =
0,2413
6 4480 , 1
Y =
∑
= =n Yi
Persamaan garis regresinya dapat diturunkan dari persamaan garis :
b aX +
= Y
Dimana : a = slope, dan b = intersept.
Selanjutnya harga slope dapat ditentukan dengan mensubstitusikan nilai-nilai pada Tabel 4.10 tersebut ke dalam persamaan berikut :
(
)(
)
(
)
0,96461750 , 0 1688 , 0
a 2 = =
− − − =
∑
∑
X Xi Y Yi X Xi 0002 , 0 ) 2500 , 0 ( 9646 , 0 2413 , 0b=Y −aX = − =
Maka, persamaan garis regresi yang diperoleh adalah : Y=0,9646X +0,0002
Untuk koefisien korelasi dapat dihitung dengan menggunakan persamaan berikut :
(
)(
)
y x S S n Y Yi X Xi . .r= ∑ − −
Dimana :
(
)
0,16476 1750 , 0 S 2 = = ∑ − = n X Xi
x dan
(
)
1708 , 0 6 1628 , 0 S 2 = = ∑ − = n Y Yi y(
)(
)
9999 , 0 1708 , 0 1647 , 0 6 1688 , 0 . .r = ∑ − − = =
x x S S n Y Yi X Xi y x
4.1.3.2 Perhitungan Konsentrasi Ion Natrium Pada Sampel Air Kelapa
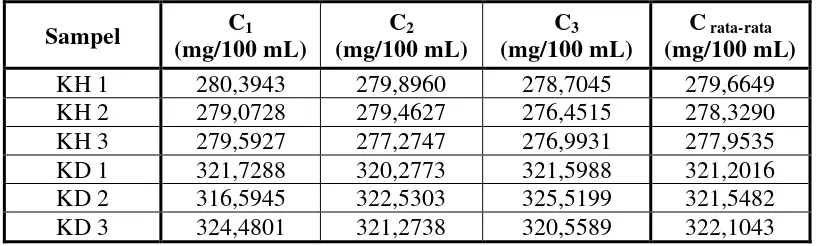
[image:56.595.121.501.301.443.2]Data pengukuran absorbansi untuk penentuan konsentrasi ion natrium pada sampel air kelapa menggunakan SSA disajikan pada Tabel 4.11 berikut ini.
Tabel 4.11 Data Pengukuran Absorbansi Untuk Penentuan Konsentrasi Ion Natrium Pada Sampel
Sampel A1 A2 A3 A rata-rata
KH 1 0.3102 0.3082 0.3066 0.3083
KH 2 0.2981 0.3013 0.3015 0.3003
KH 3 0.2992 0.3006 0.2980 0.2993
KD 1 0.3073 0.3077 0.3085 0.3078
KD 2 0.3264 0.3256 0.3280 0.3267
KD 3 0.3268 0.3251 0.3271 0.3263
Keterangan :
- Untuk sampel KH 1, KH 2, dan KH 3 yaitu sampel air kelapa varietas Hibrida
- Untuk sampel KD 1, KD 2, dan KD 3 yaitu sampel air kelapa varietas Dalam - A1, A2, dan A3 merupakan nilai absorbansi untuk perlakuan 1, 2 dan 3.
Berdasarkan hasil pengukuran absorbansi untuk sampel air kelapa, maka dapat ditentukan konsentrasi ion natrium pada sampel tersebut dengan menggunakan persamaan garis regresi Y=0,9646X +0,0002.
Sebagai contoh, untuk perhitungan konsentrasi ion natrium pada sampel air kelapa KH 1 perlakuan 1, dimana diketahui nilai absorbansinya sebesar 0,3102
A. Jadi, konsentrasi dari ion natrium adalah sebagai berikut :
Dalam 5 mL air kelapa yang diencerkan menjadi 50 mL : mL mg X mL mg x mL mL X 100 / 6050 , 1 100 / 0321 , 0 1 50 = =
Dalam 100 mL sampel air kelapa :
mL mg X mL mg x mL mL X 100 / 1377 , 32 100 / 6050 , 1 5 100 = =
[image:57.595.109.516.364.510.2]Berdasarkan perhitungan tersebut maka konsentrasi ion natrium pada sampel air kelapa disajikan pada Tabel 4.12 sebagai berikut :
Tabel 4.12 Data Pengukuran Konsentrasi Ion Natrium Pada Sampel Air Kelapa
Sampel C1 (mg/100 mL)
C2 (mg/100 mL)
C3 (mg/100 mL)
C rata-rata (mg/100 mL)
KH 1 32.1377 31.9303 31.7645 31.9442
KH 2 30.8833 31.2150 31.2357 31.1113
KH 3 30.9973 31.1424 30.8729 31.0042
KD 1 31.8370 31.8785 31.9614 31.8923
KD 2 33.8171 33.7342 33.9830 33.8448
KD 3 33.8586 33.6824 33.8897 33.8102
Keterangan :
- Untuk sampel KH 1, KH 2, dan KH 3 yaitu sampel air kelapa varietas Hibrida - Untuk sampel KD 1, KD 2, dan KD 3 yaitu sampel air kelapa varietas Dalam - C1, C2, dan C3 merupakan konsentrasi ion natrium untuk perlakuan 1, 2 dan 3
Untuk menghitung rata-rata konsentrasi ion natrium dari air kelapa tiap sampel, maka dapat diolah secara statistik yaitu dengan standar deviasi (S) menggunakan persamaan berikut ini :
Keterangan :
Ci = Konsentrasi Ion Natrium (ppm); C = Konsentrasi Rata-Rata Ion Natrium (ppm); dan n = Jumlah Perlakuan
Sebagai contoh, untuk perhitungan konsentrasi pada sampel air kelapa KH 1 diketahui C1 = 32,1377 mg/100 mL, C2 = 31,9303 mg/100 mL, dan C3 = 31,7645 mg/100 mL, maka rata-rata konsentrasi ion natrium adalah :
mL mg/100 ,9442 1 3 3 100 / ) 7645 , 31 9303 , 31 1377 , 32 ( Ci
C= ∑ = + + mg mL =
n 0699 , 0 ) C -i (C 0323 , 0 ) 9442 , 31 7645 , 31 ( ) C -i C ( 0002 , 0 ) 9442 , 31 9303 , 31 ( ) C -(Ci 0374 . 0 ) 9442 , 31 1377 , 32 ( ) C -i C ( 2 2 2 2 2 2 2 = ∑ = − = = − = = − =
Jadi, standar deviasinya adalah 0,1870
2 0699 , 0 1 ) ( S 2 = = − ∑ − = n C Ci
Dari harga standar deviasi (S) yang diperoleh, dapat dihitung konsentrasi ion natrium sampel air kelapa KH1 dengan batas kepercayaan melalui persamaan berikut :
( )
n tS C + = µ Keterangan :μ = Populasi Rata-Rata
C = Konsentrasi Rata-Rata (%)
Dari data harga distribusi t untuk n = 3, derajat kepercayaan (dk) = 3 - 1 untuk derajat kepercayaan 95% (p = 0,05), dan nilai t = 2,920, sehingga diperoleh :
(
)
3 ) 1870 , 0 ( 920 , 2 9442 ,
31 +
=
µ
µ=
(
31,9442)
+0,3152mg/100mLµ =
( )
31,9 +0,3152mg/100mL [image:59.595.104.520.377.512.2]Hal yang sama juga dilakukan untuk menghitung konsentrasi rata-rata ion Natrium pada semua sampel yang hasil penghitungannya dapat dilihat pada Tabel 4.13 berikut.
Tabel 4.13 Data Perhitungan Konsentrasi Ion Natrium Pada Sampel Air Kelapa
Sampel Konsentrasi Ion Natrium (mg/100 mL)
Konsentrasi Ion Natrium Rata-Rata (mg/100 mL)
KH 1 31,9 + 0,2666
31,3 + 0,8344 mg/100 ml
KH 2 31,1 + 0,2920
KH 3 31,0 + 0,1686
KD 1 31,9 + 0,1686
33,2 + 1,8819 mg/100 ml
KD 2 33,8 + 0,2575
KD 3 33,8 + 0,1947
Keterangan :
- Untuk sampel KH 1, KH 2, dan KH 3 yaitu sampel air kelapa varietas Hibrida - Untuk sampel KD 1, KD 2, dan KD 3 yaitu sampel air kelapa varietas Dalam
4.1.4 Hasil Penentuan Kadar Protein Pada Sampel Air Kelapa
Pengujian kadar protein untuk menentukan sampel air kelapa ini menggunakan Metode Kjeldhal, yang diawali dari tahap destruksi sampel, destilasi dan titrasi. Pada tahapan titrasi ini data yang diperoleh, dihitung kadar protein yang terkandung dalam sampel tersebut. Hasil pengujian tersebut, diperoleh data hasil pengukuran kadar protein dari semua sampel air kelapa
[image:60.595.138.485.273.426.2]seperti pada Tabel 4.14 sebagai berikut :
Tabel 4.14 Data Hasil Pengukuran Kadar Protein Dari Air Kelapa
No Sampel Kadar Protein (%)
Rata-Rata Kadar Protein
(%)
1 2 3
1 KH 1 0,52 0,45 0,53 0,50
2 KH 2 0,48 0,44 0,50 0,47
3 KH 3 0,43 0,47 0,50 0,47
4 KD 1 0,22 0,14 0,12 0,16
5 KD 2 0,25 0,19 0,21 0,22
6 KD 3 0,17 0,14 0,19 0,17
Keterangan :
- Untuk sampel KH 1, KH 2, dan KH 3 yaitu sampel air kelapa varietas Hibrida
- Untuk sampel KD 1, KD 2, dan KD 3 yaitu sampel air kelapa varietas Dalam
4.1.4.1 Perhitungan Standarisasi Larutan HCl 0,1 N
Untuk standarisasi larutan HCl 0,1 N sebanyak 10 mL, diketahui volume I dari Na2CO3 9,4 mL, volume II 9,3 mL, dan volume III 9,2 mL. Maka volume rata- rata dari Na2CO3 0,1 N adalah sebesar 9,3 mL. Dari data tersebut, standarisasi konsentrasi larutan HCl dapat ditentukan menggunakan persamaan berikut :
3 2 3
2CO x NNa CO
Na V HCl N x HCl
V =
N mL
mL 9,3 x0,1 HCl
N x 0
1 =
N
0930 , 0 HCl
4.1.4.2 Perhitungan Kadar Protein Pada Sampel Air Kelapa
Penentuan kadar protein dalam sampel air kelapa dapat dihitung menggunakan persamaan berikut :
100% x 1000 x W F x F x 14,008 x N x ) V (V Protein
Kadar = Titran− Blanko k p
Keterangan :
VTitran = Volume Larutan Sampel, HCl (ml) VBlanko = Volume Larutan Blanko yaitu 0,02 ml N = Normalitas HCl yaitu 0,0930 N
Fk = Faktor Konversi Untuk Protein Sampel Air Kelapa (6,25) Fp = Faktor Pengenceran (2 kali)
W = Bobot Sampel (g)
Sebagai contoh, untuk perhitungan kadar protein pada sampel air kelapa KH 1 perlakuan 1, dimana diketahui volume titran larutan HCl 0,0930 N sebesar 0,67 mL, volume larutan blanko 0,02 mL