KARAKTERISTIK MORFOLOGI DAN AKTIVITAS ENZIM POLIFENOL OKSIDASE DAN PEROKSIDASE PADA ORGAN TANAMAN SALAK
SIDEMPUAN (Salacca sumatrana var. Sidempuan)
SKRIPSI
RUTH AGREE K. S 050805031
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
KARAKTERISTIK MORFOLOGI DAN AKTIVITAS ENZIM POLIFENOL OKSIDASE DAN PEROKSIDASE PADA ORGAN TANAMAN SALAK
SIDEMPUAN (Salacca sumatrana var. Sidempuan)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
RUTH AGREE KARTINI SIHOMBING 050805031
Disetujui Oleh :
Pembimbing II Pembimbing I
(Drs. Kiki Nurtjahja, M.Sc) (Dra. Elimasni, M.Si)
NIP. 132 207 808 NIP. 131 945 355
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul :KARAKTERISTIK MORFOLOGI DAN AKTIVITAS ENZIM POLIFENOL OKSIDASE DAN PEROKSIDASE PADA ORGAN TANAMAN SALAK SIDEMPUAN (Salacca sumatrana var. Sidempuan)
Kategori : SKRIPSI
Nama : RUTH AGREE KARTINI SIHOMBING
Nomor Induk Mahasiswa : 050805031
Program Studi : SARJANA (S1) BIOLOGI
Departemen : BIOLOGI
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Diluluskan di
Medan, 12 Juni 2009 Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Drs. Kiki Nurtjahja, M.Sc Dra. Elimasni, M.Si NIP. 132 207 808 NIP. 131 945 355
Diketahui/Disetujui oleh
Departemen Biologi FMIPA USU Ketua,
PERNYATAAN
KARAKTERISTIK MORFOLOGI DAN AKTIVITAS ENZIM POLIFENOL OKSIDASE DAN PEROKSIDASE PADA ORGAN TANAMAN SALAK
SIDEMPUAN (Salacca sumatrana var. Sidempuan) SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, 12 Juni 2009
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Tuhan yang Maha Pengasih lagi Maha Penyayang atas limpahan rahmat kekuatan dan kemudahan sehingga penulis dapat menyelesaikan skripsi dengan “KARAKTERISTIK MORFOLOGI DAN AKTIVITAS ENZIM POLIFENOL OKSIDASE DAN PEROKSIDASE PADA ORGAN TANAMAN SALAK SIDEMPUAN (Salacca sumatrana var. Sidempuan)” dalam waktu yang telah ditentukan.
Ucapan terima kasih penulis sampaikan kepada Dra. Elimasni, M.Si selaku Dosen Pembimbing I dan Drs. Kiki Nurtjahja, M.Sc. selaku Dosen Pembimbing II atas bimbingan, arahan dan bantuannya dalam pembuatan skripsi ini. Penulis juga mengucapkan terima kasih kepada Bapak Dr. Dwi Suryanto, M.Sc dan Yurnaliza, S.Si, M.Si sebagai tim Penguji I dan II atas arahan dan saran dalam penyempurnaan penulisan skripsi ini.
Ucapan terima kasih juga penulis sampaikan kepada Prof. Dr. Dwi Suryanto, M.Sc sebagai Ketua Departemen Biologi FMIPA USU dan Dra. Nunuk Priyani, M.Sc sebagai Sekretaris Departemen Biologi FMIPA USU, Prof. Erman Munir, M.Sc sebagai Kepala Laboratorium Mikrobiologi, Seluruh Staf Pengajar Departemen Biologi FMIPA USU. Bapak Sukirmanto, Ibu Nurhasni Muluk, Ibu Roslina Ginting dan Bang Erwin selaku staf pegawai Departemen Biologi FMIPA USU.
Ungkapan terima kasih yang tak ternilai penulis ucapkan kepada kedua Orang tua, Ayahanda Drs. A.D Sihombing dan Ibunda D. Rajagukguk atas doa dan dorongan kepada penulis, kepada adikku Mika Andi Sihombing atas dorongan semangat sehingga penulis dapat menyelesaikan skipsi ini.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh karena itu penulis mengharapkan kritik dan saran yang bersifat membangun demi kesempurnaan skipsi ini. Akhir kata semoga skripsi ini bermanfaat bagi kita semua.
Medan, 12 Juni 2009
ABSTRAK
THE MORPHOLOGY CHARACTERISTIC AND ACTIVITIES OF POLYPHENOL OXIDASE AND PEROXIDASE ENZYME IN PLANT ORGANS OF SIDEMPUAN SALACCA (Salacca sumatrana var. Sidempuan)
ABSTRACT
DAFTAR ISI
Halaman
Penghargaan i
Abstrak ii
Abstract iii
Daftar Isi iv
Daftar Lampiran v
Bab 1 Pendahuluan 1
1.1 Latar Belakang 1
1.2 Permasalahan 4
1.3 Tujuan Penelitian 4
1.4 Hipotesis Penelitian 4
1.5 Manfaat Pemelitian 5
Bab 2 Tinjauan Pustaka 6
2.1 Botani Tanaman Salak 6 2.2 Penyakit Tanaman Salak 7 2.3 Faktor-faktor Lingkungan Pendukung Pertumbuhan
Tanaman Salak 8
2.4 Enzim PO (Peroksidase) dan PPO (Polifenol Oksidase) pada Tanaman Salak 13
Bab 3 Metodologi Penelitian 16
3.1 Waktu dan Tempat 16
3.2 Alat dan Bahan Penelitian 16
3.3 Metode Penelitian 17
Bab 4 Hasil dan Pembahasan 23
4.1 Karakteristik Morfologi Tanaman Salak 23 4.2 Determinasi Protein 26 4.3 Pengujian Aktivitas Enzim Peroksidase 27 4.4 Pengujian Aktivitas Enzim Polifenol Oksidase 29 4.5 Analisis Faktor Fisik Tanah 32 4.6 Analisis Faktor Kimia Tanah 34
Bab 5 Kesimpulan dan Saran 36
5.1 Kesimpulan 36
5.2 Saran 36
DAFTAR LAMPIRAN
ABSTRAK
THE MORPHOLOGY CHARACTERISTIC AND ACTIVITIES OF POLYPHENOL OXIDASE AND PEROXIDASE ENZYME IN PLANT ORGANS OF SIDEMPUAN SALACCA (Salacca sumatrana var. Sidempuan)
ABSTRACT
BAB 1
PENDAHULUAN
1.1Latar Belakang
Salak merupakan tanaman asli Indonesia. Tanaman salak di Indonesia sangat banyak macamnya (lampiran A). Oleh karena itu, bila kita bertanam salak berarti kita melestarikan dan meningkatkan produksi negeri sendiri. Salak termasuk famili
Palmae, serumpun dengan kelapa, kelapa sawit, aren (enau), palem, pakis yang bercabang rendah dan tegak. Batangnya hampir tidak kelihatan karena tertutup pelepah daun yang tersusun rapat dan berduri. Dari batang yang berduri itu tumbuh tunas baru yang dapat menjadi anakan atau tunas bunga buah salak dalam jumlah yang banyak (Soetomo, 2001).
Penanaman salak biasanya dilakukan dengan mencampur tanaman betina dan jantan. Salak jantan ditanam menyebar di antara salak betina atau sebagai pagar kebun salak. Penyerbukan dapat terjadi sendiri atau melalui bantuan serangga polinator. Pembentukan buah secara alami ini biasanya kurang optimal, sehingga sangat dianjurkan untuk melakukan perkawinan buatan dengan bantuan manusia (Nuswamarhaeni et al., 1999).
Perlu dilakukan penelitian enzim peroksidase dan polifenol oksidase pada tanaman salak guna meningkatkan mutu tanaman salak. Menurut Rivero et al. (2001), beberapa penelitian telah melaporkan bahwa aktivitas enzim polifenol oksidase dan peroksidase dapat mengurangi beberapa tipe stres pada tanaman baik yang biotik maupun abiotik (Pandolvini et al., 1992; Ruiz et al., 1999). Lebih spesifik dapat ditunjukkan bahwa kedua enzim tersebut telah saling bergabung dan sama-sama muncul untuk mencegah cekaman fisiologis yang disebabkan oleh kondisi stres tadi.
Berbagai penelitian menunjukkan bahwa tanaman yang mengalami cekaman (pertahanan terhadap penyakit) secara fisik ataupun fisiologis menunjukkan peningkatan aktivitas enzim peroksidase (PO) yang signifikan (Artlip and Funkhouser, 1995). Abeles et al. (1990) juga mengemukakan bahwa peningkatan aktivitas enzim peroksidase adalah respon umum tanaman terhadap cekaman lingkungan. Seperti cekaman suhu rendah pada gandum dan jagung (Peruanskii et al., 1991) dan cekaman terhadap polusi udara (Rao and Dubey, 1990). Selain itu aktivitas enzim peroksidase juga menunjukkan adanya mekanisme pertahanan dan perlindungan terhadap penyakit yang menyerang tanaman (Herison et al., 2007).
Aktivitas dari berbagai enzim terjadi selama adanya interaksi ketahanan, setiap enzim menggunakan batasan tertentu terhadap pertumbuhan penyakit tersebut agar tidak bertambah banyak. Contohnya dapat dilihat dari aktivitas enzim dari kelompok padi yaitu Xanthomonas oryzae, dimana respon pertahanan pada padi tersebut muncul setelah terdapat interksi antargennya. Penambahan enzim peroksidase telah dilakukan selama adanya interaksi ketahanan dan kerentanan pada padi. Sejumlah besar gen peroksidase pada padi muncul seiring dengan meningkatnya penyakit yang timbul untuk mengatasi serangan penyakit pada tanaman dan juga pada saat yang yang paling kritis atau kondisi stres pada padi tersebut (Chittoor et al., 1997).
dan konsentrasi kelarutan fenolik, dimana pada tomat (total enzim PO, r = -0,890 dan total enzim PPO, r = -0,820) dan pada semangka (total enzim PO, r = -0,841 dan total enzim PPO, r = -0,739). Kedua aktivitas enzim tersebut dipicu oleh stres terhadap panas maupun dingin dari suhu yang optimal berturut-turut, yaitu pada tomat dengan suhu 35oC dan pada semangka dengan suhu 15oC. Kelarutan komponen fenol dihasilkan sebagai mekanisme aklimatisasi untuk mencegah stres panas dan dingin pada tanaman tomat dan semangka (Rivero et al., 2001).
Hasil dari beberapa penelitian menunjukkan adanya respon aktivitas enzim PPO dan PO terhadap infeksi patogen, yaitu bahwa tanaman yang tahan terhadap penyakit cenderung memperlihatkan aktivitas kedua enzim tersebut lebih tinggi dibandingkan dengan tanaman yang rentan (Andreeva, 1989; Gupta et al., 1990; Zhou
et al., 1992; Yurina et al., 1993). Pada tanaman yang terinfeksi patogen, peningkatan radikal bebas yang selaras dengan peningkatan aktivitas kedua enzim tersebut berkaitan dengan mekanisme pertahanan. Mekanisme pertahanan tersebut diwujudkan dalam bentuk lignifikasi dinding sel (Vance et al., 1980) dan pembentukan senyawa fitoaleksin (Lagrimini et al., 1991; Hammerschmidt, 1999) sehingga perkembangan patogen terhambat (Herison et al., 2001).
Enzim PPO dan PO memerlukan gen untuk mengekspresikan reaksi pertahanannya pada tanaman. Untuk menganalisis peran dari enzim ini diperlukan tiga gen peroksidase seperti POX22.3, POX8.1 dan POX5.1 contohnya pada daun tanaman padi untuk reaksi ketahanan terhadap patogen. Gen tersebut hampir sama dengan rangkaian asam nukleat dan asam amino yang berada pada satu famili gen. Ketiga gen tersebut menunjukkan ekspresi yang berbeda pada daun selama interaksi patogen dan mekanisme ketahanan tanaman (Chittoor et al., 1997).
jamur putih, juga terdapat penyakit rebah kecambah yang menyerang tanaman salak. Menurut Anarsis (1999), penyakit rebah kecambah sering muncul pada tunas yang baru muncul dari biji. Penyakit ini banyak terjadi pada kecambah yang berumur kurang dari 2 bulan, yaitu sebelum daun pertamanya mekar.
1.2 Permasalahan
Salak Sidempuan merupakan buah yang mempunyai potensi untuk dikembangkan, namun pengembangannya masih terbatas. Hal ini disebabkan karena kurangnya penelitian, terutama yang berkaitan dengan penelitian dasar baik penelitian tentang morfologi, anatomi maupun fisiologi. Dilihat dari segi fisiologisnya, salah satunya dapat mengamati enzim PO dan PPO yang berperan dalam proses pencoklatan dan proteksi terhadap penyakit. Enzim PO dan PPO bersifat konstitutif (sudah ada dan tersebar pada organ tanaman) dan berbeda penyebarannya berdasarkan organ vegetatif tanaman dan lokasi yang berbeda juga.
1.3 Tujuan Penelitian
Penelitian ini bertujuan ini untuk mengetahui karakteristik morfologi dan aktivitas enzim PO dan PPO pada organ vegetatif (batang dan daun) tanaman Salacca sumatrana var Sidempuan dari tempat dan lingkungan yang berbeda yaitu dari Desa Sibakua dan Desa Huta Lambung.
1.4 Hipotesis Penelitian
1.5Manfaat Penelitian
Dengan dilakukannya penelitian, diharapkan akan didapat informasi mengenai karakteristik morfologi dan aktivitas enzim PO dan PPO pada organ vegetatif (batang dan daun) dalam meningkatkan resistensi dan proteksi terhadap penyakit yang akan mempengaruhi pertumbuhan tanaman sehingga dapat meningkatkan mutu maupun kualitas salak Sidempuan.
BAB 2
TINJAUAN PUSTAKA
2.1 Botani Tanaman Salak
Tanaman salak (Zalacca edulis) sefamili dengan kelapa (Palmae), tanaman ini memiliki ciri batang tegak, pelepah daun berduri, tingginya 1,5 - 5 m. Tanaman ini tumbuh baik jika ada pohon penaungnya, cocok dengan iklim yang basah, tidak tahan genangan air, serta memerlukan tanah gembur yang banyak mengandung bahan organik. Tanaman salak adalah tanaman asli Indonesia. Hampir di semua daerah di Indonesia dapat ditumbuhi salak, baik yang telah dibudidayakan maupun yang masih tumbuh liar di hutan. Tanaman salak termasuk tanaman berumah dua. Pada satu tanaman hanya ada satu jenis bunga saja, jantan atau betina (Tjahjadi, 1989).
Menurut Tjitrosoepomo (2004), sistematika tanaman salak Sidempuan adalah sebagai berikut :
Kingdom : Plantae
Divisi : Spermatophyta
Sub Divisi : Angiospermae
Kelas : Monocotyledoneae
Ordo : Arecales/Spadiciflorae
Family : Arecaceae/Palmae
Genus : Salacca
dengan tangkai panjang. Bunga betina terbungkus oleh seludang dengan tangkai pendek. Bunga (seludang) muncul dari ketiak pelepah daun (Sunarjono, 2000).
Tanaman salak berasal dari Desa Sibakua dan Hutalambung, Tapanuli Selatan yang dibudidayakan sudah lama, yaitu mulai sekitar tahun 1930. Masyarakat di daerah setempat mempercayai bahwa tanaman salak ini dapat menambah nafsu makan. Buahnya berbentuk bulat telur terbalik cenderung ke bulat. Kulit buahnya bersisik besar dan berwarna cokelat kehitaman. Uniknya, daging buahnya yang tebal berwarna kuning tua dan bersemburat merah. Rasanya manis bercampur asam, berair, dan tidak terasa sepatnya. Bijinya berukuran relatif besar dan berwarna cokelat muda. Ukuran buahnya bervariasi dari kecil sampai besar (Pracaya, 2002).
Secara umum penampakan salak Padang Sidempuan lebih kekar dan lebih besar dari salak jenis lainnya. Salak Padang Sidempuan dicirikan dengan bentuk batang, pelepah dan helaian daun yang besar dan kokoh. Dari jauh dengan melihat letak susunan daun dan ukurannya, kita dapat menentukan bahwa itu salak jenis Padang Sidempuan. Ciri utamanya daunnya dapat dilihat pada daun paling ujung dari pelepah yang bentuknya sangat lebar, sedangkan daun di bagian lainnya mengarah ke samping atau tegak lurus terhadap posisi pelepah daun. Ciri khas dari salak Padang Sidempuan ini terletak pada ukuran pelepah dan durinya, letak anak daun terhadap pelepah serta daun yang paling ujung dari pelepah, warna daging buah dan rasanya serta bentuk bunga jantannya (Anarsis, 1999).
2.2 Penyakit Tanaman Salak
Pengendalian penyakit ini biasanya dilakukan dengan memotong bagian yang terserang, kemudian dibakar. Usaha ini dilakukan hanya untuk mengurangi sumber penyakit (Anarsis, 1999).
Penyakit rebah kecambah sering muncul pada tunas yang baru muncul dari biji. Pada kecambah yang terserang dapat dijumpai benang-benang putih dan titik-titik putih sampai coklat seperti pasir. Akibat serangan penyakit ini daun menjadi patah, jika tidak cepat dibongkar dari persemaiannya maka bibit akan mati. Penyebab penyakit ini sama dengan penyebab penyakit busuk buah. Pengendaliannya dapat dilakukan dengan membuat tempat persemaian yang baik. Gunakan tanah yang bebas dari penyebab penyakit rebah kecambah. Tempat bekas terjangkit penyakit ini harus dibiarkan sampai beberapa waktu dan dibakar untuk menghilangkan bibit penyakitnya (Anarsis, 1999).
2.3 Faktor-Faktor Lingkungan Pendukung Pertumbuhan Tanaman Salak
Terdapat beberapa faktor yang berperan penting dalam pertumbuhan dan perkembangan tanaman salak, salah satunya adalah faktor fisik atau lingkungan dan faktor kimia. Yang termasuk faktor fisik adalah suhu atau temperatur tanah, kelembaban tanah, sedangkan faktor kimianya adalah pH dan unsur-unsur hara yang terdapat di dalam tanah.
2.3.1 Temperatur Tanah
tahan genangan air (www.iptek.net.id/ind/warintek/html, diakses tanggal 22 Agustus 2008).
Temperatur tanah merupakan faktor yang mengatur pertumbuhan akar terutama pada awal dan akhir dari siklus pertumbuhan tanaman. Tanah dengan suhu yang tinggi atau rendah dapat membatasi pertumbuhan akar. Kebutuhan suhu optimum bagi pertumbuhan akar umumnya lebih rendah dibandingkan dengan suhu bagi pertumbuhan pucuk. Suhu permukaan tanah yang langsung terkena sinar matahari cukup tinggi dan sering menimbulkan kerusakan pada akar dan pangkal batang. Pada tanaman apel dan pir ditemukan bahwa pertumbuhan akar optimal pada suhu tanah 16oC kemudian pertumbuhan akan menurun pada suhu 25oC (Islami & Utomo, 1995).
Temperatur tanah mempengaruhi aktivitas jasad renik dalam tanah. Hal ini terbatas pada temperatur dibawah 10oC. Tingkat aktivitas optimum bagi jasad hidup tanah terjadi pada temperatur antara 18oC-30oC. Bakteri dapat memfiksasi nitrogen dari udara dengan baik yaitu pada keadaan panas atau tanah agak kering. Temperatur lapisan tanah atas mengalami perubahan selama 24 jam dalam suatu hari, dan perubahan ini tergantung pada musim. Sedangkan lapisan tanah bawah sampai kedalaman satu meter tidak banyak mengalami perubahan. Perubahan temperatur ini bergantung pada banyaknya panas yang diterima dari matahari. Hal ini banyak dipengaruhi oleh keadaan cuaca, bentuk daerah dan keadaan tanah (Sarief, 1986).
Temperatur tanah juga dipengaruhi oleh warna tanah, kandungan air, dan bobot volume tanah. Permukaan tanah yang berwarna terang mempunyai suhu permukaan tanah yang lebih rendah dibandingkan dengan permukaan tanah yang gelap. Bobot volume tanah akan mempengaruhi ruang pori tanah, sehingga akan menentukan kelancaran difusi gas. Tanah yang mempunyai bobot volume tinggi, apalagi jika ruang porinya berukuran sangat kecil, akan menyebabkan difusi gas terhambat sehingga cenderung mempunyai suhu yang lebih tinggi (Islami & Utomo, 1995).
2.3.2 Kelembaban Tanah
Bilamana curah hujan itu mencapai permukaan tanah maka seluruh atau sebagiannya akan diabsorbsi ke dalam tanah. Bagian yang tidak diabsorbsi akan menjadi limpasan permukaan (surface runoff). Kapasitas infiltrasi curah hujan dari permukaan tanah ke dalam tanah sangat berbeda-beda yang tergantung pada kondisi tanah di tempat bersangkutan. Permeabilitas tanah ditentukan oleh tekstur dan struktur butir-butir tanah. Tetapi perbedaan tekstur dan struktur menetukan juga kapasitas menahan kelembaban tanah. Oleh karenanya, maka hubungan antara kelembapan tanah dan infiltrasi akan dikemukakan lebih dahulu (Sosrodarsono & Takeda, 1978).
Dapat ditegaskan, bahwa tanpa adanya air di dalam tanah, suatu jenis tanaman apapun tidak mungkin dapat tumbuh dan berkembang, demikian pula semua makhluk hidup di dalam tanah. Air mutlak sangat dibutuhkan oleh tanaman demi pertumbuhan dan perkembangannya. Peranan air bagi tanaman antara lain sebagai pengangkut hara tanaman dari tanah ke tempat fotosintesis, mengedarkan hasil fotosintesa dan metabolisme, mempertahankan ketegangan sel tanaman, dengan demikian maka berlangsungnya berbagai mekanisme dalam tubuh tanaman dapat tetap terjamin, menjamin keberlangsungan fotosintesa karbohidrat (Sutedjo & Kartasaputra, 1988).
partikel-partikel tanah dan menurunkan bentuk gumpalan dan pengolahan tanah memberikan hasil yang optimum. Kemudian bila air ditambah, kohesi lapisan air di sekitar partikel tanah akan meningkat, menyebabkan tanah menjadi lekat dan plastis. Tanah akan mudah melumpur pada keadaan ini (Yunus, 2004).
Menurut Hanafiah (2005), air merupakan komponen utama tubuh tanaman, bahkan hampir 90% sel-sel tanaman dan mikrobia terdiri dari air. Air yang diserap tanaman di samping berfungsi sebagai komponen sel-selnya, juga berfungsi sebagai media reaksi pada hampir seluruh proses metabolismenya yang apabila telah terpakai diuapkan melalui mekanisme transpirasi, yang bersama-sama dengan penguapan dari tanah sekitarnya (evaporasi) disebut evapotranspirasi. Kadar air tanah sama dengan masukan air yang dikurangi dengan kehilangan air pada tanaman.
2.3.3 pH Tanah
Penentuan pH tanah dalam klasifikasi dan pemetaan tanah diperlukan selain untuk menaksir lanjut tidaknya perkembangan tanah juga diperlukan dalam penggunaan tanahnya, terutama untuk tanah pertanian. Pada umumnya tanah yang telah berkembang lanjut dalam daerah iklim basah mempunyai pH tanah yang rendah. Makin lanjut umurnya makin asam tanah. Sebaliknya tanah di daerah beriklim kering penguapan menyebabkan tertimbunnya unsur-unsur basa di permukaan tanah karena besarnya evaporasi dibandingkan dengan presipitasi, sehingga makin lanjut umur tanah makin tinggi pH nya. Akan tetapi, pada umumnya di daerah kering jarang ditemukan tanah yang senantiasa tetap pada tempatnya mengingat angin yang senantiasa bertiup sebagai akibat perubahan iklim yang besar (Darmawijaya, 1992).
Pada umumnya reaksi tanah menyatakan keadaan unsur basa dalam tanah. Tanah asam banyak mengandung ion H yang dapat ditukar, sedang tanah alkalis kaya akan unsur-unsur basa yang dapat ditukar. pH tanah hanya merupakan ukuran intensitas keasaman tanah, bukan kapasitas jumlah unsur hara. Biasanya nilai pH yang lebih besar dari 7 menunjukkan adanya karbonat-karbonat Ca dan atau Mg yang bebas. Tanah yang mempunyai nilai pH lebih tinggi dari 8,5 hampir selalu mengandung sejumlah Na yang dapat ditukarkan. Adanya CaCO3 yang bebas dapat
ditentukan dengan penetesan HCl 10%. Pemercikan akan berarti adanya kadar Ca. Kadar Mn dapat pula ditentukan dengan pengamatan pemercikan oleh penetesan H2O2
20% (Darmawijaya, 1992).
Menurut Islami & Utomo (1995), keasaman tanah (pH) dapat juga mempengaruhi pertumbuhan akar. Meskipun masing-masing tanaman menghendaki kisaran pH tertentu, tetapi kebanyakan tanaman tidak dapat hidup pada pH yang sangat rendah (dibawah 4,0) dan sangat tinggi (diatas 9,0). Karena pada pH tersebut merupakan kondisi yang beracun bagi pertumbuhan akar tanaman. Pada pH disekitar netral (7,0) didapatkan pertumbuhan akar yang baik.
2.3.4 Unsur Hara Tanaman Salak
Tanaman menyerap (mengabsorbsi) berbagai unsur hara yang tersedia di dalam tanah melalui akar. Akan tetapi ternyata banyak pula yang mampu mengambilnya melalui daun, batang atau organ-organ lain tanaman, sebagai misal dalam hal ini penyemprotan daun atau bagian atas tanaman untuk menambah N, FE, Zn, Cu, Mo. Unsur hara yang merupakan zat makanan untuk tanaman dibagi dalam 2 golongan yaitu unsur hara makro, yang terdiri dari zat arang, oksigen, hidrogen, nitrogen, fosfat, kalium, kapur, magnesium dan belerang. Unsur hara mikro yang terdiri dari zat borium, khlor, kuningan, besi, mangan, molibden, dan seng yang kadang-kadang masih diperlukan juga Si, Na dan Co (Sutedjo & Kartasaputra, 1988).
dengan fosfor, ternyata mempunyai akar yang lebih banyak yang dibandingkan dengan tanaman yang tanpa dipupuk. Hal ini mungkin disebabkan ketersediaan fosfor akan meningkatkan laju fotosintesis yang selanjutnya akan meningkatkan pertumbuhan akar. Pertumbuhan akar akan meningkat setelah terjadi peningkatan pertumbuhan pucuk (Islami & Utomo, 1995).
Kapasitas tanah untuk menyediakan unsur-unsur hara tersebut merupakan masalah edapologi, yang dalam hal ini apabila tanah tidak mampu menyediakannya, haruslah diterapkan pemberian pupuk, baik pupuk anorganis, organis, kompos dan lainnya, karena ketidaklengkapan dari zat makro dan mikro dapat mengakibatkan hambatan bagi pertumbuhan tanaman, pengembangbiakan dan produktivitasnya. Tanaman memerlukan C, O, H, N, P dan S dalam jumlah banyak yang terutama untuk membangun jaringan. Sedangkan Fe, Mg, Zn, Cu, Bo dan biasanya juga Mo yang walaupun diperlukan dalam jumlah yang sedikit adalah penting untuk pembentukan enzim (Sutedjo & Kartasaputra, 1988).
Unsur hara disebut esensial bagi tanaman bila : (1) kekurangan unsur hara tersebut tidak memungkinkan tanaman untuk menyelesaikan pertumbuhan baik vegetatif maupun reproduktif, (2) Kekurangan suatu unsur hara esensial memperlihatkan gejala yang spesifik dan hanya dapat dicegah dan diperbaiki dengan unsur hara itu, (3) unsur hara esensial secara langsung terlibat dalam pemenuhan nutrisi tanaman dan tidak mudah mengoreksi kekurangan akibat kondisi dalam tanah atau media (www.iel.ipb.ac.id/sac/hibah/2002/agrostologi/ketersediaanunsurhara.html, diakses tanggal 8 September 2008).
2.4 Enzim PO (Peroksidase) dan PPO (Polifenol Oksidase) pada Tanaman Salak 2.4.1 Enzim PO (Peroksidase)
dinding sel (pengikat) tanaman, aktivitas enzim PO memainkan peran pada penstabilan produksi dan deposisi dari lignin pada jaringan tanaman. Pada dinding primer yang non lignin, enzim PO mungkin melibatkan rantai dari asam sinamik seperti asam ferulik, produksi dari implikasi penambahan dari adhesi sel pada jaringan parenkim (Santandrea et al., 2000).
Peroksidase adalah enzim yang ada dimana saja pada tanaman khususnya pada aktivitas fisiologinya, dengan fungsi yang berhubungan dengan perubahan morfogenik pada divisi sel, pertumbuhan dan diferensiasi. Aktivitas dari peroksidase pada jaringan tanaman terdistribusi pada industri pembuatan makanan seperti gandum. Aktivitas peroksidase juga menunjukkan untuk memberi perlindungan pada jaringan hewan yaitu mekanisme oksidatifnya. Pada reaksi fenomena pencoklatan pada jaringan tanaman adalah respon fisiologi dari polimer yang spesifik yang dapat diisolasi dari permukaan yang rusak terhadap infeksi patogen (Omidiji et al., 2006).
Pencoklatan enzimatis pada buah dan sayuran dapat menyebabkan dampak yang tidak diinginkan yang dapat menyebabkan perubahan selama dipetik, diproses dan disimpan. Reaksi ini dihasilkan kebanyakan oleh polifenol oksidase (PPO) dan peroksidase (POD). Kedua enzim mengkatalisis lebih dari satu reaksi dan sejumlah substrat; pencoklatan atau penghitaman adalah bersifat prinsip dan menghasilkan konsekuensi, tetapi perubahan warna, rasa dan hilangnya nutrisi juga sering terjadi. Bagaimanapun, pencoklatan ini berpotensi pada beberapa tanaman secara langsung pada tingkat fenol, atau kombinasi dari aktivitas enzimatik (PPO dan PO) dan fenol (Cano et al., 1997).
2.4.2 Enzim PPO (Polifenol Oksidase)
Pada buah dan sayuran, pencoklatan terjadi pada reaksi polifenol oksidasi. Pencoklatan oksidatif dikatalisis oleh Polifenol Oksidase (PPO, monofenol, dihidroksi fenilalanin, oksigen oksidoreduktase). Ketika produk segar dirusak oleh terjadinya pencoklatan oksidatif, dan ini merupakan masalah ekonomi untuk produsen dan konsumen. Polifenol oksidase, yang tersusun atas enzim tembaga, mengkatalisis daerah aerob oksidatif dari monofenol menjadi o-difenol yang diikuti dengan dehidrogenasi menjadi o-quinon. PPO biasanya terdistribusi pada tanaman dan mikroorganisme dan banyak peneliti tertarik pada isolasi PPO dari berbagai sumber seperti pisang, apel Amasya, buah kiwi, daun selada, pir, kelapa, biji coklat, dan minyak (Yagar & Sagiroglu, 2000).
Pada sel tanaman utuh, PPO dan substrat fenoliknya dipisahkan secara fisik pada kloroplas dan vakuola, demikian juga oksidasi dari fenolik dan bahkan pencoklatan enzimatik. Gangguan pada sel karena dilukai oleh pembongkaran sel selama perubahan tersebut memberi kontak PPO dengan fenolik dan terjadilah pencoklatan enzimatik. Pada buah termanifestasi sebagai warna coklat pada bagian daging dan epidermis. Tingkat dari PPO dan fenolik mampu mengubah perkembangan buah dan reaksi perubahan warna dapat terjadi sebagai kerusakan potensial yang disebabkan oleh enzim pencoklatan (Vela et al., 2000).
BAB 3
BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada awal Januari sampai Juni 2009 di desa Sibakua dan desa Huta Lambung, Kecamatan Angkola Barat, Kabupaten Tapanuli Selatan, yang selanjutnya pada bulan Agustus 2009 dibawa ke Laboratorium Genetika, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Laboratorium Biologi Molekuler Pusat Penelitian Kelapa Sawit Marihat, Pematang Siantar, Laboratorium Farmasi Kuantitatif, Fakultas Farmasi, USU dan Laboratorium Kimia Bahan Pangan, Fakultas Pertanian, USU.
3.2 Alat dan Bahan Penelitian
Alat-alat yang digunakan dalam percobaan ini seperti cangkul, sarung tangan, kantongan plastik, termometer, soil pH tester, termometer tanah, spidol, kertas label, polibag, kertas pasir, termos, mikroskop, sampel cup, pinset, kertas saring, tisu gulung, objek dan gelas penutup, aluminium foil, pipet serologi, pipet tetes, gelas beaker, gelas ukur, neraca analitik, spektrofotometer, kuvet, pH meter, mikrosentrifuge, tabung nitrogen cair dan mikropipet.
posfat, pyrogallol, coomassie brilliant blue G-250, bovine serum albumin (BSA), Triton-X 100, H2O2, H2SO4 5%, buffer tris HCl, nitrogen cair.
3.3 Metode Penelitian a. Penanaman salak
Biji salak yang diperoleh dari desa Sibakua dan Huta Lambung, Padang Sidempuan, Tapanuli Selatan diambil secara random (acak) sebanyak masing-masing 25 buah yang selanjutnya dibawa ke Laboratorium Genetika, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan. Kemudian digerus pada bagian embrio dengan kertas pasir halus. Direndam dalam air selama 1-2 jam. Ditanam dalam polibag yang berukuran 25 cm sedalam 15 cm dengan perbandingan tanah dan pasir 1:1 sampai setengah bagian biji salak tampak di permukaan polibag. Disiram setiap hari agar biji tidak kering. Penanaman dilakukan selama 6 bulan untuk anakan salak yang berdaun dan berbatang muda serta sudah berakar dan selama 2 bulan untuk kecambah salak.
b. Metode pengujian aktivitas enzim Peroksidase dan Polifenol Oksidase : 1. Ekstraksi Organ Tanaman
Ekstraksi organ tanaman dari kecambah, batang dan daun salak (anakan berumur 6 bulan dan kecambah berumur 2 bulan) diambil sebanyak 200 mg kemudian digerus dengan menggunakan nitrogen cair dan dihomogenisasi dengan 2 ml buffer 0,05 M pada pH 8 suhu 0oC dan 0,15% Triton-X 100, lalu disentrifugasi dengan kecepatan 14.000 rpm selama 20 menit suhu 0oC. Diambil supernatan yang terbentuk untuk analisis selanjutnya.
2. Determinasi Protein
terjadi ikatan antara reagan warna protein dengan protein setelah 2 menit hingga 1 jam.
3. Penentuan Aktivitas Enzim
Penentuan aktivitas dari enzim Peroksidase (PO) dan Polifenoloksidase (PO) dengan menggunakan metoda Kar and Mishra (1976). Prosedur ini berdasarkan kenyataan bahwa PO dan PPO dapat mengoksidasi pyrogallol. Proses oksidasi dari PO dalam mengkatalisis reaksi menggunakan H2O2 (Kar and Mishra, 1976: Maehly and
Chance, 1954), sedangkan oksidasi dari PPO tidak menggunakan H2O2.
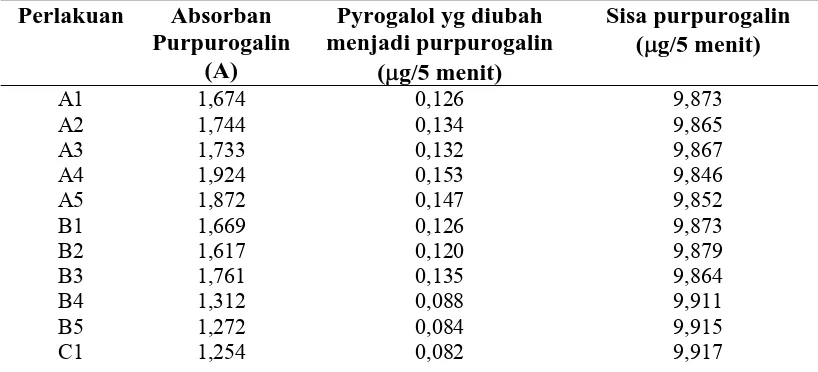
3. 1 Enzim Peroksidase (PO)
Pengujian aktivitas enzim PO dengan menggunakan 30 μl protein dari batang dan daun salak dicampur dengan 0,1 ml buffer posfat pada pH 6,8 dan suhu 25oC, lalu ditambahkan 10 mM H2O2 sebanyak 0,1 ml, didiamkan selama 5 menit,
kemudian ditambahkan 0,5 ml H2SO4 5% (v/v) untuk menghentikan reaksi.
Pengukuran kadar purpurogallin dilakukan dengan menggunakan metoda Bausch & Lomb Spectronic 70 Kolorimeter dengan menggunakan spektrofotometer panjang gelombang 420 nm. Campuran reaksi antara buffer posfat dengan pyrogallol digunakan sebagai larutan blanko.
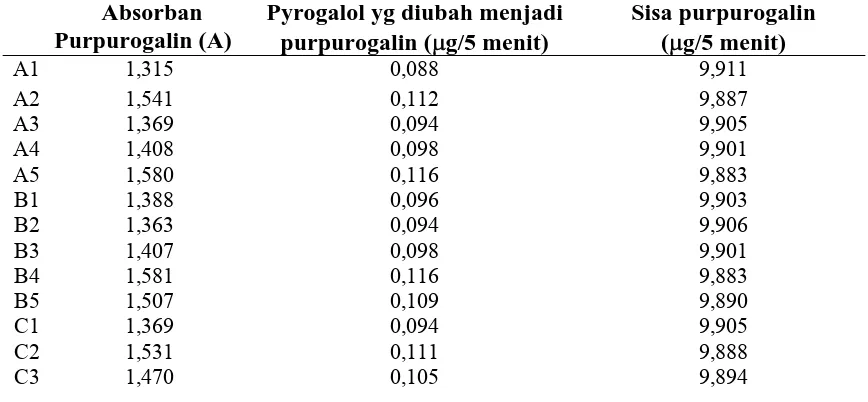
3. 2 Enzim Polifenoloksidase (PPO)
Pengujian aktivitas enzim PPO menggunakan prosedur yang sama dengan pengujian enzim peroksidase. Pengujian ini menggunakan penambahan ekstrak kecambah, batang dan daun salak sebanyak 70 μl protein dan ditambahkan 5 ml larutan pereaksi yang terdiri dari 0,1 ml buffer posfat pada pH 6,8 dan suhu 25oC, didiamkan selama 5 menit, kemudian ditambahkan 0,5 ml H2SO4 5% (v/v) untuk
menghentikan reaksi. Larutan diukur nilai absorbansinya pada panjang gelombang 420 nm.
3.3 Pembuatan Kurva Standar Bovine Albumin
aquadest. Lalu larutan BSA dimasukkan ke dalam tabung reaksi sebanyak 0 (blanko), 0; 0,2; 0,4; 0,6; 0,8; dan 1 ml. Ke dalam masing-masing tabung reaksi ditambahkan Coomassie Brilliant Blue G-250 hingga volume total mencapai 5 ml. Absorbansi diukur dengan spektrofotometer pada panjang gelombang 595 nm. Persamaan garis regresi kurva standar larutan protein ditentukan dengan rumus sebagai berikut :
Y = a + bx
Dimana : a = intersep a = Y – b X
n (XY) – (X) (Y) b = slope (koefisien regresi) b =
n ({X2) – (Y)2
c. Prosedur Pengukuran Faktor Fisika Tanah 1. Suhu
Dilakukan dengan menggunakan soil termometer yang ditancapkan ke dalam tanah tempat penelitian dilakukan, yakni tanah dari desa Sibakua dan Huta Lambung.
2. pH
Dilakukan dengan menggunakan soil pH tester yang ditancapkan ke dalam tanah tempat penelitian dilakukan, yakni tanah dari desa Sibakua dan Huta Lambung.
3. Kelembaban Tanah
Dilakukan dengan membawa tanah dari tempat penelitian dilakukan yakni tanah dari desa Sibakua dan Huta Lambung ke Laboratorium Sentral Fakultas Pertanian USU untuk dianalisis dan dihitung nilai kelembaban tanahnya (Harahap, 2000).
Cara kerja : ditimbang 10 g tanah sebagai berat awal. Dimasukkan ke dalam cawan lembab. Diovenkan selama 24 jam. Ditimbang lagi tanah sebagai berat akhir. Dihitung % kadar air (kelembaban tanah).
Perhitungan :
Berat awal berat akhir
% kadar air = x 100% Berat akhir
d. Prosedur Pengukuran Faktor Kimia Tanah
1. Unsur C (Carbon) dengan menggunakan metode Walkey & Black
Prinsip : C-organik dihancurkan oleh oksidasi Kalium Bikromat yang berlebih akibat penambahan asam sulfat. Kelebihan kromat yang tidak direduksi oleh C-organik tanah kemudian ditetapkan dengan jalan titrasi dengan larutan ferro.
Cara kerja : yaitu ditimbang 0,5 g tanah kering udara, dan dimasukkan ke dalam erlenmeyer 500 cc. Ditambahkan 5 ml K2Cr2O7 1 N (pergunakan pipet) dan
digoncang dengan tangan. Ditambahkan 10 ml H2SO4 pekat, kemudian digoncang 3-4
menit, selanjutnya didiamkan selama 30 menit. Ditambahkan 100 ml air suling dan 5 ml H3PO4 85%, NaF 4% 2,5 ml, kemudian ditambahkan 5 tetes diphenilamine,
digoncang, dan diperoleh larutan berwarna biru tua kehijauan kotor. Dititrasi dengan Fe (NH4)2 (SO4)2 0,5 N dari buret hingga warna berubah menjadi hijau terang.
Dilakukan lagi tanpa tanah untuk mendapatkan volume titrasi Fe (NH4)2 (SO4)2 0,5 N
untuk blanko.
Perhitungan :
T 1 100
Corg = 5 x 1 – x 0,003 x x S 0,77 BCT
Dimana :
T = vol. Titrasi Fe (NH4)2 (SO4)2 0,5 N dengan tanah
S = vol. Titrasi Fe (NH4)2 (SO4)2 0,5 N blanko (tanpa tanah)
0,003 = 1 ml K2Cr2O7 1N + H2SO4 mampu mengoksidasi 0,003 g C-organik
1/0,77 = metode ini hanya 77% organik yang dapat dioksidasi BCT = Berat Contoh Tanah
2. Unsur N (Nitrogen) dengan menggunakan metode Kjeldhal
Prinsip : N-organik diubah menjadi N-amonium oleh asam sulfat yang dipanaskan sekitar 380oC dan menggunakan Cu-sulfat + Selenium + Na-sulfat sebagai katalisator. Proses ini disebut digestasi dan hasilnya disebut digest yang mengandung amonium dibasakan dengan NaOH sehingga ion amonium dikonversi menjadi amoniak. Lalu didestilasi menjadi amonium hidroksida. NH4OH ditentukan jumlahnya
Cara Kerja : a.Destruksi
Ditimbang 2 g contoh tanah dan ditempatkan ke tabung digester. Berat contoh tanah tergantung kepada kadar C-organik. Ditambahkan 2 g katalis campuran (sebanyak contoh tanah) dan ditambahkan 10 ml H2O. Kemudian ditambahkan lagi 10
ml campuran H2SO4 asam salisilat dan dibiarkan 1 malam. Didestruksi pada alat
Digestor (Kjeldhaltherm) dengan suhu rendah dan dinaikkan secara bertahap hingga larutan jernih atau putih (suhu dibawah 200oC). Dinaikkan suhu setelah larutan jernih dan dilanjutkan selama 30 menit. Didinginkan dan diencerkan dengan menambahkan 15 ml H2O.
b.Destilasi
Ditempatkan tabung destruksi pada alat destilasi. Ditempatkan pipet 25 ml H3BO3 4% pada erlenmeyer 250 cc dan ditambahkan 3 tetes indikator campuran, dan
ditempatkan sebagai penampung hasil destilasi. Ditambahkan NaOH 40% 25 ml ke tabung destilasi dan langsung didestilasi. Ditampung amoniak hasil destilasi dierlenmeyer yang berisi H3BO3. Dihentikan destilasi bila larutan dalam erlenmeyer
berwarna hijau dan volumenya 75 ml. c.Titrasi
Dipindahkan erlenmeyer hasil destilasi dan dititrasi dengan HCl 0,02 N. Ditandai titik akhir titrasi oleh perubahan warna dari hijau menjadi merah.
Perhitungan :
mlHCl x NHCl x 14 x 100
N(%) =
Berat Tanah x 1000 = ml HCl x 0,014
3. Unsur P (Fosfor) dengan menggunakan metode Bray I
Prinsip : P-tersedia tanah diekstrak oleh NH4F2 dan HCl, P yang bebas
direaksikan dengan molibdat asam akan menjadi berwarna biru dengan adanya asam askorbat. Perkembangan warna biru diukur sebagai kadar P secara spektrometri. Cara Kerja: ditimbang 2 g contoh tanah dan ditempatkan pada gelas erlenmeyer 250 cc. Ditambahkan larutan Bray I sebanyak 20 ml dan digoncang pada
pipet filtrat sebanyak 5 ml pada tabung reaksi. Ditambahkan pereaksi posfat B sebanyak 10 ml. Dibiarkan selama 5 menit. Diukur transmitan pada spektronik dengan panjang gelombang 660 nm. Diberi pipet masing-masing 5 ml larutan standar P 0 – 0,5 – 1,0 – 2,0 – 3,0 – 4,0 dan 5,0 ppm P ke tabung reaksi kemudian ditambahkan 10 ml pereaksi Posfat B. Diukur transmitan standar pada spektronik dengan panjang gelombang yang sama yaitu 660 nm.
Perhitungan:
Nilai absorben = - log transmitan/100. Dibuat kurva standar P (0 – 5 ppm P) sebagai sumbu X dan nilai absorben sebagai sumbu Y. Konsentrasi P-larutan ditetapkan dengan menginterpolasikan nilai absorben dari sampel ke kurva standar (kurva standar dan interpolasi dapat dilakukan secara mudah dengan menggunakan kalkulator pakai program LR).
20
Pavl(ppm) = Plrt x x faktor pengencer (bila ada) 2
4. Pengamatan
BAB 4
HASIL DAN PEMBAHASAN
4.1Karakteristik Morfologi Tanaman Salak
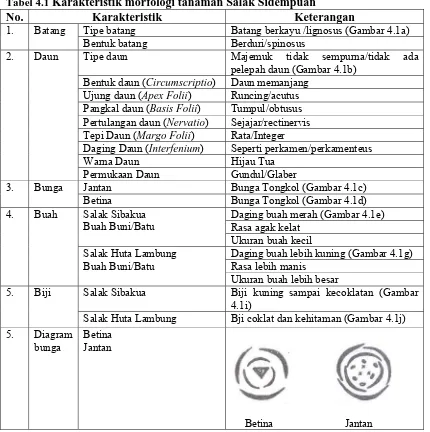
[image:35.595.102.532.338.770.2]Berdasarkan penelitian yang telah dilakukan, dapat dikarakterisasi morfologi dari tanaman salak yang berasal dari dua desa yaitu desa Sibakua dan desa Huta Lambung. Deskripsi dari tanaman salak tersebut ditampilkan pada tabel 4.1 dibawah ini.
Tabel 4.1 Karakteristik morfologi tanaman Salak Sidempuan
No. Karakteristik Keterangan
1. Batang Tipe batang Batang berkayu /lignosus (Gambar 4.1a)
Bentuk batang Berduri/spinosus
2. Daun Tipe daun Majemuk tidak sempurna/tidak ada
pelepah daun (Gambar 4.1b) Bentuk daun (Circumscriptio) Daun memanjang
Ujung daun (Apex Folii) Runcing/acutus
Pangkal daun (Basis Folii) Tumpul/obtusus Pertulangan daun (Nervatio) Sejajar/rectinervis Tepi Daun (Margo Folii) Rata/Integer
Daging Daun (Interfenium) Seperti perkamen/perkamenteus
Warna Daun Hijau Tua
Permukaan Daun Gundul/Glaber
3. Bunga Jantan Bunga Tongkol (Gambar 4.1c)
Betina Bunga Tongkol (Gambar 4.1d)
4. Buah Salak Sibakua
Buah Buni/Batu
Daging buah merah (Gambar 4.1e) Rasa agak kelat
Ukuran buah kecil Salak Huta Lambung
Buah Buni/Batu
Daging buah lebih kuning (Gambar 4.1g) Rasa lebih manis
Ukuran buah lebih besar
5. Biji Salak Sibakua Biji kuning sampai kecoklatan (Gambar
4.1i)
Salak Huta Lambung Bji coklat dan kehitaman (Gambar 4.1j) 5. Diagram
bunga
Betina Jantan
6. Rumus bunga
♂ K 3, C 3, A (6), G 0
♀ K 3, C 3, A 0, G (3)
K = Kelopak (Calyx), C = Tajuk/mahkota
(Corolla), A = Benang Sari (Androecium),
G = Putik (Gynaecium)
Penampakan morfologi tanaman salak dari desa Sibakua dan Huta Lambung juga dapat dilihat dari gambar di bawah ini.
a b
[image:36.595.108.472.177.573.2]
c d Gambar 4.1 Morfologi Tanaman Salak Sidempuan a. Batang tanaman salak
b. Daun tanaman salak
e f
g h
i j
Gambar 4.1 Morfologi Buah dan Biji Salak Sidempuan
e. Buah tanaman salak dari desa Sibakua penampakan luar f. Penampakan dalam
g. Buah tanaman salak dari desa Huta lambung penampakan luar
h. Penampakan dalam
i. Biji tanaman salak dari desa Sibakua
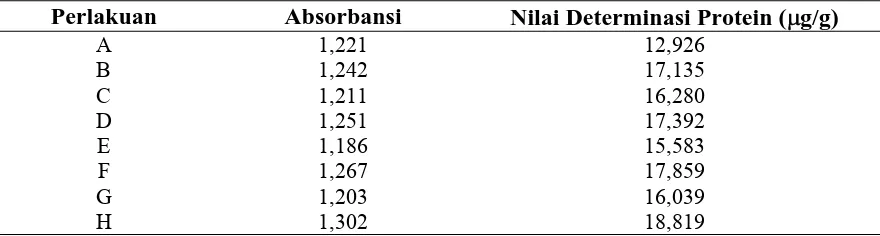
4.2 Determinasi Protein
Determinasi protein dari kecambah, batang dan daun tanaman salak diukur dengan menggunakan spektrofotometer pada panjang gelombang 595 nm dapat dilihat pada Lampiran I (Halaman 53). Hasil yang diperoleh dapat dilihat pada Gambar 4.2 berikut ini.
Gbr. 4.2 Nilai Determinasi Protein dari Kecambah, Batang dan Daun Salak pada Panjang Gelombang 595 nm dari desa dan Sibakua dan Huta Lambung
Ket :
A : Daun anakan Huta Lambung B : Batang anakan Huta Lambung C : Daun anakan Sibakua D : Batang anakan Sibakua E : Daun kecambah Huta Lambung F : Batang kecambah Huta Lambung G : Daun kecambah Sibakua
H : Batang kecambah Sibakua
Berdasarkan Gambar 4.2 di atas, menunjukkan bahwa kadar protein yang tertinggi pada desa Sibakua yaitu H dengan nilai 18,819 dan yang terendah pada desa Huta Lambung yaitu A dengan nilai 12,926. Hal ini menunjukkan bahwa kadar protein pada desa Sibakua lebih tinggi dari desa Huta Lambung.
proses-proses fisiologi tanaman yang pengadaan dan pengaturannya dikontrol secara genetik (Shannon, 1968). Penggunaan penandaan isozim mempunyai kelebihan karena isozim diatur oleh gen tunggal dan bersifat kodominan dalam pewarisan dan bersegregasi secara normal. Penanda ini bersifat stabil karena tidak dipengaruhi oleh faktor lingkungan, lebih cepat dan akurat karena tidak menunggu tanaman ini sampai bereproduksi (Hadiati, et al., 2002).
Suatu reaksi kimia khususnya antara senyawa organik yang dilakukan di dalam laboratorium memerlukan suatu kondisi yang ditentukan oleh beberapa faktor seperti suhu, tekanan, waktu dan lain-lain. Reaksi atau proses kimia yang berlangsung dengan baik di dalam tubuh kita dimungkinkan karena adanya katalis yang disebut enzim (Poedjiadi, 2004). Salah satu fungsi yang menonjol dari protein adalah aktivitas enzim. Enzim mengontrol dan mengkatalis aktivitas kimia dari sel makhluk hidup (Page, 1989).
Enzim merupakan protein biokatalisator untuk proses-proses fisiologi tanaman yang pengadaan dan pengaturannya dikontrol secara genetik (Shannon, 1968). Penggunaan penandaan isozim mempunyai kelebihan karena isozim diatur oleh gen tunggal dan bersifat kodominan dalam pewarisan dan bersegregasi secara normal. Penanda ini bersifat stabil karena tidak dipengaruhi oleh faktor lingkungan, lebih cepat dan akurat karena tidak menunggu tanaman ini sampai bereproduksi (Hadiati, et al., 2002).
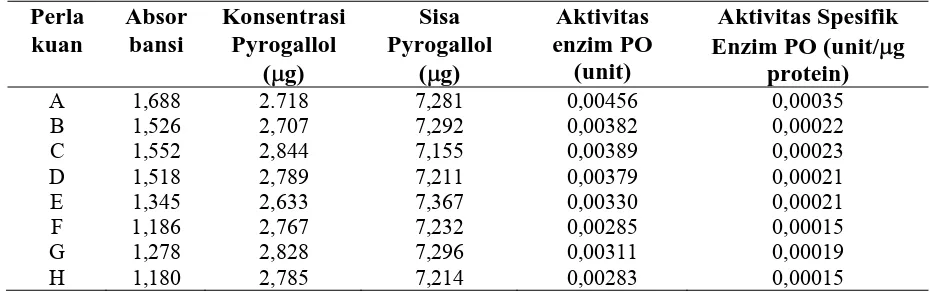
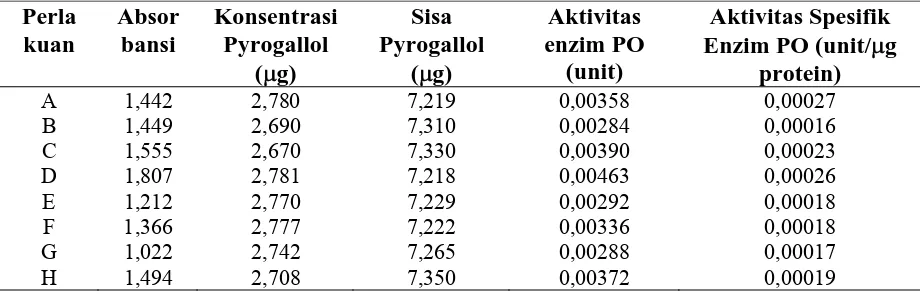
4.3 Pengujian Aktivitas Enzim Peroksidase
Pengujian aktivitas enzim peroksidase ini menggunakan metode Kar dan Mishra (1976), yang diukur dengan spektrofotometer dengan panjang gelombang 420 nm.
Gbr. 4.3 Nilai Aktivitas Enzim Peroksidase dari Kecambah, Batang dan Daun Salak pada Panjang Gelombang 420 nm dari desa Sibakua dan Huta Lambung
Ket :
A : Daun anakan Huta Lambung B : Batang anakan Huta Lambung C : Daun anakan Sibakua D : Batang anakan Sibakua E : Daun kecambah Huta Lambung F : Batang kecambah Huta Lambung G : Daun kecambah Sibakua
H : Batang kecambah Sibakua
Berdasarkan Gambar 4.3 di atas, menunjukkan bahwa nilai aktivitas enzim peroksidase yang tertinggi pada desa Huta Lambung yaitu A dengan nilai 0,00456 dan yang terendah pada desa Sibakua yaitu H dengan nilai 0,00283. Hal ini menunjukkan bahwa aktivitas enzim peroksidase pada desa Huta Lambung lebih tinggi dari desa Sibakua.
(Gaspar, et al., 1980). Aktivitas isozim peroksidase mudah dideteksi karena aktivitasnya yang luar biasa pada jaringan (Touti, 1988).
Enzim peroksidase (PO) memerlukan gen untuk mengekspresikan reaksi pertahanannya pada tanaman. Untuk menganalisis peran dari enzim ini diperlukan tiga gen peroksidase seperti POX22.3, POX8.1 dan POX5.1 contohnya pada daun tanaman padi untuk reaksi ketahanan terhadap patogen. Gen tersebut hampir sama dengan rangkaian asam nukleat dan asam amino yang berada pada satu famili gen. Ketiga gen tersebut menunjukkan ekspresi yang berbeda pada daun selama interaksi patogen dan mekanisme ketahanan tanaman (Chittoor et al., 1997).
Enzim peroksidase berperan dalam resistensi tanaman, dapat meningkatkan pertumbuhan dan perkembangan tanaman serta dapat meningkatkan sistem mekanisme pertahanan sehingga tanaman dapat tumbuh dan berkembang dengan baik. Abeles et al. (1990) juga mengemukakan bahwa peningkatan aktivitas enzim peroksidase adalah respon umum tanaman terhadap cekaman lingkungan. Seperti cekaman suhu rendah pada gandum dan jagung (Peruanskii et al., 1991) dan cekaman terhadap polusi udara (Rao and Dubey, 1990). Selain itu aktivitas enzim peroksidase juga menunjukkan adanya mekanisme pertahanan dan perlindungan terhadap penyakit yang menyerang tanaman (Herison et al., 2007).
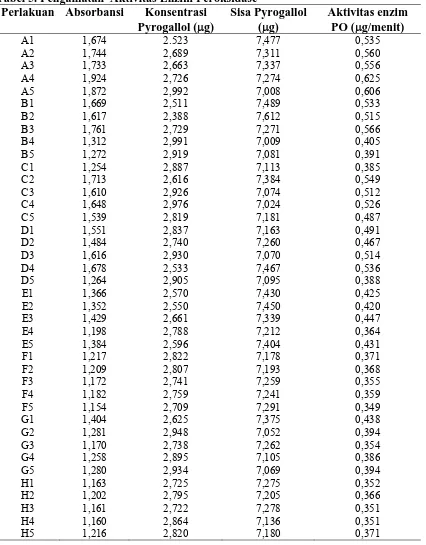
4.4 Pengujian Aktivitas Enzim Polifenol Oksidase
Pengujian aktivitas enzim polifenol oksidase ini menggunakan metode Kar dan Mishra (1976), yang diukur dengan spektrofotometer dengan panjang gelombang 420 nm.
Gbr. 4.4 Nilai Aktivitas Enzim Polifenol Oksidase dari Kecambah, Batang dan Daun Salak pada Panjang Gelombang 420 nm dari desa Sibakua dan Huta Lambung
Ket :
A : Daun anakan Huta Lambung B : Batang anakan Huta Lambung C : Daun anakan Sibakua D : Batang anakan Sibakua E : Daun kecambah Huta Lambung F : Batang kecambah Huta Lambung G : Daun kecambah Sibakua
H : Batang kecambah Sibakua
Berdasarkan Gambar 4.4 di atas, menunjukkan bahwa nilai aktivitas enzim polifenol oksidase yang tertinggi pada desa Sibakua yaitu D dengan nilai 0,00463 dan yang terendah pada desa Huta Lambung yaitu B dengan nilai 0,00284. Hal ini menunjukkan bahwa aktivitas enzim polifenol oksidase pada desa Sibakua lebih tinggi dari desa Huta Lambung.
perkembangan buah dan reaksi perubahan warna dapat terjadi kerusakan potensial yang disebabkan oleh enzim pencoklatan (Vela et al., 2000).
Polifenol oksidase (PPO) tidak terbatas pada beberapa bagian organ tanaman. Keberadaannya dapat dilihat dalam setiap jenis dari organ-organ tersebut. Jaringan, sel, dan ditempat yang sama dalam suatu varietas dari fraksi sel, keduanya terdapat di dalam organela-organela dan dalam cairan sel (Kar and Mishra, 1976; Sato and Hasegawa, 1976).
Enzim Polifenol Oksidase (PPO) adalah komponen protein yang memiliki reaksi sekunder polimerisasi dan biasanya berada pada buah, sayuran dan tanaman yang mengalami pencoklatan atau browning. Fungsi fisiologis dari enzim PPO berhubungan dengan proses perlawanan terhadap serangan dari hama serangga dan bakteri patogen. Enzim ini dikode oleh gen nuklear, dan ditransportasikan pada kloroplas. Beberapa dari enzim ini melibatkan pigmen pada reaksi biosintesisnya, contohnya pada bunga naga, bunga ros dan umbi (Schmitz et al., 2008).
4.5 Analisis Faktor Fisik Tanah
Analisis faktor fisik tanah yang telah dianalisis di Laboratorium Sentral Fakultas Pertanian USU dapat dilihat pada Tabel 4.5 di bawah ini.
Tabel 4.5 Analisis Faktor Fisik Tanah
No. Daerah
Faktor Fisik
Suhu Kelembaban pH
1. Sibakua 25oC 3,09% 6,8
2. Huta Lambung 24,5oC 2,04% 6,5
Suhu atau temperatur tanah yang diperoleh pada desa Sibakua dan Huta Lambung keduanya yaitu 25oC dan 24,5oC termasuk suhu yang optimum untuk pertumbuhan tanaman. Menurut Hanafiah (2005), perbedaan temperatur merupakan cerminan energi panas matahari yang sampai ke suatu wilayah yang berfungsi sebagai pemicu proses fisik dalam pembentukan liat dari mineral-mineral bahan induk tanah, keanekaragaman hayati yang aktif karena memiliki temperatur optimum spesifik serta kesempurnaan proses dekomposisi biomassa tanah hingga ke mineralisasinya dan sebagai hasilnya maka kadar biomassa tanah akan bervariasi. Tanah-tanah yang terbentuk pada temperatur 18-30oC termasuk dalam kondisi optimum pada daerah humid (temperatur sedang) akan mempunyai jenis dan populasi mikroba yang ideal, maka aktivitas biologisnya dalam dekomposisi biomassa juga akan ideal. Sumber biomassanya berlimpah karena semua jenis tanaman akan tumbuh dan berkembang dengan baik.
Kelembaban tanah pada tanaman merupakan salah satu faktor fisik tanah. Kelembaban tanah yang didapat dari desa Sibakua dan Huta Lambung adalah sedang dan tidak terlalu tinggi ataupun rendah. Menurut Yunus (2004), pada kelembaban yang rendah, tanah akan keras dan bergumpal-gumpal karena perekatan antara partikel-partikel kering tanah, bila tanah pada keadaan ini diolah (dibajak) maka akan timbul bongkahan-bongkahan tanah. Bila kelembaban tanah ditingkatkan, maka molekul-molekul air ditingkatkan pada permukaan partikel-partikel tanah dan menurunkan bentuk gumpalan dan pengolahan tanah memberikan hasil yang optimum. Kemudian bila air ditambah, kohesi lapisan air di sekitar partikel tanah akan meningkat, menyebabkan tanah menjadi lekat dan plastis. Tanah akan mudah melumpur pada keadaan ini.
Menurut Sutedjo & Kartasaputra (1988), dapat ditegaskan bahwa tanpa adanya air di dalam tanah, suatu jenis tanaman apapun tidak mungkin dapat tumbuh dan berkembang, demikian pula semua makhluk hidup di dalam tanah. Air mutlak sangat dibutuhkan oleh tanaman demi pertumbuhan dan perkembangannya. Peranan air bagi tanaman antara lain sebagai pengangkut hara tanaman dari tanah ke tempat fotosintesa, mengedarkan hasil fotosintesa dan metabolisme, mempertahankan ketegangan sel-sel tanaman, dengan demikian maka berlangsungnya berbagai mekanisme dalam tubuh tanaman dapat tetap terjamin, menjamin keberlangsungan fotosintesa karbohidrat.
Menurut Mukhlis (2007), nilai pH tanah tidak sekedar menunjukkan suatu tanah asam atau alkali, tetapi juga memberikan informasi tentang sifat-sifat tanah yang lain, seperti ketersediaan posfor, status kation-kation basa atau unsur racun, dsb. Kebanyakan tanah pertanian memiliki pH 4 hingga 8. Tanah yang lebih asam biasanya ditemukan pada jenis tanah gambut dan tanah yang tinggi kandungan aluminium atau belerang. Sementara tanah yang basa ditemukan pada tanah yang tinggi kapur dan berada di kawasan pantai. pH tanah merupakan suatu ukuran intensitas keasaman, bukan ukuran total asam yang ada di tanah tersebut.
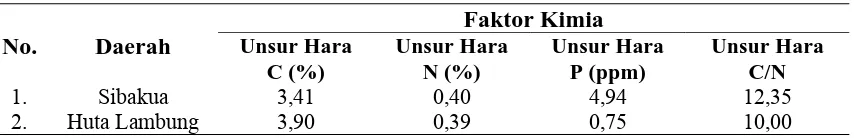
4.6 Analisis Faktor Kimia Tanah
[image:46.595.105.532.373.442.2]Analisis faktor kimia tanah yang telah dianalisis di Laboratorium Sentral Fakultas Pertanian USU dapat dilihat pada Tabel 4.5 sdi bawah ini.
Tabel 4.6 Analisis Faktor Kimia Tanah No. Daerah
Faktor Kimia Unsur Hara
C (%)
Unsur Hara N (%)
Unsur Hara P (ppm)
Unsur Hara C/N
1. Sibakua 3,41 0,40 4,94 12,35
2. Huta Lambung 3,90 0,39 0,75 10,00
Unsur hara yang diukur dari kedua desa yaitu C (Carbon), N(Nitrogen), P(Fosfor) dan C/N. Dimana desa Sibakua memiliki nilai yang lebih tinggi dibandingkan Huta Lambung pada unsur hara N, P dan C/N. Desa Huta Lambung memiliki nilai yang lebih rendah kecuali pada unsur hara C.
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
a. Aktivitas enzim Peroksidase yang tertinggi pada desa Huta Lambung yaitu A dengan nilai 0,00456 dan yang terendah pada desa Sibakua yaitu H dengan nilai 0,00283
b. Aktivitas enzim Polifenol Oksidase yang tertinggi pada desa Sibakua yaitu D dengan nilai 0,00463 dan yang terendah pada desa Huta Lambung yaitu B dengan nilai 0,00284
c. Faktor fisik yang telah diukur dari kedua desa yaitu suhu, kelembaban tanah dan pH yang paling tinggi diperoleh dari desa Sibakua
d. Faktor kimia yang telah diukur dari kedua desa yaitu unsur hara N, P dan C/N yang paling tinggi diperoleh dari desa Sibakua. Sedangkan unsur hara C yang paling tinggi diperoleh dari desa Huta Lambung
5.2 Saran
a. Perlu dilakukan penelitian lebih lanjut untuk mengetahui aktivitas enzim peroksidase dan polifenol oksidase pada tanaman salak guna meningkatkan mutu dan kualitasnya
DAFTAR PUSTAKA
Abeles, F. B, C. L. Biles & L.J. Dunn. 1990. Induction of Peroxidases as a Response to Environmental Stimuli. Monograph. British Soc. Plant Growth Regulation. (Abstract)
Anarsis, W. 1999. Agribisnis Komoditas Salak. Jakarta : Bumi Aksara. hlm. 25, 69, 72-73
Andreeva, I. V. 1989. “Membrance Permeability and Peroxidase Activity in Soy Cultivars Differing in Resistance to Mosaic Virus’. Soviet Plant Physiol 36(4). hlm. 667-674
Artlip, T. S, and E. A. Funkhouser. 1995. Protein Synthetic Responses to Enviromental Stresses. New York : Handbook of Plant Physiol. Hlm. 627-644 Ashari. S. 2004. Biologi Reproduksi Tanaman Buah-buahan Komersial. Edisi 1.
Cetakan 1. Malang : Bayumedia. hlm. 169-170
Bradford, 1976. “A Rapid and Sensitive Method for The Quantitation of Microgram Quantities of Protein Utilizing The Principle of Protein-Dye Binding”. Anal.
Biochem. 72 : hlm. 248-254
Cano, M.P, B. Ancos, M. G. Lobo & M. Santos. 1997. Improvement of Frozen Banana (Musa cavendishii cv.Enana) Colour by Blancing : Relationship Between Browning, Phenols and Polyphenol Oxidase and Peroxidase Activities. Spain : Plant Food Science and Technology Department. hlm. 60
Chittoor, J. M, J. E. Leach & F. F. White. 1997. Differential Induction of a Peroxidase Gene Family During Infection of Rice by Xanthomonas oryzae pv. Oryzae. Molekular Plant Microbe Interactions. 10(7) : hlm. 861
Darmawijaya, M. I. 1992. Klasifikasi Tanah, Dasar Teori Bagi Peneliti Tanah dan Pelaksana Pertanian di Indonesia. Yogyakarta : UGM Press. hlm. 175-176 Gaspar, T, C. Pewel, T. Torpe & H. Greeppin. 1980. Peroxidases a Survey of Their
Biochemical and Physiology Roles in Higher Plant. University of Geneva. hlm. 210-225
Hadiati, S, H. K. Murdaningsih, A. Baihaki & N. Rostini. 2002. “Variasi Pola Pita dan Hubungan Kekerabatan Nanas Berdasarkan Analisis Isozim”. Zuriat 13(2) : hlm. 65-72
Hanafiah, K. A. 2005. Dasar-Dasar Ilmu Tanah. Jakarta : Raja Grafindo Persada. hlm. 45-45, 88, 99 & 102
Hammerschmidt, R. 1999. “Phytoalexins; What Have we Learned After 60 Years?”.
Annu Rev Phytopathology (37). hlm. 285-306
Harahap, E. M. 2000. Buku Praktikum Fisika Tanah. Medan : USU Press. hlm. 20 Herison, C, Rustikawati & Sudarsono. 2007. “Aktivitas Peroxidase, Skor ELISA dan
Respon Ketahanan 29 Genotip Cabai Merah Terhadap Infeksi Cucumber Mosaic Virus (CMV)”. Jurnal Akta Agrosia. 10(1) : hlm. 11
Institut Pertanian Bogor. 2002. Ketersediaan Unsur Hara. http;// iel. Ipb .ac. id/ sac/ hibah/ 2002/ agrostologi/ ketersediaan_unsur_hara. Html. 8 September 2008 Islami, T. & W. N. Utomo. 1995. Hubungan Tanah, Air dan Tanaman. Semarang :
IKIP Press. hlm. 137-138, 140-141, 143
Kar, M., and D. Mishra. 1976. “Catalase, Peroxidase, and Polyphenoloxidase Activity During Rice Leaf Senescence”. Plant Physiology. 57 : hlm. 315-319
Klapp, A. H, F. C. Richard, P. M. Goupy & J. J. Nicolas. 1990. ”Kinetic Studies on Apple Polyphenol Oxidase”. Journal of Agricultural and Food Chemistry. 38(7) : hal. 1438
Lagrimini, L. M, J. Vaugh, W. A. Erb & S. A. Miller. 1991. “Peroxidase Overproduction in Tomato-wounded Polyphenol Deposition and Diseases Resistance”. Hortscience 28(3). hlm. 218-221
Maehly, A. C & B. Chance. 1954. ”The Assay of Catalases and Peroxidases. In: Methods of Biochemical Analysis”. New York : ED. David, G. Interscience Publishers, Inc. hlm. 357-445
Menteri Negara Riset dan Teknologi. 2005. Teknologi Tepat Guna. http://www.iptek.net.id/ind/warintek/. Html. 22 Agustus 2008
Mukhlis. 2007. Analisis Tanah Tanaman. Medan : USU Press. hlm. 102, 107, 109-110, 113-116, 117-120.
Notohadiprawiro. T. 1198. Tanah dan Lingkungan. Jakarta : Direktorat Jenderal Pendidikan Tinggi Departemen Pendidikan dan Kebudayaan. hlm. 125 & 171.
Omidiji, O, J. E. Okpuzor & O. Otubu. 2006. “The Contribution of an Ionic Peroxidase Isozym to Enzyme-Mediated Browning in Dioscorea esculenta L. Tubers”. Pakistan Journal of Nutrition. 5(5) : hlm. 478
Oszmianski, J & C. Y. Lee. 1990. Inhibition of Polyphenol Oxidase Activity and Browning by Honey. New York : Department of Food Science and Technology. hlm. 90
Page, D.S. 1989. Prinsip-Prinsip Biokimia. Diterjemahkan oleh Soendono. Jakarta: Penerbit Airlangga. hlm 80
Pandolvini, T, R. Gabrieli & C. Comparining. 1992. “Nickel Toxicity and Peroxidase Activity in Seedlings of Triticum aestivum L.”. Plant, Cell and Environment
(15). hlm. 719-725
Peruanskii, Y. V, I. M. Savich & T. L. Tazhibaeva. 1991. Relative Content and Amino Acid CompositionI of The Iso Peroxidases in Leaves of Wheat and Maize Seedlings as Criterion of Resistance to Low Temperature Stress. Sel’skokhozyais tvennaya Biologiya. (Abstract)
Poedjiadi. A. 1994. Dasar-Dasar Biokimia. Jakarta: UI Press. hlm 81-82
Poerwodido. 1991. Genesa Tanah Batuan Pembentuk Tanah. Jakarta : Rajawali Press. hlm. 133-134
Pracaya, 2001. Bertanam Sayuran Organik di Kebun, Pot, dan Polibag. Jakarta: Penebar Swadaya. hlm. 68
Rao, M. V & P. S . Dubey. 1990. Biochemical Aspects (Antioxidants) for Development of Tolerance in Plants Growing at Different Low Levels of Ambient Air Pollutants. Environmental Pollution. (Abstract)
Rivero, R. M, J. M. Ruiz, P. C. Garcia, L. R. Lopez, E. Sanches & L. Romero. 2001. “Resistance to Cold and Heat Stress, Accumulation of Phenolic Compounds in Tomato and Watermelon Plants”. Plant Science (160) : hlm. 318-319
Ruiz, J. M, P. C. Garcia, R. M. Rivero & L. Romero. 1999. “Responce of Phenolic Metabolism to The Application to The Carbendazim Plus Boron in Tobacco Leaves”. Plant Physiol (106). hlm. 151-157
Santandrea, G, T. Pandolfini & A. Bennicci. 2000. “A Physiological Characterization of Mn-tolerant Tobacco Plants Selected by in Vitro Culture”. Plant Science
(150) : hlm. 164
Sarief, E. S. 1986. Ilmu Tanah Pertanian. Cetakan ke-2. Bandung : Pustaka Buana. hlm. 61
Sato, M & M. Hasegawa. 1976. “The Letency of Spinach Chloroplast Phenolase”.
Schmitz, G. E, M. L. Sulivan & R. D. Hatfield. 2008. “Three Polyphenol Oxidases from Red Clover (Trifolium pratense) Differ in Enzymatic Activities and Activation Properties”. Journal of Agricultural and Food Chemistry (56) : hlm. 272
Sedmak, J. J & S. E Grossberg. 1977. “A Rapid Sensitive and Verstile Assay for Protein Using Coomasive Brilliant Blue G-250”. Anal. Biochem. 79 : hlm. 544-552
Shannon, L. M. 1968. “Plant Isozym”. Physiology 19 : hlm.187-210
Soetomo, M. 2001. Teknik Bertanam Salak. Bandung : Sinar Baru Algensindo. hlm. 5 Sosrodarsono, S. & K. Takeda. 1978. Hidrologi Untuk Pengairan. Jakarta : Pradnya
Paramita. hlm. 71
Sucipto, A. 2008. Phenol dan Aktifitas Phenol. http;//naksara.net/index.php. physiology/&/phenol. 17 Oktober 2008
Sunarjono, H. H. 2000. Prospek Berkebun Buah. Jakarta: Penebar Swadaya. hlm. 22 Sutedjo, M. M & A. G Kartasaputra. 1988. Pengantar Ilmu Tanah. Jakarta : Bina
Aksara. hlm. 55-56, 61, 84-85
Tjahjadi, N. 1989. Bertanam Salak. Cetakan ke-3. Yogyakarta : Kanisius. hlm. 11 Tjitrosoepomo, G. 2004. Taksonomi Tumbuhan (Spermatophyta). Cetakan ke-8.
Yogyakarta : UGM Press. hlm. 458
Touti, D. 1988. “Molecular Genetic of SOD Free Radical”. Biol Med (5). hlm. 393-405
Vance, C. P, T. K. Kirk & R. T. Sherwood. 1980. “Lignification as a Mechanism of Disese Resistance”. Ann Rev Phytopathology (18). hlm. 259-288
Vela, J. C, S. S. Marchart, I. G. Lucas & B. Martinez. 2000. Evolution of Phenolics and Polyphenoloxidase Isoenzymes in Relation to Physical-Chemical Parameters during Loquat (Eriobotrya japonoca cv. Algerie Fruit) Development and Ripening. Spain : Alicante. Hlm. 161
Yagar, H. & A. Sagiroglu. 2000. Partially Purification and Characterization of Polyphenol Oxidase of Quince. Turkey : Department of Chemistry. Hlm. 97 Yunus, Y. 2004. Tanah Dan Pengolahan. Bandung : Alfabeta. hlm. 15-16
Lampiran A. Berbagai jenis tanaman salak di Indonesia menurut Soetomo (2001) :
No Nama Daerah asal Rasa Ukuran/warna kulit
1. Bali Ds. Sibetan, Bali Manis, kering,
tidak masir, daging
buah tebal
Kecil sampai sedang, coklat
muda, sisik kecil-kecil
2. Banjarnegara Ds.Blitar,
Banjarnegara
Manis, manis agak
sepet, masir berair
Besar, coklat
kekuning-kuningan sampai kehitaman
3. Condet Kel.Condet, Jakarta Bervariasi dari
manis sampai
manis agak sepet,
masir dan tak berair
Bervariasi dari kecil, sedang
sampai besar, coklat sampai
kehitaman
4. Doren Bangkalan, Madura Manis, masir,
berair banyak
Besar, kuning
5. Gading Kab. Sleman Manis sampai
manis agak sepet,
masir
Sedang, kuning gading,
mengkilap
6. Kebo Bangkalan, Madura Manis agak masam,
masir
Besar, coklat kehitaman
7. Kembang
Arum
Ds.Kembang
Arum, Sleman
Manis sampai
manis agak sepet,
masir
Kecil, sedang sampai besar,
coklat
8. Manalagi Bangkalan, Madura Manis, masir,
sedikit berair
Sedang sampai besar, agak
kehitaman
9. Manggis Bangkalan, Madura Manis, sedikit
masam, masir
berair sedang
Sedang sampai besar,
kehitaman
10. Manojaya Ds.Pasirbatang dan
Cilangkap,
Tasikmalaya
Bervariasi dari
manis sampai
manis agak sepet,
berair, tidak masir
Bervariasi dari kecil, sedang
sampai besar, coklat sampai
kehitaman
11. Nangka Ds.Bejalan,
Ambarawa
Manis agak sepet,
berair banyak
Sedang, coklat, sampai coklat
kehitaman
12. Nasek (nasi) Bangkalan, Madura Agak manis Sedang, coklat kekuningan
13. Padang
Sidempuan
Ds. Sibakua dan
Hutalambung,
Tapanuli Selatan
Manis dan ada
asamnya, berair
Bervariasi dari kecil, sedang
sampai besar, coklat sampai
kehitaman
14. Penjalinan Bangkalan, Madura Manis, renyah dan
masir
Kecil, coklat kekuningan
15. Petruk Ds.Bejalan,
Ambarawa
Manis sampai
manis agak sepet,
masir
Sedang, bentuk agak
memanjang, coklat sampai
coklat kehitaman
16. Pondoh Hitam Ds.Soka, Sleman Sangat manis, tidak
masir
Kecil, coklat kehitaman
17. Pondoh kuning Ds.Soka, Sleman Manis, tidak masir Kecil, coklat kekuningan
18. Pondoh merah Ds.Soka, Sleman Manis, tidak masir Kecil, coklat kemerahan
19. Pondoh
merah-kuning
Ds.Soka, Sleman Manis, tidak masir Kecil, sampai agak besar,
merah gelap kehitam-hitaman
20. Pondoh,
merah-hitam
Ds.Soka, Sleman Manis, masir Kecil, kuning,
kemerah-merahan
21. Super Ds.Blitar,
Banjarnegara
Manis, masir Besar, coklat muda
22. Suweru Ds.Suweru, Malang Manis sampai
manis agak sepet,
masir
Kecil, sedang sampai besar,
coklat sampai coklat
Lampiran B . Ekstraksi Organ Tanaman
Digerus 200 mg sampel dengan menggunakan alu dan lumpang
Ditambahkan nitrogen cair
Dihomogenisasi dengan 2 ml buffer 0,05 M (pH 8 suhu 0oC) dan 0,15% Triton-X 100
Disentrifugasi 14.000 rpm selama 20 menit suhu 0oC
Diambil supernatan yang terbentuk untuk analisis selanjutnya
Kecambah batang dan daun
Lampiran C. Alur Kerja Determinasi Protein
Diambil sebanyak 0,1 ml
Dimasukkan kedalam tabung reaksi
Dicampur dengan 5 ml larutan reagan pewarna Coomassie brilliant blue G-250
Dihomogenkan
Diukur absorbansinya pada panjang gelombang 595 nm
Crude Extract
Lampiran D. Alur Kerja Pembuatan Kurva Standar BSA
Dilarutkan dengan 100 ml akuades
Dimasukkan ke dalam masing-masing tabung reaksi 0(blanko), 0,2; 0,4; 0,6; 0,8 dan 1 ml (konsentrasi larutan0;0,2;0,4;0,6;0,8 dan 1 µg/ml
Ditambahkan larutan Coomassie Brilliant Blue G-250 hingga volume batas
Dihomogenkan
Dimasukkan ke dalam kuvet spektrofotometer Diukur absorbansi pada panjang gelombang 595 nm
Ditentukan persamaan garis regresi kurva standar larutan protein dengan metode Least Square.
0,01 g BSA
Larutan
Lampiran E. Alur Kerja Penentuan Aktivitas Enzim Peroksidase
Ditambahkan 10 mM pyrogallol
Dicampurkan dengan buffer posfat sebanyak 0,1 ml pada pH 6,8 dan suhu 25oC
Ditambahkan 10 mM H2O2
Didiamkan selama 5 menit
Ditambahkan 0,5 ml H2SO4 (v/v) untuk menghentikan
reaksi
Dimasukkan ke dalam kuvet spektrofotometer Diukur pada panjang gelombang 420 nm 30 µg protein dari batang dan daun salak (crude extract)
Larutan
Lampiran F. Alur Kerja Penentuan Aktivitas Enzim Polifenol Oksidase
Ditambahkan 10 mM pyrogallol
Dicampurkan dengan buffer posfat sebanyak 0,1 ml pada pH 6,8 dan suhu 25oC
Didiamkan selama 5 menit
Ditambahkan 0,5 ml H2SO4 (v/v) untuk menghentikan
reaksi
Dimasukkan ke dalam kuvet spektrofotometer Diukur pada panjang gelombang 420 nm 70 µg protein dari batang dan daun salak (crude extract)
Larutan
Lampiran G. Data Pengukuran Kurva Standar Bovine Serum Albumin (BSA)
X (Konsentrasi)
Y
(Absorbansi) XY X2 Y2
0 0 0 0 0
3 0,417 1,251 9 0,173
6 0,725 4,350 36 0,525
9 1,186 10,674 81 1,406
12 1,398 16,776 144 1,954
15 1,669 25,035 225 2,785
X = 45 X = 7,5
X = 5,395 y = 0,899
XY = 58,086 X2 = 2,20 Y2 = 6,846
XY –(X) (Y)/n r =
√ {X2-(X)2/n} {Y2-(Y)2/n}
058,086 – 40,4625
= √ (157,5) (1,9950) 9,6035
r2 =
17,726 = 0,9899
Dimana : a = intersep a = Y – b X
n (XY) – (X) (Y) b = slope (koefisien regresi) b =
n ({X2) – (Y)2 b = 6 (58,086) – (45) (5,395)
6 (495) – (16,846075)2 = 0,0356
a = 0,899 – 0,0356 (0,5) = 0,632
Sehingga diperoleh persamaan regresinya Y = a + bx
Lampiran H. Data Pengukuran Kurva Standar Pyrogallol
X (Konsentrasi)
Y
(Absorbansi) XY X2 Y2
0 0 0 0 0
1,5 1,036 1,554 2,25 1,0732
2 1,317 2,634 4 1,7344
2,5 1,664 4,16 6,25 2,7688
3 1,875 5,625 9 3,5156
3,5 1,983 6,9405 12,25 3,9322
X = 12,5 X = 2,5
X = 7,875 y = 1,575
XY = 20,9135 X2 = 33,75 Y2 = 13,0242
XY –(X) (Y)/n r =
√ {X2-(X)2/n} {Y2-(Y)2/n} 20,9135 – 16,40625
= √ (7,7) (2,6882) 4,5072
r2 =
4,5521 = 0,9901
n (XY) – (X) (Y) b =
n ({X2) – (Y)2
b = 6 (20,9135) – (12,5) (1,575) 6 (33,75) – (13,0242) = 0,55834
a = 1,575 – 0,55834 (2,5) = 0,17915
Sehingga diperoleh persamaan regresinya Y = a + bx
Lampiran I. Data Pengukuran Determinasi Protein
Dapat dihitung dengan menggunakan persamaan regresi, yaitu : Y = a + bx Dimana nilai a = 0,632
Nilai b = 0,0356
Sehingga diperoleh untuk masing-masing nilai X yaitu dengan rumus X = Y – a
[image:65.595.107.547.278.396.2]b
Tabel 4. Rataan Pengukuran Determinasi Protein
Perlakuan Absorbansi Nilai Determinasi Protein (g/g)
A 1,221 12,926
B 1,242 17,135
C 1,211 16,280
D 1,251 17,392
E 1,186 15,583
F 1,267 17,859
G 1,203 16,039
H 1,302 18,819
Ket :
A : Daun anakan Huta Lambung B : Batang anakan Huta Lambung C : Daun anakan Si