ABSTRAK
PENGARUH JARAK STRAW DENGAN NITROGEN CAIR PADA PROSES PRE FREEZING TERHADAP KUALITAS
SEMEN BEKU SAPI LIMOUSIN
Oleh KUROTUL AINI
Penelitian ini bertujuan untuk mengetahui pengaruh jarak straw dengan nitrogen cair pada proses pre freezing serta jarak straw yang terbaik terhadap kualitas semen beku Sapi Limousin sehingga layak untuk proses IB. Penelitian ini dilaksanakan di Unit Pelayanan Teknis Daerah Balai Insemninasi Buatan Daerah (UPTD-BIBD) Lampung, Kecamatan Terbanggi Besar, Kabupaten Lampung Tengah, Provinsi Lampung pada tanggal 07—13 April 2014. Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan 5 perlakuan jarak straw, yaitu 2 cm, 4 cm, 6 cm, 8 cm, dan 10 cm dengan 4 kali ulangan. Data yang diperoleh dianalisis menggunakan analisis ragam dan dilanjutkan dengan uji Polinomial Ortogonal.
Hasil penelitian menunjukkan bahwa jarak straw berpengaruh sangat nyata (P<0,01) terhadap motilitas dan spermatozoa hidup setelah thawing namun tidak berpengaruh nyata (P>0,05) terhadap motilitas dan spermatozoa hidup setelah pre freezing. Uji polinomial ortogonal diperoleh bahwa jarak straw berpengaruh sangat nyata (P<0,01) terhadap motilitas spermatozoa setelah thawing, berpola kuadratik dengan persamaan Y = - 6,50 + 12,09x – 0,89x2 ; R2 = 41,3%, dengan pengaruh yang terbaik pada jarak straw 6 cm yaitu 34%. Selain itu jarak straw juga berpengaruh sangat nyata (P<0,01) terhadap persentase spermatozoa hidup setelah thawing, berpola kuadratik dengan persamaan Y = 8,97 + 8,81x - 0,64x2 ; R2 = 41,3%, dengan pengaruh yang terbaik pada jarak straw 6 cm yaitu 38,79%.
PENGARUH JARAK STRAW DENGAN NITROGEN CAIR PADA PROSES PRE FREEZING TERHADAP KUALITAS
SEMEN BEKU SAPI LIMOUSIN
Oleh
KUROTUL AINI
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar Sarjana Peternakan
Pada
Jurusan Peternakan
Fakultas Pertanian, Universitas Lampung
JURUSAN PETERNAKAN FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
RIWAYAT HIDUP
Penulis dilahirkan di Madura pada 07 Februari 1992 sebagai
anak pertama dari dua bersaudara pasangan Bapak Sayadi dan Ibu Latifa. Penulis menyelesaikan pendidikan taman
kanak-kanak pada tahun 1998 di TK. Amarta Tani H.K.T.I Bandar Lampung; pendidikan sekolah dasar pada tahun 2004
di SD Negeri 1 Labuhan Dalam, Bandar Lampung; pendidikan sekolah menengah pertama pada tahun 2007 di SMP Negeri 20 Bandar Lampung; dan pendidikan sekolah menengah atas pada tahun 2010 di SMA Al-Azhar 3 Bandar Lampung.
Pada 2010, penulis terdaftar sebagai mahasiswa Jurusan Peternakan, Fakultas Pertanian, Universitas Lampung melalui Jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri.
Selama masa perkuliahan penulis telah melaksanakan Praktik Umum (PU) di
Farm Jati Indah, Kecamatan Tanjung Bintang, Kabupaten Lampung Selatan; dan
Kuliah Kerja Nyata (KKN) di Desa Goras Jaya, Kecamatan Lampung Tengah.
Dengan segala rasa syukur kupersembahkan skripsi ini
untuk kedua orang tuaku tercinta, Ayahanda Sayadi
dan Ibunda Latifa yang telah membesarkan dan
mendidikku dengan penuh kasih, keikhlasan hati, dan
kesabaran yang telah diberikan selama ini serta Adikku
tersayang Fadhur Rohman yang telah memberikan
motivasi, kasih sayang, dan doa, semoga Allah SWT
senantiasa menganugerahkan rahmat dan hidayah-Nya
kepada kalian.
Salah satu mantra yang menjawab untuk meningkatkan
semangat diri adalah dengan berkata “ saya mampu, saya bisa, dan saya dapat”.
Apapun masalah kita, jika kita membaikkan hati, Tuhan
akan membaikkan hidup kita.
(Mario Teguh)
Apapun yang terjadi dalam dirimu yakinlah bahwa
semuanya adalah kehendak dan rencana Allah untuk
Tidak ada seorangpun dapat kembali kemasa lalu untu membuat suatu awal
yang baru. Namun, setiap orang dapat memulai saat ini untuk membuat
suatu akhir yang baru.
Saat ujian terus menempa
Saat seolah tidak ada yang mendukung
Saat seolah tidak ada yang membantu
Itu mungkin teguran dari Allah
Agar kita sadar, bahwa hanya Allah tempat bergantung
Agar kita ingat, hanya kepada Allah kita mohon pertolongan
Mohonlah pertolongan dengan sabar dan sholat.
Jika anda menemukan jalan buntu,
Maka carilah jalan yang lain.
Percayalah, jalan itu ada.
Jika ada satu batasan menghalangi anda,
Jangan terhenti karena satu penghalang
Sebab pintu menuju solusi dan tujuan itu masih banyak.
KATA PENGANTAR
Alhamdullilah, segala puji bagi Allah SWT, karena berkat rahmat, hidayah, dan
kehendak-Nya lah sehingga penulis dapat menyelesaikan skripsi ini, dalam kesempatan ini penulis mengucapkan terimakasih kepada :
1. Ibu Sri Suharyati, S.Pt, M.P.— selaku Pembimbing Utama — atas bimbingan, kesabaran, saran dan arahan dalam menyelesaikan skripsi;
2. Bapak drh. Madi Hartono, M.P.— selaku Pembimbing Anggota — atas bimbingan, saran dan arahan dalam menyelesaikan skripsi;
3. Bapak Siswanto, S.Pt., M.Si.— selaku Penguji Utama — atas bimbingan,
saran dan arahan dalam menyelesaikan skripsi;
4. Ibu Dr.Ir. Farida Fathul, M.Sc.— selaku Pembimbing Akademik — atas bimbingan, saran dan arahan selama masa perkuliahan;
5. Bapak Prof. Dr. Ir. Muhtarudin, M.S.— selaku Ketua Jurusan Peternakan, Fakultas Pertanian, Universitas Lampung;
6. Bapak Prof. Dr. Ir. Wan Abbas Zakaria, M.S.— selaku Dekan Fakultas Pertanian, Universitas Lampung;
7. Ibu dan Bapak Dosen di Jurusan Peternakan atas ilmu dan dukungannya;
9. Mas drh. Akbar , Mba Murtiawan, S.Pt., Bapak Ir. Joko, dan Mas Vivid
Bambang SN, S.Pt —atas bimbingan, saran dan arahan selama pelaksanaan penelitian;
10. Mama, Papa, Adik —atas doa, nasehat, perhatian, kesabaran, kasih sayang, materil serta dukungan yang tak henti-hentinya;
11. Rizki Indah Pratiwi, Faradina Kusuma Savitri, Ajrul Mukminat —atas
kesabaran, pengertian, perhatian, dukungan, kerjasama, bantuan, pelajaran, kasih sayang, dan persaudaraan, semoga tetap bertahan;
12. Saudara peternakan angkatan 2010 (Sherly, Nani, Tiwi, Anung, Nurma, Sekar, Irma, Dian, Repi, Dewa, Afrizal, Etha, Gaby, Nova, Fauzan, Imam,
Rahmat, Repki, dkk) —atas persaudaraan, bantuan, semangat, dukungan dan kebersamaan yang selalu diberikan, semoga tetap bertahan;
Semoga segala kebaikan yang telah diberikan kepada penulis menjadi amal baik
dan mendapat balasan yang berlipat dari Allah SWT. Semoga bermanfaat.
Bandar Lampung, Agustus 2014
Penulis,
DAFTAR ISI
Halaman
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vii
1. PENDAHULUAN ... 1
A. Latar Belakang dan Masalah ... 1
B. Tujuan Penelitian ... 4
C. Kegunaan Penelitian ... 4
D. Kerangka Pemikiran ... 5
E. Hipotesis ... 9
II. TINJAUAN PUSTAKA ... 10
A. Sapi Limousin ... 10
B. Semen ... 10
C. Semen Beku ... 13
D. Pembekuan Semen ... 16
E. Motilitas Spermatozoa ... 20
F. Spermatozoa Hidup ... 22
III. METODE PENELITIAN ... 25
A. Waktu dan Tempat Penelitian ... 25
B. Alat Penelitian ... 25
D. Rancangan Penelitian ... 26
E. Pelaksanaan Penelitian ... 26
F. Peubah yang Diamati ... 30
IV. HASIL DAN PEMBAHASAN ... 31
A. Penilaian Kualitas Semen Segar ... 31
B. Penilaian Kualitas Semen setelah Ekuilibrasi ... 33
C. Pengaruh Jarak Straw terhadap Persentase Motilitas Spermatozoa setelah Pre freezing ... 34
D. Pengaruh Jarak Straw terhadap Persentase Motilitas Spermatozoa setelah Thawing ... 36
E. Pengaruh Jarak Straw terhadap Persentase Spermatozoa Hidup setelah Pre freezing ... 41
F. Pengaruh Jarak Straw terhadap Persentase Spermatozoa Hidup setelah Thawing ... 42
V. SIMPULAN DAN SARAN ... 46
A. Simpulan ... 46
B. Saran ... 46
DAFTAR PUSTAKA ... 47
DAFTAR TABEL
Tabel Halaman 1. Pengaruh ketinggian straw di atas permukaan N2 cair terhadap
kualitas semen beku ... 16
2. Hasil evaluasi kualitas semen segar ... 31
3. Kualitas semen setelah ekuilibrasi ... 33
4. Rataan persentase motilitas spermatozoa setelah pre freezing ... 35
5. Rataan persentase motilitas spermatozoa setelah thawing ... 37
6. Rataan persentase spermatozoa hidup setelah pre freezing ... 41
7. Rataan persentase spermatozoa hidup setelah thawing ... 42
8. Analisis ragam persentase motilitas spermatozoa setelah pre freezing ... …….. 53
9. Analisis ragam persentase motilitas spermatozoa setelah thawing ... 53
10. Analisis ragam persentase spermatozoa hidup setelah pre freezing ... 53
11. Analisis ragam persentase spermatozoa hidup setelah thawing ... 53
12. Perhitungan nilai Q (perkalian antara kontras dengan jumlah nilai parameter yang diukur) motilitas spermatozoa setelah thawing ... 54
13. Analisis ragam motilitas spermatozoa setelah thawing pada uji Polinomial Ortogonal ... 54
14. Perhitungan nilai a dan b persamaan regresi motilitas spermatozoa setelah thawing ... 55
16. Perhitungan nilai Q (perkalian antara kontras dengan jumlah nilai
parameter yang diukur) spermatozoa hidup setelah thawing ... 56
17. Analisis ragam spermatozoa hidup setelah thawing pada uji Polinomial Ortogonal ... 56
18. Perhitungan nilai a dan b persamaan regresi spermatozoa
hidup setelah thawing ... …….. 57
DAFTAR GAMBAR
Gambar Halaman
1. Bagan pelaksanaan penelitian ... 27
2. Hubungan antara perlakuan dengan persentase motilitas spermatozoa
setelah thawing ... 38
3. Hubungan antara perlakuan dengan persentase spermatozoa hidup
1
I. PENDAHULUAN
A. Latar Belakang dan Masalah
Sapi Limousin adalah sapi yang pertama kali dikembangkan di Perancis. Sapi ini memiliki perototan yang lebih baik, bulu berwarna coklat tua kecuali di sekitar
ambing berwarna putih serta lutut ke bawah dan sekitar mata berwarna lebih muda. Bentuk tubuh jenis sapi ini yaitu besar, panjang, padat, dan kompak.
Keunggulan Sapi Limousin yaitu pertumbuhan badannya sangat cepat, kualitasnya lebih bagus, dan lezat untuk dijadikan makanan sehingga nilai jualnya jauh lebih mahal, dan keuntungan yang didapat oleh peternak atau pedagang akan lebih
banyak (Thomas, 1991).
Penerapan teknologi Inseminasi Buatan merupakan alternatif yang paling tepat untuk meningkatkan populasi ternak secara progresif. Untuk menunjang
peningkatan efisiensi reproduksi peternakan dapat dilakukan melalui teknik IB dengan menggunakan semen beku (Toelihere, 1993). IB terbukti memiliki
keunggulan dibandingkan dengan kawin alami, beberapa diantaranya adalah penggunaan pejantan unggul sehingga mempercepat perbaikan genetik,
penghematan biaya, dan pencegahan penularan penyakit.
2
dibekukan dan disimpan pada kontainer N2 cair suhu -1960C. Tahapan proses
pembekuan yaitu pre freezing dan freezing. Proses pre freezing (pembekuan awal) yaitu straw yang berisi semen disusun pada rak straw dan ditempatkan
dalam uap N2 cair sekitar 4,5 cm di atas permukaan nitrogen cair, proses ini
berlangsung sekitar 9 menit, kemudian dimasukkan langsung ke dalam nitrogen cair. Dengan teknik pembekuan yang semakin baik diharapkan kualitas semen
beku setelah thawing akan baik pula. Freezing merupakan proses penghentian sementara kegiatan hidup sel tanpa mematikan fungsi sel dan proses hidup dapat
berlanjut setelah pembekuan dihentikan (Toelihere, 1985).
Pada proses pembekuan semen akan mengakibatkan terjadinya cold shock dan perubahan intraseluler yang berkaitan dengan pembentukan kristal-kristal es. Jika
suatu larutan dibekukan maka air sebagai pelarut membeku menjadi kristal-kristal es, sedangkan bahan terlarut berakumulasi dalam larutan yang masih ada. Pada saat terbentuk kristal-kristal es tersebut, terjadi penumpukan elektrolit dan bahan
terlarut lainnya baik di dalam larutan maupun di dalam sel-sel. Konsentrasi elektrolit yang berlebihan akan melarutkan selubung lipoprotein dinding sel spermatozoa sehingga pada waktu thawing, permeabilitas membran sel akan
berubah dan menyebabkan kematian sel. Masalah pembekuan ini sebagian dapat diatasi dengan menggunakan zat-zat pelindung di dalam media pengencer dan
penurunan suhu secara gradual.
Pada umumnya problema fertilitas dengan semen beku pada pusat IB terletak pada
3
dalam kontainer, dan distribusi semen beku. Selama penyimpanan semen beku
akan mengalami penurunan kualitas apabila tidak dilakukan penanganan dengan baik.
Salamon (1971) menunjukkan ketika semen (0,03 ml) yang diuapkan di atas permukaan nitrogen cair (pre freezing) selama 9 menit sebelum dimasukkan ke
dalam nitrogen cair akan mempertahankan persentase gerakan individu spermatozoa setelah diperiksa post thawing motility.
Pre freezing adalah proses setelah semen diisikan ke dalam straw yang dilakukan
dengan cara diletakan pada canister dan digantungkan dalam uap nitrogen cair
selama beberapa menit. Tujuan pre freezing adalah menghindari terjadinya cold shock. Proses pre freezing akan memengaruhi gerakan individu atau daya gerak
spermatozoa, persentase hidup, dan abnormalitas sperma. Lama waktu
pre freezing menurut beberapa sumber adalah beragam. Straw yang telah diisi
semen diletakkan pada permukaan nitrogen cair 4 cm dengan suhu berkisar
-110⁰C sampai -120⁰C selama 9 menit (Standar Operasional Pelayanan BIB
Ungaran, 2011).
Peraturan Direktur Jenderal Peternakan Nomor :1220/HK.060/F/12/2007 Tentang
Petunjuk Teknis Produksi dan Distribusi Semen Beku menunjukkan proses pre freezing dilakukan dalam storage kontainer, straw disusun dirak dan
dilakukan 2—4 cm di atas permukaan N2 cair selama 5—9 menit sedangkan di
Balai Inseminasi Buatan Daerah (BIBD) Lampung melakukan proses pre freezing dengan jarak straw di atas permukaan nitrogen cair yang diterapkan yaitu 4 cm
4
proses pre freezing straw yang berisi semen diatur pada rak straw dan
ditempatkan dalam uap N2 cair sekitar 4,5 cm di atas permukaan nitrogen cair
selama 10 menit, kemudian dimasukkan langsung ke dalam nitrogen cair.
Kaiin et al., (2004) menyatakan bahwa ketinggian straw dari permukaan nitrogen
cair sebesar 10 cm dengan volume nitrogen cair delapan liter menghasilkan motilitas spermatozoa sebesar 43%, spermatozoa hidup sebesar 39%, dan
abnormalitas spermatozoa 12%. Belum ada informasi lebih lanjut mengenai jarak sraw dengan N2 cair yang terbaik terhadap kualitas semen beku setelah
pembekuan sehingga perlu dilakukan penelitian jarak straw yang terbaik dengan
nitrogen cair pada proses pre freezing terhadap kualitas semen beku.
B. Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. mengetahui pengaruh jarak straw (2 cm, 4 cm, 6 cm, 8 cm, dan 10 cm) dengan nitrogen cair pada proses pre freezing terhadap kualitas semen beku
Sapi Limousin;
2. mengetahui jarak straw yang terbaik dengan nitrogen cair pada proses
pre freezing terhadap kualitas semen beku Sapi Limousin.
C. Kegunaan Penelitian
5
straw yang terbaik dengan nitrogen cair terhadap kualitas semen beku sehingga
layak untuk proses IB.
D. Kerangka Pemikiran
Sapi Limousin merupakan jenis sapi potong keturunan Bos taurus yang berhasil dijinakkan dan dikembangbiakkan di Perancis. Sapi ini dapat beradaptasi pada
kondisi yang kritis (musim dingin), mempunyai karakter keindukkan, daya hidup tinggi, dan mudah dipelihara seperti sapi potong pada umumnya. Sapi Limousin termasuk sapi berbadan besar, tingginya 1,5 meter, dan mempunyai bulu yang
sangat tebal dan kompak menutupi seluruh tubuhnya. Keunggulan lainnya dapat digunakan sebagai sapi pekerja karena kekuatan dan kecepatannya dalam
pengolahan tanah. Harga Sapi Limousin lebih mahal tetapi dari hari ke hari permintaan hasil ternak Sapi Limousin semakin meningkat (Sudarmono, 2006).
Upaya peningkatan populasi Sapi Limousin diperlukan teknologi yang tepat dan
efisien yaitu menggunakan teknik IB. IB adalah pemasukan semen ke dalam saluran kelamin hewan betina dengan menggunakan alat-alat buatan manusia. IB merupakan bioteknologi dalam pengembangbiakkan ternak dan merupakan cara
yang paling baik dan cepat untuk menyebarluaskan bibit unggul (Toelihere, 1993).
Semen yang digunakan dalam IB yaitu semen beku yang banyak memberikan
manfaat bagi peternak karena tersedia semen yang dikehendaki setiap waktu dan peternak dapat memilih semen dari pejantan yang diinginkan. Kelebihan ini yang
6
(Partodiharjo, 1992). Semen beku adalah semen yang telah diencerkan sesuai
dosis dengan pengencer yang mengandung krioprotektan (gliserol), dibekukan dan disimpan pada kontainer N2 cair suhu -1960C.
Penggunaan semen beku untuk pelaksanaan IB dilakukan secara intensif dengan
tujuan meningkatkan produksi ternak tetapi hasil kebuntingan yang diperoleh di lapangan sangat bervariasi dan relatif masih rendah. Hal-hal yang dapat
menyebabkan rendahnya kualitas semen beku diantaranya suhu lingkungan, thawing, jarak straw dari permukaan nitrogen cair, cara penyimpanan semen beku,
dan penambahan nitrogen cair (Toelihere, 1993).
Pada proses pembekuan, jarak straw akan memengaruhi kualitas semen beku
namun belum ada informasi lanjut mengenai jarak straw yang terbaik dengan nitrogen cair setelah pembekuan. Proses pembekuan pada temperatur -1960C akan menurunkan kualitas spermatozoa 30% spermatozoa akan mati selama
proses pendinginan dan pembekuan (Goldman et al., 1991). Menurut
Hammerstedt (1993), selama proses pendinginan dan pembekuan spermatozoa
yang masih mampu bertahan hidup sangat sensitif. Tujuan dari proses
pendinginan dan pembekuan adalah untuk menghambat aktifitas spermatozoa
sehingga menghemat penggunaan energi metabolik yang akhirnya dapat memperpanjang daya hidup spermatozoa.
Pre freezing merupakan salah satu tahapan proses pembekuan. Proses dalam
pre freezing dilakukan dengan cara meletakkan straw pada uap nitrogen (N2) cair,
7
selama 9 menit. Suhu tersebut diperoleh bila straw yang disusun di atas rak yang
ditempatkan kurang lebih 4 cm di atas permukaan N2 cair. Hal ini bertujuan
sebagai proses adaptasi semen untuk tahap selanjutnya, supaya tidak
terjadi temperatur shock, yang dapat menyebabkan abnormalitas atau kematian spermatozoa di dalam semen. Setelah pembekuan, semen beku disimpan di dalam storage kontainer yang berisi N2 cair -1960 C (Nilna, 2010).
Maxwell dan Watson (1996) menunjukkan pada saat pembekuan terjadi kerusakan membran plasma spermatozoa akibat terbentuknya peroksidasi lipid. Keadaan ini terjadi karena membran spermatozoa banyak mengandung asam laktat tak jenuh
yang sangat rentan terhadap kerusakan peroksidasi. Menurut Parrish (2003), semen akan mengalami penurunan kualitas sekitar 10—40% pada saat
pembekuan.
Menurut Said et al (2004), ketinggian straw dari permukaan nitrogen cair sebesar 10 cm dengan volume nitrogen cair delapan liter menghasilkan motilitas sperma
sebesar 43% sehingga layak digunakan dalam proses IB karena masih diatas nilai minimal 40% yang ditentukan oleh Badan Standarisasi Nasional tahun 1998.
Purwasih et al., (2013), menunjukkan ketinggian straw yang berisi semen
diletakkan pada jarak ±4 cm di atas nitrogen cair (pre freezing) pada suhu -1100C menghasilkan gerakan individu spermatozoa 2,27 %, spermatozoa hidup 41,72 %
artinya semen beku yang layak untuk diinseminasikan yaitu memiliki persentase hidup ≥40% (Standar Operasional Pelayanan BIB Sidomulyo Ungaran, 2011).
8
Menurut Imran (2012), jarak ketinggian straw dengan permukaan nitrogen cair
sangat berpengaruh terhadap motilitas spermatozoa semen beku. Jarak ketinggian yang memberikan hasil motilitas spermatozoa yang baik pada jarak ketinggian
straw dengan permukaan nitrogen cair 2 cm, sedangkan untuk lama waktu dan
intensitas keduanya (jarak ketinggian straw dengan permukaan nitrogen cair dan lama waktu) pada tahap pre freezing tidak berpengaruh terdapat motilitas
spermatozoa semen beku.
Pada proses pembekuan semen akan mengakibatkan terjadinya cold shock dan perubahan intraseluler akibat pengeluaran air maka terjadi pembentukan
kristal-kristal es yang berpengaruh terhadap kualitas spermatozoa. Masalah ini secara langsung akan menyebabkan penurunan kualitas semen beku yang
dihasilkan. Jarak straw mempunyai pengaruh besar terhadap keadaan
spermatozoa khususnya keutuhan spermatozoa dalam semen. Jarak antara straw
dengan nitrogen cair yang berbeda mengakibatkan temperatur sekitar straw
berbeda yaitu temperatur yang rendah dapat menyebabkan spermatozoa yang berada dalam straw akan mengalami cold shock dan temperatur yang tinggi dapat mematikan spermatozoa yang berada dalam straw (Kaiin et al., 2004).
Jarak straw dengan nitrogen cair pada proses pre freezing akan memengaruhi kualitas semen beku Sapi Limousin sehingga apabila telah diketahui jarak straw
9
E. Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah sebagai berikut:
1. terdapat pengaruh jarak straw dengan nitrogen cair pada proses pre freezing terhadap kualitas semen beku Sapi Limousin;
10
II. TINJAUAN PUSTAKA
A. Sapi Limousin
Sapi Limousin merupakan keturunan sapi Eropa yang berkembang di Perancis. Karakteristik Sapi Limousin adalah pertambahan badan yang cepat perharinya
sekitar 1,1 kg, tinggi mencapai 1,5 m, bulu tebal yang menutupi seluruh tubuh warnanya mulai dari kuning sampai merah keemasan, tanduknya berwarna cerah,
bobot lahir tergolong kecil sampai medium (sapi betina dewasa mencapai 575 kg dan pejantan dewasa mencapai berat 1100 kg), fertilitasnya cukup tinggi, mudah melahirkan, mampu menyusui, dan mengasuh anak dengan baik serta
pertumbuhannya capat (Blakely dan Bade, 1994).
Sapi Limousin dapat berproduksi secara optimal pada daerah yang beriklim temperatur dengan suhu antara 4—150C dengan mendapat hijauan serta
konsentrat yang bernilai tinggi (Meyn, 1991). Menurut Thomas (1991), Sapi Limousin memiliki berat lahir rata-rata 39,95 kg dengan berat sapih pada umur 205 hari yaitu 198 kg.
B. Semen
11
terjadi kopulasi, tetapi dengan kemajuan teknologi dapat pula ditampung dengan
berbagai cara untuk keperluan Inseminasi Buatan. Semen mengandung dua unsur utama, yaitu plasma semen dan spermatozoa. Plasma semen merupakan cairan
yang sebagian besar disekresikan oleh kelenjar vesikularis dan jumlah kecil disekresikan oleh testis. Plasma semen mempunyai pH sekitar 7,0 dan tekanan osmotik sama dengan darah, yaitu ekuivalen dengan 0,9 % natrium chlorida
(Toelihere, 1993).
Komponen yang terpenting dari semen tentu saja spermatozoa. Semen tanpa spermatozoa adalah plasma semen yang tidak memiliki sifat-sifat sangat penting
dalam proses reproduksi hewan jantan, dengan fungsi utama membuahi ovum. Semen segar yang diejakulasikan oleh sapi jantan dikatakan normal, bila semen
tersebut mengandung spermatozoa yang memperlihatkan daya gerak dan aktif, memiliki gerakan masa yang bergelombang. Banyaknya spermatozoa yang terdapat di dalam sejumlah semen tertentu, akan memengaruhi sifat
penampakannya. Semen yang encer dan jernih mengandung spermatozoa yang sedikit jumlahnya sedangkan semen yang keruh dan kental dalam keadaan yang normal memiliki konsentrasi spermatozoa tinggi (Salisbury dan Van Denmark,
1985).
Semen dari suatu spesies hewan mempunyai perbedaan dalam sifat-sifatnya dengan spesies lain. Perbedaan itu terletak pada volume, kekentalan, pH,
konsentrasi, warna, dan baunya. Pada sapi dan domba memiliki volume semen sedikit karena kelenjar asesoris mengeluarkan cairan dalam jumlah yang rendah
12
Semen sapi normal berwarna seperti susu atau krem keputih-putihan dan keruh.
Derajat kekeruhannya tergantung pada konsentrasi spermatozoa. Sapi pejantan menghasilkan semen yang normal berwarna kekuning-kuningan. Warna ini
disebabkan oleh pigmen riboflavin yang dibawakan oleh satu gene autosomal resesif dan tidak mempunyai pengaruh terhadap fertilitas. Semen yang berwarna
merah gelap sampai merah muda menandakan adanya darah segar dalam jumlah
berbeda dan berasal dari saluran kelamin urethra atau penis. Warna kecoklat-coklatan menunjukkan adanya darah yang telah mengalami dekomposisi. Suatu
warna coklat muda atau warna kehijau-hijauan menunjukkan kemungkinan kontaminasi dengan faeces (Toelihere, 1985).
Menurut Partodihardjo (1992), volume semen bervariasi antara 1—12 ml tiap
ejakulasi untuk sapi yang masih muda dan untuk sapi yang telah dewasa dapat menghasilkan semen tiap ejakulat 10—15 ml. Teknologi Inseminasi Buatan dilakukan dengan tujuan memperoleh efisiensi dan efektifitas dalam penggunaan
pejantan terpilih, menghindari terjadinya penyakit melalui sarana reproduksi dan untuk mengatasi bila terjadi kendala dalam proses perkawinan alami antara jantan dan betina. Menurut Susilawati et al., (2003), semen yang berkualitas dari seekor
penjantan unggul dapat dipengaruhi oleh beberapa faktor, antara lain berat badan, umur pejantan, sifat genetik, suhu dan musim, frekuensi ejakulasi dan makanan.
Toelihere (1985) menunjukkan bahwa penyimpanan dalam bentuk straw dapat menghemat tempat, ringan, dan praktis dibawa kemana-mana serta dapat dibuat
13
C. Semen Beku
Spermatozoa dalam semen beku dapat hidup bertahun-tahun. Spermatozoa yang
dibekukan dan disimpan pada suhu -790C di dalam CO2 padat dan alkohol tahan
hidup 3—4 tahun/lebih, sedangkan pada -1960C di dalam nitrogen cair tahan hidup dalam waktu sampai 10 tahun (Toelihere, 1993).
Semen beku adalah semen yang telah diencerkan kemudian dibekukan di bawah
suhu 00C atau titik beku air. Pembekuan semen merupakan usaha untuk menjamin daya tahan spermatozoa dalam waktu yang lama, melalui proses
pengolahan, pengawetan, dan penyimpanan semen sehingga dapat digunakan pada suatu waktu sesuai kebutuhan (Graha, 2005). Semen beku sapi merupakan semen yang berasal dari pejantan sapi terpilih yang diencerkan sesuai prosedur proses
produksi sehingga menjadi semen beku dan disimpan dalam rendaman nitrogen cair pada suhu -1960C pada kontainer (SNI 01.4869. 1-2005).
Semen beku yang telah dievaluasi dan mempunyai Post Thawing Motility (PTM)
lebih dari 40% dapat disimpan untuk keperluan Inseminasi Buatan. Penyimpanan
dapat dilakukan menggunakan kontainer nitrogen cair yang bersuhu -196 oC.
Kapasitas kontainer yang digunakan disesuaikan dengan jumlah straw yang akan disimpan. Selain kontainer untuk penyimpanan semen beku, perlu disediakan
kontainer untuk persediaan nitrogen cair. Persediaan nitrogen cair diperlukan untuk menambah persediaan nitrogen cair di dalam kontainer yang berisi straw. Kualitas semen beku akan tetap terjaga jika tetap terendam dalam N2 cair.
Penyimpanan semen beku berbentuk ampul dalam rak ditempatkan pada beberapa
14
Bentuk-bentuk straw dan pellet ditempatkan dahulu didalam tabung-tabung
plastik pendek (goblet) sebelum diletakkan didalam canister dan disimpan di dalam canister (Toelihere, 1993). Setiap pengiriman semen beku dalam kontainer
harus diberi label, disegel dan disertai kartu petunjuk isi kontainer. Kartu petunjuk isi kontainer tersebut minimal harus berisi keterangan bangsa/breed, kode pejantan, jumlah, tanggal, dan hasil pemeriksaan mutu semen serta nama
produsen (SNI 01. 4869. 1-2005).
Menurut Partodiharjo (1992), semen beku adalah semen yang telah diencerkan
menurut prosedur dengan tujuan untuk menyediakan makanan bagi spermatozoa dan meningkatkan volume dengan menurunkan konsentrasi semen sehingga didapat 25 juta sel spermatozoa dalam satu straw yang sebelumnya telah
dilakukan pemeriksaan saat semen segar, kemudian dibekukan jauh dari titik 00C tergantung pada zat yang dipakai untuk membekukan semen tersebut. Pembekuan
bisa menggunakan es kering, cairan udara, O2 cair, dan N2 cair. N2cair yang
popular digunakan sebab dapat membekukan pada suhu yang paling rendah dan dapat menyimpan semen dalam waktu yang lama. Kombinasi es kering dan
kristal CO2 dapat mencapai titik -700C, cairan N2 suhunya -1960C, sedangkan CO2
cair dan udara cair suhunya -1900C.
Toelihere (1993), keuntungan menggunakan semen beku diantaranya: 1. semen pejantan-pejantan unggul, baik yang masih sehat maupun yang
terluka, cacat, pincang, dapat dipakai secara efisien sepanjang tahun;
2. mengatasi hambatan waktu dan jarak;
3. memungkinkan perkawinan selektif dengan pejantan-pejantan unggul untuk
15
4. biaya pengangkutan semen dari pusat Inseminasi Buatan ke pelaksanaan
inseminasi di daerah atau di lapangan dan di pelosok-pelosok sangat
dikurangi karena penyediaan semen dan nitrogen cair hanya dilakukan sekali
sebulan, tidak dua kali seminggu seperti dengan semen cair. Semen beku dapat dikirimkan dengan mobil, kereta api, atau barang kiriman pos melalui kapal udara atau kapal laut;
5. pembekuan semen memungkinkan pengawetan semen pejantan-pejantan muda sebelum mencapai umur yang lebih tua dimana semennya menjadi
relatif infertil.
Hafez (1993), model pengemasan semen beku yang biasa digunakan yaitu: 1. straw yang dibuat dari polivinil klorida terdapat dua ukuran yang ministraw
berisi 0,25 ml dan midistraw 0,5 semen; 2. ampul gelas berisi 0,5—1 ml semen; 3. pellet berisi 0,1—0,2 ml semen.
Umur dan daya guna semen yang dibekukan akan bertambah lama karena
pembekuan adalah menghentikan sementara kegiatan hidup dari sel (metabolisme sel) tanpa mematikan fungsi sel dimana proses hidup dapat terus berlanjut setelah
16
D. Pembekuan Semen
Peraturan Direktur Jenderal Peternakan Nomor :1220/HK.060/F/12/2007 Tentang Petunjuk Teknis Produksi dan Distribusi Semen Beku bahwa proses pembekuan
semen dilakukan melalui 2 (dua) tahap yaitu : 1. Pra pembekuan (pre freezing)
Proses pre freezing dilakukan dalam storage kontainer, straw disusun dirak
dan dilakukan 2—4 cm diatas permukaan N2 cair selama 5—9 menit.
2. Pembekuan (freezing)
Pembekuan dilakukan setelah pre freezing, straw diletakkan dalam goblet dan canister, direndam dalam N2 cair suhu -1960C.
Keuntungan dengan dilakukannya pembekuan semen yaitu:
1. efisiensi penggunaan semen pajantan-pejantan unggul baik yang masih sehat maupun cacat sepanjang tahun;
2. mengatasi hambatan jarak dan waktu;
3. memungkinkan perkawinan pejantan-pejantan unggul untuk daerah luas; 4. biaya transportasi relatif murah.
Tabel 1. Pengaruh ketinggian straw di atas permukaan N2 cair terhadap kualitas
semen beku.
Ketinggian straw Motilitas (%) Hidup (%) Abnormal (%)
4 cm 23 36 4
6 cm 29 46 10
8 cm 37 40 9
10 cm 43 39 12
17
Permasalahan yang sering terjadi saat proses pembekuan semen yaitu pengaruh
cold shock terhadap sel yang dibekukan dan perubahan-perubahan intraseluler
akibat pengeluaran air dengan terbentuknya kristal-kristal es. Kristal-kristal es
intraseluler dapat merusak spermatozoa secara mekanik. Konsentrasi elektrolit yang berlebihan akan melarutkan selubung lipoprotein dinding sel sperma waktu pencairan kembali (thawing), permeabilitas membran sel akan berubah dan
menyebabkan kematian sel. Spermatozoa banyak mengalami kerusakan pada suhu antara -1,50C dan -3,00C rata- rata pada suhu -1,70C. Kerusakan 20% dari
seluruh sperma pada waktu pembekuan masih dianggap memuaskan (Toelihere, 1993).
Proses pembuatan semen beku terdiri dari: (1) proses pengenceran, yaitu
perhitungan volume pengencer dan proses pengenceran dengan pengencer organik (skim milk) ataupun anorganik (tris); (2) pemeriksaan before freezing, setelah
proses pengenceran selesai maka dilakukan pemeriksaan secara mikroskopik terhadap motilitas sel spermatozoa yang bergerak aktif maju ke depan (progresif) dengan nilai minimal 70%; (3) proses filling dan sealing, dilakukan di dalam cool
top yang bersuhu 3 – 50C; (4) pre freezing, straw yang telah dikemas disusun diatas rak, kemudian diletakkan di atas nitrogen cair dalam kontainer, prosessing
sampai suhunya mencapai -1400C, yang membutuhkan waktu sebanyak 9 menit; (5) freezing (pembekuan), straw dimasukkan ke dalam gablet dan setelah itu
direndam dalam nitrogen cair -1960C dalam kontainer.
Proses pembekuan semen meliputi:
1. Cooling (pendinginan) merupakan proses pendinginan semen setelah proses
18
beaker glass berisi air. Cooling sampai 50C dapat dilakukan dengan
memasukkan tabung-tabung yang berisi semen yang telah diencerkan dalam bak yang berisi air (Toelihere, 1985).
2. Pre freezing (pembekuan awal) yaitu straw yang berisi semen diatur pada rak straw dan ditempatkan dalam uap N2 cair sekitar 4,5 cm diatas permukaan
nitrogen cair. Pembekuan ini berlangsung sekitar 10 menit, kemudian
dimasukkan langsung ke dalam nitrogen cair (Toelihere, 1985). 3. Freezing (pembekuan)
Freezing merupakan proses penghentian sementara kegiatan hidup sel tanpa mematikan fungsi sel dan proses hidup dapat berlanjut setelah pembekuan
dihentikan sedangkan semen beku adalah semen yang telah diencerkan
menurut prosedur lalu dibekukan di bawah suhu 00C atau titik beku air (Partodiharjo, 1992).
Pembekuan atau pencairan semen beku dapat menyebabkan kerusakan
spermatozoa dan menghilangkan fertilitas spermatozoa. Untuk membuahi sel
telur, spermatozoa harus mempertahankan kemampuannya untuk memasuki oosit
dan flagellum dengan mendorong permukaan membran dan menghindari
pencakupan oleh fagosit pada saluran reproduksi atau pengikatan ireversibel pada sel epitel (Blakely dan Bade, 1994).
Menurut Partodiharjo (1992), Freezing merupakan proses penghentian sementara
kegiatan hidup sel tanpa mematikan fungsi sel dan proses hidup dapat berlanjut setelah pembekuan dihentikan. Sedangkan semen beku adalah semen yang telah
19
Menurut Toelihere (1993), pembekuan dapat menggunakan CO2 padat, udara
basah, O2 cair dan nitrogen cair. Pembekuan dengan N2 cair lebih sering
digunakan karena suhunya yang sangat rendah dapat menyimpan semen dalam
jangka waktu yang lama. Pada proses ini straw direndam dengan suhu -1960C. Volume N2 cair harus dikontrol secara periodik, karena jika kehabisan akan
menaikkan suhu sehingga akan mematikan spermatozoa. Untuk menjamin
kelangsungan hidup spermatozoa yang terkandung di dalam straw maka N2 cair di
dalam kontainer tidak boleh kurang dari ukuran minimal yang ditentukan yaitu
setinggi 13,3 cm. Seandainya 13,3 cm, maka penambahan N2 cair harus
dilakukan segera dalam waktu 12 jam.
Salah satu kendala penyimpanan semen beku dengan nitrogen cair adalah sifat
nitrogen cair yang mudah menguap. Faktor yang mempercepat terjadinya penguapan nitrogen cair diantaranya cara menyimpan kontainer, intensitas terbukanya tutup kontainer, jumlah akseptor, dan jenis kontainer. Kontainer
merupakan bejana vakum yang terdiri dari bahan baja atau almunium dengan dinding berisi ruang vakum dan isolasi yang ketat. Kontainer yang kurang baik
mutunya sering bocor karena dinding vakumnya tidak normal lagi atau tutupnya terlalu longgar dan menyebabkan penguapan nitrogen cair terlalu banyak dan terlalu cepat (Tolihere, 1993).
Kontainer merupakan bejana vakum yang umumnya terdiri dari bahan baja atau
aluminium dengan dinding berisi ruang vakum dan isolasi yang ketat dengan ukuran yang berbagai ukuran sesuai dengan kebutuhan. Satu kontainer di Pusat
20
straw. Kontainer tersebut diisi dengan larutan nitrogen cair (N2) dengan
temperatur -1960C. Semen beku yang disimpan dalam kontainer, maka dapat disimpan dalam waktu yang lama bahkan hingga bertahun-tahun sebelum
didistribusikan ke peternak atau ke daerah-daerah.
E. Motilitas Spermatozoa
Motilitas merupakan salah satu kriteria penentu kualitas semen yang dilihat dari banyaknya spermatozoa yang motil progresif dibandingkan dengan seluruh
spermatozoa yang ada dalam satu pandang mikroskop. Menurut Evans dan
Maxwell (1997), terdapat tiga tipe pergerakan spermatozoa yaitu pergerakan
progresif (maju ke depan), pergerakan rotasi (gerakan berputar) dan osilator atau konvulsif tanpa pergerakan ke depan atau perpindahan posisi. Skala presentase pergerakan dari 0 sampai 100 atau 0 sampai 10 merupakan penilaian standar
untuk mencapai tujuan bersama.
Evaluasi motilitas spermatozoa post thawing adalah salah satu parameter yang banyak digunakan untuk menentukan kualitas semen sapi yang akan digunakan untuk Inseminasi Buatan. Syarat minimal motilitas individu semen post thawing
agar semen dapat dipergunakan dalam Inseminasi Buatan adalah 40% (Garner dan Hafez, 2000). Susilawati et al., (2003) menunjukkan proses fertilisasi
membutuhkan spermatozoa motil sekitar sepuluh juta spermatozoa, maka syarat spermatozoa sebagai standar inseminasi adalah 2,5 x 107 spermatozoa per straw
21
Motilitas mempunyai nilai 0—100% meliputi gerakan massa dan gerakan
individu (Toelihere, 1993). Banyak hal-hal yang dapat menyebabkan rendahnya kualitas semen beku terutama terhadap motilitas diantaranya suhu dan
kelembaban, thawing, jarak straw, cara penyimpanan semen beku, dan penambahan nitrogen cair. Suhu berperan sangat besar dalam menentukan
motilitas sebab kadar metabolisme dan motilitas spermatozoa berbeda (Toelihere,
1993). Suhu panas dan kelembaban yang terlalu mudah atau dingin secara terus menerus lebih berpengaruh buruk terhadap fertilitas daripada suhu dan
kelembaban yang berganti-ganti panas dan dingin sehingga berpengaruh terhadap kualitas dan kuantitas semen beku terutama motilitas yang akhirnya menurunkan
angka konsepsi (Toelihere, 1993).
Energi yang digunakan untuk motilitas spermatozoa berasal dari perombakan ATP di dalam selubung mitokondria melalui reaksi-reaksi penguraiannya
menjadi ADP (adenosin diphosphat) dan AMP (adenosin monophosphat). Energi yang dihasilkan ini akan dipakai sebagai pergerakan (energi mekanik) atau
sebagai biosintesis (energi kimiawi). Dalam semen terdapat empat bahan organik
yang dapat dipakai secara langsung maupun tidak langsung oleh spermatozoa sebagai sumber energi untuk kelangsungan hidup dan motilitas spermatozoa.
Bahan-bahan tersebut adalah fruktosa, serbitol, GPC (glycerylphosphorylcholine), dan plasmalogen (Toelihere, 1993).
Penilaian gerakan individual spermatozoa menggunakan mikroskop dan melihat
22
atau media yang kurang isotonik terhadap semen. Gerakan berayun dan
berputar-putar di tempat biasanya terlihat pada semen yang sudah tua dan apabila kebanyakan spermatozoa berhenti bergerak dan dianggap mati. Motilitas
spermatozoa dipengaruhi oleh kemampuan metabolisme spermatozoa yang
ditunjang oleh lingkungan yaitu suhu dan komponen-komponen yang terdapat di dalam medium (Toelihere, 1993).
Pergerakan gerak individu ini sangat dipengaruhi oleh peneliti terutama
keterampilan dan pengalaman dari pemeriksaan secara mikroskopis. Oleh karena
itu penelitian dari seseorang dengan orang lain berbeda (Susilawati et al., 2003).
F. Spermatozoa Hidup
Spermatozoa normal memiliki kepala, leher, badan, dan ekor. Bagian depan
kepala tampak sekitar 2/3 bagian tertutup oleh akrosom. Tempat sambungan dasar akrosom dan kepala disebut cincin nucleus. Antar kepala dan badan
terdapat sambungan pendek yaitu leher yang berisi sentriol proksimal, kadang dinyatakan sebagai pusat kinetik aktifitas spermatozoa. Bagian badan dimulai
dari leher dan berlanjut ke cincin sentriol. Bagian badan dan ekor mampu
bergerak bebas meskipun tanpa kepala. Ekor membantu mendorong spermatozoa
untuk bergerak maju (Salisbury dan Van Denmark, 1985).
Persentase spermatozoa hidup tinggi serta gerak progresif dan kuat merupakan tanda semen berkualitas baik. Persentase spermatozoa hidup dan mati dapat
23
jumlah spermatozoa hidup atau mati, sewaktu semen dicampur dengan zat warna,
maka spermatozoa hidup (viabil) tidak akan menyerap warna karena membrannya masih bagus. Spermatozoa yang motil dan hidup tidak berwarna (Suyadi dan
Susilawati, 1992). Menurut Susilawati et al., (2003) menunjukkan bahwa kadang-kadang spermatozoa masih hidup akan mengambil warna sebagian dari ekor sampai setengah badan.
Pengambilan zat warna oleh spermatozoa dapat dipengaruhi oleh faktor-faktor lain seperti sekresi kelenjar assesoris, pH, suhu, kesalahan teknik pada waktu pembuatan preparat, dan umur semen sesudah pengambilan semen. Persentase
hidup dan mati sangat dipengaruhi oleh suhu, sinar matahari secara langsung dan goncangan yang berlebihan (Toelihere, 1993). Metode pewarnaan eosin 2%
adalah metode yang dilakukan dalam pemeriksaan persentase spermatozoa hidup.
Keterbatasan daya hidup spermatozoa selain disebabkan oleh cold shock juga disebabkan oleh terjadinya deficit energi dan kerusakan membran sel sebagai hasil
reaksi peroksida lemak (Situmorang et al., 2000). Menurut Toelihere (1993), untuk mempertahankan kehidupan spermatozoa maka semen beku dimasukkan ke
dalam kontainer yang berisi nitrogen cair pada suhu -1960C dan terus dipertahankan pada suhu tersebut sampai waktu dipakai.
Pengamatan hidup mati spermatozoa atau viabilitas dapat dilakukan dengan
metode pewarnaan diferensial menggunakan zat warna eosin saja atau dengan kombinasi eosin-nigrosin. Eosin adalah zat warna khusus untuk spermatozoa,
24
metode pewarnaan eosin-nigrosin adalah terjadinya penyerapan zat warna eosin
pada spermatozoa yang mati pada saat pewarnaan tersebut dilakukan. Hal ini terjadi karena membran pada spermatozoa yang mati tidak permeabel terhadap zat
warna atau memiliki aktivitas yang rendah sehingga menyebabkan spermatozoa yang mati berwarna merah (Toelihere, 1993).
Penentuan persentase hidup spermatozoa dilakukan setelah semen beku dibuat
preparat apus. Menurut Salisbury dan Van Denmark (1985), persentase hidup spermatozoa dapat dihitung dengan melihat reaksi spermatozoa terhadap zat
warna tertentu. Standar yang digunakan untuk spermatozoa mati adalah kepala
atau seluruh tubuh spermatozoa menyerap warna. Spermatozoa yang hidup tidak berwarna sedangkan spermatozoa yang mati akan menyerap warna. Zat warna
yang digunakan adalah eosin atau eosin-negrosin. Pada waktu semen bercampur dengan zat warna, sel-sel spermatozoa yang hidup tidak atau sedikit sekali menghisap warna (berwarna putih) sedangkan sel-sel yang mati akan mengisap
25
III. METODE PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada 7—13 April 2014, di BIBD Lampung,
Kecamatan Terbanggi Besar, Kabupaten Lampung Tengah, Provinsi Lampung.
B. Alat Penelitian
Peralatan yang digunakan dalam penelitian ini meliputi peralatan freezing (box freezing lengkap, kontainer depo lengkap, kontainer nitrogen cair, rak hitung,
timer, pinset panjang, sarung tangan kulit), peralatan thawing (pemanas air, pinset,
beaker glass 1000 ml, thermometer, timer), dan peralatan pemeriksaan kualitas
(gunting, kertas label, mikroskop, pipet tetes, object glass, cover glass, hair dryer,
counter).
C. Bahan Penelitian
26
D. Rancangan Penelitian
Penelitian ini dilakukan dengan menggunakan Rancangan Acak Lengkap (RAL) dengan lima perlakuan dan empat ulangan. Perlakuan pertama jarak straw 2 cm selama 9 menit, perlakuan kedua jarak straw 4 cm selama 9 menit, perlakuan
ketiga jarak straw 6 cm selama 9 menit, perlakuan keempat jarak straw 8 cm selama 9 menit, dan perlakuan kelima jarak straw 10 cm selama 9 menit.
Pengambilan sampel straw dilakukan secara acak. Jumlah straw yang digunakan sebanyak 20 straw. Data yang diperoleh dari hasil pengamatan disajikan dalam bentuk tabel dan kemudian dilakukan analisis secara statistik. Analisis data yang
digunakan dalam penelitian ini adalah analisis sidik ragam dengan taraf nyata 5% atau 1%. Apabila hasilnya berbeda nyata maka akan dilanjutkan dengan uji
Polinomial Ortogonal pada taraf 5% atau 1% menurut petunjuk Steel dan Torrie (1991).
E. Pelaksanaan Penelitian
Pelaksanaan penelitian dimulai dengan menampung semen dari pejantan Sapi Limousin menggunakan vagina buatan (artificial vagina), selanjutnya dilakukan
evaluasi semen segar secara makroskopis (volume, konsistensi, warna, pH) dan mikroskopis (gerakan massa, gerakan individu, konsentrasi). Semen segar yang memenuhi syarat kemudian diencerkan dengan pengencer Andromed® secara
merata. Selanjutnya dilakukan ekuilibrasi terhadap semen yang telah diencerkan dengan tujuan untuk menyesuaikan diri sebelum dilakukan proses pembekuan.
27
memenuhi standar akan dilanjutkan proses filling, sealing, dan printing. Langkah
selanjutnya yaitu melaksanakan sampling terhadap straw berisi semen Sapi Limousin yang akan dibekukan. Sampel dibagi sesuai dengan perlakuan jarak
straw saat proses pre freezing (2 cm, 4 cm, 6 cm, 8 cm, dan 10 cm).
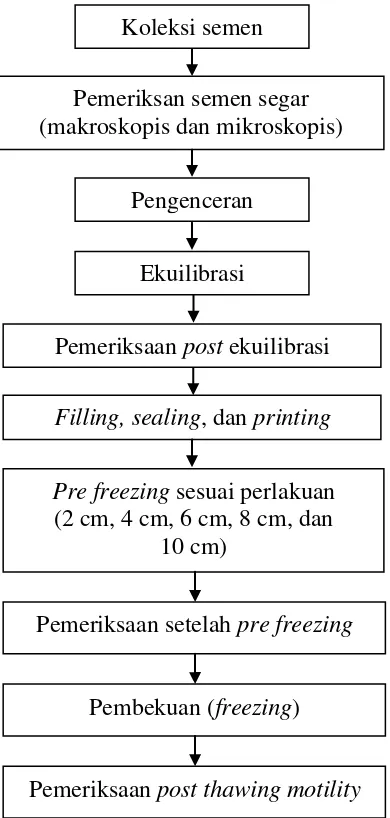
Bagan pelaksanaan penelitian dapat dilihat pada Gambar 1.
Gambar 1. Bagan pelaksanaan penelitian Ekuilibrasi
Koleksi semen
Pengenceran
Filling, sealing, dan printing Pemeriksaan post ekuilibrasi
Pre freezing sesuai perlakuan (2 cm, 4 cm, 6 cm, 8 cm, dan
10 cm)
Pemeriksan semen segar (makroskopis dan mikroskopis)
Pemeriksaan setelah pre freezing
Pembekuan (freezing)
28
Proses pembuatan semen beku sebagai berikut:
1. melakukan penampungan semen menggunakan vagina buatan;
2. melakukan evaluasi terhadap semen segar (makroskopis dan mikroskopis);
3. mencampurkan semen yang memenuhi syarat dengan pengencer Andromed® yang disimpan dalam water bath suhu 270C;
4. menutup beaker glass yang berisi semen yang telah diencerkan menggunakan
alumunium foil dan memasukkannya ke dalam cool top bersuhu 3—50C; 5. melakukan proses ekuilibrasi selama 4 jam di dalam cool top;
6. setelah ekuilibrasi selesai dilanjutkan dengan pemeriksaan post ekuilibrasi; 7. proses filling, sealing, dan printing;
8. meletakkan straw yang berisi semen cair di atas rak hitung yang telah diberi label sesuai perlakuan;
9. melakukan pre freezing dengan cara memasukkan rak hitung yang berisi straw
semen cair di atas permukaan N2 cair dengan volume N2 7,5 liter dalam box
freezing berukuran 43 x 27 cm selama perlakuan jarak yang diberikan (2 cm,
4 cm, 6 cm, 8 cm, dan 10 cm);
10.setelah pre freezing selesai dilanjutkan dengan pemeriksaan setelah pre freezing;
11.mengambil straw menggunakan pinset dan mencelupkannya ke dalam nitrogen cair sampai terendam;
12.setelah pembekuan selesai, dilanjutkan dengan pemeriksaan post thawing
29
13.melakukan pengumpulan data parameter yang diamati yaitu persentase
motilitas spermatozoa dan persentase spermatozoa hidup pada setiap pemeriksaan kualitas.
Prosedur yang dilakukan untuk melihat penilaian motilitas individu spermatozoa sebagai berikut:
1. meneteskan sampel semen di atas object glass kemudian ditutup dengan cover
glass;
2. mengamati motilitas spermatozoa menggunakan mikroskop dengan
perbesaran lemah (10 x 10) atau pembesaran sedang (10 x 40);
3. menentukan persentase motilitas spermatozoa sesuai dengan kriteria yang ada.
Menurut Toelihere (1985), penilaian gerakan individu spermatozoa yang terlihat
pada mikroskop adalah sebagai berikut: 0% : spermatozoa tidak bergerak;
0 − 30% : gerakan berputar ditempat, pergerakan progresif; 30 − 50% : gerakan berayun atau melingkar, pergerakan progresif; 50 − 80% : ada gerakan massa, pergerakan progresif;
80 − 90% : ada gelombang, pergerakan progresif;
90 − 100% : gelombang sangat cepat, pergerakan sangat progresif;
Prosedur yang dilakukan untuk melakukan pemeriksaan spermatozoa hidup sebagai berikut:
1. melakukan thawing;
30
4. menempelkan ujung gelas obyek yang lain pada kedua cairan sehingga
keduanya bercampur, kemudian didorong ke ujung gelas obyek; 5. mengeringkan preparat ulas tersebut menggunakan hair dryer;
6. setelah kering, melakukan pemeriksaan spermatozoa yang hidup dan mati dengan menggunakan mikroskop pada perbesaran sedang (10 × 40) atau kuat (10 × 100), spermatozoa yang hidup tetap tidak berwarna sedangkan
spermatozoa yang mati akan berwarna merah atau merah muda. Jumlah
spermatozoa yang dihitung minimal 210 sel;
7. menghitung persentase spermatozoa hidup dengan rumus berikut.
Spermatozoa hidup (%) = jumlah sperma terhitung −jumlah sperma mati
jumlah � �� � � terhitung × 100%
F. Peubah yang Diamati
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan hasil penelitian ini, maka dapat disimpulkan sebagai berikut: 1. Jarak straw dengan nitrogen cair pada proses pre freezing tidak berpengaruh
nyata terhadap motilitas spermatozoa setelah pre freezing dan persentase
spermatozoa hidup setelah pre freezing tetapi memberikan pengaruh sangat nyata terhadap motilitas spermatozoa setelah thawing dan persentase
spermatozoa hidup setelah thawing
2. Berdasarkan uji Polinomial Ortogonal, jarak straw yang terbaik dengan nitrogen cair pada proses pre freezing terhadap motilitas spermatozoa dan
spermatozoa hidup Sapi Limousin yaitu 6 cm.
B. Saran
Agar diperoleh kondisi semen beku yang baik untuk dipergunakan dalam
47
DAFTAR PUSTAKA
Almquist, J. O. 1968. Diary Cattle. In : E. J. Perry (Ed.). The Artificial Insemination of Farm Animals. Fourth Revised Edition, Rutgers University Press. New Jersey
Amin, M. R., M. R. Toelihere, Tuty, Yusuf dan P. Stumorang. 1998. Pengaruh plasma semen sapi terhadap kualitas semen beku kerbau lumpur (Bubalus bubalis). JITV 4: 143—147
Blakely, J. dan D. H. Bade. 1994. Ilmu Peternakan edisi ke-4. Terjemahan: B. Srogandono. Gajah Mada University Press. Yogyakarta
Chatterjee, S., E. R. Smith, Hanada, K. Stevens, VL. and S. Mayor. 2001. GPI anchoring leads to sphingolipid-dependent retention of endocytosed proteins in the recycling endosomal compartment. EMBO J. 20: 1583—1592
Datta, U., M. C. Sekar, M. L. Hembram and R. Dasgupta. 2009. Development of a New Methode to Preserve Caprine Cauda Epididymal Spermatozoa in Situ at 100C. Procedings. Department of Veterinary and Animal Sciences West Bengal University of Animal and Fishery Sciences. Kolkata West Bengal. India
Direktorat Jenderal Peternakan. 2007. Petunjuk Teknis Produksi dan Distribusi Semen Beku. Direktorat Jenderal Peternakan. Jakarta
Evans, G. and W. M. C. Maxwell. 1997. Salamon’s Artifical Insemination of Sheep and Goats. Butter worth. London
Garner, D. L. and E. S. E. Hafez. 2000. Spermatozoa and Seminal Plasma. In Reproduction In Farm Animals. Edited by E. S. E. Hafez. 7th Edition. Lippincott Wiliams and Wilkins. Maryland. USA
Graha, N. 2005. Recovery Rate dan Longivitas Pasca Thawing Semen Beku Sapi FH (Frisian Holstein) Menggunakan Berbagai Bahan Pengencer.
Skripsi. Fakultas Kedokteran Hewan. Institut Pertanian Bogor. Bogor
48
Hafez, E. S. E. 1987. Reproduction In Farm Animal. 4th Edition. Lea and Fibiger. Philadelfia. USA
Hafez, E. S. E. 1993. Semen Evaluation. In : Reproduction In Farm Animal. 6th Edition. Lea and Febiger. Philadelfia. USA
Hafez, E. S. E. 2000. Semen Evaluation. In: Reproduction In Farm Animals. 7th Edition. Lippincott Wiliams and Wilkins. Maryland. USA
Hardjopranjoto, S. H. 1995. Ilmu Kemajiran Pada Ternak. Air Langga University Press. Surabaya
Hammerstedt, R. H. 1993. Maintanence of bioenergic balance in sperma and prevention of lipid peroxidation: A review of the effects on design and storage preservation system. Reprod. Fert. Div. 5: 675—690
Herdis, M., Surachman, Yulnawati, M. Rizal dan H. Maheshwari. 2008. Viabilitas dan Keutuhan Membran Plasma Spermatozoa Epididimis Kerbau Belang Pada Penambahan Maltosa Dalam Pengencer
Andromed®. http://eprints.undip.ac.id/18998/1/33%282%292008p101-106.pdf. Diakses 14 September 2013. 33(2): 101—106
Imran. 2012. Pengaruh Jarak Ketinggian Straw Dengan Permukaan Nitrogen Cair dan Lama Waktu Pada Tahap Pre-freezing Semen Terhadap Motilitas Sperma Sapi Bangsa Limousine. Skripsi. Universitas Negeri Malang.
Kaiin, E. M., S. Said, F. Afianti dan M. Gunawan. 2004. Optimalisai Pembekuan Semen Sapi PO: PerbaikanTeknik Pembekuan Sperma. Pros. Seminar Nasional Industri Peternakan Modern. Puslit Bioteknologi- LIPI. Makasar: 99—105
Kuswanto, S. Suharyati dan P. E. Santoso. 2007. Pengaruh Penggunaan
Andromed, Stock Solution, dan Susu Skim Sebagai Bahan Pengencer Terhadap Kualitas Semen Cair Sapi Limousin Selama Penyimpanan. Kumpulan Abstrak Skripsi. Jurusan Peternakan. Fakultas Pertanian Universitas Lampung. Bandar Lampung
Maxwell, W.M.C. and P.F. Watson. 1996. Recent progress in the preservation of ram semen. J. Anim. Reprod.Sci. 42: 55—65
49
Nilna. 2010. Standar Operasional Pekerjaan Prosesing Semen. Pengawas Mutu Bibit Ternak pada Dinas peternakan. Sumatra Barat
Pangestu, M. 2002. Preservation of spermatozoa : methods and applications. Indonesian Forum on Reproduction. Journal on Reproduction. 1(2): 55—56
Parrish, J. 2003. Techniques in domestic animal reproduction-evaluation and freezing of semen. http://www.wisc.edu/anscirepro/. Diakses 14 September 2013
Partodihardjo, S. 1992. Ilmu Reproduksi Hewan. Mutiara Sumber Widya. Jakarta
Purwasih, Y., S. Ondho dan Sutopo. 2013. Parameter keberhasilan processing semen beku. Efektivitas pre freezing semen Sapi Jawa. http://ejournal-s1.undip.ac.id/index.php/aaj. Diakses 1 januari 2014.
Rizal, M. dan Herdis. 2008. Inseminasi Buatan pada Domba. Rineka Cipta. Jakarta
Rizal, M. 2009. Daya hidup spermatozoa epididimis sapi bali yang dipreservasi pada suhu 3—50C dalam pengencer tris dengan konsentrasi laktosa yang berbeda. 14(2): 142—149
Said, S., E. M. Kaiin, F. Afianti, M. Gunawan dan B. Tappa. 2004. Perbaikan Teknik Pembekuan Sperma: Pengaruh Ketinggian Straw dan
Penggunaan Rak Dinamis. Pros. Seminar Nasional Teknologi Peternakan dan Veteriner. Bogor, 4—5 Agustus 2004. Puslitbang Peternakan. Bogor: 57—60
Salamon, S. 1971. Fertility of ram spermatozoa following pellet preezing on dry ice at -790C and -1400C. Aust. J. Biol. 24: 183—185
Salisbury, G.W. dan N. L. Van Denmark. 1985. Fisiologi Reproduksi dan Inseminasi Buatan Pada Sapi. Terjemahan R. Djanuar. Gadjah Mada University Press. Yogyakarta
Situmorang, P. E., Triwulanningsih, A. Lubis, W. Coroline dan T. Sugianti. 2000. Pengaruh proline carnitine terhadap daya hidup spermatozoa yang disimpan dalam suhu 50c (chilling semen). JITV 6(1): 131—137
50
Sonjaya, H., Hasbi, Sutomo dan Hastuti. 2005. Pengaruh penambahan calcium ionophore terhadap kualitas spermatozoa kambing boer hasil sexing. Jurnal Sains dan Teknologi. 5(2): 90—101
Steel, R. G. D. dan J. H. Torrie. 1991. Prinsip-Prinsip dan Prosedur Statistika. Terjemahan B. Sumatri. PT. Gramedia. Jakarta
Sudarmono, A. S. 2006. Sapi Potong. Penebar Swadaya. Depok
Sugiarti, T., E. Triwulanningsih, P. Situmorang, R. G. Sianturi dan D. A.
Kusumaningrum. 2004. Penggunaan Katalase dalam Produksi Semen Dingin Sapi. Prosiding Seminar Nasional Teknologi Peternakan dan Veteriner. Puslitbangnak. Bogor: 215—220
Susilawati, T., Suyadi, Nuryadi, N. Isnaini dan S. Wahyuninigsih. 1993. Kualitas Semen Sapi Fries Holland dan Sapi Bali pada Berbagai Umur dan Berat Badan. Laporan Penelitian. Fakultas Peternakan Universitas
Brawijaya. Malang
Susilawati, T., P. Srianto, Hermanto dan E. Yuliani. 2003. Inseminasi Buatan dengan Spermatozoa Beku Hasil Sexing pada Sapi untuk Mendapatkan Anak dengan Jenis Kelamin Sesuai Harapan. Laporan Penelitian. Fakultas Peternakan Universitas Brawijaya. Malang
Suyadi, dan Susilawati. 1992. Pengantar Fisiologi Reproduksi. LUW Animal Husbandry Project Universitas Brawijaya. Malang
Toelihere. M. R. 1985. Fisiologi Reproduksi pPada Ternak. Penerbit Angkasa Bandung
Toelihere. M. R. 1993. Inseminasi Buatan pada Ternak. Penerbit Angkasa Bandung
Thomas, V. M. 1991. Beef Cattle Production. Wafel and Press. Montana University. USA
Turyan. 2005. Penurunan Motilitas Spermatozoa pada Berbagai Bangsa Sapi Akibat Proses Pembekuan. Skripsi. Universitas Brawijaya. Malang Umar, S. dan M. Maharani. 2005. Pengaruh berbagai waktu ekuilibrasi terhadap
daya tahan sperma Sapi Limousin dan uji kebuntingan. Jurnal Agribisnis Peternakan. 1(1): 17—21
51
Yudhaningsih, H. 2004. Kualitas dan Integritas Membran Spermatozoa Sapi Madura Menggunakan Motilitas dan Pengencer yang Berbeda Selama Proses Pembekuan Semen. Skripsi. Universitas Brawijaya. Malang Zenichiro, K., Herliantien dan Sarastina. 2002. Teknologi Prosessing Semen