Lampiran 1. Ekstraksi Etanol Batang dan Daun Evodia dengan Metode
dimasukkan ke dalam botol
Lampiran 2. Peremajaan Biakan Murni dan Penyiapan Mikroba Uji
disubkultur dengan menggunakan media miring
dinkubasi pada suhu 37º C selama 24-72 jam
disuspensikan dalam larutan NaCl 0,9% steril sehingga diperoleh kekeruhan standart Mc. Farland dilakukan pengenceran 10-2 sehingga diperoleh suspensi 106 CFU/ml
Suspensi C. albicans Isolat S. mutans,
Lampiran 3. Uji Aktivitas Ekstrak Etanol Batang dan Daun Evodia (Euodia ridleyi Horch.) terhadap Pertumbuhan S. mutans,
S. dysenteriae dan C. albicans
dituang ke dalam cawan steril dibiarkan memadat
diusapkan suspensi biakan dengan
cotton bud
diletakkan cakram yang mengandung ekstrak tumbuhan uji
diletakkan cakram pembanding diinkubasi selama 24-72 jam
diamati dan diukur zona bening di sekitar cakram
Media MHA
Media Uji
Lampiran 4. Pengamatan Zona Hambat (mm) Ekstrak Etanol Batang Evodia terhadap Pertumbuhan S. mutans, S. dysenteriae, dan
C. albicans Hari I
Perlakuan Ulangan diameter zona hambat (mm) Keterangan: Diameter zona hambat sebesar 6 mm sama dengan diameter cakram sehingga dinyatakan tidak memiliki daya hambat pertumbuhan.
Pengamatan Zona Hambat (mm) Ekstrak Etanol Batang Evodia terhadap Pertumbuhan S. mutans, S. dysenteriae, dan C. albicans Hari II
Lampiran 5. Pengamatan Zona Hambat (mm) Ekstrak Etanol Batang Evodia terhadap Pertumbuhan S. mutans, S. dysenteriae, dan
C. albicans Hari III
Perlakuan Ulangan diameter zona hambat (mm)
Total (mm) Rata-rata (mm) Mikroba uji Konsentrasi
Ekstrak (%)
1 2 3
S. mutans 0 6,00 6,00 6,00 18,00 6,00
5 6,03 10,69 9,03 25,74 8,58 10 8,53 10,03 9,53 28,08 9,36 20 7,03 13,03 12,03 32,08 10,69 40 8,03 10,53 11,65 30,20 10,07
S. dysnteriae 0 6,00 6,00 6,00 18,00 6,00 5 10,53 9,03 7,03 26,58 8,86 10 14,03 8,03 7,53 29,58 9,86 20 12,53 11,03 11,03 34,58 11,53 40 16,03 12,14 9,53 37,69 12,56
C. albicans 0 6,00 6,00 6,00 18,00 6,00
Lampiran 6. Pengamatan Zona Hambat (mm) Ekstrak Etanol Daun Evodia
terhadap Pertumbuhan S. mutans, S. dysenteriae, dan
C. albicans Hari I
Perlakuan Ulangan diameter zona hambat (mm) Keterangan: Diameter zona hambat sebesar 6 mm sama dengan diameter cakram sehingga dinyatakan tidak memiliki daya hambat pertumbuhan.
Pengamatan Zona Hambat (mm) Ekstrak Etanol Daun Evodia terhadap Pertumbuhan S. mutans, S. dysenteriae, dan C. albicans Hari II
Lampiran 7. Pengamatan Zona Hambat (mm) Ekstrak Etanol Daun Evodia
terhadap Pertumbuhan S. mutans, S. dysenteriae, dan
C. albicans Hari III
Perlakuan Ulangan diameter zona hambat (mm)
Total (mm) Rata-rata (mm) Mikroba uji Konsentrasi
Ekstrak (%)
1 2 3
S. mutans 0 6,00 6,00 6,00 18,00 6,00
5 10,03 9,20 6,03 25,25 8,42 10 13,03 8,03 8,03 29,08 9,69 20 11,53 10,03 14,03 35,58 11,86 40 15,03 9,53 14,53 39,08 13,03
S. dysnteriae 0 6,00 6,00 6,00 18,00 6,00
5 9,03 9,53 9,08 27,63 9,21
10 7,03 12,03 10,53 29,58 9,86 20 12,60 10,54 11,03 34,16 11,39 40 10,03 14,03 12,53 36,58 12,19
C. albicans 0 6,00 6,00 6,00 18,00 6,00
Lampiran 8. Pengamatan Zona Hambat (mm) Kontrol Positif Kloramfenikol (30 µg), Nistatin (20,6 µg) dan Kontrol Negatif (DMSO)
terhadap Pertumbuhan S. mutans, S. dysenteriae, dan
C. albicans Hari I, II dan III
Mikroba uji
Senyawa / Diameter Zona Hambat (mm)
Hari I Hari II Hari III Kloramfenikol
(30 µg) DMSO
Kloramfenikol
(30 µg) DMSO
Kloramfenikol
(30 µg) DMSO
S. mutans 25,05 6,00 23,89 6,00 22,89 6,00
S. dysenteriae 27,86 6,00 26,86 6,00 25,03 6,00 Keterangan: Diameter zona hambat sebesar 6 mm sama dengan diameter cakram sehingga dinyatakan tidak memiliki daya hambat pertumbuhan.
Mikroba uji Senyawa / Diameter Zona Hambat (mm)
Hari I Hari II Hari III Nistatin
(20,6 µg) DMSO
Nistatin
(20,6 µg) DMSO
Nistatin
(20,6 µg) DMSO
Lampiran 9. Pengamatan Zona Hambat Konsentrasi Hambat Minimum (KHM) Batang Evodia dan Daun Evodia terhadap pertumbuhan S. mutans, S. dysenteriae, dan C. albicans Hari I
Sampel Tumbuhan
Perlakuan Ulangan diameter zona hambat
Lampiran 10. Pengamatan Zona Hambat Konsentrasi Hambat Minimum (KHM) Batang Evodia dan Daun Evodia terhadap pertumbuhan S. mutans, S. dysenteriae, dan C. albicans Hari II
Sampel Tumbuhan
Perlakuan Ulangan diameter zona hambat
Lampiran 11. Pengamatan Zona Hambat Konsentrasi Hambat Minimum (KHM) Batang Evodia dan Daun Evodia terhadap pertumbuhan S. mutans, S. dysenteriae, dan C. albicans Hari III
Sampel Tumbuhan
Perlakuan Ulangan diameter zona hambat
Lampiran 12. Hasil Uji Statistik Ekstrak Etanol Batang Evodia terhadap Pertumbuhan S. mutans
Perlakuan Rata-Rata Zona Hambat (mm)
Mikroba Uji Kontrol + /
Hasil Uji Statistik Ekstrak Etanol Batang Evodia terhadap Pertumbuhan
S. dysenteriae
Perlakuan Rata-Rata Zona Hambat (mm)
Mikroba Uji Kontrol +/
Hasil Uji Statistik Ekstrak Etanol Batang Evodia terhadap Pertumbuhan
C. albicans
Perlakuan Rata-Rata Zona Hambat (mm)
Lampiran 13. Hasil Uji Statistik Ekstrak Etanol Daun Evodia terhadap Pertumbuhan S. mutans
Perlakuan Rata-Rata Zona Hambat (mm) Mikroba Uji Kontrol +/
Konsentrasi Ekstrak Hari 1 Hari 2 Hari 3
S. mutans Kloramfenikol 25,05 a 23,89 a 22,89 a
0 % 6,00 b 6,00 b 6,00 b
5 % 11,13 c 10,25 c 8,42 c
10 % 13,71 cd 10,48 c 9,69 cd
20 % 17,07 d 13,23 c 11,86 d
40 % 18,44 d 15,03 c 13,03 de
Hasil Uji Statistik Ekstrak Etanol Daun Evodia terhadap Pertumbuhan
S. dysenteriae
Perlakuan Rata-Rata Zona Hambat (mm)
Mikroba Uji Kontrol +/
Konsentrasi Ekstrak Hari 1 Hari 2 Hari 3
S. dysenteriae Kloramfenikol 27,86 a 26,86 a 25,03 a
0 % 6,00 b 6,00 b 6,00 b
5 % 9,54 c 9,40 c 9,21 c
10 % 11,26 cd 10,49 cd 9,86 cd
20 % 13,10 d 11,56 cd 11,39 d
40 % 14,66 d 12,80 c 12,19 d
Hasil Uji Statistik Ekstrak Etanol Daun Evodia terhadap Pertumbuhan
C. albicans
Perlakuan Rata-Rata Zona Hambat (mm)
Mikroba Uji Kontrol +/
Konsentrasi Ekstrak Hari 1 Hari 2 Hari 3
C. albicans Nistatin 6,34 a 6,34 a 6,34 a
0 % 6,00 a 6,00 a 6,00 a
5 % 6,88 ac 6,53 ac 6,36 ab
10 % 7,72 b 7,19 bc 6,69 ab
20 % 7,52 ab 7,38 bc 6,69 ab
DAFTAR PUSTAKA
Adi, P., Noorhamdani, A.S. dan Chielwin, I.G. 2010. Uji Efektivitas Antibakteri Ekstrak Etanol Bawang Putih (Allium sativum) terhadap Pertumbuhan
Streptococcus mutans Penyebab Karies Secara In Vitro. Universitas
Brawijaya. Malang
Adnyana, I.K., Yulinah, E., Sigit, J.I., Fisheri, N. dan Insanu, M. 2004. Efek Ekstrak Daun Jambu Biji Daging Buah Putih dan Jambu Biji Daging Buah Merah Sebagai Antidiare. Acta Pharmaceutica Indonesia 29(1): 19-27
Agoes, G. 2007. Teknologi Bahan Alam. Penerbit ITB. Bandung
Alexopoulos, C.J. and Mims, C.W. 1979. Introductory Mycology.Third Edition. John Wiley and Sons Inc. New York
Akpan, A. and Morgan, R. 2002. Oral Candidiasis. Journal Postgrad Med. 78: 455-459
Antony, B., Rekha, B., Anup, K.S., Thomas, K., and Ramanathan, K. 2010. Semiquantitation and Characterization of Streptococcus mutans from Patients Under Going Orthodontic Treatment. Journal Biosci Tech. 1(2): 59-63
Astuti, N.F. 2012. Perbandingan Resistensi Candida albicans dan Candida non
albicans terhadap Flukonazol dan Nistatin. [Tesis]. Yogyakarta:
Universitas Gadjah Mada
Bawa, I. 2011. Aktivitas Antioksidan Antijamur Senyawa Atsiri Bunga Cempaka Putih (Michelia alba). Jurnal Kimia. 5(1): 43-50
Berman, J. and Peter, E.S. 2002. Candida albicans: A Molecular Revolution Built on Lessons From Budding Yeast. Jurnal Nature. 3: 919-930
Burch, D.G. and Broschat, T.K. 1983. Aralias in Florida Horticulture. Proc Fla
State Hort Soc. 9: 161-164
Chander, J. 2002. Medical Mycology. Mentha Publisher. India
Chin, J.D. 2000. Manual Pemberantasan Penyakit Menular. Edisi 17. Terjemahan I Nyoman Kandun. Bakti Husada
Ciocan, I.D. and Bara, I.I. 2007. Plant Products as Antimicrobial Agents. Genetic
Biology Molecular. 7: 151-156
Cowan, M.M. 1999. Plant Products as Antimicrobial Agents. Clinical
Microbiology. 12(4): 564-582
Dalimunthe, A. 2009. Interaksi pada Obat Antimikroba. Universitas Sumatera Utara. Medan
David, W.W. and Stout, T.R. 1971. Disc Plate Method of Microbiological Antibiotic Assay. Microbiology. 22(4): 659-665
Dewi, F.K. 2010. Aktivitas Antibakteri Ekstrak Etanol Buah Mengkudu (Morinda
citrifolia Linn.) terhadap Bakteri Pembusuk Daging Segar. [Skripsi].
Surakarta: Universitas Sebelas Maret
Dzen, S., Roekistiningsih., Sanarto, S., Sri, W., Sumarno., Samsul, I., Noorhamdani, A. dan Dewi, S. 2003. Bakteriologi Medik. Bayumedia Publishing. Malang
Fatimah, C., Urip. H., Isma, S., Safrida. dan Ernawati. 2006. Uji Aktivitas Antibakteri Ekstrak Daun Angsana (Pterocarpus indicus Willd) Secara In Vitro. Jurnal Ilmiah PANNMED. 1(1): 1-8
Falahudin, D. 2008. Penghambatan Peroksidasi Lipid Sel Khamir Candida sp. Y390 oleh Ekstrak Daging Buah Salak Bongkok (Salacca edulis Reinw.) [Skripsi]. Bogor: Institut Pertanian Bogor
Gozali, D., Ida, M., Mutakin dan Kartika, A. 2009. Uji Aktivitas Antinyamuk dari Ekstrak Daun Zodia (Evodia suaveolens Scheff) terhadap Nyamuk Culex
fatigans dalam Sediaan. Farmaka. 7(3): 27-40
Hale, F.A. 2004. Dental Caries. Hale Veterinary Clinic Februari 2013]
Hamilton, M. 1973. Polyene Resistance in Yeast: a consideration of Physiological and Biochemical Mechanisms. Microbios 8: 209
Hasyim, N. 2005. Chemical Constitiuents and Biological Activity of Four Melicope Species (Rutaceae). [Tesis]. Malaysia: Universiti Putra Malaysia
Harborne, J. 1996. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan. Penerbit ITB. Bandung
Hotmauli, M. 2010. Perbandingan Efektivitas Ekstrak Daun Pacar Air (Impatiens
balsamina Linn.) dengan Ketokonazol 2% terhadap Pertumbuhan Candida
American Type Culture Collection (ATCC) 10231 pada Media Saboraud Dextorse Agar (SDA). [Karya Tulis Ilmiah]. Semarang: Universitas Diponegoro
Irianto, K. 2006. Mikrobiologi. Jilid 2. Yrama Widya. Bandung
Ismiati, E. 2006. Studi Efikasi Ekstrak Daun Kisampang (Melicope denhamii) terhadap Ektoparasit pada Ayam Kampung yang ada di Bagian Ekor. [Skripsi]. Bogor: Institut Pertanian Bogor
Krieg, N.R., Staley, J.T., Brown, D.R., Hedlund. B,P., Paster, B.J., Ward, N.L., Ludwig, W., Whitman, W.B. and Parte, A.C. 2010. Bergey’s Manual of Systematic Bacteriology. Second Edition. Volume Four. Springer. New York
Kumala, W. 2006. Mikologi Dasar Kedokteran. Penerbit Universitas Trisakti. Jakarta
Kusumamaningtyas, E. 2009. Mekanisme Infeksi Candida albicans pada Permukaan Sel. Lokakarya Nasional Penyakit Zoonosis. Bogor
Lathifah, Q. 2008. Uji Efektivitas Ekstrak Kasar Senyawa Antibakteri pada Buah Belimbing Wuluh (Averrhoa bilimni L.) dengan Variasi Pelarut. [Skripsi]. Malang: Universitas Islam Negeri Malang
Lay, B.W. 1994. Analisis Mikroba di Laboratorium. PT Raja Grafindo Persada. Jakarta
Legros, D. and Pierce, N.F. 2005. Guidelines for the Control of Shigellosis, including Epidemics due to Shigella dysenteriae type 1. World Health Organization
Lemmens. R.H.M.Y and Bunyapraphatsara, N. 2003. Plant Resources of South-East Asia. Prosea. Bogor
Lenny, S. 2006. Senyawa Terpenoid dan Steroida. [Karya Ilmiah]. Universitas Sumatera Utara
Lubis, R.D. 2008. Pengobatan Dermatomikosis. Universitas Sumatera Utara. Medan
Maryuni, A.E. 2008. Isolasi dan Identifikasi Senyawa Antibakteri Minyak Atsiri Daun Zodia (Evodia sp.). [Tesis]. Bogor: Institut Pertanian Bogor Sekolah Pascasarjana
Mukhlisoh, W. 2010. Pengaruh Ekstrak Tunggal dan Gabungan Daun Belimbing Wuluh (Averrhoa bilimbi Linn) terhadap Efektivitas Antibakteri Secara In Vitro. [Skripsi]. Malang: Universitas Islam Negeri Maulana Ibrahim
Prathibha, K.P., Raghavendra, B.S. and Vijayan, V.A. 2010. Evaluation of Larvecidal Effeect of Euodia ridleyi Horch. Leaf Extract Againts Three Mosquito Spesies at Mysore. Biological Sciences 5(6): 452-455
Rippon, J.W. 1988. Medical Mycology. Third Edition. W. B. Saunders Company. Canada
Roekistiningsih, Yudani, T. dan Tadhfirah, F. 2010. Efek Antimikroba Ekstrak Daun Pepaya (Carica papaya L.) sebagai Antimikroba terhadap Shigella
dysenteriae secara In Vitro. [Tugas Akhir]. Malang: Universitas
Brawijaya
Robinson, 1995. Kandungan Organik Tumbuhan Tinggi. Penerbit ITB. Bandung
Safitri, R. dan Sinta, S. Medium Analisis Mikroorganisme. Trans Info Media. Jakarta
Santoso, A.T., Noorhamdani, dan Bambang, S. 2009. Uji Ekstrak Bunga Kamboja (Plumeria acuminatae Ait) sebagai Antimikroba terhadap Shigella
dysenteriae. Universitas Brawijaya. Malang
Sari, L.O. 2006. Pemanfaatan Obat Tradisional dengan Pertimbangan Manfaat dan Keamanannya. Majalah Ilmu Kefarmasian. 3(1). 1-7
Silaban, L.W. 2009. Skrining Fitokimia dan Uji Aktivitas Antibakteri dari Kulit Buah Sentul (Sandoricum koetjape Burn F. Merr) terhadap Beberapa Bakteri Secara In Vitro. [Skripsi]. Medan: Universitas Sumatera Utara
Suprianto. 2008. Potensi Ekstrak Sereh Wangi (Cymbopogon nardus L.) sebagai Anti Streptococcus mutans. [Skripsi]. Bogor: Institut Pertanian Bogor
Suprihatin, S. 1982. Candida dan Kandidiasis pada Manusia. Balai Penerbitan FKUI. Jakarta
Tekur, U. 2007. Pharmalogy Antimicrobial Agents: Antibacterial Drugs. Maulana Azad Medical College. New Delhi
Volk, W.A., dan Wheeler, M.F. 2006. Mikrobiologi Dasar. Jilid I. Terjemahan Markam. Erlangga. Jakarta
Waji, R.A. dan Andis, S. 2009. Flavonoid (Quercetin). [Makalah]. Universitas Hasanudian Program S2 Kimia
Way, A., Camberley. and Surrey. 2007. The Genus Streptococcus, An Overview.
Microgen Bioproducts Newsletter. 25: 1-4
Wulandari, A. R. 2012. Uji Daya Efektivitas Antifungi Biji Tanjung (Mimusops elengi Linn.) terhadap Pertumbuhan Candida albicans secara In Vitro dengan Metode Difusi. [Skripsi]. Jakarta: Universitas Pembangunan Nasional Veteran
Yulia, R. 2006. Kandungan Tanin dan Potensi Anti Streptococcus mutans Daun Teh Var. Assamica pada Berbagai Tahap Pengolahan. [Skripsi]. Bogor: Institut Pertanian Bogor
BAB 3
BAHAN DAN METODE
3.1. Waktu Dan Tempat
Penelitian ini dilaksanakan pada bulan Maret 2013 sampai dengan Juni
2013 di Laboratorium Kimia Organik Bahan Alam FMIPA dan Laboratorium
Mikrobiologi FMIPA, Universitas Sumatera Utara, Medan.
3.2. Alat Dan Bahan
Alat yang digunakan adalah neraca analitik, timbangan meja, rotary evaporator,
cawan Petri, Erlenmeyer, autoklaf, inkubator, mikroskop, blender, gelas piala,
gelas ukur, spatula, plastik wrap, aliminium voil, magnetic stirrer, oven,
handspray, propipet, Bunsen, jangka sorong, pinset, hot plate, jarum ose dan
pipet serologi.
Bahan yang digunakan dalam penelitian ini adalah batang dan daun evodia
yang diambil dari beberapa tempat di Kota Medan, isolat S. mutans,
S. dysenteriae dan C. albicans, cotton bud, aquadest, alkohol 70%, Mueller
Hinton Agar (MHA), nutrient agar (NA), NaCl 0,9 %, kertas cakram, kapas,
kloramfenikol (30 µg), nistatin (20,6 µg), dimethilsulfoxyde (DMSO), etanol,
pereaksi Wagner, Meyer, Bouchardart, Dragendrof, FeCl3 1%, CeSO4,
Lieberman-Bouchard, alkohol 96%, dan HCl 6% 2 N.
3.3. Susunan Rancangan Penelitian
Uji aktivitas ekstrak etanol batang dan daun evodia terhadap S. mutans,
S. dysenteriae dan C. albicans secara in vitro dilaksanakan dengan Rancangan
Acak Lengkap (RAL) Faktorial dengan 3 faktor yaitu faktor 1: variasi konsentrasi
ekstrak etanol batang evodia, faktor 2: variasi konsentrasi ekstrak etanol daun
evodia, serta faktor 3: mikroorganisme uji yang terdiri dari S. mutans, S.
dysenteriae dan C. albicans. Perlakuan diulangi sebanyak 3 kali dan data hasil uji
homogenitasnya. Jika data yang didapatkan normal dan homogen, maka dilakukan
uji beda dengan menggunakan uji parametrik One Way Anova diperoleh p < 0,05
dan dilanjutkan dengan uji Post Hoc Bonferroni. Jika data yang didapatkan tidak
normal dan tidak homogen, maka dilakukan uji beda dengan menggunakan uji
non parametrik Kruskall-Wallis diperoleh p <0,05 dan dilanjutkan dengan uji
Mann-Whitney.
3.4. Prosedur
Penelitian ini dilakukan dalam beberapa tahap, yaitu preparasi sampel tumbuhan
uji, ekstraksi etanol batang dan daun evodia dengan metode maserasi, uji skrining
fitokimia, peremajaan biakan murni dan penyiapan mikroba uji, serta pengujian
aktivitas antimikroba oleh ekstrak etanol batang dan daun evodia.
3.4.1. Preparasi Sampel Tumbuhan Uji
Batang dan daun evodia masing-masing dikumpulkan sebanyak 1 kg dari
beberapa tempat di Kota Medan, kemudian dicuci dan dikeringanginkan pada
suhu kamar, hingga berat konstan (500 g), kemudian diblender menjadi serbuk
(Mukhlisoh, 2010).
3.4.2. Ekstraksi Etanol Batang dan Daun Evodia dengan Metode Maserasi
Serbuk batang dan daun evodia masing-masing direndam dengan etanol
selama 3 x 24 jam dengan beberapa kali pemaserasian. Kemudian larutan ekstrak
batang dan daun evodia masing-masing disaring, dipisahkan filtrat dengan
ampasnya. Filtrat ekstrak batang dan daun evodia masing-masing dipekatkan
dengan rotary evaporator dan ditimbang. Ekstrak pekat yang diperoleh digunakan
untuk uji golongan senyawa aktif dan uji antimikroba (Lathifah, 2008). Setelah
perlakuan tersebut, masing-masing ekstrak kental dimasukkan dalam botol vial
dan dikeringkan di desikator. Ekstrak etanol batang dan daun evodia sebanyak 0,8
g dari masing-masing ekstrak dilarutkan dalam 2 ml dimethilsulfoxyde (DMSO).
Ekstrak yang diperoleh disimpan di dalam botol gelap dan disimpan pada suhu
refrigerator. Ekstraksi tumbuhan dengan metode maserasi dapat dilihat pada
3.4.3. Uji Skrining Fitokimia Ekstrak Etanol Batang dan Daun Evodia
Uji skrining fitokimia ekstrak etanol batang dan daun evodia yang
dilakukan meliputi pemeriksaan kandungan senyawa flavonoid, alkaloid, steroid,
terpenoid dan saponin. Pemeriksaan senyawa ini sesuai dengan prosedur yang
telah dilakukan Harbone (1996), yaitu:
a. Uji Flavonoid
Ekstrak kental batang dan daun evodia masing-masing dimasukkan ke dalam
tabung reaksi dan ditetesi FeCl3. Kemudian diamati perubahan warna yang
terjadi. Ekstrak dinyatakan mengandung flavonoid jika larutan berwarna biru
kehitaman.
b. Uji Alkaloid
Ekstrak kental batang dan daun evodia masing-masing dimasukkan ke dalam
4 buah tabung reaksi. Tabung I ditetesi pereaksi Meyer, tabung II ditetesi
pereaksi Wagner, tabung III ditetesi Bouchardart dan tabung IV ditetesi
Dragendrof. Kemudian diamati perubahan warna yang terjadi. Ekstrak
dinyatakan mengandung alkaloid jika salah satu pada tabung reaksi I terdapat
endapan putih kekuningan, pada tabung reaksi II terdapat endapan coklat,
pada tabung reaksi III terdapat endapan coklat dan pada tabung reaksi IV
terdapat endapan merah bata.
c. Uji Steroid dan Terpenoid
Ekstrak kental batang dan daun evodia masing-masing dimasukkan ke dalam
tabung reaksi dan ditetesi Lieberman-Bouchard. Ekstrak dinyatakan
mengandung terpenoid dan steroid jika pada tabung reaksi terbentuk larutan
biru kehijauan.
d. Uji Saponin
Ekstrak kental batang dan daun evodia masing-masing dimasukkan ke dalam
tabung reaksi. Kemudian ditambahkan aquadest, alkohol 96% dan HCl 6% 2
N, dikocok selama beberapa detik. Ekstrak dinyatakan mengandung saponin
3.4.4. Peremajaan Biakan Murni dan Penyiapan Biakan Mikroba Uji
Mikroba uji (S. mutans, S. dysenteriae dan C. albicans) diperoleh dari
laboratorium Mikrobiologi FMIPA Universitas Sumatera Utara. Mikroba uji
tersebut, diremajakan pada media padat agar miring dengan cara menggoreskan
jarum ose yang mengandung S. mutans, S. dysenteriae dan C. albicans secara
aseptis. Kemudian tabung reaksi ditutup dengan kapas dan diinkubasi selama 48
jam pada suhu 37oC. Penyiapan biakan mikroba uji dilakukan dengan membuat
suspensi mikroba, yaitu dengan mengambil koloni mikroba uji, kemudian
dimasukkan ke dalam larutan NaCl 0,9 % dan disesuaikan dengan kekeruhan Mc.
Farland (1x108 CFU/ml). Kemudian diambil 0,1 ml suspensi mikroba uji dan
dimasukkan ke dalam tabung reaksi steril kemudian ditambahkan 9,9 ml larutan
NaCl 0,9%, divortex sampai homogen, sehingga diperoleh suspensi mikroba 106
CFU/ml (Fatimah dkk, 2006). Peremajaan biakan murni dan penyiapan mikroba
uji dapat dilihat pada Lampiran 2 hal. 43.
3.4.5. Uji Aktivitas Antimikroba Ekstrak Etanol Batang dan Daun Evodia terhadap Pertumbuhan S. mutans, S. dysenteriae dan C. albicans
Pengujian ekstrak etanol batang dan daun evodia, menggunakan kertas
cakram kosong (Oxoid, Inggris) yang memiliki diameter 6 mm. Cakram
dimasukkan ke dalam cawan Petri kosong steril. Larutan ekstrak yang telah
diencerkan dengan konsentrasi 5%, 10%, 20%, 40% dan 0% sebagai kontrol
negatif (DMSO). Masing-masing dipipet sebanyak 10 μl selanjutnya diteteskan
pada permukaan cakram dan ditunggu selama 1 jam hingga larutan berdifusi ke
dalam cakram. Dituangkan sebanyak 10 ml media Mueller Hinton Agar (MHA)
ke dalam cawan Petri steril dan dibiarkan memadat. Dicelupkan cotton bud steril
pada suspensi mikroba uji dan diusapkan secara perlahan-lahan pada permukaan
media secara merata, selanjutnya dibiarkan mengering selama beberapa menit.
Dengan menggunakan pinset, cakram yang telah ditetesi ekstrak tanaman dengan
konsentrasi yang berbeda diletakkan secara teratur pada permukaan media uji.
Untuk pembanding digunakan cakram yang mengandung antijamur standart
nistatin 20,6 µg dan antibakteri standart kloramfenikol 30 µg. Kemudian
Aktivitas ekstrak tumbuhan dapat dilihat dengan adanya zona hambat (daerah
bening) di sekitar cakram. Diameter zona hambat diukur dengan menggunakan
jangka sorong (Bawa, 2011). Uji aktivitas ekstrak etanol batang dan daun evodia
dapat dilihat pada Lampiran 3 hal. 44.
3.4.6. Penentuan Konsentrasi Hambat Minimum (KHM) Ekstrak Etanol
Batang dan Daun Evodia terhadap Pertumbuhan S. mutans,
S. dysenteriae dan C. albicans
Pengujian Konsentrasi Hambat Minimum (KHM) ekstrak etanol batang
dan daun Evodia dilakukan dengan metode difusi cakram. Nilai KHM
menunjukkan konsentrasi terendah komponen antimikroba dimana tidak terjadi
pertumbuhan mikroba pada masa inkubasi 24 jam. Dalam penelitian ini,
konsentrasi ekstrak etanol batang dan daun evodia yang dicoba 1-4 %,
BAB 4
HASIL DAN PEMBAHASAN
4.1. Skrining Fitokimia Ekstrak Etanol Batang dan Daun Evodia
Hasil uji skrining fitokimia ekstrak etanol batang dan daun evodia dengan
berbagai pereaksi tertera di Tabel 4.1 di bawah ini:
Tabel 4.1. Hasil Skrining Fitokimia Batang Evodia dan Daun (Euodia ridleyi Horch.)
Metabolit Sekunder Pereaksi Batang Daun
Alkaloid Meyer - -
Keterangan : (-): Tidak terdapat senyawa, (+) : sedikit, (++): sedang, (+++): banyak
Dari Tabel 4.1 di atas dapat dilihat hasil skrining fitokimia ekstrak etanol batang
dan daun evodia. Ekstrak etanol batang evodia mengandung senyawa metabolit
sekunder seperti alkaloid, flavonoid, steroid dan terpenoid. Ekstrak etanol daun
evodia mengandung metabolit sekunder seperti alkaloid, flavonoid, dan saponin.
Secara keseluruhan dari kedua ekstrak tersebut, memiliki metabolit sekunder
terbanyak dari golongan senyawa alkaloid dan flavonoid.
Penelitian ini menggunakan pelarut etanol karena memiliki kemampuan
dalam mengekstrak senyawa metabolit sekunder. Menurut Agoes (2007), senyawa
yang dapat larut dalam etanol diantaranya adalah flavonoid, alkaloid, dan saponin
serta senyawa aktif lainnya.
Senyawa metabolit sekunder telah banyak digunakan sebagai bahan obat
aromatis sebagai antibakteri. Golongan terpenoid juga memiliki kemampuan
untuk menghambat mikroba. Salah satu contoh terpenoid yang dapat menghambat
mikroba yaitu golongan triterpenoid dan monoterpenoid (Lenny, 2006; Silaban,
2009; Waji dan Andis, 2009).
Dalimunthe (2009) mengatakan, ada beberapa mekanisme senyawa
antimikroba yaitu, sebagai antimetabolit, menghambat sintesis dinding sel,
menghambat fungsi kerja membran sel, menghambat sintesis protein dan
menghambat asam nukleat.
Flavonoid memiliki struktur fenolik yang mengandung satu gugus
hidroksil. Dalam menghambat mikroba, flavonoid dapat berikatan dengan
membran ekstraseluler dan protein. Sehingga sel bakteri mengalami kebocoran
dan tidak dapat bereproduksi. Mekanisme terpenoid dalam menghambat mikroba
belum diketahui dengan pasti, tetapi diduga dapat berikatan membran sel bakteri
oleh senyawa yang bersifat lipofilik. Senyawa lipofilik berikatan dengan senyawa
lipid pada bakteri sehingga dapat menembus lapisan dinding sel bakteri. Selain
senyawa flavonoid dan terpenoid, alkaloid dan saponin juga dapat menghambat
mikroorganisme. Adapun mekanisme alkaloid sebagai antimikroba yaitu dengan
mengganggu sintesis DNA dan dinding sel sedangkan saponin, dengan cara
merusak membran sel, sehingga menyebabkan kebocoran sel yang akhirnya
memacu terjadinya kematian sel (Ciocan dan Bara, 2007; Cowan 1999; Hotmauli,
2010).
4.2.Uji Antagonis Ekstrak Etanol Batang Evodia terhadap Pertumbuhan
S. mutans, S. dysenteriae dan C. albicans
Hasil uji antagonis ekstrak batang evodia terhadap S. mutans, S. dysenteriae, dan
C. albicans secara in vitro menunjukkan bahwa ekstrak batang evodia berpotensi
menghambat pertumbuhan ketiga mikroba tersebut. Data hasil uji antagonis
batang evodia terhadap mikroba dapat dilihat pada Lampiran 4 hal. 45 dan
Lampiran 5 hal. 46. Diameter zona hambat ekstrak batang evodia dapat dilihat
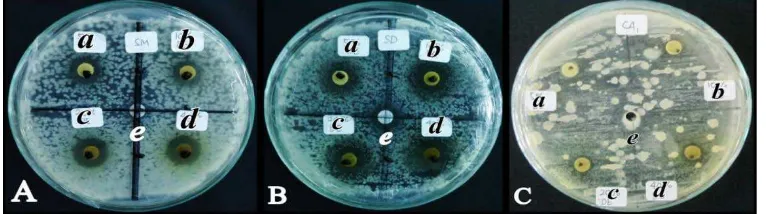
Gambar 4.1. A. Zona Hambat Ekstrak Etanol Batang Evodia terhadap Pertumbuhan S. mutans setelah 24 jam inkubasi B. S. dysenteriae setelah 24 jam inkubasi C. C. albicans setelah 48 jam inkubasi dengan konsentrasi a=5%, b=10%, c=20%, d=40% dan e=0% pada Media Mueller Hinton Agar pada suhu 37 º C
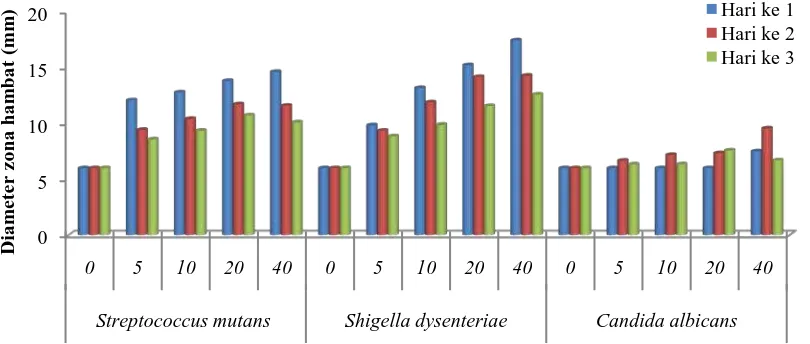
Dari Gambar 4.1, rata-rata diameter zona hambat terbesar dihasilkan oleh
konsentrasi 40%. Hasil pengukuran diameter zona hambat menunjukkan bahwa
ekstrak batang evodia memiliki kemampuan menghambat lemah terhadap
C. albicans (7,51 mm), sedang terhadap S. mutans (14,59 mm) dan kuat terhadap
S. dysenteriae (17,42 mm). Penentuan kriteria ini menurut David dan Stout (1971)
yang mengatakan bahwa ketentuan kekuatan daya antibakteri sebagai berikut:
daerah hambatan 20 mm atau lebih termasuk sangat kuat, daerah hambatan 10-20
mm kategori kuat, daerah hambatan 5-10 mm kategori sedang, dan daerah
hambatan 5 mm atau kurang termasuk kategori lemah.
Gambar 4.2. Diamater Zona Hambat Ekstrak Etanol Batang Evodia terhadap Pertumbuhan S. mutans, S. dysenteriae dan C. albicans Hari 1,2 dan 3
Streptococcus mutans Shigella dysenteriae Candida albicans
D
Konsentrasi Ekstrak Etanol Batang Evodia (%)
Berdasarkan Gambar 4.2, dapat dilihat bahwa diameter zona hambat ekstrak
etanol batang evodia terhadap pertumbuhan S. mutans dan S. dysenteriae, dari
hari 1, 2 dan 3 mengalami penurunan, tetapi tidak terjadi pada C. albicans.
Penurunan diameter zona hambat yang terjadi disebabkan oleh waktu. Menurut
David dan Stout (1971), waktu kontak ekstrak dengan mikroba uji juga
mempengaruhi diameter zona hambat. Penurunan zona hambat ini dipengaruhi
oleh kondisi laju difusi ekstrak yang berkurang pada hari berikutnya. Pada saat
berdifusi, konsentrasi ekstrak etanol batang evodia pada tepi zona mengecil,
sehingga memberikan kesempatan untuk pertumbuhan mikroba.
Mikroorganisme mengalami beberapa fase tumbuh yaitu fase lag, fase log,
fase stationer, dan fase kematian. Fase lag terjadi sebagai awal proses
pertumbuhan C. albicans. Fase ini dipengaruhi oleh jenis C. albicans, umur
C. albicans dalam stok awal, dan komposisi media tumbuhnya. Menurut
Falahudin (2008), fase lag C. albicans terjadi pada hari ke-0 sampai hari ke-1, dan
fase log C. albicans terjadi pada hari ke-1 sampai hari ke-2. Pertumbuhan
C. albicans yang tidak merata pada hari ke-1 di media mengakibatkan diameter
zona hambat tidak terlihat secara sempurna. Diameter zona hambat C. albicans
dapat terlihat pada hari ke-2, yaitu pada saat seluruh permukaan media telah
ditumbuhi oleh koloni C. albicans.
Kemampuan ekstrak etanol batang evodia pada ketiga mikroorganisme
tersebut berbeda-beda. Perbedaan ini dipengaruhi oleh struktur dinding sel
mikroba. Berdasarkan penelitian yang dilakukan oleh Dewi (2010), bakteri G +
cenderung lebih sensitif terhadap antibakteri, karena struktur dinding sel bakteri
G + lebih sederhana dibandingkan dengan struktur dinding sel bakteri G -
sehingga memudahkan senyawa antibakteri untuk masuk kedalam bakteri G +.
Hasil uji antagonis ekstrak etanol batang evodia terhadap pertumbuhan
terhadap S. mutans, S. dysenteriae, dan C. albicans terdapat perbedaan. Ekstrak
etanol batang evodia lebih efektif terhadap S. dysenteriae dibandingkan dengan
S. mutans dan C. albicans. Perbedaan efek ekstrak etanol batang evodia ini dapat
dipengaruhi oleh senyawa metabolit sekunder yang terkandung dalam ekstrak
Berdasarkan Tabel 4.1 hal. 19, ekstrak etanol batang evodia memiliki
senyawa flavonoid, alkaloid, terpenoid, dan steroid. Dinding sel bakteri G -
contohnya S. dysenteriae, memiliki dinding sel berlapis tiga yang tersusun atas
lipopolisakarida, peptidoglikan dan lipid dengan kadar yang tinggi (11-22%).
Menurut Dewi (2010), flavonoid yang bersifat polar dapat berikatan dengan
peptidoglikan yang juga bersifat polar. Setelah lapisan peptidoglikan dapat
ditembus oleh flavonoid, senyawa terpenoid dan steroid yang bersifat lipofilik
akan menembus lapisan lipid. Kemudian alkaloid akan mengganggu sintesis
DNA.
Hasil uji statistik One Way Annova diameter zona hambat kontrol positif
(kloramfenikol 30 µg) dengan berbagai ekstrak etanol batang evodia terhadap
pertumbuhan S. mutans menunjukkan nilai signifikan 0,000 (p < 0,05).
Berdasarkan hasil uji statistik menunjukkan bahwa kontrol positif dan konsentrasi
ekstrak etanol batang evodia baik konsentrasi 0%, 5%, 10%, 20% dan 40% telah
menunjukkan aktivitas yang berbeda terhadap pertumbuhan S. mutans.
Uji statistik dilanjutkan dengan uji Post Hoc Bonferroni untuk melihat
perlakuan mana yang memiliki efek yang sama atau berbeda dan efek yang
terkecil sampai efek yang terbesar antara satu dengan yang lainnya. Uji Post Hoc
Bonferroni hari pertama antara kontrol positif dengan konsentrasi ekstrak batang
evodia menunjukkan perbedaan yang nyata (p < 0,05). Kontrol positif yang
digunakan adalah kloramfenikol 30 µg yang menunjukkan diameter zona hambat
sebesar 25,05 mm pada hari pertama. Berdasarkan hasil uji Post Hoc Bonferroni,
kontrol positif lebih efektif atau lebih berpengaruh dibandingkan dengan variasi
konsentrasi ekstrak etanol batang evodia terhadap pertumbuhan S. mutans .
Uji statistik Post Hoc Bonferroni hari pertama terhadap diameter zona
hambat S. mutans untuk konsentrasi 0% dengan konsentrasi 5%, 10%, 20% dan
40% menunjukkan adanya perbedaan yang nyata (p < 0,05). Hasil uji statistik
berarti bahwa konsentrasi 0% dengan konsentrasi 5%, 10%, 20% dan 40%
memberikan efek yang berbeda terhadap pertumbuhan S. mutans. Uji statistik
Post Hoc Bonferroni untuk konsentrasi 5% (12,04 mm), konsentrasi 10% (12,75
mm), konsentrasi 20% (13,78 mm), dan konsentrasi 40% (14,59 mm) tidak ada
ekstrak etanol batang evodia memiliki kemampuan yang sama terhadap
pertumbuhan S. mutans.
Hasil uji statistik Kruskal-Wallis diameter zona hambat antara kontrol
positif (kloramfenikol) dengan berbagai ekstrak etanol batang evodia terhadap
pertumbuhan S. dysenteriae menunjukkan perbedaan yang nyata dengan nilai
signifikan 0,000 (p < 0,05). Hasil uji menunjukkan bahwa kontrol positif dan
konsentrasi ekstrak batang evodia baik konsentrasi 0%, 5%, 10%, 20% dan 40%
telah memberikan aktivitas yang berbeda dalam menghambat pertumbuhan
S. dysenteriae.
Uji statistik dilanjutkan dengan uji statistik Mann-Whitney untuk melihat
perlakuan mana yang lebih efektif dalam menghambat pertumbuhan
S. dysenteriae. Uji statistik Mann-Whitney hari pertama antara kontrol positif dan
berbagai ekstrak etanol batang evodia menunjukkan adanya perbedaan yang nyata
(p < 0,05). Kontrol positif yang digunakan adalah kloramfenikol 30 µg. Diameter
zona hambat yang dihasilkan oleh kontrol positif ini adalah diameter yang paling
besar yaitu 27,86 mm pada hari pertama. Hasil uji statistik menunjukkan bahwa
kontrol positif memiliki kemampuan yang lebih baik dibandingkan dengan variasi
konsentrasi ekstrak etanol batang evodia dalam menghambat pertumbuhan
S. dysenteriae.
Uji statistik Mann-Whitney hari pertama terhadap diameter zona hambat
S. dysenteriae untuk konsentrasi 0% dengan konsentrasi 5%, 10%, 20% dan 40%
menunjukkan perbedaan yang nyata. Hasil uji statistik menunjukkan bahwa
terdapat perbedaan efek antara konsentrasi 0% dengan konsentrasi ekstrak lainnya
dalam aktivitasnya terhadap pertumbuhan S. dysenteriae. Uji Mann-Whitney hari
pertama untuk konsentrasi 5% (9,81 mm) dengan konsentrasi 10% (13,15 mm),
konsentrasi 20% (15,19 mm) dan konsentrasi 40% (17,42 mm) menunjukkan
perbedaan yang nyata. Hasil uji statistik menunjukkan bahwa konsentrasi ekstrak
etanol batang evodia memiliki efek terhadap pertumbuhan S. dysenteriae.
Hasil uji statistik Kruskall-Wallis diameter zona hambat antara kontrol
positif (nistatin 20,6 µg) dengan berbagai konsentrasi ekstrak etanol batang evodia
terhadap pertumbuhan C. albicans pada hari pertama menunjukkan tidak ada
terjadi karena koloni C. albicans yang tidak tumbuh merata, sehingga zona
hambat ekstrak belum dapat terlihat secara sempurna. Namun pada hari ke-2,
menunjukkan perbedaan yang signifikan 0,001 (p < 0,05). Berdasarkan hasil uji
statistik menyatakan bahwa ekstrak etanol batang evodia dan kontrol positif
memberikan efek terhadap pertumbuhan C. albicans.
Uji statistik dilanjutkan dengan uji Whitney. Uji statistik
Mann-Withney diameter zona hambat pada hari ke-2 untuk kontrol positif (6,34 mm)
dengan konsentrasi 5% (6,68 mm), 10% (7,19 mm), dan 20% (7,35 mm)
menunjukkan tidak ada perbedaan yang nyata (p > 0,05). Namun menunjukkan
perbedaan yang nyata (p < 0,05) dengan konsentrasi 40% (9,57 mm). Berdasarkan
hasil uji statistik berarti konsentrasi ekstrak etanol batang evodia 40% lebih
efektif dibandingkan dengan kontrol positif dalam menghambat pertumbuhan
C. albicans. Notasi hasil uji statistik diameter zona hambat ekstrak etanol batang
evodia terhadap pertumbuhan S. mutans, S. dysenteriae dan C. albicans dapat
dilihat pada Lampiran 12 hal. 53.
4.3.Uji Antagonis Ekstrak Etanol Daun Evodia terhadap Pertumbuhan
S. mutans, S. dysenteriae dan C. albicans
Hasil uji antagonis ekstrak daun evodia terhadap S. mutans, S. dysenteriae, dan
C. albicans secara in vitro menunjukkan ekstrak daun evodia berpotensi
menghambat pertumbuhan mikroba. Data hasil uji antagonis daun evodia terhadap
mikroba dapat dilihat pada Lampiran 6 hal. 47 dan Lampiran 7 hal. 48. Diameter
zona hambat ekstrak daun evodia dapat dilihat pada Gambar 4.3. (A, B, dan C).
Gambar 4.3. A. Zona Hambat Ekstrak Etanol Daun Evodia terhadap Pertumbuhan
S. mutans setelah 24 jam inkubasi B. S. dysenteriae setelah 24 jam
inkubasi C. C. albicans setelah 48 jam inkubasi dengan Konsentrasi a=5%, b=10%, c=20%, d=40% dan e=0% pada Media Mueller
Dari Gambar 4.3, rata-rata diameter zona hambat terbesar terdapat pada
konsentrasi 40%. Menurut David dan Stout (1971), hasil pengukuran diameter
zona hambat menunjukkan bahwa ekstrak etanol daun evodia memiliki aktivitas
yang lemah terhadap C. albicans (8,35 mm), sedang terhadap S. dysenteriae
(14,66 mm) dan kuat terhadap S. mutans (18,44 mm).
Gambar 4.4. Diamater Zona Hambat Ekstrak Etanol Daun Evodia terhadap Pertumbuhan S. mutans, S. dysenteriae dan C. albicans Hari 1, 2 dan 3
Berdasarkan Gambar 4.4, dapat dilihat bahwa diameter zona hambat ekstrak
etanol batang evodia terhadap pertumbuhan S. mutans dan S. dysenteriae, dan
C. albicans dari hari 1, 2 dan 3 mengalami penurunan. Penurunan diameter zona
hambat ini dipengaruhi oleh waktu. Menurut David dan Stout (1971), waktu
kontak ekstrak dengan mikroba uji juga mempengaruhi diameter zona hambat.
Penurunan zona hambat ini dipengaruhi oleh kondisi laju difusi ekstrak yang
berkurang pada hari berikutnya. Pada saat berdifusi, konsentrasi ekstrak etanol
batang evodia pada tepi zona terlalu kecil, sehingga memberikan kesempatan
untuk pertumbuhan mikroba.
Kemampuan ekstrak etanol daun evodia dalam menghambat pertumbuhan
ketiga mikroorganisme ini berbeda-beda. Perbedaan kemampuan ekstrak ini
dipengaruhi oleh penyusun dinding sel mikroorganisme. Hasil uji ekstrak etanol
0
Streptococcus mutans Shigella dysenteriae Candida albicans
D
Konsentrasi Ekstrak Etanol Daun Evodia (%)
Hari ke 1
Hari ke 2
daun evodia menunjukkan bahwa ekstrak lebih efektif dalam menghambat
pertumbuhan bakteri G + yaitu S. mutans dibandingkan dengan bakteri G - yaitu
S. dysenteriae dan jamur C. albicans.
Menurut Lathifah (2008), senyawa metabolit sekunder seperti flavonoid
yang bersifat polar lebih mudah menembus dinding sel bakteri G + (S. mutans),
karena struktur dinding sel bakteri ini berlapis tunggal dan tersusun atas
peptidoglikan (protein dan gula) serta lipid dengan kadar rendah (1-4%), sehingga
ekstrak tumbuhan lebih mudah menembus bakteri ini. Dinding sel bakteri G –
(S. dysenteriae) lebih sulit ditembus senyawa yang bersifat polar karena struktur
dinding sel bakteri ini berlapis tiga yang tersusun atas lipopolisakarida,
peptidoglikan dan lipid dengan kadar yang tinggi (11-22%).
Kusumaningtyas (2009), mengemukakan komposisi dinding sel
C. albicans yang terdiri dari fibrillar layer, mannoprotein, β-gulcan, kitin, dan
membram plasma. Ekstrak etanol daun evodia memiliki senyawa metabolit
sekunder yaitu saponin. Saponin mempunyai aktivitas sebagai antifungal dengan
mekanisme kerjanya yaitu dengan cara merusak membran sel, sehingga
menyebabkan kebocoran sel yang akhirnya memacu terjadinya kematian sel.
Hasil uji statistik Kruskall-Wallis diameter zona hambat antara kontrol
positif (kloramfenikol 30 µg) dengan berbagai konsentrasi ekstrak etanol daun
evodia terhadap pertumbuhan S. mutans menunjukkan perbedaan yang nyata
dengan signifikan 0,000 (p < 0,05). Hasil uji statistik menunjukkan bahwa kontrol
positif dan berbagai konsentrasi ekstrak tersebut memberikan pengaruh terhadap
pertumbuhan S. mutans.
Uji statistik dilanjutkan dengan menggunakan uji statistik Mann-Whitney
untuk melihat perlakuan yang paling efektif dalam menghambat pertumbuhan
S. mutans. Dari hasil uji Mann-Whitney hari pertama diameter zona hambat antara
kontrol positif (25,05 mm) dengan konsentrasi 0% (6 mm), 5% (11,13 mm), 10%
(13,71 mm), 20% (17,07 mm) dan 40% (18,44 mm) menunjukkan ada perbedaan
yang nyata. Apabila dibandingkan dengan konsentrasi ekstrak daun evodia,
kontrol positif menghasilkan aktivitas yang kuat dengan diameter zona hambat
terbesar. Berdasarkan hasil uji statistik berarti kloramfenikol 30 µg lebih efektif
Uji statistik Mann-Whitney hari pertama diameter zona hambat antara
ekstrak konsentrasi 0% dengan konsentrasi 5%, 10%, 20% dan 40% menunjukkan
perbedaan yang nyata. Berdasarkan hasil uji statistik menunjukkan bahwa ekstrak
dengan konsentrasi 0% memiliki pengaruh yang tidak sama dengan konsentrasi
5%, 10%, 20%, dan 40%. Uji statistik Mann-Whitney konsentrasi 5% dan 10%
serta 10%, 20%, dan 40% tidak menunjukkan perbedaan yang nyata. Hasil uji
statistik menunjukkan bahwa konsentrasi ekstrak 5% dan 10% serta 10%, 20%
dan 40% memiliki efek yang sama.
Hasil uji statistik Kruskall-Wallis diameter zona hambat antara kontrol
positif (kloramfenikol 30 µg) dengan berbagai konsentrasi ekstrak etanol daun
evodia terhadap pertumbuhan S. dysenteriae menunjukkan perbedaan yang nyata
(p < 0,05) dengan signifikan 0,000. Hal ini berarti kontrol positif dengan variasi
konsentrasi ekstrak berpengaruh terhadap pertumbuhan S. dysenteriae.
Uji statistik dilanjutkan dengan uji Mann-Whitney untuk melihat
konsentrasi yang paling efektif dalam menghambat pertumbuhan S. dysenteriae.
Hasil uji Mann-Whitney hari pertama antara kontrol positif (27,86 mm) dengan
konsentrasi 0% (6 mm), 5% (9,54 mm), 10% (11,26 mm), 20% (13,10 mm) dan
40% (14,66 mm) menunjukkan perbedaan yang nyata. Hasil uji statistik
menunjukkan bahwa antara kontrol positif dan konsentrasi ekstrak memiliki
aktivitas yang berbeda terhadap S. dysenteriae.
Hasil uji statistik Mann-Whitney hari pertama antara kontrol positif dengan
konsentrasi 40% memiliki perbedaan yang nyata (p < 0,05). Hasil uji statistik
menunjukkan kontrol positif memiliki aktivitas menghambat mikroba lebih baik
daripada konsentrasi 40%. Berdasarkan kriteria David dan Stout (1971), kontrol
positif memiliki aktivitas yang sangat kuat terhadap S. dysenteriae.
Berdasarkan Gambar 4.4 hal. 26, dapat dilihat bahwa ekstrak etanol daun
evodia dapat menghambat pertumbuhan C. albicans dengan diameter zona hambat
terbesar dihasilkan oleh konsentrasi 40% dengan diameter 8,35 mm, dan diameter
zona hambat terkecil dihasilkan oleh konsentrasi 5 % (6,88 mm). Pada konsentrasi
0 %, tidak menunjukkan zona hambat yang ditandai dengan diameter 6 mm (sama
Hasil uji statistik Kruskall-Wallis diameter zona hambat antara kontrol
positif (nistatin 20,6 µg) dengan variasi konsentrasi ekstrak etanol daun evodia
menunjukkan perbedaan yang nyata (p < 0,05) dengan signifikan 0,009. Hal ini
menunjukkan bahwa kontrol positif dan variasi ekstrak etanol daun evodia
memiliki pengaruh terhadap pertumbuhan C. albicans.
Uji statistik dilanjutkan dengan uji Mann-Whitney untuk mengetahui
perlakuan yang paling efektif dalam menghambat pertumbuhan C. albicans. Hasil
uji statistik Mann-Whitney hari pertama antara kontrol positif (6,34 mm) dengan
konsentrasi 0% (6 mm) dan 5% (6,88 mm), dan menunjukkan tidak ada perbedaan
yang nyata. Namun konsentrasi 0% dengan konsentrasi 10% (7,72 mm), 20 %
(7,52 mm), dan 40% (8,35 mm) menunjukkan perbedaan yang nyata. Hasil uji
statistik menunjukkan bahwa ekstrak pada konsentrasi 10%, 20%, dan 40%
merupakan konsentrasi yang memiliki efek yang sama dalam menghambat
pertumbuhan C. albicans. Notasi hasil uji statistik diameter zona hambat ekstrak
etanol daun evodia terhadap pertumbuhan S. mutans, S. dysenteriae dan
C. albicans dapat dilihat pada Lampiran 13 hal. 54.
Ekstrak etanol batang evodia dan ekstrak etanol daun evodia memiliki
kemampuan untuk menghambat S. mutans, S. dysenteriae, dan C. albicans.
Ekstrak etanol batang evodia lebih efektif dalam menghambat S. dysenteriae
dibandingkan dengan ekstrak etanol daun evodia. Perbedaan efek antimikroba
kedua ekstrak dipengaruhi oleh perbedaan metabolit sekunder yang terkandung
dalam ekstrak. Hasil skrining fitokimia pada Tabel 4.1 hal. 19, menunjukkan
ekstrak etanol batang evodia memiliki senyawa steroid dan terpenoid yang tidak
terkandung dalam ekstrak etanol daun evodia. Mekanisme terpenoid dan steroid
dalam menghambat mikroorganime adalah dengan cara berikatan dengan lipid.
Kadar lipid pada bakteri G – lebih banyak, sehingga dengan adanya senyawa
terpenoid dan steroid, lapisan lipid bakteri dapat ditembus, dan dapat
mengakibatkan kebocoran sel.
Ekstrak etanol daun evodia lebih efektif dalam menghambat S. mutans dan
C. albicans dibandingkan dengan ekstrak etanol batang evodia. Perbedaan efek
antimikroba kedua ekstrak dipengaruhi oleh perbedaan metabolit sekunder yang
menunjukkan ekstrak etanol daun evodia mengandung senyawa saponin
sedangkan pada ekstrak etanol batang tidak. Saponin merupakan senyawa yang
dapat merusak membran sel pada S. mutans dan C. albicans.
4.4. Uji Kontrol Positif Kloramfenikol (30 µg), Nistatin (20,6 µg) dan Kontrol Negatif (DMSO) terhadap Pertumbuhan S. mutans, S.
dysenteriae, dan C. albicans
Hasil uji kontrol positif dan kontrol negatif terhadap pertumbuhan S. mutans,
S. dysenteriae dan C. albicans secara in vitro dapat pada Gambar 4.5. (A, B, dan
C). Data hasil uji kontrol positif dan negatif dapat dilihat pada lampiran 8 hal. 49.
Gambar 4.5. Zona Hambat DMSO (a) dan Kloramfenikol (30 µg) (b) terhadap
Pertumbuhan A. S. mutans setelah 24 jam inkubasi, B.
S. dysenteriae setelah 24 jam inkubasi, dan Zona Hambat DMSO
(a) dan Nistatin (20,6 µg) (b) C. terhadap Pertumbuhan C. albicans setelah 48 jam inkubasi pada Media Mueller Hinton Agar pada suhu 37º C
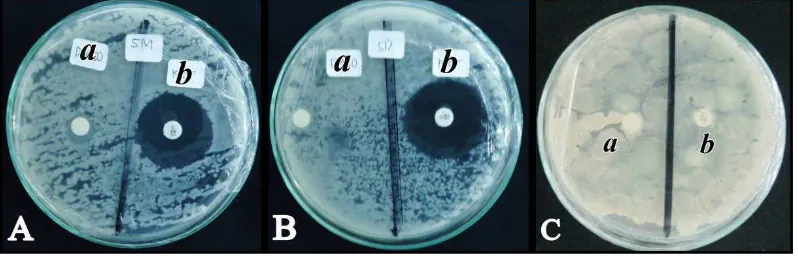
Berdasarkan Gambar 4.5 (A. a), (B. a), dan (C. a) menunjukkan bahwa kontrol
negatif (DMSO) tidak menghasilkan zona hambat. Gambar 4.5. (A. b), dan (B. b),
menunjukkan bahwa kontrol positif (kloramfenikol 30 µg) menunjukkan zona
hambat yang besar yaitu pada hari pertama diameter zona hambat masing-masing
adalah 25,05 mm dan 27,86 mm. Untuk Gambar 4.5. (C. b) kontrol positif
(nistatin 20,6 µg) menunjukkan zona hambat yang kecil sebesar 6,34 mm pada
hari pertama.
Kontrol negatif berfungsi untuk mengetahui apakah pelarut juga
berpotensi untuk menghambat atau membunuh mikroba. Kontrol positif
yang kuat ini digunakan sebagai perbandingan potensi ekstrak batang dan daun
evodia dalam menghambat pertumbuhan mikroba.
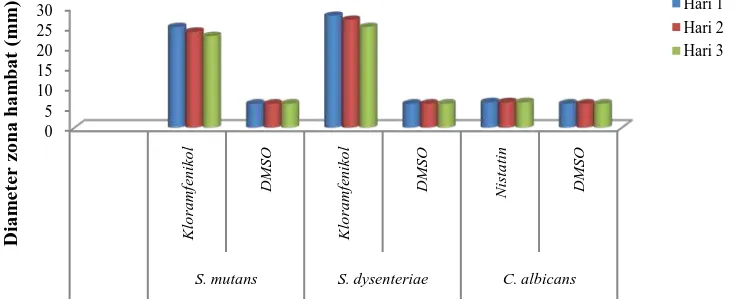
Gambar 4.6. Diameter Zona Hambat Kontrol Positif Kloramfenikol (30 µg), Nistatin (20,6 µg) dan Kontrol Negatif (DMSO) terhadap Pertumbuhan S. mutans, S. dysenteriae dan C. albicans pada Hari 1, 2 dan 3
Berdasarkan Gambar 4.6, dapat dilihat pada hari pertama kontrol positif
(kloramfenikol 30 µ g) terhadap S. mutans dan S. dysenteriae menghasilkan
diameter zona hambat masing-masing sebesar 25,05 mm dan 27,86 mm serta
menurun pada hari ke-2 dan hari ke-3. Pada hari pertama kontrol positif (nistatin
20,6 µg) menghasilkan dimeter zona hambat sebesar 6,34 mm dan tidak
menunjukkan perubahan pada hari ke-2 dan hari ke-3. Menurut kriteria kekuatan
daya antimikroba yang dinyatakan David dan Stout (1971), kloramfenikol 30 µg
memiliki kemampuan daya hambat yang sangat kuat terhadap S. mutans dan
S. dyenteriae, sedangkan nistatin 20,6 µg memiliki kemampuan daya hambat yang
lemah. Kontrol negatif (DMSO) terhadap ketiga mikroba tidak menunjukkan
diameter zona hambat yang ditandai dengan diameter zona hambat 6 mm (sebesar
diameter cakram).
Menurut Reapina (2007), DMSO adalah pelarut yang umum digunakan
sering digunakan dalam analisis atau percobaan, karena kemampuannya untuk
melarutkan senyawa baik polar ataupun non polar. DMSO memiliki sifat seperti
emulsifier. Rumus senyawa DMSO adalah (CH3)2SO. DMSO merupakan cairan
bening dengan bau seperti bawang putih. DMSO memiliki titik didih 189o C dan
dapat larut dalam air. DMSO bersifat stabil dalam kondisi normal dan bersifat 0
S. mutans S. dysenteriae C. albicans
higrokopis. DMSO efektif sebagai pelarut dalam proses ekstraksi dan pemisahan
komponen aroma (flavor), serta dalam fraksinasi komponen tidak jenuh dari suatu
bahan.
Menurut Tekur (2007), kloramfenikol juga disebut chloromycetin.
Kloramfenikol diperoleh dari Streptomyces venezuelae. Kloramfenikol
mengandung gugus nitrobenzena. Mekanisme kloramfenikol sebagai antimikroba
adalah dengan menghambat sintesis protein bakteri dengan mengikat reversibel ke
50 S subunit ribosom dan menghambat pembentukan ikatan peptida. CLSI (2006),
menyatakan zona hambat pada mikroba yang dihasilkan oleh kloramfenikol 30 µg
akan dikatakan resisten apabila diameter zona hambat yang dihasilkan adalah ≤ 12
mm. Diameter zona hambat yang dihasilkan oleh kloramfenikol dalam penelitian
ini > 12 mm, yang menunjukkan S. mutans dan S. dysenteriae tidak bersifat
resisten.
Namun untuk C. albicans, kontrol positif yang diujikan tidak
menunjukkan daya hambat. Pada Gambar 4.5. (C. b) terlihat bahwa nistatin lemah
dalam menghambat pertumbuhan C. albicans karena hanya sedikit ditemukannya
zona bening.
Menurut Lubis (2008), nistatin merupakan antibiotik yang digunakan
sebagai antijamur, diisolasi dari Streptomyces nourse pada tahun 1951 dan
merupakan antibiotik grup poliene. Nistatin tidak bersifat toksik tetapi dapat
menimbulkan mual, muntah dan diare jika diberikan dengan dosis tinggi. Nistatin
bekerja dengan mengikat sterol dalam membran sel sehingga mengakibatkan
perubahan permeabilitas membran dan selanjutnya kebocoran komponen
intraseluler.
Dalam penelitian Astuti (2012), resisten C. albicans mengalami resisten
terhadap nistatin sebesar 2,95 %. Resisten terhadap antifungal golongan poliene
jarang terjadi selama pengobatan, tetapi yang umum terjadi isolat menunjukkan
konsentrasi hambat minimum yang tinggi. Apabila terjadi resisten terhadap
antifungi golongan poliene, diakibatkan karena membran yang tidak biasa,
sehingga mengakibatkan penurunan efektivitas poliene dalam menembus
4.5. Uji Konsentrasi Hambat Minimum (KHM) terhadap Pertumbuhan
S. mutans, S. dysenteriae, dan C. albicans
Hasil uji antagonis ekstrak etanol batang dan daun evodia dalam menghambat
S. mutans, S. dysenteriae dan C. albicans secara in vitro menunjukkan bahwa
ekstrak tersebut sudah mampu menghambat pertumbuhan ketiga mikroorganisme
ini pada konsentrasi 5%. Untuk mengetahui konsentrasi hambat minimum dari
ekstrak tersebut, maka konsentrasi ekstrak diturunkan dengan pengenceran.
Konsentrasi yang digunakan untuk uji KHM ini adalah 1%, 2%, 3% dan 4%.
Grafik hasil pengujian KHM ekstrak batang dan daun evodia dapat dilihat pada
Gambar 4.7 dan 4.8.
Gambar 4.7. Diameter Zona Hambat Minimum Ekstrak Etanol Batang Evodia terhadap Pertumbuhan S. mutans, S. dysenteriae, dan C. albicans pada Hari 1, 2 dan 3
Gambar 4.8. Diameter Zona Hambat Minimum Ekstrak Etanol Daun Evodia terhadap Pertumbuhan S. mutans, S. dysenteriae, dan C. albicans pada Hari 1, 2 dan 3
S. mutans S. dysenteriae C. albicans
D
Konsentrasi Ekstrak Etanol Batang Evodia (%)
Hari ke 1
S. mutans S. dysenteriae C. albicans
D
Konsentrasi Ekstrak Etanol Daun Evodia (%)
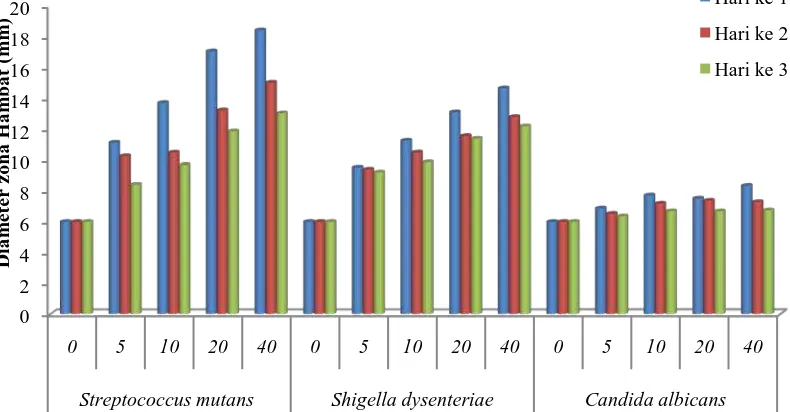
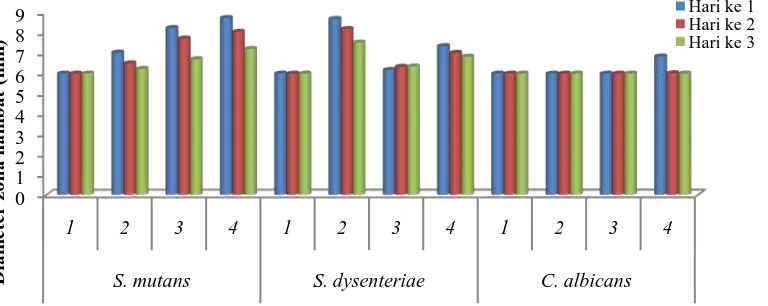
Berdasarkan Gambar 4.7, ekstrak etanol batang evodia pada konsentrasi 1% tidak
dapat menghambat pertumbuhan S. mutans dan S. dysenteriae, pada konsentrasi
2% dapat menghambat S. mutans dengan diameter zona hambat sebesar 7,02 mm
dan menghambat S. dysenteriae dengan diameter zona hambat 8,69 mm. Ekstrak
etanol batang evodia pada konsentrasi 1%, 2%, dan 3% tidak dapat menghambat
pertumbuhan C. albicans, pada konsentrasi 4% dapat menghambat C. albicans
dengan diameter zona hambat 6,85 mm. Berdasarkan pada hasil penelitian diatas,
menunjukkan bahwa konsentrasi hambat minimum ekstrak etanol batang evodia
terhadap S. mutans dan S. dysenteriae adalah 2%, serta terhadap C. albicans
adalah 4%.
Berdasarkan Gambar 4.8, ekstrak etanol daun evodia pada konsentrasi 1%
tidak dapat menghambat pertumbuhan S. mutans, pada konsentrasi 2% dapat
menghambat pertumbuhan S. mutans dengan diameter zona hambat sebesar 7,73
mm. Ekstrak etanol daun evodia pada konsentrasi 1%, 2%, 3% dan 4% tidak dapat
mengambat pertumbuhan S. dysenteriae. Ekstrak etanol daun evodia pada
konsentrasi 1% dan 2% tidak dapat menghambat pertumbuhan C.albicans, namun
pada konsenstrasi 3% ekstrak dapat menghambat pertumbuhan C. albicans
dengan diameter zona hambat sebesar 7,18 mm. Berdasarkan hasil penelitian di
atas, menunjukkan bahwa konsentrasi hambat minimum ekstrak etanol daun
evodia terhadap S. mutans adalah 2%, S. dysenteriae adalah 5%, dan C. albicans
adalah 3%. Data uji konsentrasi hambat minimum ekstrak etanol batang dan daun
evodia dapat dilihat pada Lampiran 9 hal. 50, Lampiran 10 hal. 51 dan Lampiran
11 hal. 52.
Hasil uji KHM ekstrak etanol batang dan daun evodia terhadap
pertumbuhan S. mutans, S. dysenteriae dan C. albicans bervariasi. Konsentrasi
Hambat Minimum ekstrak etanol batang dan daun evodia terhadap pertumbuhan
S. mutans adalah sama yaitu pada konsentrasi 2%. Dalam menghambat
pertumbuhan S. dysenteriae, KHM ekstrak etanol batang evodia lebih rendah
daripada ekstrak etanol daun evodia serta dalam menghambat pertumbuhan C.
albicans, KHM ekstrak etanol daun evodia lebih rendah daripada ekstrak etanol
Nilai KHM ekstrak etanol batang sereh wangi dan ektrak etanol daun
sereh wangi terhadap S. mutans adalah 6 % (Suprianto, 2008). Nilai KHM ekstrak
etanol bawang putih terhadap S. mutans sebesar 5% (Adi dkk., 2010). Kedua nilai
KHM tersebut lebih besar dibandingkan dengan nilai KHM ekstrak etanol batang
evodia dan ekstrak etanol daun evodia yang didapat.
Nilai KHM ekstrak daun pacar air terhadap C. albicans ATCC 10231
sebesar 12,5 % (Hotmauli, 2010). Nilai KHM ekstrak daun pacar air lebih besar
dibandingkan dengan nilai KHM ekstrak etanol batang evodia dan ekstrak etanol
daun evodia. Nilai KHM ekstrak etanol jambu biji daging buah putih 0,03 %
(Adnyana dkk., 2004). Nilai KHM ini lebih kecil dibandingkan dengan KHM
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Hasil skrining ekstrak etanol batang evodia menunjukkan bahwa ekstrak
tersebut mengandung senyawa alkaloid, flavonoid, steroid, dan terpenoid serta
hasil skrining ekstrak etanol daun evodia menunjukkan bahwa ekstrak tersebut
mengandung senyawa alkaloid, flavonoid dan saponin. Ekstrak etanol batang dan
daun evodia memiliki aktivitas antimikroba terhadap S. mutans, S. dysenteriae,
dan C. albicans. Zona hambat terbesar dihasilkan pada konsentrasi 40%.
Konsentrasi Hambat Minimum ekstrak etanol batang evodia terhadap S. mutans
dan S. dysenteriae adalah 2%, sedangkan untuk C. albicans adalah 4%.
Konsentrasi hambat Minimum ekstrak etanol batang evodia terhadap S. mutans
adalah 2%, S. dysenteriae adalah 5%, dan C. albicans adalah 3%.
5.2. Saran
Sebaiknya dilakukan penelitian untuk mengetahui senyawa spesifik yang
berkhasiat sebagai antimikroba pada batang dan daun evodia (Euodia ridleyi
Horch.) dan aktivitas antimikroba terhadap mikroorganisme patogen lainnya.
Serta dilakukan penelitian lebih lanjut mengenai uji toksisitas dari ekstrak batang
dan daun evodia untuk mengetahui dosis yang aman digunakan sebagai alternatif
BAB 2
TINJAUAN PUSTAKA
2.1. Karakteristik Streptococcus mutans
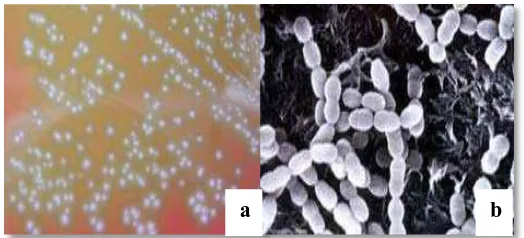
Streptococcus merupakan bakteri berbentuk bulat dengan susunan bentuk rantai.
Bakteri ini ditemukan oleh Billroth (1874). Menurut Dzen dkk., (2003),
berdasarkan tipe hemolisis pada lempeng agar darah (blood agar plate), bakteri
ini dibedakan menjadi 3 yaitu yang pertama Streptococcus hemolitik alfa (Gambar
2.1.a.) (Partial hemolytic Streptococcus). Koloni Streptococcus ini pada BAP
(Blood Agar Plate) memberikan zona hemolisis yang sempit, artinya sel darah
merah pada inner zone dari BAP tidak mengalami hemolisis secara komplit. Pada
sekitar koloni sering didapatkan warna kehijauan (disebabkan oleh pembentukan
reductans of haemoglobin) (Dzen dkk., 2003). S. mutans (Gambar 2.1.b.)
termasuk ke dalam grup viridans (Antony et al., 2010).
Golongan kedua adalah Streptococcus hemolitik beta (Total Hemolytic
Streptococcus) disebut grup piogenes. Pada BAP bakteri ini dapat menyebabkan
zona hemolisis yang luas pada sekitar koloni. Golongan ketiga Streptococcus
hemolitik gamma (Non-Hemolytic Streptococcus). Pada BAP bakteri ini tidak
mengadakan hemolisis sama sekali (Dzen dkk., 2003).
Gambar 2.1.a. Koloni Streptococcus pada media agar darah (α-hemolysis)
(Way et al., 2007) b. S. mutans mikroskopis (Yulia, 2006)
Menurut Krieg et al., (2010), taksonomi S. mutans adalah sebagai berikut:
Kingdom : Bacteria
Filum : Bacteroidetes
Kelas : Bacteroidia
Ordo : Bacteroidales
Famili : Porphyromonadaceae
Genus : Streptococcus
Spesies : Streptococcus mutans
2.2. Karakteristik Shigella dysenteriae
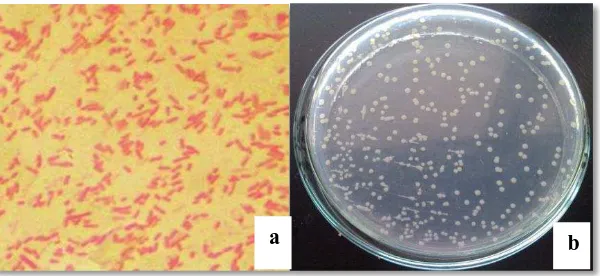
Shigella termasuk kedalam golongan bakteri gram negatif (Gambar 2.2.a.),
berbentuk batang, dan non-motil. Shigella terdiri dari empat jenis yaitu
S. dysenteriae, S. flexneri, S. boydii dan S. sonnei. Semua jenis Shigella
menyebabkan diare akut. S. dysenteriae (Gambar 2.2.b.) dikenal sebagai Shiga
bacillus, berbeda dengan yang lainnya karena menghasilkan sitotoksin (Shiga
toksin), sehingga menyebabkan penyakit yang bersifat fatal apabila dibandingkan
dengan spesies Shigella yang lain, dan lebih resisten terhadap antimikroba
(Legros dan Pierce, 2005).
Gambar 2.2.a. Hasil pewarnaan gram S. dysenteriae (Santoso dkk., 2009) b. Koloni S. dysenteriae pada media Nutrient Agar (Roekistiningsih dkk., 2010)
Menurut Krieg et al., (2010), taksonomi S. dysenteriae adalah sebagai
berikut:
Kingdom : Bacteria
Filum : Verrucomicroba
Kelas : Opitutae
Ordo : Opitutales
Famili : Enterobacteriaceae
Genus : Shigella
Spesies : Shigella dysenteriae
2.3. Karakteristik Candida albicans
Candida albicans merupakan fungi dimorfik yang sering ditemukan pada mulut,
dan vagina (Irianto, 2002). C. albicans juga merupakan fungi patogen oportunistik
yang menyebabkan berbagai penyakit pada manusia seperti sariawan, lesi pada
kulit, vulvavaginitis, candiduria dan gastrointestinal candidiasis. Mekanisme
infeksi C. albicans sangat kompleks termasuk adhesi dan invasi, perubahan
morfologi dari bentuk sel khamir ke bentuk filamen (hifa), pembentukan biofilm
dan penghindaran dari sel-sel imunitas inang. Kemampuan C. albicans untuk
melekat pada sel inang merupakan faktor penting pada tahap permulaan kolonisasi
dan infeksi. Perubahan fenotip menjadi bentuk filamen memungkinkan
C. albicans untuk melakukan penetrasi ke epithelium dan berperan dalam infeksi
dan penyebaran C. albicans pada sel inang. C. albicans juga dapat membentuk
biofilm yang diduga terlibat dalam penyerangan sel inang dan berhubungan
dengan resistensi terhadap antifungi (Kusumaningtyas, 2009).
Candida memperbanyak diri dengan membentuk tunas, dan spora jamur
disebut blastospora atau sel ragi (sel khamir) (Gambar 2.3.b.). Jamur ini
membentuk hifa semu (pseudohypha) yang sebenarnya adalah rangkaian
blastospora, yang juga dapat bercabang-cabang. Berdasarkan bentuk-bentuk jamur
tersebut maka dikatakan bahwa Candida menyerupai ragi (yeast-like), tidak
membentuk simpai dan tidak berpigmen serta mudah tumbuh pada medium
dengan variasi pH yang luas (Suprihatin, 1982).
Candida albicans dapat menginfeksi berbagai bagian tubuh, meliputi
mulut, vagina, kulit dan paru-paru. Organisme ini biasanya tampil sebagai sel
seperti khamir lonjong yang membiak dengan bertunas. Akan tetapi, mungkin
juga terlihat pada daerah yang terinfeksi hifa berbentuk benang dan pseudohifa
(yang terdiri atas sel-sel khamir memanjang yang tetap menempel satu sama lain).
Khamir ini mudah tumbuh pada suhu 25 sampai 37º C pada agar glukosa
Sabauraud (Volk dan Wheeler, 2006).
Koloni C. albicans (Gambar 2.3.a.) berwarna krem, pucat, dan halus. Laju
pertumbuhan yang cepat dalam tiga hari. Pada agar tepung jagung suhu 25ºC,
besar, berdinding tebal, terminal, dan memiliki chlamydospore (Chander, 2002).
Ukuran sel C. albicans 2-5µ x 3-6 µ hingga 2-5,5 µ x 5-28,5 µ tergantung pada
umurnya. Spesies Candida dapat dibedakan berdasarkan kemampuan fermentasi
dan asimilasi terhadap larutan glukosa, maltosa, sakrosa, galaktosa dan laktosa
(Suprihatin, 1982). Penambahan 0,1 g klorida tetrazolium triphenyl (TTC) untuk
100 ml medium sangat memudahkan identifikasi dari genus Candida karena
koloni ragi menghasilkan warna yang berbeda seperti putih, mawar merah dan
violet (Safitri dan Sinta, 2010). Sedangkan pada agar CHROM candida, koloni
C. albicans adalah memiliki karakteristik dengan koloni berwarna hijau muda ke
hijau kebiruan (Chander, 2002).
Menurut Alexopoulos dan Mims (1979), taksonomi C. albicans adalah
sebagai berikut:
Kingdom : Fungi
Divisi : Amastigomycota
Sub Divisi : Deuteromycotina
Kelas : Deuteromycetes
Ordo : Cryptococcales
Famili : Cryptococcaceae
Genus : Candida
Spesies : Candida albicans
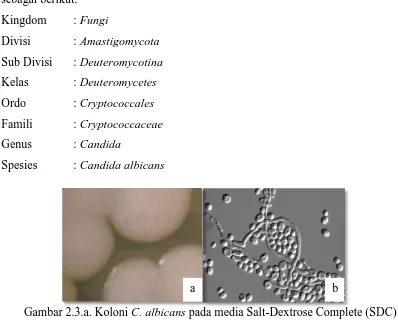
Gambar 2.3.a. Koloni C. albicans pada media Salt-Dextrose Complete (SDC) b. Sel C. albicans secara mikroskopis (Berman dan Peter, 2002)
2.4. Patogenitas Streptococcus mutans
Streptococcus mutans merupakan bakteri dominan penyebab karies pada gigi.
Karies gigi (kavitasi) (Gambar 2.4.) adalah daerah yang membusuk di dalam gigi,
terjadi akibat suatu proses bertahap yang dapat melarutkan email (permukaan gigi
sebelah luar yang keras) dan terus berkembang ke bagian dalam gigi sehingga
pada akhirnya menyebabkan gigi tanggal (Yulia, 2006).
Gigi merupakan tempat bagi menempelnya mikroba. Ada dua spesies
bakteri yang dijumpai berasosiasi dengan permukaan gigi yaitu S. sanguins dan
S. mutans yang merupakan penyebab utama kerusakan gigi, atau pembusuk gigi.
Tertahannya kedua spesies ini pada permukaan gigi merupakan akibat sifat
adhesif baik dari glikoprotein liur maupun dari polisakarida bakteri. Sifat
menempel ini sangat penting bagi kolonisasi bakteri di dalam mulut. Glikoprotein
liur mampu menyatukan bakteri-bakteri tertentu dan berikatan pada permukaan
gigi. S. mutans maupun S. sanguins menghasilkan polisakarida ekstraseluler yang
disebut dekstran yang bekerja sebagai zat perekat, mengikat sel-sel bakteri
menjadi satu dan juga melekatkan diri pada permukaan gigi. Tertahannya bakteri
dapat juga terjadi karena terperangkapnya secara mekanis di celah-celah gusi atau
di dalam lubang atau retakan gigi (Irianto, 2002).
Gambar 2.4. Karies Gigi (Hale, 2004)
2.5. Patogenitas Shigella dysenteriae
Penyakit yang disebabkan oleh Shigella ditularkan melalui makanan atau air.
Organisme Shigella menyebabkan disentri basiler yang menghasilkan respons
inflamasi pada kolon melalui enterotoksin dan invasi bakteri. Secara klasik,
Shigellosis timbul dengan gejala adanya nyeri abdomen, demam, BAB berdarah,
dan feses berlendir. Gejala awal terdiri dari demam, nyeri abdomen dan diare cair
tanpa darah, kemudian feses berdarah setelah 3-5 hari kemudian. Lamanya gejala
rata-rata pada orang dewasa adalah 7 hari, pada kasus yang lebih parah dapat
terjadi selama 3-4 minggu. Shigellosis kronis dapat menyerupai kolitis ulseratif,