PERUBAHAN MORFOLOGI SEL DAN KEMAMPUAN FERMENTASI Saccharomyces sp. ISOLAT DAGING BUAH DURIAN (Durio zibethinus Murr.)
YANG DIRADIASI DENGAN SINAR ULTRAVIOLET
SKRIPSI
RIRIS D.H PURBA 050805051
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PENGESAHAN
JUDUL : PERUBAHAN MORFOLOGI SEL DAN KEMAMPUAN FERMENTASI Saccharomyces sp. ISOLAT DAGING BUAH DURIAN (Durio zibethinus Murr.) YANG DIRADIASI DENGAN SINAR ULTRAVIOLET
NAMA : RIRIS D.H PURBA NIM : 050805051
NO Nama Keterangan Tanggal Tanda
Tangan 1. Drs. Kiki Nurtjahja, M.Sc.
NIP. 197109102000122001
Dosen
Pembimbing 1
2. Dra. Nunuk Priyani, M.Si. NIP. 19404281996032001
Dosen
Pembimbing 2
3. Yurnaliza, S.si, M.Si. NIP. 197108180320011999
Dosen Penguji 1 4. Dra. Elimasni, M.Si.
NIP. 196505241991032001
PERSETUJUAN
Judul : PERUBAHAN MORFOLOGI SEL DAN KEMAMPUAN FERMENTAS Saccharomyces sp. ISOLAT DARI DAGING BUAH DURIAN (Durio zibethinus Murr.) YANG DIRADIASI DENGAN SINAR ULTRAVIOLET
Kategori : SKRIPSI
Nama : RIRIS D.H PURBA Nomor Induk Mahasiswa : 050805051
Program Studi : SARJANA (S1) BIOLOGI Departemen : BIOLOGI
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Diluluskan di
Medan, 14 Maret 2010 Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dra. Nunuk Priyani, M.sc Drs. Kiki Nurtjahja, M.Sc
NIP. 19404281996032001 NIP. 197109102000122001
Diketahui/Disetujui oleh
Departemen Biologi FMIPA USU Ketua,
PERNYATAAN
PERUBAHAN MORFOLOGI SEL DAN KEMAMPUAN FERMENTASI Saccharomyces sp. ISOLAT DAGING BUAH DURIAN (Durio zibethinus Murr.)
YANG DIRADIASI DENGAN SINAR ULTRAVIOLET
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, 14 Maret 2010
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Tuhan yang Maha Esa atas limpahan berkat ,kekuatan dan kemudahan sehingga penulis dapat menyelesaikan skripsi dengan “PERUBAHAN MORFOLOGI SEL DAN KEMAMPUAN FERMENTASI Saccharomyces sp. ISOLAT DAGING BUAH DURIAN (Durio zibethinus Murr.) YANG DIRADIASI DENGAN SINAR ULTRAVIOLET” dalam waktu yang telah ditentukan.
Ucapan terima kasih penulis sampaikan kepada Drs. Kiki Nurtjahja, M.Sc. selaku Dosen Pembimbing I dan Ibu Dra. Nunuk Priyani, M.Sc. selaku Dosen Pembimbing II atas bimbingan, arahan dan bantuannya dalam pembuatan skripsi ini. Penulis juga mengucapkan terima kasih kepada Ibu Yurnaliza, S.Si, M.Si dan Ibu Dra. Elimasni, M.Si sebagai tim Penguji I dan II atas arahan dan saran dalam penyempurnaan penulisan skripsi ini.
Ucapan terima kasih juga penulis sampaikan kepada Dr. Dwi Suryanto, M.Sc sebagai Ketua Departemen Biologi FMIPA USU dan Dra. Nunuk Priyani, M.Sc sebagai Sekretaris Departemen Biologi FMIPA USU, Prof. Erman Munir, M.Sc sebagai Kepala Laboratorium Mikrobiologi, Seluruh Staf Pengajar Departemen Biologi FMIPA USU. Bapak Sukirmanto, Ibu Nurhasni Muluk, Ibu Roslina Ginting dan Bang Erwin selaku staf pegawai Departemen Biologi FMIPA USU.
Ungkapan terima kasih yang tak ternilai penulis ucapkan kepada Kedua Orang tua saya yang telah memberikan dorongan, semangat serta material, Ayahanda K. Purba dan Ibunda D. Aritonang, kepada Saudara-saudaraku k’Yobel, k’Natanael, b’Anthon, k’Erin, k’Minda, k’Sarni, k’rinto dan keponaanku (Muel, natanael, Yobel, Novel, Yezekiel, Erin, Elton dan Tiara) buat dorongan, semangat dan juga material sehingga penulis dapat menyelesaikan skipsi ini. Dan juga teman-temanku kost 7b (k’Nida, k’Dedeb, k’Bunga, Dora, Bina, Tina).
yang telah banyak membantu dalam penyelesaian skripsi ini yang tidak dapat penulis sebutkan namanya satu per satu. Semoga Tuhan Yang Maha Esa akan membalasnya.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh karena itu penulis mengharapkan kritik dan saran yang bersifat membangun demi kesempurnaan skipsi ini. Akhir kata semoga skripsi ini bermanfaat bagi kita semua.
Medan, 13 Maret 2010
ABSTRAK
THE EFFECT OF ULTRAVIOLET LIGHT TO THE MORFOLOGI STRUCTURE OF Saccharomyces sp. ISOLATED FROM DURIAN (Durio
zibethinus)
ABSTRACT
DAFTAR ISI
Judul Halaman
Persetujuan i
Penyataan ii
Pengesahan iii
Penghargaan iv
Abstrak vi
Abstract vii
Daftar Isi viii
Daftar Tabel ix
Daftar Gambar x
Daftar Lampiran xi
Bab 1. Pendahuluan 1.1 Latar Belakang 1
1.2 Permasalahan 2
1.3 Tujuan penelitian 2
1.4 Hipotesis Penelitian 3
1.5 Manfaat Penelitian 3
Bab 2. Tinjauan Pustaka 2.1 Radiasi Ultraviolet 4
2.2 Mutasi 5
2.2 Saccharomyces sp. 7
2.3 Fermentasi Alkohol 9
2.4Fermentasi Durian 12
Bab 3. Bahan dan Metode 3.1Waktu dan Tempat 14
3.2Sterilisasi Alat 14
3.3Isolasi Saccharomyces sp. Dari daging durian 14 3.4Pemberian Sinar Ultraviolet Terhadap Pada Kultur Saccharomyces sp. 15 3.5 Fermentasi Daging Buah Durian Oleh Isolat Saccharomyces sp. 15
3.6 Penentuan Gula Reduksi 16
3.7 Metode Penelitian 17
5.1 Kesimpulan 29
5.2 Saran 29
Daftar Pustaka 30
DAFTAR TABEL
Halaman Tabel 4.1 Pengamatan Morfologi Koloni Saccharomyces sp. 19
Setelah Radiasi Ultraviolet
.
Tabel 4.2 Pengamatan Morfologi Sel Saccharomyces sp. 20 Setelah Radiasi Ultraviolet
DAFTAR GAMBAR
Halaman Gambar 4.1 Saccharomyces sp. yang diisolasi dari daging 18
buah durian pada media PDA. a. koloni, b. morfologi sel vakuola (1), dinding sel (2) dengan perbesaran 1000x. sGambar 4.2 Morfologi sel Saccharomyces sp. dengan perlakuan
sinar radiasi ultraviolet dengan intensitas 20 Watt dengan waktu 21 30 detik (a), 40 detik (b), 50 detik (c), 60 detik (d) dengan
perbesaran 1000x
Gambar 4.3 Morfologi sel Saccharomyces sp. dengan perlakuan sinar 23 radiasi ultraviolet dengan intensitas 30 Watt dengan waktu 30 detik (a), 40 detik (b), 50 detik (c), 60 detik (d) dengan perbesaran 1000x. Gambar 4.4 Morfologi sel Saccharomyces sp. dengan perlakuan sinar 24
radiasi ultraviolet dengan intensitas 30 Watt dengan waktu 30 detik (a), 40 detik (b), 50 detik (c) dengan perbesaran 1000x.
DAFTAR LAMPIRAN
Lampiran 1. Komposisi media PDA (Potato Dextro Agar) 37 Lampiran 2. Penentuan Glukosa, Fruktosa dan Gula Invert 38
dalam Suatu Bahan Dengan Metode Luff Shrool.
ABSTRAK
THE EFFECT OF ULTRAVIOLET LIGHT TO THE MORFOLOGI STRUCTURE OF Saccharomyces sp. ISOLATED FROM DURIAN (Durio
zibethinus)
ABSTRACT
BAB 1
PENDAHULUAN
1.1Latar Belakang
Istilah khamir umumnya digunakan untuk menyebut bentuk-bentuk yang menyerupai jamur dari kelompok Ascomycetes yang tidak berfilamen tetapi uniseluler dengan bentuk ovoid atau spheroid. Khamir ada yang bermanfaat dan ada pula yang membahayakan manusia. Saccharomyces cerevisiae merupakan mikroorganisme yang sangat dikenal oleh masyarakat luas sebagai ragi roti (baker’s yeast). Ragi roti ini digunakan dalam pembuatan makanan, minuman dan juga dalam industri etanol. Fermentasi khamir banyak digunakan dalam pembuatan roti, bir, wine, vinegar, dan sebagainya (Hidayat et al., 2006).
Saccharomyces sp. dapat memproduksi ataupun melakukan metabolisme pada
asam-asam organik sehingga mengubah keasaman dan profil flavor dari suatu produk. Etanol merupakan salah satu produk industri yang penting di Indonesia, yang diproduksi dari bahan baku glukosa, tetes tebu dan pati. Namun demikian, dewasa ini bahan-bahan baku tersebut cukup sulit diperoleh. Oleh karena itu, perlu dikembangkan penelitian-penelitian dasar yang nantinya mampu diterapkan dalam industri etanol. Penelitian-penelitian yang dapat dikembangkan antara lain adalah memanipulasi mikroorganisme yang berperan dalam proses fermentasi etanol dengan cara pemberian sinar ultraviolet (Puspaningsih, 2009).
Mutan Saccharomyces sp. ini sering ditandai dengan warna askospora yang berwarna hitam dan penelitian lain menyebutkan terjadi proses perubahan fungsi DNA pada mitokondria.
Valadi, et al., (1998) telah pula melaporkan upaya peningkatan produksi etanol menggunakan mutan Saccharomyces cerevisiae pada lokus gen pengkode enzim gliserol-3-fosfat dehodrogenase. Mutasi pada DNA mitokondria akan menghasilkan mutan yang disebut mutan petite. Mutan petite mampu meningkatkan kadar etanol 30 - 40% dibanding tipe liarnya.
Saccharomyces sp. secara komersial adalah banyak tetapi untuk mendapatkan
yang strain liarnya diperoleh dari daging buah durian. Diduga pada durian banyak terdapat Saccharomyces sp. karena pada durian banyak mengandung gula, dan juga pada durian yang sudah matang telah terjadi adanya proses fermentasi. Durian juga merupakan buah yang banyak terdapat di kota Medan, sehingga untuk mendapatkannya sangat mudah. Saccharomyces sp. yang diisolasi dari daging buah durian akan diamati dan kemudian diperlakukan dengan penyinaran ultraviolet, yang diharapkan kemampuan fermentasinya lebih tinggi dibandingkan dari strain liarnya.
1.2Permasalahan
Saccharomyces sp. strain liar diperoleh dari daging buah durian yang ditumbuhkan pada media PDA padat. Bagaimana pengaruh sinar radiasi ultraviolet dengan intesitas dan lama waktu yang berbeda terhadap perubahan morfologi sel dan kemampuan fermentasi Saccharomyces sp. isolate dari daging buah durian (Durio zibethinus Merr.)
1.3 Tujuan penelitian
1.4Hipotesis penelitian
Radiasi sinar ultraviolet pada intensitas dan lama penyinaran yang berbeda akan menghasilkan mutan pada Saccharomyces sp. dengan kemampuan menghasilkan gula reduksi yang berbeda.
1.5Manfaat penelitian
BAB 2
TINJAUAN PUSTAKA
2.1 Radiasi Ultraviolet
Sejak ditemukan sinar X oleh Rontgent dan sinar ultraviolet orang mulai menyelidiki pengaruhnya terhadap bakteri atau mikroba yang lain. Sinar ultraviolet mempunyai panjang gelombang 210-310 nm, sinar X, sinar (gamma), sinar (beta), sinar α dan sinar netron dapat dihasilkan oleh radiasi gelombang elektromagnetik. Penyerapan energi dari radiasi dengan sinar ultraviolet dapat menimbulkan dua hal penting dalam bakteri yaitu kematian sel atau terjadi mutasi (Wanto & Arief, 1981).
Ultraviolet digunakan untuk penelitian genetika, keperluan medis, juga untuk sterilisasi karena dapat membunuh bakteri. Ultraviolet banyak ditemukan pada sinar matahari, tapi ultraviolet ini dipancarkan keluar oleh ozon di atmosfer (Snustad & Gardner, 1984). Radiasi ultraviolet tidak memiliki cukup energi untuk menginduksi ionisasi seperti sinar X. Namun ultraviolet mempunyai kemampuan sebagai mutagen dan pada dosis yang tinggi dapat membunuh sel (Lewis, 1997).
Interaksi ultraviolet dengan materi genetik tergantung pada panjang gelombang. Penyerapan energi radiasi pada materi genetik melalui reaksi fotokimia. Pengaruh biologi dari radiasi ultraviolet tergantung panjang gelombang. Radiasi ini dapat menyebabkan kerusakan biologi yang dapat diperbaiki jika panjang gelombang rendah. Walaupun demikian, jika kerusakan yang ditimbulkan besar maka dapat terjadi mutasi permanen. Jika kerusakan terjadi pada gen regulator, kemungkinan menyebabkan karsinogenesis (Mertens & Hammersmith, 1995).
1988). Sinar UV yang berlebihan justru akan mengganggu aktivitas DNA suatu spesies. Untuk dapat bertahan pada kondisi lingkungan yang tidak sesuai, suatu spesies dapat melakukan perubahan materi genetik atau melakukan proses mutasi sehingga fenotif yang muncul tidak lagi sama persis dengan fenotif semula (Tamarin, 1995).
Sinar UV sangat berpengaruh terhadap perkembangan sel. Sel merupakan satuan hidup terkecil yang dapat menderita akibat radiasi. Tanggapan sel atau jaringan terhadap radiasi berbeda-beda, baik yang menyangkut perubahan derajat ketahanan hidup, mutasi ataupun karsinogen (Soedjono, 2003).
2.2 Mutasi
Mutasi ada dua macam yaitu mutasi kromosom dan mutasi gen. Mutasi kromosom terjadi pada proses meiosis, akibat mutasi gamet mempunyai kromosom tidak lengkap atau kromosomnya berlebih. Hal ini menyebabkan terjadinya perubahan-perubahan dalam sifat-sifatnya. Pada mutasi gen terjadi perubahan gen dari kromosom. Hal ini terjadi juga di alam, di mana alam semesta menerima radiasi dari sinar matahari selama bertahun-tahun dan bahkan berabad-abad, maka terjadi jugalah mutasi alamiah. Seperti telah diketahui DNA adalah penyusun kromosom dan kromosom adalah penentu dari sifat-sifat sesuatu makhluk hidup (Wanto & Arief, 1981).
Mikroba menanggapi keadaan lingkungan dan caranya tergantung pada keadaan lingkungan. Bila keadaan lingkungan baik ia akan tumbuh, kalau keadaan tidak baik dia akan merespon dengan cara bertahan (survive) dengan tidak berubah, bertahan dengan perubahan genetika yang disebut mutasi dan mati. Mutasi yang bertahan dengan tidak berubah ini dapat dilakukan dengan beberapa cara misalnya: membentuk spora, mendiamkan diri, menghemat makanan, merusakkan zat yang racun dan membentuk membran, di mana racun tidak dapat masuk ke dalam sel (Wanto & Arief, 1981).
DNA menyerap sinar ultraviolet dengan kuat, penyerapan maksimal DNA terletak pada panjang gelombang 260 nm. Sel dengan cepat terbunuh akibat penyerapan sinar ultraviolet, dan angka laju mutasi yang tinggi terjadi antara sel-sel yang bertahan hidup. Apabila cairan DNA yang diiradiasi dengan sinar ultraviolet, akan terjadi dua jenis perubahan kimia. Pertama-tama ada pembentukan ikatan kovalen antara residu-residu pirimidin yang berdekatan satu sama lain pada untaian yang sama dan membentuk dimmer pirimidin. Kegiatan mutagenik sinar ultraviolet dapat dihubungkan dengan pembentukan dimmer primidin. Pentingnya dimmer pirmidin sebagai sebab mutasi yang diinduksi sinar ultraviolet dibuktikan dengan perlakuan yang mengarah kepada pengeluaran atau pemotongan dimmer mengembalikan sebagian terbesar pengaruh mutagenik sinar ultraviolet. Jika sel-sel bakteri yang diperlakukan dengan sinar ultraviolet segera diiradiasi, misalnya dengan sinar yang tampak dengan kisaran panjang gelombang 300 – 400 nm, maka frekuensi mutasi dan kematian sel kedua-duanya akan sangat menurun, kejadian yang disebut fotoreaktivasi. Proses ini ternyata disebabkan oleh aktifasi oleh sinar dengan panjang gelombang tertentu, yang mengaktifasi enzim yang menghidrolisis dimmer pirimidin (Stanier et al., 1984).
DNA dapat dirusak oleh ultraviolet pada panjang gelombang 254-260 nm, sehingga ultraviolet dapat menginduksi secara langsung akibat penyerapan oleh purin dan pirimidin. Pirimidin umumnya sangat kuat menyerap pada 254 nm dan menjadi sangat reaktif. Beberapa indikasi lain adalah pembentukan timin dimmer (Lewis, 1997).
2.3 Saccharomyces sp.
Istilah khamir umumnya digunakan untuk menyebut bentuk-bentuk yang menyerupai jamur dari kelompok Ascomycetes yang tidak berfilamen tetapi uniseluler dengan bentuk ovoid atau spheroid. Khamir ada yang bermanfaat dan ada pula yang membahayakan manusia. Fermentasi khamir banyak digunakan dalam pembuatan roti, bir, wine, vinegar, dan sebagainya. Khamir yang tidak diinginkan adalah yang ada pada makanan dan menyebabkan kerusakan pada saurkraut, juice buah, sirup, molase, madu, jelly, daging, dan sebagainya (Hidayat et al., 2006).
Yeast adalah salah satu mikroorganisme yang termasuk dalam golongan fungi
Pertumbuhan khamir pada media bahan pangan tersebut sangat tergantung pada sifat fisiologisnya yaitu pada umumnya khamir tumbuh pada kondisi dengan persediaan cukup air artinya tidak yang berlebihan. Dibandingkan dengan bakteri, khamir dapat tumbuh dalam larutan yang pekat misalnya larutan gula atau garam lebih juga menyukai suasana asam dan lebih bersifat menyukai adanya oksigen. Khamir juga tidak mati oleh adanya antibiotik dan beberapa khamir mempunyai sifat antimikroba sehingga dapat menghambat pertumbuhan bakteri dan mould. Adanya sifat-sifat yang tahan pada lingkungan yang stress (garam, asam dan gula) maka dalam persaingannya dengan mikroba lain yeast lebih bisa hidup normal (Brown, 1990).
Oleh karena itu pertumbuhan yeast yang liar sebagai kontaminan perlu diwaspadai dan dikontrol secara ketat sehingga produk-produk fermentasi yang dihasilkan tidak makin menjadi rusak. Di Indonesia dalam hal memproduksi makanan tradisional ataupun makanan fermentasi dengan menggunakan yeast masih belum begitu membudaya jika dibandingkan dengan penggunaan bakteri atau jamur seperti: Rhizopus spp., Aspergillus spp., Penicillium spp., Mucor spp. dan yang lainnya. Bahkan terlihat sangat tertinggal jauh dengan starter yang berasal dari kelompok bakteri asam laktat (BAL) “friendly bacteria” yang biasanya dipakai sebagai Probiotik. Probiotik adalah sekelompok mikroba hidup yang menguntungkan dan digunakan untuk mempengaruhi induk semang melalui perbaikan mikroorganisme dalam saluran pencernaan (Fuller, 1992).
cerevisiae, D. hansenii akan meningkatkan produksi asam asetat, akan tetapi belum
banyak diketahui pada jenis yeast yang lain (Berry & Watson, 1987; Fleet, 1992).
2.4 Fermentasi Alkohol
Fermentasi dapat didefinisikan sebagai perubahan gradual oleh enzim beberapa bakteri, khamir dan jamur. Contoh perubahan kimia dari fermentasi meliputi pengasaman susu, dekomposisi pati dan gula menjadi alkohol dan karbon dioksida, serta oksidasi senyawa nitrogen organik. Industri fermentasi dalam pelaksanaan prosesnya dipengaruhi oleh beberapa faktor yaitu mikrobia, bahan dasar, sifat-sifat proses, pilot-plant, faktor sosial ekonomi (Hidayat et al., 2006).
Alkohol dalam sehari-hari disebut dengan etanol. Alkohol industri atau spritus adalah alkohol untuk keperluan industri tidak dikenakan pajak tinggi dan biasa dicampur dengan methanol dan zat warna metilen biru. Sehingga berwarna untuk menandakan bahwa alkohol itu tidak boleh diminum. Alkohol yang dapat diminum dikenakan pajak tinggi. Sifat-sifat alkohol : berat molekul 46, kerapatan 0,791 gram/ ml pada 20°C, titik lebur -117,3°C, titik didih 78,3°C, titik nyala 372°C, batas keracunan 1000 btj, jenis mutu: kering (anhydrous), 95% dan denaturasi (Wanto & Arief, 1981).
Jamur merupakan mikroba multiseluler yang banyak dimanfaatkan manusia dalam fermentasi. Dalam bidang fermentasi umumnya yang digunakan adalah jamur yang berbentuk hifa dan dikenal dengan sebutan jamur. Contohnya dalam pembuatan tempe, alkohol, angkak dan kecap. Sedang yang dibudidayakan untuk diambil badan buahnya dikenal sebagai cendawan, misalnya jamur tiram, jamur merang, jamur kuping dan sebagainya (Hidayat et al., 2006).
organisme ini meragikan karbohidrat menjadi etanol dan karbon dioksida. Juga pada beberapa bakteri anaerob dan anaerob fakultatif, pada peragian heksosa dan pentosa terjadi alkohol sebagai produk utama atau produk samping. Peragian glukosa menjadi etanol dan karbon dioksida menjadi etanol dan karbon dioksida oleh ragi Saccharomyces cereviceae terjadi melalui alur fruktosa difosfat. Transformasi piruvat
didekarbosilasi menjadi asetaldehida oleh piruvat dekarboksilase dengan diikutsertakan tiamin pirofosfat, asetaldehida oleh alkohol dehidrogenase direduksi dengan NADH2 menjadi etanol (Schlegel, 1994).
Alkohol merupakan bahan kimia yang diproduksi dari bahan baku tanaman yang mengandung pati seperti ubi kayu, ubi jalar, jagung, dan sagu biasanya disebut dengan bioethanol. Ubi kayu, ubi jalar, dan jagung merupakan tanaman pangan yang biasa ditanam rakyat hampir di seluruh wilayah Indonesia, sehingga jenis tanaman tersebut merupakan tanaman yang potensial untuk dipertimbangkan sebagai sumber bahan baku pembuatan bioethanol atau gasohol. Namun dari semua jenis tanaman tersebut, ubi kayu merupakan tanaman yang setiap hektarnya paling tinggi dapat memproduksi ethanol. Selain itu pertimbangan pemakaian ubi kayu sebagai bahan baku proses produksi bio-ethanol juga didasarkan pada pertimbangan ekonomi. Pertimbangan keekonomian pengadaan bahan baku tersebut bukan saja meliputi harga produksi tanaman sebagai bahan baku, tetapi juga meliputi biaya pengelolaan tanaman, biaya produksi pengadaan bahan baku, dan biaya bahan baku untuk memproduksi setiap liter ethanol/bio-ethanol (Kartika, 2000).
Alkohol yang dihasilkan dari proses fermentasi biasanya masih mengandung gas-gas antara lain CO2 (yang ditimbulkan dari pengubahan glucose menjadi
ethanol/bio-ethanol) dan aldehid yang perlu dibersihkan. Gas CO2 pada hasil
fermentasi tersebut biasanya mencapai 35 persen volume, sehingga untuk memperoleh ethanol/bio-ethanol yang berkualitas baik, ethanol/bio-ethanol tersebut harus dibersihkan dari gas tersebut. Proses pembersihan (washing) CO2 dilakukan dengan
menyaring ethanol/bio-ethanol yang terikat oleh CO2, sehingga dapat diperoleh
ethanol/bio-ethanol yang bersih dari gas CO2). Kadar ethanol/bio-ethanol yang
dilaksanakan melalui dua tingkat, yaitu tingkat pertama dengan beer column dan tingkat kedua dengan rectifying column. Definisi kadar alkohol atau ethanol/bio-ethanol dalam % (persen) volume adalah “volume ethanol/bio-ethanol pada temperatur 15°C yang terkandung dalam 100 satuan volume larutan ethanol pada temperatur tertentu (Wasito, 1981).
Asam-asam organik dari produk fermentasi merupakan hasil hidrolisis asam lemak dan juga sebagai hasil aktivitas pertumbuhan bakteri. Penentuan kuantitatif asam organik pada produk fermentasi adalah penting untuk mempelajari kontribusi bagi aroma sebagian besar produk fermentasi, alasan gizi, dan sebagai indikator aktivitas bakteri (Bevilacqua & Califano, 1989). Asam-asam organik juga sering digunakan sebagai acidulants (bahan pengasam) yang dapat menurunkan pH. Sehingga pertumbuhan mikroba berbahaya pada produk fermentasi akan terhambat (Winarno, 1997).
Pada prinsipnya reaksi dalam proses pembuatan alkohol dengan fermentasi adalah sebagai berikut:
C6H12O6 2 C2H2O5 + CO2
jika digunakan disakarida seperti sakarosa, reaksinya adalah sebagai berikut, reaksi hidrólisis reaksi fermentasi sama seperti penggunaan monosakarida.
C12H22O11 + H2O 2 C6H12O6
Khamir tidak dapat langsung menfermentasikan pati. Oleh karena itu tahap yang penting adalah proses sakarifikasi, yaitu perubahan pati menjadi maltosa dan glukosa dengan menggunakan enzim atau asam. Hasil alkohol ditentukan secara langsung dari banyaknya pati yang ada di dalam bahan atau asal isolat (Hidayat et al., 2006).
dikehendaki, dan dapat menghasilkan produk atau senyawa turunan yang bermanfaat bagi kehidupan manusia). Dengan kata lain teknologi fermentasi dapat meningkatkan nilai guna dan nilai sosial ekonomi bahan pangan (Neech et al., 1985).
Mikroba tersebar luas di alam, sehingga proses fermentasi dapat terjadi secara alami. Namun, fermentasi alami mempunyai beberapa kelemahan antara lain prosesnya tidak terkendali sehingga mutu produk yang dihasilkan tidak konstan. Untuk mengatasi hal tersebut diperlukan ragi atau starter yang sesuai dengan bahan dan produk akhir yang diinginkan. Tempe merupakan salah satu produk fermentasi asli Indonesia yang banyak dikembangkan baik oleh peneliti dalam maupun luar negeri, sehingga dari proses fermentasi alami telah dikembangkan sampai proses modern untuk menghasilkan produk generasi lanjutan (Fardiaz, 1986). Sosis dikenal sebagai produk fermentasi dari Eropa, padahal produk sejenis sosis, yaitu urutan merupakan produk fermentasi daging tradisional asal Bali. Perbaikan mutu dengan pengendalian proses pengembangan starter serta modifikasi bahan baku untuk memperluas jangkauan konsumen dan pasar telah diteliti antara lain oleh Hermanianto dan Widowati.
Fermentasi yang terjadi pada gula seperti contohnya: glukosa, fruktosa, sukrosa dan maltosa adalah sebagai reaksi metabolisme kunci dari sebagian besar yeast apabila dikulturkan dalam media yang kondisinya fakultatif anaerob. Hal ini juga disebabkan karena pada umumnya gula terdapat dalam makanan dan minuman sehingga pada kondisi yang seperti itu mudah terjadi proses fermentasi oleh yeast (Berry & Brown, 1987).
2.5 Fermentasi Durian
merupakan keunggulan karena masa berbuah durian menjadi panjang, sehingga durian dapat dipanen hampir sepanjang tahun. Jenis/varietas yang beragam juga akan mengurangi kemungkinan tanaman mati secara serentak akibat serangan hama dan penyakit (Balitbu, 2001).
Pada fermentasi tempoyak dalam penelitian Ekowati (1998) terbentuk asam-asam organik meliputi asam-asam butirat 7,3% untuk substrat daging buah kuning dan 6,2% untuk substrat daging buah putih, asam laktat 1,6% (daging buah putih) dan 1,7% (daging buah kuning). Kadar asam asetat 0,34% untuk daging buah putih dan 0,27% untuk daging buah kuning, serta kadar asam malat dan sitrat kurang dari 0,01%.
Substrat yang dapat digunakan untuk fermentasi dengan menggunakan khamir adalah gula, kandungan gula pada sari buah untuk pembuatan anggur umumnya bervariasi antara 12-25 %. Kadar gula yang baik untuk fermentasi adalah 16 %, hal ini bertujuan untuk mempercepat pertumbuhan khamir pada awal fermentasi (Sai’d, 1987). Selama fermentasi alkohol, lemak dari sari buah akan dipecah oleh enzim lipase menjedi asam lemak yang dapat bereaksi dengan alkohol membentuk ester dan protein dari sari buah akan dipecah oleh enzim protease menjadi peptida dan juga asam amino (Muljohardjo, 1988).
BAB 3
BAHAN DAN METODE
3.1 Waktu Dan Tempat
Penelitian ini dilakukan pada bulan Mei 2009 sampai dengan bulan September di Laboratorium Genetika dan Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan.
3.2 Sterilisasi Alat
Alat-alat yang digunakan yaitu cawan Petri, gelas ukur, glass beaker, Erlenmeyer, pipet serologi, botol, tabung reaksi, di cuci dan dibersihkan, lalu dikeringkan dan dibungkus denan kertas pembungkus untuk disterilkan dalam oven pada suhu 170 oC selama 2 jam.
3.3 Isolasi Saccharomyces sp. dari Durian
Saccharomyces sp. diisolasi dari daging buah durian yang berasal dari Desa Lausalak,
3.4 Pemberian Sinar Ultraviolet terhadap pada kultur Saccharomyces sp
Kultur Saccharomyces sp. yang berumur 5 hari yang ditumbuhkan pada media PDA disinari dengan ultraviolet (merk Sankyo Denki) dengan intensitas 20, 30, 40 Watt masing-masing selam 30, 40, 50, dan 60 detik. Setelah diradiasi kultur Saccharomyces sp. diinkubasi kembali pada inkubator pada suhu 29 oC selama 5 hari dalam keaadaan gelap (Abu Bakar, 1995). Kultur yang telah diperlakukan dengan radiasi ultraviolet diamati perubahanya koloni dan juga morfologi sel. Biakan Saccharomyces sp. diambil sebanyak satu ose dan diencerkan dengan akuades steril dan diletakkan di atas gelas objek dan ditutup dengan gelas penutup kemudian diamati warna koloni, konsistensi, bentuk permukaan, warna sel, ukuran sel dan warna vakuolanya.
3.5 Fermentasi Daging Buah Durian Oleh Isolat Saccharomyces sp.
Fermentasi dilakukan dengan menggunakan biakan Saccharomyces sp. hasil dari radiasi ultraviolet. Sebelum fermentasi dilakukan maka dilakukan penyediaan starter. Penyediaan starter ini dilakukan dengan penghitungan jumlah sel Saccharomyces sp. Pengitungan jumlah sel Saccharomyces sp. ditentukan pada awal fermentasi dengan menggunakan hemositometer. Sebelum sel khamir dihitung, maka terlebih dahulu dilakukan pengenceran sampai konsentrasi 10-4 dimana menurut Amerine et al., (1982) dalam Elimasni (1990) jumlah sel Saccharomyces sp. yang baik dalam fermentasi harus mencapai 107 sel/ml. Suspensi dengan konsentrasi 10-4 ini diteteskan pada hemositometer dan ditutup dengan gelas penutup, kemudian diamati di bawah mikroskop. Untuk menentukan jumlah sel Saccharomyces sp. dalam 1 ml sampel dipakai rumus seperti yang dikemukakan oleh Hadioetomo (1985) dalam Elimasni (1990) yaitu:
Y = X. 50. P Dimana:
Y= jumlah sel khamir dalam 1 ml sampel
Prose penghitungan gula reduksi diawali dari prose fermentasi daging buah durian. Media fermentasi yang digunakan adalah dengan konsentrasi 40 % yang sudah di blender. Hasil blender kemudian disaring dan diambil sarinya lalu diukur kadar gulanya dan didapatkan kadar gula reduksinya 33, 0 mg. Sari daging buah durian dipasteurisasi pada suhu 70-80 0C selama 30 menit. Secara aseptis didinginkan kemudian dimasukkan ke dalam botol-botol fermentasi masing-masing sebanyak 100 ml, ditambahkan 10 ml starter dengan kerapatan sel 107 masing-masing botol fermentasi. Fermentasi dilakukan secara anaerob dengan menutup rapat wadah dengan menggunakan kapas dan aluminium foil. Waktu fermentasi dilakukan selama 7 hari pada suhu kamar (Elimasni, 1990 dan Renita , 2005).
3.6 Penentuan Gula Reduksi
Sampel ditimbang sebanyak 5 gram, dipindahkan ke dalam labu takar 100 ml kemudian ditambahkan 50 ml akuades, ditambahkan Al (OH)3 sebagai bahan
penjernih dengan cara diberi tetes demi tetes sampai penetesan dari reagenesia tidak menimbulkan pengeruhan lagi. Akuades ditambahkan sampai tanda tera labu lalau disaring. Sebanyak 25 ml dari larutan yang mengandung 15-60 mg gula reduksi dan ditambahkan 25 ml larutan Luff-Schoorl dengan 25 ml akuades.
Perlakuan blanko dibuat juga yaitu sebanyak 25 ml larutan Luff-Schoorl dengan 25 ml aquadest dan diperoleh 18,3 mg. Sampel dimasukkan kedalam Erlenmeyer dihubungkan ke pendingin balik, kemudian dipanaskan diupayakan 2 menit sudah mendidih dan pendidihanya dipertahankan selama 10 menit. Kemudian didinginkan dan ditambahkan 15 ml KI 20 %, dan juga dengan hati-hati ditambahkan 25 ml H2SO4 26, 5 %. Kemudian dititrasi dengan larutan Na-thiosulfat 0,1 N memakai indikator pati sebanyak 2-3 ml. Untuk memperjelas perubahan warna pada akhir titrasi maka sebaiknya pati diberikan sampai pada saat titrasi berakhir. Akan didapatkan selisih titrasi contoh sampel. Untuk mendapatkan kadar gula reduksinya adalah:
3.7 Metode Penelitian
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) faktorial yang terdiri atas dua faktor sebagai berikut:
a. Faktor perbedaan intensitas Cahaya, dibedakan atas : A0 = 0 Watt
A1 = 20 Watt A2 = 30 Watt A3 = 40 Watt
b. Faktor perbedaan waktu, yaitu: T0 = 0 detik
T1 = 30 detik T2 = 40 detik T3 = 50 detik T4 = 60 detik
Dengan perlakuan sebagai berikut:
A0T0 A2T1 A3T1
A1T1 A2T2 A3T2
A1T2 A2T3 A3T3
A1T3 A2T3 A3T4
A1T4
BAB 4
HASIL DAN PEMBAHASAN
4.1 Isolasi Saccharomyces sp. Dari Daging Buah Durian
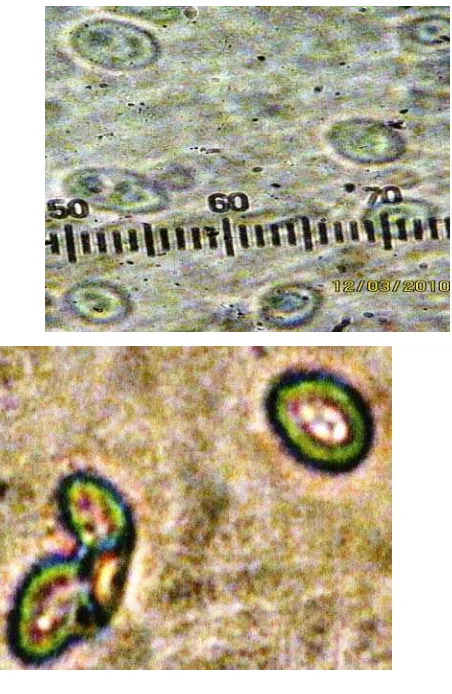
Hasil isolasi khamir dari daging buah durian diperoleh satu isolat. Khamir dikarakterisasi sebagai Saccharomyces sp. berdasarkan ciri-ciri morfologi yang diidentifikasi. Ciri-ciri morfologi tersebut adalah permukaannya licin, berwarna putih, dengan konsistensi lengket, bentuk tepi koloni adalah entire (Gambar 4.1 (a)). Ciri-ciri morfologi sel adalah bentuk oval, dinding selnya tipis, dengan vakuola di bagian tengah berwarna hitam ( Gambar 4.1(b)).
Gambar 4.1 Saccharomyces sp. yang diisolasi dari daging buah durian pada media PDA. a. koloni, b. morfologi sel vakuola (1), dingding sel (2) dengan perbesaran 1000x.
Menurut Narita (2008), Saccharomyces sp. terdiri atas sel anak, sel induk. Bagian tengah berwarna kehitaman, tepi berbentuk entire, permukaan halus atau licin, koloni berwarna putih keruh, permukaan dan tepi rata, dengan diamter 5- 7 µm. Reproduksinya melalui proses difusi yang dikenal sebagai budding.
Menurut Ahmad (2005), Saccharomyces sp. merupakan khamir yang tergolong pada eukariot yang secara morfologi hanya membentuk blastospora berbentuk bulat lonjong, silindris, oval atau bulat telur yang dipengaruhi oleh strainnya. Dapat berkembang biak dengan membelah diri melalui budding cell. Reproduksinya dapat dipengaruhi oleh keadaan lingkungan serta jumlah nutrisi yang tersedia bagi pertumbuhan sel. Penampilan makroskopik mempunyai koloni berbentuk bulat, warna kuning memiliki sel bulat dengan askospora 1-8 buah.
4.2 Perlakuan Sinar Ultraviolet Terhadap Saccharomyces sp. Isolat Daging Buah Durian
Perlakuan dengan sinar ultraviolet dengan intensitas dan waktu yang berbeda-beda diperoleh perubahan terhadap morfologi koloni yaitu warna koloni didominasi oleh warna putih kecuali pada perlakuan A2T1, A2T4, A3T1. Konsistensi pada setiap perlakuan adalah kental kecuali pada perlakuan A1T3 dan A3T1 dengan konsistensi cair. Bentuk dari permukaan koloni dari setiap perlakuan adalah sama yaitu licin (Tabel 4.1).
Tabel 4.1 Pengamatan Morfologi Koloni Saccharomyces sp. Setelah Radiasi Ultraviolet
Perlakuan
Karakteristik Pengamatan
Warna Koloni Konsistensi Permukaan
Kontrol Putih kental Licin
A1T2 Putih kental Licin
A1T3 Putih encer Licin
A1T4 Putih kental Licin
A2T1 Putih kental Licin
A2T2 Putih kekuningan kental Licin
A2T3 Putih kekuningan kental Licin
A2T4 Putih kental Licin
A3T1 Putih encer Licin
A3T2 Putih kekuningan kental Licin
A3T3 Putih kekuningan kental Licin
A3T4 - - -
Ket - : Tidak tumbuh
[image:35.595.107.520.441.714.2]Menurut Mertens & Hammermith (1995), menyatakan bahwa interaksi ultraviolet dengan materi genetik tergantung pada panjang gelombang. Penyerapan energi radiasi ultraviolet pada materi genetik melalui reaksi fotokimia. Pengaruh biologi dari radiasi ultraviolet tergantung pada panjang gelombang. Jika kerusakan yang ditimbulkan besar maka dapat terjadi mutasi permanen.
Tabel 4.2 Pengamatan Morfologi sel Saccharomyces sp. Setelah Radiasi Ultraviolet Perlakuan
Karakteristik Pengamatan
Ukuran sel (milimikron) Bentuk
Kontrol 5 Oval
A1T1 6 Bulat
A1T2 7 Bulat
A1T3 7 Bulat
A1T4 6 oval
A2T1 5 Oval
A2T2 8 Oval
A2T3 7 Bulat
A2T4 7 Bulat dan oval
A3T1 5 Bulat dan oval
A3T2 8 Oval
A3T3 9 Bulat
A3T4 - -
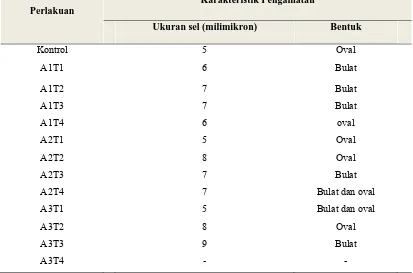
Pengamatan morofologi sel dengan intensitas 20 Watt yang diamati di bawah mikroskop diperoleh ciri-ciri yaitu bentuk sel adalah oval dan ada juga yang berbentuk bulat, sedangkan bagian tengahnya ada yang berbwarna hitam dan juga berwarna coklat, dan ukuran sel pada adalah sekitar 6- 7 milimikron dapat (Gambar 4.3) di bawah ini:
[image:38.595.111.332.84.439.2]
d e
Gambar 4.3 Morfologi sel Saccharomyces sp. strain liar (a), dan morofologi sel setelah perlakuan sinar radiasi ultraviolet dengan intensitas 20 Watt dengan waktu 30 detik (a), 40 detik (b), 50 detik (c), 60 detik (d) dengan perbesaran 1000x.
Menurut Sitompul (2003), bahwa pemberian radiasi ultraviolet 20 watt dengan panjang gelombang di bawah 254 nm memungkinkan menghasilkan mutan yang lebih rendah. Hal ini mungkin disebabkan karena panjang gelombang rendah hanya menembus bagian permukaan, sehingga untuk terjadinya mutasi adalah sangat sedikit. Kemungkinan lain adalah karena kehilangan kemampuan metabolisme tetapi tidak meyebabkan kematian, karena mereka dapat tetap bertahan hidup oleh proses glikolisis sebagai sumber energi seperti glukosa yang ditambahkan pada medium.
nm, sedangkan lampu ultraviolet 20 Watt memiliki panjang gelombang di bawah 254 nm, dan lampu ultraviolet pada 40 Watt memiliki panjang gelombang di atas 254 nm.
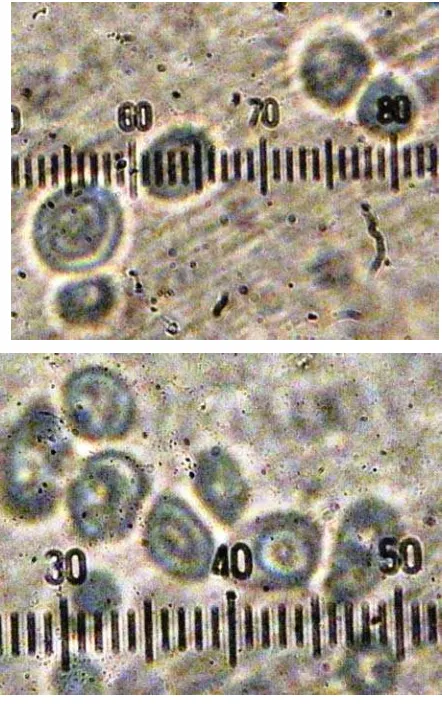
Pengamatan terhadap morofologi sel yang diamati di bawah mikroskop diperoleh ciri-ciri yaitu bentuk sel adalah oval dan ada juga yang berbentuk bulat, vakuola ada yang berwarna hitam dan juga berwarna coklat, dan ukuran sel pada adalah sekitar 5-8 milimikron (Tabel 4.2). Menurut Gull & Olive (1980), radiasi ultraiolet pada panjang gelombang berkisar antara 254-260 nm dapat menyebabkan aberasi kromosom berupa translokasi, inversi, dan non disjunction pada jamur. Pemberian radiasi ultaviolet leih lama atau lebih cepat dari 50 detik akan menghasilkan mutan yang lebih sedikit karena kemungkinan bila waktu pemberian radiasi ultraviolet singkat maka akan tidak semua hifa terlewati.
[image:41.595.143.382.83.430.2]
d e
Gambar 4.5 Morfologi sel Saccharomyces sp. strain liar (a), dan morfologi sel setelah perlakuan sinar radiasi ultraviolet dengan intensitas 30 Watt dengan waktu 30 detik (a), 40 detik (b), 50 detik (c), 60 detik (d) dengan perbesaran 1000x.
Menurut Sitompul (2003), bahwa pemberian radiasi ultraviolet dengan 30 Watt pada Sordaria fimicola dimana mempunyai kelas yang sama dengan Saccharomyces sp. menghasilkan mutan yang lebih tinggi. Menurut Harahap (1994), perubahan fisik yang diikuti perubahan kimia merupakan petunjuk adanya efek biologis dari radiasi ultraviolet yang dapat mengganggu kesimbangan biologis yang sangat sensitif terhadap radiasi sehingga menyebabkan perubahan fisiologis dan morfologi.
40 Watt pada panjang gelimbang diatas 254 nm menghasilkan jumlah mutan yang terendah.
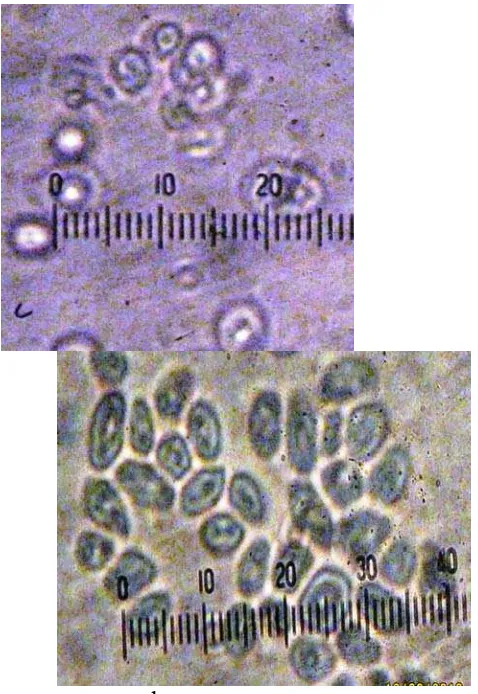
Pengamatan morofologi sel dengan intensitas 40 Watt yang diamati di bawah mikroskop diperoleh ciri-ciri yaitu bentuk sel adalah oval dan juga bulat, sedangkan vakuola ada yang berbwarna hitam, hijau dan juga berwarna coklat, ukuran sel adalah sekitar 5- 9 milimikron. Dinding sel lebih tebal dibandingkan dengan yang intensitas 20 dan 30 watt.
[image:43.595.109.335.82.429.2]
c d
Gambar 4.7 Morfologi sel Saccharomyces sp. strain liar (a), dan morfologi sel setelah perlakuan sinar radiasi ultraviolet dengan intensitas 30 Watt dengan waktu 30 detik (a), 40 detik (b), 50 detik (c) dengan perbesaran 1000x.
Menurut Zul et al. (2003), menyatakan bahwa semakin jauh jarak radiasi akan semakin besar persentasi sel hidup, sebaliknya semakin lama waktu radiasi maka semakin kecil persentasi sel hidup. Kisaran dosis terbaik adalah pada jarak 15 – 50 cm. mikroba yang diradiasi dengan ultraviolet pada dosis yang tepat akan menghasilkan enzim dengan aktivitas yang lebih tinggi dibanding tipe liar. Hal ini terjadi karena radiasi sinar ultraviolet akan menyebabkan perubahan susunan gen dari genom tertua sehingga dihasilkan mutan.
karbon. Mutan petite melakukan metabolism karbon bukan dengan respirasi menggunakan O2 melainkan melalui fermentasi glukosa.
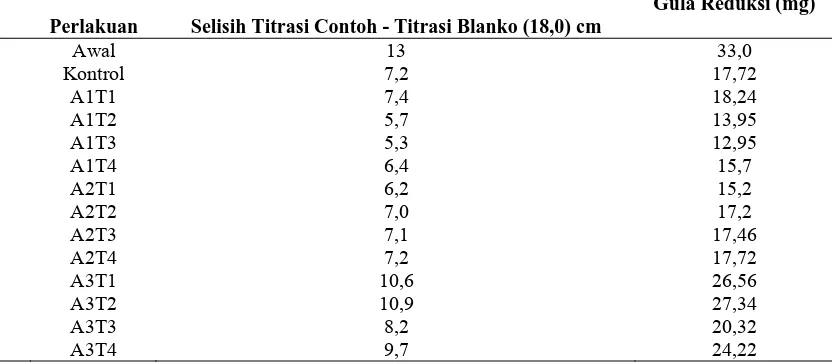
4.4 Hasil penentuan gula reduksi hasil fermentasi
[image:44.595.113.529.469.651.2]Karena volume alkohol yang didapatkan pada saat destilasi yang dilakukan terlalu sedikit yaitu hanya melekat pada bagian selang destilasi maka untuk mengetahui terjadinya suatu fermentasi maka dilakukan penghitungan penentuan gula reduksinya. Menurut Reed & Peppler (1973), kadar gula terlarut mempunyai hubungan yang erat dengan kadar alkohol, kadar alkohol yang tinggi akan mempunyai kadar gula yang terendah. Pengamatan kadar gula reduksi hasil fermentasi dari daging buah durian oleh Saccharomyces sp. dengan metode Luff Schrool terdapat pada tabel 4.2 berikut ini:
Tabel 4.2 Data Gula reduksi Fermentasi Durian oleh Saccharomyces sp. yang diisolasi dari daging buah durian
Perlakuan Selisih Titrasi Contoh - Titrasi Blanko (18,0) cm
Gula Reduksi (mg)
Awal 13 33,0
Kontrol 7,2 17,72
A1T1 7,4 18,24
A1T2 5,7 13,95
A1T3 5,3 12,95
A1T4 6,4 15,7
A2T1 6,2 15,2
A2T2 7,0 17,2
A2T3 7,1 17,46
A2T4 7,2 17,72
A3T1 10,6 26,56
A3T2 10,9 27,34
A3T3 8,2 20,32
A3T4 9,7 24,22
dengan baik dengan sinar ultraviolet sehingga dapat tumbuh dan berkembang dengan baik. Menurut Hutter et al. (1998) mengatakan bahwa mutan petite atau mutasi yang terjadi pada DNA mitokondria mampu meningkatkan kadar etanol 30 - 40% dibanding tipe liarnya. Valadi et al. (1998) telah pula melaporkan upaya peningkatan produksi etanol menggunakan mutan Saccharomyces cerevisiae pada lokus gen pengkode enzim gliserol-3-fosfat dehodrogenase.
Gula reduksi merupakan hasil metabolisme karbohidrat yang digunakan untuk aktivitas pertumbuhan dan pembentukan metabolit sekunder oleh mikroba. Penurunan kadar gula reduksi di akhir fermentasi mengindikasikan terbentuknya metabolit sekunder. Hal ini didukung terjadinya perbedaan pH selama fermentasi (Nur, 2009).
Menurut Hidayat et al. (2006), menyatakan bahwa mutasi genetik yang dilakukan pada mikroba tidak memiliki stabilitas genetik yang baik. Mutan yang diperoleh tidak langsung digunakan tetapi harus melalui seleksi. Seleksi adalah suatu prosedur untuk memdeteksi dan mengisolasi sel mutan yang diinginkan diantara sekian banyak populasi mikroba. Mutan yang diperoleh atau lolos seleksi biasanya masih mendapat perlakuan mutasi dan seleksi berulang untuk menghasilkan biakan yang menguntungkan pemakaianya dalam industri fermentasi.
Menurut Puspaningsih (2009), bahwa mutan petite Saccharomyces cerevisiae yang dihasilkan kan mampu meningkatkan kadar etanol, sehingga walaupun ketersediaan bahan baku terbatas, mutan ini mampu menghasilkan etanol lebih tinggi dibanding tipe liarnya. Hal ini tentunya akan menguntungkan bagi industri etanol dan diharapkan kebutuhan etanol dalam negeri dapat terpenuhi.
bertambahnya waktu fermentasi, penurunan ini disebabkan karena khamir menggunakan gula tersebut dalam melakukan aktifitasnya dan juga merubahnya menjadi alkhol, sehingga gula pada substrat akan semakin sedikit (Elimasni, 1990). Hasil ini dapat dibuat dalam bentuk gambar sebagai berikut:
Gambar 4.6 Hasil gula reduksi fermentasi durian dengan metode Luff Schrool
Dari gambar diatas jelas dapat dilihat perbedan hasil gula reduksi sisa dari setiap perlakuan berbeda-beda. Hal ini terjadi dapat disebabkan karena waktu dan intensitas yang diberikan
mempengaruhi pertumbuhan khamir, sehingga ada yang mengalami terjadinya mutasi. Tingginya gula reduksi pada perlakuan dengan intensitas 40 Watt dengan lama penyinaran 40 detik ini mungkin dapat disebabkan karena sel Saccharomyces sp. ini mengalami kerusakan pada sel nya yaitu dapat dilihat pada koloni yang disubkulturkan kembali sangat sedikit pertumbuhanya dibandingkan dengan kontrol.
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil penelitian yang telah dilakukan, maka dapat diambil kesimpulan sebagai berikut:
a. Radiasi ultraviolet pada intensitas 40 Watt dengan waktu 60 detik, setelah di subkulkturkan kembali koloni tidak tumbuh.
b. Semakin tinggi intensitas sinar Ultraviolet terhadap Saccharomyces sp. menyebabkan kemampuan mereduksi gula semakin lemah, perlakuan yang paling rendah gula reduksinya adalah pada 20 Watt 50 menit yaitu 12,95 mg sedangkan yang paling tinggi adalah pada 40 Watt 40 detik yaitu 27,34 mg, kadar gula awal adalah 33 mg.
5.2 Saran
DAFTAR PUSTAKA
Abu Bakar, F. D. 1995. A Study on The Virulence of a Wild Type Strain & Ultraviolet Induce Mutans of The Entopathogenic Fungus. Jilid 24. Penerbit Universitas Kebangsaan Malaysia (UKM), Malaysia: 29.
Ackerman, E., Ellis, L. B. M., dan Williams, L. E. !988. Ilmu Biofisika. Jakarta: Penerbit Universitas Airlangga. hal. 283-261
Ahmad, Riza, Z. 2005. pemanfaatan khamir saccharomyces cerevisiae untuk ternak. Balai Penelitian Veteriner, PC Box 151, Bogor. Wartazoa 15(1): 51-55.
Bachrudin, Z., Astuti, dan Y. S. Dewi. 2000. Isolasi dan Seleksi Mikroba Penghasil Laktat dan Aplikasinya Pada Fermentasi Limbah Industri Tahu. Prosiding Seminar Nasional Industri Enzim dan Bioteknologi. Mikrobiologi Enzim dan Bioteknologi.
Bailey, P. S., Dills, C. E.,dan Baeley, C. A,. 1978. Organic Chemistry. Boston: Allyn An Bacon.
Berry D. R. and Watson D.C.1987. Production of Organoleptic Compounds, in Yeast Biotechnology, Berry D.R., Rusell I. and Steward G.G., Eds., Allen & Unwin London. hal. 159.
Birch, G. G., Cameron, A. G., dan Spencer, M. 1987. Food Science 2nd ed. Pergamon Press. Oxforrd. hal.59.
Brown, T. A. 1990. Genetics a Molecular Approach, London: Van Nostrand Reinhold (Internasional), Co,Ctd.
Budiyanto, H. M. 2002. Mikrobiologi Terapan. Malang: Penerbit Universitas Muhammadiyah. hal. 72.
Chan, E. C. S. 1988. Dasar-Dasar Mikrobiologi. Jakarta: Penerbit Universitas Indonesia. hal. 933.
Elevri, Putra dan Surya Rosa Putra. 2006. Produksi Etanol Menggunakan Saccharomyces cerevisiae yang Diamobilisasi dengan Agar Batang. Kimia ITS. Akta Kimindo 1(2): 109-110.
Elimasni, 1990. Penggunaan Khamir Candida tropicalis (Cast) Berkhout dan Saccharomyces cereviceae Hansen Serta Lama Fermentasi yang Berbeda dalam Pembuatan Anggur Pala. Tesis Sarjana Biologi, Padang, Indonesia. Unversitas Andalas. Padang. hal. 13, 15.
Fardiaz, S. 1992. Penuntun Praktek Mikrobiologi Pangan. Bogor: Institut Pertanian Bogor.
Farnsworth, M. W. 1988. Genetic. Second Edition. Harper & Row Publisher. New York. hal. 519-521.
Fleet, G. H. 1992. Spoilage Yeasts. Critical Reviews in Biotechnology. Berlin. hal. 1-20.
Gandjar, I., Sjamsuridjal, W., dan Oetari, A. 2006. Mikologi Dasar dan Terapan. Jakarta: Yayasan Obor Indonesia. hal. 166.
Gull, K & G. Oliver. 1980. The Fungal Nucleus. First Edition. Cambridge University Press, New York. Pp. 268-269.
Harahap, U. 1994. Radiasi, Efek Biologis, dan Penggunaannya Dalam Bidang Farmasi. Fakultas Matematika dan Ilmu Pengetahuan Alam, University Sumatera Utara, Medan. hal. 19-23.
Hepworth, M. 2005. Technical, Environmental and Economic Aspects of Unit Operations for the Production of Bioethanol from Sugar Beet in the United Kingdom. CET IIA Exercise 5, Corpus Christi College.
Hidayat, N., Padaga, M. C., dan Suhartini, S. 2006. Mikrobiologi Industri. Yogyakarta: Penerbit ANDI.
Judoamidjojo, E. 1990. Teknologi Fermentasi. Jakarta: Penerbit Rajawali Press. hal. 57.
Kartika, W. S. 2000. Pertumbuhan Isolat Bakteri Asam Laktat pada Media Ekstrak Daging Buah Durian (Durio zibethinus Murr.). Skripsi FMIPA. Universitas Lampung, Bandar Lampung.
Lay, B. W. 1994. Analisis Mikrobiologi di Laboratorium. Jakarta: PT. Raja Grafindo Persada.
Lois, B. 1987. Microbiology In Practice. Forth Edition. Harper & Row Publisher. New York: 6, 52-55.
Manurung, Renita. 2005. Pembuatan Anggur Pepaya dengan Proses Fermentasi. Jurnal Sistem Teknik Industri 6(2): 70-72.
Mertens, T. R dan R. L. Hammersmith. 1995. Genetic Laboratory Investigation. Tenth Edition. Tenth Printing. Prentice Hall. Engwood Cliff. New Jersey. hal. 145-153.
Muljohardjono, M. 1988. Teknologi Pengawetan Pangan. Jakarta: Universitas Indonesia press.
Narita. 2008. Saccharomyces cereviceae Super Jamur yang Memiliki Sejarah Luar Biasa. http/www2.kompas.com/kompas-cetak.html. diakses tanggal 10 Maret 2010.
Neech, GA., M. A. Melvin, dan J. Taggart. 1985. Food, Drink, and Biotechnology. In Higgins, J., D.J. Best, and J. Jones (Eds.). Biotechnology. Melbourne. Blackwell Sci. pub.
Nur, Hasrul, S. 2005. Pembentukan asam organik oleh isolat bakteri asam laktat pada media ekstrak daging buah durian (Durio zibethinus Murr.). Bioscientiae 2(1): 15-20.
Prescott, S. C, dan C. G. Dunn. 1959. Industrial Microbiology. Third edition. Mc Graw-Hill Book Company, Inc. New York.
Puspaningsih, Ni Nyoman. 2009. Manipulasi Genetik Saccharomyces Cerevisiae Dalam Upaya Meningkatkan Produksi Etanol. http://www.rudyct.com/ PPS702-ipb/01101/nyomantri. htm. 1092009.
Rahayu, E. S., Sudarmadji, D. W, dan T. F, Djaafar. 1995. Isolasi Bakteri Asam Laktat dan Karakteristik Agensia yang Berpotensi Sebagai Biosafety Makanan Indonesia. Laporan Penelitian PAU Pangan dan Gizi. UGM, Yogyakarta.
Reed, G dan H. J, Peppler. 1973. Yeast Technology. The AVI Publi. Co, Inc. New york.
Sa’id, G. A. 1987. Bio Industri Penerapan Teknologi Fermentasi. PAU Bioteknologi. Jakarta: Mediyatama Sarana Perkasa.
Sari, L dan Purwadaria, T. 2004. Pengkajian Nilai Gizi Hasil Fermentasi Mutan Aspergillus niger pada Substrat Bungkil Kelapa dan Bungkil Inti Sawit. Biodiversitas 5(2): 48-51.
Stainer, R., Edward, A., John, I. 1984. Dunia Mikroba II. Jakarta: Penerbit Bhratara Karya Aksara. hal. 20.
Sitompul, Tetty. 2003. Uji Intensitas Ultraviolet dan Lama Penyinaran Terhadap Mutasi Induksi Sordaria fimicola CM+ Stain Liar. Skripsi. Medan, Indonesia: Departemen Biologi, FMIPA, Universitas Sumatera Utara. hal. 20-24.
Snustad, E.J dan Gardner. 1984. Principles of Genetics. Seventh Edition. John Wiley & Sons, Inc, New York. hal. 311-312.
Soedjono, S. 2003. Aplikasi Mutasi Induksi Dan Variasi Somaklonal Dalam PemuliaanTanaman. Jurnal Litbang Pertanian 22(2): 45-51.
Susanti, S., Fitri. W., dan Tarkus. 2008. Pembuatan Strain Nonpatogenik Fusarium oxysporum f.sp. lycopersici dengan Radiasi Sinar Ultraviolet. Jurusan HPT Fakultas Pertanian Universitas Padjadjaran Jatinangor, Bandung 40600. hal. 2. Tamarin, R. 1995. Principles of Genetics.Third Edition. WEB, Boston. hal. 452-454 Wanto dan Arief, S. 1981. Dasar-Dasar Mikrobiologi Industri. Departemen
Pendidikan Dan kebudayaan, Direktorat Pendidikan Menengah Umum.
Wasito. 1981. BPPT, Kajian Lengkap Prospek Pemanfaatan Biodiesel Dan Bioethanol Pada Sektor Transportasi Di Indonesia.
Winarno, F. G. 1997. Kimia Pangan dan Gizi. Jakarta: Gramedia Pustaka Utama. hal. 24.
Widowat, S., J. Hermanianto, dan Ratih D. H. 2000. Evaluasi Sifat Fisik dan Kimia Sosis Daging Sapi Tradisional Bali (urutan) Dengan Starter Kultur Bakteri Asam Laktat. Makalah pada PIT-PERMI 2000. Denpasar, 27-28 Juni 2000.
Widowati. S dan Misgiyarta. 2008. Efektifitas Bakteri Asam Laktat (BAL) dalam Pembuatan Produk Fermentasi Berbasis Protein/Susu Nabati. Prosiding Seminar Hasil Penelitian Rintisan dan Bioteknologi Tanaman. hal. 361.
Youssef, Ghareib dan Khalil (1989). Production of Ethanol by Alginat-entrapped Saccharomyces cerevisiae Strain. Indian Journal of Experimental Biology, 27 (2): 121-123.
Zaiffbio. 2009. Genetika Dasar. Zaiffbio Word Press,com/2009/10/31. Diakese tanggal 15 Maret 2010.
Lampiran A. Komposisi media PDA (Potato Dextro Agar)
Komposisi media PDA adalah: 1. Potato dextro agar 4,0 g/l 2. Glukose 20,0 g/l
Lampiran B. Penentuan Glukosa, Fruktosa dan Gula Invert dalam Suatu Bahan Dengan Metode Luff Shrool.
ml 0,1 N Na-thiosulfat Glukosa, fruktosa, gula invert mg C6H12O6
1 2,4 2,4
2 4,8 2,4
3 7,2 2,5
4 9,7 2,5
5 12,2 2,5
6 14,7 2,5
7 17,2 2,6
8 19,8 2,6
9 22,4 2,6
10 25,0 2,6
11 27,6 2,7
12 30,3 2,7
13 33,0 2,7
14 35,7 2,8
15 38,5 2,8
16 41,3 2,9
17 44,2 2,9
18 47,1 2,9
19 50,0 3,0
Lampiran C. Proses Fermentasi Daging Buah Durian
Pengamatan Kadar Gula Reduksi