KAJIAN TEKNIK ELEKTROKOAGULASI UNTUK
PEMISAHAN MIKROALGA
SKRIPSI
NOVA AFRIYANTI
F34070011
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
THE STUDY OF ELECTROCOAGULATION TECHNIQUE FOR
MICROALGAE REMOVAL
Nova Afriyanti
Departement of Agricultural Engineering, Faculty of Agricultural Technology
Bogor Agricultural University, IPB Darmaga Campus, PO Box 220, Bogor, West Java, Indonesia. Phone 0856 9255 3141, e-mail : nova.afriyanti@gmail.com
ABSTRACT
Although microalgae can grow fast in liquid wastes, there was no efficient technique yet for remove them. An electro-coagulation technique was examined to remove microalgae from the liquid wastes. For the batch system electro-coagulation process used in this experiments two aluminum electrode. This type of metal selected because it could introduce the coagulation agent into the liquid, there by microalgae could be removed. The used wastes are wastewater from animal husbandry and synthetic wastewater. The experiment was done by batch method used 1 Liter microalgae for each treatment on direct current variated from 9, 12 and 15 Volt and operation time from 10 to 40 minutes. The result of treatment were remarkably good and the efficiencies to total suspended solid (TSS) as the amount of microalgae removed reached to 51,55% for husbandry wastewater and 28,98% for synthetic on the direct current of 15 Volt and operation time 40 minutes. Beside can removed microalgae from wastewater electro-coagulation give effect for the other parameters of the wastewater like turbidity, color, concentration of COD, concentration of phosphate and pH value. The reduction of those parameters value reached along with the raising direct current voltage and operating time.
NOVA AFRIYANTI. F34070011. Kajian Teknik Elektrokoagulasi untuk Pemisahan Mikroalga. Dibawah bimbingan Suprihatin dan Muhammad Romli. 2011
RINGKASAN
Mikroalga (biasa dikenal sebagai fitoplankton) merupakan kelompok tumbuhan berukuran renik yang biasa hidup di perairan tawar dan laut. Mikroalga dapat tumbuh dengan cepat yaitu dalam waktu 4-10 hari. Mikroalga memiliki manfaat yang sangat besar bagi kehidupan manusia. Mikroalga dapat dimanfaatkan sebagai bahan baku pembuatan biodiesel karena mikroalga memiliki kemampuan untuk menghasilkan minyak yang tinggi (58.700-136.900 L/ha.tahun). Selain itu mikroalga juga banyak digunakan untuk produksi protein sel tunggal atau yang biasa dikenal sebagai Single Cell Protein (SCP) (Kowaroe et al., 2010 dan Stainer, 1976).
Limbah cair hasil kegiatan manusia yang tidak mengalami pengolahan terlebih dahulu akan menyebabkan pencemaran lingkungan. Mikroalga termasuk salah satu mikroorganisme yang biasa digunakan untuk pengolahan limbah cair secara biologis. Mikroalga mengkonsumsi bahan organik pada limbah cair seperti N-Organik dan fosfor untuk pertumbuhannya. Dengan menumbuhkan mikroalga pada limbah cair akan diperoleh manfaat yang ganda. Selain untuk mereduksi pencemar yang ada pada limbah cair, mikroalga yang tumbuh pada limbah cair tersebut dapat dipanen untuk dimanfaatkan.
Salah satu contoh limbah cair yang dapat digunakan untuk membiakan mikroalga adalah limbah cair peternakan. Produktivitas rata - rata mikroalga pada media limbah cair peternakan adalah 130 mg/L atau sekitar 26 gram m2 perhari (Manalu, 2010). Pembiakan mikroalga dengan menggunakan media limbah cair di Indonesia sangat menjanjikan.
Pengkajian mengenai metoda atau cara yang efisien untuk pemisahan dan pemanenan mikroalga yang telah dibiakkan pada limbah cair perlu dilakukan. Teknik pemisahan yang efektif dan effisien akan menghasilkan jumlah panenan mikroalga yang banyak sehingga dapat diperoleh manfaat yang lebih banyak pula. Salah satu teknik pemisahan mikroalga yang akan dikaji adalah teknik pemisahan mikroalga dengan cara elektrokoagulasi. Jika dibandingkan dengan teknik koagulasi secara kimia (metode jar test), teknik elektrokoagulasi memerlukan biaya yang lebih murah karena pada teknik elektrokoagulasi tidak membutuhkan bahan kimia tambahan. Untuk itu pengkajian mengenai penggunaan teknik elektrokoagulasi untuk pemisahan mikroalga perlu dilakukan. Selain untuk pemisahan mikroalga dari medianya, elektrokoagulasi juga dapat membantu menurunkan zat pencemar dilihat dari parameter COD, kadar fosfat, warna, dan kekeruhan dari limbah cair.
Tujuan penelitian ini adalah mempelajari kemungkinan teknik elektrokoagulasi untuk pemisahan mikroalga melalui pengamatan TSS, kekeruhan, warna, COD, konsentrasi fosfat dan nilai pH.
Pada penelitian ini pemisahan mikroalga dilakukan dengan menggunakan teknik elektrokoagulasi. Perlakuan yang dilakukan menggunakan variasi tegangan dan waktu kontak. Tegangan yang digunakan adalah 9 , 12, dan 15 Volt. Dan variasi waktu kontak yang digunakan adalah 10, 20, 30, dan 40 menit. Untuk setiap kombinasi perlakuan diterapkan pada 1000 ml mikroalga yang telah dibiakan pada dua jenis limbah cair yaitu limbah cair peternakan sapi dan limbah cair sintetik. Pada perangkat elektokoagulasi digunakan jenis elektroda aluminium. Banyaknya mikroalga yang dapat dipisahkan dihitung dengan melihat penurunan TSS yang diperoleh setelah penerapan teknik elektrokoagulasi. Selain itu parameter pencemar lain dihitung melalui parameter kekeruhan, warna, konsentrasi COD, konsentrasi Fosfat, dan pH limbah cair peternakan dan limbah cair sintetik yang digunakan.
KAJIAN TEKNIK ELEKTROKOAGULASI UNTUK
PEMISAHAN MIKROALGA
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian,
Institut Pertanian Bogor
Oleh
NOVA AFRIYANTI
F34070011
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Kajian Teknik Elektrokoagulasi untuk Pemisahan Mikroalga Nama : Nova Afriyanti
NIM : F34070011
Menyetujui,
Pembimbing I, Pembimbing II,
(Prof. Dr.-Ing.Ir. Suprihatin) (Dr. Ir. Muhammad Romli, M. Sc, St) NIP. 196312211990031002 NIP. 196012051986091001
Mengetahui : Ketua Departemen,
(Prof. Dr. Ir. Nastiti Siswi Indrasti) NIP. 196210091989032001
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Saya menyatakan dengan sebenar - benarnya bahwa skripsi dengan judul Kajian Elektrokoagulasi untuk Pemisahan Mikroalga adalah hasil karya saya sendiri dengan arahan Dosen Pembimbing Akademik, dan belum diajukan dalam bentuk apapun pada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Juni 2011
Yang membuat pernyataan
© Hak cipta milik Nova Afriyanti, Tahun 2011 Hak cipta dilindungi
RIWAYAT HIDUP
Nova Afriyanti, lahir di Tangerang, Banten pada tanggal 30 Januari 1990 dari pasangan Afrizon dan Yati Iskandar. Penulis merupakan anak kedua dari tiga bersaudara, dengan kakak bernama Novi Afriyanti dan adik bernama Mutia Chaerunisa.
Sebelumnya penulis telah menyelesaikan jenjang pendidikan di TK Cahaya Budi Tangerang pada tahun 1996, sekolah dasar SD Negeri Doyong 1 Tangerang pada tahun 2001, SMP Negeri 12 Tangerang pada tahun 2004, dan sekolah mengengah atas SMA Negeri 4 pada tahun 2007. Selama sekolah, penulis aktif dalam berbagai kegiatan OSIS (Organisasi Siswa Intera Sekolah) dan mengikuti ekstrakulikuler klub olah raga bola basket.
Penulis melanjutkan studi perguruan tinggi di Institut Pertanian Bogor pada tahun 2007 melalui jalur USMI (Undangan Seleksi Masuk IPB), kemudian diterima sebagai mahasiswa departemen Teknologi Industri Pertanian pada tahun 2008. Selama kuliah di IPB, penulis aktif pada beberapa kegiatan organisasi seperti klub bola basket Fakultas Teknologi Pertanian sebagai sekretaris umum (2009-2010) dan sebagai anggota HIMALOGIN (Himpunan Mahasiswa Teknologi Industri) pada tahun 2008-2010. Penulis juga pernah menjadi asisten Praktikum Teknologi Pengemasan Distribusi dan Transportasi pada tahun 2010 dan asisten Praktikum Teknik Penyimpanan dan Penggudangan pada tahun 2011 serta aktif pada kegiatan kepanitiaan serta berbagai kegiatan kampus lainnya.
Pada tahun 2010 penulis melakukan kegiatan Praktek Lapang (PL) di PT. Amanah Prima
Indonesia, Curug, Tangerang Banten dengan judul “ Mempelajari Teknologi Proses dan Sistem
KATA PENGANTAR
Puji dan syukur dipanjatkan ke hadapan Allah SWT atas karuniaNya sehingga skripsi ini berhasil diselesaikan. Penelitian dengan judul Kajian Teknik Elektrokoagulasi untuk Pemisahan Mikroalga dilaksanakan di Laboratorium Teknik Manajemen Lingkungan sejak bulan Februari sampai Maret 2011.
Pada pelaksanaan penyusunan skripsi ini penulis telah banyak dibantu oleh berbagai pihak baik secara langsung maupun tidak langsung. Oleh karena itu, pada kesempatan kali ini penulis menyampaikan banyak terima kasih kepada :
1. Prof. Dr. -Ing. Ir. Suprihatin sebagai dosen pembimbing I yang tiada henti - hentinya memberikan saran, arahan, bimbingan, serta kritik positif kepada penulis.
2. Dr. Ir. Muhammad Romli, M. Sc, St. sebagai dosen pembimbing II yang juga senantiasa memberikan tuntunan serta kritik yang membangun.
3. Drs. Purwoko, M.Si sebagai dosen penguji atas saran dan kritik yang membangun bagi penulis.
4. Orang tua, kakak, adik serta seluruh keluarga besar atas segala doa dan dukungannya. 5. Seluruh Dosen, laboran, dan staf TIN yang telah banyak membatu penulis selama menuntut
ilmu di TIN dan menjalankan penelitian.
6. Mba Lya Agustina atas bantuan dan kerjasamanya
7. Nurhidayanti dan Agung Utomo selaku teman seperjuangan atas dukungan dan kerjasamanya.
8. Seluruh temen - teman seperjuangan TIN 44 atas segala dukungan, bantuan dan kebersamaannya, serta
9. Rekan - rekan TIN 43, 45 dan 46 atas dukungan dan bantuannya.
Akhirnya penulis berharap semoga tulisan ini bermanfaat dan memberikan kontribusi yang nyata terhadap perkembangan ilmu pengetahuan di bidang Teknologi Industri Pertanian.
DAFTAR ISI
Halaman
KATA PENGANTAR ... iii
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
I. PENDAHULUAN ... 1
1.1 LATAR BELAKANG ... 1
1.2 TUJUAN ... 1
II. TINJAUAN PUSTAKA ... 2
2.1 KULTIVASI MIKROALGA ... 2
2.1.1 Definisi Alga dan Mikroalga ... 2
2.1.2 Sifat Mikroalga ... 4
2.1.3 Komposisi Sel Mikroalga ... 4
2.1.4 Media Pertumbuhan Mikroalga ... 5
2.2 PEMISAHAN MIKROALGA ... 7
2.2.1 Sedimentasi ... 7
2.2.2 Flotasi ... 8
2.2.3 Koagulasi/Flokulasi ... 8
2.2.4 Filtrasi ... 8
2.2.5 Sentrifugasi ... 9
2.2.6 Elektrokoagulasi ... 9
III. METODOLOGI ... 12
3.1 ALAT DAN BAHAN ... 12
3.2 WAKTU DAN TEMPAT PENELITIAN ... 12
3.3 METODE PENELITIAN ... 12
3.3.1 Penumbuhan Mikroalga ... 12
3.3.2 Penentuan Waktu Kontak ... 13
3.3.3 Penelitian Utama ... 13
IV. HASIL DAN PEMBAHASAN ... 19
4.1 PENUMBUHAN MIKROALGA ... 19
4.2 PENENTUAN WAKTU KONTAK ... 22
4.3 PENGARUH TEKNIK ELEKTROKOAGULASI ... 22
4.3.1 TSS... 23
4.3.2 Kekeruhan ... 28
4.3.3 Warna ... 30
4.3.4 COD ... 32
4.3.5 Konsentrasi Fosfat... 33
4.3.6 pH... 35
4.4 KEBUTUHAN ENERGI DAN BIAYA ... 36
V. KESIMPULAN DAN SARAN ... 39
5.1 KESIMPULAN ... 39
5.2 SARAN ... 39
DAFTAR PUSTAKA ... 40
DAFTAR
TABEL
Halaman
Tabel 1. Golongan Besar Alga ... 3
Tabel 2. Beberapa perbedaan syarat lingkungan hidup dan sifat Fisiologis antara Alga dan Bakteri ... 4
Tabel 3. Komposisi Sel Blue-Green Alga ... 5
Tabel 4. Kondisi tempat tumbuh mikroalga ... 5
Tabel 5. Beberapa Mikronutrien pada Pertumbuhan Mikroalga ... 6
Tabel 6. Komposisi Media Diatom ... 7
Tabel 7. Karakterisasi Limbah Cair Peternakan Sindang Barang ... 19
DAFTAR GAMBAR
Halaman
Gambar 1. Diagram venn proses yang mendasari elektrokoagulasi ... 9
Gambar 2. Mekanisme elektrokoagulasi ... 10
Gambar 3. Rangkaian elektrokoagulasi untuk pemisahan mikroalga... 14
Gambar 4. Diagram alir penelitian 1 (limbah cair peternakan) ... 17
Gambar 5. Diagram alir penelitian 2 (limbah cair sintetik) ... 18
Gambar 6. Mikroalga tumbuh pada media limbah 1 ... 20
Gambar 7. Air sebelum dan sesudah ditumbuhi mikroalga ... 21
Gambar 8. Mikroalga yang ditumbuhkan pada media limbah cair sintetik ... 21
Gambar 9. Flok Mikroalga yang terbentuk ... 22
Gambar 10. Grafik nilai TSS limbah cair peternakan pada setiap perlakuan elektrokoagulasi ... 24
Gambar 11. Grafik nilai TSS limbah cair sintetik setiap perlakuan elektrokoagulasi ... 24
Gambar 12 . Mikroalga limbah cair peternakan sebelum dan sesudah elektrokoagulasi ... 26
Gambar 13. Mikroalga dari limbah cair sintetik sebelum dan sesudah elektrokoagulasi ... 27
Gambar 14. Mikroalga mengapung dan mengendap setelah elektrokoagulasi... 27
Gambar 15. Grafik nilai kekeruhan limbah cair peternakan pada setiap perlakuan elektrokoagulasi ... 28
Gambar 16. Grafik nilai kekeruhan limbah cair sintetik pada setiap perlakuan elektrokoagulasi ... 29
Gambar 17. Grafik konsentrasi warna limbah cair peternakan pada setiap perlakuan elektrokoagulasi ... 30
Gambar 18. Grafik konsentrasi warna limbah cair sintetik pada setiap perlakuan elektrokoagulasi ... 30
Gambar 19. Grafik konsentrasi COD limbah cair peternakan pada setiap perlakuan elektrokoagulasi ... 32
Gambar 20. Grafik konsentrasi COD limbah cair sintetik pada setiap perlakuan elektrokoagulasi ... 33
Gambar 21. Grafik konsentrasi fosfat limbah cair peternakan pada setiap perlakuan elektrokoagulasi ... 34
Gambar 22. Grafik konsentrasi fosfat limbah sintetik pada setiap perlakuan elektrokoagulasi ... 34
Gambar 23. Grafik nilai pH limbah cair peternakan pada setiap perlakuan elektrokoagulasi ... 35
Gambar 24. Grafik nilai pH limbah cair sintetik pada setiap perlakuan elektrokoagulasi ... 36
Gambar 25. Hubungan kebutuhan energi dengan reduksi TSS, konsentrasi COD, dan konsentrasi fosfat pada limbah cair peternakan ... 37
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Data hasil uji pengaruh waktu kontak dan tegangan elektrokoagulasi terhadap TSS limbah cair peternakan sebagai media tumbuh
mikroalga ... 43 Lampiran 2. Data hasil uji pengaruh waktu kontak dan tegangan elektrokoagulasi
terhadap TSS limbah cair sintetik sebagai media tumbuh
mikroalga ... 44 Lampiran 3. Hasil analisa keragaman waktu kontak dan tegangan elektrokoagulasi
terhadap konsentrasi TSS limbah cair peternakan ... 45 Lampiran 4. Hasil analisa keragaman waktu kontak dan tegangan elektrokoagulasi
terhadap konsentrasi TSS limbah cair sintetik... 45 Lampiran 5. Data hasil uji pengaruh waktu kontak dan tegangan elektrokoagulasi
terhadap kekeruhan limbah cair peternakan sebagai media tumbuh
mikroalga ... 46 Lampiran 6. Hasil analisa keragaman waktu kontak dan tegangan elektrokoagulasi
terhadap kekeruhan limbah cair peternakan ... 47 Lampiran 7. Hasil uji lanjut Duncan waktu kontak elektrokoagulasi terhadap
kekeruhan limbah cair peternakan pada α = 0,05 ... 47 Lampiran 8. Hasil uji lanjut Duncan tegangan elektrokoagulasi terhadap kekeruhan
limbah cair peternakan pada α = 0,01 ... 47 Lampiran 9. Data hasil uji pengaruh waktu kontak dan tegangan elektrokoagulasi
terhadap kekeruhan limbah cair sintetik sebagai media tumbuh
mikroalga ... 48 Lampiran 10. Hasil analisa keragaman waktu kontak dan tegangan elektrokoagulasi
terhadap kekeruhan limbah cair sintetik ... 49 Lampiran 11. Hasil uji lanjut Duncan waktu kontak elektrokoagulasi terhadap
kekeruhan limbah cair sintetik... 49 Lampiran 12. Hasil uji lanjut Duncan tegangan elektrokoagulasi terhadap kekeruhan
limbah cair sintetik ... 49 Lampiran 13. Data hasil uji pengaruh waktu kontak dan tegangan elektrokoagulasi
terhadap warna limbah cair peternakan sebagai tumbuh
mikroalga ... 50 Lampiran 14. Hasil analisa keragaman waktu kontak dan tegangan elektrokoagulasi
terhadap warna limbah cair peternakan ... 51 Lampiran 15. Hasil uji lanjut Duncan waktu kontak elektrokoagulasi terhadap
warna limbah cair peternakan ... 51 Lampiran 16. Hasil uji lanjut Duncan tegangan elektrokoasulasi terhadap
warna limbah cair peternakan ... 51 Lampiran 17. Data hasil uji pengaruh waktu kontak dan tegangan elektrokoagulasi
terhadap warna limbah cair sintetik sebagai tumbuh mikroalga ... 52 Lampiran 18. Hasil analisa keragaman waktu kontak dan tegangan elektrokoagulasi
terhadap warna limbah cair sintetik ... 53 Lampiran 19. Hasil uji lanjut Duncan waktu kontak elektrokoagulasi terhadap
warna limbah cair sintetik ... 53 Lampiran 20. Hasil uji lanjut Duncan tegangan elektrokoagulasi terhadap
warna limbah cair sintetik ... 53 Lampiran 21. Data hasil uji pengaruh waktu kontak dan tegangan elektrokoagulasi
terhadap COD limbah cair peternakan sebagai media
tumbuh mikroalga ... 54 Lampiran 22. Data hasil uji pengaruh waktu kontak dan tegangan elektrokoagulasi
terhadap COD limbah cair sintetik sebagai media
tumbuh mikroalga ... 55 Lampiran 23. Hasil analisa keragaman waktu kontak dan tegangan elektrokoagulasi
Lampiran 24. Hasil analisa keragaman waktu kontak dan tegangan elektrokoagulasi
terhadap COD limbah cair sintetik ... 56
Lampiran 25. Data hasil uji pengaruh waktu kontak dan tegangan elektrokoagulasi terhadap konsentrasi fosfat limbah cair peternakan sebagai media tumbuh mikroalga ... 57
Lampiran 26. Data hasil uji pengaruh waktu kontak dan tegangan elektrokoagulasi terhadap konsentrasi fosfat limbah cair sintetik sebagai media tumbuh mikroalga ... 58
Lampiran 27. Hasil analisa keragaman waktu kontak dan tegangan elektrokoagulasi terhadap konsentrasi fosfat pada limbah cair peternakan ... 59
Lampiran 28. Hasil analisa keragaman waktu kontak dan tegangan elektrokoagulasi terhadap konsentrasi fosfat limbah cair sintetik ... 59
Lampiran 29. Hasil uji lanjut Duncan waktu kontak elektrokoagulasi terhadap konsentrasi fosfat limbah cair sintetik ... 59
Lampiran 30. Hasil uji lanjut Duncan tegangan elektrokoagulasi terhadap konsentrasi fosfat pada limbah cair sintetik ... 60
Lampiran 31. Data hasil uji pengaruh waktu kontak dan tegangan elektrokoagulasi terhadap pH limbah cair peternakan sebagai media tumbuh mikroalga ... 61
Lampiran 32. Hasil analisa keragaman waktu kontak dan tegangan elektrokoagulasi terhadap nilai pH pada limbah cair peternakan ... 62
Lampiran 33. Hasil uji lanjut Duncan waktu kontak elektrokoagulasi terhadap nilai pH limbah cair peternakan ... 62
Lampiran 34. Hasil uji lanjut Duncan tegangan elektrokoagulasi terhadap nilai pH limbah cair peternakan ... 62
Lampiran 35. Data hasil uji pengaruh waktu kontak dan tegangan elektrokoagulasi terhadap pH limbah cair sintetik sebagai media tumbuh mikroalga ... 63
Lampiran 36. Hasil analisa keragaman waktu kontak dan tegangan elektrokoagulasi terhadap nilai pH limbah cair sintetik... 64
Lampiran 37. Hasil uji lanjut Duncan waktu kontak elektrokoagulasi terhadap nilai pH limbah cair sintetik ... 64
Lampiran 38. Hasil uji lanjut Duncan tegangan elektrokoagulasi terhadap nilai pH limbah cair sintetik ... 64
Lampiran 39. Hubungan antara kebutuhan energi elektrokoagulasi dengan efisiensi penurunan beberapa parameter dari limbah cair peternakan ... 65
Lampiran 40. Hubungan antara kebutuhan energi elektrokoagulasi dengan efisiensi penurunan beberapa parameter dari limbah cair sintetik ... 65
Lampiran 41. Peraturan Menteri Negara Lingkungan Hidup No. 11 Tahun 2009 mengenai baku mutu limbah cair industri peternakan ... 66
Lampiran 42. Prosedur pengujian COD (Chemical Oxygen Demand)(APHA ed. 21th 4500- H+ B, 2005) ... 66
Lampiran 43. Prosedur Pengujian Konsentrasi Ortofosfat (APHA ed 21th 4500-P D,2005) ... 66
Lampiran 44. Prosedur pengujian TSS dengan Spektrofotometer ... 67
Lampiran 45. Prosedur pengujian Kekeruhan dengan Spektrofotometer ... 67
Lampiran 46. Prosedur pengujian warna dengan Spektrofotometer ... 67
Lampiran 47. Prosedur pengukuran pH dengan pH meter (APHA ed 21th 4500-H+ A,2005) ... 67
Lampiran 48. Perhitungan kebutuhan energi untuk teknik elektrokoagulasi ... 67
I.
PENDAHULUAN
A.
LATAR BELAKANG
Mikroalga (biasa dikenal sebagai fitoplankton) merupakan kelompok tumbuhan berukuran renik yang biasa hidup di perairan tawar dan laut. Mikroalga dapat tumbuh dengan cepat yaitu dalam waktu 4-10 hari. Mikroalga memiliki kemampuan untuk melakukan fotosintesis karena mikroalga memiliki klorofil dalam selnya. Mikroalga menggunakan CO2 sebagai sumber karbon dan mengkonsumsi bahan organik pada media tumbuhnya untuk pertumbuhannya. Mikroalga memiliki manfaat yang sangat besar bagi kehidupan manusia. Mikroalga dapat dimanfaatkan sebagai bahan baku pembuatan biodiesel karena mikroalga memiliki kemampuan untuk menghasilkan minyak yang tinggi (58.000-136.900 L /ha. tahun). Selain itu mikroalga juga banyak digunakan untuk produksi protein sel tunggal atau yang biasa dikenal sebagai Single Cell Protein (SCP) (Kowaroe et al., 2010 dan Stainer, 1976).
Selain dapat tumbuh pada media air laut dan tawar, mikroalga juga dapat dikembangkan pada media limbah cair. Limbah cair hasil kegiatan manusia yang tidak mengalami pengolahan terlebih dahulu akan menyebabkan pencemaran lingkungan. Mikroalga termasuk salah satu mikroorganisme yang biasa digunakan untuk pengolahan limbah cair secara biologis. Mikroalga mengkonsumsi bahan organik pada limbah cair seperti N-Organik dan fosfor untuk pertumbuhannya. Dengan menumbuhkan mikroalga pada limbah cair akan diperoleh manfaat yang ganda. Selain untuk mereduksi pencemar yang ada pada limbah cair, mikroalga yang tumbuh pada limbah cair tersebut dapat dipanen untuk dimanfaatkan.
Salah satu contoh limbah cair yang dapat digunakan untuk membiakkan mikroalga adalah limbah cair peternakan. Produktivitas rata - rata mikroalga pada media limbah cair peternakan adalah 130 mg/L atau sekitar 26 gram m2 perhari (Manalu, 2010). Pembiakan mikroalga dengan menggunakan media limbah cair di Indonesia sangat menjanjikan.
Pengkajian mengenai metoda atau cara yang efisien untuk pemisahan dan pemanenan mikroalga yang telah dibiakkan pada limbah cair perlu dilakukan. Teknik pemisahan yang efektif dan effisien akan menghasilkan jumlah panenan mikroalga yang banyak sehingga dapat diperoleh manfaat yang lebih banyak pula. Salah satu teknik pemisahan mikroalga yang akan dikaji adalah teknik pemisahan mikroalga dengan cara elektrokoagulasi. Jika dibandingkan dengan teknik koagulasi secara kimia (metode jar test), teknik elektrokoagulasi memerlukan biaya yang lebih murah karena pada teknik elektrokoagulasi tidak membutuhkan bahan kimia tambahan. Untuk itu pengkajian mengenai penggunaan teknik elektrokoagulasi untuk pemisahan mikroalga perlu dilakukan. Selain untuk pemisahan mikroalga dari medianya, elektrokoagulasi juga dapat membantu menurunkan zat pencemar dilihat dari parameter COD, kadar fosfat, warna, dan kekeruhan dari limbah cair.
B.
TUJUAN
II. TINJAUAN PUSTAKA
2.1 KULTIVASI MIKROALGA
2.1.1 Definisi Alga dan Mikroalga
Pelczar dan Reid (1958) mendefinisikan alga sebagai tumbuhan sederhana, yang tidak memiliki akar, batang dan daun. Alga memiliki klorofil yang menyebabkan mereka dapat mensintesis makanan sendiri dengan melakukan fotosintesis. Alga menggunakan energi dari cahaya matahari untuk mengubah bahan inorganik menjadi senyawa organik dalam selnya.
Menurut Kanibawa (2001), mikroalga merupakan jasad renik atau mikroorganisme dengan tingkat organisasi sel termasuk dalam tumbuhan tingkat rendah. Mikroalga dikelompokan dalam filum thalophyta. Kawaroe (2010) menjelaskan mikroalga (juga lazim disebut fitoplakton) merupakan kelompok tumbuhan berukuran renik, baik sel tunggal maupun koloni yang hidup di seluruh wilayah perairan tawar dan laut.
Presscott (1978) menambahkan bahwa sebagian besar alga yang tumbuh di air tawar tergolong ke dalam mikroalga karena bersifat mikroskopik. Namun ada beberapa jenis yang dapat dilihat tanpa menggunakan bantuan mikroskop. Mikroalga yang hidup di air tawar dapat
menyebabkan “water-bloom”.
Keragaman alga cukup besar, ukuran alga bermacam - macam mulai dari yang terkecil memiliki diameter 0,2 - 2 µm hingga yang besar mencapai 60 meter panjangnya. Keanekaragaman alga juga dilihat dari ekologi dan habitannya, struktur selnya, tingkat morfologinya, pigmen fotosintesis yang dimilikinya. Istilah alga mencakup makroalga (berukuran besar) dan mikroorganisme yang biasa dikenal sebagai mikroalga. Spesies alga diperkirakan mencapai satu sampai sepuluh juta spesies dan kebanyakan adalah golongan mikroalga (Barsanti dan Gualtieri 2006).
Tabel 1. Golongan Besar Alga
Nama Grup
Sistem Pigmen Komposisi Dinding Sel Bahan cadangan Jumlah Flagel Rentang Struktur Klorofil Pigmen
Lain Alga Hijau
(Chlorophyta)
a + b - Selulosa Pati Umumnya dua flagel per sel Uniseluler, mirip tumbuhan, multiseluler Euglena (Euglenophyta)
a + b - Tidak memiliki dinding sel Lemak dan Paramilum
Satu, dua atau tiga flagel per sel
Semua Uniseluler
Dinoflagelata (Phyrrophyta)
a + c Karotenoid tertentu
Selulosa Pati dan Minyak
Dua flagelata, (bentuk dan posisinya dalam sel tidak sama)
Kebanyakan Uniseluler dan berbentuk filament atau lembaran
Chrysophyta dan diatom (Chrysophyta)
a + c Karotenoid tertentu
Silica dan beberapa tidak memiliki dinding sel Leocosin dan minyak Dua Flagelata
Uniseluler dan lembaran
Alga Cokelat a + c Karotenoid tertentu Selulosa dan algin Laminarin dan lemak Dua Flagelata dengan panjang yang tidak sama
Mirip tanaman, multiseluler
Alga Merah a Phycobilin Selulosa Pati Tidak memiliki Flagel
2.1.2 Sifat Mikroalga
Sebagai bagian dari alga, mikroalga memiliki sifat yang hampir sama dengan alga lainnya. Beberapa alga yang melakukan fotosintesis dan menggunakan CO2 sebagai sumber karbon dapat tumbuh dengan baik pada tempat gelap dengan menghabiskan beberapa senyawa organik. Hal ini berarti sifat metabolismenya berubah dari fotosintesis menjadi respirasi. Perubahan ini tergantung pada keberadaan sinar matahari. Alga yang seluruhnya terbungkus oleh dinding sel adalah osmotropik. Sumber energi yang digunakan untuk pertumbuhan alga di tempat gelap tergantung dari keberadaan substrat organik yang terlarut di dalam media. Beberapa mikroalga yang tidak mempunyai dinding sel dapat menelan bakteri atau organisme yang lebih kecil (Stanier, 1976).
Menurut Pleczar dan Chan (1986), alga menyimpan berbagai produk makanan cadangan hasil kegiatan fotosintesis sebagai granula di dalam selnya. Alga dapat menyimpan kelebihan nutrien dalam massa selnya. Oleh karena itu, alga dapat digunakan sebagai alat untuk mengambil beberapa nutrien yang terdapat pada hasil buangan atau limbah cair. Pengambilan nutrien dalam sistem alga akan memberikan hasil yang baik apabila tersedia tanah yang cukup luas, cukup mendapatkan sinar matahari, dan jenis alga yang ditumbuhkan cukup mudah dipanen dan dimanfaatkan.
Diantara mikroorganisme yang melakukan fotosintesis, mikroalga merupakan mikroorganisme yang paling efisien dalam menggunakan sinar matahari, yaitu sekitar 7% dengan kemampuan produksi 60 - 80 ton berat kering/ha/tahun, sedangkan produktivitas tanaman budidaya secara konvensional berkisar antara 10 - 30 ton berat kering/ha.tahun. Walaupun sama - sama tergolong mikroorganisme, alga dan bakteri memiliki perbedaan syarat lingkungan hidup dan sifat fisiologisnya. Hal tersebut dapat dilihat pada Tabel 2 berikut.
Tabel 2. Beberapa perbedaan syarat lingkungan hidup dan sifat Fisiologis antara Alga dan Bakteri
Karakteristik Alga Bakteri
pH optimum 4 - 11 6,5 - 7,5
Suhu optimum 20 - 30°C 20 - 37°C
Kebutuhan oksigen Aerobik Aerobik atau anaerobik
Cahaya Sebagian besar Sebagian kecil
Sumber Karbon Kabanyakan organik Organik dan anorganik Dinding Sel Sebagian besar selulosa,
beberapa digantikan oleh xilan dan manan
Peptidoglikan
Sumber : Pleczar dan Chan (1986)
2.1.3 Komposisi Sel Mikroalga
Komposisi nutrisi yang dikandung mikroalga sangat tergantung pada ukuran sel, daya cerna, komposisi biokimia yang dimilikinya. Komposisi nutrisi yang dikandung oleh jenis mikroalga satu berbeda dengan mikroalga lainnya. Menurut Fogg (1973) walaupun komposisi nutrisi pada setiap mikroalga berbeda, protein merupakan senyawa yang dominan, kemudian diikuti oleh lipid dan karbohidrat.
Komponen lipid dalam mikroalga (khususnya mikroalga hijau-biru) yang beragam, banyak terdapat lamela fotosintesis. Lipid ini terlibat dalam transport elektron, pengambilan cahaya sekaligus perlindungan terhadap cahaya yang berlebihan, dan kemungkinan besar juga berperan pada proses evolusi oksigen. Komponen lipid dalam mikroalga terbagi atas beberapa kategori yaitu klorofil, karotenoid, digliserida, quinon, dan sterol. Selain kelima kategori ini terdapat pula lipid droplet yang menyebar diantara tilakoid sel dan didekat permukaan sel (Fogg et al. 1973).
Tabel 3. Berikut ini menunjukkan komposisi nutrisi sel mikroalga (blue-green alga). Tabel 3. Komposisi Sel Blue-Green Alga
Komponen Persentase (%)
Protein 50
Karbohidrat 30
Lipid 5
Abu 15
Sumber : Fogg (1973)
2.1.4 Media Pertumbuhan Mikroalga
Alga dapat tumbuh dihampir semua habitat. Alga dapat ditemukan di tanah, danau, sungai, dan perairan tawar. Kultur dapat didefinisikan sebagai lingkungan buatan dimana alga tumbuh. Kultur memiliki syarat tertentu untuk dapat ditumbuhi mikroalga, yaitu ketersediaan cahaya, CO2, dan nutrien.
Barsanti (2006) mengatakan bahwa parameter terpenting untuk pertumbuhan mikroalga adalah temperatur, cahaya, pH, salinitas, serta kuantitas dan kualitas nutrien. Tabel 4 berikut menunjukan contoh paremeter yang biasanya dapat ditumbuhi mikroalga.
Tabel 4. Kondisi tempat tumbuh mikroalga
Paremeter Satuan Nilai
Temperatur °C 16 - 27
Cahaya µE/sm2 100 - 200
PH 7 - 9
Salinitas g/L 20 - 24
Kuantitas dan kualitas nutrien juga merupakan substansi penting untuk pertumbuhan mikroalga. Menurut Richmond (1986) konsentrasi nutrien yang optimal bagi pertumbuhan strain mikroalga tertentu sangat bervariasi tergantung pada kerapatan populasi, intensitas matahari, suhu dan pH media.
Nutrien yang dibutuhkan mikroalga untuk tumbuh diketegorikan menjadi beberapa ketegori utama, yaitu sumber karbon, sumber nitrogen, sumber fosfor dan mikronurtien. Menurut Stainer (1976) mikroalga menggunakan CO2 sebagai sumber karbon. Barsanti (2006) menambahkan bahwa CO2 diperoleh mikroalga dari udara dan untuk menjaga ketersediaan CO2 tersebut kultur mikroalga sebaiknya diberi silkulator.
Kebanyakan mikroalga mempunyai kemampuan menggunakan ammonium (NH4), nitrit (NO3), dan nitrat (NO2), sedangkan kemampuan mengikat nitrogen dari udara hanya dimiliki oleh mikroalga prokariotik. Beberapa mikroalga dapat menggunakan berbagai senyawa N-organik seperti amida, urea, glutamin, dan asparagin sebagai sumber nitrogennya (Richmond 1986).
Fosfor merupakan salah satu elemen utama yang diperlukan untuk pertumbuhan mikroalga secara normal. Menurut Richmond (1986) kekurangan fosfor dapat menyebabkan perubahan morfologi sel, misalnya perubahan bentuk dan ukuran sel, karena fosfor berperan dalam transfer energi dan sintesa asam nukleat. Bentuk fosfor utama yang digunakan mikroalga adalah P-anorganik.
Beberapa mikronutrien yang esensial terhadap pertumbuhan mikroalga dapat dilihat pada Tabel 5.
Tabel 5. Beberapa Mikronutrien dan Peranannya pada Pertumbuhan Mikroalga
Unsur Peranan
Besi (Fe) Asimilasi nitrogen, fotosintesis, sintesa pigmen, fotosintesis utama (klorofil -A)
Bohr (B) Diperlukan oleh beberapa cyanobacteria dan diatom, tetapi tidak diperlukan oleh alga hijau.
Mangan dan Tembaga (Mn dan Cu)
Komponen penting dalam transfer elektron fotosintesis, sebagai komponen dan kofaktor beberapa enzim dan diperlukan oleh semua alga. Molibden (Mo) Diperlukan alga untuk reduksi nitrit dan fiksasi nitrogen
Vanadium (V) Penting bagi alga tertentu
Kobalt (Co) Diperlukan beberapa alga Cyanobacterium, seperti Calotrix parientina, Coccochloris peniocystic, Diplocystis aeruginosa.
Silikon Komponen utama dinding sel diatom
Selenium Meningkatkan Cyanobacterium dan menurunkan diatom
Media untuk pertumbuhan mikroalga diantaranya adalah laut (perairan asin) (Harrison dan Berges, 2005) dan perairan tawar (Watanabe, 2005). Selain berasal dari media alami, media untuk pertumbuhan mikroalga juga dapat dibuat (media sintetik). Menurut Barsanti (2006), media perairan tawar dipilih karena karakteristiknya mirip dengan lingkungan alam habitat mikroalga tumbuh. Media sintetik dikenal sebagai komposisi kimia sering dijadikan sebagai media tambahan yang digunakan untuk mensimulasikan kebutuhan nutrisi dan kebutuhan fisik dari jenis mikroalga tertentu. Tabel 6 berikut berisikan contoh komposisi kimia yang dibutuhkan untuk menumbuhkan mikroalga jenis diatom.
Tabel 6. Komposisi Media Diatom
Reagent Per (mg/ L)
Ca(NO3)2*4H2O KH2PO4 MgSO4 NaHCO3 EDTA FeNa EDTA Na2 H3BO3 MnCl2*4H2O (NH4)6Mo7O24*4H2O Biotin (Vitamin H) Thiamine (Vitamin B1)
Cyanocobalamin (Vitamin B12) Na2SiO3*9H2O
pH = 6,9
20 12,4 25 15,9 2,25 2,25 2,48 1,39 1,0 0,04 0,04 0,04 57
Sumber : Barsanti (2006)
2.2 PEMISAHAN MIKROALGA
Pemisahan mikroalga adalah bagian yang penting dari proses produksi mikroalga. Proses pemisahan menentukan banyak sedikitnya hasil mikroalga yang dapat diperoleh. Oleh karena itu, pemilihan dan penggunaan cara yang tepat sangat disarankan. Beberapa metode untuk pemisahan mikroalga diantaranya adalah sedimentasi, koagulasi/flokulasi, sentrifugasi, autokoagulasi, dan elektrokoagulasi.
2.2.1 Sedimentasi
Berdasarkan penelitian yang dilakukan Mohn (1988), penambahan ruang sedimentasi 300 m2 pada pengembangan mikroalga skala besar, dapat memisahkan 15m3/h mikroalga. Biasanya sedimentasi dilakukan setelah melakukan flokulasi. Selama sedimentasi endapan dipaksa untuk keluar melalui lubang kerucut pada dasar wadah melelui saluran. Pada proses sedimentasi, cairan jernih yang dihasilkan menunjukan efisiensi proses sedimentasi yang dilakukan.
2.2.2 Flotasi
Flotasi atau pengapungan adalah suatu cara untuk memisahkan padatan dari cairan dengan cara mengapungkan. Flotasi mudah untuk dilakukan karena terdapat beberapa zat padat atau substansi dengan kerapatan yang renggang sulit untuk diendapkan tetapi mudah untuh diapungkan. Cara untuk mengapungkan suspense tersebut biasanya dilakukan dengan memasukan gelembung udara pada larutan tersebut ( Sugiharto, 1987).
Lebih lanjut Mohn (1988) melakukan pemisahan mikroalga dengan cara flotasi. Mohn menyatakan bahwa proses operasi flotasi lebih efisien dibandingkan dengan sedimentasi dan juga menghasilkan fraksi padatan lebih tinggi sampai dengan 7%. Kekurangan dari proses pemisahan mikrolaga dengan flotasi adalah biaya investasi untuk fasilitas flotasi cukup tinggi.
2.2.3 Koagulasi/ Flokulasi
Koagulasi adalah proses penghilangan stabilitas partikel koloid sehingga perkembangan partikel dapat terjadi sebagai akibat dari benturan partikel. Sedangkan flokulasi adalah proses dimana ukuran partikel meningkat dikarenakan oleh benturan partikel. Proses koagulasi biasanya diikuti oleh proses flokulasi. Biasanya proses koagulasi flokulasi dilakukan dengan menambahkan bahan kimia pembantu yang biasanya dikenal sebagai koagulan dan flokulan. Koagulan dan flokulan yang biasanya digunakan adalah polimer, garam logam seperti alum atau ferric sulfat (Metcalf dan Eddy, 2004).
Menurut Oswald (1988) koagulan dan flokulan yang paling efektif untuk memisahkan alga adalah aluminium sulfat dan ferric sulfat. Reaksi yang terbentuk antara lain :
Al2(SO4)3 + 3Ca(HCO3)2 => 3CaSO4 + 2Al(OH)3 + 6CO2 Fe2(SO4)3 + 3Ca(HCO3)2 => 3CaSO4 + 2 Fe(OH)3 + 6CO2 2AlCl3 + 3Ca(HCO3)2 => 3CaCl2 + 2Al(OH)3 + 6CO2 2FeCl3 + 3Ca(HCO3)2 => 3CaCl2 + 2Fe(OH)3 + 6CO2
2.2.4 Filtrasi
2.2.5 Sentrifugasi
Proses sentrifugasi biasa digunakan untuk memisahkan padatan dan cairan dengan cara menghilangkan air yang ada pada larutan dengan menggunakan gaya sentrifugal (putaran). Setelah proses sentrifugasi selesai maka akan terbentuk endapan didasar dan cairan (supernatant) dibagian atas.
Oswald (1988) menerangkan bahwa kebanyakan spesies mikroalga dapat dipisahkan dari medianya dengan menggunakan sentrifugasi dengan rentang 500-3600 kali lebih cepat dibandingkan dengan menggunakan gaya gravitasi. Untuk menghasilkan 500 g alga memerlukan waktu 10 menit pada proses sentrifugasi dengan mangkuk padat.
2.2.6 Elektrokoagulasi
Elektrokoagulasi adalah suatu teknik pemisahan yang menggunakan sel elektrokimia yang biasa digunakan untuk menangani air. Elektrokoagulasi merupakan suatu teknik yang menjanjikan yang dapat diterapkan diberbagai bidang. Elektrokoagulasi terdiri dari tiga proses dasar yaitu elektrokimia, koagulasi dan flotasi. Ketiga proses dasar ini saling berinteraksi dan berhubungan untuk menjalankan elektrokoagulasi. Peranan ketiga proses dasar pada elektrokoagulasi dapat dilihat pada diagram venn berikut :
Gambar 1. Diagram venn proses yang mendasari elektrokoagulasi Sumber : Holt , 2002
Holt (2002) menambahkan elektrokoagulasi yang melibatkan proses elektrokimia, koagulasi dan flotasi tersebut dapat dilakukan dalam sebuah reaktor kontinyu ataupun dengan reaktor batch. Didalam setiap proses elektrokimia, akan digunakan elektrode yang bersentuhan langsung dengan air yang tercemar. Elektroda yang biasa digunakan adalah aluminium, besi dan stainless steel.
Aplikasi elektrokoagulasi yang sudah dilakukan dalam beberapa tahun belakangan
diantaranya penerapan elektrokoagulasi untuk peningkatan kualitas air (Ni’am et al., 2007;
Holt et al., 2004; Susetyaningsih et al., 2008). Selain itu elektrokoagulasi juga telah diteliti untuk diterapkan dalam rangka mengurangi kandungan logam pada limbah cair (Nouri et al., 2010; Hansen et al., 2007), untuk proses decolorization atau pengurangan zat warna berbahaya pada limbah cair (Ghosh et al., 2008; Essadki et al., 2008), untuk menangani limbah cair industri penyamakan kulit ( Babu et al., 2007) dan untuk pemisahan mikroalga dari effluent lumpur aktif.
Sedangkan ion negatif bergerak menuju anoda yang bermuatan positif yang kemudian ion-ion tersebut dinamakan sebagai anion-ion (bermuatan negatif) (Purwaningsih, 2008).
Berikut adalah gambaran yang dapat menunjukkan interaksi/ mekanisme yang terjadi didalam reaktor elektrokoagulasi.
Gambar 2. Mekanisme Elektrokoagulasi (Holt et.al ,2002)
Proses elektrokoagulasi memiliki kelebihan dan kekurangan dalam mengolah limbah cair.
a. Kelebihan Elektrokoagulasi
Elektrokoagulasi dalam pengolohan limbah sudah dilakukan sejak ratusan tahun yang lalu, tetapi abad 20 ini telah ditemukan berbagai pengembangan teknologi tentang elektrokoagulasi, berikut ini kelebihan dari elektrokoagulasi :
1. Elektrokoagulasi memerlukan peralatan sederhana dan mudah untuk dioperasikan.
2. Flok yang dihasilkan elektrokoagulasi ini sama dengan flok yang dihasilkan koagulasi biasa. 3. Keuntungan dari elektrokoagulasi ini lebih cepat mereduksi kandungan koloid/partikel yang
paling kecil, hal ini disebabkan pengaplikasian listrik kedalam air akan mempercepat pergerakan mereka didalam air dengan demikian akan memudahkan proses.
4. Gelembung-gelembung gas yang dihasilkan pada proses elektrokoagulasi ini dapat membawa polutan ke atas air sehingga dapat dengan mudah dihilangkan.
5. Dapat memberikan efisiensi proses yang cukup tinggi untuk berbagai kondisi, dikarenakan tidak dipengaruhi temperatur.
6. Tidak diperlukan pengaturan pH.
7. Tanpa menggunakan bahan kimia tambahan. b. Kelemahan Elektrokoagulasi
Ada beberapa kekurangan elektrokoagulasi ini, berikut ini kekurangan dari proses elektrokoagulasi :
electrons
H2(g)
electrons
OH -H2 gas formation
(Al3+)
Al
Al
Stable floc
Sludge
(Pollutant)
Pollutant settles
Al3+
Anode (oxidation)
Cathode (reduction)
Pollutant rises to surface
Hydrated cation
Precipitate Solution Chemistry
flocculation
coagulation
H2O
flotation
1. Tidak dapat digunakan untuk mengolah limbah cair yang mempunyai sifat elektrolit cukup tinggi dikarenakan akan terjadi hubungan singkat antar elektroda.
2. Besarnya reduksi logam berat dalam limbah cair dipengaruhi oleh besar kecilnya arus voltase listrik searah pada elektroda, luas sempitnya bidang kontak elektroda dan jarak antar elektroda.
III. METODOLOGI
3.1 ALAT DAN BAHAN
Alat yang digunakan dalam kultivasi yaitu 1 unit bak/ wahana raceway (p = 100 cm, l = 60 cm, dan t = 40 cm), 2 unit aquarium (p = 40 cm, l = 25 cm, dan t = 50 cm), saringan 35 mesh, derigen 25 liter sebanyak 8 buah. Alat yang digunakan untuk pengujian antara lain : spektrofotometer, COD reactor, Automatic N Distillator, Pompa vacum, pH meter, botol sampel berbagai ukuran, serta berbagai alat gelas seperti erlenmeyer, tabung reaksi, gelas ukur, pipet mohr, pipet tetes, buret, dan sudip. Alat yang digunakan untuk pemisahan mikroalga yaitu gelas piala ukuran 1 liter, pipet volumetrik, dan power supply.
Penelitian ini menggunakan dua jenis limbah sebagai media pertumbuhan yaitu limbah cair peternakan sapi dan limbah cair sintetik. Limbah cair peternakan adalah hasil buangan peternakan sapi yang berwujud cair. Limbah cair ini berasal dari air sisa pencucian kandang, pencucian alat - alat dan urin ternak. Limbah cair peternakan yang digunakan pada penelitian ini diambil dari unit peternakan Fahara Farm yang terletak di daerah Sindang Barang, Bogor, Jawa Barat. Limbah cair sintetik yang digunakan dibuat dengan cara menambahkan pupuk NPK kedalam air bersih yang dimasukkan kedalam aquarium. Tujuan penambahan pupuk NPK adalah agar air mengandung nutrisi dan bahan organik yang dibutuhkan untuk pertumbuhan mikroalga. Menurut Askari (2011), pupuk NPK tergolong kedalam pupuk majemuk karena mengandung tiga unsur sekaligus yaitu nitrogen dalam NH3 (15%), fosfor dalam bentuk P2O5 (15%), dan kalium dalam bentuk K2O (15%).
Kultur mikroalga yang akan ditumbuhkan atau dijadikan sebagai inokulum yakni kultur mikroalga alamiah yang berasal dari Danau LSI IPB. Hal ini dilakukan untuk mendapatkan mikroalga yang telah beradaptasi dengan cuaca dan iklim didaerah Bogor. Mikroalga yang diambil sebanyak 45 liter untuk diinokulasikan pada media limbah cair peternakan.
Berbagai macam bahan kimia yang digunakan dalam pengujian antara lain : NaOH 6N, larutan H2SO4 0,02%, larutan ammonium molybdat, larutan SnCl2, glycerol, air destilata, larutan K2Cr2O7, pereaksi asam COD H2SO4 , indikator ferroin, dan larutan Ferro Aluminium Sulfat (FAS) 0,1 M.
3.2 WAKTU DAN TEMPAT PENELITIAN
Penelitian ini dilakukan sejak bulan Februari hingga bulan Meret 2011, bertempat di Laboratorium Departemen Teknologi Industri Pertanian, Fakultas Taknologi Pertanian, Institut Pertanian Bogor, Bogor (Laboratorium Pengemasan, Laboratorium Pengawasan Mutu, Laboratorium Teknik Manajeman Lingkungan, dan Laboratorium Instrumen).
3.3 METODE PENELITIAN
3.3.1 Penumbuhan Mikroalga
ketinggian 22,5 cm dari bak kultivasi. Sedangkan inokulum mikroalga yang dimasukkan kedalam bak kultivasi sebanyak 45 Liter atau mencapai ketinggian 7,5 cm dari bak kultivasi.
Sebelum diinokulasikan mikroalga, dilakukan karakterisasi limbah cair peternakan yang digunakan serta dilakukan pretreatment (perlakuan pendahuluan). Perlakuan pendahuluan yang dilakukan diantaranya adalah penyaringan dan aerasi. Penyaringan bertujuan untuk menghilangkan kotoran dan zat terlarut berukuran besar yang ada pada limbah cair peternakan sedangkan aerasi dilakukan untuk menyuplai udara. Udara yang dimasukkan akan menciptakan gelembung untuk menaikan bahan - bahan terlarut. Penyediaan udara pada limbah cair juga membantu pada proses pendegradasian zat pencemar seperti nitrit, nitrat atau fosfat oleh mikroorganisme aerobik. Menurut Sirait et al. (2008), mengolah limbah secara aerobik memanfaatkan aktivitas mikroba aerob dalam kondisi aerob untuk menguraikan zat organik yang terdapat dalam air limbah menjadi zat inorganik yang stabil dan tidak memberikan dampak pencemaran terhadap lingkungan. Setelah dilakukan aerasi selama 7 hari, inokulum mikroalga dimasukkan kedalam bak kultivasi yang telah diisikan limbah cair peternakan. Waktu inkubasi yang dilakukan adalah selama 14 hari.
Berbeda dengan limbah cair peternakan, pada limbah cair sintetik tidak dilakukan pretreatment. Hal ini disebabkan karena asal limbah cair sintetik adalah air sumur yang bersih yang diberi pupuk NPK sehingga bahan organik yang berpotensi sebagai pencemar yang ada pada limbah cair sintetik dianggap tidak terlalu banyak dan tidak akan menganggu pertumbuhan mikroalga.
3.3.2 Penentuan Waktu Kontak
Penelitian pendahuluan dilakukan pada tahap pemisahan mikroalga. Tujuan dilakukannya penelitian pendahuluan adalah untuk menentukan waktu kontak yang dibutuhkan untuk pemisahan mikroalga yang akan dilakukan pada penelitian utama dengan menggunakan teknik elektrokoagulasi.
Sebanyak 1000 ml mikroalga dimasukkan kedalam gelas piala. Kemudian didalam gelas piala dipasangkan alat elektrokoagulasi berupa plat elektroda terbuat dari aluminium yang dipasangkan pada power supply dengan tegangan yang dapat diatur (9 V, 12 V dan 15 V). Pada penelitian pendahuluan ditetapkan waktu kontak pemisahan mikroalga selama 5, 10, 15, 20, dan 25 menit. Setiap selang waktu diamati reaksi dan perubahan yang terjadi.
3.3.3
Penelitian Utama
a. Prosedur Pemisahan Mikroalga dengan Teknik Elektrokoagulasi
Mikroalga yang telah dibiakkan pada media diambil untuk dipisahkan sebanyak 1 L untuk setiap parlakuan dan dimasukkan kedalam gelas piala. Kemudian dipasang rangkaian alat elektrokoagulasi yang terdiri dari power supply atau pembangkit tegangan dan plat elektroda. Pemisahan mikroalga pada penelitian ini dilakukan dengan sistem batch.
Setelah rangkaian elektrokoagulasi telah dipasang dan dihubungkan pada sumber listrik, pengatur tegangan diputar sesuai dengan besar tegangan yang diinginkan. Variasi besar tegangan yang digunakan adalah 9 Volt, 12 Volt, dan 15 Volt. Proses pemisahan dilakukan dengan beberapa variasi waktu yaitu 10, 20, 30, dan 40 menit. Setelah mencapai waktu yang ditentukan, proses elektrokoagulasi dihentikan. Sebelum sampel diambil, terlebih dahulu mikroalga didiamkan selama 15 menit dengan tujuan memberikan kesempatan pada flok yang terbentuk untuk terpisah secara sempurna dengan cara mengendap atau mengapung.
Sampel diambil sebanyak 100 ml untuk diuji dilaboratorium dengan parameter TSS, Kekeruhan, Warna, COD, Konsentrasi Fosfat, dan pH. Sampel diambil di 5 titik yang berbeda dengan menggunakan pipet volumetrik pada kedalaman kurang lebih setengah dari tinggi gelas piala atau sekitar 6 cm. Sampel yang telah diperoleh untuk masing - masing kombinasi perlakuan disimpan pada wadah.
Gambar 3. Rangkaian Elektrokoagulasi untuk Pemisahan Mikroalga
Total sampel yang diambil dari dua jenis media dan dua kali ulangan adalah 52 sampel. Setiap ulangan dari satu jenis media diambil 13 sampel dengan rincian sebagai berikut :
1. Satu sampel awal (sebelum perlakuan)
2. Satu sampel dengan tegangan 9 V dalam waktu pemisahan 10 menit 3. Satu sampel dengan tegangan 9 V dalam waktu pemisahan 20 menit 4. Satu sampel dengan tegangan 9 V dalam waktu pemisahan 30 menit 5. Satu sampel dengan tegangan 9 V dalam waktu pemisahan 40 menit 6. Satu sampel dengan tegangan 12 V dalam waktu pemisahan 10 menit 7. Satu sampel dengan tegangan 12 V dalam waktu pemisahan 20 menit 8. Satu sampel dengan tegangan 12 V dalam waktu pemisahan 30 menit 9. Satu sampel dengan tegangan 12 V dalam waktu pemisahan 40 menit 10. Satu sampel dengan tegangan 15 V dalam waktu pemisahan 10 menit 11. Satu sampel dengan tegangan 15 V dalam waktu pemisahan 20 menit 12. Satu sampel dengan tegangan 15 V dalam waktu pemisahan 30 menit 13. Satu sampel dengan tegangan 15 V dalam waktu pemisahan 40 menit
b. Rancangan Percobaan
Faktor yang diteliti pada penelitian ini adalah tegangan dan waktu elektrokoagulasi. Tegangan dihasilkan melalui power supply yang telah dibuat. Besarnya tegangan yang digunakan bervariasi yaitu 9 Volt, 12 Volt, dan 15 Volt. Sedangkan waktu kontak elektrokoagulasi yang digunakan adalah 10 , 20, 30, dan 40 menit. Pada penelitian ini
+
+
-
-
Power Supply
dilakukan kombinasi antara tegangan dan waktu kontak elektrokoagulasi. Selanjutnya akan diteliti apakah variasi tegangan dan waktu kontak elektrokoagulasi akan mempengaruhi pemisahan mikroalga dan parameter - parametar yang akan diamati.
Terdapat enam parameter yang akan diamati pada penelitian ini. Pertama adalah TSS (Total Suspended Solid) atau total padatan tersuspensi. TSS diukur sebagai banyaknya sel mikroalga yang dapat dipisahkan dengan menggunakan teknik elektrokoagulasi. Selisih jumlah TSS sebelum dan sesudah dilakukannya pemisahan dengan teknik elektrokoagulasi dihitung sebagai banyaknya mikroalga yang dapat terpisahkan.
Parameter lain yang akan diamati adalah kekeruhan, warna, COD, Fosfat, dan pH. Parameter - parameter tersebut biasa digunakan sebagai syarat pengelolaan limbah cair sebelum dibuang ke lingkungan. Pada penelitian ini akan diamati apakah perlakuan yang diberikan memberikan pengaruh terhadap parameter -parameter tersebut sebagai nilai tambah yang dapat diperoleh. Selain dapat memisahkan mikroalga, teknik elektrokoagulasi juga dapat digunakan untuk pengolahan limbah cair yang digunakan sebagai media sebelum dibuang ke lingkungan.
Setelah dilakukan perlakuan terhadap sampel penelitian, nilai yang diperoleh akan ditabulasi dan diuji secara statistik untuk mengetahui apakah perlakuan yang diberikan berpengaruh atau tidak. Metode pengujian yang digunakan adalah model rancangan acak blok (rancangan acak petak jalur). Rancangan petak jalur adalah rancangan faktorial yang bertujuan memeriksa interaksi dan faktor utama dengan tingkat ketelitian yang sama, artinya dideteksi dengan satu macam galat percobaan. Adapun model untuk rancangan petak jalur adalah sebagai berikut :
di mana :
Yijk : respon yang diamati µ : nilai tengah umum
Rk : Pengaruh kelompok atau ulangan ke-k Ai : Pangaruh faktor A yang ke-i
Bj : Pengaruh faktor B yang ke-j
ABij : Pengaruh interaksi faktor A ke-i, faktor B ke-j
ijk : Pengaruh sisa karena faktor A ke-I,faktor B ke-j, dan ulangan ke-k (Hicks, 1973)
Nilai yang diperoleh dari peralakuan akan dibuat tabulasi dan akan dilakukan analisis variannya (ANOVA). Adapun contoh gambaran ANOVA untuk rancangan petak jalur (blok) adalah sebagai berikut :
SK Db JK KT Fhitung F 5% F 1%
di mana :
SK : Sumber Keragaman JK : Jumlah Kuadrat KT : Kuadrat Tengah
Untuk menghitung JK, KT, dan F hitung digunakan rumus sebagai berikut :
Setelah ANOVA dari rancangan petak jalur diperoleh, selanjutnya dilakukan pengujian tahap lanjut dengan menggunakan metode UJD (Uji Jarak Duncan). UJD dilakukan untuk melihat perlakuan mana yang memiliki pengaruh yang signifikan. Nilai tengah perlakuan dengan selang perlakuan tertentu dibandingkan dengan nilai UJD. Untuk mencari UJD digunakan rumus
:
UJD = R
a(P; db Galat)x
√
di mana :
p : Banyaknya perlakuan
R: tergantung dari banyaknya perlakuan yang dibandingkan (lihat tabel rp)
(Sastrosupadi, 2000)
JK = ∑ X2
- KT = JK/db
Diagram alir 1 dan 2 berikut akan menjelaskan mengenai tahapan penelitian yang akan dilakukan.
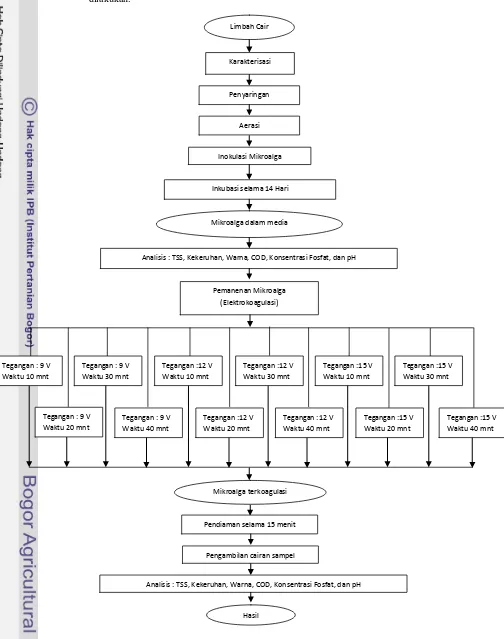
Gambar 4. Diagram alir penelitian 1 (limbah cair peternakan)
Hasil
Analisis : TSS, Kekeruhan, Warna, COD, Konsentrasi Fosfat, dan pH Pengambilan cairan sampel
Penyaringan
Aerasi
Inokulasi Mikroalga Limbah Cair
Karakterisasi
Inkubasi selama 14 Hari
Mikroalga dalam media
Analisis : TSS, Kekeruhan, Warna, COD, Konsentrasi Fosfat, dan pH
Pemanenan Mikroalga (Elektrokoagulasi)
Tegangan : 9 V Waktu 10 mnt
Tegangan : 9 V Waktu 30 mnt
Tegangan :12 V Waktu 10 mnt
Tegangan :12 V Waktu 30 mnt
Tegangan :15 V Waktu 10 mnt
Tegangan :15 V Waktu 30 mnt
Tegangan : 9 V Waktu 20 mnt
Tegangan : 9 V Waktu 40 mnt
Tegangan :12 V Waktu 20 mnt
Tegangan :12 V Waktu 40 mnt
Tegangan :15 V Waktu 20 mnt
Tegangan :15 V Waktu 40 mnt
Mikroalga terkoagulasi
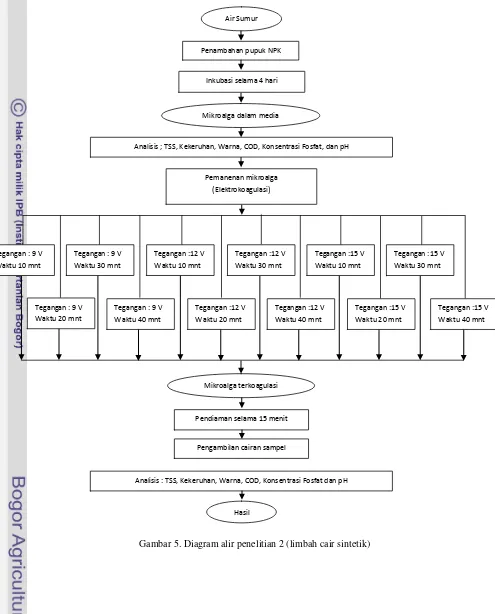
Gambar 5. Diagram alir penelitian 2 (limbah cair sintetik)
Pendiaman selama 15 menit Air Sumur
Penambahan pupuk NPK
Inkubasi selama 4 hari
Mikroalga dalam media
Pemanenan mikroalga (Elektrokoagulasi)
Analisis ; TSS, Kekeruhan, Warna, COD, Konsentrasi Fosfat, dan pH
Tegangan : 9 V Waktu 10 mnt
Tegangan : 9 V Waktu 30 mnt
Tegangan :12 V Waktu 10 mnt
Tegangan :12 V Waktu 30 mnt
Tegangan :15 V Waktu 10 mnt
Tegangan :15 V Waktu 30 mnt
Tegangan : 9 V Waktu 20 mnt
Tegangan : 9 V Waktu 40 mnt
Tegangan :12 V Waktu 20 mnt
Tegangan :12 V Waktu 40 mnt
Tegangan :15 V Waktu 20 mnt
Tegangan :15 V Waktu 40 mnt
Mikroalga terkoagulasi
Pengambilan cairan sampel
Analisis : TSS, Kekeruhan, Warna, COD, Konsentrasi Fosfat dan pH
IV. HASIL DAN PEMBAHASAN
4.1 PERTUMBUHAN MIKROALGA
Pertumbuhan mikroalga pada penelitian ini dilakukan pada dua jenis limbah yaitu limbah cair peternakan dan limbah cair sintetik. Penumbuhan pada limbah cair peternakan dilakukan pada bak kultivasi berukuran 100 cm x 60 cm x 40 cm. Sebanyak 135 liter limbah cair peternakan dimasukkan kedalam bak kultivasi. Sebelum dilakukan penanganan pendahuluan (pretreatment) terlebih dahulu dilakukan karakterisasi terhadap limbah cair peternakan yang digunakan. Tabel 7 berikut menunjukkan karakteristik limbah cair peternakan yang digunakan.
Tabel 7. Karakteristik limbah cair peternakan Sindang Barang
Parameter Satuan Nilai
TSS mg/L Suspended Solid 23
Kekeruhan FTU Turbidity 121
Warna Unit PtCo 614
COD mg/L 276
Fosfat mg/L 28,99
NH4+ mg/L 2,18
NO3- mg/L 9,64
pH 5,2
Berdasarkan hasil karakterisasi yang telah dilakukan, dapat dilihat bahwa kandungan senyawa organik yang ada pada limbah cair peternakan cukup tinggi. Hal ini dapat dilihat pada COD (Chemical Oxygen Demand) yang ada. Nilai COD yang dimiliki oleh limbah cair peternakan yang digunakan sebesar 276 mg/L. Dengan demikian limbah peternakan yang digunakan tergolong kedalam limbah tercemar karena melebihi baku mutu air limbah usaha peternakan sapi berdasarkan Peraturan Mentri Negara Lingkungan Hidup No. 11 tahun 2009 yaitu sebesar 200 mg/L. Untuk itu pengolahan pendahuluan diperlukan untuk menurunkan zat pencemar yang ada pada limbah tersebut.
Setelah pretreatment dilakukan, sebanyak 45 liter inokulum mikroalga dimasukkan pada media limbah cair peternakan kemudian dilakukan inkubasi selama 14 hari. pada hari ke 14 setelah diinokulasikan, mikroalga tumbuh pada limbah cair peternakan namun jumlahnya hanya sedikit. Mikroalga terlihat menumpuk pada bagian tepi bak dan hanya sedikit mikroalga yang berada pada permukaan.
[image:35.595.101.569.311.545.2]Berbeda dengan limbah cair peternakan, pada limbah cair sintetik tidak dilakukan pretreatment atau penanganan pendahuluan. Hal ini disebabkan karena asal limbah cair sintetik adalah dari air sumur yang bersih dan diberi pupuk NPK sehingga zat pencemar yang ada pada limbah cair sintetik dianggap masih belum terlalu banyak. Tujuan pemberian pupuk dilakukan agar air sumur yang digunakan mengandung bahan organik yang dibutuhkan mikroalga untuk tumbuh. Menurut Kowaroe et al. (2010) unsur hara yang dibutuhkan mikroalga terdiri dari mikronutrien dan makronutrien. Makronutrien antara lain C, H, N,P K, S, Mg dan Ca. Sedangkan makronutrien yang dibutuhkan antara lain adalah Fem Cu, Mn, Zn, Co, Mo, Bo, Vn. Dan Si. Biasanya dalam kultivasi mikroalga ditambahkan nutrien antara lain nitrat, fosfat dan silikat untuk memenuhi nutrien yang dibutuhkan. Pertumbuhan mikroalga pada limbah cair peternakan dapat dilihat pada Gambar 6 berikut.
Gambar 6. Mikroalga tumbuh pada limbah cair peternakan
Pertumbuhan mikroalga pada limbah cair sintetik dapat diindikasikan dengan perubahan warna air yang awalnya jernih atau bening menjadi berwarna hijau. Warna hijau yang timbul menandakan keberadaan mikroalga karena mikroalga memiliki pigmen hijau atau klorofil. Mikroalga yang biasa dijumpai di danau dan di kolam adalah Chlorophyta (alga hijau) yang memiliki klorofil dan mampu melakukan fotosintesis (Kowaroe, 2010). Perbedaan warna air setelah ditumbuhi mikroalga dapat dilihat pada Gambar 7 berikut.
A B
Gambar 7. Air Sebelum (A) dan Sesudah Ditumbuhi Mikroalga (B)
Waktu yang dibutuhkan mikroalga untuk tumbuh pada media limbah cair sintetik lebih cepat dibandingkan dengan limbah cair peternakan. Mikroalga tumbuh hanya dalam waktu 4 hari setelah pemberian pupuk. Hal ini dikarenakan pada limbah cair sintetik nutrisi dan bahan organik yang dibutuhkan mikroalga untuk tumbuh dapat tercukupi dengan baik. Menurut Askari (2011), pupuk NPK tergolong kedalam pupuk majemuk karena mengandung tiga unsur sekaligus yaitu nitrogen dalam NH3 (15%), fosfor dalam bentuk P2O5 (15%), dan kalium dalam bentuk K2O (15%). Barsanti (2006) menambahkan bahwa pertumbuhan mikroalga tidak dikontrol oleh total nutrien yang tersedia tetapi dikontrol oleh jumlah terkecil nutrien yang tersedia yang dibutuhkan oleh mikroalga tersebut.
Mikroalga pada limbah cair sintetik ditumbuhkan dengan menggunakan dua buah aquarium dengan volume 50 liter. Mikroalga yang sudah tumbuh pada aquarium dengan media limbah cair sintetik dapat dilihat pada Gambar 8 berikut. Dapat dilihat pada gambar tersebut mikroalga yang tumbuh cukup banyak yang tersebar pada cairan dan sebagian berkumpul pada permukaan limbah cair sintetik.
Gambar 8. Mikroalga yang Ditumbuhkan pada Media Limbah Cair Sintetik Sel Mikroalga yang
tumbuh
4.2 WAKTU KONTAK ELEKTROKOAGULASI
[image:37.595.76.556.291.620.2]Penentuan waktu kontak dilakukan pada penelitian pendahuluan. Sebanyak 1 liter mikroalga akan dipisahkan dengan menggunakan perangkat elektrokoagulasi. Tegangan yang digunakan adalah 9 , 12 dan 15 V sedangkan untuk waktu kontak awal yang digunakan adalah 5, 10, 15, 20 dan 25 menit. Hasil yang diperoleh menunjukkan bahwa pada waktu kontak 5 menit, elektrokoagulasi yang dilakukan belum menunjukkan pengaruh yang nyata. Gelembung udara pada elektroda belum dihasilkan. Pada waktu 25 menit flok mikroalga yang terbentuk masih terlalu kecil dan masih cenderung untuk melayang pada larutan dan tidak terpisah. Untuk itu diambil kesimpulan dari penelitian pendahuluan ini adalah perlu dilakukannya penambahan waktu kontak. Sehingga pada pemisahan mikroalga dengan elektrokoagulasi pada penelitian utama menggunakan waktu kontak 10, 20, 30 dan 40 menit serta diberi penambahan waktu 15 menit setelah elektrokoagulasi dilakukan. Mikroalga yang terbentuk pada waktu kontak 25 menit pada penelitian pendahuluan dapat dilihat pada Gambar 9 berikut.
Gambar 9. Flok mikroalga yang terbentuk
4.3 PENGARUH TEKNIK ELEKTROKOAGULASI
Setelah mikrolaga tumbuh pada kedua limbah, pemisahan mikroalga dilakukan dengan menerapkan teknik elektrokoagulasi. Pada masing - masing limbah, mikroalga yang diambil untuk pemisahan sebanyak 12 liter untuk setiap ulangan (terdapat dua ulangan). Variabel yang digunakan pada penelitian ini adalah tegangan dan waktu kontak. Tegangan memiliki tiga taraf perlakuan (9 V, 12 V, dan 15 V) dan waktu kontak memiliki empat taraf perlakuan (10, 20, 30, dan 40 menit). Masing - masing perlakuan akan diterapkan untuk memisahkan mikroalga sebanyak 1000 ml dengan sistem batch.
Flok mikroalga melayang pada larutan
Sebelum dilakukan pemisahan, terlebih dahulu dilakukan karakteristik kondisi awal mikroalga pada kedua jenis media. Kondisi awal limbah yang telah ditumbuhi mikroalga sebelum dipisahkan menggunakan teknik elektrokoagulasi dinilai sebagai kondisi mikroalga pada waktu kontak 0 menit. Kondisi awal limbah cair sebelum mikroalga dipisahkan dengan teknik elektrokoagulasi dapat dilihat pada Tabel 8 berikut.
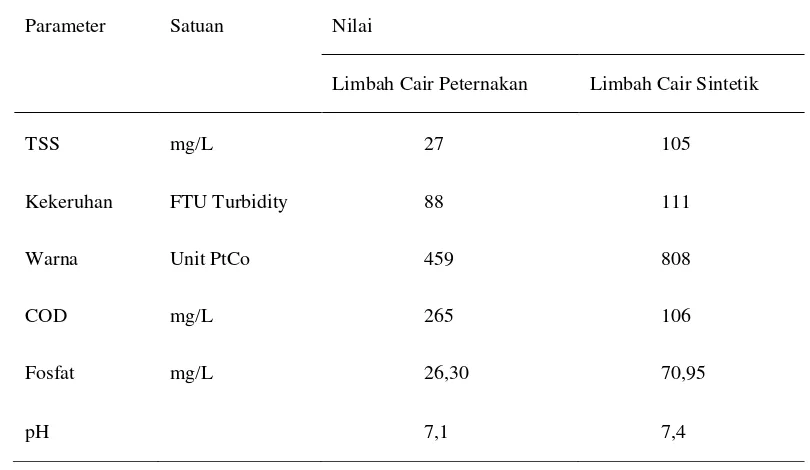
Tabel 8. Karakteristik awal limbah cair sebelum elektrokoagulasi Parameter Satuan Nilai
Limbah Cair Peternakan Limbah Cair Sintetik
TSS mg/L 27 105
Kekeruhan FTU Turbidity 88 111
Warna Unit PtCo 459 808
COD mg/L 265 106
Fosfat mg/L 26,30 70,95
pH 7,1 7,4
Dapat dilihat pada Tabel 8, nilai TSS yang diasumsikan sebagai jumlah mikroalga yang ada meningkat dari kondisi limbah cair peternakan sebelum diinokulasikan (lihat Tabel 7). Beberapa parameter lain seperti COD dan konsentrasi fosfat mengalami penurunan. Hal ini menandakan bahwa zat organik yang terdapat pada limbah cair peternakan dipergunakan untuk metabolisme mikroalga. Menurut Ginting (2007), penggunaan zat organik pada limbah menandakan terjadinya mekanisme pengolahan limbah cair secara biologis. Pengolahan limbah biologis yang terjadi pada penelitian ini terjadi secara aerobik. Karena mekanisme ini melibatkan oksigen yang dihasilkan oleh aerator yang dipasang. Mikroalga berperan dalam penyediaan oksigen untuk bakteri pengolah limbah. Hal ini terjadi karena mikroalga memiliki kemampuan untuk berfotosintesis dan menghasilkan oksigen.
4.3.1 TSS
TSS (Total Suspended Solid) atau total padatan tersuspensi adalah padatan yang tersuspensi di dalam air berupa bahan-bahan organik dan inorganik (Huda, 2009). Pada penelitian ini mikroalga yang dapat dipisahkan dilihat dari selisih nilai TSS sebelum dilakukan elektrokoagulasi dan nilai TSS setelah dilakukan elektrokoagulasi.
dibandingkan dengan limbah cair peternakan sehingga pertumbuhan mikroalga tidak mengalami hambatan.
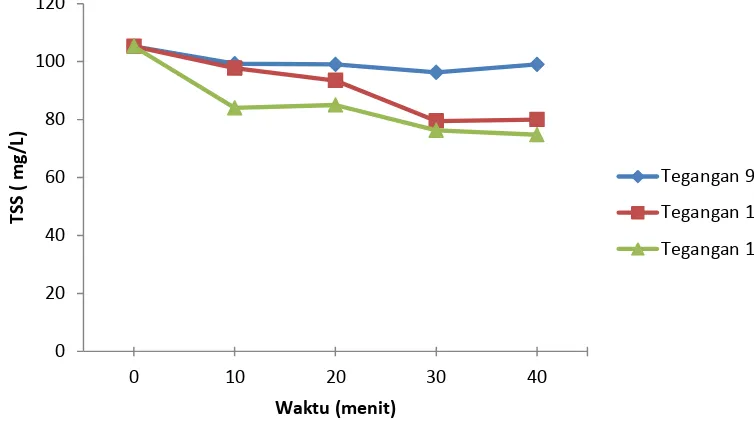
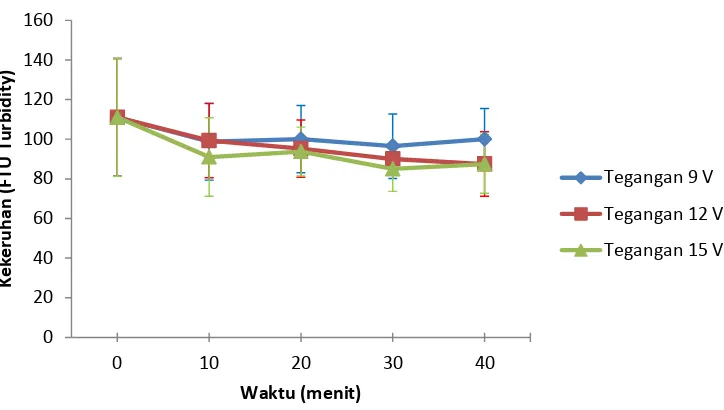
[image:39.595.145.522.430.642.2]Berikut ini adalah hasil penerapan teknik elektrokoagulasi untuk pemisahan mikroalga dari limbah cair peternakan dan pengaruhnya terhadap milai TSS limbah.
Gambar 10. Grafik nilai TSS limbah cair peternakan pada setiap perlakuan elektrokoagulasi
Hasil penerapan teknik elektrokoagulasi terhadap limbah cair sintetik dan pengaruhnya terhadap nilai TSS dapat dilihat pada Gambar 11 berikut.
Gambar 11. Grafik nilai TSS limbah cair sintetik pada setiap perlakuan elektrokoagulasi
Dapat dilihat pada Gambar 10 dan 11 bahwa penerapan elektrokoagulasi memberikan pengaruh terhadap penurunan nilai TSS.
Pengaruh elektrokoagulasi pada kedua jenis limbah yang digunakan menunjukkan hasil yang berbeda. Pada limbah cair peternakan (Gambar 10) elektrokoagulasi menyebabkan
0 5 10 15 20 25 30
0 10 20 30 40
TS
S
(m
g
/L)
Waktu (menit)
Tegangan 9 V
Tegangan 12 V
Tegangan 15 V
0 20 40 60 80 100 120
0 10 20 30 40
TS
S
( m
g
/L)
Waktu (menit)
Tegangan 9 V
Tegangan 12 V
penurunan nilai TSS untuk masing - masing tegangan dengan waktu kontak 10 menit. Namun terjadi peningkatan kembali pada tegangan 9 V dan 12 V dengan waktu kontak 20 sampai dengan 40 menit. Sedangkan pada tegangan 15 V terjadi penurunan mulai dari waktu kontak 0 sampai dengan 40 menit.
Efisiensi penurunan nilai TSS terbesar yang dapat dicapai pada limbah cair peternakan terjadi pada tegangan 9 V dengan waktu kontak 10 menit yaitu sebesar 51,55%. Sedangkan efisiensi penurunan TSS terkecil dicapai pada tegangan 12 V pada waktu 40 menit (Lampiran 1). Perlakuan elektrokoagulasi yang diterapkan rata - rata efisiensi penurunan mikroalga yang dapat dicapai sebesar 41,15%.
Pada pemisahan mikroalga dari limbah cair peternakan tidak terlalu sesuai dengan teori yang ada. Secara teori, semakin tinggi tegangan dan semakin lamanya waktu kontak yang diterapkan pada elektrokoagulasi maka nilai TSS yang dikandung akan semakin menurun. Ketidaksesuaian ini dikarenakan jumlah mikroalga yang tumbuh pada limbah cair peternakan tidak terlalu banyak sehingga pada saat koagulasi terjadi mikroalga yang terkoagulasi belum mencapai bobot yang cukup untuk mengendap sehingga cenderung melayang pada limbah. Sehingga pada saat pengambilan sampel untuk analisis mikroalga yang melayang ikut terbawa dan terhitung sebagai nilai TSS yang ada.
Pada pemisahan mikroalga dari limbah cair sintetik menunjukkan penurunan nilai TSS yang signifikan (Gambar 11). Semakin besar tegangan dan waktu kontak yang diberikan nilai TSS semakin rendah. Efisiensi penurunan nilai TSS tertinggi didapat dengan tegangan 15 V dengan waktu kontak 40 menit yaitu mencapai 28,98%. Sedangkan efisiensi penurunan nilai TSS yang terendah diperoleh pada tegangan 9 V dengan waktu kontak 10 menit yaitu 5,7% (Lampiran 2).
Teknik elektrokoagulasi yang diterapkan melibatkan reaksi elektrokimia didalamnya. Reaksi kimia yang terjadi adalah reaksi oksidasi dan reduksi. Pada saat elektrokoagulasi berlangsung reaksi yang terjadi pada kedua elektrodanya adalah sebagai berikut :
Reaksi di Anoda (Positif)
Pada anoda akan terjadi reaksi oksidasi dari logam penyusun elektrodanya. Dalam penelitian ini yang akan mengalami oksidasi adalah aluminium.
Al Al3+(aq) + 3e
-Al3+(aq) + 3 H2O Al(OH)3 + 3H+(aq)
nAl(OH)3 Aln(OH)3n Reaksi di Katoda (Negatif)
Pada Katoda akan terjadi reaksi reduksi. Reaksi pada katoda tergantung pada pH larutannya. Pada kondisi netral atau basa reaksi reduksi yang terjadi adalah reduksi air.
2H2O + 2e- H2(g)+ 2 OH-
Reaksi oksidasi pada anoda menghasilkan gugus Al(OH)3 sebagai hasil bergabungnya ion Al3+ dengan ion OH-. Gugus Al(OH)3 memiliki kemampuan untuk mengadsorbsi dan bertindak sebagai koagulan/flokulan. Semakin lama waktu elektrokoagulasi dilakukan maka aluminium yang mengalami reduksi semakin banyak dan semakin banyak pula gugus Al(OH)3 yang terbentuk. Dengan banyaknya koagulan yang terbentuk maka jumlah flok mikroalga yang terbentuk akan semakin banyak.
flotasi sehingga flok yang terbentuk akan berada dipermukaan cairan. Sedangkan ion hidroksi (OH-) yang terbentuk akan kembali berikatan dengan Al3+ dan membentuk koagulan - koagulan lainnya.
Melalui reaksi oksidasi inilah mikroalga dapat dipisahkan. Reaksi reduksi-oksidasi mengganggu kestabilan larutan limbah sehingga zat yang tersuspensi pada larutan tersebut juga mengalami destabilitas. Ketidakstabilan muatan pada limbah cair dan mikroalga menyebabkan mikroalga dengan muatan yang sejenis membentuk flok untuk mencapai kestabilannya k