TERHADAP LIMA JENIS ANTIMIKROBA
SECARA
IN VITRO
DAN
IN VIVO
RAMA PRIMA SYAHTI FAUZI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Resistensi Campylobacter jejuni Isolat Lokal terhadap Lima Jenis Antimikroba Secara In Vitro dan In Vivo adalah karya saya sendiri dengan arahan dari komisi pembimbing dan belum pernah diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Mei 2012
RAMA PRIMA SYAHTI FAUZI. Resistance ofCampylobacter jejuniLocal Isolates Against Five Type of Antimicrobials In Vitro and In Vivo. Under direction of MIRNAWATI B SUDARWANTO and USAMAH AFIFF.
Campylobacter jejuni is one of the foodborne zoonotic pathogens that cause gastroenteritis in humans. Many reports from different countries showed that Campylobacter jejuni was resistant to some antimicrobial such as erytromycin, enrofloxacin, and ciprofloxacin. The objective of this research were 1) to find the resistance of local isolates ofCampylobacter jejuni (Demak and Kudus) against five types of antimicrobials: amoxicillin, tetracycline, chloramphenicol, erytromycin, and ciprofloxacin, 2) to get the type and minimum inhibitory concentration (MIC) to inhibit Campylobacter jejuni infection and 3) to evaluate the effectiveness of five types of antimicrobials (amoxicillin, tetracycline, chloramphenicol, erytromycin, and ciprofloxacin) for the treatment of Campylobacter jejuni infection. Campylobacter jejuni was isolated from chicken meat that sold in the traditional markets and supermarkets. Resistance test was performed using disc diffusion method and broth dilution method. The result of disc diffusion method test showed that Demak isolates were resistant to two types of antimicrobials; ciprofloxacin (9 mm) and tetracycline (12,2 mm), while the Kudus isolates were sensitive to four types of antimicrobials. The results of broth dilution method test showed that Demak isolates were resistant to ciprofloxacin (5 g/ml) and tetracycline (20 g/ml), while the Kudus isolates were sensitive to five types of antimicrobials. To evaluate the effectiveness of five types of antimicrobials for the treatment of Campylobacter jejuni infection, chickens were infected orally with Campylobacter jejuni (104 CFU) and then treated with five antimicrobials in each group. The result showed that generally the use of antimicrobials in treated groups could maintain the body weight compared to the untreated groups. It could be concluded that the local isolates of Campylobacter jejuni were resistant to antimicrobials; nevertheless infected chicken could still be treated effectively with antimicrobials.
Terhadap Lima Jenis Antimikroba Secara In Vitro dan In Vivo. Dibimbing oleh MIRNAWATI B. SUDARWANTO dan USAMAH AFIFF.
Foodborne disease adalah penyakit yang disebabkan mengkonsumsi makanan tercemar. Campylobacter jejuni merupakan bakeri gram negatif bersifat motil dan memiliki bentuk spiral. Identifikasi menggunakan uji oksidase dan katalase + (positif) serta tidak mengoksidasi/memfermentasi karbohidrat. C. jejuni dapat di isolasi dari hewan baik liar maupun domestik. Bakteri Campylobacter sp merupakan patogen penyebab terjadinya penyakit kampilobakteriosis dan termasuk ke dalam foodborne diseases. Hasil penelitian Balai Penelitian Veteriner, Puslitbang Peternakan Bogor menemukan bahwa 71.43% (5/7) pabrik pakan di Kabupaten Bogor, Tanggerang, Cianjur, Bekasi, dan Sukabumi menggunakan antibiotik golongan tetrasiklin dan sulfonamid sebagai bahan tambahan pakan (Balitvet 1990; Bahri et al. 2000). Beberapa jenis antimikroba yang sering digunakan pada industri peternakan adalah tetrasiklin, siprofloksasin, enrofloksasin, doksisiklin, eritromisin, sulfonamid, trimetoprim, amoksisilin, neomisin, dan kolistin.
Campylobacter jejunimerupakan bakteri patogen penyebab gastroenteritis pada manusia yang tersebar luas diseluruh dunia. Insidensi terjadinya kampilobakteriosis terbanyak pada bayi dan anak-anak, diikuti orang dewasa antara usia 20-40 tahun (Lesmana 2003). Menurut Gilbert dan Gurdeau (2003) telah terjadi resistensi Campylobacter jejuni diberbagai negara terhadap antimikroba seperti eritromisin, enrofloksasin, dan siprofloksasin. Penggunaan antimikroba pada ternak yang tidak sesuai aturan dan tanpa pengawasan dokter hewan dapat menjadi faktor timbulnya resistensi terhadap antimikroba tersebut dan meningkatkan resiko perpindahan resistensi pada Campylobacter jejuni. Hal tersebut menjadi dasar pentingnya dilakukan penelitian terhadap resistensi Campylobacter jejuni isolat lokal terhadap beberapa jenis antimikroba.
kelompok bakteri zoonosis atau bakteri yang dapat ditularkan dari hewan ke manusia atau sebaliknya.
Penelitian ini terdiri dari dua tahap yang melibatkan proses secara in vitro dan in vivo. Tahap pertama meliputi isolasi, identifikasi, dan uji resisten in vitro. Tahapan ini bertujuan untuk mengetahui pola resistensi C. jejuni dan mendapatkan dosis Minimal Inhibitory Concentration (MIC) yang akan digunakan untuk pengobatan hewan coba pada penelitian tahap kedua. Tahap kedua melibatkan proses In Vivo meliputi pemeliharaan hewan coba, pengobatan, isolasi dan identifikasi. Tahapan kedua bertujuan untuk mengevaluasi dosis MIC yang digunakan setelah hewan coba di infeksi C. jejuni sebanyak 104 CFU dan mendapatkan jenis antimikroba yang tepat untuk mengurangi kerugian akibat kampilobakteriosis.
C. jejunidiisolasi dari bahan pangan asal hewan yakni daging ayam yang dijual di supermarket dan pasar tradisional di Kabupeten Demak dan Kudus. Isolasi dan identifikasi C. jejuni asal daging ayam menggunakan metode konvensional (BAM 2001). Hasil isolasi dan identifikasi dari kedua lokasi tersebut menghasilkan isolat lokal yakniC. jejuniasal Demak dan Kudus. Kemudian kedua isolat di uji resistensi terhadap lima jenis antimikroba yakni amoksisilin, tetrasiklin, kloramfenikol, eritromisin dan siprofloksasin secara in vitro dengan metode agar difusi untuk mengetahui diameter zona hambatan dan metode pengenceran untuk menentukan Minimal Inhibitory Concentration. Dari penelitian tahap pertama ini diperoleh profil resistensi isolat C. jejuni yang berasal dari daging ayam terhadap lima jenis antimikroba (amoksisilin, tetrasiklin, kloramfenikol, eritromisin, dan siprofloksasin). Berdasarkan hasil pengujian secara invitro terhadap isolat yang digunakan terdapat perbedaan karakter pola resistensi di kedua wilayah tersebut.
Hasil uji resistensi terhadap isolatC. jejuniasal Demak diperoleh bahwa bakteri tersebut resisten terhadap siprofloksasin dan tetrasiklin berdasarkan dua metode yang diterapkan. Hasil pengujian isolat Kudus terhadap lima jenis antimikroba menggunakan metode pengenceran menunjukkan bahwaC. jejuniisolat Kudus masih sensitif terhadap lima jenis antimikroba (siprofloksasin, tetrasiklin, kloramfenikol, dan eritromisin). Pengujian dengan menggunakan metode agar difusi diketahui keempat jenis antimikroba yaitu siprofloksasin, tetrasiklin, kloramfenikol, dan amoksisilin berada dalam zona hambatan sensitif, sedangkan eritromisin berada dalam zona antara.
Hasil yang diperoleh dari dua metode pengujian isolat Demak terhadap ke 5 jenis antimikroba maka C. jejuni isolat Demak resisten terhadap siproflokasin dan tetrasiklin. Hasil uji kedua metode untuk isolat Kudus menunjukkan bahwa ke lima jenis antimikroba tidak dalam batas resisten. Terdapat perbedaan pola respon terhadap kelima jenis antimikroba isolat Kudus dibandingkan dengan isolat Demak. Isolat Kudus cenderung masih sensitif pada dosis antimikroba yang rendah.
Pengamatan gejala klinis, 4) Pengobatan setelah 4 hari post infeksi selama 5 hari (amoksisilin, tetrasiklin, kloramfenikol, eritromisin, dan siprofloksasin) dosis MIC hasil uji resistensi tahap 1 dan, 5) Evaluasi usapan (swab) mukosa usus ayam keberadaanCampylobacter jejuni setelah pengobatan.
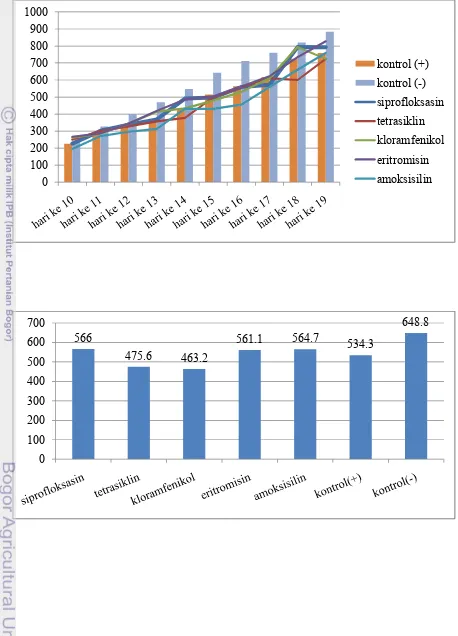
Dari hasil pengobatan terlihat bahwa dosis MIC yang diberikan kepada ayam yang di infeksi oleh C. jejuni isolat Demak sebagian besar efektif, kecuali kelompok ayam yang diobati dengan eritromisin. Pengamatan terhadap bobot badan ayam yang di infeksi dengan C. jejuni isolat Demak pada kelompok diobati dan tidak diobati terlihat bahwa bobot badan kelompok ayam yang diberikan pengobatan relatif tinggi dibandingkan dengan kelompok ayam tanpa pengobatan. Kelompok ayam yang tidak di infeksi menunjukkan bobot badan yang tertinggi dibandingkan dengan kedua kelompok ayam lainnya. Untuk isolat Kudus, dari hasil pengobatan terlihat bahwa dosis MIC yang diberikan kepada ayam yang di infeksi oleh C. jejuni isolat Kudus sebagian besar efektif, kecuali kelompok ayam yang diobati dengan tetrasiklin dan kloramfenikol. Hal tersebut dapat dipengaruhi oleh respon individu dan patogenitas bakteri. Pengamatan terhadap bobot badan ayam yang di infeksi dengan C. jejuni isolat Kudus pada kelompok diobati dan tidak diobati terlihat bahwa bobot badan kelompok ayam yang diberikan pengobatan relatif tinggi dibandingkan dengan kelompok ayam tanpa pengobatan. Kelompok ayam yang tidak di infeksi menunjukkan bobot badan yang tertinggi dibandingkan dengan kedua kelompok ayam lainnya.
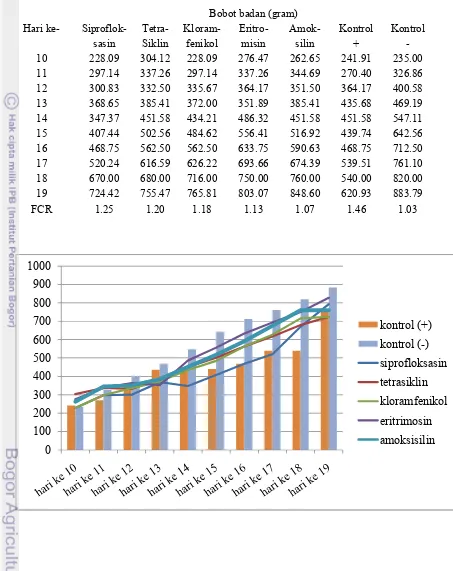
Sehubungan dengan kerugian ekonomi akibat infeksi C. jejuni, kaitannya dengan terapi yang bertujuan untuk mengetahui bagaimana antimikroba dapat mengurangi kerugian akibat kampilobakteriosis maka dilakukan penghitungan Feed Conversion Ratio (FCR) antara jumlah konsumsi pakan dibandingkan bobot akhir. Hasil yang diperoleh dalam penelitian adalah kelompok ayam dengan kampilobakteriosis apabila diberikan terapi antimikroba maka akan menghasilkan FCR yang relatif lebih kecil dibandingkan kelompok ayam dengan kampilobakteriosis tanpa pemberian antimikroba.
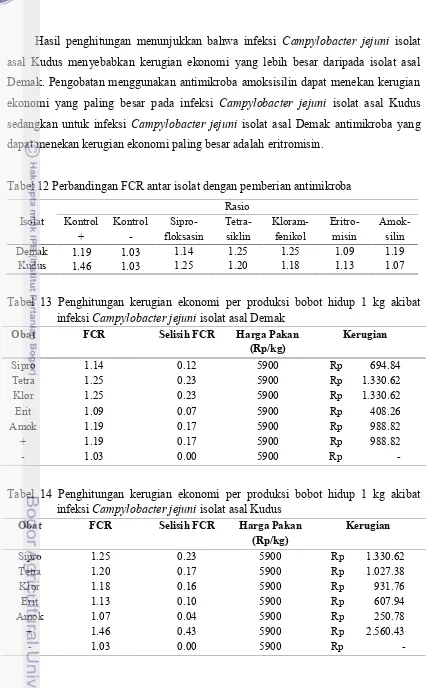
Perbandingan FCR antara kontrol positif dan kontrol negatif memberikan gambaran selisih manfaat yang akan didapat jika tidak terjadi infeksi C. jejunipada suatu kelompok ayam. Pada kelompok ayam yang di infeksi C. jejuni asal Demak terdapat selisih FCR antara kontrol positif (1.19) dan kontrol negatif (1.03) sebesar 0.17. Hasil uji pada kelompok ayam yang di infeksi C. jejuni asal Kudus terdapat selisih rasio antara kontrol positif (1.46) dan kontrol negatif (1.03) sebesar 0.43. Perbedaan FCR antara kontrol negatif dengan kontrol positif artinya dengan pola pemeliharaan dan pemberian pakan yang sama terdapat kerugian dalam pembentukan 1 kg bobot hidup ayam. Hal ini terjadi karena tidak efisiennya penyerapan usus akibat kerusakan epitel usus.
efektif mengurangi kerugian akibat infeksi isolat C. jejuni asal Demak yang digunakan dalam penelitian adalah eritromisin sedangkan jenis antimikroba yang paling efektif mengurangi kerugian akibat infeksi isolat C. jejuni asal Kudus yang digunakan dalam penelitian adalah amoksisilin.
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
TERHADAP LIMA JENIS ANTIMIKROBA
SECARA
IN VITRO
DAN
IN VIVO
RAMA PRIMA SYAHTI FAUZI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Kesehatan Masyarakat Veteriner
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama : Rama Prima Syahti Fauzi
NIM : B251080021
Disetujui :
Komisi Pembimbing
Prof. Dr. drh. Hj. Mirnawati B. Sudarwanto Ketua
drh. Usamah Afiff, M.Sc Anggota
Diketahui :
Ketua Program Studi Kesehatan Masyarakat Veteriner
Dr. drh. Denny W. Lukman, M.Si
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, M.Sc.Agr
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karuniaNya sehingga penulis dapat menyelesaikan penulisan tesis yang berjudul Resistensi Campylobacter jejuni isolat lokal terhadap Lima Jenis Antimikroba secara in Vitro danin Vivo, sebagai salah satu syarat memperoleh gelar Magister Sains pada Program Studi/Mayor Kesehatan Masyarakat Veteriner, Sekolah Pascasarjana, Institut Pertanian Bogor (IPB).
Pada kesempatan ini penulis menyampaikan rasa terima kasih dan penghargaan yang setinggi-tingginya kepada Prof. Dr. drh. Hj. Mirnawati B. Sudarwanto, selaku ketua komisi pembimbing dan drh. Usamah Afiff, M.Sc selaku anggota komisi pembimbing, yang dengan sabar dan tulus memberikan bimbingan, nasehat dan pengorbanan waktu yang diberikan selama masa penelitian sampai dengan penyelesaian tesis. Secara khusus penulis menyampaikan terima kasih kepada Kepala Balai Besar Veteriner Wates atas perkenannya memberikan dua isolat Campylobacter jejuni untuk digunakan dalam penelitian. Ucapan terima kasih penulis sampaikan atas bantuan pendanaan dalam penelitian dari program Kerjasama Kemitraan Penelitian Pertanian dengan Perguruan Tinggi (KKP3T) antara Institut Pertanian Bogor dengan Badan Penelitian dan Pengembangan Pertanian. Tidak lupa penulis juga menyampaikan terima kasih dan penghargaan kepada drh. Andriyani, M.Si dan drh. Herwin Pisestyani, M.Si atas segala bantuan selama penelitian sehingga penelitian dapat berjalan dengan baik.
Penulis menyampaikan rasa terima kasih kepada Dr. drh. Denny W. Lukman, M.Si selaku ketua Program Studi/Mayor Kesehatan Masyarakat Veteriner IPB beserta seluruh staf yang telah mencurahkan waktu, tenaga dan pikiran dalam proses belajar-mengajar selama penulis menempuh pendidikan. Ungkapan terima kasih penulis sampaikan kepada teman seperjuangan drh. Syafrison Idris, M.Si, rekan-rekan MKM 08 dan adik kami Murdiana dan Iin Nuraini atas dukungannya. Kepada papa dan mama serta adik-adik tercinta terimakasih atas segala doa restu, bimbingan, semangat dan didikan dalam keluarga sehingga ananda senantiasa terpacu menyelesaikan pendidikan S2.
Terimakasih kepada drh. Hernanto selaku pimpinan semasa menjadi karyawan Sanbe Farma sehingga penulis dapat melanjutkan kuliah dan Bapak Budi Winarso yang telah merekrut penulis sebagai health controlpada Pratama Perkasa farm. Rasa terima kasih juga penulis sampaikan kepada pimpinan di lingkungan Kedeputian III Kementerian Koordinator Bidang Kesejahteraan Rakyat dr. Emil Agustiono, M.Kes, dr. Chabib Afwan, dan drg. Naalih Kelsum, MPH yang telah memberikan izin selama masa penyelesaian studi.
Akhirnya dengan penuh rasa cinta penulis menyampaikan tulisan ini sebagai bekal ilmu selama menjalani kehidupan di masa depan untuk istri tercinta Eka Handayani yang selalu mengisi hari-hari penulis dengan senyuman, semangat dan motivasi, semoga tulisan ini menjadi berkah bagi kita, masyarakat dan Negara.
Penulis menyadari bahwa karya ilmiah ini belum sempurna, oleh karena itu dengan kerendahan hati penulis berharap pembaca dapat memberikan saran yang bermanfaat demi kesempurnaan karya tulis ini. Semoga karya ini dapat bermanfaat bagi kemajuan ilmu pengetahuan dan teknologi.
Bogor, Mei 2012
Penulis dilahirkan di Malang, Jawa Timur pada tanggal 26 April 1985 merupakan anak pertama dari tiga bersaudara pasangan Bapak Mochammad Syahfur Fauzi dan Ibu Titin Larasati.
Penulis menyelesaikan pendidikan sekolah dasar di SDN Tugu 1 Cimanggis-Depok pada tahun 1996 dan pada tahun 1999 penulis menyelesaikan sekolah menengah pertama di SLTPN 251 Jakarta Timur. Selanjutnya penulis menyelesaikan Sekolah Menengah Umum tahun 2002 di SMUN 39 Jakarta Timur, kemudian melanjutkan studi S1 sampai dengan dokter hewan di Fakultas Kedokteran Hewan Institut Pertanian Bogor Angkatan 39 dan lulus pada tahun 2008.
Halaman
Latar Belakang Timbulnya Resistensi Antimikroba pada Bakteri 6
Resistensi Bakteri Terhadap Antimikroba . 8
Klasifikasi, Farmakodinamika dan Farmakokinetika Antimikroba .. 12
Klasifikasi antimikroba 12
Farmakodinamik dan Farmakokinetik antimikroba . 17
Eritromisin .. 18
Waktu dan Tempat Penelitian 27
Materi Penelitian 27
Sampel isolat lokal 27
Hewan percobaan . 27
Media 28
Metode Penelitian .. 28
Isolasi dan identifikasiCampylobacter jejuni .. 29
Uji Resistensi Antimikroba .. 31
PenentuanMinimal Inhibitory Concentration (MIC) dan Minimal
Bactericidal Concentration(MBC) .
33
Uji Efektifitas Pengobatan Terhadap Hewan (in vivo) . 34
Pemeliharaan ayam broiler .. 34
Pengamatan gejala klinis yang timbul pasca infeksi ... 35
Pengobatan terhadap ayam terinfeksi .. 35
Evaluasi hasil pengobatan .. 35
HASIL DAN PEMBAHASAN . 37
Hasil UjiIn Vitro ... 37
Isolat Demak 37
Isolat Kudus . 38
Hasil UjiIn Vivo 40
Isolat Demak 40
Isolat Kudus . 44
Kerugian Ekonomi Hubungannya dengan Terapi .. 47
SIMPULAN DAN SARAN. .. 51
Halaman
1 Spektrum antimikroba (Sumber : Giguere 2006) .. . 13
2 Aktivitas beberapa antimikroba (Sumber : Giguere 2006).. .. 14
3 Pengelompokkan sampel uji resistensi .. 28
4 Hasil Pengujian oksidase, katalase dan API-Campy untuk identifikasi C. jejuni/coli
30
5 Pola Pemeliharaan dan Aktifitas Percobaan . 36
6 Hasil uji resistensi In Vitro terhadap isolat Campylobacter jejuni asal
Demak .
37
7 Hasil uji resistensi In Vitro terhadap isolat Campylobacter jejuni asal
Kudus .
39
8 Hasil ujiIn Vivoisolat Demak terhadap keberadaanCampylobacter jejuni.. 40
9 Hasil pengamatan pertambahan bobot badan isolat asal Demak 41 10 Hasil uji In Vivo isolat asal Kudus terhadap keberadaan Campylobacter
jejuni...
45
11 Hasil pengamatan pertambahan bobot badan isolat asal Kudus . 46 12 Perbandingan rasio antar isolat dengan pemberian antimikroba 49 13 Penghitungan kerugian ekonomi per produksi bobot hidup 1 kg akibat
infeksiCampylobacter jejuniisolat asal Demak
49
14 Penghitungan kerugian ekonomi per produksi bobot hidup 1 kg akibat infeksiCampylobacter jejuniisolat asal Kudus
Halaman
1 Mekanisme Resistensi Bakteri Gram Negatif (Sumber: Peleg dan Hooper
2010) ..
11
2 Mekanisme resistensi bakteri gram positif (Sumber: Arias dan Murray, 2009) 12
3 Skema pengenceran antimikroba 33
4 Pola resistensi isolatCampylobacter jejuniasal Demak 38
5 Pola resistensi isolatCampylobacter jejuniasal Kudus . 39
6 Diagram peningkatan bobot ayam harian yang di infeksi menggunakan C.
jejuniisolat asal Demak ..
42
7 Diagram peningkatan bobot ayam yang di infeksi menggunakan Campylobacter jejuniisolat asal Demak
42
8 Diagram peningkatan bobot ayam harian yang di infeksi menggunakan Campylobacter jejuniisolat asal Kudus
46
9 Diagram peningkatan bobot ayam yang di infeksi menggunakan Campylobacter jejuniisolat asal Kudus
DAFTAR LAMPIRAN
Halaman
1 Bagan alir pengujian Api-Campy® 59
2 Acuan kriteria resisten atau sensitif dalam penelitian 60
3 Hasil pengamatan terhadap kematian ayam coba .. 62
PENDAHULUAN
Latar Belakang
Bahan pangan merupakan kebutuhan pokok setiap manusia. Bahan pangan dapat berasal dari tumbuhan (nabati) dan hewan (hewani). Jenis bahan pangan asal hewan memiliki komposisi nutrisi (protein, karbohidrat, vitamin dan mineral) yang sangat cocok untuk perkembangan tubuh dan regenerasi sel sekaligus menjadi media yang cukup baik untuk perkembangan mikroorganisme yang berpotensi membawa bibit penyakit. Bahan pangan asal hewan sangat mudah rusak atau mudah terjadi proses pembusukan akibat pengaruh fisik, kimia, biologis dan mikrobiologis. Foodborne disease atau penyakit yang disebabkan akibat mengkonsumsi makanan tercemar patogen. Salah satu penyebab terjadinya foodborne
disease adalah Campylobacter jejuni. Kampilobakteriosis terjadi akibat mengkonsumsi pangan yang terkontaminasi dan tidak dimasak dengan benar. Infeksi ini digolongkan juga sebagai penyakit zoonosa yang ditularkan melalui makanan atau foodborne zoonoses.
Kampilobakteriosis pada manusia ditandai dengan gejala diare, nyeri abdominal, lemah, demam, mual dan muntah. Komplikasi akibat Campylobacter jejunimencakup gejala kejang febris pada anak, neonatal septikemi, reaktif arthritis, Guillain-Barre syndrome,
Reiter syndrome dan erythrema nodosum. Komplikasi ini biasanya terjadi pada penderita yang mengalami imunosupresi. Guillain Barre syndrome jarang sekali terjadi, sindrom ini berefek pada syaraf tubuh yang dimulai pada minggu pertama sejak timbulnya diare.
Tingginya penggunaan antimikroba dipengaruhi oleh jumlah kasus penyakit sedangkan kasus penyakit di dunia dipengaruhi oleh beberapa faktor seperti arus urbanisasi, polusi, perubahan demografis, penyebaran AIDS, munculnya kembali penyakit lama atau munculnya penyakit baru dan perdagangan global (WHO 2002). Peningkatan kebutuhan pangan dan penyebaran populasi manusia menjadi faktor penting dalam peningkatan pemakaian antimikroba sebagai terapi dalam pengobatan dan imbuhan pakan secara rutin pada industri peternakan. Perlakuan ini memberikan kontribusi terhadap terjadinya resistensi mikroba yang dapat ditransmisikan dari hewan ke manusia.
Rumusan Masalah
Campylobacter jejuni merupakan bakteri patogen penyebab gastroenteritis pada manusia yang tersebar luas diseluruh dunia. Insidensi terjadinya Campylobacter jejuni terbanyak pada bayi dan anak-anak, diikuti orang dewasa antara usia 20-40 tahun (Lesmana 2003). Menurut Gilbert (2003) telah terjadi resistensi Campylobacter jejuni diberbagai negara terhadap antimikroba seperti eritromisin, enrofloksasin dan siprofloksasin. Penggunaan antimikroba pada ternak yang tidak sesuai aturan dan tanpa pengawasan dokter hewan dapat menjadi faktor timbulnya resistensi terhadap antimikroba. Terjadinya kasus resistensi pada bakteri patogen maupun komensal terhadap antimikroba dapat meningkatkan resiko perpindahan resistensi padaCampylobacter jejuni. Penjelasan diatas menjadikan dasar pentingnya dilakukan penelitian terhadap resistensi Campylobacter jejuni isolat lokal terhadap beberapa jenis antimikroba.
Tujuan
Penelitian ini dilakukan dengan tujuan untuk : a) mengetahui profil resistensi terhadap 5 jenis antimikroba (amoksisilin, tetrasiklin, kloramfenikol, eritromisin dan siprofloksasin) isolat Campylobacter jejuni asal daging ayam; b) mendapatkan jenis antimikroba dan dosis yang tepat untuk mengurangi kerugian akibatCampylobacter jejuni.
Manfaat penelitian
siprofloksasin; b) mendapatkan jenis antimikroba yang efektif untuk mengurangi kerugian kampilobakteriosis pada unggas.
Hipotesis
Dalam penelitian ini disusun hipotesis sebagai berikut :
H0. = ditemukan resistensi Campylobacter jejuni isolat lokal terhadap satu atau lebih antimikroba yang diuji
TINJAUAN PUSTAKA
Campylobacter jejuni
Campylobacter jejuni pertama kali diisolasi pada tahun 1909 dari plasenta fetus ternak. Dalam perkembangannya genusCampylobacter jejunidibagi atas :
1. Campylobacter fetusyang bersifat oportunitis
2. Campylobacter jejuni dan Campylobacter coli yang bersifat patogen untuk manusia
Kampilobakteriosis pada umumnya disebabkan oleh Campylobacter jejuni dan Campylobacter coli. C. jejuni dan C. coli bersifat termofilik, Gram-negatif, berbentuk langsing dan melengkung, dan dapat bergerak (OIE 2008 dan Schlundt et al. 2004). Beberapa spesies Campylobacter yang telah diketahui adalah :
Campylobacter fetus, Campylobacter jejuni, Campylobacter coli, Campylobacter upsaliensis, Campylobacteri hyointestinalis, Campylobacteri lari, Campylobacteri sputorum,Campylobacter mucosalisdanCampylobacter rectus(Lesmana 2003).
Campylobacter jejuni merupakan bakteri gram negatif berbentuk batang bengkok (wing shape) atau seperti huruf S atau batang spiral (pada sel yang sudah tua berbentuk kokoid atau bulat). Memiliki ukuran lebar 0.2-0.9 µm dan panjang 0.5-5.0 µm. Bakteri ini tidak membentuk spora. Alat gerak bakteri ini berupa 1 buah flagella di kedua ujungnya dengan arah gerak positif. Campylobacter jejuni hidup pada kondisi mikroaerofilik (CO2 10%, 02 5% dan N2 85%). Bakteri ini bersifat invasif dan mampu membentuk toksin yang menyerupai toksin kolera. Pengkulturan
C. jejuni dalam media perlu ditambahkan antibiotika untuk mencegah persaingan dengan mikroflora lainnya.Koloni akan tumbuh bulat, meninggi, tembus sinar tetapi tidak transparan (translucent), dan kadang-kadang bersifat mukoid. Bakteri dapat di identifikasi dengan serangkaian uji biokimia(Lesmana 2003 dan Dharmojono 2001).
Gejala Klinis
tropis yang menderita Campylobacter jejuni menunjukkan gejala diare tanpa tanda peradangan. Infeksi yang bersifat simptomatik biasanya terjadi pada usia dibawah 1 tahun, sedangkan infeksi asimptomatik banyak dijumpai pada usia anak yang lebih dari 1 tahun. Patogenesis C. jejuni masih kurang dipahami. C. jejuni menimbukan enterokolitis akut yang tidak mudah dibedakan dengan penyakit yang disebabkan oleh patogen enterik lainnya (Schlundt et al. 2004). Gejala infeksi Campylobacter
jejuni dapat bervariasi namun gejala utamanya adalah : malaise, demam, nyeri perut, diare yang berlangsung beberapa hari sampai lebih dari 1 minggu (mengandung darah atau hanya air saja) serta mual dan muntah. Infeksi ekstra intestinal akibat
Campylobacter jejuni yang dapat terjadi, meliputi : bakteriemia, meningitis, abortus, sepsis neonatorum dan sindrom Guillain-Barre.
Sindrom Guillain-Barre adalah suatu kelainan paralitik dari sistem saraf perifer. Tidak semua jenis Campylobacter jejuni dapat menyebabkan sindrom ini, hanya beberapa serotipe tertentu saja, diantaranya yang paling banyak adalah serotipe O:19. Patogenesis dari sindrom ini belum dapat dijelaskan secara pasti namun diduga akibat suatu bagian yang mirip gangliosida di dalam lipopolisakarida Campylobacter jejuni mengadakan reaksi silang dengan jaringan syaraf perifer. Waktu inkubasi infeksi
Campylobacter jejuni biasanya berlangsung antara 2 sampai 4 hari, dengan jarak antara 1 sampai 10 hari, tergantung dari dosis yang masuk (Viray dan Lynch 2012).
Menurut Center for Food Security and Public Health Iowa State University
Cillege of Veterinary Medicine (2003) Campylobacter jejuni dapat menyerang sapi, kambing, domba, kalkun, anjing, kucing, marmot, babi, primata dan spesies lainnya. Hewan dapat terinfeksi tanpa menunjukkan gejala klinis. Masa inkubasi infeksi ini sangat singkat. Simptom enteritis muncul dalam 3 hari pada anak anjing, anak ayam dan ayam dewasa. Gejala yang tampak adalah timbulnya diare dengan feses yang berwarna kekuningan kadang disertai mucus atau darah.
Latar Belakang Timbulnya Resistensi Antimikroba pada Bakteri
penampilan ternak, peningkatkan produksi ternak, pemacu pertambahan bobot, serta efisiensi penggunaan pakan. Pemakaian antibiotik sebagai imbuhan pakan biasanya digunakan pada industri ternak potong, terutama ternak ayam dan babi serta ternak penghasil susu untuk konsumsi manusia (EMEA 1999, Furuya dan Lowy 2006).
Menurut Feed Animal Compedium (Anonim 2002) antimikroba yang direkomendasikan dipakai sebagai imbuhan pakan unggas adalah penisilin, basitrasin, streptomisin, eritromisin, tilosin, neomisin, tetrasiklin, oksitetrasiklin, klortetrasiklin, linkomisin, spiramisin dan virginiamisin. Dosis antimikroba yang digunakan sebagai imbuhan pakan biasanya lebih rendah dibanding dosis pengobatan.
Pemakaian antimikroba sebagai imbuhan pakan dengan dosis yang tidak tepat dapat memicu resistensi mikroba terhadap bakteri. Akibat yang akan terjadi jika pemakaian antimikroba seperti hal diatas maka hanya bakteri resisten yang mampu bertahan hidup dalam ekosistemnya sedangkan bakteri yang sensitif akan tereliminasi (Furuya dan Lowy 2006).
penanggulangan penyakit tanpa pengawasan dokter hewan. Luasnya penggunaan antimikroba dalam terapi dan imbuhan pakan pada hewan secara tidak langsung meningkatkan risiko terjadinya resistensi bakteri seperti Salmonella dan
Campylobacter jejunidan memiliki kemungkinan bakteri tersebut dapat masuk dalam makanan yang kemudian menginfeksi manusia (WHO 2002).
Resistensi bakteri merupakan masalah yang harus mendapat perhatian khusus karena menyebabkan terjadinya banyak kegagalan pada terapi dengan antimikroba. Berbagai strategi disusun untuk mengatasi masalah resistensi, diantaranya dengan mencari antimikroba baru atau menciptakan antimikroba semisintetik. Meskipun demikian ternyata usaha ini belum dapat memecahkan masalah. Kehadiran antimikroba baru diikuti jenis resitensi baru dari bakteri sebagai pertahanan hidup. Penggunaan bermacam-macam antimikroba yang tersedia telah mengakibatkan munculnya banyak jenis bakteri yang resisten terhadap lebih dari satu jenis antimikroba (multiple drug resistance).
Resistensi Bakteri Terhadap Antimikroba
Menurut The Committee for Veterinary Medical Products, istilah resistensi antimikroba mengacu pada dua pengertian, yaitu resistensi mikrobial dan resistensi klinik. Resistensi mikrobial adalah suatu proses biologi yang terkait dengan berbagai mekanisme resistensi yang melibatkan peran gen resistensi dalam satu bakteri. Resistensi mikrobial dipengaruhi oleh suatu enzim yang membuat agen antimikroba tidak aktif (EMEA 1999, Fluit et al.2001). Resistensi klinis adalah resistensi bakteri berdasarkan efek yang ditimbulkan terhadap bakteri setelah pengobatan. Pengertian resistensi klinik berkaitan dengan keberhasilan suatu pengobatan dengan antimikroba yang tergantung dari dosis yang diberikan, spesies agen penyakit, mekanisme farmakokinetik antimikroba, status pertahanan tubuh inang dan konsentrasi antimikroba yang dapat mencapai bakteri dalam organ atau jaringan tubuh induk semang (EMEA 1999, Fluitet al.2001).
resistensi terhadap antimikroba ternyata dapat berpindah antara DNA kromosom dan DNA ekstra kromosom bakteri, baik antar spesies yang sama maupun spesies yang berbeda atau antara bakteri gram positif dengan bakteri gram negatif (Courvalin 1994, Tassioset al.1997, Linget al.1998, Nastasiet al.2000).
Resistensi kromosomal adalah resistensi yang timbul karena adanya mutasi susunan asam nukleat dalam kromosom bakteri. Mutasi tersebut mengakibatkan terjadinya sintesis protein atau makromolekul lain yang berbeda sehingga mengganggu aktivitas antimikroba terhadap sel inang. Mutasi dalam kromosom terjadi karena pendedahan yang terus menerus (Anonim 2006). Perkembangan resistensi antimikroba karena mutasi biasanya spesifik terhadap antimikroba tertentu atau spesifik untuk golongan antimikroba yang sama atau berdekatan dan sifat ini dapat diturunkan (EMEA 1999).
Plasmid merupakan elemen genetik yang terdapat diluar kromosom yang dimiliki oleh sebagian bakteri gram positif, gram negatif dan beberapa khamir (EMEA 1999). Plasmid dapat bereplikasi sendiri tanpa bergantung dari kromosom dan plasmid mengandung materi genetik. Plasmid berperan penting dalam evolusi, metabolisme, fertilitas. Plasmid mengandung berbagai macam gen seperti gen resistensi terhadap antimikroba dan logam berat, gen pengendali produksi toksin, gen perangsang pertumbuhan tumor dan lain-lain (Anonim 2006). Plasmid pengendali gen resistensi adalah plasmid R yang ditemukan di Jepang saat terjadi wabah disentri olehShigella dysentrie. Sifat resistensi pada plasmid lebih mudah berpindah daripada dalam kromosom, karena plasmid dapat dipindahkan antar sel baik yang sama maupun berbeda spesies (Courvalin 1994, Davies 1997).
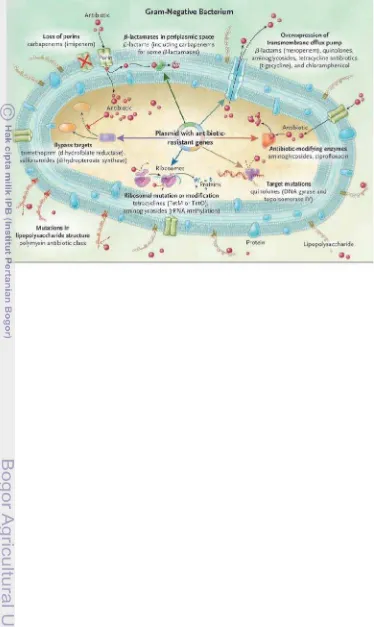
Menurut Peleg and Hooper (2010) terdapat beberapa mekanisme resistensi antimikroba dari bakteri gram negatif yang digunakan sebagai perlawanan terhadap antimikroba. Mekanisme-mekanisme tersebut adalah:
- Resistensi melalui penutupan celah atau pori (loss of porins) pada dinding sel bakteri, sehingga menurunkan jumlah obat yang melintasi membran sel; peningkatan produksi betalaktamase dalam periplasmik, sehingga merusak struktur betalaktam;
- Peningkatan aktivitas pompa keluaran (efflux pump) pada transmembran, sehingga bakteri akan membawa obat keluar sebelum memberikan efek;
- Modifikasi enzim-enzim, sehingga antimikroba tidak dapat berinteraksi dengan tempat target;
- Mutasi tempat target, sehingga mengahambat bergabungnya antimikroba dengan tempat aksi;
- Modifikasi atau mutasi ribosomal, sehingga mencegah bergabungnya antimikroba yang menghambat sistesis protein bakteri;
- Mekanisme langsung terhadap metabolik (metabolic bypass mechanism), yang merupakan enzim alternatif untuk melintasi efek penghambatan antimikroba; dan
Gambar 1 Mekanisme Resistensi Bakteri Gram Negatif (Peleg dan Hooper 2010)
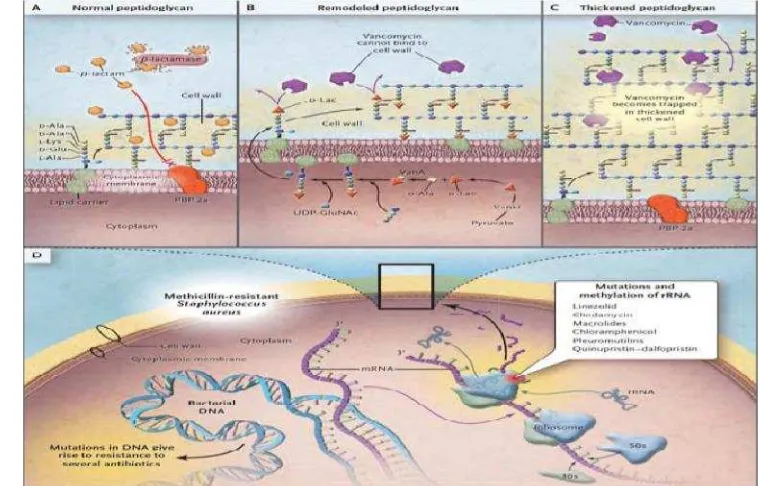
Gambar 2 Mekanisme resistensi bakteri gram positif (Sumber: Arias dan Murray, 2009)
Klasifikasi, Farmakodinamika dan Farmakokinetika Antimikroba Klasifikasi Antimikroba
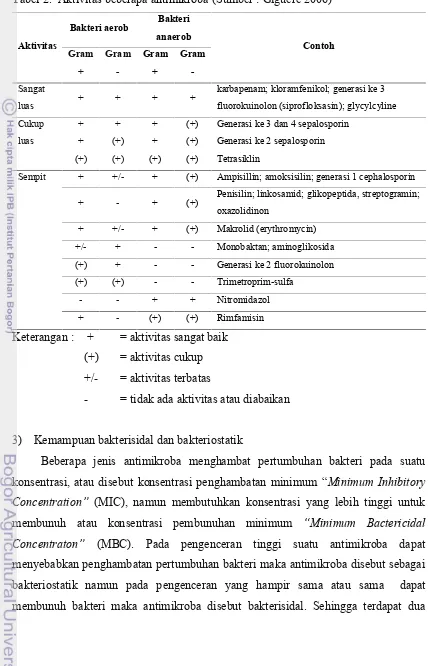
Menurut Giguere (2006) antimikroba adalah zat-zat yang dihasilkan oleh berbagai spesies mikroba maupun yang dibuat secara sintetik yang dalam jumlah kecil dapat membunuh/menghambat pertumbuhan mikroba lain (bakteri, jamur dll.). Obat antimikroba dapat diklasifikasikan berdasarkan beberapa kelompok yaitu : target mikroorganisme, aktivitas antibakteri, kemampuan bakterisidal atau bakteriostatik serta waktu dan konsentrasi obat, yang dapat dijelaskan sebagai berikut:
1) Target mikroorganisme
mikoplasma, rikettsia dan klamidia. Spektrum aktivitas terhadap target mikroorganisme dijelaskan pada Tabel 1.
2) Aktivitas antibakteri
Beberapa obat antimikroba hanya menghambat bakteri gram negatif atau gram positif saja sehingga disebut memiliki aktivitas yang sempit, sedangkan antimikroba denganaktivitas spektrum yang luas memiliki kemampuan menghambat atau bekerja pada bakteri gram negatif dan positif. Definisi ini tidak sepenuhnya mutlak karena beberapa jenis antimikroba dapat bekerja terhadap kedua kelompok bakteri baik gram positif dan negatif tetapi hanya menghambat sebagian jenis bakteri dari keduanya. Aktifitas beberapa jenis antimikroba terhadap kelompok bakteri gram positif maupun negatif dijelaskan pada Tabel2.
Tabel 1. Spektrum obat antimikroba (Sumber : Giguere 2006)
Antimikroba Kelas mikroorganisme
Bakteri Fungi Mikoplasma riketsia klamidia protozoa
Aminoglikosida + - + - -
-Beta-laktam + - - - -
-Kloramfenikol + - + + +
-Fluorokuinolon + - + + +
-Linkosamid + - + - -
+/-Makrolid + - + - +
+/-Oksazolidinon + - + - -
-Pleuromutilin + - + - +
-Tetrasiklin + - + + +
+/-Streptogramin + - + - +
+/-Sulfonamid + - + - + +
Trimethoprim + - - - - +
Tabel 2. Aktivitas beberapa antimikroba(Sumber : Giguere 2006)
karbapenam; kloramfenikol; generasi ke 3 fluorokuinolon (siprofloksasin); glycylcyline
Generasi ke 3 dan 4 sepalosporin Generasi ke 2 sepalosporin Tetrasiklin
Sempit + +/- + (+) Ampisillin; amoksisilin; generasi 1 cephalosporin
+ - + (+) Penisilin; linkosamid; glikopeptida, streptogramin; oxazolidinon
+ +/- + (+) Makrolid (erythromycin)
+/- + - - Monobaktan; aminoglikosida
(+) + - - Generasi ke 2 fluorokuinolon
(+) (+) - - Trimetroprim-sulfa
- - + + Nitromidazol
+ - (+) (+) Rimfamisin
Keterangan : + = aktivitas sangat baik (+) = aktivitas cukup +/- = aktivitas terbatas
- = tidak ada aktivitas atau diabaikan
3) Kemampuan bakterisidal dan bakteriostatik
Beberapa jenis antimikroba menghambat pertumbuhan bakteri pada suatu konsentrasi, atau disebut konsentrasi penghambatan minimum Minimum Inhibitory
Concentration (MIC), namun membutuhkan konsentrasi yang lebih tinggi untuk membunuh atau konsentrasi pembunuhan minimum Minimum Bactericidal
pengelompokkan yaitu : Bakteriostatik (kloramfenikol, tetrasiklin) dan Bakterisidal (beta-lactam, aminoglikosida). Hal ini tidak berlaku mutlak karena bergantung juga pada konsentrasi obat dan jenis mikroba target. Salah satu contohnya adalah benzyl penisilin dari kelompik bakterisidal namun pada konsentrasi rendah dapat sebagai bakteriostatik.
4) Waktu dan Konsentrasi obat
Antimikroba seringkali diklasifikasikan berdasarkan aktifitas waktu atau konsentrasi yang bergantung pada farmakodinamik. Farmakodinamik obat menggambarkan efek obat terhadap bakteri. Farmakokinetik obat menggambarkan konsentrasi obat dalam serum host yang melalui proses absorpsi, distribusi, metabolisme dan eliminasi. Ketika digabungkan dengan nilai MIC dapat memprediksi kemungkinan pemusnahan bakteri dan keberhasilan pengobatan. Beberapa jenis antimikroba mampu meningkatkan efek bakterisidal jika dilakukan penambahan konsentrasi. Beberapa jenis antimikroba juga membutuhkan waktu cukup lama dan konsentrasi tinggi untuk dapat bekerja efektif seperti fluoroquinolone dan aminoglikosida.
Berdasarkan aktivitasnya, antimikroba dibagi menjadi dua golongan besar, yaitu (Ganiswara 1995, Lüllmannet al.2005):
1. Antimikroba kerja luas (broad spektrum), yaitu agen yang dapat menghambat pertumbuhan dan mematikan bakteri gram positif maupun bakteri gram negatif. Golongan ini diharapkan dapat menghambat pertumbuhan dan mematikan sebagian besar bakteri. Yang termasuk golongan ini adalah tetrasiklin dan derivatnya, kloramfenikol, ampisilin, sefalosporin, carbapenem dan lain-lain. 2. Antimikroba kerja sempit (narrow spektrum) adalah golongan ini hanya aktif
terhadap beberapa bakteri saja. Yang termasuk golongan ini adalah penisilina, streptomisin, neomisin, basitrasin.
Penggolongan antimikroba berdasarkan cara kerjanya pada bakteri adalah sebagai berikut (Ganiswara 1995; Lüllmannet al.2005):
1. Antimikroba yang bekerja dengan menghambat sintesis dinding sel bakteri, misalnya penisilin, sefalosporin, carbapenem, basitrasin, vankomisin, sikloserin. 2. Antimikroba yang mengganggu keutuhan membran sel mikroba, yang termasuk
kelompok ini adalah polimiksin, golongan polien serta berbagai antibakteri kemoterapetik.
3. Antimikroba yang bekerja dengan menghambat sintesa protein, yang termasuk golongan ini adalah kloramfenikol, eritromisin, linkomisin, tetrasiklin dan antimikroba golongan aminoglikosida.
4. Antimikroba yang bekerja melalui penghambatan sintesis asam nukleat bakteri, yang termasuk golongan ini adalah asam nalidiksat, rifampisin, sulfonamid, trimetoprim.
5. Antimikroba yang menghambat metabolisme sel mikroba, yang termasuk dalam kelompok ini adalah sulfonamid, trimetoprim, asam p-aminosalisilat (PAS) dan sulfon.
Penggolongan antimikroba berdasarkan gugus kimianya dibagi atas (Katzung 2007) :
adalah menghambat pertumbuhan bakteri melalui pengaruhnya terhadap sintesis dinding sel. Dinding sel ini tidak ditemukan pada sel-sel tubuh manusia dan hewan, antara lain: golongan penisilin, sefalosporin dan sefamisin serta betalaktam lainnya.
2. Kloramfenikol, Tetrasiklin, Makrolida, Clindamisin dan Streptogramin
Golongan agen ini berperan dalam penghambatan sintesis protein bakteri dengan cara mengikat dan mengganggu ribosom, antara lain: kloramfenikol, tetrasiklin, makrolida, klindamisin, streptogramin, oksazolidinon.
3. Aminoglikosida
Golongan Aminoglikosida, antara lain: streptomisin, neomisin, kanamisin, amikasin, gentamisin, tobramisin, sisomicin, etilmicin, dan lain-lain.
4. Sulfonamida, Trimethoprim, dan Kuinolon
Sulfonamida, aktivitas antimikroba secara kompetitif menghambat sintesis dihidropteroat. Antimikroba golongan Sulfonamida, antara lain Sulfasitin, sulfisoksazole, sulfamethizole, sulfadiazine, sulfamethoksazole, sulfapiridin, sulfadoxine dan golongan pirimidin adalah trimethoprim. Trimethoprim dan kombinasi trimetoprim-sulfametoksazol menghambat bakteri melalui jalur asam dihidrofolat reduktase dan menghambat aktivitas reduktase asam dihidrofolik protozoa, sehingga menghasilkan efek sinergis. Fluoroquinolon adalah quinolones yang mempunyai mekanisme menghambat sintesis DNA bakteri pada topoisomerase II (DNA girase) dan topoisomerase IV. Golongan obat ini adalah asam nalidiksat, asam oksolinat, sinoksasin, siprofloksasin, levofloksasin, slinafloksasin, enoksasin, gatifloksasin, lomefloksasin, moxifloksasin, norfloksasin, ofloksasin, sparfloksasin dan trovafloksasin dan lain-lain.
Farmakodinamika dan Farmakokinetika Antimikroba
a. Eritromisin
Eritromisin merupakan antimikroba yang masuk dalam kelompok makrolida. Obat ini sulit larut dalam air (0,1%) namun dapat langsung larut pada zat-zat pelarut organik. Larutan ini cukup stabil pada suhu 4oC, tetapi aktivitasnya dapat hilang dengan cepat pada suhu 20oC dan kondisi asam. Eritromisin memiliki aktivitas farmakodinamik antimikroba yang efektif terhadap organisme-organisme gram positif, terutama Pneumokokkus, Streptokokkus, dan Corynebacteria, dalam konsentrasi plasma sebesar 0,02 mg/mL. Selain itu mycoplasma, legionella,
Chlamydia trachomatis, Chlamydia psittaci, Chlamydia pneumonia, helicobacter, Listeria, dan Mycobacteria tertentu, juga rentan terhadap eritromisin. Demikian pula organisme-organisme gram negatif, seperti spesies Neisseria, Bordetella pertussis,
Batonella henselae, dan Batonella quintana (agen-agen penyebab pada penyakit cat scratch dan angiomatosis basiler), beberapa spesies rickettisia,Tropenome pallidum, serta spesiesCampylobacter jejuni.
Antimikroba ini bekerja dengan cara menghambat sintesa protein Hambatan sintesis protein terjadi melalui ikatan ke RNA ribosom 50S. Sintesis protein terhambat karena reaksi-reaksi translokasi aminoasil dan hambatan pembentuk awal. Resistensi terhadap eritromisin biasanya dikode oleh plasmid. Terdapat 3 mekanisme yang telah dikenal yaitu :
1) Penurunan permeabilitas membran sel atau pengaliran keluar (efflux) yang aktif 2) Produksi esterase (olehenterobacteriaceae) yang menghidrolisi makrolida
3) Modifikasi situs ikatan ribosom (disebut juga preoteksi ribosom) oleh mutasi kromosom atau oleh metilase pengganti atau penginduksi makrolida.
Sebagian besar eritromisin diekskresikan dalam empedu, hilang dalam feses, dan hanya 5% yang diekskresikan dalam urine. Obat yang telah diabsorbsi didistribusikan secara luas, kecuali dalam otak dan cairan serebrospinal. Eritromisin diangkut oleh leukosit polimorfonukleus dan makrofag. Obat ini dapat menembus plasenta dan mencapai janin.
b. Tetrasiklin
Antimikroba golongan tetrasiklin yang pertama ditemukan adalah klortetrasiklin kemudian ditemukan oksitetrasiklin. Tetrasiklin sendiri dibuat secara semisintetik dari klortetrasiklin, tetapi juga dapat diperoleh dari species Streptomyces lain. Demeklosiklin, doksisiklin dan minosiklin juga termasuk antibiotik golongan tetrasiklin. Farmakodinamik golongan tetrasiklin adalah menghambat sintesis protein bakteri pada ribosomnya. Paling sedikit terjadi dua proses dalam masuknya antimikroba ke dalam ribosom bakteri gram negatif yakni proses pertama yang disebut difusi pasif melalui kanal hidrofilik dan proses kedua yakni sistem transport aktif. Setelah masuk maka antibiotik berikatan dengan ribosom 30S dan menghalangi masuknya tRNA-asam amino pada lokasi asam amino.
Efek Antimikroba golongan tetrasiklin pada umumnya sama (sebab mekanismenya sama), namun terdapat perbedaan kuantitatif dan aktivitas masing-masing derivat terhadap kuman tertentu. Hanya mikroba yang cepat membelah yang dipengaruhi obat ini. Golongan tetrasiklin termasuk antibiotik yang terutama bersifat bakteriostatik dan bekerja dengan jalan menghambat sintesis protein kuman.
Tetrasiklin dapat digunakan sebagai pengganti penisilin dalam pengobatan infeksi batang gram-positif seperti B. anthracis, Erysipelas, Clostridium tetani dan
Listeria monocytogenes. Kebanyakan strain N. gonorrhoeae sensitif terhadap tetrasiklin, tetapi N. gonorrhoeae penghasil penisilinase (PPNG) biasanya resisten terhadap tetrasiklin.
Efektivitas tetrasiklin tinggi pada infeksi bakteri batang gram-negatif seperti
Brucella, Francisella tularensis, Pseudomonas mallei, Pseudomonas pseudomallei, Vibrio cholorae, Campylobacter fetus, Haemophyllus ducreyi, dan Calymmatobacterium granulomatis, Yersinia pestis, Pasteurella multocida, Spirillum minor, Leptotrichia buccalis, Bordetella pertusis, Acinetobacter dan Fusobacterium. Strain tertentu H. influenzadiketahui sensitif namun E. coli, klebsiella, enterobacter, Proteus indol positif dan Pseudomonas umumnya resisten.
Tetrasiklin merupakan obat yang sangat efektif untuk infeksi Mycoplasma
pneumoniae, Ureaplasma urealyticum, Chlamydia trachomatis, Chlamydia psittaci dan berbagai riketsia. Selain itu juga aktif terhadap Borrelia recurrentis, Treponema
pertenue, Actinomyces israelii, dalam kadar tinggi aktif menghambat Entamoeba histolytica. Resistensi tetrasiklin terhadap beberapa spesies kuman terutama Streptokokus beta hemolotikus, E. coli, Pseudomonas aeruginosa, Str. pneumoniae, N. gonorrhoeae, Bacteroides, Shigella, dan S. aureus. Resistensi terhadap satu jenis tetrasiklin biasanya disertai resistensi terhadap semua tetrasiklin lainnya, kecuali minosiklin pada resistensiS.aureusdan doksisiklin pada resistensiB. fragilis.
dalam serum. Penetrasi ke CSS ini tidak tergantung dari adanya meningitis. Penetrasi ke cairan tubuh lain dan jaringan tubuh cukup baik. Metabolisme dalam tubuh obat golongan tetrasiklin disimpan di hati, limpa dan sumsum tulang serta di dentin dan email gigi yang belum bererupsi. Golongan tetrasiklin dapat menembus sawar urin dan terdapat dalam ASI dalam kadar yang relatif tinggi.
Dibandingkan dengan tetrasiklin lainnya, doksisiklin dan minosiklin daya penetrasinya ke jaringan lebih baik. Golongan tetrasiklin di ekskresi melalui urin dengan filtrasi glomerolus dan melalui empedu. Pemberiaan per oral kira-kira 20-55% golongan tetrasiklin diekskresi melalui urin. Golongan tetrasiklin yang diekskresi oleh hati ke dalam empedu mencapai kadar 10 kali kadar dalam serum. Sebagian besar obat yang diekskresi ke dalam lumen usus ini mengalami sirkulasi enterohepatik; maka obat ini masih terdapat dalam darah untuk waktu lama setelah terapi dihentikan. Bila terjadi obstruksi pada saluran empedu atau gangguan faal hati obat ini akan mengalami kumulasi dalam darah. Obat yang tidak diserap diekskresi melalui tinja.
berupa pertumbuhan berlebihan dari kandida (misalnya dalam vagina) atau stafilokokus resisten (dalam usus) dapat terjadi.
c. Kloramfenikol
Kloramfenikol di isolasi pertama kali dari Streptomyces venezuelae. Karena daya anti mikrobanya yang kuat, maka penggunaannya meluas hingga tahun 1950, dan diketahui obat ini dapat menimbulkan anemia aplastik yang fatal. Karena toksisitasnya, penggunaan obat ini dibatasi hanya untuk mengobati infeksi yang mengancam kehidupan dan tidak ada alternatif lain.
Farmakodinamik kloramfenikol adalah bekerja dengan mengikat sub unit 50S ribosom bakteri dan menghambat sintesis protein bakteri. Pengambatan terjadi pada produksi enzim peptidil trasferase yang merupakan katalisator untuk pembentukan ikatan-ikatan peptida pada proses sintesis protein kuman. Karena kemiripan ribosom mitokondria mamalia dengan bakteri, sintesis protein pada organela ini dihambat dengan kadar kloramfenikol tinggi. Tingginya kadar kloramfenikol dalam darah akan menimbulkan toksisitas sumsum tulang. Efek toksiknya pada sel mamalia terutama terlihat pada sistem hemopoetik dan diduga berhubungan dengan mekanisme kerja obat ini.
Spektrum antibakteri kloramfenikol cukup luas meliputi gram positif dan negatif seperti D. pneumoniae, Streptomyces pyogenes, Streptomycesviridans,
Neiserria, Haemophilus, Bacillus sp, Listeria, Bartonella, Brucella, P. multocida, C. diphtheriae, Chlamydia, Mycoplasma, Rickettsia, Treponema, dan kebanyakan bakteri anaerob. Diketahui bahwa beberapa strain D. pneumoniae, H. influenzae dan
N. meningitidis bersifat resisten. Sifat resisten juga terjadi pada kelompok Enterobactericeae sedangkan S. aureus umumnya masih sensitif. Kloramfenikol efektif terhadap kebanyakan strain E.coli, K. pneumoniae dan Pr. mirabilis serta strain Serratia, Providencia, dan Proteus rettgerii resisten, juga kebanyakan strain
Pseudomonas aeruginosadan strain tertentuSalmonella typhi.
dalam darah dalam 2 jam. Kira-kira 50% kloramfenikol dalam darah terikat dengan albumin. Obat ini diditribusikan ke berbagai jaringan tubuh, termasuk otak, cairan cerebrospinal dan mata. Dalam hati kloramfenikol mengalami konjugasi dengan asam glukoronat oleh enzim glukuronil transferase. Dalam waktu 24 jam, 80-90% kloramfenikol yang diberikan per oral telah diekskresi melalui urin dan hanya 5-10% dalam bentuk aktif. Sisanya terdapat dalam bentuk konjugasi glukuronat atau hidrolisat lain yang tidak aktif. Bentuk aktif kloramfenikol diekskresi terutama melalui filtrat glomerulus sedangkan metabolitnya dengan sekresi tubulus.
d. Amoksisilin
Amoksisilin adalah antimikroba yang termasuk ke dalam golongan penisilin. Beberapa contoh obat yang termasuk ke dalam golongan adalah ampicillin, piperacillin dan ticarcillin. Karena berada dalam satu golongan maka semua obat tersebut mempunyai mekanisme kerja yang mirip. Amoksisilin bersifat bakterisidal terhadap mikroorganisme rentan melalui mekanisme penghambatan biosintesis dinding sel mukopeptida selama multiplikasi.
Menurut Amin AS et al. (1994), farkmako dinamik amoksisilin adalah menghambat pertumbuhan bakteri dengan mengganggu reaksi transpeptidasi dalam sintesis dinding sel bakteri. Dinding sel bakteri tersusun atas polimer polisakarida dan polisakarida yang berikatan silang kompleks yakni peptidoglikan (murein, mukopeptida) polisakarida ini mengandung gula amino yang berpasangan yakni N-asetilglukosamin dan asam N-asetilmuramat. Suatu peptida mengandung lima asam amino dikaitkan dengan gula asam N-asetilmuramat dan berahir di D-alanil-D-alanin. Enzim Penisilin Binding Protein (PBP) memotong alanin terminal tersebut pada proses pembentukan suatu ikatan silang dengan peptida didekatnya. Ikatan silang tersebut membuat struktur dinding sel menjadi kaku. Antibiotik betalaktam secara struktural merupakan analog substrat PBP yaitu D-alanin-D-alanial berikatan secara kovalen dengan tempataktif di PBP. Ikatan ini menghambat reaksi transpeptidase yang menyebabkan penghentian sintesis peptidoglikan sehingga sel akan mati.
Sintesis dinding sel bakteri yang tidak sempurna menyebabkan sel-sel bakteri menyerap air secara osmosis, bakteri gram positif dan gram negatif memiliki masing-masing 10-30 dan 3-5 kali tekanan osmotik intraseluler dari lingkungan eksternal. Amoksisilin lebih efektif terhadap bakteri gram positif daripada bakteri gram negatif dan menunjukkan keberhasilan yang lebih besar dibandingkan penisilin dan antibiotik lain, misalnya : ampicillin, azithromycin, clarithromycin, cefuroxime dan doxycycline, dalam pengobatan berbagai infeksi / penyakit.
oral yang tinggi (70-90%) dengan tingkat puncak plasma yang terjadi dalam 1 sampai 2 jam. Amoksisilin yang diberikan secara oral akan menghasilkan peningkatan kadar darah dua kali lipat lebih tinggi. Distribusi amoksisilin pada tubuh adalah hati, ginjal, empedu, usus, limfa dan semen. Tingkat obat yang sangat rendah ditemukan dalam aqueous humor, dan tingkat rendah yang ditemukan dalam air mata, keringat dan saliva. Sekitar 17-20% terikat pada protein plasma, terutama albumin. Ekskresi amoksisilin terutama adalah ginjal, sehingga menyebabkan konsentrasi sangat tinggi pada urine, selain itu amoksisilin juga disekresi dalam susu.
e. Siprofloksasin
Siprofloksasin adalah sintetik kemoterapi antibiotik dari golongan obat fluorokuinolon. Antibakteri ini adalah generasi kedua fluorokuinolon. Mekanisme kerjanya dalam membunuh bakteri adalah dengan menghambat dengan enzim yang diperlukan untuk sintesis DNA dan protein. Siprofloksasin pertama kali dipatenkan pada tahun 1983 oleh Bayer AG dan kemudian disetujui oleh US Food and Drug
Administration (FDA) pada tahun 1987. Siprofloksasin disetujui FDA untuk digunakan pada manusia dan hewan. Siprofloksasin adalah antibiotik spektrum luas yang aktif terhadap bakteri Gram-positif dan Gram-negatif. Mekanisme kerjanya yaitu dengan cara menghambat DNA girase, topoisomerase tipe II, dan topoisomerase IV, enzim yang diperlukan untuk pemisahan DNA bakteri, sehingga menghambat pembelahan sel.
Mekanisme ini juga dapat mempengaruhi replikasi sel mamalia. Meskipun kuinolon sangat beracun bagi sel-sel mamalia dalam kultur, mekanisme kerjanya sitotoksik tidak diketahui. Kuinolon yang menginduksi kerusakan DNA pertama kali dilaporkan pada tahun 1986 (Hussyet al.1986).
Reaksi yang merugikan parah dialami oleh beberapa pasien saat diberikan terapi fluorokuinolon.
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian berlangsung dari bulan April 2010 sampai dengan Juli 2011 di Laboratorium Kesehatan Masyarakat Veteriner, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan Institut Pertanian Bogor (FKH IPB) dan fasilitas kandang Unit Pengembangan, Pemeliharaan dan Pelayanan Hewan (UP3H) FKH IPB.
Materi Penelitian Sampel isolat lokalCampylobacter jejuni
Isolat lokal C. jejuni berasal dari daging ayam yang dijual di pasar swalayan atau super market dan pasar tradisional di wilayah Kabupaten Demak dan Kudus.
Hewan percobaan
Tabel 3 Pengelompokkan sampel uji resistensi
Asal Isolat
Isolat asal Demak Isolat asal Kudus
Kontrol + (positif) Campylobacter jejuni Kontrol + (positif) Campylobacter jejuni Kontrol (negatif) Aquadest Kontrol (negatif) Aquadest
ND1 N1-I (Amx, Tet, Clr, Ert, Cip) NK1 N1-I (Amx, Tet, Clr, Ert, Cip) ND2 N2-I (Amx, Tet, Clr, Ert, Cip) NK2 N2-I (Amx, Tet, Clr, Ert, Cip) ND3 N3-I (Amx, Tet, Clr, Ert, Cip) NK3 N3-I (Amx, Tet, Clr, Ert, Cip) ND4 N4-I (Amx, Tet, Clr, Ert, Cip) NK4 N4-I (Amx, Tet, Clr, Ert, Cip) ND5 N5-I (Amx, Tet, Clr, Ert, Cip) NK5 N5-I (Amx, Tet, Clr, Ert, Cip)
Media
Media yang digunakan antara lain nutrient broth No.2 (Oxoid CM67), brain
heart infusion broth (Bacto), buffered pepton water/BPW 0,1 % (Pronadisa), charcoal cefaphorazone deoxychilate agar/CCDA (Oxoid CM739), preston (SR117), growth supplement (SR232), CCDA selective suplement (SR155), Campylobacter jejuni ATCC 33291, Campygen® (Oxoid CN0025A), blood agar base No.2 (CM271B), dan API-Ca Campy®(Bio Mèrieux, 20800), Mueller Hinton agar (Oxoid CM0337), NaCl fisiologis, alkohol 70%, aquades steril, fuchsin Ziehl, minyak emersi, mineral oil, H2O23% dan Bactident® Oxidase (Merck 1.13300.001). Isolat lokalC. jejuniyang digunakan adalah isolat dari Demak dan Kudus.
Uji resistensi menggunakan bahan antara lain kertas cakram antimikroba, amoksisilin 20 µg (Oxoid CT0425B), tetrasiklin 30 µg (Oxoid CT0054B), amoksisilin 25 µg (Oxoid CT0061B), eritromisin 15 µg (Oxoid CT0020B), dan siprofloksasin 5 µg (Oxoid CT0425B), serta antimikroba sediaan serbuk (amoksisilin, tetrasiklin, kloramfenikol, eritromisin, dan siprofloksasin).
Metode Penelitian
Penelitian ini terdiri dari dua tahap yang melibatkan proses secara in vitrodan
jejuni dan mendapatkan dosis Minimal Inhibitory Concentration (MIC) yang akan digunakan untuk pengobatan hewan coba pada penelitian tahap kedua. Tahap kedua meliputi : 1) pemeliharaan ayam, 2) infeksi ayam dengan bakteri Campylobacter
jejuni (isolat lokal dari Demak dan Kudus) secara oral dengan sebanyak 1 ml (104 CFU/ml), 3) pengobatan ayam menggunakan lima jenis antimikroba (amoksisilin, tetrasiklin, kloramfenikol, eritromisin, dan siprofloksasin), 4) isolasi dan identifikasi
Campylobacter jejunidari usapan (swab) mukosa usus ayam setelah pengobatan dan, 5) evaluasi hasil pengobatan terhadap rasio peningkatan bobot badan. Tahapan kedua bertujuan untuk mengevaluasi dosis MIC yang digunakan setelah hewan coba di infeksiC. jejunisebanyak 104CFU/ml dan mendapatkan jenis antimikroba yang tepat untuk mengurangi kerugian akibat kampilobakteriosis.
Isolasi dan IdentifikasiCampylobacter jejuni
Campylobacter jejuni diisolasi dari bahan pangan asal hewan yakni daging ayam. Pengambilan bahan pangan dilakukan pada berbagai tempat seperti pasar tradisional dan supermarket.
a. Sampel daging ayam
1) Daging sebanyak 25 gram dipotong-potong kemudian di masukan dalam kantong steril yang sebelumnya dimasukan BPW 0,1 % (Buffered Pepton Water) sebanyak 50 ml kemudian di kocok selama 5 menit kemudian ekstrak dituang ke dalam tabung sentrifuse.
2) Kemudian ekstrak di sentrifuse dengan kecepatan 9000 rpm selama 12 menit pada suhu 4°C, endapan diambil kemudian ditambahkan nutrient broth dan di inkubasi selama 24-48 jam dalam kondisi mikroaerofilik (CampyPack) pada suhu 42°C dengan menggunakan anaerobic jar. Setelah di inkubasi selama 24-48 jam dilakukan strik ke selektif agar Charcoal-cefoperazone-deoxycholate-agar (CCDA), kemudian diinkubasi kembali seperti proses sebelumnya.
4) Pengamatan terhadap koloni dengan penampakan sebagai berikut : berwarna keabu-abuan, datar, pinggir tidak teratur, mengkilat dan menyebar.
5) Pewarnaan gram dilakukan dengan fuchsin, kemudian diamati menggunakan mikroskop terhadap koloni dengan bentuk batang bengkok menyerupai wing
shapeberwarna merah muda.
6) Pengujian selanjutnya dilakukan dengan uji oksidase dan uji katalase yang akan diperoleh hasil uji dalam Tabel 4.
7) Selanjutnya dilakukan uji API Campy yang membutuhkan koloni tunggal dalam jumlah cukup banyak dari bakteri yang di identifikasi. Koloni diperbanyak dengan cara menanam 1 loop koloni yang diduga C. jejuni ke media agar darah dengan teknik goresan langsung. Kemudian diinkubasi pada suhu 36 ± 20C selama 24 48 jam dalam kondisi mikroaerofilik. Uji API-Campy dimulai dengan membuat suspensi bakteri dari koloni tunggal sampai setara dengan kekeruhan Mc. Farland No. 6. Suspensi ini dipindahkan kedalam mikrotube pada strip-strip API-Campy dan diinkubasi pada suhu 36 ± 20C selama 24 dalam kondisi mikroaerofilik untuk setengah strip dan kondisi aerob untuk setengah strip yang lainnya. Setelah diinkubasi, diuji dengan reagen-reagen yang sudah tersedia untuk membuktikan bahwa isolat tersebut adalah C. jejuni. Diagram alir proses uji API-Campy dapat dilihat pada Lampiran.
Tabel 4 Hasil Pengujian oksidase, katalase dan API-Campy untuk identifikasi C.
jejuni/coli
Pengujian C. jejuni C. coli
Oksidase Positif Positif
Katalase Hippurate
Positif Positif
Positif Negatif
b. Sampel Swab
dengan kondisi mikroaerofilik menggunakananaerobic jardan CampyPack pada suhu 42°C selama 24-48 jam. Setelah diinkubasi selama 24-48 jam dilakukan strik ke selektif agar Charcoal-cefoperazone-deoxycholate-agar (CCDA), kemudian diinkubasi kembali seperti proses sebelumnya.
2) Selanjutnya dilakukan identifikasi dengan tahapan dan proses yang sama seperti penjelasan sebelumnya.
Uji Resistensi Antimikroba(Lalitha 2008, NCCLS 1997)
Uji resistensi Antimikroba dilakukan dengan dua metode yaitu agar difusi dan pengenceran. Metode agar difusi menggunakan kertas cakram dengan lima jenis antimikroba (amoksisilin 20 µg, tetrasiklin 30 µg, amoksisillin 25 µg, eritromisin 15 µg dan siprofloksasin 5 µg) untuk mengetahui diameter zona hambat antimikroba terhadap pertumbuhan bakteri. Cakram yang digunakan berdiameter 6 mm. Prosedur uji dapat dijelaskan sebagai berikut :
a. Preparasi Mueller Hinton Agar
1) Penyiapan agar dilakukan dengan melarutkan 34 g/l dengan aquades dalam penangas air. Kemudian dilakukan dengan kondisi mild autoclave (10 menit dalam suhu 115°C).
2) Setelah proses autoclave agar didinginkan pada suhu 45 - 50 C dalam penangas air.
3) Tuangkan agar yang telah dipersiapkan ke dalam cawan petri plastik atau gelas dengan ketebalan agar 4 mm, apabila menggunakan cawan petri berdiameter 150 mm membutuhkan 60 sampai 70 ml agar sedangkan apabila menggunakan cawan petri berdiameter 100 mm membutuhkan 25 sampai 30 ml agar.
4) Medium agar diletakkan pada suhu ruang, jika tidak digunakan pada hari yang sama medium agar dapat diletakkan pada refrigerator (2 8° C).
6) Untuk membuktikan sterilitas media dapat dilakukan pengujian dengan menginkubasikan media dalam suhu 30 - 35° C dalam 24 jam.
b. Preparasi antimikroba
Antimikroba yang digunakan dalam bentuk serbuk. Antimikroba dapat digunakan dari produk komersil. Serbuk antimikroba yang digunakan dilarutkan dengan pelarut yang cocok untuk mendapatkan konsentrasi yang dibutuhkan dengan menggunakan gelas steril.
Potensi antimikroba bisa tertera di produk sediaan murni dan dapat dicari menggunakan rumus :
P = kandungan aktif / berat sediaan
Larutan antimikroba dipersiapkan dengan menggunakan rumus : W = (1000/P) x V x C
Keterangan P = Potensi obat, V = Volume yang dibutuhkan (ml), C = Konsentrasi akhir yang akan digunakan dan W = Berat antimikroba yang akan dilarutkan (mg)
c. Preparasi kertas cakram
Kertas cakram yang digunakan adalah kertas saring no. 1 dengan diameter 6 mm yang diletakkan pada petri discdan disterilkan dengan oven. Antimikroba yang akan digunakan diteteskan sengan bantuan pipet ependorf sebanyak 0,005 ml pada setiap cakramnya. Kertas cakram yang ada di pasaran telah mengandung antimikroba dapat digunakan dalam uji ini.
d. Preparasi inokulum
dengan 3 x 108 CFU/ml. Penyesuaian jumlah koloni dapat dilakukan dengan penambahan media Broth.
Penentuan Minimal Inhibitory Concentration (MIC) dan Minimal Bactericidal Concentration(MBC)
Penentuan MIC dan MBC menggunakan metode Broth dilution. Pada pengujian ini digunakan 5 jenis antimikroba. Prosedur uji dijelaskan sebagai berikut :
a. Pengenceran antimikroba
Pada penelitian ini digunakan 5 jenis antimikroba. Uji dilakukan dengan berbagai tingkat konsentrasi antimikroba mulai dari 320 hingga 0.675 mg/L (320, 160, 80, 40, 20, 10, 5, 2.5, 1.25, 0,675). Sebelum pengenceran bertingkat dilakukan penyiapan larutan stok dengan konsentrasi 320 mg/L untuk masing-masing jenis antimikroba. Pengenceran dilakukan dalam tabung reaksi sebanyak 10 buah menggunakan nutrient broth no. 2, ditambah dengan 2 tabung yang terdiri dari satu tabung reaksi sebagai kontrol positif (tanpa pemberian Campylobacter jejuni) dan satu tabung reaksi sebagai kontrol negatif (tanpa pemberian antimikroba). Skema pengenceran dijelaskan dalam gambar berikut:
Gambar 3 Skema pengenceran antimikroba
b. Pembacaan hasil
MIC adalah pengenceran terendah yang dapat menghambat pertumbuhan bakteri yang dapat langsung diamati setelah menginkubasi Campylobacter jejuni dengan mengamati pertumbuhannya berdasarkan kekeruhan dan sedimen yang
2 ml 320 mg/L 1 ml 1 ml 1 ml 1 ml 1 ml 1 ml 1 ml 1 ml 1 ml Buang 1 ml
dihasilkan, sedangkan MBC adalah pengenceran tertinggi yang dapat menghambat pertumbuhan bakteri. Penentuan MBC dapat dibuktikan dengan penambahan waktu inkubasi 1 x 24/48 jam untuk pengamatan pertumbuhan mikroba pada tabung.
Uji Efektifitas Pengobatan Terhadap Hewan (in vivo)
Setelah dilakukan pengujian resistensi antimikroba secara in vitro maka dilanjutkan pengujian efektifitas pengobatan 5 jenis antimikroba terhadap infeksi
Campylobacter jejunipada ayam broiler. Pengujian ini meliputi beberapa tahap yaitu ; 1) Pemeliharaan ayam broiler, 2) Infeksi Campylobacter jejuni, 3) Pengamatan gejala klinis yang timbul pasca infeksi, 4) Pengobatan terhadap ayam terinfeksi, 5) Evaluasi hasil pengobatan. Data yang diperoleh berupa data primer berbentuk kualitatif dan kuantitatif terhadap efektifitas pengobatan 5 jenis antimikroba terhadap infeksiCampylobacter jejuni. Tahapan uji ini dijelaskan sebagai berikut :
1. Pemeliharaan ayam broiler
Jenis ayam yang digunakan adalah ayam broiler strain Cobb. Kelompok uji akan dibagi menjadi 7 kelompok yaitu : 5 kelompok sesuai dengan jenis antimikroba yang digunakan, 1 kelompok sebagai kontrol positif infeksi tanpa pengobatan dan 1 kelompok sebagai kontrol negatif tanpa perlakuan. Masing-masing kelompok berjumlah 10 ekor. Pengujian dilakukan menggunakan dua isolat C.
2. InfeksiCampylobacter jejuni
InfeksiCampylobacter jejuni dilakukan pada umur 10 hari dengan cara dicekok atau peroral. Konsentrasi Campylobacter jejuni yang di infeksi ke hewan coba sebanyak 104CFU/ml yang ditambahkan larutan BPW 0.1 %. Gejala klinis akan nampak setelah waktu inkubasi sekitar 2 sampai 5 hari pasca infeksi. Satu hari sebelum dilakukan infeksi terhadap ayam Perlakuan air minum menggunakan desinfektan dihentikan.
3. Pengamatan gejala klinis yang timbul pasca infeksi
Gejala klinis yang tampak akan diamati dan dilakukan pencatatan setiap hari selama 9 hari setelah infeksi. Gejala yang diamati berupa diare, kelemahan umum, penurunan nafsu makan hingga ke kematian.
4. Pengobatan terhadap ayam terinfeksi
Pengobatan dilakukan dengan menggunakan 5 jenis antimikroba. Masing-masing antimikroba diaplikasikan di 1 kelompok. Dosis yang diujikan disesuaikan dengan dosis baktericidal yang didapatkan sesuai dengan hasil uji resistensi dan MIC/MBC. Pengobatan dilakukan pada umur ayam 14 hari, Pengobatan dilakukan selama 5 hari secara oral atau sampai umur ayam 18 hari.
5. Evaluasi hasil pengobatan
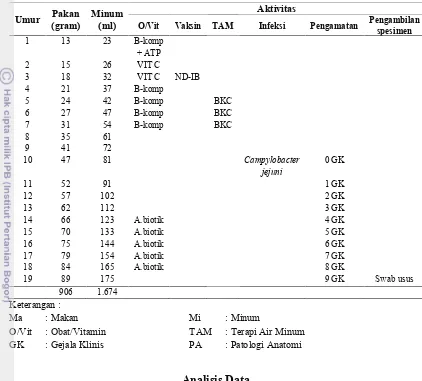
Tabel 5 Pola Pemeliharaan dan Aktifitas Percobaan
O/Vit Vaksin TAM Infeksi Pengamatan Pengambilan spesimen
O/Vit : Obat/Vitamin TAM : Terapi Air Minum GK : Gejala Klinis PA : Patologi Anatomi
Analisis Data
Hasil yang diperoleh dianalisis secara deskriptif antara rata-rata diameter zona hambatan dan dosis MIC menggunakan standar National Antimicrobial Resistance
Monitoring System Enteric bacteria (NARMS 2006), metode yang dilakukan oleh Holasova dan Karpiskova (2007), dan British Society for Antimicrobial