PROTEIN BIOAKTIF DARI BAGIAN TANAMAN
DAN AKAR TRANSGENIK CUCURBITACEAE
SERTA AKTIVITAS ANTIPROLIFERASI
GALUR SEL KANKER IN VITRO
CHURIYAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRAK
CHURIYAH. Protein Bioaktif dari Bagian Tanaman dan Akar Transgenik Cucurbitaceae serta Aktivitas Antiproliferasi Galur Sel Kanker In Vitro. Dibimbing oleh G. A. WATTIMENA sebagai ketua komisi pembimbing, SAID HARRAN, BAMBANG PONTJO PRIOSOERYANTO, LATIFAH K. DARUSMAN dan WAHONO SUMARYONO sebagai anggota.
Berbagai tanaman menghasilkan protein bioaktif yang berguna untuk melawan penyakit penting seperti hiperproliferasi dan infeksi virus, diantaranya beberapa species Cucurbitaceae. Untuk mendapatkan protein bioaktif dapat secara langsung mengekstraksi tanaman dari lapang atau melalui kultur in vitro.
Keuntungan kultur in vitro antara lain: kultur dalam kondisi aseptik, lingkungan
tumbuh terkendali dan pertumbuhan cepat. Kultur akar rambut dengan bantuan
Agrobacterium rhizogenes merupakan kultur in vitro yang mempunyai kestabilan
genetik tinggi karena tidak memerlukan penambahan zat pengatur tumbuh. Tujuan penelitian adalah: 1) mendapatkan bagian tanaman dari tiga spesies Cucurbitaceae yang menghasilkan protein bioaktif dengan rendemen dan aktivitas tinggi, serta mudah penanganannya 2) memperoleh kultur akar rambut
Trichosanthes cucumirena L. var anguina (L.) Haines yang dapat tumbuh dan
berkembang tanpa pemberian ZPT serta menghasilkan protein bioaktif dengan rendemen dan aktivitas tinggi 3) mendapatkan bagian tanaman atau akar rambut yang menghasilkan protein bioaktif yang dapat menghambat proliferasi galur sel kanker in vitro.
Uji pendahuluan aktivitas protein menggunakan uji kematian larva udang untuk mendapatkan konsentrasi protein yang dapat mematikan separuh dari jumlah larva Artemia salina Leach yang diuji (LC50). Uji selanjutnya menggunakan galur sel kanker in vitro untuk mengetahui konsentrasi protein yang
dapat menghambat proliferasi sel HeLa dan sel K-562 hingga setengah dari proliferasi sel kontrol (IC50).
Hasil penelitian menunjukkan diantara ketiga spesies maupun masing-masing bagian tanaman dalam satu spesies menghasilkan rendemen dan aktivitas protein yang beragam. Berdasarkan tingginya rendemen dan aktivitas protein yang dihasilkan serta kemudahan dalam penanganan bahan tanaman, dari Benincasa hispida (Thunb.) Cogn (bligo) dipilih akar yang menghasilkan fraksi protein BR2
dengan rendemen 0,54% dan LC50 0.36 µg/ml. Dari Coccinia grandis (L..) Voigh (kemarongan) dipilih buah muda yang menghasilkan fraksi protein CYF3 dengan rendemen 0.023% dan LC50 32 µg/ml. Sedangkan dari Trichosanthes cucumirena L.
var anguina (L.) Haines (paria ular) dipilih biji dan akar yang masing-masing
menghasilkan fraksi protein TS3 dengan rendemen 1.11 % dan LC50 0.19 µg/ml dan fraksi protein TR3 dengan rendemen 0.36% dan LC50 0.25 µg/ml. Diantara bagian-bagian tanaman dari tiga spesies, biji paria ular menghasilkan fraksi protein TS3 dengan rendemen dan aktivitas tertinggi.
Induksi akar rambut pada biji paria ular yang dikecambahkan secara in vitro
rendemen 0.83% dan LC50 5.76 µg/ml. Hasil konfirmasi transformasi pada klon THR2 dengan amplifikasi PCR menunjukkan terintegrasinya TL-DNA A.
rhizogenes pada genom, dibuktikan dengan terdeteksinya gen rolB pada hasil
elektroforesis pada 780 bp. Fraksinasi protein dari akar rambut klon THR2 menghasilkan empat fraksi, dan fraksi protein THR2-3 memiliki rendemen dan aktivitas paling tinggi yaitu 0.29% dan LC50 0.92 µg/ml.
ABSTRACT
CHURIYAH. Bioactive Protein from Plant Parts and Hairy Root of Cucurbitaceae and The Antiproliferation Acivity on In Vitro Cancer Cell Line. Supervised by G. A. WATTIMENA as the chairman, SAID HARRAN, BAMBANG PONTJO PRIOSOERYANTO, LATIFAH K. DARUSMAN and WAHONO SUMARYONO as advisory committee members.
Several plants produce bioactive protein which are very useful for treatment of many diseases especially hiperproliferation and virus infections. Various proteins were found in several species belonging to family of Cucurbitaceae. Production of plant protein can be directly extracted from intact plant parts or by in vitro culture. The advantages of the in vitro culture are: the culture is sterile, the environmental condition is under control and the growth is faster. The hairy root culture, resulted from plant transformation using Agrobacterium rhizogenes is the
most suitable method of in vitro culture, which does not require growth regulator so the hairy root has high genetic stability.
The purpose of this research were : 1) to find the plant part of three species of Cucurbitaceae which produced high yields and activities of the bioactive protein 2) to establish the hairy root culture of Trichosanthes cucumirena L. var anguina (L.) Haines that proliferate without growth regulator addition, and produced high yield and activity of the bioactive protein 3) to find the plant parts or hairy roots that produced the bioactive protein which have the antiproliferation acitivity on cancer cell line in vitro.
The protein activities were examinated using the brine shrimp lethality test based on the concentration which can kill half of number the brine shrimp (LC50) treated. Continuously with antiproliferation assay using cancer cell line to find the protein concentration that can inhibit half of the cell proliferation (IC50)..
The result indicated that there were difference among the three species and among the plant parts in one species in yield and activities of protein produced. Based on the highest yield and activity of the bioactive protein produced, and the ease to handle the material from the species Benincasa hispida (Thunb.) Cogn was selected to the root which produced protein fractions BR2 (0.54 %) and LC50 36 µg/ml, and on the Coccinia grandis (L.) Voigh from immature fruit which
produced CYF3 (0.023%) and LC50 32 µg/ml. The other were root and seed of
Trichosanthes cucumirena L. var anguina (L.) Haines which produced protein
fractions TS3 and TR3. The yield and activity of protein of TS3 and TR3 were 1.11 % and LC50 19 µg/ml, 0.36 % and LC50 25 µg/ml respectively. The seed of
Trichosanthes cucumirena L. var anguina (L.) Haines resulted in the highest yield
and activity of protein (TS3).
Hairy root induction on the germinating seed of T. cucumirena L. var anguina (L.) Haines in vitro, resulted in six root clones those were THR1, THR2,
THR3, THR4, THR6 and THR8 that can proliferate in the medium without addition of the growth regulator. Selection of the six root clones based on yield and activity of the protein produced, resulted two clones those were THR8 and THR2. The yield and activity of protein from THR8 and THR2 were 0.74% and LC50 63 µg/ml and 0.83% and LC50 5.76 µg/ml, respectively. Confirmation of transformation on the THR2 root clone using PCR amplification technique indicated the integration of the T-DNA from A. rizhogenes to the genome of plant
Protein fractionation on the THR2 root clone resulted in four fractions, and the highest yield and activities was 0.29% and LC50 0.92 µg/ml resulted from THR2-3 protein fractions.
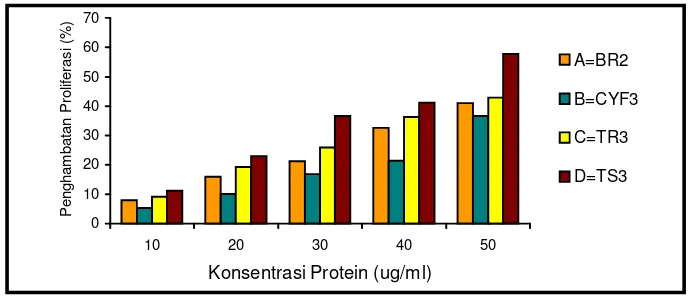
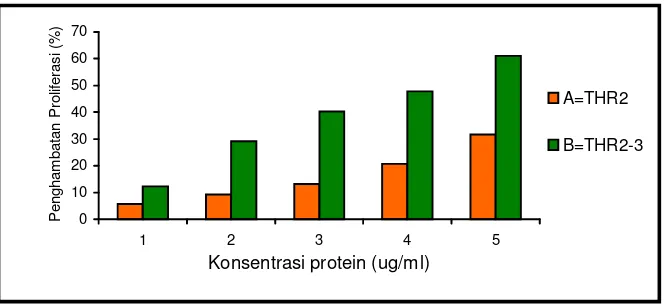
Antiproliferation assay using cancer cell line indicated the selectivity of the bioactive protein to certain cancer cell line, and the activity tend to increase with the increasing of protein concentrations as showed by limited number of the living cells. The BR2, TR3,TS3 and THR2-3 bioactive proteins tend to inhibit the K-562 proliferation, on the other hand CYF3 and THR2 have antiproliferation acivity higher on HeLa than on K-562. Protein resulted from hairy root more potent to inhibit cancer cell proliferation than protein from intact plants. The IC50 of the hairy root protein were about 3.9-11.80 µg/ml, and was lower than IC50 of the protein plant parts, which were in the range of 45-106 µg/ml.
PROTEIN BIOAKTIF DARI BAGIAN TANAMAN
DAN AKAR TRANSGENIK CUCURBITACEAE
SERTA AKTIVITAS ANTIPROLIFERASI
GALUR SEL KANKER IN VITRO
CHURIYAH
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Agronomi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Disertasi : Protein Bioaktif dari Bagian Tanaman dan Akar Transgenik Cucurbitaceae serta Aktivitas Antiproliferasi Galur Sel Kanker In Vitro
Nama : Churiyah NIM : 985033
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. G.A.Wattimena, M.Sc. Ketua
Dr. Ir. Said Harran Drh. Bambang P. Priosoeryanto, Ph.D Anggota Anggota
Prof.Dr.Ir. Latifah K. Darusman., MS. Dr. Wahono Sumaryono, Apt.APU Anggota Anggota
Diketahui
Ketua Program Studi Agronomi Dekan Sekolah Pascasarjana
Dr. Ir. Satriyas Ilyas, M.Sc. Prof. Dr. Ir. Syafrida Manuwoto, M.Sc.
RIWAYAT HIDUP
Penulis dilahirkan di Temanggung pada tanggal 17 Agustus 1956 sebagai
putri kedua dari bapak H. M. Dharsono dan ibu Imronah (almarhumah). Pendidikan sarjana ditempuh di Fakultas Biologi Universitas Gajahmada, lulus tahun 1981. Pada tahun 1992 penulis diterima di Program Studi Agronomi pada Program Pascasarjana IPB dan menamatkannya pada tahun 1995. Kesempatan untuk melanjutkan ke program doktor pada program studi dan pada perguruan
tinggi yang sama diperoleh pada tahun 1998, dengan beasiswa dari Proyek Peningkatan Kemampuan Personil (PPKP), Badan Pengkajian dan Penerapan Teknologi.
Penulis bekerja di Badan Pengkajian dan Penerapan Teknologi sejak tahun 1982. Saat ini penulis sebagai peneliti pada Pusat Pengkajian dan Penerapan
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala karunia
Nya sehingga disertasi dengan judul Protein Bioaktif Dari Bagian Tanaman
Dan Akar Transgenik Cucurbitaceae serta Aktivitas Antiproliferasi Galur Sel Kanker In Vitro, berhasil diselesaikan.
Penghargaan dan terimakasih yang sebesar-besarnya kepada Bapak Prof. Dr. Ir. G.A.Wattimena, MSc., Bapak Dr. Ir. Said Harran, Bapak Drh. Bambang Pontjo Priosoeryanto, Ph.D., Ibu Prof. Dr. Ir. Latifah K. Darusman, MS. dan
Bapak Dr. Wahono Sumaryono, Apt. APU., selaku komisi pembimbing atas segala bimbingan, petunjuk serta pengarahannya selama penelitian sampai selesainya penulisan disertasi. Penghargaan dan terimakasih yang sebesar-besarnya kepada Ibu Prof Dr. Ir. Livy Winata Gunawan (Alm) yang telah berkenan memberikan kesempatan kepada penulis untuk bergabung dalam hibah
Tim-URGE yang dipimpinnya.
Penghargaan dan terimakasih juga disampaikan kepada dosen pengajar pada Sekolah Pascasarjana IPB yang telah banyak memberikan ilmu dan pengetahuan. Kepada Ketua Program Studi Agronomi penulis ucapkan terimakasih atas saran dan pengarahannya dalam penulisan disertasi. Ucapan terima kasih juga penulis sampaikan kepada bapak Prof. Dr. Ir. Sudarmadi
Hardjosuwignyo, MSc. dan ibu Dr. Ir. Maharani Hasanah, APU atas perkenannya menjadi dosen penguji luar komisi pada sidang terbuka, dan atas saran-sarannya untuk perbaikan disertasi. Kepada Ibu Dr. Ir. Sandra Arifin Azis, MS., penulis ucapkan terimaksih yang sebesar-besarnya yang telah berkenan menjadi dosen
penguji luar komisi pada sidang tertutup, dan atas kebaikannya memberikan koleksi tanamannya. Ucapan terimakasih juga penulis sampaikan kepada Dr. Ir. Achkam Subroto, peneliti dari LIPI atas kebaikannya memberikan A. rhizogenes
yang dikoleksinya.
Penghargaan dan ucapan terimakasih yang sebesar-besarnya penulis sampaikan kepada Bapak Deputi Kepala BPPT Bidang Teknologi Agroindustri
Balai Bioteknologi, Kepala Lab. Bioteknologi Pertanian dan staf, Kepala Lab. Rekayasa Genetika beserta staf, Kepala Lab. Recovery dan staf – Balai Bioteknologi BPPT, Kepala Lab. Bioindustri, Kepala Lab. Teknologi Farmasi dan Medika., Puspiptek – Serpong. Koordinator Lab Patologi FKH-IPB, yang telah
memperkenankan penulis melaksanakan penelitian untuk disertasi. Ucapan terimaksih juga penulis sampaikan kepada Pimpinan Proyek Peningkatan Kemampuan Personil (PPKP) – BPPT atas beasiswa yang diberikan, dan kepada Pimpinan Proyek Hibah Tim-URGE atas bantuan sebagian biaya penelitian.
Kepada Ibu Dr. Ir. Yusnita, MSc. dan Dra. Rismayanti penulis ucapkan terimakasih yang sebesar-besarnya atas bantuannya dalam dokumentasi. Terutama kepada seluruh staf Pusat Pengkajian dan Penerapan Teknologi Farmasi dan Medika penulis ucapkan terima kasih atas segala bantuan moril dan materiil dalam melaksanakan penelitian.
Terimakasih yang sedalam-dalamnya kepada seluruh keluarga, suami
(Alm) serta anak-anak tercinta Maulana dan Haikal, bapak, kakak dan adik-adik, Amma’ dan adik-adik ipar, semua keponakan serta seluruh keluarga atas segala do’a, dorongan dan bantuan yang tiada ternilai yang telah diberikan. Akhirnya kepada semua pihak yang telah memberikan bantuan, penulis menyampaikan terima kasih. Semoga Allah SWT membalas segala kebaikan yang telah diberikan
kepada penulis, dengan balasan yang berlipat ganda. Amien. Semoga tulisan ini bermanfaat.
Bogor, Desember 2005
DAFTAR ISI
Halaman
DAFTAR SINGKATAN ....………... xiv
DAFTAR TABEL ………... xv
DAFTAR GAMBAR ………. xvi
DAFTAR LAMPIRAN ………... xvii
I. PENDAHULUAN UMUM A. Latar Belakang ... 1
B. Tujuan Penelitian ... 3
C. Hipotesis ... 4
D. Manfaat Penelitian ... 4
E. Perumusan Masalah ... 4
II. TINJAUAN PUSTAKA A. Diskripsi Cucurbitaceae ... 6
1. Benincasa hispida (Thunb.) Cogn. ... 6
2. Coccinia grandis (L.) Voigh. ………. 6
3. Trichosanthes cucumirena L. var anguina (L.) Haines ... 7
B. Proses Pembentukan Akar Rambut ...………. 7
C. Biosintesis Protein Pada Tanaman ...………... 11
1. Pembentukan Asam Amino ... 11
2. Sintesis Protein. ... 13
D. Protein Bioaktif ... 17
E. Uji Kematian Larva Udang ... 19
F. Uji Menggunakan Galur Sel Kanker In Vitro ... 21
III. PENAPISAN PROTEIN BIOAKTIF DARI BAGIAN TANAMAN BEBERAPA SPESIES CUCURBITACEAE A. Pendahuluan ... 24
B. Bahan dan Metode ... 25
1.Tempat, Waktu, dan Bahan ... ... 25
a. Tempat dan waktu ... 25
b. Bahan ... 25
2. Prosedur Kerja. ... 26
b. Ekstraksi Protein ... 26
c. Fraksinasi Protein ... 27
d. Uji aktivitas Protein ... 27
e. Karakterisasi Protein ... 28
C. Hasil dan Pembahasan ... 29
1. Koleksi Tanaman di Lapang .. ... 29
2. Ekstraksi Protein ... 30
3. Fraksinasi Protein ... 34
4. Uji aktivitas Protein ... 39
5. Karakterisasi Protein ... 40
D. Kesimpulan ... 43
IV. INDUKSI KULTUR AKAR RAMBUT (HAIRY ROOT) Trichosanthes cucumirena L. var anguina (L.) Haines UNTUK MENDAPATKAN PROTEIN BIOAKTIF A. Pendahuluan ………... .. 45
B. Bahan dan Metode ………... .. 47
1. Tempat, Waktu, dan Bahan ...……… .. 47
a. Tempat dan Waktu ...……….. .. 47
b. Bahan ...……….. .. 47
2. Prosedur Kerja ... 47
a. Induksi Kultur Akar Rambut ... 47
b. Kurva Pertumbuhan Akar Rambut ... . 48
c. Ekstraksi Protein ... 48
d. Uji Aktivitas Protein ... 48
e. Konfirmasi Transformasi ... 49
f. Fraksinasi Protein ... 50
g. Karakterisasi Protein ... 50
C. Hasil dan Pembahasan ... 51
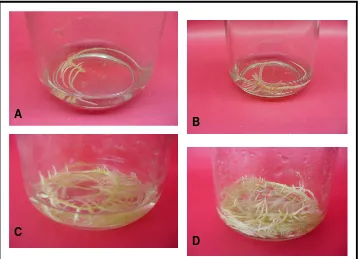
1. Induksi Kultur Akar Rambut ... 51
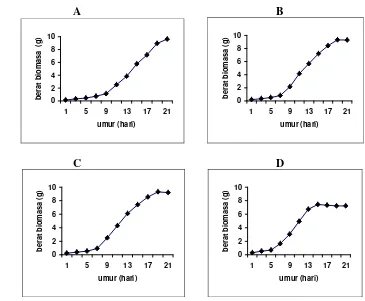
2. Kurva Pertumbuhan Akar Rambut ... 54
3. Ekstraksi Protein ... 58
4. Fraksinasi Protein ... 59
5. Uji Aktivitas Protein ... 60
6. Uji Konfirmasi Transformasi ... 61
7. Karakterisasi Protein ... 62
D. Kesimpulan ... 63
V. AKTIVITAS PROTEIN BIOAKTIF DARI BAGIAN TANAMAN DAN KULTUR AKAR RAMBUT CUCURBITACEAE TERHADAP PROLIFERASI GALUR SEL KANKER IN VITRO.
A. Pendahuluan ... 65
B. Bahan dan Metode ... . 67
1. Tempat, Waktu, dan Bahan ... 67
a. Tempat dan Waktu ... 67
b. Bahan ... 67
2. Persiapan Sampel Protein ... 67
3. Persiapan Media dan Kultur Sel ... 68
C. Hasil dan Pembahasan ... 69
D. Kesimpulan ... 76
VI. PEMBAHASAN UMUM ... 77
VII. KESIMPULAN DAN SARAN A. Kesimpulan... 80
B. Saran ... 80
VIII DAFTAR PUSTAKA ... 82
DAFTAR SINGKATAN
APS : Amonium persulfatBM : Berat Molekul BR : Benincasa root BS : Benincasa seed
BSLT : Brine shrimp Lethality Test CMF : Coccinia mature fruit CR : Coccinia root
CYF : Coccinia young fruit DNA : Deoxyribo nucleic acid GE : Gel elektroforesis
HIV : Human immunodefisiense virus HSA : Hari setelah antesis
HST : Hari setelah tanam
IC50 : Inhibitive concentration 50% kDa : Kilo Dalton
LC50 : Lethal concentration 50% LMW : Low Molecular Weight
MAP-50 : Momordica charantia Anti virus Protein
MS0 : Murashige dan Skoog tanpa zat pengatur tumbuh MSA : Minggu setelah antesis
MST : Minggu setelah tanam
MTT : 3-(4,5-dimethylthiazol-2-yl)-2,5diphenyl-tetrazolium bromide NCPPB : National Collection Phyto Pathogenic Bacteria
PAP : Phytolaca americana Protein
PBS : Phosphat Buffer Saline PCR : Polymerase chain reaction PR-5 : Pathogenesis Related – 5 Ri-plasmid : Root Inducing-plasmid RIPs : Ribosome inactivating protein rol-gene : Root locus- gene
SDS-PAGE : Sodium dodecyl sulfat Polyacrylamid Gel Electrophoresis TAP : Trichosanthes Antivirus Protein
T-DNA : Transfer- DNA
TEMED : Tetrametil-ethilendiamin TF : Trichosanthes Fruit THR : Trichosanthes Hairy Roots TL-DNA : Transfer Left – DNA TMV : Tobacco Mosaic Virus TR : Trichosanthes Root TR-DNA : Transfer Right - DNA TS : Trichosanthes Seed UV-Vis : Ultra Violet - Visible YMA : Yeast malt agar
DAFTAR TABEL
Halaman
3. Rendemen fraksi protein kemarongan ... 49
4. Rendemen fraksi protein paria ular ... ... 51
5. Aktivitas protein dan fraksinya dari 3 spesies Cucurbitaceae ... 53
6. Fase pertumbuhan akar rambut pada perlakuan berat inokulum ... 74
7. Waktu panen dan berat biomasa akar rambut ... 75
8. Rendemen ekstrak protein 6 klon akar rambut ... 77
9. Rendemen fraksi protein akar rambut klon THR2 ... 79
10. Aktivitas protein dan fraksinya dari klon THR2 ... 80
DAFTAR GAMBAR
Halaman 1. Diagram alir penelitian ... 52. Artemia salina Leach ... 21
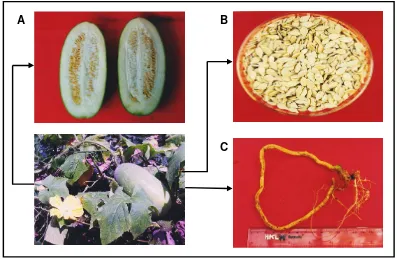
4. Bagian tanaman dari bligo ... 31
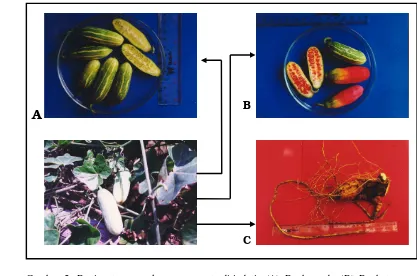
5. Bagian tanaman dari kemarongan ... 32
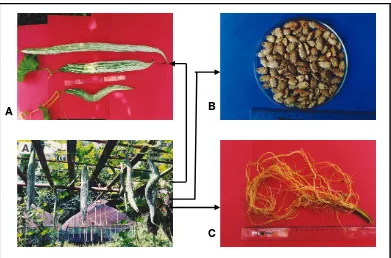
6. Bagian tanaman dari paria ular ... 33
7. Pola pemisahan protein bligo ... 34
8. Pola pemisahan protein kemarongan ... 36
9. Pola pemisahan protein paria ular ... ... 37
10. Hasil elektroforesis SDS-PAGE protein bligo ... 41
11. Hasil elektroforeis SDS-PAGE protein kemarongan ... 42
12. Hasil elektroforeis SDS-PAGE protein paria ular ... 43
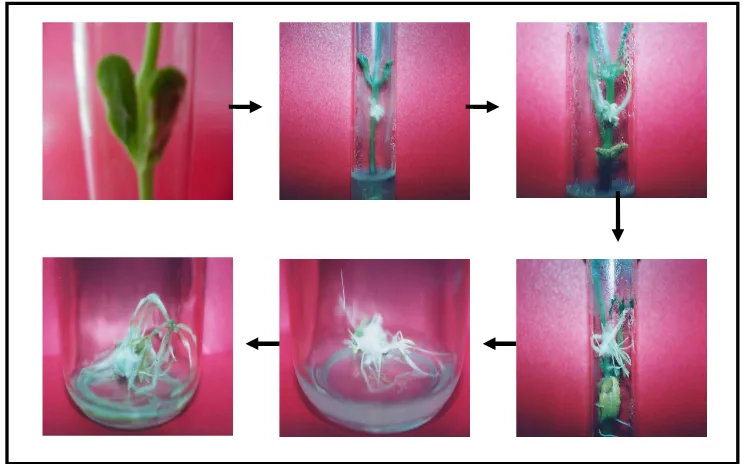
13. Kultur in vitroTrichosanthes cucumirena L.var anguina (L) ... 52
14. Perkembangan akar adventif T. Cucumerina ... 53
15. Kultur akar rambut T. Cucumerina umur 18 HST ... 54
16. Kurva pertumbuhan akar rambut variabel berat inokulum ... 55
17. Perkembangan kultur akar rambut klon THR2 dalam MS0 cair ... 57
18. Pola pemisahan protein dari T. cucumerina klon THR2 ... 59
19. Hasil amplifikasi PCR DNA akar rambut klon THR2 ... 62
20. Hasil elektroforesis SDS-PAGE akar rambut klon THR2 ... 63
21. Kurva standar galur sel kanker dengan metode MTT ... 70
22. Aktivitas protein asal tanaman lapang terhadap galur sel HeLa ... 71
23. Aktivitas protein asal akar rambut terhadap galur sel HeLa ... 72
24. Galur sel Hela : A. Kontrol, B. Perlakuan ... 72
25. Akitivitas protein asal tanaman lapang terhadap galur sel K-562 ... 73
26. Aktivitas protein asal akar rambut terhadap galur sel K-562 ... 74
27. Galur sel K-562 : A. Kontrol, B. Perlakuan ... 74
28. IC50 protein asal tanaman dari lapang dan akar rambut ... 75
DAFTAR LAMPIRAN
Halaman 1. Komponen larutan stok media Murashige dan Skoog (MS) yang dimodifikasi ... 832. Media kultur akar rambut ... 89
3. Media Yeast Manitol Agar (YMA) ... 90
I. PENDAHULUAN UMUM
A. Latar Belakang
Kecenderungan pemakaian bahan alam terutama tumbuh-tumbuhan sebagai obat-obatan semakin meningkat, karena mahalnya obat sintetik dan berbagai efek sampingnya yang merugikan. Berbagai penelitian telah membuktikan bahwa
tanaman menghasilkan senyawa aktif yang berkhasiat sebagai obat.
Diantara senyawa aktif yang dihasilkan oleh tanaman diantaranya protein bioaktif, yang biasanya digunakan sebagai protein pertahanan bagi tanaman penghasilnya. Protein bioaktif tersebut diekspresikan pada berbagai organ dan jaringan, misalnya peptida antimikroba Snakin-1 (SN1) dari umbi kentang. Snakin
mempunyai aktivitas anti bakteri dan anti jamur, menyebabkan agregasi pada bakteri gram negatif dan gram positif (Segura et al. 1999). Protein anti jamur, misalnya protein PR-5 dari daun labu (Cucurbita sp.) dan protein PR-5d dari daun
serta akar tembakau. Keduanya mempengaruhi permiabilitas membran plasma, sehingga menyebabkan kebocoran membran dan keluarnya material intraseluler dari organisme target (Cheong et al. 1997; Koiwa et al. 1997). Protein antivirus
dari akar Bougainvillea spectabilis (BAP 1) menunjukkan aktivitas penghambatan
sintesis protein secara in vitro (Balasaraswati et al. 1998). Protein anti virus
MAP 30 dari biji Momordica charanthia dan GAP 31 dari Gelonium multiflorum.
Kedua protein tersebut menghambat infeksi virus HIV-1 dan perkembangbiakan virus pada sel yang sudah terinfeksi dengan menghambat HIV-integrase dan
menonaktifkan topologi HIV-LTR (Huang et al. 1999). Protein penginaktivasi ribosom (ribosom inactivating protein = RIPs), menghambat sintesis protein pada
organisme lain. RIPs bekerja dengan memotong N-glikosida pada Subunit besar ribosom pada situs spesifik, akibatnya ribosom tidak dapat berinteraksi dengan faktor elongasi, sehingga menghambat perpanjangan rantai polipeptida (Endo
et al. 1987; Jensen et al. 1999).
Protein bioaktif yang telah digunakan dalam imunotoksin antara lain protein antivirus dari daun dan biji Phytolaca americana (PAP). PAP termasuk
kelompok protein penginaktivasi ribosom, yang dapat menahan serangan virus pada tanaman maupun manusia seperti virus influenza, herpes simplek, polio dan
HIV-1. PAP dikonjugasikan dengan antibodi TXU (anti CD7) menjadi TXU-PAP untuk perlakuan sel yang terinfeksi HIV. Konjugat TXU-PAP sangat efektif dalam menghambat perkembangbiakan HIV-1 in vitro, efisiensi
pengham-batannya meningkat 400 kali dibanding dengan PAP, selain itu tidak toksik
terhadap sel-T (Anonym, 1998).
Untuk mendapatkan protein dari tanaman dapat diperoleh dengan mengekstrak langsung tanaman yang berasal dari lapang, atau melalui kultur in vitro. Keuntungan dari kultur in vitro adalah kultur dalam kondisi aseptik,
lingkungan tumbuh dapat diatur, dan waktu relatif pendek. Kultur in vitro yang
sering dilakukan untuk memproduksi suatu metabolit adalah kultur sel dan kultur
organ. Kendala yang sering terjadi antara lain pada tingkat sel seringkali metabolit yang diinginkan tidak terbentuk, atau terbentuk tetapi jumlahnya sangat kecil. Sedangkan untuk menjaga kelangsungan pertumbuhan sel atau jaringan diperlukan zat pengatur tumbuh (ZPT). Pemberian ZPT pada suatu kultur secara terus menerus dalam waktu lama dapat mengubah komposisi genetik sel, dan
berpengaruh terhadap pertumbuhan dan kestabilan metabolit yang dihasilkan (Baiza et al. 1999).
Kultur in vitro yang lebih menjanjikan adalah kultur akar rambut (hairy root) melalui bantuan Agrobacterium rhizogenes yang mampu mentransfer
sebagian materi genetiknya (T-DNA) ke genom tanaman. Ekspresi T-DNA dari plasmid Ri (root inducing) mengakibatkan tumbuhya akar adventif dari tempat
infeksi. Keunggulan kultur akar rambut adalah akar dapat tumbuh dan berkembang tanpa pemberian ZPT, karena terintegrasinya T-DNA dalam genom. Oleh karenanya dapat menurunkan biaya produksi dan mempunyai kestabilan genetik tinggi, sehingga pertumbuhan kultur serta metabolit yang diproduksi juga lebih stabil.
Uji pendahuluan aktivitas protein dilakukan dengan uji kematian larva udang (brine shrimp lethality test) menggunakan larva Artemia salina mengikuti
bahannya mudah didapat, relatif murah, perlu waktu singkat, dan mempunyai korelasi positif dengan pengujian sitotoksisitas pada 3PS (P-388 murine leukemia
in vivo).
Uji selanjutnya menggunakan galur sel kanker in vitro untuk mengetahui
aktivitas protein dalam menghambat proliferasi sel kanker. Uji in vitro
menggunakan kultur sel dapat mengamati secara langsung pengaruh protein terhadap viabilitas sel (Wilson, 1992). Uji in vitro sering dilakukan sebelum
melangkah ke uji in vivo karena lebih ekonomis dan cepat.
Kanker adalah salah satu penyakit yang mendapat perhatian besar dalam ilmu kedokteran. Dengan perubahan pola hidup serta tingginya polusi, penderita kanker semakin meningkat jumlahnya dari tahun ke tahun. Berbagai pengobatan untuk penanggulangan penyakit kanker telah dilakukan, namun karena mahalnya biaya pengobatan dan dampak sampingnya yang berat semakin banyak dicari obat alternatif dari alam antara lain tumbuh-tumbuhan.
B. Tujuan Penelitian
Tujuan Umum
Penelitian ini bertujuan untuk mendapatkan bagian tanaman dari tiga spesies Cucurbitaceae yaitu B. hispida (Thunb.) Cogn, Coccinia grandis (L.) Voigh.dan T. cucumirena L. var anguina (L.) Haines, dan kultur akar rambut dari bagian
tanaman terpilih yang menghasilkan protein bioaktif dengan rendemen dan
aktivitas tinggi serta dapat menghambat proliferasi galur sel kanker in vitro.
Tujuan Khusus
1. Mendapatkan informasi dari bagian tanaman, yaitu akar, buah dan biji dari tiga spesies Cucurbitaceae yang menghasilkan protein bioaktif dengan
rendemen dan aktivitas tinggi dan BM 20-40 kDa.
2. Mendapatkan kultur akar rambut dari spesies terpilih yang dapat tumbuh dan berkembang dengan stabil dalam medium tanpa zat pengatur tumbuh dan menghasilkan protein bioaktif dengan rendemen dan aktivitas tinggi.
3. Mendapatkan protein bioaktif dari dari bagian tanaman dan kultur akar rambut terpilih yang dapat menghambat proliferasi galur sel kanker.
1. A. rhizogenes mampu mentrasfer T-DNA ke genom tanaman T. cucumirena L.
var anguina (L.) Haines), sehingga dihasilkan kultur akar rambut yang dapat
tumbuh dan berkembang dalam medium tanpa zat pengatur tumbuh.
2. Terdapat bagian tanaman dan kultur akar rambut yang menghasilkan protein
bioaktif dengan rendemen dan aktivitas tinggi serta mempunyai BM 20-40 kDa.
3. Terdapat fraksi protein bioaktif asal tanaman dari lapang dan akar rambut yang dapat menghambat proliferasi secara spesifik terhadap galur sel kanker
in vitro.
D. Manfaat Penelitian
Dari penelitian ini diharapkan :
1. Mendapatkan metode induksi dan pemeliharaan kultur akar rambut untuk memproduksi protein bioaktif dengan rendemen dan aktivitas tinggi. 2. Mendapatkan informasi tentang bagian tanaman atau kultur akar rambut
yang menghasilkan protein bioaktif yang dapat menghambat proliferasi sel kanker.
3. Meningkatkan nilai ekonomis dari beberapa spesies Cucurbitaceae dari kelompok sayuran menjadi fitofarmaka.
E. Perumusan Masalah
Penelitian terdiri dari tiga tahap seperti tersaji dalam diagram alir penelitian (gambar 1), yaitu :
1. Penapisan protein bioaktif dari bagian tanaman tiga spesies Cucurbitaceae, bertujuan untuk mendapatkan informasi dari bagian tanaman yang menghasilkan protein bioaktif dengan rendemen dan aktivitas tinggi
(Penelitian 1).
2. Induksi kultur akar rambut dari spesies terpilih untuk mendapatkan protein bioaktif, dengan tujuan untuk mendapatkan kultur akar rambut yang dapat tumbuh dan berkembang dengan stabil dalam medium tanpa ZPT serta menghasilkan protein dengan rendemen dan aktivitas tinggi (Penelitian 2).
bioaktif dari bagian tanaman atau akar rambut terpilih yang dapat menghambat proliferasi sel kanker (Penelitian 3).
Gambar 1. Diagram Alir Penelitian
II. TINJAUAN PUSTAKA
ekstraksi, fraksinasi, ujiaktivitas, karakterisasi protein
Organ tanaman terpilih yang menghasilkan protein bioaktif dengan rendemen dan aktivitas tinggi
I. Penapisan protein bioaktif dari bagian tanaman pada tiga spesies
Cucurbitaceae
II.Induksi kultur akar rambut dari spesies terpilih untuk mendapatkan protein bioaktif
Klon akar rambut :
♣ dapat tumbuh dalam medium tanpa ZPT ♣ menghasilkan protein
dengan rendemen dan aktivitas tinggi
Uji penghambatan proliferasi sel in vitro
- Konfirmasi transformasi - Seleksi klon
III.Uji aktivitas protein bioaktif dari bagian tanaman dan kultur akar rambut terhadap proliferasi
galur sel kanker in vitro.
Protein bioaktif dari bagian tanaman/kultur akar rambut
1. Benincasa hispida (Thunb.) Cogn
Benincasa hispida (Thunb.) Cogn di Indonesia disebut bligo merupakan tanaman tahunan, umumnya berumah satu. Tanaman tumbuh baik pada dataran rendah, relatif toleran terhadap kekeringan. Batang tebal, menjalar hingga mencapai panjang beberapa meter. Daun sederhana, panjang tangkai daun 5-20 cm, helaian daun berukuran 10-25 cm x 10-20 cm, dengan 5-7 sudut. Bunga
terletak pada ketiak daun, berwarna kuning, diameter 6-12 cm, panjang tangkai bunga 5-15 cm pada bunga jantan dan 2-4 cm pada bunga betina, bunga jantan mempunyai 5 benang sari. Buah besar, berbentuk lonjong, berukuran 20-60 cm x 10-25 cm, berwarna hijau tua, tertutup lapisan kapur, daging buah berwarna putih dengan ketebalan 2-4 cm. Biji berbentuk pipih lonjong, berwarna kuning
kecoklatan, berukuran 10-15 mm x 5-7 mm x 1-2 mm. Perbanyakan tanaman melalui biji, untuk perkecambahan biji perlu waktu 1-2 minggu. Berbunga pada umur 50-80 hari setelah tanamm, penyerbukan memerlukan bantuan serangga. Pemasakan buah 1-2 bulan setelah penyerbukan, buah muda dapat dipanen 1-2 minggu setelah berbunga, buah tua 100-160 hari setelah tanam (Rifai dan
Reyes, 1994).
2. Coccinia grandis (L.) Voigh
Coccinia grandis (L.) Voigh, di Indonesia dikenal dengan nama papasan
atau kemarongan, merupakan tanaman tahunan. Tempat tumbuh sampai dengan
ketinggian 1500 m, dengan kelembaban tinggi, dan tidak tahan genangan. Tanaman ini berumah dua, merupakan herba menjalar dapat mencapai panjang 20 m, akar berumbi. Batang muda berwarna hijau, setelah tua berbintik putih dan berkayu. Daun sederhana, berseling, panjang tangkai daun 1-5 cm, helaian daun berukuran 3-12 cm x 3-15 cm dengan 3-5 sudut. Bunga jantan diketiak daun,
tunggal atau berpasangan, panjang tangkai bunga 0.7-7 cm, kelopak 5 helai dengan panjang lebih dari 6 mm, mahkota berwarna kuning kemerahan. Bunga betina juga diketiak daun, tunggal, panjang tangkai bunga lebih dari 2.5 cm. Bakal buah silindris, panjang 1.5 cm, tangkai putik panjang 3 mm, kepala putik 3 lobi. Buah berbentuk lonjong, berukuran 3-7 cm x 1-3.5 cm, buah muda berwarna hijau dengan garis putih, setelah masak berubah merah, panjang tangkai buah 4 cm. Biji
satu-satunya Cucurbitaceae yang diperbanyak melalui stek. Daun dan buah muda biasanya dimanfaatkan sebagai sayuran (Boonkerd et al. 1994).
4. Trichosanthes cucumirena L. var anguina (L.) Haines
Trichosanthes cucumirena L. var anguina (L.) Haines, di Indonesia ada yang
menyebutnya paria belut atau paria ular. Tempat tumbuh pada dataran rendah tropis, tidak tahan kekeringan, perlu kelembaban tinggi, dan tidak tahan genangan.
Tanaman ini merupakan tanaman tahunan, berumah satu, berbatang lunak, dan tumbuh menjalar. Daunnya sederhana dengan 5-7 lobi, berukuran 7-25cm x 8-20 cm, berambut halus, panjang tangkai daun 2-10 cm. Bunga jantan terdiri dari 5 bunga atau lebih, panjang tangkai bunga 10-30 cm. Buah silindris memanjang, berukuran 30-180 cm x 2-10 cm, berwarna hijau keputihan saat masih muda dan
berubah kemerahan setelah tua. Biji tebal, berwarna cokelat, panjang 1-1,5 cm. Berbunga sekitar 5 minggu setelah tanam, bunga jantan muncul lebih dulu, kira-kira tiga hari kemudian diikuti bunga betina, penyerbukan dibantu serangga. Buah muda berwarna hijau, dipanen 12-20 hari setelah berbunga atau setelah mencapai panjang 30-60 cm, sedangkan buah tua 1-2 bulan kemudian. Perbanyakan
tanaman melalui biji, yang dipanen setelah buah benar-benar masak. Bagian tanaman yang dimanfaatkan buahnya, digunakan sebagai sayuran (Gildemacher
et al. 1994).
B. PROSES PEMBENTUKAN AKAR RAMBUT
Agrobacterium adalah genus bakteri tanah familia Rhizobiaceae yang
bersifat gram negatif. Spesies Agrobacterium yang bersifat parasit pada tanaman
dan sudah dikenal luas adalah Agrobacterium tumefaciens dan Agrobacterium rhizogenes. Kedua Agrobacterium tersebut dapat menginfeksi berbagai tanaman
spesies dikotil serta beberapa monokotil. A. tumefaciens menyebabkan timbulnya
tumor, sedangkan A. rhizogenes menyebabkan tumbuhnya akar adventif pada
tanaman yang terinfeksi. Timbulnya tumor maupun akar adventif tersebut akibat ditransfernya sebagian materi genetik (T-DNA) dari Ti-plasmid A. tumefaciens
atau Ri-plasmid A. rhizogenes ke genom tanaman.
proses transfer T-DNA, dimana masing-masing tahap melibatkan sekelompok gen yang berbeda. Selanjutnya adalah proses integrasi T-DNA didalam kromosom tanaman.
a) Kontak antara Agrobacterium dengan sel tanaman
Dalam tahap ini diperlukan peranan dari gen-gen kromosom antara lain dua lokus yang saling berpautan yaitu chvA dan chvB, dimana chvB berfungsi
mensintesis β-1-2glukan dan chvA mensekresikan senyawa tersebut. Mutasi pada
dua lokus tersebut menurunkan kemampuan Agrobacterium untuk kontak dengan
sel tanaman. Gen lainnya adalah pscA (ExoC) berperan dalam sintesis polisakarida
ekstraseluler.
b) Proses transfer DNA ke sel tanaman
Didalam proses transfer melibatkan berbagai gen vir yang terdiri dari virA, virB, virD dan virG yang berpenanan dalam proses transfer, virC dan virE untuk
meningkatkan efisiensi transfer. Pada sel tanaman terluka mengeluarkan suatu
senyawa fenol dengan BM rendah yaitu asetosiringone (AS) atau hidroksi asetosiringone (OH-AS). AS akan menginduksi ekspresi gen vir pada
Agrobacterium melalui dua sistem komponen yaitu komponen sensor disandi oleh
gen virA, dan komponen regulator oleh gen virG. VirA merupakan protein
membran dalam, berfungsi sebagai khemoreseptor untuk menangkap AS. Dengan terdeteksinya senyawa AS oleh reseptor virA, AS ditransduksikan dari sensor
virA ke regulator virG, mengakibatkan terjadinya aktivasi virG. Selanjutnya virG
mengaktivasi ekspresi gen vir lainnya, diikuti terjadinya perubahan pada elemen
T-DNA. Gen virD memproduksi protein virD1 dan virD2 yang berfungsi sebagai
endonuklease untuk memotong kedua border dari T-DNA sehingga dihasilkan utas T (T-strand), yaitu molekul intermediet yang ditransfer dari Agrobacterium
ke sel tanaman. Gen virC menghasilkan dua polipeptida yang berfungsi meningkatkan aktivitas virD1 dan virD2 sebagai nuklease pada T-DNA border. Gen virE memproduksi protein virE2 yang berperan dalam memproses utas T
menjadi DNA utas tunggal dan berikatan dengan T-DNA utas tunggal tersebut membentuk ”ssDNA binding protein”. Selain virE2 protein lainnya yang
berikatan dengan DNA utas tunggal adalah protein virD2 yang berikatan pada
tidak menggulung sehingga tetap dalam posisinya, dan sebagai pilot yang memandu transfer utas T dari Agrobacterium ke sel tanaman. Protein produk dari
gen virB diduga berfungsi mengarahkan transfer T-DNA melalui membran Agrobacterium. Selanjutnya transfer T-DNA dari Agrobacterium ke sel tanaman
dipandu oleh protein virD2.
c) Integrasi T-DNA ke genom tanaman
Tahap ini diawali dengan interaksi antara protein virD2 yang terdapat pada ujung 5’ dari T -DNA dengan titik potong (nick) pada DNA tanaman. DNA utas
tunggal menempel pada suatu utas DNA tanaman dan terjadi pemilinan pada DNA tanaman yang menghasilkan titik potong kedua. Masing-masing utas dari T-DNA berligasi dengan DNA tanaman dan menghasilkan utas homolog. Penyusunan kembali dan replikasi dari titik potong yang berturutan pada DNA tanaman menghasilkan duplikasi dan perubahan susunan pada DNA target.
A. rhizogenes mentransfer T-DNA dari Ri (root inducing) plasmid ke sel
tanaman yang diinfeksinya. Didalam Ri plasmid terdapat gen yang berfungsi mendorong pertumbuhan akar adventif. Ri plasmid. membawa satu atau beberapa T-DNA, dan dapat mentransfernya satu persatu atau beberapa T-DNA sekaligus. Ri plasmid selain membawa gen yang mendorong pertumbuhan akar adventif, juga membawa gen penyandi enzim yang memproduksi dan mensekresikan opin.
Senyawa opin merupakan substrat pertumbuhan bagi Agrobacterium. Berdasarkan jenis opin yang diproduksi, antara lain terdapat A. rhizogenes strain mannopin dan
A. rhizogenes strain agropin. A. rhizogenes strain manopin hanya mempunyai satu
T-DNA. Sedangkan strain agropin mempunyai dua T-DNA yaitu TL-DNA dan TR-DNA. Salah satu dari T-DNA yaitu TR-DNA mempunyai homologi dengan T-DNA A. tumefaciens, yaitu gen iaaM dan iaaH yang meregulasi biosintesis
auksin, dan gen penyandi sintase yaitu gen ags yang menyandi agropin.
Sedangkan TL-DNA mempunyai beberapa homologi dengan T-DNA dari strain manopin. Pada kondisi tertentu TL-DNA tanpa TR-DNA dapat menginduksi pembentukan akar rambut, tetapi pada kondisi lainnya memerlukan TR-DNA, diduga meningkatnya biosintesis auksin endogen memacu kerja gen TL-DNA
(Nilsson dan Olsson, 1997).
terhadap morfologi akar rambut yang dihasilkan. Lokus tersebut adalah root locus A-D (rolA-D), yaitu rolA (ORF 10), rolB (ORF11), rolC (ORF12) dan rolD
(ORF15). Akar yang diinduksi oleh oleh T-DNA mutant rolA mempunyai
fenotipe lurus. Mutan rolB menyebabkan A. rhizogenes tidak virulen,
menunjukkan begitu pentingnya lokus rolB pada induksi akar. Mutant rolC terjadi
penghambatan pertumbuhan akar, sedangkan mutant rolD meningkatkan
pembentukan kalus sehingga menghambat pertumbuhan akar (Oono et al. 1993).
Pada pembentukan akar rambut yang paling berpengaruh adalah gen rolA
dan gen rolB, dimana gen rolA diduga berpengaruh terhadap rasio sitokinin/auksin. Sedangkan gen rolB bekerja melalui dua mekanisme, yaitu : 1) meningkatkan pool auksin aktif bebas dengan memediasi terjadinya hidrolisis IAA konjugat yang tidak aktif, 2) meningkatkan sensitivitas sel terhadap IAA. (Nilsson dan Olsson, 1997). Selain itu gen rolB diduga mendorong pembentukan
meristem. Gen rolA maupun rolB secara tunggal mampu menginduksi
pertumbuhan akar rambut, sedangkan gen rol C memerlukan promoter yang kuat (35S promoter). Tetapi bila semua gen rol berada bersama-sama akan bekerja
secara sinergis dan cenderung mempunyai efek lebih kuat dibanding dalam keadaan tunggal (Nilsson dan Olsson, 1997).
Meskipun produksi akar rambut akibat infeksi A. rhizogenes merupakan
hasil proses transfer gen seperti pada tumor akibat infeksi A. tumefaciens, tetapi proses yang terjadi pasca infeksi sangat berbeda. Selain itu sejumlah gen yang terlibat juga berbeda, dalam hal ini ekspresi gen rol terutama gen rolB sangat
penting untuk terjadinya akar rambut. Sedangkan ORF lainnya seperti gen iaaM
dan iaaH hanya merupakan faktor pelengkap yang diperlukan untuk terbentuknya
akar rambut. Perbedaan lainnya antara crown gall dan akar rambut adalah crown gall terdiri dari sel yang tidak terdeferensiasi, tumbuh dengan cepat membentuk
tumor yang terdiri dari sel-sel tertransformasi dan sel-sel non-transformasi. Karena pada crown gall seringkali terjadi difusi auksin dan sitokinin yang
disintesis oleh sel tertransformasi ke sel sekitar yang tidak tertransformasi. Sebaliknya akar rambut terdiri dari sel-sel yang terdeferensiasi dan
tertransformasi, karena akar rambut berasal dari sel tunggal yang tertransformasi (Nilsson dan Olsson, 1997).
semua gen rol mempunyai persamaan pola ekspresi yaitu pada jaringan tertentu
(tissue specific expression) terutama meristem akar dan floem. Kecuali gen rolD
ekspresinya diregulasi oleh perkembangan tanaman (developmentally regulated expression), terjadi pada fase elongasi/ekspansi dan pemasakan jaringan.
Promoter rolB terekspresi pada parenkhim floem dan sel ray, demikian pula
promoter rol C diekspresikan pada sel floem (Nilsson et al. 1997).
Altamura et al. (1991) melaporkan ada korelasi tinggi antara ekspresi gen rol dan inisiasi akar, yang ditunjukkan dengan diekspresikannya promoter rolB
dan rolC pada sel-sel pericycle sebelum dan selama inisiasi serta pertumbuhan akar adventif. Menurut Maurel et al. (1994), promoter rolB diaktivasi oleh auksin, sedangkan aktivitas rolC dimodulasi oleh sukrosa. Kandungan sukrosa paling
tinggi terdapat didalam floem dimana sukrosa ditransportasikan. Sedangkan konsentrasi IAA maksimal terdapat didalam pembuluh kambium, tetapi sejumlah IAA juga ditransportasikan melalui floem. Pengaturan promoter rolB dan rolC
oleh sukrosa dan auksin menunjukkan pentingnya peranan kedua senyawa tersebut selama inisiasi akar, keduanya merupakan komponen yang diperlukan dalam induksi akar adventif. Oleh karena itu sel-sel dengan kandungan sukrosa dan auksin tinggi kompeten sebagai asal meristem akar dan merupakan sel target yang ideal untuk infeksi A. rhizogenes, sel-sel tersebut adalah sel ray dan sel
floem.
C. BIOSINTESIS PROTEIN PADA TANAMAN
Biosintesis protein pada tanaman bersifat khas berbeda dengan organisme lain, karena tanaman mampu mensintesis asam amino yang diperlukan untuk
pembentukan protein (Salysbury dan Ross, 1991).
1. Pembentukan Asam Amino
Pembentukan asam amino pada tanaman memerlukan dua unsur penting yaitu karbon dan nitrogen, serta sulfur untuk asam amino tertentu. Berdasarkan cara mendapatkan sumber nitrogen Salysbury dan Ross (1991) membagi tanaman
menjadi tiga kelompok: a) melalui fiksasi N2, b) menggunakan NO3 sebagai sumber nitrogen, c) menggunakan NH4 sebagai sumber nitrogen.
prokariot membentuk NH3. Proses tersebut merupakan kerjasama secara simbiotik antara mikroorganisme dan sel akar, ditandai dengan terbentuknya nodul akar. Tanaman inang mensuplai karbohidrat hasil fotosintesis dari daun, ditrans-lokasikan melalui floem ke nodul akar dalam bentuk sukrosa. Kemudian sukrosa
dioksidasi oleh bakteroid pada nodul akar, hasilnya untuk mereduksi NAD+ menjadi NADH atau NADP+ menjadi NADPH. Selain karbohidrat pada tanaman lain terjadi oksidasi piruvat yang mereduksi protein flavodoksin. Selanjutnya flavodoksin, NADH atau NADPH mereduksi feredoksin atau protein lain mirip
feredoksin yang sangat efektif dalam mereduksi N2 menjadi NH3. Reaksi fiksasi nitrogen yang mereduksi N2 menjadi NH3 sebagai berikut:
N2 + 16 ATP + 8e + 8 H ◊ 2NH3 + H2 + 16ADP + 16Pi
Tanaman yang menggunakan NO3 sebagai sumber nitrogen mereduksi NO3, sebagian besar terjadi di akar atau daun di tempat nitrat reduktase paling aktif. Proses reduksi nitrat terdiri dari 2 reaksi, masing-masing dikatalisir oleh ensim
yang berlainan. Reaksi pertama reduksi nitrat ke nitrit dikatalisir ensim nitrat reduktase, terjadi di sitosol diluar organel sebagai berikut :
NO3 - + NAD(P)H + H+ + 2e ◊ NO2- + NAD(P) + H2O
Selanjutnya nitrit dari sitoplasma ditransportasikan ke kloroplas daun atau ke proplastid akar. Reaksi berikutnya adalah reduksi NO2- menjadi NH4+dikatalisir
oleh ensim nitrit reduktase sebagai berikut :
NO2- + 6Fdred + 8H+ + 6e ◊ NH4+ + 6 Fdox + 2H2O
Tanaman yang menggunakan NH4 sebagai sumber nitrogen utama, mengabsorbsi nitrogen dalam bentuk NH4. Tanaman ini biasanya hidup didaerah dengan kondisi pH tanah rendah, sehingga menghambat proses nitrifikasi.
Selain proses reduksi nitrogen pembentukan asam amino tertentu
melibatkan asimilasi sulfur. Pada tanaman sumber sulfur umumnya dalam bentuk oksidasi atau sulfat, sehingga terjadi proses reduksi membentuk S = sebagai berikut :
SO4= + ATP + 8e- +8 H+ ◊ S = + 4H2O + AMP + PPi
Sulfur merupakan unsur penting dalam pembentukan asam amino sistein dan
metionin (Crawford et al. 2000).
sitrat (Coruzzi dan Last., 2000). Asam organik tersebut antara lain :
a. á-ketoglutarat, menyumbangkan rangka karbon untuk asam amino glutamat, glutamin, histidin, prolin dan arginin.
b. Oksaloasetat, menyumbangkan rangka karbon untuk asam amino aspartat,
asparagin, treonin, isoleusin, metionin dan lisin.
c. 3-fosfogliserat, sebagai sumber rangka karbon dari serin, glisin, sistein. d. Fosfoenol piruvat, merupakan sumber rangka karbon dari triptofan, tirosin
dan fenilalanin.
e. Piruvat , merupakan sumber rangka karbon dari alanin, leusin dan valin. Pembentukan asam amino melalui berbagai proses antara lain proses reduksi
aminasi yang terjadi pada pembentukan glutamat dari á-ketoglutarat yang dikatalisir oleh ensim glutamat dehidrogenase. Selanjutnya pembentukan glutamin yang dikatalisir ensim glutamin sintetase, kemudian glutamin mentransfer gugus amidanya ke asam aspartat membentuk asparagin, dikatalisir ensim asparagin
sintetase. Pembentukan asam amino lainnya melalui berbagai reaksi transaminasi dua arah. Reaksi transaminasi ini melibatkan perpindahan dua arah gugus
α-amino dari suatu asam amino ke gugus α-keto dari asam α-keto, diikuti dengan
terbentuknya asam amino baru dan asam α-keto baru (Coruzzi dan Last, 2000).
2. Sintesis Protein
Protein merupakan hasil ekspresi gen yang terbentuk melalui proses transkripsi, prosesing dan translasi. Pada proses transkripsi DNA dihasilkan
pre-mRNA, selanjutnya pre-mRNA mengalami prosesing menjadi mRNA, kemudian mRNA ditranslasi atau diterjemahkan menjadi protein (Sugiura dan Takeda, 2000).
a. Perangkat sintesis protein
Menurut Spremulli (2000) berbagai makromolekul yang berperanan dalam
proses translasi, antara lain :
- Messenger RNA (mRNA)
- Transfer RNA (tRNA)
Transfer RNA (tRNA) berperanan sebagai penterjemah runtunan kodon mRNA menjadi runtunan asam amino, dibantu seperangkat ensim. Antikodon tRNA mengenali kodon mRNA melalui pasangan basa, masing-masing basa dari
kodon membentuk pasangan dengan basa yang komplementer dari antikodon.
- Ribosom
Merupakan organel tempat sintesis protein berlangsung, mempunyai struktur spesifik dan komplek. Pada sel eukariot ribosom terletak dalam sitoplasma,
mempunyai koefisien sedimentasi 80S yang terbagi menjadi dua yaitu Subunit besar (60S) dan Subunit kecil (40S). Subunit kecil terdiri dari molekul RNA tunggal 18S, sedangkan Subunit besar mempunyai tiga molekul RNA (28S, 7S, dan 5S). Pada ribosom terdapat satu situs untuk mRNA, dua situs untuk tRNA (situs A dan situs P), dan satu situs untuk ensim peptidil transferase yaitu situs. Situs mRNA terdapat pada subunit kecil, sedangkan dua situs tRNA sebagian
besar terletak pada subunit besar dan sebagian lagi pada subunit kecil, situs peptidil transferase pada subunit besar. Pada tanaman selain ribosom pada sitoplasma juga terdapat ribosom lain pada organel yaitu pada mitokondria dan kloroplas. Ribosom organel berfungsi mensintesis protein yang diperlukan oleh organel tersebut .
b. Mekanisme sintesis protein
Mekanisme sintesis protein disebut translasi, karena merupakan penterjemahan dari pasangan empat macam basa asam nukleat kedalam 20 macam asam amino. Menurut Watson et al. (1998) mekanisme sintesis protein meliputi
berbagai tahap sebagai berikut :
- Pembentukan aminoasil-tRNA
Pada proses ini terjadi perpautan antara asam amino dengan tRNA membentuk aminoasil-tRNA, dikatalisir aminoasil-tRNA sintetase, yang disebut "activating enzyme". Perpautan ini berfungsi mengaktivasi gugus karboksil
untuk membentuk suatu peptida. dan sebagai molekul adaptor karena asam amino tidak dapat mengenali langsung kodon pada mRNA. Satu
amino tersebut, sehingga dengan cepat dapat bergabung dengan sintetase yang sesuai.
- Inisiasi
Pada proses ini terjadi ikatan antara inisiator tRNA dengan tanda awal (start signal) dari mRNA. Inisiator tRNA menempati situs P (peptidil) pada ribosom.
Proses inisiasi terdiri dari tiga tahap :
- penempelan subunit kecil ribosom pada tRNA inisiator
- penempelan mRNA pada kompleks subunit kecil ribosom dan tRNA
inisiator
- pembentukan kompleks subunit besar ribosom, subunit kecil ribosom, tRNA
dan mRNA yang siap membaca kodon-kodon mRNA.
Proses inisiasi dibantu dua molekul protein yang disebut eIF2 dan eIF3 (eIF =
eucaryotic initiation factor). Didalam sitoplasma kedua faktor inisiasi
menempel pada subunit kecil ribosom. Fungsi eIF2 mendorong penempelan
aminoasil-tRNA inisiator dan mRNA pada subunit kecil ribosom. Sedangkan eIF3 berfungsi memisahkan subunit kecil ribosom dari subunit besar setelah ribosom selesai melakukan translasi.
- Elongasi
Perpanjangan rantai polipeptida melibatkan sejumlah protein faktor
perpanjangan EF (elongation factor), enzim peptidil tranferase serta GTP. Proses ini terdiri dari tiga tahap, yaitu pengikatan aminoasil-tRNA (pengenalan kodon), pembentukan ikatan peptida, dan translokasi.
- Terminasi
Merupakan akhir proses translasi yang terjadi bila tanda berhenti (stop signal)
pada mRNA dibaca oleh protein faktor pembebas, dan terjadi pelepasan rantai
polipeptida dari ribosom.
Didalam setiap tahapan proses sintesis protein terjadi interaksi antara berbagai perangkat (makromolekul) yang berperanan dalam proses sintesis protein. Interaksi tersebut terjadi dalam semua tahapan sintesis protein yaitu didalam proses inisiasi, elongasi dan terminasi (Spremulli, 2000).
selesai proses translasi periode sebelumnya. Dengan adanya penempelan faktor inisiasi ini terjadi interaksi antara subunit kecil ribosom dengan mRNA, dimana subunit kecil ribosom akan menempel pada ujung 5' dan kemudian bergerak sepanjang mRNA untuk mencari kodon awal AUG. Pada proses inisiasi terjadi
hidrolisis ATP menjadi ADP dan P yang diperlukan untuk mencari kodon awal. Setelah subunit kecil menyelesaikan inisiasi, subunit besar ribosom bergabung, dan GTP yang menempel pada eIF2 dihidrolisis menjadi GDP dan P. Kemudian. eIF2 dan eIF3 terlepas dari ribosom, dan ribosom siap memulai proses
perpanjangan polipeptida. Pada akhir proses inisiasi subunit besar ribosom bersatu dengan subunit kecil ribosom dan berasosiasi dengan aminoasil-tRNA inisiator serta mRNA.
Proses elongasi dimulai dengan masuknya aminoasil-tRNA kedua ke situs A. Pada prokariot masuknya aminoasil-tRNA dibantu oleh faktor elongasi EF-Tu serta GTP yang membentuk kompleks EF-Tu-GTP-aminoasil-tRNA. Setelah
terjadi hidrolisis GTP menjadi GDP dan P, maka EF-Tu-GDP terlepas dari aminoasil-tRNA. Protein faktor elongasi lainnya EF-Ts mengembalikan EF-Tu-GDP menjadi EF-Tu-GTP untuk berperan kembali dalam siklus berikutnya. Sedangkan pada eukariot hanya ada satu protein faktor elongasi yaitu EF1 yang mempunyai peran kombinasi EF-Tu dan EF-Ts.Tahap berikutnya adalah
pembentukan ikatan peptida. Bila antikodon pada aminoasil tRNA sesuai dengan kodon mRNA pada situs A, maka ensim peptidil transferase akan melepaskan asam amino dari tRNA pada situs P dan menggabungkannya dengan asam amino yang terdapat pada aminoasil-tRNA pada situs A. Pada aminoasil-tRNA asam amino berikatan dengan tRNA melalui gugus karboksilnya (-COO-) sedangkan gugus aminonya (-NH) dalam keadaan bebas. Peptidil tranferase akan melepaskan
ikatan -COO- dari ujung 3' tRNA dari aminoasil-tRNA pada situs P dan merangkaikannya pada gugus amino pada situs A membentuk ikatan peptida, sehingga terbentuk dipeptidil pada situs A. Reaksi tersebut disebut reaksi transpeptidasi. Transpeptidasi berikutnya tidak akan berlangsung selama peptidil-tRNA masih berada pada situs A, maka untuk reaksi transpeptidasi berikutnya
nukleotida. Dengan demikian kodon berikutnya menduduki posisi yang dapat dibaca oleh aminoasil-tRNA baru. Translokasi memerlukan faktor elongasi kedua, yaitu EF2 (translokase). GTP yang terikat oleh EF2 dihidrolisa pada saat translokasi. Hidrolisis GTP menyebabkan EF2 dikeluarkan dari ribosom,
karenanya GTP juga berfungsi sebagai katalitik. Setelah translokasi, situs A menjadi kosong, dan segera mengikat aminoasil-tRNA baru untuk memulai elongasi berikutnya
Terminasi terjadi bila ribosom menemukan salah satu kodon akhir UAA,
UAG atau UGA. Pada kondisi tersebut tidak ada aminoasil-tRNA yang dapat menempel pada situs A, karena tidak ada tRNA dengan antikodon yang komplementer dengan tanda stop (stop signal). Tetapi tanda stop ini dikenali oleh
protein faktor pembebas (RF = release factor). Kemudian RF berikatan dengan
kodon akhir pada situs A, mengubah aktivitas peptidil transferase. Ensim tersebut tidak mereaksikan polipeptida dengan aminoasil-tRNA melainkan dengan H2O,
akibatnya terjadi proses hidrolisis. Peptidil tRNA pada situs P dan rantai polipeptida terlepas dari tRNA, selanjutnya GTP terhidrolisis menjadi GDP dan P, disosiasi antara ribosom, tRNA dan mRNA, dan terurainya ribosom menjadi Subunit besar dan Subunit kecil.
D. PROTEIN BIOAKTIF
Protein bioaktif adalah protein yang mempunyai aktivitas biologis diluar
aktivitas dari fungsi protein tersebut. Protein bioaktif yang sudah dikenal luas antara lain protein anti-jamur, protein anti-bakteri, protein anti-virus, dan protein penginaktivasi ribosom. Protein bioaktif pada tanaman penghasilnya diduga sebagai senyawa yang berfungsi dalam sistem pertahanan.
Protein anti jamur protein PR-5 dari daun labu ditemukan Cheong et al.
(1997) dan protein PR-5d dari tembakau oleh Koiwa et al. (1997). Kedua protein ini mempunyai mekanisme kerja dengan meningkatkan permiabilitas plasma membran, sehingga menyebabkan kebocoran membran dan keluarnya material intraseluler pada jamur.
Protein antivirus dari akar Bougainvillea spectabilis (BAP 1) menunjukkan
aktivitas penghambatan sintesis protein secara in vitro. (Balasaraswati et al. 1998)
Gelonium multiflorum. Kedua protein tersebut mampu menghambat infeksi virus
HIV-1 dan menghambat replikasi virus pada sel yang sudah terinfeksi, dengan menghambat HIV-integrase dan menginaktivasi topologi HIV-LTR (Huang et al.
1999).
Segura et al. (1999) menemukan peptida antimikroba Snakin-1 (SN1) dari
umbi kentang. Protein ini menunjukkan aktivitasnya pada konsentrasi kurang dari 10 µM terhadap bakteri dan jamur patogen pada kentang dan spesies tanaman lainnya. Snakin-1 diketahui menyebabkan agregasi bakteri gram negatif maupun
gram positif.
Protein yang menonaktifkan ribosom, menghambat sintesis protein pada organisme lain, dikenal sebagai ribosom inactivating protein (RIPs). Protein ini
merupakan toksin tanaman dengan aktivitas N-glikosidase yang memotong N-glikosida pada Sub unit besar ribosom mamalia, jamur, dan bakteri. RIPs memotong N-glikosida rRNA pada situs spesifik, yaitu pada A4324 dari 28S rRNA
liver tikus, A3024 pada 26S rRNA yeast dan A2660 dari 23S rRNA E. coli. Dengan terjadinya pemotongan N-glikosida pada Sub unit besar, ribosom tidak dapat berinteraksi dengan faktor elongation 2 (EF2) pada eukariot atau EFG pada prokariot sehingga menghambat elongasi rantai polipeptida (Girbes et al. 1993;
Jensen et al. 1999).
RIPs dibedakan menjadi 2 tipe, yaitu
a) Tipe 1, merupakan rantai polipeptida dengan aktivitas ensim yang unik. RIPs tipe 1 relatif banyak, lebih dari 30 jenis telah berhasil diisolasi.
b) Tipe 2, terdiri dari satu atau dua dimer dari dua rantai polipeptida yang berlainan yang digabungkan dengan jembatan disulfida. Salah satu rantai polipeptida bersifat ensimatik (rantai A), sedangkan rantai lainnya adalah lektin
(rantai B) yang dapat berikatan dengan gula membran, terutama residu galaktosa.
RIPs tipe 2 bekerja dengan mengikatkan toksin dari rantai B ke reseptor pada permukaan sel, kemudian rantai A masuk ke sitoplasma dan menonaktifkan sub unit besar ribosom 60 S. RIPs tipe 2 sangat jarang baru 5 jenis yang berhasil
dideteksi dan diisolasi.
terhadap degradasi denaturan maupun proteolitik (Jensen et al. 1999).
Pada umumnya protein bioaktif disintesa dalam bentuk tidak aktif, selanjutnya ditransport ketempat dimana protein tersebut disimpan, dan pada tempat protein tersebut disimpan mengalami proses pengaktifan. Kloning cDNA
pada ricin menunjukkan bahwa molekul disintesa dalam bentuk prepro sebagai polipeptida tunggal, kemudian 12 asam amino yang menghubungkan antara dua rantai dipotong untuk menghasilkan protein aktif. Hal serupa dijumpai pada toksin diphteria dimana disintesa sebagai polipeptida tunggal, kemudian mengalami
proses proteolitik membentuk dua rantai. Endopeptidase yang dapat memotong sekuen intervening 12 asam amino pada preporicin telah diisolasi dari protein pada biji jarak (Ricinus communis L), dimana toksin disimpan. Proricin tanpa
sekuen signal, tetapi dengan sekuen intervening dapat mengikat galaktosa, bentuk ini bersifat inaktif dalam uji rantai ensim. Oleh karena itu sel jarak diduga memproteksi perangkat sintesis proteinnya dari pengaruh inaktivasi oleh ricin
dengan mengekspresikan molekul ricin yang tidak aktif (proricin), kemudian menjadi aktif (ricin) setelah diekspor ke biji (Jensen et al. 1999).
Park et al. (2003) mengisolasi dan mengkarakterisasi RIPs tipe I dari akar
rambut Phytolaca americana yang disebut PAP-H. Protein tersebut disekresikan
secara konstitutif kedalam medium sebagai eksudat akar. Selain mempunyai
aktivitas menghambat sintesis protein dengan menonaktifkan ribosom PAP-H juga mempunyai aktivitas anti-jamur.
E. UJI KEMATIAN LARVA UDANG
Dasar pertimbangan dari metode ini adalah senyawa bioaktif bersifat toksik pada dosis tinggi, sehingga kematian in vivo dari hewan sederhana Artemia salina
Leach dapat digunakan untuk memonitor dengan mudah dan cepat dalam skrining ekstrak bioaktif tanaman. Selain metodenya cukup sederhana, bahannya mudah didapat, relatif murah dan perlu waktu singkat. Menurut Hostettmann (1991)
metode ini mempunyai korelasi positif dengan pengujian sitotoksisitas pada 3PS (P-388 murine leukemia in vivo). Telur A. salina Leach (larva udang) tersedia dan
air laut buatan, dalam waktu 24 jam akan diperoleh larva (nauplii ) dalam jumlah
banyak.
Larva A. salina Leach tidak mempunyai alat untuk mempertahankan diri
dari serangan musuh, satu-satunya cara untuk menghindar dari musuh adalah
dengan hidup diperairan kadar garam tinggi, dalam kondisi ini jarang organisme yang dapat bertahan hidup. Pada habitatnya A. salina memakan sisa-sisa jasad
hidup yang sudah menghancur, ganggang, bakteri dan cendawan.
A. salina Leach berkembangbiak dengan dua cara yaitu ovipar melalui telur
dan ovovivipar langsung melalui larva. Perkembangbiakan ovovivipar terjadi bila lingkungan cukup baik, kadar garam tidak terlalu tinggi dan oksigen cukup. Tetapi bila lingkungan buruk seperti meningkatnya kadar garam dan menurunnya oksigen maka larva akan berkembangbiak secara ovipar melalui telur yang bercangkang tebal disebut cyste. Dan bila lingkungan membaik telur akan menetas dalam waktu 24 – 36 jam (Meyer, 1982).
A. salina Leach atau brine shrimp adalah jenis udang-udangan primitif, dengan sistematika sebagai berikut :
filum : Arthropoda subfilum : Mandibulata kelas : Crustaceae
subkelas : Branchiopoda ordo : Anostraca famili : Artemiidae genus : Artemia
spesies : Artemia salina Leach
Uji kematian larva udang (brine shrimp lethality test = BSLT) telah
Gambar 2. Larva Artemia salina Leach
minyak (Hostettman, 1991). Oberlies et al. (1998) menggunakan uji BSL pada
skrining sitotoksisitas buah muda alpokat Persea americana. Hasil penelitiannya
menunjukkan buah muda yang diekstraksi dengan ethanol 95% pada uji BSL
memperoleh LC50 pada konsentrasi 31 µg/ml. Jaki et al. (1999) menguji 86 ekstrak lipofilik dan hidrofilik dari 43 sampel cyanobacteria untuk penapisan bioaktivitasnya dengan uji BSL. Hasil penelitiannya menunjukkan 8,1% dari
ekstrak mengakibatkan kematian ≥ 60% A. salina Leach pada konsentrasi
500 ppm. Lieberman (1999) memantau toksisitas limbah kimia rumah tangga dengan uji BSL menggunakan Artemia franciscana.
F. UJI MENGGUNAKAN GALUR SEL KANKER IN VITRO
Pada pertumbuhan normal terjadi pengaturan laju proliferasi sel dari suatu organ, meningkat atau menurunnya proliferasi sel setara dengan laju kerusakan sel sehingga ukuran organ tetap terjaga. Sebaliknya sel kanker tidak mengikuti aturan tersebut, tetapi terjadi proliferasi yang tidak terkendali, sehingga terbentuk tumor (Hood et al. 1997).
Tumor yang disebabkan oleh proliferasi sel disebut neoplasma atau pertumbuhan baru. Berdasarkan kemampuan menyebar neoplasma dibedakan antara neoplasma maligna dan neoplasma benigna. Neoplasma maligna atau kanker adalah neoplasma yang menyerang jaringan sekelilingnya, kemudian menyebar keseluruh tubuh (metastasis). Neoplasma yang membentuk tumor yang
tidak menyebar disebut neoplasma benigna. Berdasarkan asalnya antara lain terdapat dua jenis tumor yaitu tumor yang berasal dari sel epitel disebut karsinoma, sedangkan yang berasal dari sel stroma atau mesenkhim disebut sarkoma (Van de Velde et al. 1999).
Pengobatan penyakit kanker umumnya dilakukan melalui biopsi, radioterapi dan khemoterapi yang memerlukan biaya sangat mahal. Oleh karena itu berbagai
kedua di dunia kaya akan berbagai tanaman berkhasiat obat, termasuk obat anti kanker (Maat, 2000).
Untuk mengidentifikasi senyawa anti kanker dilakukan evaluasi praklinik yang ekstensif dari berbagai senyawa untuk mendeteksi aktivitas neoplastik.
Pengujian yang dilakukan meliputi pengujian in vivo menggunakan hewan model,
dan pengujian in vitro menggunakan kultur sel. Pada kultur sel dapat diamati
secara langsung sitotoksisitas suatu senyawa terhadap viabilitas sel (Wilson, 1992).
Berdasarkan asalnya Freshney (1992) membagi kultur sel menjadi beberapa jenis, yaitu : 1) Sel primer adalah kultur sel yang belum disubkultur, berasal dari jaringan yang diisolasi dan dikulturkan. Sel ini dapat mewakili atau mempunyai kemiripan dengan jaringan asal, tetapi pemeliharaannya sulit.. 2) Finite Cell Line,
kultur sel yang mempunyai masa hidup terbatas, umumnya merupakan kultur jaringan sel normal atau sel-sel yang tidak berubah selama masa pengkulturan. Sel
masih mempunyai kemiripan atau dapat mewakili jaringan asal, pemeliharaannya sulit dan waktu penggandaan sel 24-96 jam 3) Continuous cell line, adalah galur
sel yang mempunyai masa hidup tidak terbatas (immortal), bisa berasal dari tumor
atau sel yang mengalami perubahan selama pengkulturan. Umumnya sel kurang terdeferensiasi, pemeliharaannya mudah, dan memerlukan waktu penggandaan
12-24 jam.
Griffiths (1992) membedakan kultur sel berdasarkan sifat pertumbuhannya, sebagai berikut : a) sel suspensi adalah sel yang tumbuh membentuk suspensi dalam medium kultur, dapat hidup dan berkembang tanpa menempel pada cawan kultur. Sel yang berasal dari darah, limpa atau sumsum tulang, khususnya sel yang belum dewasa cenderung tumbuh dalam bentuk suspensi. Sel suspensi berbentuk
seperti bola-bola kecil, dan mudah dipanen. Keuntungan lain dari sel suspensi adalah dapat menghasilkan sel dalam jumlah besar. b) Sel yang menempel, adalah sel yang tumbuh membentuk satu lapisan (monolayer), menempel pada permukaan cawan kultur. Sel yang berasal dari lapisan embrionik ektodermal atau endodermal cenderung tumbuh secara menempel, antara lain sel fibroblas dan sel
pengujian mikroskop, hibridisasi dan pengujian fungsional lainnya.
Contoh galur sel kanker yang mempunyai masa hidup tidak terbatas adalah sel HeLa yang diisolasi dari epitheloid carcinoma pada servic seorang wanita
negro berusia 31 tahun. Sel Hela merupakan sel monolayer, dan bersifat
aneuploid. Sel lainnya adalah sel K-562 (ATCC CCL 243) diisolasi pertamakali oleh Lozzio (1972) dari efusi pleural wanita berumur 53 tahun yang menderita
leukemia myleogenous kronik pada akhir masa blast. Sel K-562 merupakan galur erythroleukemia, multipotensial dan sel malignant haematopoeitic. Galur sel
K-562 ini merupakan tipe sel yang dibiakkan dalam bentuk suspensi (ATCC, 1992).
Pada setiap kultur diperlukan pengamatan berkala secara makroskopis atau mikroskopis, karena bila sel tidak sehat percobaan tidak reprodusible.
Pengamatan kultur menurut Hay (1992) meliputi : a) warna medium, umumnya media mempunyai indikator pH, bila berubah menjadi kuning menunjukkan
bersifat asam atau keunguan menunjukkan basa. Medium yang terlalu asam atau basa menunjukkan terjadinya kontaminasi, pertumbuhan yang berlebihan, kematian kultur, atau kurangnya aliran CO2. b) ada selaput yang menyelimuti medium, menunjukkan kontaminasi atau pertumbuhan kultur yang berlebihan. c) terbentuk gumpalan sel pada kultur suspensi atau terjadi pengelupasan pada
III. PENAPISAN PROTEIN BIOAKTIF DARI BAGIAN
TANAMAN BEBERAPA SPESIES CUCURBITACEAE
A. PENDAHULUAN
Tanaman hortikultura famili Cucurbitaceae dikenal sebagai kelompok sayur-sayuran dan buah-buahan, selain itu beberapa spesies dari famili ini juga digunakan sebagai obat. Misalnya buah bligo (Benincasa hispida) sebagai
diuretik, laksatik, tonik, dan karena bersifat mendinginkan sering pula untuk pengobatan nervous disorder (Rifai dan Reyes, 1994). Buah paria ular
(Trichosanthes cucumerina) sebagai pencahar (purgative) dan vermifuge
(Gildemacher et al. 1994). Buah kemarongan (Coccinia grandis) sebagai tapal (poultice), antipiretik, dan pengobatan diabetes (Boonkerd et al. 1994). Biji segar Cucurbita pepo sebagai vermifuge, sedangkan biji olahan untuk diuretik dan
penurun demam (di Toppi et al. 1996).
Pada famili Cucurbitaceae selain menghasilkan berbagai metabolit
berkhasiat obat, juga ditemukan beberapa protein bioaktif. Dari beberapa spesies Cucurbitaceae yang dilaporkan menghasilkan protein bioaktif antara lain
Cucurbita sp. menghasilkan protein anti jamur protein PR-5 (Cheong et al. 1997;
Koiwa, et al. 1997). Pada Momordica charanthia ditemukan protein anti virus
MAP 30 (Huang et al. 1999). Dari Trichosanthes sp. dihasilkan protein
penginaktivasi ribosom karasurin A, trichosanthin, dan β-kirilowin (Dong, et al. 1994; Kitagawa et al. 1994) Sedangkan Luffa cylindrica menghasilkan protein luffin dan RIPs lainnya (Watanabe et al. 1990; di Toppi et. al. 1996). Tumilisar
(2001) melaporkan protein bioaktif dari Luffa cylindrica yang menghambat
proliferasi sel cervic carcinoma (HeLa), melanoma (B16), dan erythroleukemia
(K-562) in vitro.
Protein bioaktif pada tanaman diekspresikan pada berbagai organ dan
jaringan. Peptida Snakin-1 diekspresikan pada umbi, batang, tunas aksilar, tangkai bunga, kelopak, mahkota dan benangsari (Segura et al. 1999). Protein PR-5d dari
tembakau ditemukan pada daun yang terinfeksi TMV, kultur sel, protoplas, dan akar (Koiwa, et al. 1997). RIPs terdapat pada endosperm, buah, akar, daun, kulit
kayu dan getah tanaman (Jensen et al. 1999).
aktivitas. RIPs dari Luffa cylindrica yang diisolasi dari biji, daun muda, daun tua
dan akar, mempunyai aktivitas berlainan (di Toppi et al. 1996). Pada Phytolaca americana, RIPs dari daun, biji dan akar berbeda jenis dan aktivitasnya (Stirpe et al. 1992).
Protein bioaktif selain mempunyai kemiripan struktur juga mempunyai BM yang berdekatan. Menurut Stirpe et al. (1992) RIPs mempunyai BM antara
26 - 32 kDa. Demikian pula beberapa protein bioaktif lainnya mempunyai BM pada kisaran tersebut, misalnya protein antivirus dari akar Bougainvillea spectabilis, (BAP 1) dan protein antijamur Protein PR-5 dari daun labu (Cucurbita sp.) keduanya mempunyai BM 28 kDa (Cheong et al. 1997, Balasaraswati et al. 1998). Protein anti virus dari daun Phytolaca americana (PAP) mempunyai BM
29 kDa. Protein penginaktivasi ribosom dari biji paria (Momordica charantia)
yaitu momordin a dan momordin-b mempunyai BM 29.4 kDa (Minami et al.
1992).
Tujuan penelitian adalah melakukan penapisan bagian tanaman dari tiga spesies Cucurbitaceae yang menghasilkan protein dengan rendemen dan aktivitas tinggi serta mudah di dalam penanganannya.
B. BAHAN DAN METODE
1. Tempat, Waktu, dan Bahan Penelitian
a. Tempat dan Waktu
Koleksi tanaman induk sebagai sumber bahan ekstraksi protein ditanam dan dipelihara di Kebun Percobaan Kampus IPB Baranang Siang. Kegiatan.isolasi, uji aktivitas dan karakterisasi protein dilakukan di Lab. Balai Bioteknologi BPPT,
Puspiptek - Serpong.