PERUBAHAN STRUKTUR FENANTRENA SELAMA PROSES
BIODEGRADASI OLEH BAKTERI
BACILLUS ALTITUDINIS
LAELA ROCHDIANA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
LAELA ROCHDIANA. Perubahan Struktur Fenantrena Selama Proses
Biodegradasi oleh Bakteri
Bacillus altitudinis
. Dibimbing oleh CHARLENA dan
MUHAMMAD KHOTIB.
Pencemaran lingkungan oleh hidrokarbon polisiklik aromatik (PAH) yang
diketahui bersifat toksik, mutagenik, dan karsinogenik telah meluas di lingkungan.
Beberapa jenis bakteri dapat menggunakan PAH sebagai sumber energi untuk
metabolisme. Fenantrena merupakan salah satu PAH dengan 3 cincin aromatik,
dan senyawa ini dapat didegradasi oleh bakteri
Bacillus altitudinis.
Hasil yang
diperoleh selama 28 hari kultivasi dengan fenantrena 50 ppm dengan tambahan
Tween 80 sebagai surfaktan menunjukkan laju degradasi sebesar 14%. Parameter
yang diamati adalah
total plate count
(TPC) dan pH. Nilai TPC meningkat dari
hari ke-0 hingga hari ke
–
28. Nilai pH juga mengalami peningkatan selama 28 hari
kultivasi. Perubahan struktur yang terjadi selama 28 hari kultivasi diduga terjadi
melalui jalur asam ftalat yang ditunjukkan dengan adanya spektrum massa asam
ftalat pada waktu retensi 7.607 dengan mutu kemiripan
sebesar 72.
Kata kunci: biodegradasi, fenantrena,
bacillus altitudinis
ABSTRACT
LAELA ROCHDIANA. Structural Changes of Phenanthrene On Biodegradation
by
Bacillus altitudinis
. Supervised by CHARLENA and MUHAMMAD
KHOTIB.
Polycyclic aromatic hydrocarbons (PAHs) are toxic, mutagenic, and
carcinogenic pollutants that are present in environment. Some bacterial species
have ability to metabolize these compounds and use them as energy sources for
their growth.
Bacillus altitudinis
was used to degrade phenanthrene, a three-ring
aromatic PAH. The maximum degradation rate (14%) was obtained when
Bacillus
altitudinis
was cultured for 28 days after the addition of 50 ppm phenanthrene to
the liquid medium. Furthermore, the degradation was affected by addition of
Tween 80 as surfactants. The observation parameters were
total plate count
(TPC)
and pH. The value TPC increased for 28 days cultivation and pH value increased
too from 6 to 8 during the 28 days cultivation. The mechanism of degradation was
determined through identification of metabolites, the possible pathway of
phenanthrene degradation is via phthalic acid. It has been proofed by a mass
spectrum of phthalic acid at retention time of 7.607 with match quality of 72.
PERUBAHAN STRUKTUR FENANTRENA SELAMA PROSES
BIODEGRADASI OLEH BAKTERI
BACILLUS ALTITUDINIS
LAELA ROCHDIANA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Perubahan Struktur Fenantrena Selama Proses Biodegradasi oleh Bakteri Bacillus altitudinis
Nama : Laela Rochdiana Nrp : G44062794
Menyetujui
Pembimbing I Pembimbing II
Dr. Charlena, M.Si Muhammad Khotib, S.Si, M.Si NIP 196712221994032002 NIP 197810182007011002
Mengetahui
Ketua Departemen Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam IPB
Prof. Dr. Ir. Tun Tedja Irawadi, MS
NIP 195012271976032002
PRAKATA
Segala puji bagi Allah SWT berkat limpahan rahmat dan karunia-Nya penulis
dapat menyelesaikan karya ilmiah ini. Penelitian ini dilaksanakan dari bulan
Januari sampai Juli 2011 yang bertempat di Laboratorium Terpadu, kampus
Institut Pertanian Bogor Baranangsiang dan Laboratorium Kromatografi Pusat
Laboratorium Forensik, Jakarta.
Penulis mengucapkan terima kasih kepada Ibu Dr. Charlena, M. Si selaku
pembimbing pertama dan Bapak M.Khotib, S. Si, M. Si selaku pembimbing kedua
yang telah banyak memberikan petunjuk dan dukungan kepada penulis. Penulis
juga mengucapkan kepada Bapak M.Farid, S. Si dan M.Zaki, STP yang telah
memberikan arahan dan masukan dalam menyusun karya ilmiah ini dan kepada
Bapak Jaswanto dari Pusat Laboratorium Forensik yang telah membantu dalam
menggunakan instrumen di Laboratorium Forensik.
Ungkapan terima kasih kepada Ayah, Mama, Kakak (Wachyu Maslecha), dan
seluruh keluarga atas semangat, kasih sayang, dan dukungannya. Ucapan terima
kasih kepada Mba Lita yang telah bersama-sama melakukan penelitian ini.
Penulis juga mengucapkan terima kasih kepada sahabat-sahabat Nadya, Shelin,
Echy, Witi yang telah memberikan bantuan, semangat, motivasi, dan dorongan
dalam menyusun karya ilmiah ini dan kepada seluruh pihak yang tidak dapat
disebutkan satu persatu.
Semoga tulisan ini bermanfaat dan dapat menambah wawasan ilmu
pengetahuan bagi penulis khususnya dan pembaca umumnya.
Bogor, November 2011
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta, 14 Mei 1988 sebagai anak kedua dari dua
bersaudara, putri dari pasangan Tarmudji dan Kiki. Tahun 2006 penulis lulus dari
SMA Negeri 49 Jakarta dan melanjutkan studi di Departemen Kimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam, IPB melalui jalur USMI.
Selama mengikuti perkuliahan, penulis pernah menjadi asisten praktikum
Kimia Anorganik S
–
1 Kimia pada tahun ajaran 2009/2010. Pada tahun 2008
penulis juga pernah mengikuti kegiatan Praktik Lapangan di Pusat Penelitian dan
Pengembangan Teknologi Minyak dan Gas Bumi PPPTMGB
“
LEMIGAS
”
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... vii
DAFTAR TABEL ... vii
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ...
1
TINJAUAN PUSTAKA
Hidrokarbon Aromatik Polisiklik (PAH) ...
1
Fenantrena ...
2
Biodegradasi ...
2
Faktor-Faktor yang Mempengaruhi Biodegradasi ...
3
Surfaktan dan Tween 80 ...
4
BAHAN DAN METODE
Bahan dan Alat ...
4
Pembiakan Isolat ...
4
Uji Toksisitas ...
5
Preparasi Inokulum pada Media Kaya dan Media Minimal ...
5
Aplikasi pada Sampel Fenantrena ...
5
Analisis TPC ...
5
Analisis pH ...
6
Analisis GC-MS ...
6
HASIL DAN PEMBAHASAN
Peremajaan Bakteri ...
6
Uji Toksisitas ...
6
Aplikasi pada Fenantrena ...
8
SIMPULAN DAN SARAN
Simpulan ... 10
Saran ... 10
DAFTAR PUSTAKA ... 10
DAFTAR GAMBAR
Halaman
1 Struktur fenantrena ...
2
2 Reaksi degradasi fenantrena ...
3
3 Struktur Tween 80 ...
4
4 Media kaya dan blanko ...
6
5 Media minimal dengan solar 1%, 3%, dan 5% ...
6
6 Uji toksisitas konsentrasi 1000 dan 500 ppm ...
7
7 Uji toksisitas konsentrasi 0 dan 50 ppm ...
7
8 Nilai absorbansi uji toksisitas media cair ...
7
9 Hasil pengukuran pH ...
8
10 Hasil uji TPC hari ke-0 dan 28 ...
8
11 Kromatogram fenantrena hari ke-0 dan 28 ...
9
12 Kromatogram asam ftalat pada sampe hari ke-28 ...
9
13 Jalur perubahan struktur fenantrena ... 10
DAFTAR TABEL
Halaman
1 Tabel komposisi media kaya dan minimal ...
5
2 Tabel area kromatogram fenantrena ...
8
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 12
2 Komposisi media
marine
agar. ... 13
1
PENDAHULUAN
Hidrokarbon aromatik polisiklik (PAH) merupakan salah satu senyawa pencemar lingkungan yang bersifat toksik, mutagenik, dan karsinogenik (Hadibrata dan Tachibana 2009). Senyawa ini banyak ditemukan sebagai hasil pembakaran bahan bakar selama proses dekomposisi termal. Tumpahan hasil eks-plorasi dan eksploitasi minyak bumi juga merupakan salah satu sumber cemaran PAH di lingkungan (Yirui 2010).
Penyebaran PAH yang luas di lingkungan menyebabkan banyak cara dikembangkan untuk mengurangi jumlahnya di lingkungan. Biodegradasi merupakan salah satu cara yang banyak digunakan karena merupakan metode ramah lingkungan, cukup efektif dan efisien, serta ekonomis (Morgan dan Watkinson 1994). Degradasi hidrokarbon dapat dila-kukan dengan memanfaatkan mikroorganis-me seperti bakteri. Hal ini disebabkan oleh bakteri dilengkapi dengan sistem metabo-lisme yang dapat menggunakan hidrokarbon
sebagai sumber energi dan karbon.
Kemampuan mikroorganisme dalam mende-gradasi hidrokarbon telah dieksploitasi sejak tahun 70-an dan 80-an pada lahan pertanian tempat pembuangan minyak (Bossert dan Kosson, 1997).
United State Environmental Protection Agency (USEPA) telah menetapkan daftar 16 PAH yang menjadi senyawa pencemar utama di lingkungan, salah satunya adalah fenan-trena. Fenantrena diketahui dapat menye-babkan alergi pada manusia. Selain itu fenan-trena juga termasuk ke dalam daftar kla-sifikasi 16 PAH penyebab kanker pada The International Agency for Research on Cancer
(IARC 2002).
Biodegradasi fenantrena dibatasi oleh kemampuannya untuk larut dalam media cair. Penambahan surfaktan dapat digunakan untuk meningkatkan kelarutan fenantrena dalam air. Tween 80 telah diketahui sebagai surfaktan non ionik yang dapat meningkatkan kelarutan dan biodegradasi fenantrena dalam media cair. Penelitian Hadibrata dan Tachibana (2009) menunjukkan pengaruh penambahan surfaktan Tween 80 pada biodegradasi
fe-nantrena oleh fungi Polyporus sp.S133.
Penggunaan Tween 80 dengan konsentrasi
0.05% (b/v) menunjukkan degradasi
fenantrena sebesar 92%. Peningkatan
konsentrasi Tween 80 akan meningkatkan kecepatan biodegradasi fenantrena. Secara umum, bakteri akan mengoksidasi fenantrena dengan enzim dioksigenase dan menghasilkan
cis-dihidrodiol fenantrena. Metabolisme lebih lanjut akan menghasilkan asam 1-hidroksi-2-naftanoat dan asam protokatekuat atau katekol (Cerniglia 1993).
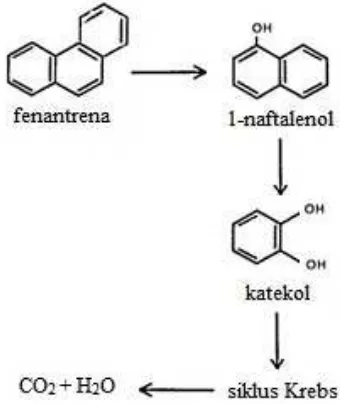
Penelitian Murniasih (2009) menun-jukkan bahwa terjadi penurunan konsentrasi fenantrena menjadi 59.5% selama 29 hari
kultivasi oleh bakteri Pseudomonas sp
KalP3b22. Penentuan senyawa hasil degradasi menunjukkan adanya senyawa 1-naftalenol.
Penelitian kali ini akan dilakukan pada sampel fenantrena yang diolah dengan bio-degradasi dengan bakteri Bacillus altitudinis
dan dianalisis perubahan senyawanya menjadi senyawa yang lebih sederhana menggunakan instrumen kromatografi gas spektroskopi (GC-MS ).
TINJAUAN PUSTAKA
Hidrokarbon Aromatik Polisiklik (PAH)
Hidrokarbon aromatik polisiklik (PAH) merupakan golongan senyawa organik yang tersusun dari gabungan dua atau lebih cincin aromatik. Terdapat lebih dari 100 jenis PAH, baik dalam bentuk gas maupun padatan tidak berwarna, putih, atau kuning kehijauan. Secara umum PAH terdapat sebagai campuran yang kompleks bukan sebagai senyawa tunggal (ATSDR 1990).
PAH seringkali ditemukan secara alami, namun dapat dibuat sebagai senyawa tunggal untuk keperluan penelitian. Sumber alami PAH berasal dari emisi gunung berapi dan ke-bakaran hutan. PAH yang dihasilkan dari sumber buatan jumlahnya lebih besar diban-dingkan sumber alami. PAH yang terdapat di atmosfer dapat berasal dari pembakaran tidak sempurna batu bara, minyak, gas, kayu, sam-pah, atau bahan organik lainnya. Emisi ken-daraan bermotor juga merupakan salah satu sumber utama cemaran PAH di atmosfer. PAH juga dapat ditemukan di tanah dan per-mukaan air. PAH yang mencemari perper-mukaan air dan tanah dapat berasal dari buangan industri atau tumpahan hasil eksplorasi dan eksploitasi minyak bumi (ATSDR 1990).
per-2
mukaan partikel padatan. PAH akan tetap berada di udara hingga turun hujan dan jatuh ke permukaan atau terjadinya pengendapan partikel. Beberapa PAH menguap ke atmosfer dari permukaan air, namun karena sifatnya yang hidrofobik, sebagian besar ditemukan terjerap pada partikel yang mengendap di bawah permukaan air atau tersuspensi pada air. Pada tanah, PAH sebagian besar terikat kuat pada partikel tanah. Beberapa jenis senyawa PAH yang banyak ditemukan pada lingkungan antara lain asenaftena, antrasena, krisena, fluorantena, fluorena, fenantrena, dan pirena (ATSDR 1990).
Banyak PAH yang diketahui sebagai senyawa polutan yang bersifat toksik, karsinogenik, dan mutagenik sehingga berpo-tensi merusak kesehatan manusia. (Dipple 1990). Hal ini dikarenakan sifatnya yang lipofilik. PAH dapat masuk ke dalam semua jaringan tubuh manusia yang mengandung lemak. Senyawa ini cenderung akan teraku-mulasi di ginjal, liver, dan lemak. Pada jum-lahnya yang lebih sedikit, PAH akan tersimpan pada limfa, kelenjar adrenalin, dan ovarium. PAH diubah menjadi zat yang ber-beda dalam jaringan manusia. Beberapa zat akan bersifat lebih berbahaya dan beberapa lainnya kurang berbahaya dibandingkan se-nyawa PAH semula. Beberapa penelitian pada hewan menunjukkan bahwa PAH tidak akan tersimpan dalam tubuh untuk waktu lama. Beberapa PAH yang masuk ke tubuh akan keluar dari tubuh melalu feses dan urin setelah beberapa hari (ATSDR 1990).
Fenantrena
Berdasarkan jumLah cincin aromatiknya, PAH dapat dibagi menjaid dua jenis, yaitu
Low Molecular Weight (LMW) dengan 2-3 cincin aromatik dan High Molecular Weight
(HMW) dengan cincin aromatik lebih dari 4. Secara umum, kecepatan degradasi akan ber-banding lurus dengan jumalah cincin aroma-tiknya. Sehingga LMW PAH seperti nafta-lena, antrasena, dan fenantrena akan lebih mudah didegradasi dan biasanya digunakan sebagai contoh PAH untuk pemahaman
mekanisme degradasi pada HMW-PAH
(Cerniglia dan Sutherland 2010).
Fenantrena merupakan salah satu jenis PAH yang terdiri dari 3 cincin aromatik. Senyawa ini memiliki rumus molekul C14H10
dengan massa molar 178.2 g mol-1. Fenantrena merupakan padatan tidak berwa-rna dengan titik lebur 100oC dan titik didih 340oC. Seperti PAH yang lain, fenantrena memiliki sifat
hidrofobik, dengan kelarutan dalam air sebesar 1.2 mg L-1 (Gambar 1).
Gambar 1 Struktur fenantrena
Fenantrena biasanya digunakan untuk membuat plastik, pestisida, bahan peledak,
dan obat-obatan. Ketika PAH seperti
fenantrena terlepas di lingkungan, tidak selalu terjadi pemaparan ke manusia. Seseorang dapat terpapar PAH dengan bernafas, makan, atau minum bahan yang mengandung PAH. Banyak faktor yang mempengaruhi efek bahaya yang timbul akibat terpapar PAH, diantaranya adalah dosis, waktu, jalur masuk PAH (pernafasan, pencernaan,atau kontak langsung dengan kulit), paparan bahan kimia lainnya, dan beberapa sifat individu seperti umur, jenis kelamin, dan keturunan (ATSDR
1990). The International Agency for
Research on Cancer telah mengklasifikasikan 16 PAH (termasuk fenantrena) yang menjadi polutan utama untuk dijadikan tinjauan ulang oleh USEPA (IARC 2002). Selain itu, beberapa penelitian menunjukkan bahwa fenantrena dapat menyebabkan kanker (Gold man 2001).
Fenantrena secara umum mempunyai bay-region dan k-region. Secara umum, degradasi fenantrena oleh bakteri terjadi pada bay-region (posisi C3 dan C4 atau C5 dan C6).
Namun, pada beberapa bakteri seperti
Streptomyces flavovirens dan sianobakteri laut
seperti Agmenellum quadru-plicatum
memetabolisme fenantrena pada k-region.
Biodegradasi
Biodegradasi secara garis besar dide-finisikan sebagai pemecahan senyawa organik oleh mikroorganisme sehingga membentuk biomassa dan senyawa yang lebih sederhana yang akhirnya menjadi air, karbondioksida atau metana (Walter dan Crawford 1997). Biodegradasi merupakan suatu proses yang penting artinya bagi rehabilitasi lingkungan yang tercemar oleh minyak bumi maupun produk-produknya.
Berdasarkan hasil penelitian-penelitian
sebelumnya yang dirangkum oleh
3
senyawa berbeda-beda. Kecenderungan hidro-karbon alifatik untuk terdegradasi pada umumnya lebih mudah dibandingkan dengan senyawa aromatik. Hidrokarbon alifatik rantai lurus pada umumnya lebih mudah ter-degradasi daripada hidrokarbon rantai ber-cabang. Hidrokarbon jenuh lebih mudah terdegradasi daripada hidrokarbon tidak je-nuh. Hidrokarbon rantai panjang lebih mudah didegradasi daripada hidrokarbon rantai pendek.
Proses terpenting dalam degradasi PAH pada air antara lain fotooksidasi, oksidasi
kimiawi, dan bidegradasi oleh
mikro-organisme air. Hidrolisisis bukan merupakan proses yang penting dalam degradasi PAH. Penelitian Nagata dan Kondo (1977) menun-jukkan bahwa antrasena, fenantrena, dan benz[a]antrasena rentan terhadap fotobio-degradasi.
Menurut Murniasih (2009) bakteri
Pseudomonas sp Kalp3b22 mampu
men-degradasi fenantrena menjadi senyawa
naftalenol. Gambar 2 berikut adalah struktur fenantrena dan 1- naftalenol. Jalur metabolik biodegradasi fenantrena dengan naftalen dengan bakteri tertentu sangat berhubungan satu sama lain, sehingga pembentukan senyawa turunan naftalena, dalam hal ini naftalenol pada metabolisme fenantrena dapat terjadi. Hasil akhir yang diharapkan pada proses biodegradasi adalah senyawa yang lebih sederhana yang akhirnya menjadi karbondioksida dan air. Jalur yang mungkin terjadi pada metabolisme fenantrena dapat dilihat pada Gambar 2.
Gambar 2 Reaksi degradasi fenantrena
Faktor-faktor yang mempengaruhi Biodegradasi
Keberhasilan proses degradasi banyak ditentukan oleh aktivitas enzim. Untuk itu
perlu mikroorganisme yang berpotensi
menghasilkan enzim pendegradasi
hidro-karbon, kemudian aktivitasnya
diopti-misasikan dengan pengaturan kondisi dan penambahan suplemen yang sesuai antara lain oksigen, kandungan air, pH, suhu, nutrient yang tersedia dan ada tidaknya material toksik (Udiharto 1996).
Beberapa faktor tersebut antara lain oksigen, kelembaban, pH, suhu, dan nutrisi.
Keberadaan oksigen merupakan faktor
pembatas laju degradasi hidrokarbon dan juga dibutuhkan untuk pertumbuhan bakteri aerob. Kebutuhan akan oksigen digunakan untuk
mengkatabolisme senyawa hidrokarbon
dengan cara mengoksidasi substrat dengan katalis enzim oksidase.
Kelembaban merupakan salah satu faktor penting dalam bioremediasi. Kelembaban sangat penting untuk hidup, tumbuh dan aktivitas metabolik mikroorganisme. Tanpa air mikroorganisme tidak dapat hidup dalam limbah minyak bumi. Mikroorganisme akan hidup aktif di daerah antara minyak dan air.
Tingkat keasaman (pH) merupakan salah
satu faktor yang mempengaruhi laju
pertumbuhan mikroorganisme (Fletcher
1991). Kemampuan mikroorganisme dalam
membangun sel, transportasi melalui
membran sel dan keseimbangan reaksi katalis (Cookson 1995). Kebanyakan bakteri dapat tumbuh dengan baik pada kisaran pH netral (pH 6,5-7,5). Tingkat keasaman (pH) dapat
berubah selama pertumbuhan
mikro-organisme. Peningkatan pH dapat terjadi jika adanya proses reduksi nitrat membentuk ammonia atau gas nitrogen. Sedangkan penurunan pH terjadi apabila terbentuknya asam-asam organik sebagai hasil proses fermentasi (Tanner 1997).
Suhu akan berpengaruh dalam proses biodegradasi, terutama terhadap sifat fisik dan kimia komponen-komponen minyak bumi, kecepatan degradasi oleh mikroorganisme, dan komposisi komunitas mikroorganisme.
Suhu yang optimal untuk degradasi
hidrokarbon adalah 30-40 oC. Pada suhu rendah viskositas minyak akan meningkat
mengakibatkan volatilitas alkana rantai
4
oleh penurunan aktivitas enzim mikrobial (Leahy and Colwell 1990).
Mikroorganisme membutuhkan nutrisi
sebagai sumber karbon, energi dan
keseimbangan metabolisme sel. Dalam
penanganan limbah minyak bumi biasanya penambahan nutrisi antara lain sumber nitrogen dan fosfor, sehingga proses degradasi oleh mikroorganisme berlangsung lebih cepat dan pertumbuhannya meningkat (Leahy and Colwell 1990; Rosenberg dan Ron 1998).
Surfaktan dan Tween 80
Surfaktan merupakan molekul amfoterik yang mengandung gugus hidrofobik yang nonpolar, biasanya hidrokarbon rantai lurus atau bercabang, atau fluorokarbon yang memiliki 8-18 atom karbon, yang diikat dengan gugus polar atau hidrofilik. Gugus hidrofilik dapat berupa nonionik, ionik, atau zwitter ionik. Rantai hidrokarbon berinteraksi lemah dengan molekul air dalam lingkungan berair, sedangkan kepala polar atau ionik berinteraksi kuat dengan molekul air melalui interaksi dipol atau ion-dipol. Ini merupakan interaksi yang kuat dengan molekul air yang menyebabkan surfaktan larut di dalam air. Tindakan kooperatif dispersi dan ikatan hidrogen antar molekul air cenderung menekan rantai hidrokarbon keluar dari air dan oleh sebab itu rantai ini disebut hidrofobik (Tadros 2005).
Salah satu aplikasi dari surfaktan adalah
sebagai pengemulsi. Emulsi merupakan
dispersi suatu cairan dengan cairan lain yang tidak bercampur. Ada dua macam emulsi, yaitu emulsi minyak dalam air dan emulsi air dalam minyak. Pada emulsi minyak dalam air, surfaktan memecah minyak menjadi droplet-droplet kecil (tetesan) di bagian antarmuka dan mencegahnya untuk kembali bersatu (koalesensi). Stabilitas emulsi merupakan
parameter untuk melihat sejauh mana
kemampuan surfaktan dalam mencegah
koalesensi (Bajpai & Tyagi 2007).
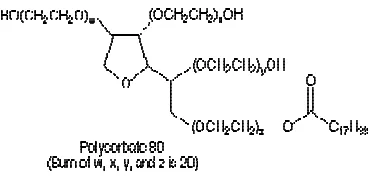
Gambar 3 Struktur Tween 80
Tween 80 atau Polisorbat 80 merupakan salah satu surfaktan nonionik yang berasal dari polietoksilat sorbitan dan asam oleat. Gugus hidrofilik Tween 80 merupakan suatu polieter yang biasa dikenal sebagai golongan polioksietilena yang merupakan suatu polimer eilena oksida (Gambar 3).
Tween 80 merupakan cairan dengan viskositas tinggi berwarna kuning yang lebih mudah larut dalam air. Selain itu Tween 80 juga larut dalam metanol, toluena, minyak jagung, dan etil asetat namun tidak larut dalam minyak.
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan yaitu isolat bakteri Bacillus altitudinis, air laut, marine
agar (Lampiran 2), solar, fenantrena, Tween 80, n-heptana, diklorometana, alkohol, H2SO4
pekat, dan Na2SO4 anhidrat.
Alat-alat yang digunakan yaitu tabung reaksi, labu erlenmeyer, gelas ukur, cawan petri, ose, pipet volumetrik, pipet mohr, pipet mikro, tip, neraca analitik, autoklaf, inku-bator, inkubator goyang, Spektrofotometri 20D+, instrumen Kromatografi Gas Spek-troskopi Massa (GC-MS), dan laminar
Metode
Pembiakan Isolat
Pembiakan isolat bakteri dilakukan pada media miring marine agar (MA) (Lampiran 2). Sebanyak 100 mL MA disiapkan dalam labu erlenmeyer dan dipipet sebanyak 5 mL ke dalam tabung reaksi. Tabung disumbat dengan sumbat kapas dan disterilisasi dengan autoklaf pada suhu 121 oC selama 15 menit. Tabung diletakkan pada papan miring dan dibiarkan hingga agar dingin dan memadat. Bakteri diinokulasikan secara aseptis pada agar miring dan diinkubasi pada suhu 30 oC selama 24 jam. Bakteri yang ditumbuhkan pada agar miring digunakan sebagai stock.
Uji Toksisitas Media Cair
Larutan fenantrena dengan konsentarsi 0, 50, 500, dan 1000 ppm dibuat dengan melarutkan padatan fenantrena ke dalam
larutan surfaktan Tween 80 dengan
5
dan ditambahkan larutan sampel fenantrena. Bakteri diinkubasi selama 3 hari dan dilakukan pengukuran absorbansi.
Uji Toksisitas Media Padat
Media MA disterilisasi dengan autoklaf pada suhu 121 oC selama 15 menit, media dituang ke dalam cawan petri steril dan dibiarkan hingga agar dingin dan memadat. Bakteri diinokulasikan secara aseptis ke dalam cawan petri dengan metode sebar. Bulatan kertas saring yang telah dibasahi dengan larutan fenantrena dengan konsentrasi 0, 50, 500, dan 1000 ppm diletakkan di atas media berisi bakteri. Cawan diinkubasi selama 2×24 jam pada suhu 37 oC. Metode dilakukan juga terhadap blanko. Pembentukan zona bening disekitar kertas saring menunjukkan bakteri tidak tumbuh.
Preparasi Inokulum pada Media Kaya dan Media Minimal
Media kaya (Tabel 1) dibuat dalam labu erlenmeyer 250 mL, diberi sumbat kapas dan disterilisasi dengan autoklaf pada suhu 121 oC selama 15 menit. Bakteri dari stock diinokulasikan dengan ose secara aseptis. Bakteri pada media kaya diinkubasi pada inkubator goyang dengan kecepatan 200 rpm pada suhu kamar selama 3 hari.
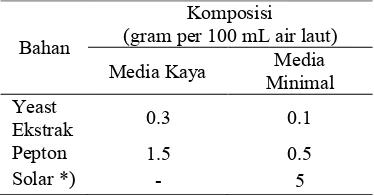
Tabel 1 Komposisi media kaya dan media minimal
Keterangan : *) disterilisasi secara terpisah
Sebanyak 1 mL bakteri dari media kaya dipindahkan ke dalam media minimal yang telah disterilisasi. Solar yang telah disterilisasi secara terpisah dengan UV selama 15 menit ditambahkan ke dalam media minimal. Bakteri pada media minimal diinkubasi pada inkubator goyang dengan kecepatan 200 rpm pada suhu kamar selama 7 hari. Pembiakan pada media minimal dilakukan sebanyak 3 kali. Bakteri yang dibiakkan pada media minimal digunakan untuk apikasi pada sampel.
Penerapan pada Sampel Fenantrena
Larutan fenantrena dengan konsentrasi 50 ppm dibuat dengan melarutkan padatan fenantrena pada larutan surfaktan Tween 80 dengan konsetrasi 0.05% dalam air laut. Sebanyak 100 mL media minimal baru disterilisasi dengan autoklaf pada suhu 121 oC selama 15 menit. Secara aseptis sebanyak 5 mL bakteri hasil aklimatisasi diinokulasikan ke dalam media minimal baru. Sebanyak 10 mL sampel diambil ke dalam media berisi bakteri. Bakteri diinkubasi pada inkubator goyang dengan kecepatan 200 rpm pada suhu kamar selama 28 hari. Penentuan pH, konsentasi PAH, dan perubahan struktur PAH dilakukan pada hari ke-0; 3; 5; 7; 14; 21; dan 28.
Analisis TPC (Hadioetomo 1998)
Larutan garam fisiologis dibuat dengan konsentrasi NaCl 0.85% (b/v) dalam akuades. Larutan garam fisiologis ini dimasukkan masing-masing 9 mL ke dalam tabung ulir menggunakan pipet mikro dengan label 10-1 sampai 10-8. Tabung ulir disterilisasi dengan isinya pada 121 oC selama 15 menit. Selain itu, disterilisasi juga pada suhu dan selang waktu yang sama yaitu marine agar, cawan petri, dan tip untuk mikropipet yang akan digunakan. Setelah sterilisasi selesai, tabung ulir dinginkan.
Sebanyak 1 mL sampel dimasukkan dalam tabung ulir yang berlabel 10-1. Tabung ulir dikocok sehingga benar-benar merata pencampurannya. Sebanyak 1 mL dari tabung ulir yang berlabel 10-1 dipipet lalu dimasukkan dalam tabung ulir yang berlabel 10-2. Tabung ulir dengan label 10-2 dikocok lalu sebanyak 1 mL dimasukkan dalam tabung ulir yang berlabel 10-3. Pemindahan dan pengocokan ini dilakukan pada setiap tabung ulir sampai dengan pengenceran/tabung ulir berlabel 10-8. Dari semua tabung ulir (10-1–10-8), dipindahkan masing-masing 1 mL ke dalam cawan petri terpisah (berlabel 10-1 sampai 10-8) yang sudah disterilisasi. Larutan marine
agar (MA) yang sudah agak dingin dan belum padat dituang ke cawan petri. MA ditunggu hingga padat lalu dimasukkan ke dalam inkubator, lalu diinkubasi selama 1–2 hari. Koloni yang tampak terbentuk pada cawan petri dihitung setelah 1 atau 2 hari tersebut.
Analisis pH
Nilai pH diukur dengan menggunakan indikator pH universal. Kertas indikator dicelupkan ke dalam sampel, lalu dibaca nilai pH-nya.
Bahan
Komposisi (gram per 100 mL air laut)
Media Kaya Media
Minimal Yeast
Ekstrak 0.3 0.1
Pepton 1.5 0.5
6
Analisis Biodegradasi Fenantrena dengan GC-MS
Ekstraksi sampel. Sebanyak 50 mL sampel di masukkan ke dalam corong pisah dan ditambahkan 10 mL diklorometana. Pengocokan dilakukan beberapa menit dalam corong pisah. Cairan dalam corong pisah dibiarkan hingga benar-benar terpisah menjadi dua lapisan. Lapisan organik dikeluarkan dari corong pisah. Hasil ekstraksi ditambahkan
sejumLah Na2SO4 anhidrat untuk
menghilangkan sisa air. Sebanyak 1 µL ekstrak diinjeksikan ke instrumen GC-MS.
HASIL DAN PEMBAHASAN
Peremajaan Bakteri
Isolat bakteri Bacillus altitudinis
dibiakkan pada media kaya selama 3 hari untuk mempercepat pertumbuhan bakteri. Pertumbuhan tersebut dapat ditandai dengan kekeruhan yang terjadi pada media selama 3 hari (Gambar 4). Proses aklimatisasi terjadi selama pembiakan pada media minimal, yaitu proses penyesuaian isolat tehadap lingkungan baru, dalam hal ini lingkungan yang kaya hidrokarbon sehingga isolat dapat diterapkan terhadap sampel fenantrena. Solar yang ditambahkan pada media berfungsi sebagai salah satu sumber hidrokarbon untuk energi selain nutrisi dari media bagi isolat bakteri yang ada.
Gambar 4 Media kaya (kiri) dan blanko (kanan) selama 3 hari
Gambar 5 Media minimal dengan solar 1, 5, dan 10% (kiri ke kanan)
Pengamatan visual selama 21 hari menunjukkan adanya perubahan kekeruhan pada media yang diberi isolat bakteri Bacillus altitudinis (Gambar 5). Kekeruhan yang terjadi disebabkan oleh tumbuhnya mikro-organisme pada media. Terdapat gelembung pada batas antara media dengan solar. Gelembung ini terbentuk karena adanya biosurfaktan yang dihasilkan oleh mikro-organisme. Biosurfaktan sebagai bagian dari surfaktan akan menurunkan tegangan antar-muka suatu fasa yang berbeda derajat polaritasnya yaitu antara media yang bersifat polar dengan solar yang bersifat nonpolar.
Pada awal pemberian solar ke dalam media, bakteri akan mulai meningkatkan
kontaknya dengan solar. Pada saat
meningkatkan kontak, bakteri melakukan
adhesi/adsorpsi yaitu kontak antara
permukaan membran sel yang bersifat hidrofobik kemudian bakteri melakukan pembelahan sel. Ketika permukaan solar menjadi jenuh oleh bakteri maka pertumbuhan bakteri dibatasi oleh ketersediaan permukaan solar (Rosenberg dan Ron 1998). Dengan keterbatasan ini, bakteri akan menggunakan
solar sebagai media tumbuh dengan
sebelumnya mengemulsi campuran larutan tersebut dengan mengeluarkan biosurfaktan. Pemeliharaan isolat selama 21 hari bertujuan untuk menjaga kemampuan isolat agar tetap
menghasilkan enzim oksigenase yang
diperlukan untuk mendegradasi hidrokarbon (Yani & Akbar 2004; Hadi 2004).
Uji Toksisitas
Uji Toksisitas dilakukan untuk menen-tukan konsentrasi fenantrena yang dapat digunakan untuk aplikasi bakteri pada sampel. Toksisitas fenantrena dapat ditandai dengan tidak tumbuhnya bakteri di sekitar kertas saring yang telah dibasahi oleh larutan fenantrena, sehingga akan terbentuk zona bening di sekitar kertas saring. Pada Gambar 6 terlihat terbentuk zona bening di sekitar kertas saring yang telah dibasahi oleh fenantrena 1000 ppm dan 500 ppm.
7
Gambar 6 Uji toksisitas pada fenentrena dengan konsentrasi (a) 1000 dan (b) 500 ppm.
Gambar 7 Uji toksisitas pada fenentrena dengan konsentrasi (a) 0 dan (b) 50 ppm
Uji toksistas juga dilakukan pada media cair. Pertumbuhan bakteri dapat diamati
dengan nilai absorbansi media cair.
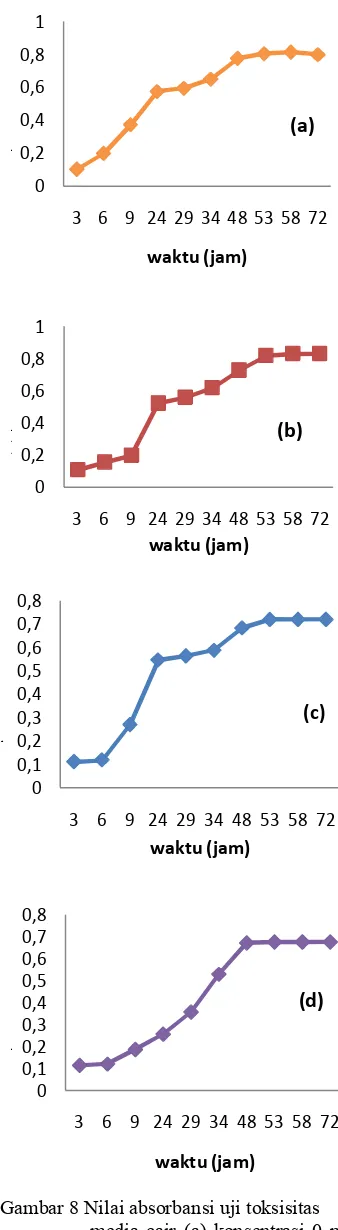
Absorbansi media cair dengan konsentrasi
fenantrena 0-500 ppm pada 24 jam
pengamatan tidak berbeda (Gambar 8). Pola pengamatan absorbansi media cair dengan konsentrasi fenantrena 50-1000 ppm selama 24 jam lebih rendah dibandingkan
dengan konsentrasi fenantrena 0 ppm
(kontrol). Hal ini menunjukkan adanya hambatan pertumbuhan bakteri akibat adanya penambahan fenantrena. Pertumbuhan bakteri pada media dengan konsentrasi fenantrena 50 ppm menunjukkan pola absorbansi yang
mengalami peningkatan paling tinggi
dibanding dengan konsentrasi fenantrena 500 dan 1000 ppm hingga 72 jam.
Berdasarkan hasil uji toksisitas media padat dan cair, konsentrasi fenantrena yang dapat digunakan adalah 50 ppm. Konsentrasi tersebut yang kemudian akan digunakan pada penerapan dengan bakteri.
Penerapan pada Fenantrena
Penerapan pada sampel fenantrena
dilakukan selama 28 hari. Konsentrasi fenantrena yang digunakan didasarkan pada hasil uji toksisitas yaitu 50 ppm. Penambahan Tween 80 bertujuan meningkatkan kelarutan fenantrena yang bersifat hidrofobik sehingga dapat menyediakan permukaan senyawa
hidrokarbon yang lebih luas melalui
pembentukan mikroemulsi dan ketersediaan
biologis untuk keperluan metabolisme mikro-organisme. 0 0,2 0,4 0,6 0,8 1
3 6 9 24 29 34 48 53 58 72
Absorbansi waktu (jam) (a) 0 0,2 0,4 0,6 0,8 1
3 6 9 24 29 34 48 53 58 72
A b sorbansi waktu (jam) (b) 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8
3 6 9 24 29 34 48 53 58 72
Absorbansi waktu (jam) (c) 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8
3 6 9 24 29 34 48 53 58 72
Absorbansi
waktu (jam)
(d)
Gambar 8 Nilai absorbansiuji toksisitas media cair (a) konsentrasi 0 ppm; (b) konsentrasi 50 ppm; (c)
konsentrasi 500 ppm; (d)
8
Adanya peningkatan kontak antara
hidrokarbon dan air akan mempermudah masuknya asupan oksigen dan nutrisi yang dibutuhkan mikroorganisme pada permukaan senyawa hidrokarbon tersebut. Kondisi ini sangat membantu mikroorganisme untuk lebih cepat dapat mendegradasi hidrokarbon.
Penelitian Hadibrata dan Tachibana (2009) pada biodegradasi fenantrena oleh
fungi Polyporus sp.S133 menggunakan
Tween 80 menunjukkan peningkatan
kelarutan fenantrena dalam air dan
biodegradasinya. Konsentrasi Tween 80 sebesar 0.05% (b/v) dapat mendegradasi fenantrena sebesar 92%. Hal ini menunjukkan bahwa surfaktan juga dapat menghambat degradasi hidrokarbon. Kekeruhan media meningkat berdasarkan pengamatan visual selama 28 hari, yang menjadi indikasi bakteri mengalami pertumbuhan.
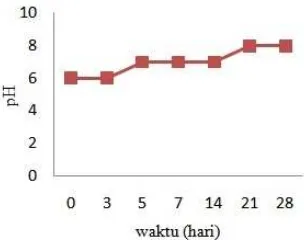
Parameter petumbuhan lainnya seperti pH juga diamati pada hari ke 0; 3; 5; 7; 21; dan 28 dan diperoleh ph media cair antara 6-8 (Gambar 9). Nilai pH dalam penelitian memungkinkan bakteri dapat tumbuh dengan baik sehingga dapat melakukan berbagai aktivitas selulernya.
Gambar 9 Hasil pengukuran pH
Indikator kuantitatif untuk melihat per-tumbuhan bakteri adalah dengan melakukan
analisis Total Plate Count (TPC) yang
menghitung jumlah bakteri yang tumbuh pada media agar pada suhu dan waktu yang ditetapkan (SNI 2008). Perhitungan dapat dilakukan dengan hitung cawan tanpa menggunakan mikroskop. Jumlah koloni berkaitan dengan persentase degradasi. Secara umum semakin besar jumlah koloni mikroba maka semakin tinggi persentase degradasinya.
Gambar 10 Hasil uji TPC hari ke -0 dan 28
Hasil analisis TPC pada media uji menunjukkan bakteri dapat tumbuh dengan baik yang ditandai dengan meningkatnya nilai TPC hari ke-0 (0.32 x 106 CFU/mL) hingga hari ke-28 (1.82 x 106 CFU/mL). Pertumbuhan bakteri yang baik didukung oleh kondisi lingkungan yang baik, nutrisi yang cukup, dan pH yang sesuai. Kondisi ini juga dicapai pada penelitian yaitu dengan pH berkisar 6-8.
Bakteri yang tumbuh baik pada penelitian
ini menunjukkan aktivitas degradasi
fenantrena oleh bakteri dapat berlangsung. Hal ini dapat ditunjukkan dengan penurunan area fenantrena hasil analisis GC-MS pada hari ke-0 dan hari ke-28 (Tabel 2). Persentase penurunan sekitar 14%.
Tabel 2 Area kromatogram fenantrena
Hari ke- Area
0 97674858
28 83642440
Hasil penelitian ini menunjukkan
degradasi fenantrena yang belum maksimal yang ditunjukkan dengan masih adanya fenantrena pada hari ke-28. Kromatogram sampel pada hari ke-0 dan 28 menunjukkan adanya senyawa fenantrena pada waktu retensi 11.20 (Gambar 11). Hal tersebut didukung oleh data yang terdapat padaMSD CHEMSTATION dengan mutu kemiripan sebesar 98. Terdapatnya fenantrena pada hasil akhir pengamatan dapat dikarenakan waktu
kultivasi bakteri yang kurang untuk
pemecahan senyawa fenentrena. Penelitian Hadibrata dan Tachibana 2009 menunjukkan laju biodegradasi fenantrena sebesar 92% mengunakan fungi Polyporus sp.S133 selama 28 hari kultivasi.
0 1 2 0 28 Jum la h se l (1x10
6 C
9
Bakteri yang digunakan pada bio-degradasi ini merupakan isolat tunggal. Nilai TPC yang meningkat menunjukkan bakteri dapat tumbuh pada media yang mengandung fenantrena, namun kemampuannya mende-gradasi senyawa tunggal fenantrena belum menghasilkan hasil akhir yang optimum, hal tersebut terlihat dari masih terdapatnya senyawa fenantrena di akhir kultivasi selama 28 hari.
Penggunaan konsorsium sebagai mikro-organisme pendegradasi juga telah banyak dilaporkan. Janbadhu dan Fulekar 2001 melakukan biodegradasi fenantrena dengan bakerti kosorsium menghasilkan 100% , 59.9%, dan 25.8% bidegradasi fenantrena untuk konsentrasi 100mg/L, 250 mg/L, dan 500mg/L selama 14 hari. Secara umum, biodegradasi dengan isolat tunggal tidak dapat menunjukkan jalur biodegradasi secara tepat, karena di alam, bioremediasi bergantung kepada aktifitas metabolisme dari campuran populasi mikroorganisme.
Salah satu keuntungan menggunakan konsorsium dalam biodegradasi fenantrena adalah kemampuan proses metabolisme yang beragam akan menigkatkan efisiensi proses bioremediasi.
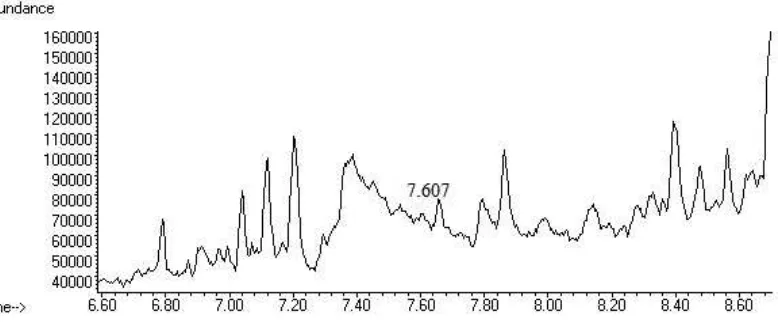
Kromatogram GC-MS menunjukkan
adanya senyawa asam ftalat pada waktu retensi 7.607 (Gambar 12) dan spektrum massa sampel menunujukkan mutu kemiripan sebesar 72 dengan spektrum massa asam ftalat pada MSD CHEMSTATION (Lampiran 3).
Adanya senyawa asam ftalat dapat
memungkinkan jalur metabolisme fenantrena pada biodegradasi kali ini adalah melalui jalur asam ftalat.
Penelitian Murniasih (2009) menun-jukkan perubahan struktur fenantrena menjadi senyawa 1-naftalenol selama 29 hari proses biodegradasi. Secara umum, metabolisme
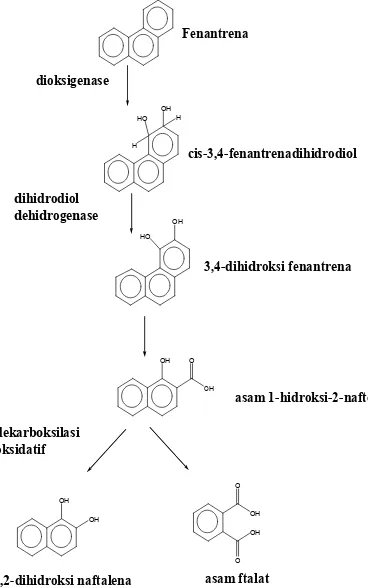
degradasi fenantrena diawali dengan
hidroksilasi pada bay-region oleh enzim
dioksigenase menjadi cis -3,4-fenantrena-dihidrodiol.
Gambar 12 Kromatogram asam ftalat pada sampel hari ke-28
10
Enzim dihidrodiol dehidrogenase akan
merubah cis-3,4-fenantrenadihidrodiol
menjadi 3,4-dihidroksi fenantrena yang
kemudian dimetabolisme kembali menjadi asam 1-hidroksi-2-naftoat. Metabolisme asam 1-hidroksi-2-naftoat dapat melalui dua jalur. Pertama melalui dekarboksilasi oksidatif menjadi 1,2-dihidroksi naftalena dan akan mengalami metabolisme lanjutan sesuai jalur naftalena melalui senyawa asam salisilat dan
katekol. Jalur lain adalah melalui
metabolisme lanjutan melalui jalur asam ftalat (Mallick et al. 2007). Jalur degradasi fenantrena dapat dilihat pada Gambar 13.
OH H HO H OH HO OH O OH OH OH OH OH O O Fenantrena dioksigenase cis-3,4-fenantrenadihidrodiol dihidrodiol dehidrogenase 3,4-dihidroksi fenantrena asam 1-hidroksi-2-naftoat dekarboksilasi oksidatif
1,2-dihidroksi naftalena asam ftalat
Gambar 13 Jalur degradasi fenantrena
SIMPULAN DAN SARAN
Simpulan
Biodegradasi fenantrena dilakukan oleh bakteri Bacillus altitudinis selama 28 hari.
Konsentrasi fenantrena yang digunakan
adalah 50 ppm setelah melalui uji toksisitas media cair dan padat. Tween 80 dengan konsentrasi 0.05 % (b/v) ditambahkan untuk meningkatkan kelarutan fenantrena. Selama 28 hari kultivasi terjadi peningkatan nilai TPC dan pH yang menunjukkan bakteri dapat berkembang dengan cukup baik pada media
sampel. Perubahan struktur yang terjadi diduga melalui jalur asam ftalat. Hal tersebut dikarenakan terdapat spektrum massa asam ftalat pada kromatogram fenantrena hari ke 28 pada waktu retensi 7.607 dengan mutu kemiripansebesar 72.
Saran
Penelitian lebih lanjut dengan konsorsium perlu dilakukan untuk meningkatkan kemam-puan bakteri dalam mendegradasi fenantrena dan dengan waktu kultivasi yang lebih lama
sehingga dapat diperoleh fragmentasi
perubahan struktur yang lebih akurat.
DAFTAR PUSTAKA
Agency for Toxic Substances and Disease Registry (ATSDR). 1990. Public Health Statement, Polycyclic Aromatic Hydrocarbons. Atlanta, GA: U.S.
Department of Health and Human
Services.
.
Bajpai D, Tyagi VK. 2007. Laundry detergents: an Overview. J. Oleo Scie. 7:327-340.
Bartha R, Bossert I. 1984. Treatment and Disposal of Petroleum Refinery Wastes. New York: Macmillan Publishers.
Boopathy R. 2000. Factors limiting
bioremediation technologies (review
paper). Journal of Bioresource
Technology. 74:63-67.
Bossert ID, Kosson DS. 1997. Methods for measuring hidrocarbon biodegradation in
soil. In Mannual of Environmental
Microbiology. ASM Pr. Washington. 738-742.
Cerniglia CE. 1993. Biodegradation of polycyclic aromatic hydrocarbons. Curr. Opin. Biotechnol. 4:331–338.
Cerniglia CE, Sutherland JB. 2010. Handbook of hydrocarbons and lipid microbiology. Germany:Berlin Heidelberg.
Citroreksoko P. 1996. Pengantar
Bioremediasi. Di dalam Prosiding
Pelatihan dan Lokakarya Peranan
Bioremediasi dalam Pengelolaan
Lingkungan; Cibinong, 24-28 Juni.
11
Cookson JT. 1995. Bioremediation
Engineering : Design and Application. Toronto: McGraw-Hill.
Crawford R, Crawford DL. 1996.
Bioremediation Principles and Applications. USA: Cambridge University Pr.
Goldman R. 2001. Smoking increases
carcinogenic polycyclic aromatic
hydrocarbons in human lung tissue.
Cancer Research 61: 6367-6371.
Hadibrata T, Tachibana S. 2010.
Characterization of phenanthrene
degradation bystrainPolyporussp. S133.
Journal of Environmental Science
22:142-149.
Hadioetomo RS. 1998. Mikrobiologi Dasar dalam Praktek. Jakarta: PT Gramedia Pustaka Utama.
Janbandhu A, Fulekar MH. 2011.
Biodegradation of phenanthrene using
microbial consortium from petrochemical
contaminated environment. Journal of
Hazardous Material.187:333-340.
Leahy JH, Colwell R. 1990. Microbial degradation of hydrocarbons in the environment. Microbiological Reviews.54 (3):305-315.
Mallick S, Subhankar Chatterjee, Tapan K Dutta. 2007. Anovel degradationpathway
in the assimilation of phenanthrene by
Staphylococcussp. Microbiology 153.
Morgan P, Watkinson RJ. 1994.
Biodegradation of Component Petroluem. C Railedge, editor. Biochemistry of
Microbial Degradation. Netherlands:
Kluwer Academic Pb.
Murniasih T, Yopi, Budiawan.2009.
Biodegradasi fenantren oleh bakteri laut
Pseudomonas sp KalP3b22 asal Kumai Kalimantan Tegah. Makara Sains. 13: 77-80.
Rosenberg E, Ron EZ. 1998. Bioremediation of Petroleum Contamination. Di dalam RL
Crawford, DL Crawford, editor.
Bioremediation Principles and
Applications. Cambridge: Cambridge
University Pr.
[SNI 2897] Standar Nansional Indonesia. 2008. Metode Pengujian Cemaran Mikrob dalam Daging, Telur, dan Susu serta Hasil Olahannya. Jakarta: Badan Standardisasi Nasional.
Tadros TF. 2005. Applied Surfactant.
Weinheim: Wiley-VCH Verlag GmbH & Co.
Tanner RS. Cultivation of Bacteria and Fungi. Ch 6. dalam C. J. Hurst (ed.). 1997. Manual of environmental Microbiology. ASM Press, Washington DC.
Udiharto M. 1996. Bioremediasi Minyak
Bumi. Prosiding Pelatihan dan Lokakarya Peranan Bioremediasi dalam Pengelolaan
Lingkungan; Cibinong, 24-28 Juni.
Cibinong: LIPI-BPPT-HSF.
Walter MV, Crawford RL. 1997.
Biotransformation and Biodegradation. Di
dalam CJ Hurst, editor. Manual of
Environmental Microbiology. Washington DC: ASM Pr.
Yani M, Akbar Y. 2004. Proses biodegradasi minyak diesel oleh campuran bakteri pendegradasi hidrokarbon. J. Tek. Ind. Pert. 19:40-44.
Yirui W. 2010. Degradation of PAHs by
12
12
Lampiran 1 Diagram alir penelitian
Pembiakan pada media
minimal
Uji toksisitas
Media cair dan padat
Penentuan konsentrasi
fenantrena
Aplikasi isolat pada
fenantrena
Kultivasi 28 hari
Uji pH
hari ke 0; 3; 5; 7; 14; 21
dan 28
Uji TPC
hari ke 0 dan 28
Pembiakan isolat
Pembiakan pada media
kaya
Penentuan
peubahan struktur
13
Lampiran 2 Komposisi
marine
agar
Bahan
Komposisi
(g/1000 mL)
Yeast extract
1
Pepton
5
Ferric citrate
0.1
NaCl
19.45
MgCl
28.8
Na
2SO
43.24
CaCl
21.88
KCl
0.55
Na
2CO
30.16
SrCl
20.034
Asam Borat
0.022
Natrium silikat
0.004
Natrium flourida
0.0024
Amonium nitrat
1.6
14
Lampiran 3 Spektrum massa asam ftalat (a) sampel hari ke 28 (b) data
MSD
CHEMSTATION
(a)