DAYA HAMBAT Bacillus thuringiensis KAHN 15.39
TERHADAP CENDAWAN PATOGEN Curvularia affinis DAN
Colletotrichum gloeosporoides ASAL DAUN KELAPA SAWIT
SYIPA PAOZIAH
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Daya Hambat Bakteri
Bacillus thuringiensis KAHN 15.39 terhadap Cendawan Patogen Curvularia affinis dan Colletotrichum gloeosporoides Asal Daun Kelapa Sawit adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2014
Syipa Paoziah
4
ABSTRAK
SYIPA PAOZIAH. Daya Hambat Bacillus thuringiensis KAHN 15.39 terhadap Cendawan Patogen Curvularia affinis dan Colletotrichum gloeosporoides Asal Daun Kelapa Sawit. Dibimbing oleh NISA RACHMANIA MUBARIK dan SRI LISTIYOWATI.
Bibit yang berkualitas menjadi salah satu faktor yang memengaruhi budidaya kelapa sawit di lapangan. Beberapa cendawan patogen dapat menyebabkan bercak pada daun bibit kelapa sawit sehingga menurunkan kualitas bibit. Penelitian ini bertujuan menguji daya hambat Bacillus thuringiensis KAHN 15.39 terhadap cendawan patogen Curvularia affinis dan Colletotrichum gloeosporoides yang diisolasi dari bibit tanaman kelapa sawit melalui metode
Leaf-pieces assays. Peremajaan bakteri menggunakan medium Nutrient Agar
yang mengandung 1% Carboxy Methyl Celullose dan peremajaan cendawan menggunakan medium Potato Dextrose Agar yang ditambahkan 500 mg/L kloramfenikol. Bacillus thuringiensis KAHN15.39 dapat menghambat Curvularia affinis dengan luas area terinfestasi sebesar 69 mm2 atau efektivitas biokontrolnya sebesar 86%, dan menghambat Colletotrichum gloeosporoides dengan luas area terinfestasi sebesar 152 mm2 atau efektivitas biokontrolnya sebesar 45%. Penghambatan bakteri Bacillus thuringiensis KAHN15.39 terhadap Curvularia affinis dan Colletotrichum gloeosporoides masing-masing bersifat kuratif.
Kata kunci: kelapa sawit, Bacillus thuringiensis KAHN15.39, Curvularia affinis,
ABSTRACT
SYIPA PAOZIAH. Activity of Bacillus thuringiensis KAHN 15.39 as Biological Control of Pathogenic Fungi Curvularia affinis and Colletotrichum gloeosporoides from Leaves Seedling of Oil Palm
Some fungi caused disease on oil palm seedling so that it could be decrease seedling quality. Therefore, the aim of this research was to investigate activity of Bacillus thuringiensis KAHN 15.39 to inhibit pathogenic fungi
Curvularia affinis and Colletotrichum gloeosporoides which were isolated from oil palm seedling. The bacteria ability to inhibit was examined with Leaf-pieces assays method. Bacteria culture medium was Nutrient Agar which was containing 1% Carboxy Methyl Celullose and medium for fungi used Potato Dextrose Agar added with 500 mg/L chloramphenicol. The results showed B. thuringiensis KAHN15.39 could inhibit Curvularia affinis which were the infestation areas 69 mm2 or biocontrol effectiveness 86% either, while to inhibit
Colletotrichum gloeosporoides was the infestation areas 152 mm2 or biocontrol effectiveness by 45%. Inhibition of Bacillus thuringiensis KAHN15.39 against
Curvularia affinis and Colletotrichum gloeosporoides have curative characteristic.
Key words: Oil palm, Bacillus thuringiensis KAHN15.39, Curvularia affinis,
DAYA HAMBAT Bacillus thuringiensis KAHN 15.39
TERHADAP CENDAWAN PATOGEN Curvularia affinis DAN
Colletotrichum gloeosporoides ASAL DAUN KELAPA SAWIT
SYIPA PAOZIAH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PRAKATA
Alhamdulillahirabbil’alamin, puji dan syukur penulis panjatkan kepada Allah Subhanahu wa Ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian yang dilaksanakan sejak bulan Januari 2014 ini berkaitan dengan mikrob sebagai biokontrol dengan judul Daya Hambat Bacillus thuringiensis KAHN 15.39 terhadap Cendawan Patogen Curvularia affinis dan
Colletotrichum gloeosporoides Asal Daun Kelapa Sawit.
Terima kasih penulis ucapkan kepada Dr Nisa Rachmania Mubarik MSi dan Dr Sri Listiyowati MSi selaku pembimbing. Terimakasih penulis ucapkan juga kepada Dr Yohana Caecilia Sulistyaningsih Msi atas saran dan diskusi yang diberikan sebagai dosen penguji skripsi. Penghargaan penulis tujukan kepada Bapak, Ibu, Kakak-kakak (Teh Lilis, Teh Mumun, Teh Pipin, Teh Ifah, Teh Ade, Teh Nunuy, Teh Ikah) serta segenap keluarga besar atas segala do’a, kasih sayang, bantuan moral serta materil sehingga penulis dapat menyeleseikan studi di IPB dengan lancar. Ungkapan terima kasih juga penulis sampaikan kepada Kak Muhammad Asril atas diskusi dan bantuan yang diberikan selama penelitian di laboratorium, sahabat sepenelitian (Suri Annisa), sahabat-sahabat seperjuangan (Ismi, Tya, Ledy, Della, Yuli, Rahma), Bapak Jaka dan Mba Heni sebagai laboran Mikrobiologi, rekan kerja di laboratorium Mikrobiologi yang telah banyak membantu dan memberikan saran dalam proses penelitian, keluarga besar Pondok
Mahasiwa Al Ihya Dramaga yang telah memberikan dukungan dan do’anya serta
teman-teman Biologi47 atas dukungan, semangat dan kebersamaannya selama kuliah di IPB. Terima kasih dan mohon maaf penulis sampaikan kepada pihak-pihak terkait yang telah banyak membantu dalam penelitian dan penyusunan skripsi yang tidak dapat penulis sebutkan satu persatu.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2014
DAFTAR ISI
DAFTAR TABEL xiv
DAFTAR GAMBAR xiv
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
METODE 2
Waktu dan Tempat 2
Bahan 2
Peremajaan Isolat 2
Kemampuan Cendawan Uji Menginfestasi Daun Kelapa Sawit 3
Reisolasi Cendawan 3
Daya Hambat Bakteri terhadap Cendawan dengan 4
Metode Leaf-Pieces Assays 4
Pengamatan Struktur Anatomi Daun Terinfestasi Cendawan 5
HASIL 5
Peremajaan Isolat 5
Kemampuan Cendawan Uji Menginfestasi Daun Kelapa Sawit 7
Reisolasi Cendawan 8
Daya Hambat Bakteri terhadap Cendawan dengan 8
Metode Leaf-pieces assays 8
Pengamatan Struktur Anatomi Daun Terinfestasi Cendawan 11
PEMBAHASAN 12
SIMPULAN DAN SARAN 14
Simpulan 14
Saran 15
DAFTAR PUSTAKA 15
14
DAFTAR TABEL
1 Daya hambat Bacillus thuringiensis KAHN 15.39 terhadap cendawan
Curvularia affinis dan Colletotrichum gloeosporoides melalui metode
uji tantang 7
2 Luas daun terinfestasi cendawan dan efektivitas biokontrol (BE) bakteri
selulolitik terhadap cendawan Curvularia affinis 9 3 Luas daun terinfestasi cendawan dan efektivitas biokontrol (BE) bakteri
selulolitik terhadap cendawan Colletotrichum gloeosporoides 10
DAFTAR GAMBAR
1 Bacillus thuringiensis KAHN15.39 5
2 Cendawan uji Curvularia affinis dan Colletotrichum gloeosporoides. 6 3 Penghambatan Bacillus thuringiensis KAHN 15.39 terhadap cendawan
patogen Curvularia affinis dan Colletotrichum gloeosporoides. 6 4 Penampakan hari kelima daun kelapa sawit yang diinokulasi cendawan. 7 5 Luas area terinfestasi cendawan Curvularia affinis pada berbagai
perlakuan bakteri 9
6 Luas area terinfestasi cendawan Colletotrichum gloeosporoides pada
berbagai perlakuan bakteri 10
7 Struktur anatomi daun kelapa sawit yang terinfestasi Curvularia affinis 11 8 Struktur anatomi daun kelapa sawit yang terinfestasi Colletotrichum
1
PENDAHULUAN
Latar Belakang
Kelapa sawit (Elaeis guineensis Jacq) merupakan tanaman produktif daerah tropis yang cukup berkembang di Indonesia. Bahan mentah maupun produk olahan dari kelapa sawit memiliki nilai ekonomi yang tinggi sebagai penyumbang devisa negara. Berdasarkan data Kementerian Pertanian (2013), luas lahan kelapa sawit di Indonesia diperkirakan 10 juta hektar dan produksi minyak sawit sebanyak 27.7 juta ton dengan rata-rata produktivitas sawit 3.8 ton per hektar per tahun. Sedangkan data Kementerian Perdagangan (2013) melaporkan bahwa ekspor kelapa sawit berada pada kisaran 13 juta ton. Poduksi kelapa sawit yang tinggi tersebut menempatkan Indonesia menjadi salah satu negara penghasil kelapa sawit terbesar di dunia selain Malaysia dan Thailand.
Permintaan kelapa sawit yang cukup besar menyebabkan produksi dan perluasan areal penanaman kelapa sawit semakin meningkat. Luas areal yang meningkat berkaitan erat dengan pengadaan bibit berkualitas dalam jumlah besar untuk produksi kelapa sawit yang optimal. Pembibitan di antaranya merupakan faktor penentu budidaya kelapa sawit. Pembibitan menjadi langkah permulaan untuk menentukan keberhasilan penanaman di lapangan. Beberapa faktor yang memengaruhi pembibitan antara lain curah hujan, tanah, iklim, dan serangan penyakit.
Keberadaan penyakit pada pembibitan kelapa sawit dapat menjadi faktor pembatas pertumbuhan bibit. Penyakit yang sering ditemukan pada bibit kelapa sawit yaitu bercak cokelat. Penyakit ini dapat merugikan pembibitan tanaman kelapa sawit karena bibit menjadi kerdil, memperlama masa tanaman untuk mulai berproduksi, meningkatkan kematian saat penanaman, dan menurunkan nilai jual bibit. Beberapa cendawan patogen penyebab bercak daun pada kelapa sawit yaitu
Helminthosporium sp., Glomerella sp., Botridiplodia sp., Melacoiem elaedis, dan
Curvularia sp.(Ditjenbun 1993). Berdasarkan penelitian Solehudin et al. (2012) mengenai status bercak cokelat di Kabupaten Sanggau, cendawan Curvularia
ditemukan pada bercak di seluruh lokasi pengamatan. Cendawan Curvularia dapat bertahan hidup pada beberapa tumbuhan inang termasuk gulma di kebun kelapa sawit. Pada bibit kelapa sawit cendawan Curvularia sp. menyerang bibit berumur 2 sampai 3 bulan. Cendawan Colletotrichum sp. merupakan cendawan umum yang ditemukan dimana-mana. Penelitian cendawan ini pada tanaman kelapa sawit belum banyak dilaporkan. Pada tanaman cabai cendawan Colletotrichum sp. dapat menurunkan produksi dan kualitas cabai sebesar 45-60% (Wiratama et al. 2013).
2
Penelitian yang telah dilakukan oleh Purnamasari (2013), menunjukkan bahwa Bacillus thuringiensis KAHN 15.39 asal tanah hutan transformasi (perkebunan) sekitar hutan Taman Nasional Bukit Dua Belas Jambi merupakan bakteri selulolitik yang dapat menghambat cendawan patogen Curvularia affinis
dan Colletotrichum gloeosporoides. Penghambatannya dihitung melalui uji tantang dan diperoleh sebesar 57.5% untuk Curvularia affinis dan 60% untuk
Colletotrichum gloeosporoides. Biakan cendawan yang digunakan merupakan isolat yang diisolasi dari tanaman kelapa sawit di Balai Penelitian Bioteknologi Perkebunan Indonesia, Bogor.
Tujuan Penelitian
Penelitian ini bertujuan menguji daya hambat Bacillus thuringiensis
KAHN15.39 terhadap cendawan patogen Curvularia affinis dan Colletotrichum gloeosporoides, yang diisolasi dari daun bibit tanaman kelapa sawit, dengan metode Leaf-pieces assays.
METODE
Waktu dan Tempat
Penelitian dilaksanakan bulan Januari 2014 - Juni 2014 yang bertempat di Laboratorium Mikrobiologi dan Laboratorium Mikologi Departemen Biologi, Fakultas MIPA, Institut Pertanian Bogor. Penyiapan preparat struktur anatomi daun dilakukan di Laboratorium Zoologi LIPI Cibinong, Bogor.
Bahan
Bakteri yang digunakan ialah isolat Bacillus thuringiensis KAHN15.39 yang diisolasi oleh Purnamasari (2013). Cendawan yang digunakan ialah
Curvularia affinis dan Colletotrichum gloeosporoides yang diisolasi oleh Purnamasari (2013) dan Haryanto (2013). Isolat bakteri dan cendawan yang diujikan disimpan di IPB Culture Collection (IPBCC).
Daun kelapa sawit yang digunakan berasal dari bibit kelapa sawit yang tumbuh di sekitar hutan Fakultas Perikanan IPB. Pemilihan daun didasarkan pada kondisi daun yaitu sehat, utuh dan berasal dari bibit berumur 2 sampai 3 bulan yang dicirikan dengan jumlah daun sekitar 3 sampai 4.
Peremajaan Isolat
Biakan bakteri diremajakan pada cawan yang berisi medium Nutrient Agar
(NA) yang mengandung 1% Carboxy Methyl Celullose (CMC) dan biakan cendawan diremajakan pada cawan yang berisi medium Potato Dextrose Agar
3
cendawan dilakukan dengan mengambil koloni cendawan beserta mediumnya dengan ukuran diameter 1 cm, kemudian diletakkan pada medium baru dan diinkubasi selama 3-5 hari.
Isolat bakteri yang telah diremajakan dilakukan uji tantang terhadap cendawan uji menggunakan metode Fokkema (1973). Sebanyak 1 lup isolat bakteri digoreskan sepanjang 2 cm dari tepi cawan petri berisi medium Potato Dextrose Agar (PDA) yang berdiameter 9 cm, kemudian diletakkan cendawan uji dengan jarak 3 cm dari bakteri. Pasangan kultur tersebut diinkubasi selama 7 hari kemudian dihitung zona hambat bakteri terhadap cendawan dibandingkan dengan kontrol.
Persentase penghambatan = (R1 – R2) /R1 x 100%. Keterangan:
R1 = jari-jari cendawan ke arah tepi cawan R2 = jari-jari cendawan ke arah bakteri
Kemampuan Cendawan Uji Menginfestasi Daun Kelapa Sawit
Cendawan yang telah menghasilkan konidium pada cawan petri berisi medium PDA diberi aquades steril sebanyak 10 mL (yang mengandung 50 μL tween 20%) pada permukaannya untuk memanen konidium. Kultur yang digunakan umur 1 minggu untuk Curvularia affinis dan 10 hari untuk
Colletotrichum gloeosporoides. Selanjutnya untuk memisahkan konidium dari miselium dilakukan penyaringan menggunakan kertas saring. Suspensi konidium
Curvularia affinis dan Colletotrichum gloeosporoides masing-masing dihitung menggunakan hemasitometer sehingga diperoleh 106 konidium/ml. Biakan bakteri selulolitik dibiakkan dalam medium Nutrient Broth yang mengandung 1% CMC. Biakan bakteri yang digunakan sebanyak 108 sel/ml. Kultur bakteri yang diujikan terhadap Curvularia affinis berumur 24 jam, dan berumur 36 jam untuk
Colletotrichum gloeosporoides sesuai data daya hambat bakteri terbesar dari penelitian sebelumnya (Purnamasari 2013).
Daun kelapa sawit diambil dari bibit berumur sekitar tiga bulan, didesinfeksi dengan cara dicuci bersih dan diseka menggunakan alkohol 70%. Potongan daun berukuran 3 cm x 4 cm masing-masing diinokulasi dengan 100 μL suspensi konidium cendawan Curvularia affinis (106 konidium/ml) dan
Colletotrichum gloeosporoides masing-masing sebanyak 106 konidium/ml lalu diletakkan di cawan petri steril besar berdiameter 9 cm yang berisi tisu lembap. Setiap cawan petri berisi lima potongan daun yang merupakan lima ulangan untuk setiap perlakuan per cawan dan satu cawan petri berisi kontrol. Pengamatan hasil inokulasi dilakukan pada 5-7 hari masa inkubasi.
Reisolasi Cendawan
4
bentuk konidium dan warna konidium menggunakan preparat yang dibuat dengan metode Riddle (Riddle 1950).
Daya Hambat Bakteri terhadap Cendawan dengan Metode Leaf-Pieces Assays
Uji penghambatan bakteri terhadap cendawan dilakukan menggunakan metode Leaf-piece assays (Hsieh dan Huang 2001). Metode ini menggunakan potongan daun dengan ukuran tertentu yang diberi perlakuan untuk diamati. Daun bibit kelapa sawit yang berumur tiga bulan dipotong ukuran 3 cm x 4 cm. Setiap satu potong untuk satu kali ulangan. Potongan-potongan daun tersebut digunakan untuk dua macam percobaan, masing-masing percobaan terdiri atas lima perlakuan dan satu kontrol negatif. Percobaan kesatu yaitu: 1) daun sebagai kontrol negatif (tanpa perlakuan), 2) daun diinokulasi dengan 100 μl cendawan
Curvularia affinis saja, 3) daun diinokulasi dengan 100μL bakteri B. thuringiensis
KAHN 15.39 dan dua jam kemudian diinokulasi 100 μl konidium Curvularia affinis, 4) daun diinokulasi dengan 100 μL bakteri B. thuringiensis KAHN 15.39 terlebih dahulu dan tiga hari kemudian diinokulasi dengan 100 μl konidium
Curvularia affinis, 5) daun diinokulasi dengan 100 μLCurvularia affinis dan dua jam kemudian diinokulasi 100 μL bakteri B. thuringiensis KAHN 15.39, 6) daun diinokulasi dengan 100 μL cendawan Curvularia affinis terlebih dahulu dan tiga hari kemudian diinokulasi dengan 100 μl bakteri B. thuringiensis KAHN 15.39.
Percobaan kedua dilakukan seperti percobaan kesatu dengan menggunakan cendawan Colletotrichum gloeosporoides. Masing-masing perlakuan sebanyak empat ulangan. Suspensi spora cendawan yang digunakan masing-masing 106 konidium/ml dan bakteri yang digunakan 108 sel/ml. Potongan daun yang telah diberi perlakuan diletakkan dalam cawan petri steril berisi tisu steril yang lembap. Potongan daun tersebut diletakkan di atas alumunium foil yang dibentuk huruf U sebagai alas sehingga tidak bersentuhan dengan tisu untuk mencegah daun terlalu basah. Pengamatan dilakukan selama tujuh hari dengan tiga hari pertama percobaan dilakukan dalam keadaan gelap. Kerusakan daun diamati dengan menghitung luas daun yang terinfestasi cendawan yaitu dengan mengukur panjang dan lebar daun yang rusak, sedangkan daya hambat bakteri diamati dengan menghitung persentase penghambatan menggunakan persamaan:
BE = (dc-dt)/dc x 100%; (Chanchaichaovivat et al. 2007) Keterangan:
BE = efektivitas biokontrol (%)
dc = luas area terinfestasi dari kontrol positif (hanya perlakuan cendawan saja) (mm2)
dt = luas area terinfestasi dari daun yang diberi perlakuan bakteri dan cendawan (mm2)
5
Pengamatan Struktur Anatomi Daun Terinfestasi Cendawan
Pengamatan struktur anatomi daun yang terinfestasi cendawan dilakukan pada daun kontrol negatif, daun yang diinokulasi cendawan terlebih dahulu dan 3 hari kemudian diinokulasi bakteri, serta daun kontrol positif (daun yang diinokulasi cendawan saja). Daun tersebut dipotong secara melintang menggunakan mikrotom beku. Hasil sayatan diberi pewarna safranin dan diamati pada mikroskop dengan perbesaran 400x. Bagian yang diamati ialah jaringan epidermis, berkas pembuluh dan jaringan mesofil.
HASIL
Peremajaan Isolat
Bacillus thuringiensis KAHN 15.39 merupakan bakteri Gram positif yang berbentuk batang (Gambar 1). Bakteri ini dapat menghasilkan enzim selulase ekstraseluler yang dicirikan dengan terbentuknya zona bening di sekitar koloni bakteri yang ditumbuhkan pada medium NA dengan CMC 1%.
Gambar 1 Bacillus thuringiensis KAHN15.39
Curvularia affinis memiliki warna koloni awal abu-abu dan setelah dewasa berwarna hitam, bentuk konidiofor gelap, pada umumnya sederhana, menghasilkan konidium pada ujung atau secara simpodial. Konidium Curvularia affinis berwarna gelap, fusiform, terdiri atas 3-5 sel dengan sel yang ujung lebih kecil dan lebih cerah dibanding sel yang di tengah sehingga bentuknya bengkok (Gambar 2).
6
Gambar 2 Cendawan uji Curvularia affinis dan Colletotrichum gloeosporoides. (a) Warna koloni dan (b) bentuk konidium Curvularia affinis, (c) warna koloni dan (d) bentuk konidium Colletotrichum gloeosporoides
Uji tantang B. thuringiensis KAHN 15.39 terhadap cendawan patogen
Curvularia affinis dan Colletotrichum gloeosporoides dilakukan selama 7 hari masa inkubasi (Gambar 3). Kontrol dengan perlakuan hanya menggunakan kedua cendawan patogen tumbuh memenuhi seluruh permukaan agar-agar (Gambar 3c dan 3d).
Gambar 3 Penghambatan Bacillus thuringiensis KAHN 15.39 terhadap cendawan patogen Curvularia affinis dan Colletotrichum gloeosporoides. (a) B. thuringiensis KAHN 15.39 + Curvularia affinis, (b) B. thuringiensis KAHN 15.39 + Colletotrichum gloeosporoides, (c) kontrol Curvularia affinis, dan (d) kontrol
7
Hasil uji tantang B. thuringiensis KAHN 15.39 terhadap cendawan uji menunjukkan daya hambat sebesar 27.48% untuk Curvularia affinis dan 34.21% untuk Colletotrichum gloeosporoides (Tabel 1). Berdasarkan penelitian yang dilakukan Purnamasari (2013), diperoleh nilai penghambatan sebesar 57.5% untuk
Curvularia affinis dan 60% untuk Colletotrichum gloeosporoides.
Tabel 1 Daya hambat Bacillus thuringiensis KAHN 15.39 terhadap cendawan
Curvularia affinis dan Colletotrichum gloeosporoides melalui metode uji tantang
Kemampuan Cendawan Uji Menginfestasi Daun Kelapa Sawit
Daun yang diinokulasi dengan cendawan menunjukkan gejala kerusakan pada hari kelima. Daun yang diinokulasi Curvularia affinis menunjukkan gejala pada hari kedua dengan terbentuk area terinfestasi cendawan berwarna cokelat di pinggiran daun, melebar pada hari ketiga dan keempat, dan berubah menjadi gelap cenderung hitam pada hari kelima (Gambar 4a).
Daun yang diinokulasi Colletotrichum gloeosporoides menunjukkan gejala pada hari ketiga dengan terbentuk area terinfestasi cendawan berwarna cokelat di pinggirann daun, melebar pada hari keempat dan pada hari kelima berwarna cokelat sedikit berbayang kuning (Gambar 4b). Daun kontrol yang tanpa inokulasi cendawan hanya diberikan aquades steril pada hari kelima tidak menunjukkan adanya perubahan warna (Gambar 4c).
8
Reisolasi Cendawan
Daun yang menunjukkan gejala berupa terbentuknya area terinfestasi cendawan pada uji infestasi cendawan digunakan untuk reisolasi cendawan. Daun yang menunjukkan gejala dari masing-maisng cendawan dipotong berukuran 1 cm untuk diletakkan di atas permukaan medium PDA dan diinkubasi selama 7 hari. Hasil reisolasi menunjukkan morfologi konidium dan konidiofor yang sama dengan inokulan awal yaitu cendawan Curvularia affinis dan Colletotrichum gloeosporoides (Gambar 2).
Pengamatan hasil reisolasi secara makroskopis dan mikroskopis dilakukan pada hari ketujuh. Cendawan Curvularia affinis memiliki warna koloni hitam dengan konidium fusiform, terdiri atas 3-5 sel, dan sel yang ujung lebih kecil serta lebih cerah dibanding sel yang di tengah sehingga bentuknya bengkok (Gambar 2b). Cendawan Colletotrichum gloeosporoides memiliki warna koloni putih dengan konidium hialin, 1 sel, berbentuk ovoid (berbentuk telur dengan satu ujungnya menyempit) atau oblong (Gambar 2d).
Daya Hambat Bakteri terhadap Cendawan dengan Metode Leaf-pieces assays
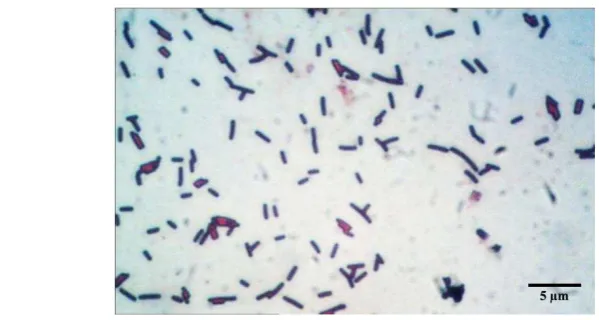
Luas daun terinfestasi cendawan pada hari ketujuh dengan perlakuan inokulasi bakteri terlebih dahulu dan tiga hari kemudian diinokulasi Curvularia affinis diperoleh sebesar 772 mm2. Nilai tersebut lebih besar dibandingkan dengan perlakuan sebaliknya yaitu 69 mm2. Luas daun terinfestasi paling rendah didapatkan pada perlakuan inokulasi cendawan terlebih dahulu dan tiga hari kemudian diinokulasi bakteri dengan nilai sebesar 69 mm2 (Tabel 1).
9
Tabel 2 Luas daun terinfestasi cendawan dan efektivitas biokontrol (BE) bakteri selulolitik terhadap cendawan Curvularia affinis
Keterangan: nilai BE (-) = luas area terinfestasi perlakuan cendawan saja lebih rendah dari perlakuan cendawan dan bakteri
nilai BE (+) = luas area terinfestasi perlakuan cedawan saja lebih tinggi dari
perlakuan cendawan dan bakteri
Luas daun terinfestasi cendawan pada hari ketujuh dengan perlakuan inokulasi bakteri terlebih dahulu dan tiga hari kemudian diinokulasi
Colletotrichum gloeosporoides diperoleh sebesar 163 mm2. Perlakuan sebaliknya dengan luas daun terinfestasi cendawan sebesar 152 mm2 merupakan luas daun terinfestasi paling rendah jika dibandingkan dengan perlakuan lainnya. Nilai BE paling tinggi sebesar 45% diperoleh pada perlakuan cendawan terlebih dahulu dan tiga hari kemudian diinokulasi Colletotrichum gloeosporoides (152 mm2). Nilai
-100
Gambar 5 Luas area terinfestasi cendawan Curvularia affinis pada berbagai perlakuan bakteri
kontrol positif (C. affinis)
10
BE perlakuan tersebut pda hari keempat sampai hari ketujuh mengalami penurunan, dengan nilai BE adalah sama pada hari keenam dan ketujuh. Sebaliknya pada pemberian bakteri terlebih dahulu dan tiga hari kemudian diinokulasi Colletotrichum gloeosporoides menghasilkan nilai BE yang lebih rendah yaitu 41%. Nilai BE perlakuan pemberian bakteri lebih awal dengan jeda waktu dua jam terhadap inokulasi cendawan (31%) lebih tinggi dari perlakuan sebaliknya (-121%).
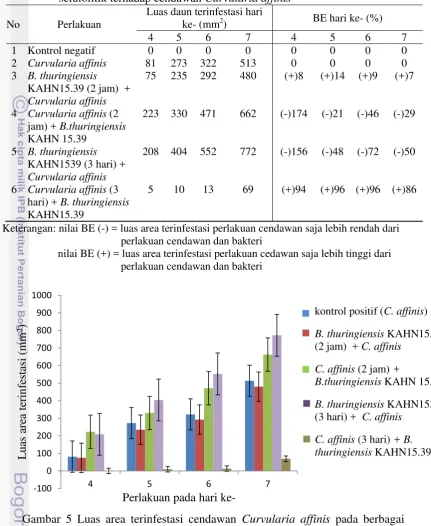
Tabel 3 Luas daun terinfestasi cendawan dan efektivitas biokontrol (BE) bakteri selulolitik terhadap cendawan Colletotrichum gloeosporoides
No Perlakuan
KKeterangan: nilai BE (-) = luas area terinfestasi perlakuan cendawan saja lebih rendah
dibandingkan perlakuan cendawan dan bakteri
nilai BE (+) = luas area terinfesatsi perlakuan cendawan saja lebih tinggi dibandingkan perlakuan cendawan dan bakteri
kontrol positif (C. gloeosporoides)
B. thuringiensis KAHN15.39 (2
11
Pengamatan Struktur Anatomi Daun Terinfestasi Cendawan
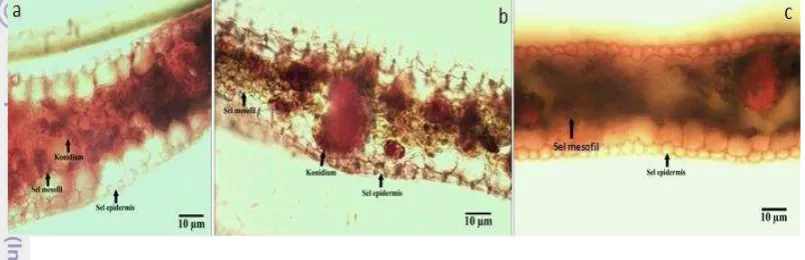
Hasil pengamatan struktur anatomi pada perlakuan inokulasi cendawan
Curvularia affinis mengalami kerusakan di bagian epidermis dan jaringan mesofil berwarna cokelat. Perlakuan bakteri dengan cendawan mengalami tingkat kerusakan pada bagian mesofil dengan konidium cendawan terinfestasi pada bagian tersebut. Struktur anatomi daun yang digunakan sebagai kontrol tidak mengalami kerusakan (Gambar 4).
Gambar 7 Struktur anatomi daun kelapa sawit yang terinfestasi Curvularia affinis. (a) Daun dengan perlakuan Curvularia affinis, (b) daun dengan perlakuan Curvularia affinis dan tiga hari kemudian B. thuringiensis
KAHN 15.39, dan (c) daun tanpa perlakuan (kontrol negatif)
Pengamatan struktur anatomi daun pada perlakuan diinokulasi cendawan
Colletotrichum gloeosporoides mengalami kerusakan di bagian epidermis dan jaringan mesofil berwarna cokelat. Perlakuan cendawan Colletotrichum gloeosporoides saja mengalami kerusakan di bagian epidermis dan terlihat jaringan mesofil berwarna cokelat. Pada perlakuan cendawan terlebih dahulu dan tiga hari kemudian diinokulasi bakteri mengalami kerusakan pada bagian mesofil. Struktur anatomi daun yang digunakan sebagai kontrol tidak mengalami kerusakan (Gambar 5).
12
PEMBAHASAN
Daun kelapa sawit yang berumur 3 sampai 4 bulan dapat diinfeksi oleh cendawan Curvularia affinis dan Colletotrichum gloeosporoides. Menurut Lubis (2008), terdapat sejumlah patogen penyebab bercak cokelat pada pembibitan kelapa sawit yaitu Botryodiplodia sp., Glomerella sp., Melanconium sp.,
Curvularia sp., Cochliobolus sp.. Semangun (2000) menyatakan bahwa jenis-jenis patogen penyebab bercak cokelat di Indonesia belum banyak dilaporkan sehingga dalam penelitian ini tidak dicantumkan pustaka mengenai cendawan
Colletotrichum gloeosporoides yang menyerang bibit kelapa sawit. Penelitian yang telah dilakukan pada cendawan Colletotrichum gloeosporoides melaporkan bahwa cendawan tersebut dapat menyebabkan penyakit antraknosa pada pepaya (Hamdayanty et al. 2012)
Nilai BE pada perlakuan cendawan terlebih dahulu, baik Curvularia affinis
maupun Colletotrichum gloeosporoidedes dengan jeda waktu 2 jam diinokulasi bakteri menunjukkan hasil yang negatif. Hal ini menunjukkan luas area terinfestasi yang mendapat perlakuan bakteri lebih besar daripada perlakuan cendawan saja (Gambar 7 dan 8). Bakteri pada perlakuan ini tidak memiliki daya hambat terhadap pertumbuhan cendawan yang menyebabkan kerusakan pada jaringan daun. Hal ini kemungkinan cendawan mampu menghasilkan suatu senyawa untuk menginfestasi jaringan dalam waktu dua jam. Senyawa tersebut kemungkinan mampu menghambat pertumbuhan bakteri pada saat diinokulasikan, sehingga pertumbuhan bakteri tidak maksimum.
Perlakuan yang sebaliknya yaitu inokulasi bakteri terlebih dahulu dengan jeda waktu dua jam diinokulasi cendawan menghasilkan nilai BE positif. Nilai BE positif menunjukkan luas area terinfestasi cendawan yang mendapat perlakuan bakteri lebih kecil daripada luas area terinfestasi cendawan tanpa mendapat perlakuan bakteri. Hal tersebut kemungkinan dalam waktu dua jam bakteri telah menginfestasi dan menghasilkan senyawa antagonis pada waktu terjadi interaksi dengan cendawan. Pada perlakuan ini interaksi antagonis yang terjadi antara bakteri dan cendawan berupa kompetisi ruang (Baker dan Cook 1982). Bacillus thuringiensis KAHN 15.39 yang digunakan dalam penelitian ini berumur 24 jam untuk Curvularia affinis dan 36 jam untuk Colletotrichum gloeosporoides. Bakteri tersebut telah memasuki fase stasioner berdasarkan hasil penelitian Purnamasari (2013).
Nilai BE menunjukkan negatif jika bakteri diinokulasi terlebih dahulu dengan jeda waktu 3 hari terhadap inokulasi cendawan Curvularia affinis, namun nilai BE positif terhadap inokulasi cendawan Colletotrichum gloeosporoides.
13
Perlakuan inokulasi cendawan terlebih dahulu, baik Curvularia affinis
maupun Colletotrichum gloeosporoides dan 3 hari kemudian diinokulasi bakteri menunjukkan hasil BE positif. Nilai tersebut menunjukkan luas area terinfestasi cendawan pada perlakuan dengan bakteri lebih kecil daripada perelakuan cendawan saja (Gambar 7 dan 8). Hal ini mungkin disebabkan bakteri mampu tumbuh dengan baik menggunakan nutrisi hasil degradasi jaringan daun oleh cendawan. Bakteri menghasilkan senyawa tertentu pada saat terjadi interaksi dengan cendawan seperti yang dilaporkan Hwang et al. (2001).
Perlakuan dengan nilai BE paling tinggi dan area terinfestasi cendawan paling rendah pada penghambatan Curvularia affinis dan Colletotrichum gloeosporoides didapatkan pada perlakuan dengan inokulasi cendawan terlebih dahulu kemudian inokulasi bakteri setelah tiga hari. Hal ini mengindikasikan bahwa bakteri Bacillus thuringiensis KAHN15.39 bersifat kuratif (penanggulangan dilakukan setelah terinfeksi penyakit) dalam penerapan di daun.
Kerusakan yang terjadi pada struktur anatomi baik pada perlakuan
Curvularia affinis maupun Colletotrichum gloeosporoides (perlakuan cendawan saja) menunjukkan kerusakan pada bagian mesofil. Cendawan dapat merusak sel atau jaringan dari tumbuhan dan menyebabkan penurunan fungsi fisiologis sel atau jaringan. Jenis sel dan jaringan yang terinfeksi akan menentukan fungsi fisiologis yang dipengaruhinya. Infeksi pada daun akan mengganggu fotosintesis (Agrios 1996) seperti yang dilaporkan oleh Dimaro et al. (2009) yang melakukan penelitian mengenai histopatologi pada daun Raphia hookeri yang diserang
Glomerella cingulata. Jaringan yang terinfeksi menunjukkan perubahan warna menjadi gelap dan gangguan transfusi pada jaringan. Setelah terjadi penetrasi pada epidermis daun, patogen akan menyerang hipodermis dan menginfeksi jaringan mesofil atau palisade. Cendawan dapat menyebabkan penyakit pada tumbuhan melalui mekanisme seperti melemahkan inang dengan menyerap makanan terus-menerus, menghasilkan atau mengganggu metabolisme sel inang dengan toksin, enzim dan zat pengatur tumbuh yang disekresikannya, menghambat transportasi makanan, hara mineral dan air melalui jaringan pengangkut, serta mengkonsumsi kandungan sel inang setelah terjadi kontak (Agrios 1996)
Bakteri selulolitik sebagai biokontrol alami diharapkan mampu menghambat pertumbuhan cendawan yang diduga patogen seperti yang telah dilaporkan Kucuk dan Kivanc (2004), bahwa aktivitas β-1,3 glukanase yang dihasilkan oleh Bacillus
sp. dapat mendegradasi dinding sel cendawan Trichoderma harzianum. Senyawa bioaktif yang dihasilkan oleh B. subtilis diketahui juga memiliki aktivitas terhadap cendawan Rhizoctonia solani (Kondoh et al. 2001). Menurut Kim et al. (2004),
B. thuringiensis dapat menghasilkan lipopeptida dari kelompok fengycin yang memiliki aktivitas antagonisme terhadap fitopatogen. Terdapat tiga kelompok lipopeptida yang dihasilkan Bacillus sp. dalam peranannya sebagai agens biokontrol yaitu surfactin, iturins, dan fengycins (Ongena dan Jacques 2007).
14
Penelitian terhadap cendawan patogen Curvularia yang selama ini dilakukan di antaranya terhadap padi untuk menguji ketahahanannya (Taufik et al. 2012) dan jagung untuk pengujian efektivitas antifungi (Ankinbode 2010).
Selama ini penelitian serangan bercak Colletotrichum lebih banyak dilakukan pada cabai (Herwidyarti et al. 2013; Wiratama 2013), gulma dan pepaya (Hamdayanty et al. 2012). Tingkat area terinfeksi dipengaruhi oleh masa inkubasi cendawan pada inang. Menurut Herwidyarti et al. (2013), masa inkubasi
Colletotrichum cukup lama (3-27 hari) jika dibandingkan Curvularia. Hal tersebut sejalan dengan hasil penelitian ini yaitu luas area terinfestasi cendawan
Colletotrichum gloeosporoides (279 mm2) lebih kecil dibandingkan Curvularia affinis (513 mm2) (Tabel 1 dan 2). Daun setelah diinokulasi cendawan disimpan dalam ruang tertutup dengan kondisi lembap selama 48 jam. Menurut Sugiprihatini (2013), kelembapan selama 48 jam secara terus menerus sangat rentan bagi tanaman untuk terserang penyakit.
Metode Leaf-pieces assays sering digunakan dalam meneliti ketahanan inang terhadap cendawan dan efektivitas fungisida (Zadoks dan Schein 1979). Beberapa penelitian yang menggunakan metode tersebut, bagian daun yang dipotong ditutup agar atau medium untuk mencegah bakteri atau cendawan masuk dari bagian tersebut (Boydom et al. 2013; Jackson et al. 2008), sehingga tingkat keparahannya dapat dibandingkan dengan penelitian menggunakan tanaman utuh. Kelebihan metode tersebut ialah reproduksibilitas lebih tinggi karena ukuran dan umur daun sama, meningkatkan perbanyakan, lebih konsisten, kondisi inkubasi seragam, peletakan inokulasi pada bagian yang spesifik di daun, kuantifikasi penyakit lebih akurat dan mudah dilakukan (Parke et al. 2005). Kelemahan dari metode Leaf-pieces assays ialah tidak dapat menjelaskan respon inang terhadap patogen. Selain itu, pada penelitian ini gejala yang muncul pada daun tidak sesuai dengan gejala bercak daun dan lebih mengarah pada gejala akibat saprofit bukan parasit, sehingga kemungkinan metode Leaf-pieces assays tidak cocok digunakan untuk semua jenis tanaman.
SIMPULAN DAN SARAN
Simpulan
Isolat Bacillus thuringiensis KAHN15.39 dapat menghambat cendawan
15
Saran
Penggunaan metode Leaf-pieces assays sebaiknya disertai dengan penelitian in planta untuk melihat respon inang terhadap patogen maupun agens biokontrol.
DAFTAR PUSTAKA
Agrios GN. 1996. Ilmu Penyakit Tumbuhan. Busnia M, penerjemah. Yogyakarta (ID): Gadjah Mada Pr. Terjemahan dari: Plant Pathology.
Akinbode, OA. 2010. Evaluation of antifungal efficacy of some plant extracts on
Curvularia lunata the causal organism of maize leaf spot. J Environ Sci Technol. 4(11):797-800.
Baker KF, Cook RJ. 1982. Biological Control of Plant Pathogen. San Francisco (US): American Phytopathological Society.
Boydom A, Dawit W, Getaneh W. 2013. Evaluation of detached leaf assay for assessing leaf rust (Puccinia triticana Eriks) resistance in wheat. J Plant Pathol Microb. 4(5):1-4
Chanchaichaovivat A, Ruenwongsa P, Panjipan B. 2007. Screening and identification of yeast strains from fruits snd vegetables: potenstial for biological control of postharvest chilli anthracnose (Colletotrichum capsici).
J Biol Control. 42:326-325.
[Ditjenbun] Direktorat Jendral Perkebunan (ID). 1993. Vademecum Budidaya Kelapa Sawit (Elaeis guineensis). Serpong (ID): PT Perkebunan XI.
Hamdayanty, Yunita R, Amin NN, Damayanti TI. 2012. Pemanfaatan kitosan untuk mengendalikan antraknosa pada pepaya (Colletotrichum gloeosporoides) dan meningkatkan daya simpan buah. J Fitopatol Indones.
8(4):97-102.
Haryanto A. 2013. Isolation of chitinolytic bacteria used as biological control of suspected pathogen fungi on oil palm seedlings [skripsi]. Bogor (ID): IPB Univ Pr.
Herwidyarti KH, Ratih S, Sembodo DRJ. 2013. Keparahan penyakit antraknosa pada cabai (Capsicum annum L) dan berbagai jenis gulma. J Agrotek Trop. 1(1):102-106.
Hsieh TF, Huang JW. 2001. Leaf-disk method assessment of disease severity of lily leaf blight caused by Botrytis elliptica. Plant Pathol Bul. 10:37-44. Hwang BK, Lee JY, Kim BS, Lim SW, Moon SS. 2001. Isolation and in vivo and
in vitro antifungal activity of phenylacetic acid and sodium phenylacetate from Streptomyces humidus. J Appl Environ Microbiol. 67(1):3739-3745. Jackson EW, Obert DE, Chong J, Avant JB, Bonman JM. 2008. Detached-leaf
method for propagating Puccinia coronata and assesing crown resistence in oat. J Plant Dis. 92(10):1400-1406.
[Kementan] Kementerian Pertanian (ID). 2013. Statistik Pertanian 2013. Jakarta (ID): Kementerian Pertanian.
16
Kondoh M, Hirai M, Shoda M. 2001. Integrated biological and chemical control of damping-off caused by Rhizoctonia solani using Bacillus subtilis RB14-C and flutolanil. J Biosci Bioeng. 1(2):173-177.
Kucuk C, Kivanc M. 2004. In vitro antifungal activity of strain of Trichoderma harzianum. J Biol. 25(1):111-115.
Lubis AU. 2008. Kelapa sawit (Elaeis guinensis Jacq) di Indonesia. Pematang Siantar (ID): Puslitbun Marihat.
Ongena M, Jacques P. 2007. Bacillus lipopeptides: versatile weapons for plant disease biocontrol. J Trend Microbiol. 16(3):115-125.
Parke JL, Roth M, Choquette C. 2005. Detached Leaf Assays with Phytophthora ramorum: Are They Valid? Sudden Oak Death Science Symposium II;18-21 January 2005; Monterey, California. Monterey (CA): Oregon State Univ Pr. Purnamasari D. 2013. Isolasi bakteri selulolitik penghambat pertumbuhan
cendawan pada kelapa sawit dari tanah hutan di Jambi [skripsi]. Bogor (ID): IPB Univ Pr.
Riddle RW. 1950. Permanent stained mycological preparation obtained by slide culture. Mycologia. 42: 265-270.
Semangun H. 2000. Penyakit-penyakit Bibit Perkebunan di Indonesia. Yogyakarta(ID): UGM Univ Pr.
Sinaga MS. 2003. Dasar-dasar Penyakit Tumbuhan. Depok (ID): Penebar Swadaya.
Solehudin D, Suswanto I, Supriyanto. 2012. Status penyakit bercak coklat pada pembibitan kelapa sawit di Kabupaten Sanggau. J Perkeb Lahan Trop. 2(1): 1-4.
Sugiprihatini D, Wiyono S, Widodo. 2011. Selection of yeasts antagonists as biocontrol agent of mango fruit rot caused by Botryodiplodia theobromae. J Microbiol Indones. 5(4): 155.
Taufik M, Asniah, Syair. 2012. Ketahanan lapangan padi gogo terhadap infeksi
Curvularia oryzae. J Fitopatol Indones. 8(2): 50-53.
Wiratama ID, Sudiarta IP, Sukewijaya IM, Sumiartha K, Utama MP. 2013. Kajian ketahanan beberapa galur dan varietas cabai terhadap serangan antraknosa di Desa Abang Songan Kecamatan Kintamani Kabupaten Bangli. J Agroekotek Trop. 2(2):71-81.
17
RIWAYAT HIDUP
Penulis dilahirkan di Kuningan pada tanggal 11 Maret 1991 dari ayah Mohammad Jahuri dan Almh. ibu Siti Khodijah. Penulis merupakan anak kedelapan dari delapan bersaudara. Tahun 2010 penulis lulus dari MAN Insan Cendekia Gorontalo. Pada tahun yang sama, penulis lulus seleksi masuk IPB melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam. Penulis mendapatkan beasiswa dari BCA Finance tahun 2011-2013 dan beasiswa dari Women International Club (WIC) tahun 2013-2014.
Penulis aktif mengikuti beberapa organisasi dalam masa studi seperti Himpunan Mahasiswa Biologi (HIMABIO) periode 2011-2012 dan 2012-2013 pada divisi Bioworld, Ikatan Alumni Insan Cendekia Gorontalo (IAICG) periode 2011-sekarang dan Ikatan Santri Mahasiswa Al Ihya (ISMA) periode 2012-2014. Penulis juga aktif mengikuti kegiatan seperti menjadi peserta kompetisi olimpiade biologi pada OSN Pertamina (2011-2012) dan peserta pelatihan Leadership and Enterpreunership School (LES) IPB (2011). Penulis juga aktif mengikuti lomba Karya Tulis Ilmiah seperti pada The 2nd Airlangga Ideas Competition (AIC), Bisnis Challenge UI Green Festival, Karya Tulis Ilmiah Al Quran (LKTIA) IPB dan Pekan Kreativitas Mahasiswa Penelitian (PKMP) yang didanai oleh DIKTI. Penulis juga mengikuti beberapa kegiatan kepanitiaan seperti pada Lomba Karate se Jawa-Bali (2010), Explo Science (2012), Fun with Bioworld (2012), Biology on Science and Application (2012/2013).