Mumpuni Uji Kawedar Anjung
ABSTRACT
CONTAMINATION IDENTIFICATION AND ISOLATION
BACTERIOPHAGE OFSALMONELLA spAS BIOCONTROL IN POST-HARVEST VANNAMEI SHRIMP(LITOPENNAUS VANNAMEI)
By
MUMPUNI UJI KAWEDAR ANJUNG
Indonesia's shrimp production has increased every year, but the export to overseas encountered resistance and rejection, which are caused by bacterial contamination of Salmonella sp.Salmonella contamination causes a decrease in the quality and shrimp is not safe to eat. Decrease in Salmonellacontamination during cultivation and processing with the use of antibiotics banned for causing a negative effect on consumers. One alternative natural ingredients that are safe to use to reduce
Salmonellacontamination is the use of bacteriophages. This study was conducted to identify theSalmonellacontamination to the decline of the organoleptic quality of vannamei shrimp, isolate Salmonellabacteria and Salmonella’s bacteriophages in vannamei shrimp.
The study was conducted by taking a sample of vannamei shrimp from the District of Wonosobo, Kotaagung, Padang Cermin and Eastern Rawajitu respectively of 3 replications to test the organoleptic quality and identification of
Salmonella bacteria contamination. Salmonella isolates produced subsequently used as a host cell for the isolation of bacteriophage virulent to Salmonella by following the method used by Sartika (2012).
Mumpuni Uji Kawedar Anjung
Kotaagung and District Padang Cermin a 33.3% positive samples contaminated withSalmonella while Rawajitu Eastern District of shrimp, no contaminated with
Salmonella. The result of the isolation of Salmonella isolates obtained 2 as a candidate host for insulation bacteriophages. Obtained 42 isolates of bacteriophages as biocontrol Salmonella on post-harvest handling of Vannamei shrimp.
Mumpuni Uji Kawedar Anjung
ABSTRAK
IDENTIFIKASI CEMARANSALMONELLA spDAN ISOLASI BAKTERIOFAGE SEBAGAI BIOKONTROL DALAM PENANGANAN PASCA PANEN UDANG VANNAMEI
(LITOPENNAUS VANNAMEI)
Oleh
MUMPUNI UJI KAWEDAR ANJUNG
Produksi udang Indonesia setiap tahunnya mengalami peningkatan, namun ekspor udang ke luar negeri mengalami hambatan dan penolakan, diantaranya disebabkan oleh cemaran bakteri Salmonella sp. Cemaran bakteri Salmonella
menyebabkan penurunan mutu udang tidak aman dikonsumsi. Penurunan cemaran
Salmonella selama budidaya dan pengolahan dengan menggunakan antibiotik dilarang karena menyebabkan efek negatif terhadap konsumen. Salah satu alternatif bahan alami yang aman digunakan untuk menurunkan cemaran
Salmonella adalah penggunaan bakteriofage. Penelitian ini dilakukan untuk mengidentifikasi cemaran Salmonella terhadap penurunan mutu organoleptik udang vannamei, mengisolasi bakteri Salmonella dan bakteriofage Salmonella
pada udang vannamei.
Penelitian dilakukan dengan mengambil sampel udang vannamei dari Kecamatan Wonosobo, Kotaagung, Padang Cermin dan Rawajitu Timur masing-masing sebanyak 3 ulangan untuk dilakukan uji terhadap mutu organoleptik dan identifikasi cemaran bakteri Salmonella. Isolat Salmonella yang dihasilkan selanjutnya digunakan sebagai sel inang untuk isolasi bakteriofage Salmonella
dengan mengikuti metode yang digunakan Sartika (2012).
Mumpuni Uji Kawedar Anjung
dapat diterima oleh konsumen dan belum menunjukkan adanya pembusukan akibat cemaranSalmonella.Udang vannamei Kecamatan Wonosobo 100% positif tercemar Salmonella, Kecamatan Kotaagung dan Kecamatan Padang Cermin sejumlah 33,3% positif tercemarSalmonella sedangkan sampel udang Kecamatan Rawajitu Timur, tidak ada yang tercemar Salmonella.. Hasil isolasi Salmonella
diperoleh 2 isolat Salmonella sebagai kandidat inang untuk isolasi bakteriofage. Diperoleh 42 isolat bakteriofage Salmonella sp sebagai biokontrol Salmonella
pada penanganan pasca panen udang Vannamei.
IDENTIFIKASI CEMARAN SALMONELLA sp DAN ISOLASI BAKTERIOFAGE SEBAGAI BIOKONTROL DALAM PENANGANAN PASCA PANEN UDANG VANNAMEI
(LITOPENNAUS VANNAMEI)
(Tesis)
Oleh :
MUMPUNI UJI KAWEDAR ANJUNG
PROGRAM PASCA SARJANA
MAGISTER TEKNOLOGI AGROINDUSTRI PERTANIAN FAKULTAS PERTANIAN
UNIVERSITAS LAMPUNG BANDAR LAMPUNG
ABSTRACT
CONTAMINATION IDENTIFICATION AND ISOLATION BACTERIOPHAGE OF SALMONELLA sp AS BIOCONTROL IN
POST-HARVEST VANNAMEI SHRIMP (LITOPENNAUS VANNAMEI)
By
MUMPUNI UJI KAWEDAR ANJUNG
Indonesia's shrimp production has increased every year, but the export to overseas encountered resistance and rejection, which are caused by bacterial contamination of Salmonella sp. Salmonella contamination causes a decrease in the quality and shrimp is not safe to eat. Decrease in Salmonella contamination during cultivation and processing with the use of antibiotics banned for causing a negative effect on consumers. One alternative natural ingredients that are safe to use to reduce
Salmonella contamination is the use of bacteriophages. This study was conducted to identify the Salmonella contamination to the decline of the organoleptic quality of vannamei shrimp, isolate Salmonella bacteria and Salmonella’s bacteriophages in vannamei shrimp.
The study was conducted by taking a sample of vannamei shrimp from the District of Wonosobo, Kotaagung, Padang Cermin and Eastern Rawajitu respectively of 3 replications to test the organoleptic quality and identification of
Salmonella bacteria contamination. Salmonella isolates produced subsequently used as a host cell for the isolation of bacteriophage virulent to Salmonella by following the method used by Sartika (2012).
District of Wonosobo 100% positive contaminated with Salmonella, District Kotaagung and District Padang Cermin a 33.3% positive samples contaminated with Salmonella while Rawajitu Eastern District of shrimp, no contaminated with
Salmonella. The result of the isolation of Salmonella isolates obtained 2 as a candidate host for insulation bacteriophages. Obtained 42 isolates of bacteriophages as biocontrol Salmonella on post-harvest handling of Vannamei shrimp.
ABSTRAK
IDENTIFIKASI CEMARAN SALMONELLA sp DAN ISOLASI BAKTERIOFAGE SEBAGAI BIOKONTROL DALAM PENANGANAN PASCA PANEN UDANG VANNAMEI
(LITOPENNAUS VANNAMEI)
Oleh
MUMPUNI UJI KAWEDAR ANJUNG
Produksi udang Indonesia setiap tahunnya mengalami peningkatan, namun ekspor udang ke luar negeri mengalami hambatan dan penolakan, diantaranya disebabkan oleh cemaran bakteri Salmonella sp. Cemaran bakteri Salmonella
menyebabkan penurunan mutu udang tidak aman dikonsumsi. Penurunan cemaran
Salmonella selama budidaya dan pengolahan dengan menggunakan antibiotik dilarang karena menyebabkan efek negatif terhadap konsumen. Salah satu alternatif bahan alami yang aman digunakan untuk menurunkan cemaran
Salmonella adalah penggunaan bakteriofage. Penelitian ini dilakukan untuk mengidentifikasi cemaran Salmonella terhadap penurunan mutu organoleptik udang vannamei, mengisolasi bakteri Salmonella dan bakteriofage Salmonella
pada udang vannamei.
Penelitian dilakukan dengan mengambil sampel udang vannamei dari Kecamatan Wonosobo, Kotaagung, Padang Cermin dan Rawajitu Timur masing-masing sebanyak 3 ulangan untuk dilakukan uji terhadap mutu organoleptik dan identifikasi cemaran bakteri Salmonella. Isolat Salmonella yang dihasilkan selanjutnya digunakan sebagai sel inang untuk isolasi bakteriofage Salmonella
dengan mengikuti metode yang digunakan Sartika (2012).
mutu udang segar. Rata-rata organoleptik udang masih di atas 7 sehingga masih dapat diterima oleh konsumen dan belum menunjukkan adanya pembusukan akibat cemaran Salmonella. Udang vannamei Kecamatan Wonosobo 100% positif tercemar Salmonella, Kecamatan Kotaagung dan Kecamatan Padang Cermin sejumlah 33,3% positif tercemar Salmonella sedangkan sampel udang Kecamatan Rawajitu Timur, tidak ada yang tercemar Salmonella.. Hasil isolasi Salmonella
diperoleh 2 isolat Salmonella sebagai kandidat inang untuk isolasi bakteriofage. Diperoleh 42 isolat bakteriofage Salmonella sp sebagai biokontrol Salmonella
pada penanganan pasca panen udang Vannamei.
IDENTIFIKASI CEMARAN SALMONELLA sp DAN ISOLASI BAKTERIOFAGE SEBAGAI BIOKONTROL DALAM PENANGANAN PASCA PANEN UDANG VANNAMEI
(LITOPENNAUS VANNAMEI)
Oleh :
MUMPUNI UJI KAWEDAR ANJUNG
Tesis
Sebagai Salah Satu Syarat untuk Mencapai Gelar MAGISTER SAINS
Pada
Program Pascasarjana Magister Teknologi Industri Pertanian Fakultas Pertanian Universitas Lampung
PROGRAM PASCASARJANA MAGISTER TEKNOLOGI AGROINDUSTRI PERTANIAN
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
RIWAYAT HIDUP
Penulis dilahirkan di Kediri, pada tanggal 24 Juni 1979 merupakan istri dari
Endang Ismail, A.Pi, M.Si dan ibu dari Rasyid Rahmat Suria, Arsyad Rahmat
Mustakim serta Dafinah Rahmah Alya. Penulis merupakan anak ke lima buah
hati pasangan Andjung Marsono, BA dan Dra. Sofaria Tabri Utami.
Penulis menyelesaikan pendidikan di Taman Kanak-kanak di TK Raudatul Atfal,
Madiun pada tahun 1986, kemudian melanjutkan ke SD N Madiun Lor XII hingga
lulus tahun 1992. SLTP penulis tekuni di SMP N 7 Madiun hingga tahun 1995
dan dilanjutkan ke jenjang SLTA di SMA N 1 Madiun sampai tahun 1998. Pada
tahun 1998 penulis mengawali masa perkuliahan di Sekolah Tinggi Perikanan,
Jakarta, Jurusan Teknologi Pengolahan Hasil Perikanan hingga lulus pada tahun
2002.
Pada tahun 2002, penulis bekerja sebagai Quality Control pada perusahaan
pengolahan perikanan, PT. ISCP di Benoa, Bali. Pada tahun 2003 penulis diterima
sebagai PNS di lingkup Kementerian Kelautan dan Perikanan, serta ditempatkan
di Sekolah Usaha Perikanan Menengah Negeri Kotaagung sebagai guru hingga
sekarang. Penulis melanjutkan pendidikan pada Program Studi Magister
SANCAWACANA
Puji syukur penulis panjatkan kehadirat Allah S.W.T, karena atas rahmat
dan hidayah-Nya tesis ini dapat diselesaikan. Tesis dengan judul “Identifikasi
Cemaran Salmonella sp dan Isolasi Bakteriofage Sebagai Biokontrol Dalam Penanganan Pasca Panen Udang Vannamei (Litopennaus Vannamei) “ adalah salah satu syarat untuk memperoleh gelar Magisster Sains di Universitas
Lampung. Dalam kesempatan ini penulis mengucapkan terima kasih kepada :
1. Dr. Dewi Sartika, STP, M.Si, selaku Pembimbing Utama sekaligus
Pembimbing Akademik.
2. Ir. Susilawati, M.Si, selaku Pembimbing Kedua.
3. Prof. Ir. Neti Yuliana, Ph.D, selaku Pembahas.
4. Dr. Sri Hidayati, S.T.P., M.P, selaku Ketua Program Studi Magister
Teknologi Industri Pertanian Unila.
5. Prof. Dr. Ir. Irwan Sukri Banuwa, M.Si, selaku Dekan Fakultas Pertanian
Unila.
6. Prof. Dr. Sudjarwo, M.S. selaku Direktur Program Pasca Sarjana.
7. Suami tercinta dan anak-anakku Rasyid, Arsyad, Alya serta keluarga besar
Papi, Mami, Puh Ita, Puh Ake, Puh Tang, Puh La, serta keluarga besar
Anjung dan keluarga besar Hadi bin Tuti.
8. Rekan-rekan Magister Teknologi Industri Pertanian angkatan 2013 (Dian
9. Adik-adik S1 (Anitsa, Lia, Nabila, Yoan, Gusman dkk), Laboran, dosen
serta karyawan MTIP dan THP, teman-teman SKI serta semua pihak yang
tidak dapat disebutkan satu-persatu.
Akhir kata, penulis menyadari bahwa tesis ini masih jauh dari
kesempurnaan. Akan tetapi sedikit harapan penulis semoga tesis ini dapat berguna
dan bermanfaat bagi pembaca dan penulis.
Bandarlampung, Maret 2016
DAFTAR ISI
Halaman
HALAMAN JUDUL ... ii
HALAMAN PERSETUJUAN ... iii
HALAMAN PENGESAHAN ... iv
DAFTAR ISI ... vi
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
I. PENDAHULUAN ... 1
A. Latar Belakang dan Masalah………. ... 1
B. Tujuan ... 4
C. Kerangka Pemikiran ... 5
D. Hipotesis ... 7
II. TINJAUAN PUSTAKA ... 8
A. Bakteriofage ……….. ... 8
1. Karakteristik Bakteriofage ... 9
2. Aplikasi Bakteriofage ... 10
B. Salmonella sp ... 14
1. Ciri-ciri Salmonella ... 14
2. Klasifikasi Salmonella ... 15
3. Patogenesis ... 17
C. Isolasi Salmonella dan bakteriofage Salmonella ... 19
D. Penanganan Pasca Panen Udang Vannamei... 25
1. Komposisi Kimia Udang Vannamei ... 25
2. Kemunduran Mutu Pasca Panen Udang Vannamei ... 25
3. Prosedur Penanganan Pasca Panen Udang Vannamei ... 29
4. Standar Mutu Udang Segar ... 30
III. METODE ... 32
A. Tempat dan Waktu Penelitian ... 32
B. Bahan dan Alat ... 32
C. Metode Penelitian ... 32
D Pelaksanan Penelitian ... 33
IV. HASIL DAN PEMBAHASAN ... 38
A. Identifikasi Cemaran Salmonella dengan Uji Organoleptik ... 39
B. Isolasi dan Pengkayaan Salmonella ... 46
C. Isolasi Bakteriofage Sebagai Biokontrol Salmonella... 56
V. SIMPULAN DAN SARAN ... 64
A. Simpulan ... 64
B. Saran ... 65
DAFTAR TABEL
Tabel Halaman
1. Bakteri Patogen Penyebab Keracunan Makanan dan Penyakit Terkait ... 16
2. Alternatif Sistem Pre-Enrichment yang Digunakan Untuk Beberapa Jenis Pangan ... 23
3. Alternatif Metode Untuk Skrining Salmonella ... 24
4. Komposisi Kimia Udang Vannamei ... 25
5. Persyaratan Mutu dan Keamanan Pangan Udang Segar ... 31
6. Kriteria Penilaian Organoleptik Udang ... 34
7. Nilai Pengujian Organoleptik Udang Vannamei di Kecamatan Wonosobo, Kotaaagung, Padang Cermin dan Rawajitu Timur ... 39
8. Hasil Pengujian Cemaran Salmonella pada Udang Vannamei di Kecamatan Wonosobo, Kotaaagung, Padang Cermin dan Rawajitu Timur ... 47
9. Data Deskriptif Cemaran Salmonella pada Udang Vannamei di Kecamatan Wonosobo, Kotaaagung, Padang Cermin dan Rawajitu Timur ... 48
10. Kuantifikasi Cemaran Salmonella pada Udang Vannamei di Kecamatan Wonosobo, Kotaaagung, Padang Cermin dan Rawajitu Timur ... 48
DAFTAR GAMBAR
Gambar Halaman
1. Elektron Mikrograph Struktur Umum Bakteriofage ... 9
2. Daur Lisis ... 11
3. Scanning Mikrograf Salmonella typhimurium ... 15
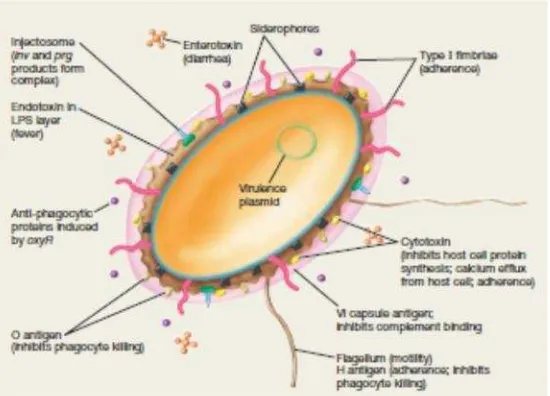
4. Virulen faktor pada patogenesis Salmonella ... 18
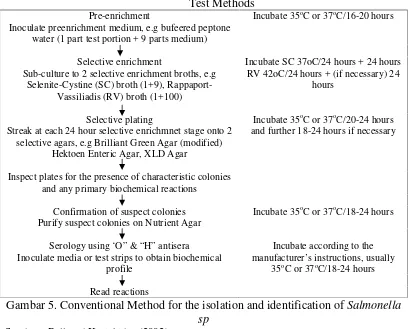
5. Conventional Method for the isolation and identification of Salmonella sp ... 20
6. Degradasi ATP Pada Udang ... 27
7. Flowchart Penelitian ... 37
8. Sampel Udang Vannamei ... 38
9. Hasil Positif Isolasi Salmonella Pada Media XLD ... 46
10. Hasil Negatif Isolasi Salmonella Pada Media XLD ... 47
11. Lokasi Budidaya Kecamatan Wonosobo dan Pemukiman ... 50
12. Lokasi Budidaya Kecamatan Padang Cermin ... 51
13. Lokasi Budidaya Kecamatan Kotaagung ... 51
14. Lokasi Budidaya Kecamatan Rawajitu Timur ... 51
15. Peremajaan Isolat Salmonella ... 56
16. Double Layer Tanpa Zona Bening ... 57
17. Double Layer Menghasilkan Zona Bening ... 57
1
I. PENDAHULUAN
A. Latar Belakang dan Masalah
Indonesia merupakan salah satu produsen dan eksportir utama produk
perikanan, terutama udang. Jenis udang yang banyak dibudidayakan di Indonesia
antara lain udang windu, udang galah dan udang vannamei. Udang vannamei
(Litopenaeus vannamei)adalah salah satu spesies udang varietas unggul yang saat ini dikembangkan oleh para pembudidaya udang di Indonesia. Udang vannamei
merupakan udang introduksi yang resmi diperkenalkan di Indonesia pada tahun
2001 (Subyakto, 2009) dengan tujuan meningkatkan produksi udang Indonesia.
Peningkatan produksi udang pada kenyataannya tidak diimbangi peningkatan
ekspor udang.
Permintaan ekspor udang Indonesia mengalami penurunan, hal ini terlihat
pada permintaan ekspor udang tahun 2009 sebesar 208.802 ton, turun menjadi
100.800 ton pada tahun 2010 (Pusat Data Statistik dan Informasi, 2012). Ekspor
udang pada tahun 2011 mengalami peningkatan menjadi 119.828,4 ton, pada
tahun 2012 sebesar 122.898,8 ton, pada tahun 2013 meningkat menjadi 126.969,9
ton dan pada tahun 2014 tercatat sebesar 148.519,4 ton (Badan Pusat Statistik,
2015). Ekspor udang ke Amerika Serikat, Uni Eropa dan Jepang pada periode
2011-2012 juga tercatat mengalami penurunan volume ekspor. Volume ekspor ke
Uni Eropa turun dari 102.334 ton menjadi 87.116 ton, ekspor ke Amerika Serikat
2
ton menjadi 33.521 ton. Penurunan tersebut karena sebagian udang ekspor
Indonesia tidak memenuhi standar mutu negara konsumen, diantaranya bebas
bakteri patogen, antibiotik dan pengawet. Menurut SNI 01-2728.1-2006, udang
harus bebas bakteriSalmonelladanVibrio cholera(Badan Standardisasi Nasional, 2006). Sedangkan Kementerian Kelautan dan Perikanan mentargetkan pada tahun
2016 peningkatan volume produksi udang meningkat menjadi 600.000 ton
(Wardani, 2016) dan sebagian besar (50%) ditujukan untuk ekspor (Noviani,
2013). Hal ini menjadi kendala bagi pemasaran udang Indonesia ke pasar ekspor.
Udang ekspor dari Indonesia ditolak karena pada umumnya terkontaminasi
bakteri Salmonella. Amerika Serikat hingga tahun 2012 menolak 181 produk perikanan dari Indonesia karena tercemar Salmonella (Supriadi, 2012). Demikian pula Uni Eropa hingga 2011 menolak 17 produk perikanan dari Indonesia. Food and Drug Administration (FDA) pada Juli 2013 menolak 5 lot Udang vannamei yang diekspor dari Indonesia karena dilaporkan tercemar bakteri Salmonella
(Maas, 2013). CemaranSalmonellamerupakan indikasi kurangnya sanitasi pada penanganan pangan.
CemaranSalmonellapada pangan menyebabkanSalmonellosis. Salmonellosis
dapat menimbulkan infeksi serius bagi manusia dan melemahkan sistem
kekebalan pada anak-anak, wanita tua dan hamil. Gejala Salmonellosis umumnya adalah sakit kepala, demam, kekejangan perut, diare, mual dan muntah (Multi Cultural Health Communication, 2011). Pada manusia, pola klinis Salmonellosis
meliputi demam enterik, gastroenteristis, bakteremia dan komplikasi nonthypoid
3
oleh konsumen. Untuk mengurangi akibat cemaran Salmonella, harus dilakukan penurunan paparan Salmonella pada pangan yang umumnya dilakukan dengan penggunaan antibiotik dan pengawet sintetis oleh pembudidaya maupun industri
pengolah udang.
Penggunaan antibiotik pada udang selama budidaya dan pengolahan dilarang,
baik di Indonesia maupun negara tujuan ekspor. Ekspor udang yang terdeteksi
terdapat komponen antibiotik akan ditolak. Penggunaan antibiotik pada dosis yang
tidak sesuai, selain menyebabkan resistensi antibiotik (Bahri, 2008) juga dapat
memberikan efek negatif yaitu produk pangan tidak aman dikonsumsi, reaksi
hipersensitivitas, bahkan depresi sumsum tulang belakang (Wibowo et al, 2010) atau gangguan fisiologis pada manusia.
Bahan-bahan alami dibutuhkan sebagai alternatif dalam menurunkan cemaran
Salmonella. Salah satu alternatif bahan alami yang aman digunakan adalah penggunaan bakteriofage. Bakteriofage adalah virus yang inangnya bakteri.
Mekanisme bakteriofage menginfeksi sel inangnya menyebabkan pengrusakan
total terhadap bakteri dengan cara melisiskan bakteri inang (Davidson, 2003).
Bakteriofage dapat digunakan sebagai agen hayati (biocontrol) Salmonella
yang ramah lingkungan. Bakteriofage nanomedicines bersifat aman untuk toksisitas dan imunogenetik (Vaks and Benhar, 2011). Modifikasi kombinasi
bakteriofage, SalmoLyse ™, secara signifikan dapat mengurangi kontaminasi
permukaan oleh Salmonella paratyphii(Woolston,et al, 2013). Bakteriofage juga telah menjadi alternatif biocontrol Salmonella serovar enteritidis dan
4
2013). Terapi bakteriofage secara oral pada manusia dinyatakan aman (McCallin
et al, 2013)
Di Indonesia belum tersedia bakteriofage secara komersial. Hal ini disebabkan
karena penelitian tentang bakteriofage masih sedikit. Penelitian bakteriofage yang
telah dilakukan ditemukan isolasi, spesifitas, karakterisasi dan keamanan
bakteriofage. Bakteriofage hanya melisiskan bakteri target, sehingga bakteriofage
untuk melisiskan Salmonella sp dapat diperoleh dari isolasi bakteriofage yang berasal dari media yang tercemar bakteri Salmonella sp (Atterbury, et al, 2007).
Bakteriofage yang dapat melisiskan Salmonella pada udang vannamei dapat diperoleh dengan mengisolasi bakteriofage dengan menggunakan Salmonella
yang terdapat pada udang dan lingkungannya.
Penelitian bakteriofage di Indonesia tidak diiringi pemanfaatannya pada
pangan dan lingkungan secara komersial. Pemanfaatan bakteriofage Salmonella
secara komersial memerlukan penelitian tentang isolasi dan pemanfaatan
bakteriofage. Pada penelitian ini dilakukan uji organoleptik udang vannamei dan
isolasi Salmonella pada udang vannamei segar untuk mengetahui kemunduran mutu akibat cemaran Salmonella pada udang vannamei segar, serta dan isolasi bakteriofage sebagai biokontrol dalam menurunkan Salmonella. Hasil penelitian ini diharapkan dapat menurunkan cemaranSalmonella.
B. Tujuan
Tujuan penelitian ini adalah :
5
2. Mengidentifikasi dan mengisolasi bakteri Salmonella pada udang vannamei
3. Mengisolasi bakteriofageSalmonella sppada udang Vannamei.
C. Kerangka Pemikiran
Udang merupakan bahan makanan yang tergolong mudah rusak (perishable food) atau menurun mutunya segera setelah udang mati. Perubahan-perubahan yang terjadi setelah ikan mati secara garis besar adalah terjadinya rigormortis
kemudian autolisis dan terakhir pembusukan (Sanger, 2010). Pada saat mulai
terjadi pembusukan, jumlah bakteri meningkat.
Penilaian mutu udang dapat dilakukan secara sensori dengan uji organoleptik.
Pengujian organoleptik merupakan cara pengujian menggunakan indera manusia
sebagai alat utama untuk menilai mutu ikan hidup dan produk perikanan yang
segar utuh (Badan Standardisasi Nasional, 2006). Pengamatan dilakukan dengan
uji organoleptik berdasarkan SNI 01-2728.1-2006 terhadap udang untuk
mengetahui penerimaan konsumen terhadap sampel udang. Kriteria udang mutu
udang segar adalah kenampakan udang utuh, bening bercahaya asli menurut jenis,
antar ruas kokoh hingga kurang bening, cahaya mulai pudar, berwarna asli, bau
sangat segar spesifik jenis hingga netral, tekstur sangat elastis hingga kurang
elastis, kompak dan padat. Kriteria mutu udang yang mengalami pembusukan
oleh bakteri adalah warna merah sangat kusam, noda hitam banyak, bau amoniak
kuat dan bau busuk, tekstur udang lunak.
Penurunan mutu udang dapat disebabkan oleh cemaran bakteri Salmonella.
6
IsolasiSalmonellaakan memisahkanSalmonelladari bakteri lain yang mencemari udang tersebu,t seperti E. Coli, Shigella dan Vibrio. Isolasi bakteri merupakan suatu cara untuk memisahkan atau memindahkan mikroba tertentu dari
lingkungannya sehingga diperoleh kultur murni atau biakan murni. Isolasi
Salmonella dilakukan dengan metode konvensional dengan media Xylose Lysine Deoxycholate agar (XLD). Media XLD memiliki konsentrasi deoksikolat yang tinggi (0,25%) sehingga menghambat pertumbuhan bakteri gram positif dan
bakteri gram negatif seperti Salmonella dapat tumbuh. XLD dapat membedakan
Salmonella dan Shigella karena medium ini mengandung xilosa laktosa dan sukrosa yang difermentasi oleh sebagian besar coloform intestinal normal yang
menghasilkan koloni kuning. Shigella tidak memfermentasi gula dan menghasilkan koloni warna merah (atau jernih). Salmonella memfermentasi xilasa, namun bakteri ini melakukan dekarboksilasi lisin pada medium,
menyebabkan produksi amonia. Salmonella akan memfermentasi laktosa dan sukrosa hadir dalam medium ke tingkat yang akan mencegah pH reversi oleh
dekarboksilasi dan mengasamkan media mengubahnya kuning, sehingga
Salmonella pada awalnya tampak berwarna kuning tetapi kemudian menjadi merah. Salmonella menghasilkan hidrogen sulfida dari natrium tiosulfat dan karenanya tampak sebagai koloni merah dengan pusat hitam. Pada saat diperoleh
isolatSalmonella,akan dipilih yang paling stabil, tidaksmear,warna koloni hitam mengkilat dan isolat tersebut yang akan dimurnikan.
Penurunan cemaran Salmonella dapat dilakukan dengan penggunaan bakteriofage. Bakteriofage pada perkembangbiakan secara vegetatif akan
7
Bakteriofage litik yang menginfeksi sel bakteri akan mengakibatkan bakteriofage
bereplikasi di dalam sel inang dan akan membentuk sejumlah bakteriofage baru,
kemudian akan membuat sel inang pecah dan akan menginfeksi sel inang lainnya
(Astriningsih, 2012). Sel inang yang pecah megakibatkan kematian sel inang
sehingga jumlah bakteri menurun. Bakteriofage untuk menurunkan cemaran
Salmonella diperoleh dengan mengisolasi bakteriofage yang sel inangnya
Salmonella dengan mengikuti metode yang digunakan Sartika (2012). Hasil penelitian berupa data rata-rata organoleptik udang dan data cemaran Salmonella
pada udang dan isolat bakteriofage sebagai biokontrol Salmonella dipaparkan menggunakan metode deskriptif.
D. Hipotesis
1. Cemaran Salmonella menurunkan mutu udang vannamei secara organoleptik.
2. Bakteri Salmonella sp pada udang vannamei dapat diisolasi dengan metode konvensional menggunakan media XLD.
8
II. TINJAUAN PUSTAKA
A. Bakteriofage
Bakteriofage adalah entitas virus bakteri yang memiliki materi genetik
baik dalam bentuk DNA maupun RNA, terkapsid oleh mantel protein (Haqet al, 2012). Lebih lanjut dijelaskan kapsid bakteriofage terpasang ke ekor yang
memiliki serat, digunakan untuk menginokulasi ke reseptor pada permukaan sel
bakteri. Sebagian besar fage memiliki kapsid polyhedral kecuali fage berserabut.
Bakteriofage memiliki ciri umum yang sama dengan virus. Perbedaan
bakteriofage dan virus adalah bakteriofage hanya menginfeksi bakteri target saja
dan tidak dapat menyerang manusia, hewan dan tumbuh-tumbuhan (Astriningsih,
2012) sedangkan virus dapat menyerang manusia, hewan dan tumbuh-tumbuhan.
Istilah virus merujuk pada partikel-partikel yang menginfeksi sel-sel eukariota
(organisme multisel dan banyak jenis organisme sel tunggal) sementara istilah
bakteriofage untuk jenis-jenis yang menyerang jenis-jenis sel prokariota (bakteri
dan organisme lain yang tidak berinti sel).
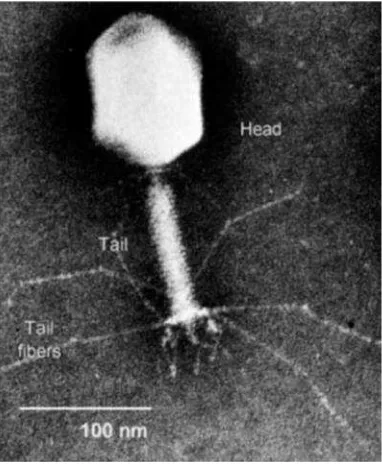
Berdasarkan morfologi, bakteriofage terdiri atas bagian kepala, ekor, dan
serabut ekor. Kepala berbentuk polyhedral (segi banyak) yang di dalamnya
mengandung DNA atau RNA saja. Tubus atau selubung memanjang yang
9
alat penginfeksi. Selubung antara bagian kepala dan ekor disebut kapsid.
[image:30.595.217.408.167.399.2]Morfologi dan struktur bakteriofage dapat dilihat pada gambar 1.
Gambar 1. Elektron Mikrograph Struktur Umum Bakteriofage
Sumber : Davidson College, 2003
Kapsid tersusun atas molekul-molekul protein, oleh sebab itu disebut
sebagai selubung protein atau pembungkus protein, fungsinya sebagai pelindung
asam nukleat (DNA dan RNA). Kapsid dapat membantu menginfeksi ke sel
inangnya dan menentukan macam sel yang akan dilekati. Bagian ujung ekor
ditumbuhi serabut-serabut ekor yang berfungsi sebagai penerima rangsang atau
reseptor. Sejumlah subunit molekul protein yang menyusun kapsid dan identik
satu dengan yang lain disebut kapsomer.
1. Karakteristik Bakteriofage
Bakteriofage diklasifikasikan ke dalam 13 famili. Lebih dari 95%
10
utamaCaudoviralesdibedakan oleh morfologi ekor yang berbeda. Famili tersebut adalah Siphoviridae (60%), Myoviridae (25%), dan Podoviridae (15%).
Siphoviridae bentuk ekor panjang, fleksibel sedangkan Myoviridae ekor lapis ganda, ekor kontraktil, dan Podoviridae ditandai dengan bentuk ringkas, ekor gemuk. Polyhedral, berserabut dan pleomorfik hanya mewakili 3-4% fag dan 10
famili (Ceyssens, 2009).
Menurut Abedon (2008), bakteriofage berdasarkan kekerabatan, morfologi
dan tipe genom dikelompokkan sebagai berikut :
1. Fage T4 : famili Myoviridae, memiliki ekor, dsDNA, antara lain P1-, P2-, Mu dan SPO1-like fages
2. Fage λ : famili Siphoviridae, memiliki ekor, antara lain T1-, T5-, c2-, dan L5-like fages
3. Fage T3 dan T7 : famili Podoviridae, memiliki ekor, dsDNA, antara lainϕ29- da P22-like fages
4. FageϕX174 : familiMicroviridae,icosahedral, ssDNA
5. Fageϕ6 : famili Cystoviridae, icosahedral dan terbungkus, terbagi dsRNA
6. Fage MS2 : famili Leviviridae, icosahedral, ssRNA, termasuk fage F2 dan Qß
7. Fage f1, fd dan M13 : familiInoviridae, filamentous, ssDNA
2. Aplikasi Bakteriofage
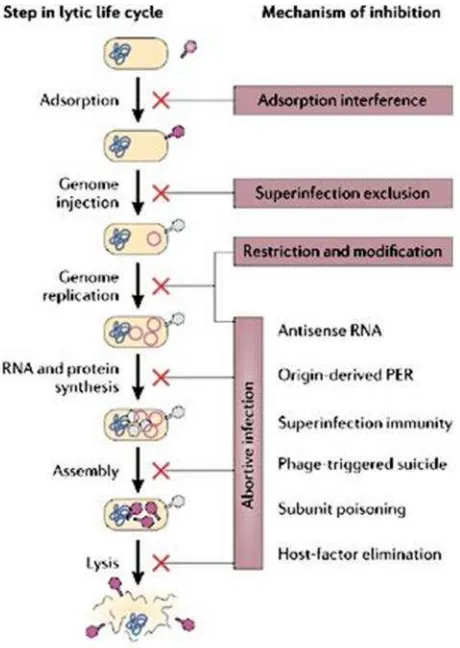
Bakteriofage memiliki dua daur siklus reproduksi yang berbeda, yaitu lisis
dan lisogenik. Bakteriofage lisis dapat memecahkan atau melisiskan bakteri
sehingga bakteri mati. Siklus bakteriofage secara lisis terdiri atas tahapan
adsorpsi, penetrasi, biosintesis, pematangan dan pelepasan. Adsorpsi dilakukan
dengan menggunakan reseptor. Laju adsorpsi bakteriofage meningkat menjadi
11
2010). Pada tahap penetrasi, bakteriofage melepaskan lisozim untuk memecah
sebagian dinding sel dan kapsid didorong menembus membran plasma. Genom
kemudian disuntikkan ke dalam bakteri dilanjutkan tahapan biosintesis. Selama
tahap pematangan atau perakitan bakteriofage, DNA dan kapsid dirakit menjadi
virus yang lengkap dan siap dilepaskan. Pelepasan terjadi ketika lisozim
bakteriofage memecah dinding sel dan partikel bakteriofage yang baru disintesis
[image:32.595.201.431.276.600.2]dilepaskan (gambar 2).
Gambar 2. Daur Lisis (Sturino and Klaenhammer, 2006)
Pemanfaatan bakteriofage untuk menurunkan kontaminasi bakteri
dilakukan pada fase lisis. Bakteriofage dapat melisiskan bakteri target sehingga
populasi bakteri menurun. Bakteriofage mampu menginfeksi bakteri dan
12
ke dalam kromosom bakteri inang (Buana dan Krisna, 2014). Bakteriofage
merupakan virus yang menginfeksi bakteri dan mampu membunuh sel bakteri
tersebut secara langsung atau mengintegrasikan DNA virus ke dalam kromosom
bakteri inang. Penelitian dan penemuan bakteriofage lisis mulai berkembang sejak
tahun 1896. Pada tahun 1896 Ernest Hanbury Hankin mengamati aktivitas
bakteriofage yang menginfeksi Vibrio choleraedi India. Penggunaan bakteriofage lisis secara klinis pada manusia mulai dilakukan setelah penemuan bakteriofage
lisis pada tahun 1915-1917, khususnya di Eropa Timur (Abedon, 2007). Pada
tahun 1921 bakteriofage lisis dimanfaatkan untuk perlakuan terhadap infeksi
Staphylococcus pada kulit. Pada tahun 1940-an, perusahaan Eli Lilly di Amerika Serikat telah memproduksi 7 produk bakteriofage untuk digunakan pada manusia.
Hingga ini penelitian bakteriofage di dunia terus berkembang di berbagai negara.
Penelitian pemanfaaatan bakteriofage sebagai biokontrol Salmonella
diantaranya dilakukan oleh Fiorentin, et al(2005) untuk menurunkan Salmonella enteridis pada ayam potong, menurunkan Salmonella pada produk peternakan (Hargis, et al. 2005), Salmonella enterica pada kompos (Heringa, et al. 2010), menurunkan Salmonella enterica (Bao, Zhang and Wang, 2011), efek terapi bakteriofage melawan Salmonella gallinarum (Hong, et al. 2013), menurunkan
Salmonella enteridis pada ayam broiler (Gonçalves, et al. 2014). Pemanfaatan bakteriofage untuk menurunkan infeksi Salmonella juga telah dilaporkan oleh Zhang, et al.(2015). Lebih lanjut dijelaskan hingga saat ini sedikitnya 25 genome bakteriofage Salmonella telah dilaporkan dengan ukuran genome berkisar antara 33 hingga 240 kb. Hal ini mengindikasikan bahwa keanekaragaman bakteriofage
13
Penelitian bakteriofage di Indonesia tidak berkembang pesat. Penelitian
bakteriofage masih terbatas pada penemuan bakteriofage lisis. Beberapa penelitian
yang telah dilakukan diantaranya penelitian bakteriofage untuk mengendalikan
infeksi bakteri pada tanaman kubis (Widadi, Linayanti, Sumiyati, 2012). Budiarti,
Pratiwi and Rusmana (2011) meneliti bakteriofage lisis pada pasien diare, isolasi
bakteriofage untuk meningkatkan keamanan pangan (Nurizkiawan, 2011),
spesifitas dan karakteristik bakteriofage lisis Salmonella (Astriningsih, 2012 dan Sunarti, 2012), isolasi bakteriofage Shigella (Iswadi, 2012). Penelitian Sartika, Budiarti and Sudarwanto (2012) telah menemukan manfaat dan keamanan
bakteriofage pada pangan. Berbagai hasil penelitian bakteriofage di Indonesia
belum disertai pemanfaatannya secara komersial.
Penelitian dan penemuan bakteriofage di berbagai negara telah diiringi
pemanfaatannya di berbagai aspek kehidupan. Pemanfaatan bakteriofage untuk
bidang kesehatan diantaranya untuk vaksin antigen untuk imunisasi terhadap
Schistosoma mansoni(Raoet al, 2003), terapi melawan infeksi pada kulit, tulang, saluran gastrointestinal, dada, abdomen, kepala, leher dan sistem organ tubuh
lainnya (Abedon, 2008). Staphylococcus aureus pada sentral vena kateter (Lungren et al, 2013). Di bidang pertanian dan peternakan antara lain untuk layu pada tembakau, kanker pada jeruk, bercak pada jeruk, hawar pada geranium,
lodoh pada jamur merang, dan hawar Xanthomonas pada bawang, (Jones et al, 2007), bercak pada apel (Youssef et al, 2011), Escherichia coli Septicemia dan Meningitis pada ayam dan anak sapi (Barrow, 1998), Salmonella pada ternak ayam (Bardinaet al,2012), multidrug resistant Klebsiella pneumonia pada ternak
14
banyak dimanfaatkan dalam menurunkan cemaran Listeria monocytogenes pada melon (Leverentz et al, 2004), Vibrio harveyi(Phumkacorn and Pongsak, 2010), Shigella (Garcia et al, 2010), E. Coli (Budiarti, Pratiwi and Rusmana, 2011), dan
Salmonella(Hootonet al,2011 dan Woolstonet al, 2013).
B. Salmonella sp
Salmonella adalah bakteri yang menjadi indikator sanitasi pada pangan.
Salmonella pada umumnya tergolong bakteri patogen.
1. Ciri-ciriSalmonella
Salmonellaadalah bakteri batang gram negatif yang bersifat motil, dengan panjang 1,0 sampai 3,0 µm memiliki lebar 0,8 sampai 1,0 µm. Salmonella akan menghasilkan batang warna merah muda pada pewarnaan gram pada pemeriksaan
mikroskopis. Salmonella dapat memfermentasikan glukosa, memproduksi gas, namun tidak memfermentasikan laktosa dan sukrosa. Salmonella bersifat patogen terhadap manusia dan hewan bila tertelan.
Salmonella tersebar luas di alam dan mereka bertahan dengan baik dalam
berbagai makanan (Pui et al, 2011). Cemaran Salmonella dapat dijumpai pada tanah dan air. Cemaran Salmonella akan menyebar ke sayuran, ternak, bahan pangan, dan manusia melalui ekskresi manusia dan hewan. Salmonella tidak berlipat jumlahnya dengan cepat jika berada di luar inangnya, tetapi dapat
bertahan beberapa minggu di air dan beberapa tahun di tanah jika kondisi
lingkungan mendukung.
15
optimum pada kisaran suhu 35-37oC.Salmonellatumbuh dalam kisaran pH antara 4-9 dengan pH optimal antara 6.5 dan 7.5. mereka membutuhkan aktivitas air
tinggi (aw) antara 0,99 dan 0,94 (Puiet al, 2011)
2. KlasifikasiSalmonella
Lebih dari 2300 serovar Salmonella telah dijelaskan namun meskipun seluruhnya bersifat potensial patogenik sangat berbeda pada inang dan
patogenisitas (Wray et al, 2000). Salmonella (Gambar 3) merupakan salah satu bakteri patogen penyebab keracunan makanan (tabel 1) pada hewan dan manusia.
Bakteri ini masuk melalui kontaminasi makanan dan minuman. Bakteri ini
menyebabkan infeksiSalmonella.
[image:36.595.212.411.416.575.2]Berikut gambarscanningmikrografSalmonella typhimurium
16
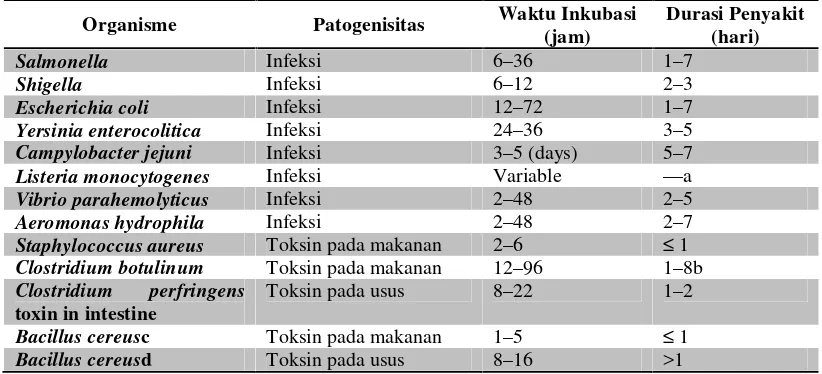
Tabel 1. Bakteri Patogen Penyebab Keracunan Makanan dan Penyakit Terkait
Organisme Patogenisitas Waktu Inkubasi
(jam)
Durasi Penyakit (hari)
Salmonella Infeksi 6–36 1–7
Shigella Infeksi 6–12 2–3
Escherichia coli Infeksi 12–72 1–7
Yersinia enterocolitica Infeksi 24–36 3–5
Campylobacter jejuni Infeksi 3–5 (days) 5–7
Listeria monocytogenes Infeksi Variable —a
Vibrio parahemolyticus Infeksi 2–48 2–5
Aeromonas hydrophila Infeksi 2–48 2–7
Staphylococcus aureus Toksin pada makanan 2–6 ≤ 1
Clostridium botulinum Toksin pada makanan 12–96 1–8b
Clostridium perfringens toxin in intestine
Toksin pada usus 8–22 1–2
Bacillus cereusc Toksin pada makanan 1–5 ≤ 1
Bacillus cereusd Toksin pada usus 8–16 >1
a mempengaruhi orang dengan faktor predisposisi, tingkat kematian yang tinggi b angka kematian tinggi, pemulihan lengkap membutuhkan waktu 6-8 bulan c tipe emetik
d tipe diare
Sumber : Vries, 1996
Klasifikasi Salmonella didasarkan pada struktur antigen. Struktur antigen utama yaitu somatic, surface dan flagellar. Somatic (O) atau Cell Wall Antigen
tergolong serovar tahan panas dan alkohol, sedangkan surface disebut juga
envelope antigen, dan flagellar (H) antigen yang labil terhadap panas (Todar, 2009).
Bakteri dapat diklasifikasikan berdasarkan filogeni. Sebuah pohon
filogenetik dapat diturunkan dari perbandingan dengan 16S rRNA atau urutan gen
lainnya. Ada 2.463 serotipe Salmonella yang sekarang ditempatkan di bawah 2 spesies karena perbedaan 16S analisis urutan rRNA: Salmonella enterica (2443 serotipe) dan Salmonella bongori (20 serotipe). Sistem saat ini digunakan oleh
17
panas dan menyumbang lebih dari 99% dari isolat klinis sedangkan sisanya
subspesies danS. bongoriyang terutama terisolasi dari hewan berdarah dingin dan mencapai kurang dari 1% dari isolat klinis. Sebagai contoh, spesies Salmonella typhimurium kini ditunjuk sebagai Salmonella subspesies enterica I serotipe Typhimurium. Dibawah sistem nomenklatur modern, subspesies
informasi sering diabaikan dan budaya disebut S. enterica serotipe Typhimurium
dan selanjutnya, tertulis sebagai S. Typhimurium. Ini sistem tata nama yang digunakan saat ini untuk membawa keseragaman dalam pelaporan (Pui et al, 2011).
3. Patogenesis
Patogenesis adalah mekanisme penyebab penyakit. Istilah ini juga dapat
digunakan untuk menggambarkan asal usul dan perkembangan penyakit, apakah
akut, kronis atau berulang. Kata ini berasal dari bahasa Yunani. Patogen
Salmonella umumnya terkait dengan pencemaran tinja yang terdeteksi secara sporadis atau tidak sama sekali (Paolaet al,2010).
Mekanisme patogenesis Salmonella umumnya dengan proses infeksi sistemik. Gejala yang timbul umumnya adalah demam, diare, mual, muntah, dan
sakit perut. Gejala ini disebut salmonellosis.Salmonella masuk melalui makanan ke lambung dan usus halus. Selanjutnya akan menyebar ke kelenjar getah bening,
pembuluh darah dan seluruh tubuh sehingga feses dan urin penderita mengandung
18
Gambar 4. Virulen Faktor pada PatogenesisSalmonella Sumber : Madiganet al(2012)
Gejala infeksi Salmonella atau Salmonellosis umumnya adalah demam, diare, mual, muntah , dan sakit perut. Dalam beberapa kasus, Salmonellosisdapat menyebar ke aliran darah yang mengakibatkan penyakit yang lebih berat seperti
infeksi arteri, endokarditis, dan arthritis (Sartika, 2012). Strategi pencegahan
penyakit Salmonellosis yang efektif adalah deteksi kasus, perbaikan sanitasi
lingkungan, pencegahan kontaminasi dalam industri makanan, menekan angka
reaktor Salmonellosis, pendidikan kesehatan masyarakat serta eliminasi sumber
infeksi (Ariyanti dan Supar, 2005).
4. Pencegahan dan Penurunan CemaranSalmonellaPada Pangan
Pencegahan cemaran Salmonella pada pangan dapat dilakukan dengan mengontrol sanitasi dan higiene pada pengolahan. Penurunan suhu penyimpanan
beku dan penambahan waktu memasak beberapa menit dapat mengurangi resiko
19
Penurunan cemaran Salmonella pada pangan dapat dilakukan secara biologi, fisik (sterilisasi dengan panas, radiasi dan filter), dan kimia (Madigan et al, 2012). Penurunan cemaran Salmonella pada pengan secara biologi yakni dengan menggunakan bakteriofage. Perubahan suhu dari 37oC ke 50oC dan 60oC
mematikan Salmonella typhimurium (Migeemanathan et al, 2011). Penurunan cemaran Salmonella secara kimia menggunakan antibiotik menyebabkan resistensi Salmonella. Cardoso (2009) menyatakan, diantara Salmonella yang berhasil diisolasi dari sosis babi segar prevalensi terbesar resisten terhadap
antibiotiktetracycline. Penggunaan antibiotik pada produkseafood menyebabkan resistensi mikrobial (Amaglianiet al,2011).
C. IsolasiSalmonelladan bakteriofageSalmonella
Metode isolasi Salmonella pada makanan dapat dilakukan dengan cara konvensional atau metode alternatif lain. Secara konvensional, metode isolasi
dapat dilakukan dengan media xylose lysine desoxycholate agar (XLD),
desoxycholate citrate agar(DCA), desoxycholate citrate lactose saccharose agar
(DCLS),Salmonella Shigella agar (SS),bismuth sulphite agar (BS), danbrilliant green agar (BG). Media untuk isolasi terbaik adalah BS (Lim et al, 1980). Metode isolasi konvensional dasar meliputi pre-enrichment of the sample, sub-culturing from the pre-enrichment broth, streaked onto two selective plating media, purified to confirmation, identification and further caracterisation (Bell and Kyriakides, 2002). Tahapan metode isolasi konvensional dapat dilihat pada
20
Test Methods
Pre-enrichment
Inoculate preenrichment medium, e.g bufeered peptone water (1 part test portion + 9 parts medium)
Incubate 35oC or 37oC/16-20 hours
Selective enrichment
Sub-culture to 2 selective enrichment broths, e.g Selenite-Cystine (SC) broth (1+9),
Rappaport-Vassiliadis (RV) broth (1+100)
Incubate SC 37oC/24 hours + 24 hours RV 42oC/24 hours + (if necessary) 24
hours
Selective plating
Streak at each 24 hour selective enrichmnet stage onto 2 selective agars, e.g Brilliant Green Agar (modified)
Hektoen Enteric Agar, XLD Agar
Incubate 35oC or 37oC/20-24 hours and further 18-24 hours if necessary
Inspect plates for the presence of characteristic colonies and any primary biochemical reactions
Confirmation of suspect colonies Purify suspect colonies on Nutrient Agar
Incubate 35oC or 37oC/18-24 hours
Serology using ‘O” & “H” antisera Inoculate media or test strips to obtain biochemical
profile
Incubate according to the manufacturer’s instructions, usually
35oC or 37oC/18-24 hours
[image:41.595.108.523.89.418.2]Read reactions
Gambar 5. Conventional Method for the isolation and identification ofSalmonella sp
Sumber : Bell and Kyriakides (2002)
Metode konvensional juga dapat dilakukan dengan menambahkan 225 ml
medialactose broth(BPW) ke dalam 25 gram sampel, selanjutnya dihomogenkan selama 2 menit lalu dibiarkan pada suhu ruang selama 60 menit. Kocok rata
larutan dan diinkubasikan pada suhu 35oC selama 24 jam. Untuk produk
perikanan dengan tingkat kontaminasi tinggi, pindahkan 0,1 ml larutan contoh ke
dalam 10 ml Rappaport-Vassiliadis (RV) medium dan 1 ml larutan contoh ke dalam 10 ml Tetrathionate Broth (TTB); Untuk jenis produk perikanan lain, pindahkan 1 ml larutan contoh ke dalam masing-masing 10 ml SCB dan 10 ml
TTB.
Inkubasi media pengkayaan selektif sebagai berikut : Untuk produk
21
jam±2 jam pada suhu 42°C ± 0,2°C (Waterbath); Inkubasi TTB selama 24 jam± 2 jam pada suhu 43°C ± 0,2°C (Waterbath); Untuk jenis produk perikanan lain, inkubasi TTB dan SCB selama 24 jam ± 2 jam pada suhu 35°C ± 1°C.
Kocok tabung (dengan vortex) dan dengan mengggunakan jarum loop
(3mm) gores TTB yang diinkubasi ke dalam media HE, XLD dan BSA. Siapkan
BSA sehari sebelum digunakan dan simpan di tempat gelap pada suhu ruang.
Gores ke dalam media yang sama dari RVBroth atau SCB. Inkubasi cawan BSA, HE dan XLD selama 24 jam pada suhu 35°C ± 1°C. Amati kemungkinan adanya
koloni Salmonella. Ambil 2 atau lebih koloni Salmonella dari masing-masing media Agarselektif setelah 24 jam ± 2 jam inkubasi. Koloni-koloni Salmonella
yang khas(typical)adalah sebagai berikut:
a) HE Agar. Koloni hijau kebiruan sampai biru dengan atau tanpa inti hitam. Umumnya kultur Salmonella membentuk koloni besar, inti hitam mengkilat atau hampir seluruh koloni terlihat berwarna hitam.
b) XLD Agar. Koloni merah jambu (pink) dengan atau tanpa inti hitam. Umumnya kultur Salmonellamembentuk koloni besar, inti hitam mengkilat atau hampir seluruh koloni terlihat berwarna hitam.
c) BSA.Koloni coklat, abu-abu atau hitam; kadang-kadang metalik. Biasanya
media di sekitar koloni pada awalnya berwarna coklat, kemudian berubah menjadi
hitam (halo effect) dengan makin lamanya waktu inkubasi. Apabila koloni yang khas (typical) tumbuh pada BSA setelah 24 jam ± 2 jam inkubasi, ambil 2 koloni atau lebih. Inkubasikan kembali media BSA selama 24 jam ± 2 jam. Setelah 48
22
media BSA yang diinkubasi selama 24 jam ± 2 jam memberikan reaksi yang tidak
sesuai pada TSI dan LIA, yang menjadikan kultur ini dinyatakan sebagai bukan
Salmonella.Ambil secara hati-hati bagian tengah koloni dengan menggunakan jarum inokulasi steril dan goreskan ke permukaan media TSI agar dengan cara
menggores agar miring dan menusuk agar tegak. Tanpa mengambil koloni baru,
gunakan jarum yang sama untuk menggores media LIA dengan cara menusuk
agar tegak lebih dahulu, setelah itu goreskan pada agar miring. Karena reaksi
Lysine Decarboxylase sangat anaerobik, LIA miring harus mempunyai tusukan yang dalam (4 cm). Simpan media agar selektif yang telah diambil koloninya pada
suhu 5°C–8°C. Inkubasi TSI dan LIA selama 24 jam ± 2 jam pada suhu 35°C ±
1°C dengan membiarkan tutup sedikit kendur untuk mencegah terbentuknya H2S
yang berlebihan. Pada TSI, kultur Salmonella yang khas memberikan reaksi
alkalin (merah) pada goresan agar miring dan asam (kuning) pada tusukan agar tegak, dengan atau tanpa H2S (warna kehitaman pada agar). Pada LIA, kultur
Salmonella yang khas memberikan reaksi alkaline (ungu) pada keseluruhan tabung. Reaksi yang benar-benar kuning pada tusukan dinyatakan sebagai kultur
negatif. Jangan hanya melihat diskolorisasi pada tusukan untuk menyatakan kultur
negatif. Umumnya kulturSalmonellamembentuk H2S pada LIA. Beberapa kultur nonSalmonellamembentuk reaksi merah bata pada agar miring LIA.
23
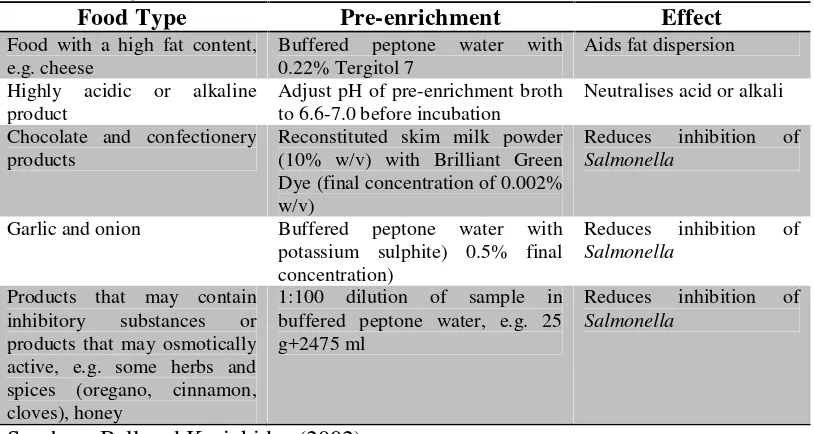
Tabel 2. Alternatif SistemPre-Enrichmentyang Digunakan Untuk Beberapa Jenis Pangan
Food Type Pre-enrichment Effect
Food with a high fat content, e.g. cheese
Buffered peptone water with 0.22% Tergitol 7
Aids fat dispersion
Highly acidic or alkaline product
Adjust pH of pre-enrichment broth to 6.6-7.0 before incubation
Neutralises acid or alkali
Chocolate and confectionery products
Reconstituted skim milk powder (10% w/v) with Brilliant Green Dye (final concentration of 0.002% w/v)
Reduces inhibition of Salmonella
Garlic and onion Buffered peptone water with potassium sulphite) 0.5% final concentration)
Reduces inhibition of Salmonella
Products that may contain inhibitory substances or products that may osmotically active, e.g. some herbs and spices (oregano, cinnamon, cloves), honey
1:100 dilution of sample in buffered peptone water, e.g. 25 g+2475 ml
Reduces inhibition of Salmonella
Sumber : Bell and Kyriakides (2002)
Selain secara konvensional, dapat digunakan alternatif metode antara lain
24
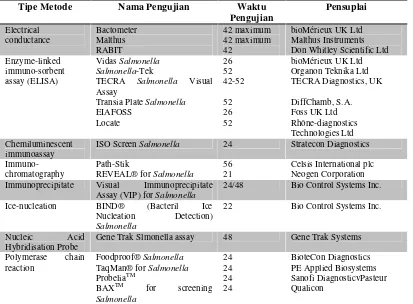
Tabel 3. Alternatif Metode untuk SkriningSalmonella.
Tipe Metode Nama Pengujian Waktu
Pengujian Pensuplai Electrical conductance Bactometer Malthus RABIT 42 maximum 42 maximum 42
bioMérieux UK Ltd Malthus Instruments Don Whitley Scientific Ltd Enzyme-linked
immuno-sorbent assay (ELISA)
VidasSalmonella Salmonella-Tek
TECRA Salmonella Visual
Assay
Transia PlateSalmonella
EIAFOSS Locate 26 52 42-52 52 26 52
bioMérieux UK Ltd Organon Teknika Ltd TECRA Diagnostics, UK
DiffChamb, S.A. Foss UK Ltd Rhône-diagnostics Technologies Ltd Chemiluminescent
immunoassay
ISO ScreenSalmonella 24 Stratecon Diagnostics
Immuno-chromatography
Path-Stik
REVEAL® forSalmonella
56 21
Celsis International plc Neogen Corporation
Immunoprecipitate Visual Immunoprecipitate
Assay (VIP) forSalmonella
24/48 Bio Control Systems Inc.
Ice-nucleation BIND® (Bacteril Ice
Nucleation Detection)
Salmonella
22 Bio Control Systems Inc.
Nucleic Acid
Hybridisation Probe
Gene Trak Slmonella assay 48 Gene Trak Systems
Polymerase chain
reaction
Foodproof®Salmonella
TaqMan® forSalmonella
ProbeliaTM
BAXTM for screening
Salmonella 24 24 24 24 BioteCon Diagnostics PE Applied Biosystems Sanofi DiagnosticvPasteur Qualicon
Sumber : Bell and Kyriakides (2002)
Metode isolasi bakteriofage Salmonella dapat dilakukan dengan berbagai metode. Metode isolasi bakteriofage diantaranya metode Clokie and Kropinski
(2009), Budiarti et al(2011) dan metode yang digunakan Sartika (2012). Metode yang digunakan Sartika merupakan kombinasi dari metode Clokie dan Budiarti.
Isolat bakteriofage yang dihasilkan selanjutnya dilakukan pengkayaan.
Pengkayaan bakteriofage Salmonella dilakukan dengan metode yang digunakan Sartika. Hasil pengkayaan digunakan untuk stok atau bahan produksi.
Penelitian sebelumnya juga menyatakan bahwa buffer terbaik untuk penyimpanan
25
D. Penanganan Pasca Panen Udang Vannamei
1. Komposisi Kimia Udang Vannamei
Udang merupakan sumber protein yang sangat baik dan itu adalah salah
satu bagian spesies popular yang kaya protein dan mineral, yang merupakan
keunggulan dibandingkan daging dan unggas. Udang memiliki kualitas tinggi
dari komposisi tubuh termasuk protein, lemak dan asam amino dan lain lain yang
merupakan indikator dari keberadaan fisiologis yang baik dan kondisi biokimia.
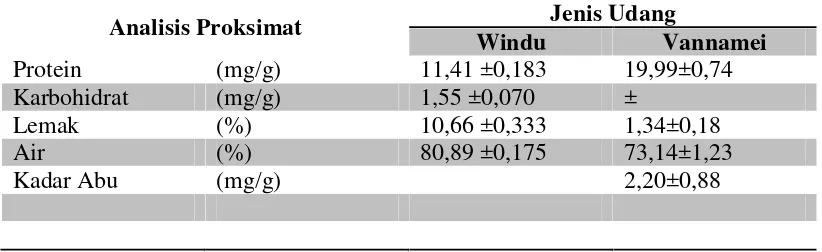
[image:46.595.107.518.348.474.2]Adapun komposisi kimia udang windu dan vannamei disajikan dalam tabel 4.
Tabel 4. Komposisi Kimia Udang
Analisis Proksimat Jenis Udang
Windu Vannamei
Protein (mg/g) 11,41 ±0,183 19,99±0,74
Karbohidrat (mg/g) 1,55 ±0,070 ±
Lemak (%) 10,66 ±0,333 1,34±0,18
Air (%) 80,89 ±0,175 73,14±1,23
Kadar Abu (mg/g) 2,20±0,88
2. Kemunduran Mutu Pasca Panen Udang Vannamei
Proses kemunduran mutu pada udang terjadi karena adanya aktivitas
enzim, mikroorganisme atau oksidasi oksigen. Setelah udang mati, berbagai
proses perubahan fisik maupun kimiawi berlangsung lebih cepat. Semua
perubahan ini akhirnya mengarah ke pembusukan.
Pada saat ditangkap, udang masih bernafas hingga beberapa waktu
kemudian. Seluruh jaringan peredaran darah udang masih mampu menyerap
26
Menurut Huss (1995) perubahan yang paling dramatis adalah rigor mortis.
Segera setelah kematian otot benar-benar santai dan tekstur elastis lemas biasanya
berlangsung selama beberapa jam, setelah itu otot akan berkontraksi. Otot udang
menjadi keras dan kaku, seluruh tubuh menjadi tidak fleksibel pada fase rigor
mortis. Kondisi ini biasanya berlangsung selama satu hari atau lebih dan
kemudian kekakuan selesai. Resolusi rigor mortis membuat otot rileks lagi dan itu
menjadi lemas, tetapi tidak lagi sebagai elastis seperti sebelum kekakuan. Tingkat
onset dan resolusi kekakuan bervariasi dari spesies ke spesies dan dipengaruhi
oleh suhu, penanganan, ukuran dan kondisi fisik udang.
Autolisis berarti " pencernaan- sendiri ". Telah diketahui selama
bertahun-tahun bahwa setidaknya ada dua jenis pembusukan ikan: bakteri dan enzimatik.
Autolisis kontribusi untuk berbagai tingkat hilangnya kualitas keseluruhan di
samping proses mikroba-dimediasi. Produksi energi di otot post mortem
Pada titik kematian, pasokan oksigen ke jaringan otot terganggu karena darah
tidak lagi dipompa oleh jantung dan tidak diedarkan. Karena tidak ada oksigen
yang tersedia untuk respirasi normal, produksi energi dari nutrisi yang tertelan
sangat dibatasi. Glikogen (disimpan karbohidrat) atau lemak teroksidasi atau
"terbakar" oleh enzim jaringan dalam serangkaian reaksi yang akhirnya
menghasilkan karbon dioksida (CO2), air dan organik senyawa adenosin trifosfat
kaya energi (ATP). Jenis respirasi berlangsung dalam dua tahap: anaerobik dan
tahap aerobik. Yang terakhir tergantung pada kehadiran lanjutan oksigen (O2)
yang hanya tersedia dari sistem peredaran darah. Kebanyakan krustasea mampu
bernapas di luar lingkungan air dengan penyerapan oksigen atmosfer untuk waktu
27
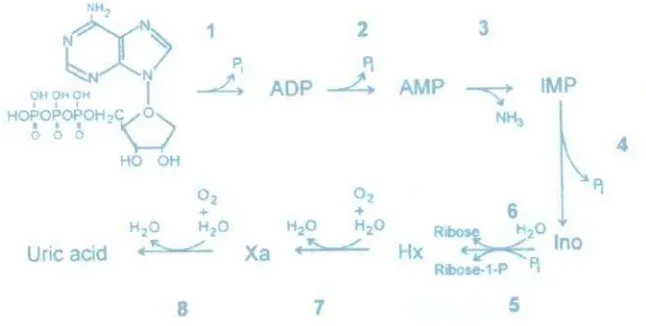
Gambar 6. Degradasi ATP pada udang.
Sumber : Gill (1992) dalam Sriket (2006).
Penurunan post mortem di pH otot ikan memiliki efek pada sifat fisik otot.
Setelah pH turun, jumlah permukaan bersih dari protein otot berkurang,
menyebabkan sebagian otot terdenaturasi dan kehilangan kapasitas daya ikat air.
Jaringan otot dalam keadaan rigor mortis kehilangan kelembaban ketika dimasak
dan sangat cocok untuk diproses lebih lanjut yang melibatkan pemanasan, karena
denaturasi panas meningkatkan kehilangan air. Kehilangan air memiliki efek yang
merugikan pada tekstur otot udang. Menurut Nurmeilita Taher (2010), perubahan
tekstur daging menjadi lunak disebabkan terjadinya perombakan pada jaringan
otot daging oleh proses enzimatis.
Pengurangan trimetilamin oksida (TMAO), suatu senyawa osmoregulatory di
banyak ikan teleost laut, biasanya karena aksi bakteri tetapi dalam beberapa
spesies enzim hadir dalam jaringan otot yang mampu memecah TMAO menjadi
dimetilamina ( DMA) dan formaldehid (FA):
28
Jumlah formaldehida dihasilkan setara dengan dimetilamine tetapi terbentuk
perubahan komersial penting yang jauh lebih besar. Formaldehida menginduksi
silang dari protein otot membuat otot mudah kehilangan daya ikat airnya. Enzim
yang bertanggung jawab untuk finduksi disebut TMAO-ase atau TMAO
demethylase. Sebagian besar enzim demethylase TMAO dilaporkan sampai saat
ini terikat membran dan menjadi yang paling aktif ketika membran jaringan
terganggu dengan pembekuan atau artifisial oleh deterjen solubilisasi. Hal tersebut
didukung oleh pendapat Pardio, et al (2010) bahwa Trimetilamina oksida (TMAO), ditemukan di sebuah besar jumlah ikan laut dan kerang, dipecah
menjadi trimetilamina (TMA) oleh salah satu enzim endogen atau bakteri enzim
trimetilamina oksidase.
Di perairan tercemar, Enterobacteriaceae dapat ditemukan dalam jumlah tinggi. Di perairan beriklim bersih, organisme ini hilang dengan cepat, tetapi telah
menunjukkan bahwaEscherichia colidanSalmonelladapat bertahan untuk waktu yang sangat lama di perairan tropis.
Daging ikan hidup atau baru-tertangkap sehat adalah steril sebagai sistem
kekebalan tubuh ikan mencegah bakteri tumbuh di dalam daging. Ketika ikan
mati, sistem kekebalan tubuh runtuh dan bakteri berkembang biak secara bebas.
Tidak ada perbedaan yang ditemukan dalam pola invasif bakteri tertentu
pembusukan (misalnya, S. putrefaciens) dan bakteri non-pembusukan. Karena hanya sejumlah organisme sebenarnya menyerbu daging dan pertumbuhan
mikroba terutama terjadi di permukaan, pembusukan mungkin untuk sebagian
besar konsekuensi dari enzim bakteri menyebar ke dalam daging dan nutrisi
29
Pada suhu kamar (25 ° C), mikroflora pada titik pembusukan didominasi
oleh mesofilik Vibrionaceae dan, terutama jika ikan yang ditangkap di perairan tercemar, Enterobacteriaceae. Sulit untuk menentukan dari mana bakteri yang diisolasi yang menyebabkan pembusukan, dan memerlukan studi luas mengenai
sensorik, mikrobiologi dan kimia.
Perbandingan senyawa kimia berkembang pada udang yang telah mati
menunjukkan bahwa sebagian besar senyawa volatil diproduksi oleh bakteri
termasuk trimetilamina, senyawa belerang yang mudah menguap, aldehid, keton,
ester, hipoksantin serta senyawa dengan berat molekul rendah lainnya.
Substrat untuk produksi volatil adalah karbohidrat (misalnya, laktat dan ribose),
nukleotida (misalnya, inosin mono-fosfat dan inosin) dan molekul lainnya NPN.
Asam amino merupakan yang substrat sangat penting untuk pembentukan sulfida
dan amonia yang menyebabkan penurunan penerimaan konsumen secara sensori.
Mikroorganisme akan mengubah struktur protein selama penyimpanan dan akan
menghasilkan bau yang tidak menyenangkan (Hastarini,et al2014).
3. Prosedur Penanganan Pasca Panen Udang Vannamei
Penanganan pasca panen adalah penanganan yang dilakukan terhadap hasil
budidaya ataupun tangkapan setelah kegiatan panen. Tujuan kegiatan penanganan
ini adalah mempertahankan mutu hasil panen sampai ke tahap distribusi kepada
konsumen. Udang merupakan salah satu produk perikanan yang mudah busuk
atau rusak oleh karena itu proses penanganan udang perlu dilakukan lebih cepat
agar memperoleh harga jual yang tinggi. Harga udang akan merosot tajam apabila
30
Tahapan yang dianjurkan bagi penanganan pasca panen udang segar adalah
sebagai berikut (Ilyas, 1993) :
a. Sortasi, memilih udang dan memisahkannya dari hasil tangkapan samping
lainnya
b. Pencucian, dengan air laut bersih atau air tawar mutu air minum
c. Pemotongan kepala atau operasi penyiangan lainnya Pencucian
d. Perlakuan pencelupan, untuk menghambat pembentukan bercak hitam
e. Pendinginan, menurunkan suhu udang segera mencapai 0ºC sampai -1ºC
dengan menggunakan hancuran es halus, atau air laut atau air tawar yang
didinginkan
f. Penyimpanan dingin (pada sekitar 0ºC sampai -1ºC) dan transportasi
dingin selama udang itu dipasarkan segar atau selama mengangkutnya ke
pabrik pengolahan beku (cold storage).
Selama kegiatan penanganan pasca panen, udang segar dapat
terkontaminasi. Kontaminasi ini baik secara mikrobiologi, kimia, maupun fisik.
Pemerintah maupun negara pengimpor udang segar mensyaratkan udang segar
yang diproduksi harus bebas kontaminan, seperti Salmonella, Escherichia coli, Vibrio Harveyi (mikrobiologi), kloramfenikol, nitrofuran, tetrasiklin dan antibiotik lain (kimia), besi, rambut, kayu dll (fisik) (Badan Standardisasi
Nasional, 2006).
4. Standar Mutu Udang Segar
Standar mutu udang segar menurut SNI 01-2728.1-2006 untuk persyaratan
31
Tabel 5. Persyaratan Mutu dan Keamanan Pangan Udang Segar
Jenis Uji Satuan Persyaratan
a. Organoleptik Angka (1-9) Minimal 7 b. Cemaran mikroba*
- ALT
- Escherichia coli - Salmonella - Vibrio cholerae
Koloni/g APM/g APM/25g APM/25g
Maksimal 5,0x105 Maksimal < 2 Negatif Negatif c. Cemaran kimia*
- Kloramfenikol - Nitrofuran - Tetrasiklin
µg/kg µg/kg µg/kg
Maksimal 0 Maksimal 0 Maksimal 100
d. Filth - Maksimal 0
32
`
III. METODE
A. Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Mikrobiologi Hasil Pertanian
Jurusan THP, Laboratorium Hama dan Penyakit Ikan SUPM N Kotaagung serta
Laboratorium Kualitas Air SUPM N Kotaagung pada bulan Juli 2014 - Desember
2015.
B. Bahan dan Alat
Bahan yang digunakan adalah udang vannamei dengan kisaran size 40-65
yang diperoleh dari Tambak Udang di Kecamatan Rawa Jitu Timur, Tambak
Udang di Kecamatan Padang Cermin, Tambak Udang di Kecamatan Kotaagung
dan Tambak Udang di Kecamatan Wonosobo., es, alkohol, spiritus, Media NA,
Media NB, Media SSA, Media XLD, Media SM, Soft Agar, Pengencer BPW.
Alat yang digunakan meliputi refrigerator, erlenmeyer, falcon, tabung durham,
petri dish, eppendorf, saringan milipore 0.22, gelas sampel, masker, kapas, tisu,
karet, sarung tangan karet, plastik tahan panas, timbangan, sentrifuge, stryrer,
incubator, laminar, jarum ose, syringe, shaker waterbath, mikropipet.
C. Metode Penelitian
Penelitian ini dilakukan dalam 2 tahap, yaitu penelitian tahap 1 dan
33
udang Vannamei, Isolasi Bakteri Salmonella dan pengujian organoleptik udang Vannamei. Penelitian tahap 2 meliputi Isolasi bakteriofage dengan mengikuti
metode yang digunakan Sartika (2012). Data yang diperoleh diolah dalam bentuk
tabel dan grafik. Hasil penelitian dipaparkan menggunakan metode deskriptif.
D. Pelaksanaan Penelitian
Prosedur Penelitian tahap 1
Penelitian dilaksanakan dengan pengambilan sampel di empat tempat,
yaitu Tambak Udang di Kecamatan Rawa Jitu Timur, Tambak Udang di
Kecamatan Padang Cermin, Tambak Udang di Kecamatan Kotaagung dan
Tambak Udang di Kecamatan Wonosobo. Sampel yang diambil adalah udang
vannamei dan air media hidup udang vannamei. Sampel diambil dari lokasi dan
disimpan dalam coolbox dan diberi es sehingga dapat dipertahankan pada suhu
rendah.
1. Identifikasi cemaranSalmonelladengan Uji Organoleptik
Sampel yang diambil dilakukan pengujian organoleptik. Pengujian
organoleptik dilakukan dengan cara sampel diambil sebanyak minimal 25 gr lalu
dilakukan penilaian secara organoleptik oleh 5 orang panelis. Score sheet yang
digunakan sesuai dengan SNI 01-2728.1 2006 (. Kriteria yang digunakan dapat
dilihat pada tabel 4). Pengujian dilakukan pengulangan masing-masing 3 ulangan.
Data yang diperoleh meliputi kriteria kenampakan, bau dan tekstur diolah
dalam bentuk tabel. Hasil pengujian kemudian dihitung rata-ratanya sesuai dengan
34
disajikan dalam bentuk tabel rata-rata Uji Organoleptik terhadap udang vannamei.
[image:55.595.111.526.165.526.2]Hasil penelitian dipaparkan menggunakan metode deskriptif.
Tabel 6. Kriteria Penilaian Organoleptik Udang Segar
SPESIFIKASI NILAI
1 Kenampakan
• Utuh, bening bercahaya asli meurut jenis, antar ruas kokoh 9
• Utuh, kurang bening, cahaya mulai pudar, berwarna asli, antar ruas kokoh
• Utuh, kebeningan agak hilang, sedikit kusam, antar ruas kurang kokoh
7
• Utuh, kebeningan hilang, kusam, warna agak mera muda, sedikit noda hitam, antar ruas kurang kokoh
5
• Warna merah, noda hitam banyak, kulit mudah lepas dari daging 3
• Warna merah sangat kusam, banyak sekali noda hitam 1
2 Bau
• Bau sangat segar spesifik jenis 9
• Bau segar spesifik jenis 8
• Bau spesifik jenis netral 7
• Mulai timbul bau amoniak 5
• Bau asam sulfit (H2S) 3
• Bau amoniak kuat dan bau busuk 1 3 Tekstur
• Sangat elastis, kompak dan padat 9
• Elastis, kompak dan padat 8
• Kurang elastis, kompak dan padat 7
• Tidak elastis, tidak kompak dan tidak padat 5
• Agak lunak 3
• Lunak 1
Rumus yang digunakan dalam menghitung rata-rata adalah sebagai
berikut:
( (1,96. s/ )) ( + 1,96. / ) 95%
35
= (x x)
n
= (x x)
Dengan :
N adalah banyaknya panelis S2adalah keragaman nilai mutu
1,96 adalah koefisien standar deviasi pada taraf 95% adalah nilai mutu rata-rata
Untuk penulisan nilai akhir organoleptik udang segar diambil nilai terkecil.
2. Identifikasi dan IsolasiSalmonella
IsolasiSalmonelladilakukan dengan mengambil sampel sebanyak 25 gram untuk ditambahkan 225 ml media preenrichment buffer peptone water (BPW), selanjutnya dilakukan pengenceran bertahap dengan memindahkan 1 ml larutan ke
dalam 9 ml BPW dalam tabung reaksi dan tiap pengenceran ditanam pada media
XLD dan diinkubasikan pada suhu 37oC selama 24 jam. Koloni yang tumbuh dimurnikan pada media XLD, diinkubasi 37oC selama 24 jam. Pada saat diperoleh
isolatSalmonella,akan dipilih yang paling stabil, tidaksmear,warna koloni hitam mengkilat dan isolat tersebut yang akan digunakan sebagai inang untuk isolasi
bakteriofage. Selanjutnya dilakukan isolasi bakteriofage dari isolat Salmonella
yang diperoleh.
Penelitian tahap 2
36
waterbath pada suhu ±37oC selama 24-48 jam. Larutan selanjutnya disentrifuse dengan kecepatan 2500 rpm selama 20 menit dan disaring menggunakan syringe
filter 0.22 µl. Sejumlah 100 µl filtrat divortek dengan 5 ml NB, dan diinkubasikan
selama 15 menit. Selanjutnya dilakukan pembiakan dengan metode double overlaydengan media NA dan diinkubasikan selama 24 jam. Bakteriofage efektif melisiskan Salmonella jika timbul plak (zona bening). Data yang diperoleh lalu diolah dalam bentuk tabel dan hasilnya disajikan dalam bentuk deskriptif.
37
Gambar 7. Flowchart Penelitian
Udang
Terdeteksi
Pengambilan Sampel
Identifikasi cemaranSalmonella
dengan uji mikrobiologi
IsolasiSalmonella
Cemaran
Isolat Salmonella Tid