Kontruksi Gen Cp Cmv Pada Agrobacterium
Fenomena serangan virus kompleks (dengan gejala keriting) pada tanaman cabai merupakan masalah yang telah lama dihadapi para petani cabai di Indonesia. Usaha untuk mendapatkan varietas cabai yang tahan (resisten) terhadap infeksi virus telah dilakukan, baik dengan teknik pemuliaan (seleksi dan persilangan) maupun dengan teknik rekayasa genetika. Virus-virus utama yang menginfeksi tanaman cabai adalah virus mosaic ketimun (CMV), virus etch tembakau (TEV), virus mosaic tembakau (TMV), virus Y kentang (PVY), dan chilli veinal mosaic virus (CVMV).
Tanaman cabai transgenic yang mengandung gen ketahanan virus (coat protein PVY/CP PVY) telah diperoleh dan diuji ketahanannya. Begitu pula sejumlah varietas dan galur tanaman cabai yang mempunyai ketahanan alamiah (natural resistant) dengan berbagai karakter agronomis yang diperlukan telah diuji dan dikoleksi. Penggabungan tanaman cabai tahan virus hasil rekayasa genetika dan galur cabai dengan ketahanan alamiah serta galur cabai dengan karakter unggul (hight yielding) menjadi suatu tanaman hibrida transgenik tahan virus dengan daya hasil tinggi akan sangat berguna untuk penghembangan pertanian di Indonesia, khususnya untuk budidaya tanaman cabai.
Metode introduksi gen ke dalam tanaman cabai dan teknik regenerasi tanaman cabai transgenik in vitro dengan bantuan Agrobacterium tumefaciens telah dikembangkan dan dibakukan oleh peneliti pengusul. Dengan demikian, dua kunci dalam teknik rekayasa genetika tanaman cabai sudah tidak menjadi masalah. Salah satu kunci lagi adalah tersedianya gen komersial yang secara ekonomis penting dan siap diintroduksikan ke dalam genom tanaman cabai. Salah satu gen tersebut adalah gen ketahanan terhadap virus mosaik ketimun (CMV) yang merupakan salah satu virus penyebab penyakit virus kompleks pada tanaman cabai.
Pada bagian penelitian ini akan dilakukan pekerjaan isolasi, kloning, dan kontruksi gen ketahanan terhadap CMV (gen CP CMV). Gen ketahanan yang diperoleh akan diintroduksikan ke dalam genom tanaman cabai dengan menggunakan metode yang telah dihasilkan dalam penelitian sebelumnya oleh peneliti pengusul. Selanjutnya tanaman cabai transgenik yang diperoleh diuji sifat-sifat dengan analisis molekuler (Uji Southern Blot, PCR), uji biokimia, uji resistensi terhadap strain-strain CMV dan virus-virus utama yang menginfeksi tanaman cabai.
dilakukan, baik dengan teknik pemuliaan (seleksi dan persilangan) maupun dengan teknik rekayasa genetika. Virus-virus utama yang menginfeksi tanaman cabai adalah virus mosaic ketimun (CMV), virus etch tembakau (TEV), virus mosaic tembakau (TMV), virus Y kentang (PVY), dan chilli veinal mosaic virus (CVMV).
Tanaman cabai transgenic yang mengandung gen ketahanan virus (coat protein PVY/CP PVY) telah diperoleh dan diuji ketahanannya. Begitu pula sejumlah varietas dan galur tanaman cabai yang mempunyai ketahanan alamiah (natural resistant) dengan berbagai karakter agronomis yang diperlukan telah diuji dan dikoleksi. Penggabungan tanaman cabai tahan virus hasil rekayasa genetika dan galur cabai dengan ketahanan alamiah serta galur cabai dengan karakter unggul (hight yielding) menjadi suatu tanaman hibrida transgenik tahan virus dengan daya hasil tinggi akan sangat berguna untuk penghembangan pertanian di Indonesia, khususnya untuk budidaya tanaman cabai. Selain itu, pengembangan varietas cabai hibrida transgenic tahan virus diharapkan dapat melindungi intellectual property right (IPR).
Metode introduksi gen ke dalam tanaman cabai dan teknik regenerasi tanaman cabai transgenik in vitro dengan bantuan Agrobacterium tumefaciens telah dikembangkan dan dibakukan oleh peneliti pengusul. Dengan demikian, dua kunci dalam teknik rekayasa genetika tanaman cabai sudah tidak menjadi masalah. Salah satu kunci lagi adalah tersedianya gen komersial yang secara ekonomis penting dan siap diintroduksikan ke dalam genom tanaman cabai. Salah satu gen tersebut adalah gen ketahanan terhadap virus mosaik ketimun (CMV) yang merupakan salah satu virus penyebab penyakit virus kompleks pada tanaman cabai.
Pada bagian penelitian ini akan dilakukan pekerjaan isolasi, kloning, dan kontruksi gen ketahanan terhadap CMV (gen CP CMV). Gen ketahanan yang diperoleh akan diintroduksikan ke dalam genom tanaman cabai dengan menggunakan metode yang telah dihasilkan dalam penelitian sebelumnya oleh peneliti pengusul. Selanjutnya tanaman cabai transgenik yang diperoleh diuji sifat-sifat dengan analisis molekuler (PCR), uji biokimia, uji resistensi terhadap strain-strain CMV dan virus-virus utama yang menginfeksi tanaman cabai.
Tujuan Tujuan penelitian adalah :
1. Menyediakan gen anti virus CMV (gen CP CMV)
2. Menghasilkan vektor transforman yang mengandung gen CP CMV
3. Menghasilkan planlet tanaman cabai transgenik yang mengandung gen CP CMV.
TINJAUAN PUSTAKA Virus Mosaik Ketimun
Sifat fisik CMV adalah sebagai berikut : titik panas inaktifasi antara 50 sampai 55
0
C, titik batas pengenceran antara 1 : 2 000 dan 1 : 3 000. Ketahanan cairan perasannya antara 2 sampai 3 hari, tetapi jika disimpan dalam lemari es bersuhu 5 0C kemampuan infeksinya bertahan antara 5 sampai 6 hari (Sugiura, Bandaranayake, and Hemachandra, 1975).
Pemuliaan Cabai Tahan Virus
Pemuliaan tanaman merupakan suatu usaha untuk memperbaiki sifat atau bentuk tanaman. Proses pemuliaan tanaman biasanya diawali dengan mendapatkan variabilitas genetik, melakukan kegiatan seleksi terhadap sumber genetik tersebut, melakukan persilangan-persilangan dan seleksi lanjutan. Hal ini menjadi masalah bila sifat yang diinginkan tidak terdapat pada sumber genetik tersebut, maka harus dicari dari sumber genetik lainnya. Telah dibuktikan bahwa teknik rekayasa genetik merupakan salah satu cara yang menjanjikan untuk mendapatkan tanaman yang resisten terhadap penyakit virus. Gen ketahanan tersebut berasal dari virus sendiri, yaitu gen CP CMV dang gen tersebut dapat dimasukkan ke dalam genom tanaman cabai.
Keperluan akan varietas cabai yang bermutu, terutama yang mempunyai ketahanan terhadap penyakit virus sangat diperlukan dan dirasakan sangat mendesak. Telah pula diketahui bahwa pengendalian penyakit infeksi yang terbaik adalah dengan menggunakan varietas yang resisten. Menurut Hull (1990), terdapat tiga pendekatan untuk mencegah penurunan produksi skibat serangan virus, yaitu : (1) menghilangkan sumber infeksi, (2) mencegah penyebaran virus, dan (3) menggunakan varietas yang tahan. Penggunaan varietas tahan mempunyai keunggulan, yaitu secara ekonomi paling baik untuk petani, berwawasan lingkungan (mengurangi penggunaan pestisida), dan efektif untuk jangka panjang.
Penggunaan gen pembungkus protein (gen CP) untuk pengendalian virus pertama kali dilaporkan oleh Powell-Abel et al. (1986) pada tanaman tembakau. Tanaman tembakau yang mengandung dan mengekspresikan gen CP TMV dapat menghambat infeksi virus TMV. Nelson et al. (1988) bahkan telah melakukan percobaan lapang terhadap tomat transgenik yang mengandung gen CP TMV. Sejak laporan tersebut, berbagai tanaman transgenic yang mengandung berbagai gen CP telah diregenerasikan dan diuji resistensinya terhadap infeksi virus. Diantaranya adalah resistensi TMV pada tomat, resistensi AlMV pada alfalfa, resistensi PVY pada kentang dan tembakau, resistensi PStV pada kacang tanah, dan berbagai resistensi lain pada tanaman yang berbeda. Resistensi terhadap penyakit virus tanaman telah direview secara vekstensif oleh Grumet (1990), dan Hull (1990).
Tiga komponen kunci rekayasa genetik untuk mendapatkan tanaman cabai transgenik tahan virus adalah : (1) tersedianya gen antivirus (gen CP CMV), (b) tersedianya cara introduksi gen CP ke dalam genom tanaman cabai dan regenerasi cabai transgenik, serta (c) ekspresi gen CP pada tanaman transforman.
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian disain primer oligonukleotida gen CP CMV, isolasi dan ekstraksi RNA CMV, proses RT-PCR CP CMV, kloning dan konstruksi gen CP CMV pada plasmid vektor, transformasi plasmid rekombinan, seleksi klon positif dan konstruksi vektor transformasi dilaksanakan di Laboratorium Virologi Jurusan Ilmu Hama dan Penyakit Tumbuhan Fakultas Pertanian, Institut Pertanian Bogor mulai bulan Juli sampai dengan bulan November 2004.
Bahan dan Alat
Bahan yang digunakan adalah primer spesifik berdasarkan urutan nukleotida spesifik CP CMV, vektor plasmid, vektor transformasi, enzim restriksi, enzim ligasi, E. Coli DH5 , primer M13, pCAMBIA 1301, pCAMBIA 1304, Agrobacterium EHA101,
Metode Penelitian
a. Disain Primer oligonukleotida gen CP CMV
Disain primer oligonukleotida gen CP CMV spesifik sebanyak 20 pasang basa dirancang berdasarkan urutan nukleotida spesifik CP CMV yang telah dipublikasikan (Namba et al., 1991). Untuk itu digunakan data dasar urutan nukeotida dari CP CMV dan akan ditentukan sekuen yang spesifik untuk CP CMV. Selain itu, prosedur ini akan membantu untuk mengoptimalkan proses pembentukan cDNA CP CMV dengan teknik RT-PCR.
Tabel 1. Primer Spesifik yang Digunakan untuk Mengamplifikasi CP CMV (Namba et al., 1991).
Primer Urutan Nukleotida
Primer F 5’ AGCTAACCATGGACAAATCTGGATGTCCCAAT 3’
Primer R 5’ AGCATTCCATGGGGCAGTTTGAAGCAATACTACC 3’
b. Ekstraksi RNA total dari sampel tanaman
Daun tanaman tembaku terinfeksi CMV 0.1 g digerus dalam 600 µl larutan (3 ml STE 2X, 0.03 g SDS, dan 30 µl mercaptoethanol sampai hancur dan larut. Larutan sap yang diperoleh disentrifugasi pada 12 000 rpm pada suhu 4 0C selama 5 menit. Supernatan diambil 200 µl dan ditambah 200 µl PCI, divorteks sampai homogen dan kemudian disentrifugasi 12 000 rpm selama 5 menit (diulang sampai 2 kali). Supernatan sebanyak 200 µl dan ditambahkan 200 µl chloroform, divorteks sampai homogen dan kemudian disentrifugasi 12 000 rpm selama 5 menit (diulang sampai 2 kali). Supernatan yang diperoleh ditambah 0.1 volume supernatan dengan 3M NaOc dan tiga kali volume supernatan dengan larutan ethanol 99% dingin. Setelah dibolak-balik suspensi disimpan pada -200C selama 2 jam. Selanjutnya disentrifugasi 12 000 rpm selama 5 menit pada suhu 40C. Pelet yang diperoleh dicuci dengan 150 µl ethanol 70% dingin, kemudian disentrifugasi 12 000 rpm selama 5 menit pada suhu 40C. Ethanol diambil secara perlahan dan dicakum sampai kering selama 20 menit, kemudian ditambahkan 10 µl aquabidest. Setelah divorteks sampai larut, suspensi RNA dipindahkan ke PCR tube dan siap digunakan untuk RT-PCR atau disimpan pada suhu -200C.
c. Proses RT-PCR CP CMV.
Proses RT-PCR (reverse transcription polymerase chain reaction) atau reaksi transkripsi balik dilakukan menurut Bohringer Mannheim RT-PCR kit. Komposisi yang dibuat dalam RT-PCR adalah 5 µl RNA hasil ekstraksi, satu PCR bead 50 µl, 1.0 µl primer F, 1.0 µl primer R, dan 43 µl aquabidest. Inkubasi dilakukan pada suhu 950C selama 5 menit untuk denaturasi, kemudian dilanjutkan pada suhu 420C selama 1 jam untuk reaksi pemanjangan untai cDNA bayangan dari RNA genom virus.
satu siklus untuk ektensi akhir pada 720C selama 5 menit. Hasil amplifikasi PCR dengan pasangan primer yang digunakan diperkirakan sekitar pada bagian CP CMV.
Setelah amplifikasi dilakukan, sekitar 10-15 µl produk PCR diseparasi dengan elektroforesis pada 1.2% agarose dalam buffer TBE (90 mM Tris-borate, pH 8.0). Setelah elektroforesis gel distaining dengan ethidium bromide dan divisualisasi dengn UV transilluminator.
d. Kloning dan Konstruksi Gen CP CMV pada Plasmid Vektor.
Kloning bertujuan untuk memperoleh klon bakteri yang mengandung plasmid rekombinan antara cDNA CP CMV dengan plasmid vektor. Awal kloning cDNA CP CMV dilakukan dengan meligasikannya ke dalam plasmid vektor. Plasmid vektor yang digunakan adalah pGEM-T Easy berukuran 3018 bp (Promega) yang mempunyai kelebihan nukleotida T (T-overhang) pada kedua ujung situs kloning. Ligasi fragmen cDNA CP CMV pada plasmid vector dilakukan untuik membentuk rekombinan plasmid yang terdiri atas DNA plasmid dan cDNA CP CMV. Prosedur ligasi dilakukan mengikuti prosedur pGEM-T Easy dengan komposisi reaksi ligasi untuk 10 ul adalah 7 ul cDNA CP CMV, 1 ul 10 x buffer ligasi, 1 ul plasmid vektor pGEM-T Easy. Campuran tersebut diinkubasikan semalam pada suhu 10 0C.
e. Transformasi Plasmid Rekombinan.
Transformasi plasmid rekombinan ke dalam Escherichia coli DH5a yang kompeten (Max Efficiency). Prosedur transformasi adalah : 2 ul larutan hasil ligasi ditambahkan 50 ul sel E. coli yang kompeten, dan diinkubasikan selama 20 menit dalam es, perlakuan panas (heat shock) selama 50 detik pada suhu 42 0C dan segera dikembalikan lagi ke dalam es selama 2 menit. Kemudian ditambahkan 950 ml media SOC dan diinkubasikan selama 1.5 jam pada suhu 37 0C sambil digoyang dengan kecepatan 200 rpm. Sebanyak 100 ml dari kultur cair bakteri tersebut dikulturkan pada media seleksi LB yang mengandung ampisilin dan X-gal, serta diinkubasikan selama 12 jam pada suhu 37 0C.
f. Seleksi Klon Positif.
Klon positif (koloni berwarna putih) diseleksi menggunakan teknik (Thompson & Dietzgen, 1997). Satu koloni diambil dengan tusuk gigi steril dan diresuspensikan ke dalam 10 ul air steril. Reaksi campuran konsentrasi akhir mengandung 0.2 mM dNTP, 1.5 unit Taq polymerase, 1 uM reverse dan forward primer, dan akuabides ditambahkan sehingga volume akhir 24 ul. Reaksi PCR dilakukan pada mesin PCR Perkin Elmer 4800 dengan siklus 94 0C selama 1 menit, 25 siklus 94 0C selama 10 detik, 50 0C selama 20 detik, dan 72 0C selama 60 detik sebelum didinginkan sampai 15 0C. Produk amplifikasi dideteksi dengan elektroforesis gel agarosa untuk melihat adanya insersi dan ukuran DNA.
g. Konstruksi Vektor Transformasi.
tumefeciens strain EHA101 dan EHA105 dengan system tri parental mating dengan menggunakan bantuan bakteri penolong HB101 (pRK2013). Selanjutnya baklteri diseleksi dengan menggunakan antibiotik penyeleksi.
HASIL DAN PEMBAHASAN
Optimasi RT-PCR CP CMV
Sebelum amplifikasi dilaksanakan dengan menggunakan primer spesisifik terhadap CP CMV perlu dilakukan kegiatan optimasi RT-PCR CP CMV untuk mendapatkan kondisi optimum proses amplifikasi.
Komposisi yang dibuat dalam RT-PCR adalah 5 µl RNA hasil ekstraksi, satu PCR bead 50 µl, 1.0 µl primer F, 1.0 µl primer R, dan 43 µl aquabidest. Inkubasi dilakukan pada suhu 950C selama 5 menit untuk denaturasi, kemudian dilanjutkan pada suhu 420C selama 1 jam untuk reaksi pemanjangan untai cDNA bayangan dari RNA genom virus.
Kondisi PCR dilakukan dalam volume 50 µl dengan siklus sebagai berikut : satu siklus pada 42 0C selama 60 menit untuk pra PCR, satu siklus untuk denaturasi inisiasi pada 950C selama 5 menit, 30 siklus untuk denaturasi pada 940C selama 30 detik, annealing 500C selama 30 detik, dan ekstensi 720C selama 1 menit, serta satu siklus untuk ektensi akhir pada 720C selama 5 menit. Hasil amplifikasi PCR dengan pasangan primer yang digunakan diperkirakan sekitar 760 bp bagian lengkap CP CMV.
Kloning dan Kontruksi Gen CP CMV
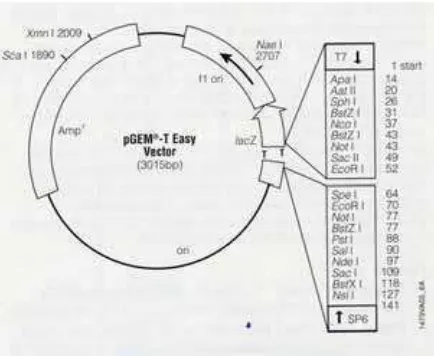
Hasil RT-PCR CP CMV selanjutnya dikloning ke dalam vektor pGEM-T Easy (Promega). Peta plasmid pGEM-T Easy (Promega) dan sekuen pemotongan serta tempat insersi cDNA CP CMV disajikan pada Gambar 1. Proses kloning cDNA CP CMV ke dalam plasmid pGEM-T Easy (Promega) dilakukan dengan proses ligasi dan selanjutnya ditransfromasi ke dalam E. coli DH5α yang kompeten (Max Efficiency).
Komposisi ligasi cDNA CP CMV ke dalam Vektor pGEM-T Easy (Promega) disajikan pada Tabel 1.
Tabel 2. Komposisi Ligasi cDNA CP CMV ke dalam Vektor pGEM-T Easy (Promega)
Pelaksanaan transformasi c-DNA CP CMV ke dalam E . coli DH5α yang kompeten (Max Efficiency) dilakukan dengan teknik heat shock. Bakteri hasil transformasi, selanjutnya diseleksi pada media seleksi LB yang mengandung ampisilin dan X-gal, serta diinkubasikan selama 12 jam pada suhu 37 0C. Seleksi dilakukan dengan
blue white assay (Thompson & Dietzgen, 1997).
Kegiatan untuk pembuatan kompeten sel E . coli DH5α E . coli DH5α dilaksanakan sebagai berikut : (1) Ditumbuhkan 1 koloni E. coli DH5α pada 10 ml medium LB cair, inkubasi semalam (max 16 jam) 37°C, (2) Subkulturkan 400 µl ke medium LB baru (10 ml), inkubasi 37°C 150 rpm, (3) Dipindahkan ke dalam mikrotube 1,5 ml, (4) Disimpan di es selama 10 menit, (5) Sentrifusi 5000 rpm selama 1 menit, (6) Buang supernatan, (7) Cuci dengan 1 ml CaCl2 0,1 M dingin, (8) Simpan dies selama 15
menit, (9) Sentrifusi 5000 rpm selama 1 menit, (10) Buang supernatant, dan (11) Resuspensi pellet dengan 200 µl CaCl2 0,1 M.
Selanjutnya dilakukan pemeotongan dengan enzim NcoI, hasil pemotongan selanjutnya disekuen dengan perantara M13 primer untuk meyakinkan bahwa cDNA yang dikloning mempunyai sekuens yang sesuai dan lengkap serta untuk mengetahui orientasi gen CP CMV yang diinsersikan.
Kontruksi Vektor Transformasi
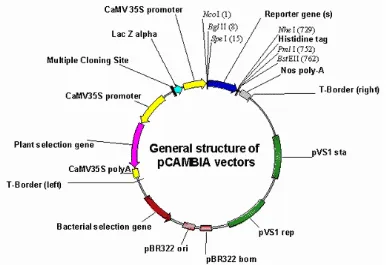
Gambar 3. Struktur Umum Kontruksi Vektor pCAMBIA
Kozak consensus
Ter S/D Initiator
BamHI SmaI BseRI NcoI BglII SpeI f
5’-GGATCCCCCGGGTAAGAGGAGTCCACC ATGGTA GAT CTG ACT AGT YOU RFA VOU *** M V D L T S X X X
Hexa-Histidine Tag Ter
NheI PmlI BstEII
RIT EGE NE! GCT AGC CAC CAC CAC CAC CAC CAC GTG TGAATTGGTGACC-3’ X X X A S H H H H H H V ***
Kegiatan transformasi dilakukan sebagai berikut : (1) Hasil ligasi dimasukkan ke dalam 100 µl kompeten sel, (2) Disimpan di es yang dihancurkan selama 30 menit, (3) Heat shock 42°C selama 90 detik, (4) Disimpan di es 2 menit, (5) Ditambah SOC sampai 1 ml, (6) Diinkubasi 37°C 150 rpm selama 90- menit, (7) Plating 100 µl dan 200 µl di medium LB +Amp+IPTG+X gal, dan (8) Inkubasi 37°C selama 16-18 jam.
Proses kontruksi dilakukan dengan mengisolasi plasmid pCAMBIA dan plasmid pGEM T-Easy yang mengandung insersi cDNA CP CMV dan kemudian dipotong dengan enzim NcoI. Hasil pemotongan kemudian diligasikan dengan enzim ligasi dan kemudian ditransformasikan ke dalam E. coli DH5α.
Karakteristik plasmid vektor transformasi yang digunakan pada penelitian disajikan pada Tabel 1.
Tabel 3. Karakteristik Vektor Transformasi pCAMBIA
1381Xa hptII kan pUC8 gusA - a FUV
1391Xa hptII kan pUC9 gusA - a FUV
1381Xb hptII kan pUC8 gusA - b FUV
1391Xb hptII kan pUC9 gusA - b FUV
1381Xc hptII kan pUC8 gusA - c FUV
1391Xc hptII kan pUC9 gusA - c FUV
1281Z hptII cmr pUC8 gusA 4984 lacZ PCV
1291Z hptII cmr pUC9 gusA 4984 lacZ PCV
1381Z hptII kan pUC8 gusA 4984 lacZ PCV
1391Z hptII kan pUC9 gusA 4984 lacZ PCV
Karakterisasi dari strain Agrobacterium EHA101 dan EHA105 yang digunakan pada penelitian disajikan pada Tabel 3.
Tabel 4. Karakterisasi Strain Agrobacterium EHA101 dan EHA105
Strain Agrobacterium Karakterisasi
EHA101
genotype C58 pTiBo542; T-region::aph, Km(R); A281 derivative harboring pEHA101, T-DNA replaced with nptII, elimination of T-DNA boundaries uncofirmed, super-virulent (Hood et al., 1986).
EHA105 is a Km(S) derivative of EHA101 (Hood et al., 1993)
KESIMPULAN
Pada kegiatan penelitian kontruksi gen CP CMV telah disediakan dengan lengkap semua bahan yang diperlukan, seperti primer spesifik untuk CP CMV, plasmid kloning pGEM-T Easy, vektor transformasi pCAMBIA 1301 dan 1304 yang mempunyai promotor kuat untuk tanaman (35S) dan terminator nos, bakteri penolong HB101 (pRK2013), A. tumefeciens strain EHA101 dan EHA105 serta telah dipelajari semua teknik yang diperlukan untuk kegitan penelitian.
DAFTAR PUSTAKA
Agrios, G.N. 1998. Plant Pathology. Academic Press. New York. 803p
Aaziz, R. and Tepfer, M. 1999. Recombination between genomic RNAs of two cucumoviruses under conditions of minimal selection pressure. Virology 263:282-289.
Allison, R. F., Thompson, G., and Ahlquist, P. 1990. Regeneration of a functional RNA virus genome by recombination between deletion mutants and requirement for cowpea chlorotic mosaic virus 3a and coat genes forsystemic infection. Proc. Natl. Acad. Sci. USA 87: 1820-1824.
Chupp, C. and A.F. Sherf. 1960. Vegetables diseases and their control. The Ronald Press Company. New York. 693p.
Ding, S.W., Anderson, B.J., Haase, H.R. and Symons, .RH. 1994. New overlapping gene encoded by the cucumber mosaic virus genome. Virology 198: 593-601
Doolittle, S.P. 1916. A new infectious mosaic disease of cucumber. Phytopathology 6: 145-147.
Francki, R.I.B., D.W. Mossop, and T. Hatta. 1979. Cucumber Mosaic Virus. CMI/AAB Descriptions of Plant Viruses, No.213.
Matthews, R.E.F. 2002. Plant Virology. Fourth Edition. Academic Press. London.
McNab, A.A., A.F. Sherf, and J.K. Springer. 1983. Identifying Diseases of Vegetables. The Pennsylvania State University.
Moorman, G.W. & Woodbridge, W.C. 1983. Morphogenesis cucumber mosaic virus induced chrystalline inclusion in pepper. Phytophatology. 73(8):1106-1108.
Murant, A.F. and A.M. Mayo. 1982. Satellites of plant viruses. Ann. Rev. Phytophatologi. 20:47-70.
Rybicki, E.P. 1995. The Bromoviridae. p. 450-457 In F. A. Murphy, C.M. Fauquet, D.H.L. Bishop, S.A. Ghabrial, A.W. Jarvis, G.P. Martelli, M.A. Summers (ed.) Virus Taxonomy, Sixth Report of the International Committee on Taxonomy of Viruses. Springer-Verlag Wien, New York, USA.
Peden, K.W.C. and Symons, R.H. 1973. Cucumber mosaic virus contains a functionally divided genome. Virology 53: 487-492.
Sugiura, M., Bandaranayake, C.M., & Hemachandra, G.H. 1975. Chilli Virus Diseases in Sri Lanka. Technic Bull. 8.TARC. 62p.
Suzuki, M., Kuwata, S., Kataoka, J., Masuta, C., Nitta, N. and Takanami, Y. 1991. Functional analysis of deletion mutants of cucumber mosaic virus RNA 3 using an in vitro transcription system. Virology 183: 106-113.