POTENSI BEBERAPA BAKTERI PENGHAMBAT
PERTUMBUHAN Xanthomonas oryzae pv. oryzae PENYEBAB
PENYAKIT HAWAR DAUN BAKTERI PADA TANAMAN
PADI
ZURAIDAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Potensi Beberapa Bakteri Penghambat Pertumbuhan Xanthomonas oryzae pv. oryzae Penyebab Penyakit Hawar Daun Bakteri pada Tanaman Padi adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Desember 2011
Zuraidah
NIM G351090141
ABSTRACT
ZURAIDAH. The Potency of Some Bacteria to Inhibit The Growth of
Xanthomonas oryzae pv. oryzae Causing Rice Bacterial Leaf Blight. Under
direction of NISA RACHMANIA MUBARIK and YADI SURYADI.
Bacterial leaf blight (BLB) disease caused by plant pathogenic bacteria
Xanthomonas oryzae pv. oryzae (Xoo) could lead to death of rice plants. Control
of plant pathogenic bacteria can be performed using biological control agents. The aim of this research was to study the inhibitory ability of eight isolates of biocontrol bacteria against Xanthomonas oryzae pv. oryzae (Xoo) under greenhouse conditions. Isolates of biological agents used in the study were obtained from IPB Culture Collection (IPBCC), Department of Biology, IPB and microbial gene bank collection of Indonesian Center for Agriculture Biotechnology and Genetic Resources (BB Biogen), consisting of Pseudomonas
aeruginosa C32a and C32b, P. fluorescens ATCC 13525 Pf , Serratia marcescens
E31, Bacillus sp. I.5, B. cereus I.21 and II.14, and B. firmus E65 isolates. The methods used in the research i.e. hypersensitivity test, antagonistic test of biocontrol bacteria to Xoo, and in vivo application of biological agents in the greenhouse condition. Hypersensitivity test on tobacco plants using C32a and C32b inoculums showed characteristics of slightly leaf yellowing but did not cause necrosis. Injection using Xoo inoculum showed necrosis on tobacco leaves. Antagonist isolates i.e. C32a, C32b, Pf, I.21, and I.5 showed inhibitory activity against Xoo, whereas others isolates did not show inhibitory activity. In greenhouse experiments IR 64 rice plants were sprayed with biological control
agents (107cfu/ml) at 7 days, 14 days, 28 days, and 42 days after planting. The
results showed that C32a isolate could suppress better the lesion length of BLB than that of chemical control (copper sulphate). Growth measurement of rice plants were assessed on plant height, number of tillers, panicle number and grain weight. Rice plants spraying treatment with isolates E65, E31, C32a, C32b, I.21, Pf, and I.5 showed no difference with control of sterile distilled water. Spraying with each suspension isolate of I.21, E31, C32a, Pf, and C32b indicated no different in the panicle number, in addition rice production was higher in C32a, Pf, C32b, and I.21 treatments. Spraying with C32a isolates produced the highest grain production compared with that of other isolates.
RINGKASAN
ZURAIDAH. Potensi Beberapa Bakteri Penghambat Pertumbuhan Xanthomonas
oryzae pv. oryzae Penyebab Penyakit Hawar Daun Bakteri pada Tanaman Padi.
Dibimbing oleh NISA RACHMANIA MUBARIK dan YADI SURYADI.
Penyakit hawar daun bakteri (HDB) yang disebabkan oleh bakteri patogen tanaman Xanthomonas oryzae pv. oryzae (Xoo) dapat menyebabkan kematian pada tanaman padi. Serangan penyakit terjadi pada fase bibit, tanaman muda, dan tanaman tua. Kerusakan terberat terjadi apabila penyakit menyerang tanaman muda yang peka sehingga menimbulkan gejala kresek dan hawar daun.
Masyarakat saat ini cenderung lebih memilih pangan yang bebas pestisida dan bahan kimia lainnya. Kesadaran akan lingkungan yang sehat dan perkembangan di bidang bioteknologi telah mendorong berkembangnya penelitian tentang penggunaan mikroorganisme. Pengendalian bakteri patogen pada tanaman dapat dilakukan dengan menggunakan agen biokontrol. Tujuan dari penelitian ini ialah untuk mempelajari kemampuan penghambatan delapan isolat bakteri terhadap bakteri patogen Xanthomonas oryzae pv. oryzae (Xoo) yang merupakan penyebab penyakit HDB pada tanaman padi di rumah kaca.
Isolat yang digunakan dalam penelitian ini berasal dari koleksi IPB Culture
Collection (IPBCC), Departemen Biologi, IPB dan bank gen mikrob Pusat
Bioteknologi Pertanian dan Sumber Daya Genetik (BB Biogen), terdiri atas:
Pseudomonas aeruginosa C32a dan C32b, P. fluorescens ATCC 13525 Pf, Serratia marcescens E31, Bacillus sp. I.5, B. cereus I.21 dan II.14, dan B. firmus
E65.
Penelitian terdiri atas 3 tahapan yaitu 1) uji reaksi hipersensitif, 2) uji bakteri antagonis terhadap Xoo, dan 3) aplikasi in vivo agen biokontrol di rumah kaca. Uji reaksi hipersensitif pada tanaman tembakau dilakukan dengan cara injeksi masing-masing inokulum pada bagian belakang helaian daun tembakau yang sehat. Respon tanaman diamati selama 48 jam. Pengujian antagonis terhadap Xoo menggunakan metode double layer untuk menyeleksi isolat yang berpotensi sebagai agen biokontrol. Perlakuan kontrol dengan akuades steril (tanpa agen biokontrol) dan kontrol pembanding kimia dengan bakterisida yang mengandung bahan aktif tembaga sulfat. Setiap perlakuan diulang sebanyak tiga kali. Diameter zona hambat yang terbentuk kemudian diamati dan dihitung indeks aktivitas antimikrob. Aplikasi in vivo agen biokontrol di rumah kaca menggunakan padi IR64. Penyemprotan inokulum pada saat padi berumur 7 hari, 14 hari, 28 hari, dan 42 hari setelah tanam. Inokulasi patogen Xoo dengan cara pengguntingan daun (leaf clipping method) pada saat tanaman mencapai 45 hari setelah tanam. Perlakuan kontrol dengan penyemprotan akuades steril (tanpa agen biokontrol), kontrol pembanding kimia disemprot dengan tembaga sulfat, dan kontrol sakit hanya diinokulasi Xoo tanpa agen biokontrol. Pengamatan terhadap gejala penyakit HDB dilakukan dengan pengukuran panjang lesio (lesion length) dan penghitungan luasan area di bawah kurva perkembangan penyakit (AUDPC). Selain itu dilakukan pengamatan terhadap tinggi tanaman, jumlah anakan padi yang muncul, jumlah malai, berat basah, dan berat kering padi.
Uji reaksi hipersensitif pada tanaman tembakau menggunakan inokulum C32a dan C32b menunjukkan daun sedikit menguning tetapi tidak menyebabkan nekrosis. Inokulum lainnya tidak menunjukkan perubahan pada daun tembakau dan tidak terjadi nekrosis. Injeksi menggunakan inokulum Xoo menunjukkan nekrosis pada daun tembakau.
Uji antagonis secara in vitro menunjukkan isolat C32a, C32b, Pf, I.21, dan I.5 memiliki aktivitas penghambatan terhadap Xoo, sedangkan isolat lainnya tidak menunjukkan aktivitas penghambatan. Isolat C32a dan C32b dapat menghambat pertumbuhan Xoo lebih baik dari pada perlakuan kontrol pembanding kimia dengan tembaga sulfat.
Aplikasi di rumah kaca pada tanaman padi IR 64 yang telah disemprot dengan agen biokontrol menunjukkan bahwa penggunaan isolat C32a mampu menekan panjang lesio HDB lebih baik dari pada kontrol pembanding kimia dengan tembaga sulfat. Pengukuran intensitas perkembangan penyakit HDB dengan penghitungan AUDPC menunjukkan penyemprotan dengan suspensi C32a dapat menurunkan nilai AUDPC hingga 49,10 cm.hari. Sedangkan isolat E31 menunjukkan intensitas penyakit yang lebih tinggi dari pada kontrol sakit dengan Xoo.
Pengukuran pertumbuhan tanaman padi setelah mendapat perlakuan juga diamati. Tinggi tanaman padi menunjukkan penyemprotan suspensi isolat E65, E31, C32a, C32b, I.21, Pf, dan I.5 tidak berbeda dengan perlakuan akuades steril. Perlakuan dengan isolat E65 menunjukkan kecenderungan tinggi tanaman padi hampir sama dengan tinggi pada perlakuan akuades steril. Jumlah anakan juga tidak berbeda dengan perlakuan akuades steril. Namun hasil pengamatan dari 2 sampai 9 mst perlakuan isolat E31 dan I.21memiliki jumlah anakan yang lebih banyak dari pada perlakuan akuades steril. Jumlah malai padi yang diproduksi pada tanaman yang disemprot dengan isolat I.21, C32a, Pf, C32b, dan E31 memiliki jumlah malai yang tidak berbeda dengan jumlah malai pada perlakuan akuades steril. Produksi padi baik bobot gabah basah dan bobot gabah kering pada perlakuan C32a, Pf, C32b, dan I.21 cenderung lebih tinggi dibandingkan dengan perlakuan akuades steril. Hal ini menunjukkan bahwa penyemprotan dengan bakteri biokontrol tersebut memberikan pengaruh nyata terhadap bobot gabah.
Berdasarkan hasil penelitian ini, mengindikasikan bahwa perlakuan penyemprotan secara preventif pada saat tanaman berumur 7, 14, 28, dan 42 hari setelah tanam lebih efektif karena mikrob yang bersifat antagonis akan lebih efektif menekan pertumbuhan Xoo. Aplikasi dengan isolat-isolat biokontrol tidak mengganggu pertumbuhan tanaman padi, bahkan pengaruh aplikasi tersebut cenderung meningkatkan bobot gabah. Penelitian ini menunjukkan potensi pemanfaatan aplikasi isolat C32a, Pf, C32b, dan I.21 cukup baik dalam menghambat pertumbuhan bakteri patogen Xanthomonas oryzae pv. oryzae secara
in vivo pada tanaman padi.
© Hak Cipta milik IPB, tahun 2011 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh Karya tulis dalam bentuk apapun tanpa izin IPB
POTENSI BEBERAPA BAKTERI PENGHAMBAT
PERTUMBUHAN Xanthomonas oryzae pv. oryzae PENYEBAB
PENYAKIT HAWAR DAUN BAKTERI PADA TANAMAN
PADI
ZURAIDAH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Potensi Beberapa Bakteri Penghambat Pertumbuhan
Xanthomonas oryzae pv. oryzae Penyebab Penyakit
Hawar Daun Bakteri pada Tanaman Padi
Nama : Zuraidah
NIM : G351090141
Disetujui Komisi Pembimbing
Dr. Nisa Rachmania Mubarik, M.Si. Ir. Yadi Suryadi, M.Sc.
Ketua Anggota
Diketahui
Ketua Mayor Dekan Sekolah Pascasarjana IPB
Mikrobiologi
Dr. Ir. Gayuh Rahayu Dr. Ir. Dahrul Syah, M.Sc. Agr.
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian yang dilaksanakan sejak bulan November 2010 ini ialah berjudul Potensi Beberapa Bakteri Penghambat Pertumbuhan Xanthomonas oryzae pv. oryzae Penyebab Penyakit Hawar Daun Bakteri pada Tanaman Padi.
Terima kasih penulis ucapkan kepada Dr. Nisa Rachmania Mubarik, M.Si dan Ir. Yadi Suryadi, M.Sc selaku pembimbing. Ucapan terima kasih disampaikan kepada Dr. Ir. Abdjad Asih Nawangsih, M.Si sebagai penguji ujian tesis atas saran dan masukan yang diberikan. Serta ucapan terima kasih disampaikan kepada Dr. Ir. Ence Darmo Jaya Supena, M.Si sebagai Ketua Departemen Biologi, FMIPA atas saran dan masukan yang diberikan. Ucapan terima kasih disampaikan kepada Rektor IAIN Ar-Raniry Banda Aceh, serta Direktorat Jenderal Pendidikan Tinggi Agama Republik Indonesia yang telah mengizinkan penulis untuk melanjutkan studi S2 di IPB Bogor. Ucapan terima kasih disampaikan pada Departemen Pendidikan dan Kebudayaan Republik Indonesia yang telah memberikan Beasiswa Pendidikan Pacsasarjana (BPPS). Di samping itu, terima kasih disampaikan kepada pimpinan Balai Besar Bioteknologi dan Sumber daya Genetik Pertanian (BB Biogen) Bogor yang telah memberikan izin menggunakan fasilitas, serta kepada laboran BB Biogen yang telah membantu selama pelaksanaan penelitian. Penghargaan penulis sampaikan kepada staf dan laboran di laboratorium Mikrobiologi, Departemen Biologi, FMIPA IPB yang telah membimbing dan membantu selama penelitian. Penelitian ini didanai dari proyek penelitian Kerjasama Kemitraan Penelitian Pertanian dengan Perguruan Tinggi (KKP3T) kepada Dr. Nisa Rachmania Mubarik, M.Si tahun 2011. Ucapan terima kasih juga penulis disampaikan kepada Bayo Alhusaeri Siregar, M.Si dan Eka Astuty, serta mikrotropisian 2009 dalam membantu pelaksanaan penelitian. Terima kasih juga penulis sampaikan kepada suami dan anak-anak tercinta Mirza Muhammad, ST, MT, Fawwaz Zakka Mirza, Faizza Zayya Mirza, kepada ayah dan ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Desember 2011
RIWAYAT HIDUP
Penulis dilahirkan di Medan pada tanggal 1 April 1977 sebagai anak pertama dari tiga bersaudara dari pasangan Ibrahim Husein dan Zaitun Yusuf. Pendidikan sarjana ditempuh di Program Studi Biologi, Fakultas MIPA UNSYIAH Banda Aceh, lulus tahun 2001. Kesempatan untuk melanjutkan ke program magister pada Program Studi Mikrobiologi IPB diperoleh pada tahun 2009. Beasiswa pendidikan pascasarjana diperoleh dari Beasiswa BPPS Dikti.
Penulis bekerja sebagai staf pengajar di program studi Biologi, Fakultas Tarbiyah IAIN Ar-Raniry Banda Aceh sejak tahun 2006.
Selama mengikuti program S2, penulis pernah mengikuti Seminar Nasional Biologi di UPI Bandung pada bulan Juli 2011 sebagai pemakalah lisan dengan judul “Potensi Bakteri Pengendali Xanthomonas oryzae pv. oryzae Penyebab Penyakit Hawar Daun Bakteri pada Tanaman Padi”. Karya ilmiah yang disajikan merupakan bagian dari penelitian S2 penulis.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xii
PENDAHULUAN Latar Belakang ... 1 Tujuan Penelitian ... 2 Hipotesis Penelitian ... 3 Manfaat Penelitian ... 3 TINJAUAN PUSTAKA Perkembangan Penyakit Hawar Daun Bakteri di Indonesia ... 5
Karakteristik Penyakit Hawar Daun Bakteri ... 5
Mekanisme Xanthomonas oryzae pv. oryzae dalam Menginfeksi Tanaman ... 6
Pergeseran Patotipe Xanthomonas oryzae pv. oryzae ... 7
Pencarian Sumber Ketahanan Tanaman Padi terhadap Penyakit Hawar Daun Bakteri ... 8
Pengendalian Hawar Daun Bakteri secara Kultur Teknis ... 9
Pengendalian Hawar Daun Bakteri secara Hayati ... 10
Senyawa Antimikrob yang Dihasilkan oleh Pseudomonas sp ... 12
Senyawa Antimikrob yang Dihasilkan oleh Bacillus sp. ... 13
Senyawa Antimikrob yang Dihasilkan oleh Serratia marcescens ... 14
BAHAN DAN METODE Waktu dan Tempat Penelitian ... 17
Bahan ... 17
Peremajaan Mikrob ... 17
Uji Reaksi Hipersensitif Isolat Uji serta Isolat Patogen Xanthomonas oryzae pv. oryzae terhadap Tanaman Tembakau ... 18
Seleksi Isolat Uji yang Berpotensi Menghambat Pertumbuhan Xanthomonas oryzae pv. oryzae ... 18
Uji In Vivo Aplikasi Isolat Uji terhadap Xanthomonas oryzae pv. oryzae pada Tanaman Padi di Rumah Kaca ... 19
HASIL
Karakteristik Pertumbuhan Mikrob ... 23
Reaksi Hipersensitif Isolat Uji serta Isolat Patogen Xanthomonas oryzae pv. oryzae terhadap Tanaman Tembakau ... 24
Potensi Isolat Uji dalam Menghambat Pertumbuhan Xanthomonas oryzae pv. oryzae ... 24
Aplikasi Isolat Uji terhadap Xanthomonas oryzae pv. oryzae pada Tanaman Padi di Rumah Kaca ... 26
Panjang Lesio Hawar Daun Bakteri ... 26
Tinggi Tanaman ... 29 Jumlah Anakan ... 30 Jumlah Malai ... 33 Produksi Gabah ... 33 PEMBAHASAN ... 37 SIMPULAN ... 49 DAFTAR PUSTAKA ... 51 LAMPIRAN ... 59
DAFTAR GAMBAR
Halaman
1 Isolat Pseudomonas aeruginosa ... 23 2 Pengujian reaksi hipersensitif pada daun tembakau setelah 48 jam
inokulasi bakteri ... 24 3 Pengujian antagonis isolat uji terhadap Xoo dibandingkan dengan
kontrol ... 25 4 Gejala HDB pada ujung daun menguning 3 hari setelah inokulasi
Xoo ... 26 5 Gejala HDB pada ujung daun menguning 18 hari setelah inokulasi
Xoo ... 27 6 Panjang lesio HDB pada daun padi setelah inokulasi Xoo ... 28 7 Intensitas serangan HDB pada tanaman padi dan nilai AUDPC
(cm.hari) ... 29 8 Tinggi tanaman padi yang diberi perlakuan isolat biokontrol ... 31 9 Jumlah anakan padi yang diberi perlakuan dengan isolat
biokontrol ... 32 10 Jumlah malai padi yang terserang Xoo dan diberi perlakuan dengan
isolat biokontrol dan panen 9 minggu setelah tanam ... 33 11 Bobot gabah padi yang terserang Xoo dan diberi perlakuan dengan
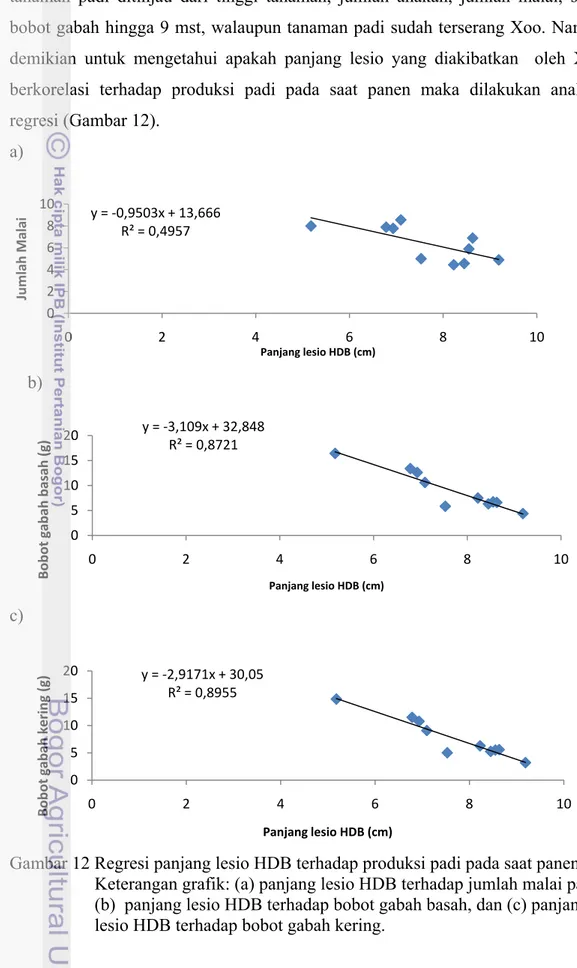
isolat biokontrol dan panen 9 minggu setelah tanam ... 33 12 Regresi panjang lesio HDB terhadap produksi padi pada
saat panen ... 34
DAFTAR LAMPIRAN
Halaman
1 Karakteristik isolat-isolat yang digunakan dalam penelitian ini ... 60 2 Komposisi bahan dalam beberapa media ... 61 3 Pengaruh perlakuan isolat-isolat uji terhadap panjang lesio HDB dan
nilai AUDPC ... 63 4 Pengaruh perlakuan isolat-isolat uji terhadap tinggi tanaman
padi ... 64 5 Pengaruh perlakuan isolat-isolat uji terhadap jumlah anakan
tanaman padi ... 65 6 Pengaruh perlakuan isolat-isolat uji terhadap bobot gabah padi ... 66
PENDAHULUAN
Latar Belakang
Penyakit hawar daun bakteri (HDB) disebabkan oleh Xanthomonas oryzae pv. oryzae (Xoo) merupakan salah satu penyakit yang dapat menurunkan kuantitas serta kualitas produksi tanaman padi (Goto 1998). HDB dapat mengurangi hasil panen dengan tingkat bervariasi, tergantung pada stadium pertumbuhan tanaman yang terinfeksi, tingkat kerentanan kultivar padi, dan kondisi lingkungan (Abdullah 2002). Penyakit ini tersebar hampir di seluruh daerah pertanaman padi di Indonesia baik di dataran rendah maupun dataran tinggi baik pada musim kemarau maupun musim hujan. Penyakit ini pada musim hujan biasanya berkembang lebih pesat dibandingkan musim kemarau. Kerugian hasil yang disebabkan oleh HDB dapat mencapai 60%. Hasil penelitian menunjukkan bahwa bila tingkat keparahan sebesar 20% sebulan sebelum panen, penyakit ini sudah mulai menurunkan hasil (Deptan 2011).
Penyakit HDB berkembang menjadi penyakit serius sejak digunakan varietas unggul IR64. Kerusakan yang ditimbulkan terus meningkat sebagai akibat meluasnya pertanaman varietas unggul IR64 yang tahan terhadap wereng batang coklat tetapi sangat rentan terhadap HDB, sehingga butuh penanganan khusus terhadap penyakit yang disebabkan oleh bakteri ini (Ratna 2000).
Berbagai usaha penanggulangan penyakit ini telah banyak dilakukan, antara lain dengan menggunakan bahan kimia sintetik seperti asam benzoat dan nitrit, ataupun aplikasi pestisida berbahan dasar senyawa antibiotik (Asman 1996). Penggunaan senyawa kimia sebagai pupuk dan pestisida serta antibiotik dalam penanganan penyakit tanaman dapat menyebabkan resistensi terhadap bakteri, menimbulkan residu, dan pencemaran lingkungan.
Alternatif biokontrol seperti aplikasi mikrob pengendali hayati menghasilkan zat antimikrob tanpa mencemari lingkungan. Bakteri mampu menghasilkan senyawa metabolit yang memiliki efek bakterisidal atau bakteriostatik untuk menghambat pertumbuhan bakteri patogen. Genus bakteri yang umum digunakan dan menghasilkan zat antimikrob berupa bakteriosin ialah
sudah digunakan antara lain Pseudomonas flourescens dan Bacillus subtilis. Formulasi campuran kedua bakteri tersebut telah diaplikasikan untuk mengendalikan penyakit pustul bakteri kedelai yang disebabkan oleh
Xanthomonas campestris pv. glycines (Dirmawati 2005).
Sejumlah spesies bakteri dari genus Bacillus dan Pseudomonas yang tergolong plant growth promoting rhizobacteria (PGPR) selain memacu pertumbuhan tanaman juga dapat meningkatkan ketahanan terhadap penyakit karena memproduksi antibiotik (Wahyudi et al. 2009), dapat memproduksi asam sianida, siderofor (Santhini et al. 2005), enzim ekstraseluler yaitu kitinase, selulase, dan protease yang melisis sel patogen (Jaiganesh et al. 2007; Mubarik et
al. 2010). Suryadi et al. (2011) melaporkan beberapa isolat bakteri memiliki
potensi menekan penyakit blas atau hawar pelepah (sheath blight) yang disebabkan oleh cendawan patogen Pyricularia grisea pada aplikasi di rumah kaca, seperti B. cereus I.21, B. firmus E65, B. cereus II.14, B. cereus C29d,
Bacillus sp. I.5, dan Serratia marcescens E31. Isolat-isolat tersebut menunjukkan
kecenderungan lebih baik menekan blas dari pada fungisida yang mengandung bahan aktif mancozeb. Berdasarkan hasil penelitian tersebut, penggunaan bakteri ramah lingkungan yang terdiri atas bakteri yang dapat menghambat penyakit patogen padi dan menghasilkan hormon pemacu pertumbuhan tanaman padi serta memproduksi enzim ekstraseluler akan lebih efektif dari pada senyawa kimia pembasmi patogen yang dapat merusak lingkungan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mempelajari kemampuan penghambatan delapan isolat bakteri terhadap bakteri patogen Xanthomonas oryzae pv. oryzae yang merupakan penyebab penyakit hawar daun bakteri pada tanaman padi di rumah kaca.
3
Hipotesis Penelitian
Hipotesis dari penelitian ini yaitu:
1. Isolat-isolat uji tidak menunjukkan respon hipersensitif terhadap tanaman
tembakau dibandingkan bakteri Xanthomonas oryzae pv. oryzae yang bersifat patogen terhadap tanaman.
2. Isolat-isolat uji menunjukkan aktivitas penghambatan terhadap bakteri
patogen Xanthomonas oryzae pv. oryzae.
3. Isolat-isolat uji menunjukkan aktivitas penghambatan terhadap penyakit
hawar daun bakteri ditinjau dari panjang lesio pada daun padi.
Manfaat Penelitian
Informasi yang didapatkan dari penelitian ini diharapkan dapat mendukung pemanfaatan lebih lanjut bakteri-bakteri uji yang bersifat biokontrol sehingga efektif untuk mengendalikan pertumbuhan Xanthomonas oryzae pv. oryzae pada tanaman padi di lapangan.
5
TINJAUAN PUSTAKA
Perkembangan Penyakit Hawar Daun Bakteri di Indonesia
Hawar daun bakteri pertama kali dilaporkan di Jepang tahun 1884, dari Jepang menyebar secara luas di Asia seperi di Srilangka, Filipina, dan Pakistan (Yamasaki et al. 2006). Salah satu penyakit padi terpenting di banyak negara penghasil beras termasuk Indonesia. Di Indonesia, HDB pertama kali disebabkan oleh organisme Xanthomonas sp. (Zhang 2006). Namun hasil penelitian Goto (1998) menunjukkan bahwa patogen penyebab HDB di Indonesia sama seperti yang menyerang tanaman padi di Jepang, sehingga namanya diganti menjadi
Xanthomonas oryzae. Pada tahun 1976, nama patogen ini menjadi Xanthomonas campestris pv. oryzae dan sejak tahun 1992 diganti menjadi Xanthomonas oryzae
pv. oryzae.
Karakteristik Penyakit Hawar Daun Bakteri
Penyakit hawar daun bakteri disebabkan oleh bakteri Xanthomonas oryzae pv. oryzae (Xoo). Bakteri ini berbentuk batang dengan koloni berwarna kuning. Memiliki virulensi yang bervariasi tergantung kemampuannya untuk menginfeksi varietas padi yang mempunyai gen resistensi berbeda. Penyakit ini tidak hanya menyerang pada fase bibit, tetapi juga menyerang tanaman dewasa. Gejala yang ditimbulkan akibat serangan Xoo adalah infeksi sistemik dan nekrosis (Ratna 2000). Yamasaki et al. (2006) menyatakan ada dua tipe gejala, yaitu kresek dan hawar daun. Hawar daun (blight) ialah gejala yang timbul pada fase generatif, ditandai dengan munculnya garis pada ujung tepi daun. Garis tersebut semakin memanjang dan melebar, sehingga menyebabkan warna menjadi kuning sampai putih dan dapat menutup ujung daun. Akibatnya tanaman yang terinfeksi berat akan menghasilkan gabah hampa sehingga produksi rendah.
Pengendalian penyakit HDB pada tanaman padi masih sulit dilakukan, karena Xoo mempunyai daerah pencar yang luas serta mempunyai kemampuan untuk beradaptasi pada tumbuhan inang alternatif, seperti pada beberapa jenis gulma. Xoo dapat bertahan di dalam tanah selama satu sampai tiga bulan
tergantung pada kelembaban dan keasaman tanah, serta pada sisa-sisa jerami dan biji yang terinfeksi (Yamasaki et al. 2006).
Karakter iklim tropis menyebabkan semakin banyak galur patogen yang ditemukan di wilayah tropis. Di Indonesia hingga saat ini telah ditemukan sekitar 12 galur Xoo dengan tingkat virulensi yang berbeda. Galur IV dan VIII mendominasi serangan HDB pada tanaman padi di Indonesia (Suparyono et al. 2003). Isolat galur VIII tersebar paling luas dan mendominasi di lapangan, sedangkan galur IV kurang meluas, tetapi mempunyai virulensi tertinggi dan umumnya semua varietas padi peka terhadap kelompok isolat ini. Perkembangan penyakit sangat tergantung pada cuaca dan ketahanan tanaman (Goto 1998).
Keragaman komposisi galur Xoo dipengaruhi oleh stadium tumbuh tanaman padi. Dominasi kelompok galur yang ditemukan pada stadium anakan, berbunga, dan pemasakan berbeda. Fenomena ketahanan tanaman dewasa, mutasi, dan karakter heterogenisitas alamiah populasi mikroorganisme diperkirakan sebagai faktor yang mempengaruhi komposisi galur dengan stadium tumbuh tanaman padi (Suparyono et al. 2003).
Mekanisme Xanthomonas oryzae pv. oryzae dalam Menginfeksi Tanaman
Bakteri Xoo menginfeksi tanaman melalui hidatoda atau luka. Penyebaran penyakit melalui kontak fisik antara daun yang terinfeksi dengan daun yang sehat, melalui aliran irigasi dari satu lahan ke lahan lainnya. Selain itu lingkungan yang lembab dan jarak tanam yang terlalu rapat juga mempermudah penularan penyakit ini (Khaeruni 2001).
Bakteri masuk ke dalam jaringan tanaman, lalu memperbanyak diri di dalam
epidermis yang menghubungkan dengan pembuluh pengangkut, kemudian
tersebar ke jaringan lainnya dan menimbulkan gejala. Infeksi yang terjadi pada pembibitan menyebabkan bibit menjadi kering. Bakteri menginfeksi masuk melalui sistem vaskular tanaman padi pada saat pindah tanam atau pada saat dicabut dari tempat pembibitan sehingga akarnya rusak, atau terjadi infeksi pada saat daun rusak (Suparyono et al. 2003).
Penyakit dapat terjadi pada semua stadia tanaman. Namun pada umumnya terjadi saat tanaman mulai mencapai anakan maksimum sampai fase berbunga.
7
Gejala penyakit disebut kresek pada stadia bibit, sedang gejala stadia tanaman yang lebih lanjut disebut hawar. Gejala diawali dengan bercak kelabu umumnya di bagian pinggir daun. Bercak berkembang terus pada varietas yang rentan dan akhirnya membentuk hawar. Ketika kondisi menjadi parah, tanaman terlihat kering seperti terbakar (Suparyono et al. 2003).
Pergeseran Patotipe Xanthomonas oryzae pv. oryzae
Xanthomonas oryzae pv. oryzae (Xoo) membentuk galur-galur baru di
lapangan sejalan dengan perkembangan penggunaan varietas padi. Perbedaan virulensi antara Xoo yang dikumpulkan dari berbagai daerah merupakan dinamika interaksi antara inang dan patogen yang dapat dibedakan menjadi varietas diferensial dan kelompok di pihak patogen (Goto 1998).
Xanthomonas oryzae pv. oryzae dikatakan sebagai spesies kompleks. Hal ini
didasari oleh penyebaran yang luas, keragaman genetik, filogenetik, dan molekuler dari galur-galur yang menyerang tanaman (Tsuyuma et al. 1996). Galur III mempunyai daerah sebaran yang paling luas, meliputi Sulawesi Selatan, Kalimantan Selatan, Jawa, dan Bali. Perbedaan virulensi dari isolat Xoo dipengaruhi oleh gen virulensi yang dimilikinya. Bila terdapat gen virulensi patogen Xoo yang kompatibel dengan gen ketahanan inang (padi), maka patogen tersebut mampu menyerang inang. Berdasarkan pola virulensinya terhadap varietas uji (galur isogenik), isolat yang termasuk dalam kelompok galur IV diduga sekurang-kurangnya memiliki 8 gen virulen, yaitu v-1, v-2, v-3, v-8, v-10,
v-11, v-12, dan v-14. Isolat yang termasuk ke dalam kelompok galur III hanya
memiliki 7 gen virulen, yaitu v-1, v-4, v-8, v-10, v-11, v-12, dan v-14 (Yamasaki et
al. 2006).
Tsuyuma et al. (1996) melaporkan bahwa interaksi antagonis antara dua
galur tipe liar bakteri hawar daun yaitu Xoo dari Filipina dan Korea, ternyata galur liar Filipina dapat menghambat galur liar Korea bila galur ini dicampur dalam satu inokulasi. Selanjutnya mutan nonpatogenik galur Filipina mengendalikan antagonistik pada bakteri lain. Ternyata galur tipe liar Filipina dan mutan nonpatogenik dapat menghambat pertumbuhan galur Korea setelah dua hari diinfeksi dan lebih dahulu menyebabkan symptoms penyakit. Ketika
penggabungan dengan mutan nonpatogenik, 10-18 macam Xoo tipe liar tidak menyebabkan penyakit. Sebaliknya tiga dari galur nonpatogenik dapat menghambat tipe liar dan mutan galur Filipina.
Pertambahan kelompok galur Xoo maka pengendalian penyakit HDB menjadi semakin sulit. Oleh karena itu, pergeseran galur Xoo perlu terus dipantau untuk mengetahui kelompok galur Xoo yang akan digunakan dalam program pemuliaan padi dan untuk dijadikan acuan dalam menentukan varietas padi yang akan direkomendasikan untuk suatu wilayah (Suparyono et al. 2003).
Pencarian Sumber Ketahanan Tanaman Padi terhadap Penyakit Hawar Daun Bakteri
Varietas tahan merupakan komponen utama pengendalian HDB secara terpadu karena sangat ekonomis, efektif, dan tidak merusak lingkungan. Tetapi keefektifan varietas yang tahan ini dipengaruhi oleh interaksi antara gen pembawa sifat tahan yang dimilikinya dan gen virulensi pada populasi Xoo yang terdapat di suatu wilayah (Yamasaki et al. 2006).
Galur Xoo berbeda dari suatu daerah dengan daerah lain, dan dari suatu negara dengan negara lain. Varietas padi yang tahan terhadap galur Xoo asal Filipina belum dapat dipastikan akan bereaksi tahan terhadap galur asal Indonesia atau negara lain, sehingga perlu adanya pengujian ulang. Varietas dengan gen ketahanan xa-5 bereaksi tahan terhadap semua galur asal Filipina, sedangkan varietas dengan gen ketahanan xa-4 seperti yang dimiliki IR64 hanya tahan terhadap galur I asal Filipina (Yamasaki et al. 2006). Oleh karena itu gen ketahanan yang masih efektif di suatu wilayah perlu diidentifikasi dengan seksama.
Penggunaan bakteri isogenik yang nonpatogen melalui mutagenesis menggunakan transposon merupakan salah satu cara untuk mendapatkan varietas yang tahan terhadap HDB. Transposon akan menyisip ke dalam genom dan terutama sekuen DNA yang berperan dalam regulasi suatu proses fisiologi tertentu seperti sifat virulen, sehingga menyebabkan perubahan ekspresi gen. Selanjutnya akan dihasilkan mutan Xoo yang tidak menginduksi reaksi hipersensitif sehingga kehilangan atau berkurang sifat virulennya. Pemanfaatan mutan bakteri yang
9
berkurang sifat virulennya mampu mengurangi kerugian produksi padi akibat penyakit HDB. Mutan yang dihasilkan secara genetik sama dengan tipe liarnya disebut isogenik. Mutan isogenik yang nonpatogenik diharapkan mampu menekan pertumbuhan tipe liarnya dengan cara kompetisi. Penggunaan mutan isogenik tersebut lebih menguntungkan karena mutan akan berperilaku sama dengan tipe liarnya dalam merespon perubahan lingkungan sehingga memiliki kesintasan yang sama di alam (Nakayachi 1995).
Menurut Sugio et al. (2005) bahwa mutasi gen hrpF pada bakteri Xoo tidak
menghilangkan patogenitasnya tetapi dapat mengurangi kemampuan bakteri untuk tumbuh pada padi dan juga mengurangi kemampuannya dalam menyebabkan gejala HDB. Hal ini disebabkan keterlibatan gen-gen lain yang menentukan sifat virulen Xoo. Beberapa gen yang diketahui berperan dalam menentukan virulensi Xoo antara lain gumG, xps, aroE, rpfF, pgi, purH, dan eglXoB, sehingga mutasi pada gen hrp Xoo tidak dapat secara langsung menghilangkan seluruh sifat patogenitasnya pada tanaman padi (Hu et al. 2007).
Pengendalian Hawar Daun Bakteri secara Kultur Teknis
Intensitas serangan HDB tidak hanya dipengaruhi oleh ketahanan varietas dan virulensi patogen, tetapi juga dipengaruhi oleh teknik bercocok tanam yang diterapkan oleh petani. Sama halnya dengan penyakit-penyakit padi lainnya, penyakit HDB mempunyai hubungan yang jelas dengan pemupukan, khususnya pemupukan nitrogen. Pemberian pupuk N dengan dosis tertentu untuk meningkatkan pertumbuhan vegetatif dan produktivitas. Sebaliknya pemupukan N dengan dosis yang tinggi akan meningkatkan kerusakan pada varietas dengan ketahanan, walaupun pada varietas yang resisten dampaknya relatif kecil. Oleh
karena itu, pemupukan N yang berlebihan sebaiknya dihindarkan. Selain
pemupukan sesuai dosis anjuran, pergiliran varietas dan tanaman, sanitasi dan eradikasi pada tanaman yang terserang dapat dilakukan untuk mengendalikan penyakit HDB pada suatu daerah tertentu (Tsuyuma et al. 1996).
Pengendalian Hawar Daun Bakteri secara Hayati
Kondisi lingkungan yang cocok untuk perkembangan penyakit dapat mendorong penyakit berkembang lebih pesat. Arwiyanto et al. (2007) melaporkan bahwa petani belum melakukan pengelolaan penyakit secara benar misalnya masih menggunakan bibit padi yang terinfeksi penyakit hawar daun bakteri, membiarkan sisa-sisa tanaman sakit, dan tidak melakukan pemupukan sehingga dapat memacu perkembangan penyakit HDB. Pengendalian penyakit tanaman di Indonesia selama ini lebih banyak mengandalkan penggunaan pestisida, namun akibat efek samping yang ditimbulkan maka penggunaannya mulai dikurangi karena residu yang ditinggalkan dapat bersifat racun dan karsinogenik.
Pengendalian bakteri patogen lebih efektif bila dilakukan secara terpadu dengan mengkombinasikan berbagai teknik pengendalian, meliputi varietas tahan atau toleran, teknik budidaya (pergiliran tanaman, bahan organik, pemupukan), pengendalian menggunakan agen biokontrol, pestisida nabati dan membatasi penyebaran bakteri patogen termasuk pengaturan karantina (Arwiyanto et al. 2007).
Menurut Pal dan Gardener (2006) biokontrol telah digunakan dalam berbagai bidang biologi, terutama entomologi dan patologi tanaman. Bidang entomologi menggunakan predator serangga hidup, nematoda entomopatogen, atau mikrob patogen untuk menekan populasi hama serangga. Dalam patologi tanaman penggunaan berjangka mikrob antagonis untuk menekan penyakit serta penggunaan patogen inang spesifik untuk mengendalikan populasi patogen lainnya. Organisme yang menekan hama atau patogen disebut sebagai agen biokontrol. Agen biokontrol umumnya menghasilkan antibiotik dalam jumlah relatif kecil sehingga kosentrasi di alam relatif rendah, walaupun senyawa tersebut mempunyai spektrum yang luas namun tidak memberikan tekanan yang terlalu kuat terhadap patogen sehingga tidak menimbulkan resistensi (Nawangsih 2006).
Pengembangan agen biokontrol sebagai komponen pengendalian penyakit HDB pada tanaman padi secara terpadu yang ramah lingkungan perlu dikembangkan dan diharapkan menjadi alternatif pengendalian yang penting dalam era pertanian yang berkelanjutan. Keuntungan biokontrol antara lain lebih
11
aman, tidak terakumulasi dalam rantai makanan, adanya proses reproduksi sehingga dapat mengurangi pemakaian yang berulang-ulang dan dapat digunakan secara bersama-sama dengan pengendalian yang telah ada. Penggunaan agen biokontrol dalam skala luas di lapangan memerlukan beberapa kriteria antara lain formulasi agen biokontrol mudah diaplikasi di lapangan, pembiakan massal dan bahan formulasi yang murah dan mudah didapatkan, serta agen biokontrol mampu bertahan pada waktu yang relatif lama dalam bahan formulasinya di suhu ruang (Dirmawati 2005).
Sebagian besar pekerjaan di bidang biokontrol masih dalam taraf percobaan dan kajian kelayakan ekonomi, seperti halnya biokontrol penyakit HDB masih dalam taraf pengujian di laboratorium dan rumah kaca. Hasil penelitian Khaeruni (2001) menunjukkan bahwa terdapat sejumlah bakteri filosfer yang diisolasi dari daun padi berpotensi sebagai agen biokontrol penyakit HDB pada skala rumah kaca. Demikian pula Machmud dan Farida (1995) melaporkan bahwa bakteri filosfer Pseudomonas fluorescens dan Bacillus sp. yang diisolasi dari daun dan batang tanaman padi berpotensi sebagai agen biokontrol penyakit HDB pada padi secara in vitro.
Kemampuan bakteri tanah bertahan hidup diduga sangat tergantung pada keberadaan tanaman inang. Bakteri patogen yang spesifik pada tanaman inang terdapat pada lahan tertentu. Hal tersebut berkaitan dengan faktor lingkungan, baik faktor abiotik, seperti suhu, tipe tanah, dan curah hujan maupun faktor biotik, sebagai contoh keberadaan nematoda dapat memperparah serangan penyakit HDB pada tanaman padi (Agustiansyah 2009). Tanaman merespon berbagai stimulus lingkungan, termasuk gravitasi, cahaya, suhu, stres fisik, air, dan ketersediaan hara. Tanaman juga menanggapi berbagai rangsangan kimia yang diproduksi oleh tanah dan tanaman yang berasosiasi dengan mikrob. Rangsangan tersebut dapat menginduksi pertahanan tanaman melalui perubahan biokimia yang meningkatkan perlawanan terhadap infeksi berbagai patogen. Induksi pertahanan inang dapat bersifat lokal atau sistemik di alam tergantung pada jenis, sumber, dan jumlah rangsangan. Terdapat beberapa jalur induksi resistensi yang dirangsang oleh agen biokontrol. Jalur pertama disebut ketahanan sistemik yang diterima atau systemic acquired resistance (SAR) yang diperantarai
oleh asam salisilat (SA) yaitu senyawa yang sering diproduksi oleh mikrob yang menginfeksi dan biasanya mengarah ke ekspresi protein terkait patogenesis (PR). Protein PR ini termasuk beberapa enzim yang beragam yang bertindak secara langsung untuk melisiskan sel yang menyerang, memperkuat batas-batas dinding sel untuk melawan infeksi, atau menginduksi kematian sel lokal. Jalur lainnya ialah resistensi sistemik terinduksi atau induced systemic resistance (ISR), diperantarai oleh asam jasmonat (JA) atau etilen yang dihasilkan oleh beberapa rhizobacteria nonpatogen (Pal & Gardener 2006).
Senyawa Antimikrob yang Dihasilkan oleh Pseudomonas sp.
Bakteri Pseudomonas sp. mampu mendegradasi sejumlah besar senyawa organik, berinteraksi dengan tanaman dan berasosiasi dalam rizosfer yang bersifat menguntungkan di bidang pertanian dan sebagian lainnya dapat sebagai agen biokontrol (West 2005). Bakteri ini banyak menguntungkan bagi tanaman secara langsung, yaitu melalui pemacuan pertumbuhan dan peningkatan kesehatan tanaman, atau secara tidak langsung melalui penghambatan, kompetisi dengan patogen atau parasit (Loccoz & Defago 2004).
Bakteri Pseudomonas sp. sebagai agen pemacu pertumbuhan tanaman menghasilkan fitohormon dalam jumlah besar khususnya indole acetic acid (IAA) untuk merangsang pertumbuhan yaitu giberelin, sitokinin, dan etilen serta melarutkan fosfat, kalium atau nutrien lain sehingga tersedia bagi tanaman (Astuti 2008). Pada beberapa galur Pseudomonas sp. dapat membantu tanaman menghadapi cekaman lingkungan seperti kekurangan air dan nutrien serta pencemaran senyawa toksin (Shen 1997).
Selain sebagai pemacu pertumbuhan tanaman, Pseudomonas sp. juga mempunyai kemampuan sebagai agen biokontrol terhadap serangan fungi patogen tanaman. Mekanisme dalam menekan pertumbuhan fungi patogen tanaman antara lain karena bakteri ini mampu menghasilkan senyawa siderofor, β-1,3 glukanase, kitinase, antibiosis, dan sianida (Chermin & Chet 2002).
Senyawa antimikrob juga dapat dihasilkan oleh bakteri Pseudomonas sp. seperti bakteriosin, fenazin, pioluteorin, pirolniftril, 2,4 diasetil floroglusinol, dan fusarisidin (Beatty & Susan 2002; Dwivedi & Johri 2003). Senyawa fenazin yang
13
diproduksi oleh Pseudomonas fluorescens 2-79 mampu menghambat
Gaeumannomyces graminis var. tritici ketika diperlakukan pada benih gandum
(Weller 1988). Velusamy et al. (2006) melaporkan 2,4 diasetil floroglusinol yang diproduksi oleh Pseudomonas sp. dapat menghambat pertumbuhan Xanthomonas
oryzae pv. oryzae yang menyebabkan penyakit HDB pada tanaman padi. Hasil
penelitian lainnya melaporkan bahwa agen biokontrol seperti Pseudomonas
fluorescens mampu menghasilkan asam sianida (HCN) yang mampu menekan
penyakit Black root pada tembakau (Zhang 2006). Sedangkan menurut Loccoz & Defago (2004) agen biokontrol mampu bertindak sebagai parasit bagi patogen secara langsung dengan cara mensekresikan enzim ekstraseluler (kitinase, protease, selulase) yang dapat melisis atau mendegradasi dinding sel patogen sehingga perkembangan patogen menjadi terhambat. Pseudomonas fluorescens memproduksi pigmen fluoresen berwarna kuning hijau berfungsi sebagai siderofor (Weller 1988), juga menghasilkan 2,4-diasetilfloroglusinol (Raaijmakers
et al. 1999) yang mampu mengendalikan berbagai penyakit tular tanah.
Senyawa Antimikrob yang Dihasilkan oleh Bacillus sp.
Bakteri Bacillus sp. mampu membentuk endospora pada kondisi lingkungan yang tidak menguntungkan sehingga dapat bertahan hidup. Kemampuannya dalam membentuk endospora menjadikan Bacillus sp. banyak digunakan dalam industri secara komersil karena dapat bertahan lama dan beradaptasi dengan formula dan bahan-bahan kimia yang diaplikasikan dalam tanah pertanian (Bai et al. 2003). Bakteri ini tergolong dalam bakteri aerob dan anaerob fakultatif (Holt et al. 1994).
Bakteri Bacillus sp. mempunyai kemampuan sebagai biokontrol penyakit tanaman dengan memproduksi antibiotik yang disekresikan saat kultur memasuki fase stasioner dan memproduksi antibiotik metabolit sekunder seperti enzim kitinase, mycobacilin, basitrasin, dan zwittermicin (Madigan et al. 2000). Bakteriosin merupakan senyawa antimikrob polipeptida yang disintesis di ribosom dan biasanya hanya menghambat galur-galur bakteri yang berkerabat dekat dengan bakteri penghasil bakteriosin tersebut (Jack et al. 1995). Isramilda (2007) menyatakan bahwa isolat Bacillus sp. galur LTS 40 dapat menghasilkan
metabolit aktif yaitu bakteriosin. Secara in vitro bakteriosin dapat diproduksi kemudian dipekatkan dengan berbagai metode pengendapan sebagaimana metode pengendapan protein. Berbagai pelarut organik seperti aseton, metanol dan etanol dapat digunakan untuk mengendapkan bakteriosin. Beberapa jenis bakteriosin yang dihasilkan oleh Bacillus ialah subtilin (B. subtilis), megacin (B.
megaterium), ericin (B. subtilis), licherin (B. licherniformis), coagulin (B. coagulans), cerein (B. cereus), dan thuricin (B. thuringiensis) (Jack et al.1995).
Senyawa antibiotik zwittermicin A yang diproduksi oleh B. cereus dilaporkan oleh Weller (1988) mampu menghambat pertumbuhan koloni Phytophthora
medicaginic.
Bakteri B. subtilis dan B. cereus positif menghasilkan senyawa siderofor, sehingga bakteri ini mampu berkompetisi dengan bakteri patogen dalam
menggunakan Fe3+ yang kosentrasinya sangat terbatas dalam tanah. Pengambilan
Fe3+ oleh bakteri tidak mengganggu kebutuhan tanaman karena tanaman hanya
membutuhkan dalam jumlah sedikit dibandingkan dengan mikroorganisme (Nawangsih 2006). B. cereus galur UW85 mampu menghasilkan zwittermicin dan kanosamine. Kemampuan menghasilkan beberapa antibiotik mampu menekan beragam mikrob pesaing sebagai patogen tanaman (Pal & Gardener 2006).
Senyawa Antimikrob yang Dihasilkan oleh Serratia marcescens
Beberapa galur S. marcescens dapat menghasilkan pigmen prodigiosin yang berwarna merah gelap hingga merah muda, tergantung pada usia koloni bakteri tersebut (Madigan et al. 2000). Bakteri ini termasuk Gram negatif yang dapat tumbuh pada kondisi nutrisi sederhana dan mudah mengkolonisasi pada filosfer tanaman (Carbonell et al. 2003). Bakteri ini memproduksi enzim kitinase, lipase, kloroperoksidase, dan protein ekstraseluler. Antibiotik yang umumnya digunakan untuk mengobati infeksi Serratia yaitu β-laktam, aminoglikosida, dan fluoroquinol (Hejazi & Falkiner 1997).
Penggunaan bakteri epifit Serratia marcescens galur Kgh1, Pseudomonas
fluorescens galur E10, dan Pantoea agglomerans galur Abp2 mampu mengurangi
gejala penyakit hawar api atau fire blight yang disebabkan oleh Erwinia
15
galur Kgh1 di lapangan sangat baik dalam menekan penyakit hawar api tersebut (Gerami et al. 2011).
Serratia marcescens galur 90-166 sebagai rhizobakteria mampu
menginduksi resistensi sistemik (ISR) terhadap fungi patogen, bakteri, dan virus. Hal ini disebabkan S. marcescens galur 90-166 dapat memproduksi asam salisilat (SA) dengan menggunakan plasmid salicylateresponsif pUTK21. Bakteri ini mampu menekan penyakit yang diakibatkan oleh fungi patogen Colletotrichum
orbiculare pada tanaman mentimun. Selain itu S. marcescens galur 90-166
menghasilkan salisilat hidroksilase yang dapat menekan penyakit yang disebabkan oleh Pseudomonas syringae pv. tabaci pada tembakau tipe liar Xanthi-nc dan tembakau transgenik NahG-10. Kenaikan kosentrasi besi secara in vitro ternyata dapat mengurangi produksi SA, dan meningkatnya kosentrasi besi di dalam tanaman mentimun yang diserap melalui akar ternyata mengurangi induksi ISR terhadap C. orbiculare (Press et al. 1997).
17
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan November 2010 sampai dengan Juni 2011 di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB dan di laboratorium serta rumah kaca Balai Besar Bioteknologi dan Sumber daya Genetik Pertanian (BB Biogen), Bogor.
Bahan
Bahan yang digunakan ialah: padi IR64, tanaman tembakau, isolat bakteri
Pseudomonas aeruginosa C32a dan C32b, Serratia marcescens E31, B. firmus
E65, dan isolat patogen Xanthomonas oryzae pv. oryzae (Xoo) dari koleksi bank gen mikrob BB Biogen. Isolat bakteri P. fluorescens ATCC 13525 Pf, Bacillus sp. I.5, dan Bacillus cereus I.21 dan II.14 dari koleksi IPB Culture Collection (IPBCC) Departemen Biologi, FMIPA, IPB, (Lampiran 1). Media yang digunakan ialah: King’S B agar, nutrient agar (NA), dan wakimoto agar (WA) (Lampiran 2).
Peremajaan Mikrob
Isolat bakteri Pseudomonas aeruginosa C32a dan C32b dan P. fluorescens Pf diperbanyak dengan memindahkan kultur pada medium agar-agar King’S B dan diinkubasi pada suhu ruang selama 24-48 jam. Isolat tersebut diremajakan dan diperiksa kemurniannya dengan menggunakan metode kuadran. Biakan yang telah murni ditumbuhkan pada medium agar-agar miring King’S B dan disimpan dalam
lemari pendingin pada suhu 200C. Hal yang sama juga dilakukan pada isolat
bakteri Xanthomonas oryzae pv. oryzae Xoo yang diperbanyak pada medium WA serta isolat bakteri Serratia marcescens E31, Bacillus sp. I.5, Bacillus cereus I.21 dan II.14, dan B. firmus E65 yang masing-masing diperbanyak dengan memindahkan kultur pada medium NA.
Uji Reaksi Hipersensitif Isolat Uji serta Isolat Patogen Xanthomonas oryzae pv. oryzae terhadap Tanaman Tembakau
Uji reaksi hipersensitif dilakukan pada daun tembakau (Nicotiana tobacum) (Zou et al. 2006). Masing-masing isolat C32a, C32b, dan Pf diperbanyak pada medium King’S B cair. Xoo diperbanyak pada medium WA cair, serta E31, I.5, I.21, II.14, dan E65 diperbanyak pada medium NA cair diinkubasi selama 24
jam pada rotary shaker hingga populasinya mencapai 107cfu/ml. Masing-masing
inokulum diinjeksi sebanyak 1 ml menggunakan syringe steril berukuran 1 ml tanpa jarum pada bagian belakang helaian daun tembakau yang sehat. Sebagai kontrol negatif digunakan akuades steril. Daun tembakau diberi label sesuai isolat yang diinjeksi. Respon tanaman diamati dalam jangka waktu 24-48 jam. Pengamatan pada daun tembakau terjadi nekrosis atau tidak. Isolat-isolat yang tidak menimbulkan reaksi hipersensitif kemudian dipilih untuk diuji daya hambatnya terhadap Xoo.
Seleksi Isolat Uji yang Berpotensi Menghambat Pertumbuhan Xanthomonas
oryzae pv. oryzae
Uji ini menggunakan metode double layer (Lisboa et al. 2006). Uji daya hambat bakteri-bakteri uji terhadap Xoo secara in vitro dilakukan untuk menyeleksi isolat yang berpotensi sebagai agen biokontrol. Sebanyak 800 μL
(107cfu/ml) kultur cair bakteri patogen diinokulasi ke dalam 80 ml WA semipadat
lalu dituang pada permukaan cawan WA padat masing-masing sebanyak 10 ml. Setelah permukaan media WA double layer memadat, potongan kertas saring
Whatman No.2 (diameter 0,7 cm) yang telah direndam dalam larutan yang
mengandung bakteri yang berumur 24 jam, kertas cakram dikeringanginkan kemudian diletakkan di tengah cawan petri yang berisi biakan bakteri Xoo. Biakan diinkubasi selama 24 jam kemudian diamati zona hambat di sekeliling cakram. Perlakuan kontrol terdiri atas, kontrol negatif dengan akuades steril dan kontrol pembanding kimia bakterisida yang mengandung bahan aktif tembaga
sulfat (CuSO4) 50% dengan merek dagang Nordox (Norwegia). Setiap perlakuan
19
setelah inkubasi 24 jam pada suhu ruang. Indeks aktivitas antimikrob dihitung dengan cara (Patra et al. 2009):
Indeks aktivitas antimikrob = Nilai penghambatan perlakuan X 100% Nilai penghambatan kontrol
Uji In Vivo Aplikasi Isolat Uji terhadap Xanthomonas oryzae pv. oryzae pada Tanaman Padi di Rumah Kaca
Bibit padi IR64 yang akan disemai dipersiapkan terlebih dahulu dengan cara dicuci dengan alkohol 95% selama kurang lebih 1 menit kemudian dicuci dengan akuades steril selama tiga menit sebanyak tiga kali. Kemudian dipilih benih yang tenggelam. Setelah dicuci, benih dibungkus dengan kain kasa dan diletakkan di bawah aliran air kran hingga berkecambah selama lebih kurang empat hari,
kemudian ditanam di bak plastik berukuran 15х30 cm2 berisi tanah steril lembab ±
5 Kg yang telah dicampur pupuk NPK (1:1:1). Benih padi berumur 18 hari dipindahkan ke dalam pot-pot berdiameter 30 cm, dan setiap pot ditanam 3 rumpun padi.
Koloni Xoo yang telah diperbanyak pada medium agar-agar miring selama 24 jam diambil sebanyak 2 ose kemudian ditumbuhkan dalam medium WA cair
selama 48 jam dan diukur kerapatannya sampai 107 cfu/ml. Hal yang sama juga
dilakukan pada isolat bakteri C32a, C32b, Pf, E31, I.5, I.21, II.14, dan E65 sesuai medium pertumbuhannya. Penelitian disusun dalam Rancangan Acak Lengkap (RAL) dengan 11 perlakuan dan 3 ulangan, total unit percobaan adalah 33 satuan percobaan, yaitu:
1. Kontrol positif dilakukan penyemprotan senyawa kimia tembaga sulfat 2. Kontrol negatif dilakukan penyemprotan air steril
3. Kontrol sakit dilakukan penyemprotan Xoo 4. Perlakuan dengan penyemprotan inokulum II.14 5. Perlakuan dengan penyemprotan inokulum I.5 6. Perlakuan dengan penyemprotan inokulum Pf 7. Perlakuan dengan penyemprotan inokulum C32a 8. Perlakuan dengan penyemprotan inokulum C32b 9. Perlakuan dengan penyemprotan inokulum I.21
10. Perlakuan dengan penyemprotan inokulum E.31 11. Perlakuan dengan penyemprotan inokulum E.65
Penyemprotan 30 ml filtrat suspensi bakteri dilakukan sebelum inokulasi patogen Xoo (preventif), yaitu umur 7 hari, 14 hari, 28 hari, dan 42 hari setelah tanam. Sebanyak sepuluh daun padi yang telah berkembang penuh atau daun bendera dalam setiap rumpun padi di setiap pot, masing-masing diinokulasi patogen Xoo dengan cara pengguntingan daun (leaf clipping method) pada saat tanaman mencapai 45 hari setelah tanam. Perlakuan kontrol pembanding menggunakan penyemprotan senyawa kimia atau bakterisida yang mengandung tembaga sulfat sebanyak 2 g/L dan kontrol negatif disemprot dengan akuades steril, serta kontrol sakit diinokulasi dengan Xoo. Pengamatan terhadap gejala penyakit HDB dilakukan pada setiap pot dengan selang waktu tiga hari selama sebulan setelah inokulasi melalui pengukuran panjang lesio (lesion length) HDB. Selanjutnya dilakukan penghitungan area under disease progress curve (AUDPC). Luasan area di bawah kurva perkembangan penyakit ini ditentukan untuk mengetahui hubungan antara intensitas penyakit terhadap respon waktu (Shaner & Finney 1977):
n AUDPC = ∑(yi + yi + 1) (ti + 1 –ti) i=1 2 Keterangan: n = jumlah pengamatan ti = waktu pengamatan Yi = intensitas penyakit HDB
Pengamatan juga dilakukan terhadap tinggi tanaman, jumlah anakan padi yang muncul, jumlah malai, bobot basah, dan bobot kering gabah tanaman padi pada akhir pengamatan. Tinggi tanaman padi ± 17 cm dari permukaan tanah pada saat pindah tanam ke dalam pot-pot besar. Jumlah anakan padi pada saat pindah tanam sebanyak 4 anakan pada masing-masing pot. Penelitian disusun dalam Rancangan Acak Lengkap (RAL) dengan 11 perlakuan dan 3 ulangan. Data hasil percobaan dianalisis dengan menggunakan analisis ragam pada taraf kepercayaan 95% (ANOVA), jika menunjukkan pengaruh nyata maka selanjutnya dilakukan uji perbandingan nilai tengah dengan menggunakan Duncan Multiple Range Test
21
(Uji jarak berganda Duncan, DMRT) pada taraf 5% (α=0,05) dengan menggunakan program SPSS 16.0.
23
HASIL
Karakteristik Pertumbuhan Mikrob
Pertumbuhan P. aeruginosa C32a dan C32b lebih cepat dibandingkan P.
fluorescens Pf. Biakan C32a dan C32b mampu tumbuh dalam waktu 24 jam dan
mengubah warna media King’S B menjadi hijau kekuningan (Gambar 1).
Gambar 1 Isolat Pseudomonas aeruginosa.
Isolat P. fluorescens tumbuh berpendar dalam waktu 48 jam pada medium agar King’S B. Serratia marcescens E31, Bacillus sp. I.5, Bacillus cereus I.21 dan II.14, dan B. firmus E65 ditumbuhkan pada media agar-agar miring NA, pertumbuhannya cepat dalam waktu 24 jam pada suhu ruang. Koloni isolat B.
firmus memiliki bentuk tidak beraturan dan menyebar dengan tepian berombak
serta elevasi timbul. Koloni isolat Bacillus sp., S. marcescens, P. aeruginosa, dan
B. cereus dicirikan dengan bentuk bundar, tepian licin, serta elevasi cembung.
Isolat patogen Xanthomonas oryzae pv. oryzae Xoo menunjukkan pertumbuhan koloni berwarna kekuningan berlendir dengan bentuk koloni bulat, halus, mengkilap.
C32b C32a C32a
Reaksi Hipersensitif Isolat Uji serta Isolat Patogen Xanthomonas oryzae pv.
oryzae terhadap Tanaman Tembakau
Pengujian reaksi hipersensitif pada daun tanaman tembakau setelah 48 jam diinjeksi inokulum C32a dan C32b menunjukkan ciri-ciri daun agak menguning tetapi tidak menyebabkan nekrosis (Gambar 2a). Hasil injeksi dengan inokulum dari
isolat yang lainnya tidak menunjukkan perubahan pada daun tembakau dan tidak terjadi nekrosis (Gambar 2a, 2b, dan 2c), artinya bakteri biokontrol tidak patogenik terhadap tanaman tembakau sehingga tidak menyebabkan jaringan kolaps dan mati.
Injeksi dengan menggunakan inokulum Xoo menunjukkan nekrosis munculnya bercak abu-abu gelap dan berubah menjadi kecoklatan pada daun tembakau (Gambar 2d). Injeksi perlakuan kontrol dengan akuades steril tidak terjadi nekrosis (Gambar 2a). Semua bakteri biokontrol tidak menimbulkan reaksi hipersensitif terhadap tanaman tembakau sehingga dapat dilanjutkan dengan pengujian daya hambat isolat-isolat tersebut terhadap Xoo, dan aplikasi pada tanaman padi secara in vivo di rumah kaca.
(a) (b) (c) (d)
Gambar 2 Pengujian reaksi hipersensitif pada daun tembakau setelah 48 jam inokulasi bakteri. Keterangan: (a) dan (b) menggunakan semua isolat uji termasuk kontrol (k), (c) Pf, dan (d) Xoo.
Potensi Isolat Uji dalam Menghambat Pertumbuhan Xanthomonas oryzae pv.
oryzae
Isolat yang berpotensi menghambat pertumbuhan Xoo ditunjukkan dengan pembentukan zona hambat. Pertumbuhan Xoo dapat dihambat oleh isolat C32a,
k
25
C32b, Pf, I.21, dan I.5 (Gambar 3). Perlakuan kontrol negatif menggunakan akuades steril, Xoo tumbuh hingga memenuhi permukaan cawan berisi media WA (Gambar 3). Sedangkan pada perlakuan kontrol pembanding kimia dengan tembaga sulfat menunjukkan zona hambat terhadap pertumbuhan Xoo (Gambar 3).
I.21 I.5
C32a C32b Pf
Kontrol positif (Tembaga sulfat) Kontrol negatif (Akuades steril) Gambar 3 Pengujian antagonis isolat uji terhadap Xoo dibandingkan dengan
kontrol.
Hasil pengujian efektivitas antagonisme bakteri terhadap bakteri patogen Xoo secara in vitro memperlihatkan adanya penghambatan pertumbuhan Xoo dengan terbentuknya zona hambat (Tabel 1). Isolat C32a dan C32b dapat
1 cm 1 cm
1.5 cm 2 cm 2 cm
1 cm 1 cm
menghambat pertumbuhan Xoo secara in vitro yang berbeda nyata terhadap perlakuan kontrol pembanding kimia dengan tembaga sulfat.
Tabel 1 Zona hambat dan indeks aktivitas antimikrob isolat uji terhadap Xoo.
Perlakuan Isolat Nilai rata-rata
zona hambat (cm)
Indeks aktivitas mikrob (%)
C32a Pseudomonas aeruginosa 1,30 a 325
C32b Pseudomonas aeruginosa 1,00 ab 250
Pf Pseudomonas fluorescens 0,80 bc 200
E.31 Serratia marcescens 0,00 e 0
E.65 Bacillus firmus 0,00 e 0
I.21 Bacillus cereus 0,50 bc 125
II.14 Bacillus cereus 0,00 e 0
I.5 Bacillus sp. 0,30 c 75
Tembaga sulfat (+)
- 0,40 c 100
Akuades (-) - 0,00 e 0
Angka-angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf 5% (DMRT)
Aplikasi Isolat Uji terhadap Xanthomonas oryzae pv. oryzae pada Tanaman Padi di Rumah Kaca
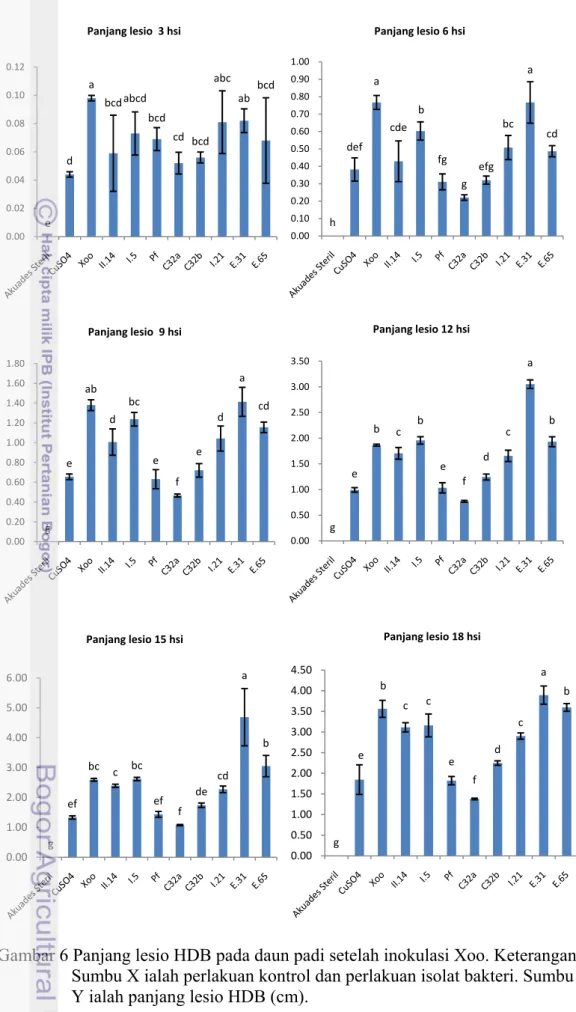
Panjang Lesio Hawar Daun Bakteri. Hasil uji in vivo gejala nekrosis pada
daun padi yang telah diinokulasi Xoo mulai terlihat 2 hari setelah inokulasi (hsi) dengan gejala berupa daun layu seperti tersiram air panas (water soaking) dan berkembang menjadi gejala hawar sehingga daun berwarna kekuningan mulai 3 hsi (Gambar 4). Gejala penyakit tersebut memanjang di sepanjang tepi daun atau di seluruh helaian daun. Panjang lesio bertambah sepanjang waktu pengamatan hingga 18 hsi (Gambar 5).
27
Panjang lesio HDB yang terbentuk 3 hsi dengan aplikasi bakteri tidak menunjukkan perbedaan dengan aplikasi menggunakan bakterisida yang mengandung tembaga sulfat dan Xoo. Penyemprotan dengan suspensi bakteri E31 menunjukkan panjang lesio yang sama dengan perlakuan kontrol sakit yang hanya diinokulasi dengan Xoo tanpa aplikasi biokontrol (Lampiran 3).
Gambar 5 Gejala HDB pada ujung daun menguning 18 hari setelah inokulasi Xoo. Keterangan perlakuan: (1) Akuades steril, (2) C32a, (3) Pf, (4) C32b, (5) I.21, (6) Tembaga sulfat, (7) I.5, (8) E65, (9) II.14, (10) E31, dan (11) Xoo.
Panjang lesio HDB yang terbentuk 6 hsi dengan aplikasi bakteri C32a mulai menunjukkan perbedaan dibandingkan aplikasi menggunakan bakterisida yang mengandung tembaga sulfat dan Xoo (Gambar 6). Aplikasi bakteri C32a merupakan perlakuan terbaik dengan panjang lesio terendah, sedangkan isolat E31 menunjukkan panjang lesio yang lebih tinggi dibandingkan perlakuan Xoo. Demikian juga pada 9 hsi dan 12 hsi menunjukkan hal yang sama. Namun pada 15 hsi aplikasi bakteri C32a, Pf, dan C32b menunjukkan tidak berbeda dengan perlakuan menggunakan tembaga sulfat (Gambar 6).
Pengamatan pada 18 hsi dengan penyemprotan suspensi bakteri C32a merupakan perlakuan terbaik yang mampu menekan intensitas perkembangan penyakit HDB dengan panjang lesio terendah (Lampiran 3). Perlakuan penyemprotan isolat C32a berbeda nyata terhadap perlakuan bakterisida dengan menggunakan tembaga sulfat. Sedangkan perlakuan dengan isolat E31 menunjukkan panjang lesio tertinggi dibandingkan perlakuan menggunakan Xoo.
5 10 8 11 9 7 6 4 2 1 3
Gambar 6 Panjang lesio HDB pada daun padi setelah inokulasi Xoo. Keterangan: Sumbu X ialah perlakuan kontrol dan perlakuan isolat bakteri. Sumbu Y ialah panjang lesio HDB (cm).
e d a bcd abcd bcd cd bcd abc ab bcd 0.00 0.02 0.04 0.06 0.08 0.10 0.12 Panjang lesio 3 hsi h def a cde b fg g efg bc a cd 0.00 0.10 0.20 0.30 0.40 0.50 0.60 0.70 0.80 0.90 1.00 Panjang lesio 6 hsi g e ab d bc e f e d a cd 0.00 0.20 0.40 0.60 0.80 1.00 1.20 1.40 1.60 1.80 Panjang lesio 9 hsi g e b c b e f d c a b 0.00 0.50 1.00 1.50 2.00 2.50 3.00 3.50 Panjang lesio 12 hsi g ef bc c bc ef f de cd a b 0.00 1.00 2.00 3.00 4.00 5.00 6.00 Panjang lesio 15 hsi g e b c c e f d c a b 0.00 0.50 1.00 1.50 2.00 2.50 3.00 3.50 4.00 4.50 Panjang lesio 18 hsi
29
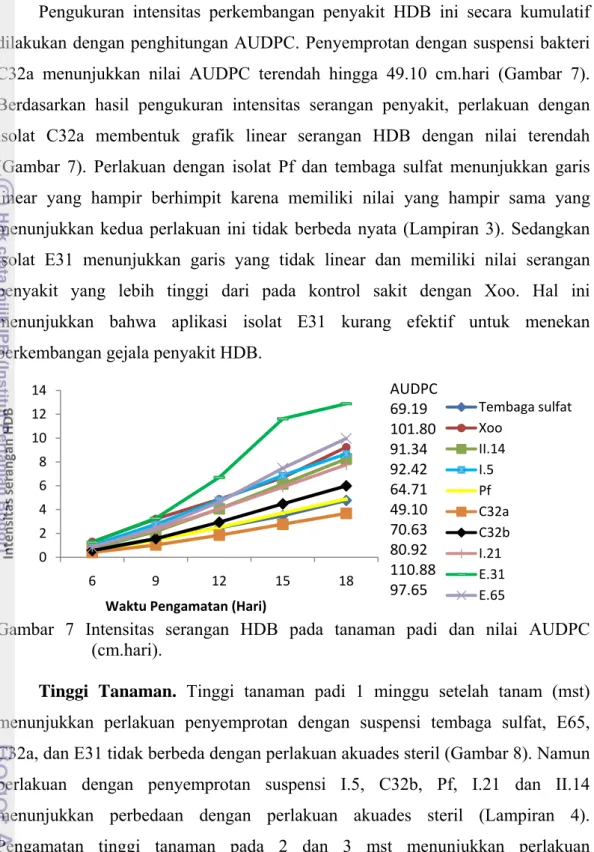
Pengukuran intensitas perkembangan penyakit HDB ini secara kumulatif dilakukan dengan penghitungan AUDPC. Penyemprotan dengan suspensi bakteri C32a menunjukkan nilai AUDPC terendah hingga 49.10 cm.hari (Gambar 7). Berdasarkan hasil pengukuran intensitas serangan penyakit, perlakuan dengan isolat C32a membentuk grafik linear serangan HDB dengan nilai terendah (Gambar 7). Perlakuan dengan isolat Pf dan tembaga sulfat menunjukkan garis linear yang hampir berhimpit karena memiliki nilai yang hampir sama yang menunjukkan kedua perlakuan ini tidak berbeda nyata (Lampiran 3). Sedangkan isolat E31 menunjukkan garis yang tidak linear dan memiliki nilai serangan penyakit yang lebih tinggi dari pada kontrol sakit dengan Xoo. Hal ini menunjukkan bahwa aplikasi isolat E31 kurang efektif untuk menekan perkembangan gejala penyakit HDB.
Gambar 7 Intensitas serangan HDB pada tanaman padi dan nilai AUDPC (cm.hari).
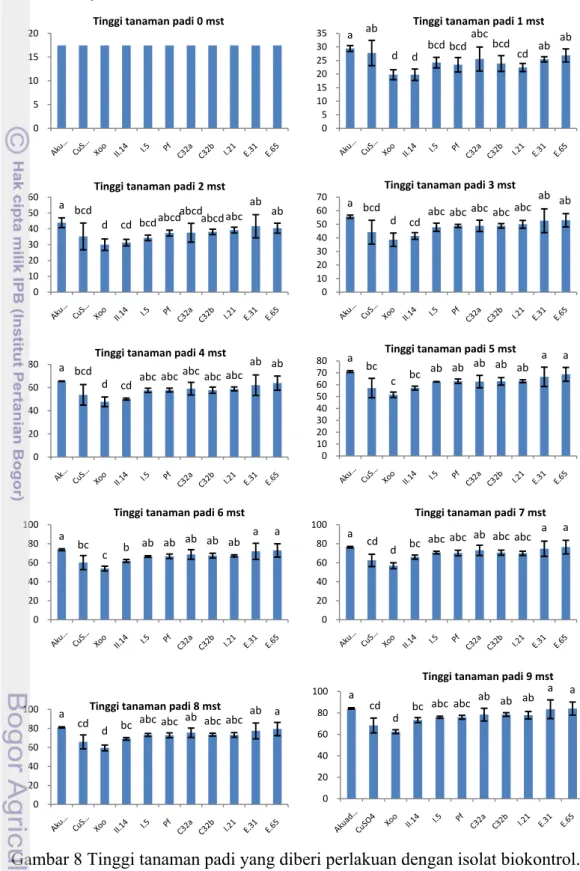
Tinggi Tanaman. Tinggi tanaman padi 1 minggu setelah tanam (mst)
menunjukkan perlakuan penyemprotan dengan suspensi tembaga sulfat, E65, C32a, dan E31 tidak berbeda dengan perlakuan akuades steril (Gambar 8). Namun perlakuan dengan penyemprotan suspensi I.5, C32b, Pf, I.21 dan II.14 menunjukkan perbedaan dengan perlakuan akuades steril (Lampiran 4). Pengamatan tinggi tanaman pada 2 dan 3 mst menunjukkan perlakuan penyemprotan dengan suspensi E65, E31, I.21, C32b, C32a, dan Pf tidak berbeda dengan perlakuan akuades steril.
Perlakuan E65, E31, C32a, I.21, Pf, C32b, dan I.5 menunjukkan tinggi tanaman yang cenderung sama dengan perlakuan yang disemprot akuades steril
0 2 4 6 8 10 12 14 6 9 12 15 18 Intensitas serangan HDB Waktu Pengamatan (Hari) Tembaga sulfat Xoo II.14 I.5 Pf C32a C32b I.21 E.31 E.65 AUDPC 69.19 101.80 91.34 92.42 64.71 49.10 70.63 80.92 110.88 97.65
pada 4 mst hingga 6 mst. Tinggi tanaman padi 7 mst menunjukkan perlakuan penyemprotan dengan suspensi isolat E65, E31, C32a, I.5, C32b, Pf, dan I.21 tidak berbeda dengan perlakuan akuades steril. Pengamatan tinggi tanaman padi pada 8 dan 9 mst menunjukkan perlakuan penyemprotan dengan suspensi E65, E31, C32a, C32b, I.21, Pf, dan I.5 juga tidak berbeda dengan perlakuan akuades steril. Namun secara keseluruhan pengamatan dari 1 mst hingga 9 mst menunjukkan bahwa perlakuan dengan E65 memiliki kecenderungan meningkatkan tinggi tanaman padi hampir sama dengan tinggi tanaman padi pada perlakuan menggunakan akuades steril. Sedangkan dari pengamatan 3 mst hingga 9 mst menunjukkan bahwa perlakuan dengan penyemprotan tembaga sulfat (kontrol pembanding kimia) dan suspensi II.14 memiliki kecenderungan tinggi tanaman yang lebih rendah dibandingkan dengan perlakuan kontrol akuades steril.
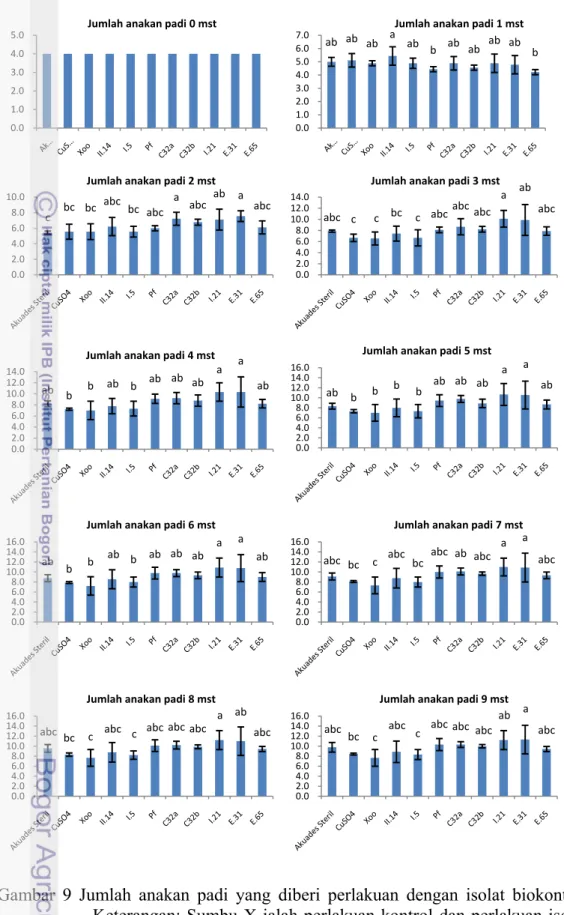
Jumlah Anakan. Saat 1 mst jumlah anakan padi seluruh perlakuan dengan
isolat bakteri menunjukkan tidak berbeda dibandingkan perlakuan akuades steril (Gambar 9). Jumlah anakan yang muncul dengan perlakuan II.14 cenderung lebih banyak dibandingkan dengan perlakuan isolat-isolat lainnya (Lampiran 5). Jumlah anakan padi 2 mst pada perlakuan isolat E31, C32a, dan I.21 menunjukkan jumlah anakan cenderung lebih banyak dari pada perlakuan akuades steril. Penyemprotan dengan suspensi E31 menunjukkan jumlah anakan cenderung lebih banyak dari pada perlakuan dengan akuades steril.
Suspensi isolat I.21, E31, C32a, C32b, Pf, E65, II.14, I.5 dan tembaga sulfat yang disemprotkan pada tanaman padi pada 3 mst menunjukkan jumlah anakan tidak berbeda dengan perlakuan akuades steril. Namun penyemprotan dengan suspensi I.21 menunjukkan jumlah anakan sebanyak 10,11 lebih banyak dari pada jumlah anakan dengan perlakuan akuades steril yaitu 7,89 (Lampiran 5).
Jumlah anakan padi 4, 5, dan 6 mst pada perlakuan isolat I.21, E31, C32a, Pf, C32b, E65, II.14, I.5 dan tembaga sulfat tidak berbeda dengan perlakuan akuades steril. Sedangkan pada pengamatan 7,8, dan 9 mst perlakuan I.21, E.31, C32a, Pf, C32b, E65, II.14, tembaga sulfat, dan I.5 tidak beda dengan perlakuan akuades steril. Namun dari 7 mst hingga 8 mst hanya perlakuan isolat I.21 yang menunjukkan jumlah anakan cenderung lebih banyak dari pada perlakuan akuades steril. Berbeda halnya pada 9 mst, perlakuan menggunakan isolat E31
31
menunjukkan jumlah anakan lebih banyak dibandingkan dengan perlakuan isolat-isolat lainnya.
Gambar 8 Tinggi tanaman padi yang diberi perlakuan dengan isolat biokontrol. Keterangan: Sumbu X ialah perlakuan kontrol dan perlakuan isolat. Sumbu Y ialah tinggi tanaman padi (cm).
0 5 10 15 20 Tinggi tanaman padi 0 mst a ab d d bcd bcd abc bcd cd ab ab 0 5 10 15 20 25 30 35 Tinggi tanaman padi 1 mst a bcd d cd bcdabcd abcd abcd abc ab ab 0 10 20 30 40 50 60 Tinggi tanaman padi 2 mst a bcd
d cd abc abc abc abc abc ab ab 0 10 20 30 40 50 60 70 Tinggi tanaman padi 3 mst a bcd
d cd abc abc abc abc abc ab ab 0 20 40 60 80 Tinggi tanaman padi 4 mst a bc c bc ab ab ab ab ab a a 0 10 20 30 40 50 60 70 80 Tinggi tanaman padi 5 mst a bc c b ab ab ab ab ab a a 0 20 40 60 80 100 Tinggi tanaman padi 6 mst a cd d bc abc
abc ab abc abc a a
0 20 40 60 80 100 Tinggi tanaman padi 7 mst a cd
d bc abc abc ab abc abc ab a 0 20 40 60 80 100 Tinggi tanaman padi 8 mst a cd d bc abc abc ab ab ab a a 0 20 40 60 80 100 Tinggi tanaman padi 9 mst
Gambar 9 Jumlah anakan padi yang diberi perlakuan dengan isolat biokontrol. Keterangan: Sumbu X ialah perlakuan kontrol dan perlakuan isolat. Sumbu Y ialah jumlah anakan padi.
0.0 1.0 2.0 3.0 4.0 5.0 Jumlah anakan padi 0 mst ab ab ab a ab b ab ab ab ab b 0.0 1.0 2.0 3.0 4.0 5.0 6.0 7.0 Jumlah anakan padi 1 mst c bc bc abc bc abc a abc ab a abc 0.0 2.0 4.0 6.0 8.0 10.0 Jumlah anakan padi 2 mst
abc c c bc c abcabcabc a ab abc 0.0 2.0 4.0 6.0 8.0 10.0 12.0 14.0 Jumlah anakan padi 3 mst ab b b ab b ab ab ab a a ab 0.0 2.0 4.0 6.0 8.0 10.0 12.0 14.0 Jumlah anakan padi 4 mst ab b b b b ab ab ab a a ab 0.0 2.0 4.0 6.0 8.0 10.0 12.0 14.0 16.0 Jumlah anakan padi 5 mst ab b b ab b ab ab ab a a ab 0.0 2.0 4.0 6.0 8.0 10.0 12.0 14.0 16.0 Jumlah anakan padi 6 mst
abc bc c abc bc abc ab abc
a a abc 0.0 2.0 4.0 6.0 8.0 10.0 12.0 14.0 16.0 Jumlah anakan padi 7 mst
abc bc c abc c abc abc abc a ab abc 0.0 2.0 4.0 6.0 8.0 10.0 12.0 14.0 16.0 Jumlah anakan padi 8 mst abc
bc c abc c abc abc abc ab a abc 0.0 2.0 4.0 6.0 8.0 10.0 12.0 14.0 16.0 Jumlah anakan padi 9 mst
33
Jumlah Malai. Pengamatan jumlah malai padi dilakukan saat 9 mst.
Perlakuan penyemprotan dengan isolat I.21, C32a, Pf, C32b, dan E31 pada tanaman padi yang terserang Xoo menunjukkan jumlah malai tidak berbeda dengan jumlah malai pada perlakuan dengan akuades steril (Gambar 10). Sedangkan perlakuan dengan isolat II.14, tembaga sulfat, E65, dan I.5 menunjukkan jumlah malai yang cenderung lebih rendah dibandingkan dengan akuades steril.
Gambar 10 Jumlah malai padi yang terserang Xoo dan diberi perlakuan dengan isolat biokontrol dan panen 9 minggu setelah tanam.
Produksi Gabah. Produksi padi yang terserang Xoo cenderung lebih tinggi
pada perlakuan dengan penyemprotan bakteri biokontrol C32a, Pf, C32b, dan I.21 dari pada dengan akuades steril. Penyemprotan dengan isolat C32a menghasilkan produksi gabah paling tinggi dibandingkan perlakuan yang lain yaitu sebesar 16,44 g untuk bobot basah dan 14,86 g untuk bobot kering gabah (Lampiran 6). Sedangkan perlakuan dengan isolat I.5, II.14, E31, E65, dan tembaga sulfat menunjukkan hasil gabah yang lebih rendah dari pada perlakuan dengan akuades steril.
Gambar 11 Bobot gabah padi yang terserang Xoo dan diberi perlakuan dengan isolat biokontrol panen panen 9 minggu setelah tanam. Keterangan:
(■)Bobot Basah, ( ■) Bobot Kering.
a bc bc bc bc a a a a ab c 0 2 4 6 8 10 12 Akuades Steril Tembaga sulfat
Xoo II.14 I.5 Pf C32a C32b I.21 E.31 E.65
Jumlah Malai Perlakuan d de e de d b a bc c de de de de e de d b a bc c d de 0 5 10 15 20 Akuades Steril Tembaga sulfat
Xoo II.14 I.5 Pf C32a C32b I.21 E.31 E.65
Bo bo t gabah (g) Perlakuan