PENGARUH MACAM DAN KONSENTRASI BAHAN
ORGANIK SEBAGAI SUMBER ZAT PENGATUR TUMBUH
ALAMI TERHADAP PERTUMBUHAN BIBIT TEBU
(
Saccharum officinarum
L.)
SKRIPSI
OLEH
HELENA LEOVICI
09/281768/PN/11591
FAKULTAS PERTANIAN
UNIVERSITAS GADJAH MADA
I. PENDAHULUAN
A. Latar Belakang
Menurut Arifin (2008), gula merupakan salah satu komoditas khusus di bidang pertanian yang telah ditetapkan Indonesia dalam forum perundingan Organisasi Perdagangan Dunia (WTO), bersama dengan beras, jagung, dan juga kedelai. Bahan baku industri gula yang merupakan komoditas unggulan dan dibudidayakan di Indonesia yakni tebu (Saccharum officinarum L).
Beberapa tahun terakhir industri gula mengalami penurunan produksi hingga mencapai titik nadir sebesar 1,48 juta ton pada tahun 1999. Sementara itu pada tahun 2002 produksi gula mencapai 1,76 juta ton, sedangkan konsumsi gula nasional mencapai 3,3 juta ton, sehingga mencapai defisit sebesar 1,54 juta ton. Defisit yang sangat besar tersebut dapat dicukupi oleh masuknya gula impor dengan mudah dan harga yang kompetitif, walaupun pendapatan petani terancam menurun karena daya saing produk gula lokal lemah. Penurunan produktivitas selama 27 tahun (1975-2002) terutama dicerminkan penurunan rendemen, sementara produktivitas tanaman alternatif mengalami kenaikan. Agar tebu memiliki daya saing terhadap tanaman alternatif, maka kinerjanya harus ditingkatkan agar mendapatkan hasil yang mendekati potensi hasil dengan penerapan baku teknis pengelolaan usahatani dan prosesing gula (Anonim, 2008).
Perluasan lahan kini tidak lagi terpaku pada lahan-lahan subur saja karena dewasa ini lahan subur sudah semakin sulit ditemukan akibat pertambahan penduduk yang semakin tinggi dan kegiatan perekonomian yang memacu alih fungsi lahan. Oleh sebab itu, kegiatan pertanian saat ini sudah mulai dikembangkan di lahan marginal yang mempunyai karakteristik keterbatasan dalam sesuatu hal, baik keterbatasan satu unsur/komponen maupun lebih dari satu unsur/komponen (Gunadi, 2002). Salah satu lahan marginal yang mungkin dapat dimanfaatkan sebagai lahan pertanian ialah lahan pasir pantai.
Di Indonesia terdapat ± 1.060.000 ha lahan pasir pantai. Kendala umum lahan ini bagi pertanian adalah tekstur kasar, daya simpan air/zat hara rendah, kandungan bahan organik rendah, kemampuan menukar kation yang rendah, daya meluluskan air dan udara tinggi, suhu tanah dan udara pada siang hari sangat tinggi, kecepatan angin sangat tinggi, angin mengandung partikel garam, dan mudah tererosi oleh angin (Kertonogero et al., 2009). Keterbatasan lahan pasir pantai perlu diatasi supaya mampu menjadi tempat tumbuh tanaman yang baik.
Lahan pasir pantai memungkinkan bagi tebu untuk tumbuh dengan baik. Menurut Elawad et al. (1982), tebu termasuk kelompok tanaman C¬4 yang memiliki sifat antara lain dapat beradaptasi terhadap kondisi lingkungan yang terik (panas) dan bersuhu tinggi, fotorespirasinya rendah dimana sangat efisien dalam menggunakan air serta toleran terhadap lingkungan yang mengandung garam.
Berdasarkan sumbernya, ZPT dapat diperoleh baik secara alami maupun sintetik. Zat pengatur tumbuh alami umumnya langsung tersedia di alam dan berasal dari bahan organik, contohnya air kelapa, urin sapi, dan ekstraksi dari bagian tanaman. Zat pengatur tumbuh sintetik didapat melalui proses sintesa oleh manusia dan sudah dapat dipastikan rumus kimianya (Shahab et al., 2009; Zhao, 2010). Zat pengatur tumbuh bersumber bahan organik lebih bersifat ramah lingkungan, mudah didapat, aman digunakan, dan lebih murah.
Aplikasi bahan organik sebagai sumber ZPT alami diharapkan dapat mempercepat pembentukan serta pertumbuhan akar dan tajuk bibit tebu di media pasir pantai. Selain itu, dapat menunjukkan pula macam dan konsentrasi bahan organik yang paling optimum sebagai sumber ZPT alami bagi pertumbuhan bibit tebu. Hal ini dapat dijadikan sebagai rujukan bagi usahatani ataupun perkebunan tebu supaya dalam melakukan pembibitan dapat lebih efektif, efisien, aman, dan ramah lingkungan.
B. Tujuan Penelitian
1. Mengetahui pengaruh macam dan konsentrasi bahan organik sebagai sumber zat pengatur tumbuh alami terhadap pertumbuhan bibit tebu.
2. Menentukan konsentrasi optimum beberapa macam bahan organik sebagai sumber zat pengatur tumbuh alami bagi pertumbuhan bibit tebu.
C. Kegunaan
1. Penelitian ini diharapkan dapat memberi acuan pemanfaatan bahan organik sebagai sumber zat pengatur tumbuh yang bermanfaat bagi pertumbuhan tebu. 2. Hasil penelitian ini diharapkan mampu menjadi rujukan bagi usahatani ataupun
II. TINJAUAN PUSTAKA
A. Tebu (Saccharum officinarum L.)
Tebu merupakan tanaman yang berasal dari India. Namun, banyak juga literatur yang menyatakan bahwa tebu berasal dari Polynesia. Meski demikian, menurut Nikolai Ivanovich Vavilov, seorang ahli botani Soviet, yang telah melakukan ekspedisi pada 1887-1942 ke beberapa daerah di Asia, Eropa, Afrika, Amerika Selatan, dan seluruh Uni Soviet, memastikan bahwa sentrum utama asal tanaman ini adalah India dan Indo-Malaya yang meliputi Indo-China, Malaysia, Philipina, dan Indonesia (Ahira, 2009).
Berikut merupakan klasifikasi botani tanamaan tebu (Plantamor, 2012): Kingdom : Plantae (tumbuhan)
Subkingdom : Tracheobionta (tumbuhan berpembuluh) Super Divisi : Spermatophyta (menghasilkan biji) Divisi : Magnoliophyta (tumbuhan berbunga) Kelas : Liliopsida (berkeping satu/monokotil) Sub Kelas : Commelinidae
Ordo : Poales
Famili : Poaceae (suku rumput-rumputan) Genus : Saccharum
Spesies : Saccharum officinarum L.
Tanaman tebu memiliki morfologi yang tidak jauh berbeda dengan tumbuhan yang berasal dari famili rumput-rumputan. Tanaman ini memiliki ketinggian sekitar 2-5 meter. Menurut Nadia (2012), morfologi tanaman tebu secara garis besar dapat dikelompokkan menjadi 4 bagian, yaitu:
a. Akar: berbentuk serabut, tebal dan berwarna putih
b. Batang: berbentuk ruas-ruas yang dibatasi oleh buku-buku, penampang melintang agak pipih, berwarna hijau kekuningan
c. Daun: berbentuk pelepah, panjang 1-2 m, lebar 4-8 cm, permukaan kasar dan berbulu, berwarna hijau kekuningan hingga hijau tua
Pada bagian pangkal sampai pertengahan batang memiliki ruas yang panjang, sedangkan pada bagian pucuk memiliki ruas yang pendek. Pada bagian pucuk batang terdapat titik tumbuh terdapat titik tumbuh yang penting untuk pertumbuhan meninggi. Selain itu juga terdapat lapisan berlilin di bagian bawah ruas dan pada ruas di bagian pucuk batang. Daun tanaman tebu merupakan jenis daun tidak lengkap, karena terdiri dari helai daun dan pelepah daun saja. Sendi segitiga terdapat di antara pelepah daun dan helaian daun. Pada bagian sisi dalamnya, terdapat lidah daun yang membatasi antara helaian daun dan pelepah daun. dalamnya terdapat lidah daun yang membatasi helaian dan pelepah daun. Warna daun tebu bermacam-macam ada yang hijau tua, hijau kekuningan, merah keunguan dan lain-lain. Ujung daun tebu meruncing dan tepinya bergerigi. Bunga tebu merupakan malai yang berbentuk piramida yang terdiri dari 3 helai daun tajuk bunga, 1 bakal buah, dan 3 benang sari. Kepala putiknya berbentuk bulu (Putri et al., 2010).
Menurut James (2004), tanaman tebu memiliki perakaran serabut, yang dapat dibedakan menjadi akar primer dan akar sekundar. Akar primer adalah akar yang tumbuh dari mata akar buku tunas stek batang bibit. Karakteristik akar primer yaitu halus dan bercabang banyak, sedangkan akar sekunder adalah akar yang tumbuh dari mata akar dalam buku tunas yang tumbuh dari stek bibit, bentuknya lebih besar, lunak, dan sedikit bercabang.
Tebu merupakan tanaman asli tropika basah. Tanaman ini tumbuh baik di daerah beriklim tropis. Umur tanaman sejak ditanam sampai bisa dipanen mencapai kurang lebih 1 tahun. Tebu tergolong tanaman perkebunan semusim yang memiliki zat gula di dalam batangnya (Supriyadi, 1992). Tebu juga termasuk kelompok tanaman C¬4 yang memiliki sifat antara lain dapat beradaptasi terhadap kondisi lingkungan yang terik (panas) dan bersuhu tinggi, fotorespirasinya rendah dimana sangat efisien dalam menggunakan air serta toleran terhadap lingkungan yang mengandung garam (Elawad et al., 1982).
penyinaran 12-14 jam tiap harinya. Angin dengan kecepatan kurang lebih 10 km/jam di siang hari berdampak positif bagi pertumbuhan tebu. Kelembaban yang rendah (45-65 %) sangat baik untuk pemasakan karena tebu sangat cepat kering. Kelembaban tinggi dapat mempengaruhi fotosintesis dengan akibat pembentukan gula juga terlambat. Tanaman tebu memerlukan curah hujan yang berkisar antara 1.000-1.300 mm/tahun dengan sekurang-kurangnya 3 bulan kering. Curah hujan yang ideal adalah selama 5-6 bulan dengan rata-rata curah hujan 200 mm, curah hujan yang tinggi diperlukan untuk pertumbuhan vegetatif yang meliputi perkembangan anakan, tinggi dan besar batang. Periode selanjutnya selama 2 bulan dengan curah hujan 125 mm dan 4-5 bulan berkaitan dengan curah hujan kurang dari 75 mm/bulan yang merupakan periode kering. Pada periode ini merupakan pertumbuhan generatif dan pemasakan tebu (Kuntohartono, 1982). Menurut Soepardiman (1996), bila musim kering tiba sebelum pertumbuhan vegetatif berakhir, maka tanaman tebu yang tidak diairi akan mati sebelum mencapai tingkat masak, sebaliknya bila hujan turun terus-menerus maka pertumbuhan vegetatif tebu tetap giat, sehingga tidak mencapai kadar gula tertinggi.
Menurut Sudiatso (1999), tebu menghendaki tanah yang gembur sehingga aerasi udara dan perakaran berkembang sempurna. Tekstur tanah ringan sampai agak berat dengan berkemampuan menahan air cukup dan porositas 30 % merupakan tekstur tanah yang ideal bagi pertumbumbuhan tanaman tebu. Kedalaman (solum) tanah untuk pertumbuhan tanaman tebu minimal 50 cm dengan tidak ada lapisan kedap air dan permukaan air 40 cm. Tanaman ini membutuhkan banyak nutrisi dan memerlukan tanah subur. Tanaman tebu juga mampu tumbuh di pantai sampai dataran tinggi antara 0-1.400 m di atas permukaan laut, tetapi mulai ketinggian 1.200 m di atas permukaan laut pertumbuhan tanaman relatif lambat. Bentuk lahan sebaiknya bergelombang antara 0-15 %. Lahan terbaik bagi tanaman tebu di lahan tegalan adalah lahan dengan kemiringan kurang dari 8 %, kemiringan sampai 10 % dapat juga digunakan untuk areal yang dilokalisir. Syarat lahan tebu adalah berlereng panjang, rata dan melandai sampai 2 % apabila tanahnya ringan dan sampai 5 % apabila tanahnya lebih berat.
tidak dapat menyerap air, sedangkan apabila tebu ditanam pada tanah dengan pH di atas 7 tanaman akan sering kekurangan unsur fosfor. Menurut Kuntohartono (1982), tanah dengan kapasitas penukaran kation yang tinggi dapat memberikan hara yang baik. Pada pH netral efisiensi pemupukan NPK lebih tinggi, sedangkan pada pH kurang dari 5 dapat menyebabkan tersedianya unsur P untuk Al dan Fe. Unsur Cl, Fe, dan Al merupakan bahan racun utama dalam tanah. Tanah yang airnya buruk dapat menimbulkan keracunan Fe, Al, dan sulfat (SO4-). Kadar Cl 0,06-0,10 % telah bersifat racun bagi akar tanaman. Keracunan unsur Fe dan Al dapat dikurangi dengan bantuan kapur fiksasi. Oleh karena itu, tanah masam dengan pH di bawah 5 perlu diberikan kapur fiksasi (CaCO3).
B. Zat Pengatur Tumbuh
Hormon tumbuhan atau fitohormon sering dikenal dengan sebutan zat pengatur tumbuh (plant growth regulator) untuk membedakanya dengan hormon pada hewan. Ada lima kelompok utama ZPT yaitu auksin (auxins), sitokinin (cytokinins), giberelin (gibberellins, GAs), etilena (etena, ETH), dan asam absisat (abscisic acid, ABA). Auksin, sitokinin, dan giberelin termasuk hormon yang bersifat positif bagi pertumbuhan tanaman pada konsentrasi fisiologis. Etilena dapat mendukung maupun menghambat pertumbuhan. Asam absisat merupakan penghambat (inhibitor) pertumbuhan (Dinas Pertanian dan Tanaman Pangan, 2012).
mampu mengurangi hambatan biologis yang terdapat dalam tanaman, sehingga penggunaannya sering dimanfaatkan untuk meningkatkan produktivitas tanaman.
Berdasarkan keberadaannya pada tanaman, ZPT digolongkan menjadi ZPT endogen dan ZPT eksogen. Zat pengatur tumbuh endogen merupakan ZPT yang diproduksi di dalam tubuh tanaman, sedangkan zat pengatur tumbuh eksogen adalah ZPT yang ditambahkan/diaplikasikan pada tanaman. Dalam penyetekan, keberadaan keduanya penting untuk diperhatikan. Jika di dalam bahan setek sudah cukup terdapat ZPT endogen, maka penambahan ZPT eksogen tidak diperlukan. Sebaliknya, jika bahan setek berada dalam kondisi kurang ZPT endogen, maka keberhasilan penyetekan sangat ditentukan oleh penambahan ZPT eksogen (Harsanto, 1997).
Zat pengatur tumbuh eksogen dapat berupa ZPT alami atau ZPT sintetis. Zat pengatur tumbuh alami merupakan ZPT yang langsung tersedia di alam dan biasanya banyak terdapat di sekitar kita dengan harga yang murah, contohnya: air kelapa, urin sapi, ekstraksi dari bagian tanaman, dan lain-lain. Zat pengatur tumbuh sintetis merupakan ZPT tiruan yang disintesa oleh manusia dan sudah dapat dipastikan rumus kimianya. Keuntungan dari penggunaan ZPT sintetis adalah kemudahan penggunaan dalam dosis yang tepat, tetapi biasanya tersedia dengan harga yang mahal. Kelemahan dari ZPT alami adalah kondisinya yang bervariasi akibat pengaruh lingkungan maupun fisiologis mahluk hidup yang memproduksinya. Hal yang penting diperhatikan dalam penggunaan ZPT alami yaitu ketepatan kondisi dan dosis yang dipakai. Meskipun demikian, usaha ini akan memberikan kemudahan introduksi pada petani-petani kecil karena aplikasinya tidak membutuhkan biaya besar. Apabila bahan-bahan asli (alami) maupun tiruannya diberikan pada tanaman, maka tanaman akan menerima pengaruhnya sebagaimana pengaruh dari zat pengaruh tumbuh sejenis yang dihasilkan oleh tanaman itu sendiri (Harsanto, 1997; Prayoga, 2013).
C. Bahan Organik sebagai Sumber Zat Pengatur Tumbuh a. Air Kelapa
umur buah. Air kelapa mengandung karbohidrat, lemak, protein, vitamin, dan sejumlah bahan anorganik yang dapat dimanfaatkan untuk berbagai keperluan (Grimwood, 1975). Penelitian lebih lanjut yang dilakukan oleh Dwidjoseputro (1989) menunjukkan bahwa selain mengandung kalori, protein, dan mineral, air kelapa muda mengandung sitokinin yaitu zat pengatur tumbuh yang mempercepat pembelahan sel. Sitokinin berpengaruh pada pertumbuhan tunas-tunas dan akar.
Air kelapa merupakan salah satu sumber alami hormon tumbuh yang dapat digunakan untuk memacu pembelahan sel dan merangsang pertumbuhan tanaman. Endosperm cair buah kelapa yang belum matang mengandung senyawa yang dapat memacu sitokinesis (Salisbury dan Ross, 1995). Air kelapa mengandung zeatin yang termasuk kelompok sitokinin (Taiz dan Zeiger, 1998). Sama halnya seperti yang dinyatakan oleh George dan Sherington (1984) yaitu bahwa zat pengatur tumbuh utama yang terdapat dalam air kelapa adalah sitokinin. Menurut Salisbury dan Ross (1995), sitokinin yang terdapat dalam air kelapa terbukti mampu mendorong pembelahan sel pada jaringan akar wortel.
Menurut Abidin (1998), sitokinin dapat memacu terjadinya organogenesis yang dapat mempercepat pertumbuhan daun. Selain berfungsi sebagai diferensiasi tunas adventif dan organ, juga berfungsi dalam sintesis protein dan pembelahan sel. Dengan adanya sitokinin maka bobot basah tanaman semakin bertambah. Hormon auksin berfungsi untuk merangsang pembesaran sel, sintesis DNA kromosom, serta pertumbuhan aksis longitudinal dan juga untuk merangsang pertumbuhan akar pada setekan atau cangkokan. Giberelin atau sering disebut asam giberelat (GA) merupakan hormon perangsang pertumbuhan tanaman yang diperoleh dari Gibberella fujikuroi, aplikasi untuk memicu munculnya bunga. Penelitian Murniati dan Zuhri (2002) mengungkapkan bahwa giberelin mampu mempercepat pertumbuhan biji kopi. Giberelin merupakan senyawa organik yang berperan dalam proses perkecambahan karena dapat mengaktifkan reaksi enzimatik di dalam benih (Wilkins, 1989).
Air kelapa mempunyai aktivitas sitokinin yang tinggi dengan kehadiran dari zeatin, zeatin glukosida, ribosida, dan 1,3-difenilurea (Wattimena et al., 2003). Sitokinin memperlambat proses penghancuran butir-butir klorofil pada daun-daun yang terlepas pada tanaman dan memperlambat proses senesen pada daun, buah, dan organ-organ lainnya (Wattimena, 1988). Selain itu, air kelapa juga mengandung IAA (Mandang, 1993) yang mempengaruhi pembesaran sel, mencegah absisi (pengguguran daun), pertumbuhan akar yaitu mendorong pembesaran sel-sel akar, dimana selang konsentrasi yang mendorong pembesaran sel-sel akar adalah sangat rendah (Wattimena, 1988).
Hasil penelitian Katuuk (2000) menyatakan bahwa pemberian 250 ml/l air kelapa menunjukkan waktu yang paling cepat dalam perkecambahan biji anggrek macan (Grammatohyllum scriptum). Air kelapa sebagai zat pengatur tumbuh juga telah diteliti oleh Zamroni dan Darini (2009) untuk melihat pengaruhnya pada tanaman cabe jamu. Hasil penelitiannya menunjukkan bahwa penggunaan air kelapa 25 % berpengaruh nyata terhadap pertumbuhan setek tanaman cabe jamu.
b. Urin Sapi
makanan, aktivitas ternak, suhu eksternal, konsumsi air, musim, dan lain sebagainya. Banyaknya urin dan feses yang dihasilkan adalah sebesar 10 % dari berat ternak. Besarnya rasio urin dan feses yang dihasilkan oleh sapi perah yaitu 1:2,2 (31 % urin, 69 % feses) (Taiganides, 1978). Menurut Sauer et al. (1999), sekitar 60-90 % nutrien yang dimakan ternak akan dieksresikan kembali melalui feses dan urin. Di dalam urin, unsur hara yang paling dominan adalah K, N, dan NH4-N. Urin sapi berpotensi menjadi produk yang lebih bernilai tinggi. Urin memiliki keunggulan yaitu mengandung kadar N dan K sangat tinggi, mudah diserap tanaman dan mengandung hormon pertumbuhan tanaman.
Menurut Dukes (1955), rata-rata jumlah urin yang dihasilkan sapi per hari sebanyak 14,2 liter. Urin yang normal mengandung air, urea, kraetinin, purin (asam urat, kantin, hipoksantin), allantion, asam hipurik, ammonia, asam amino, sulfat, sulfur, garam anorganik, pigmen urokrom, dan urobilin. Menurut Danarto (2008), urin sapi perah mengandung hormon yang bisa memacu pertumbuhan tanaman, seperti giberelin, sitokinin, dan auksin. Sapi perah memakan lebih banyak hijauan daripada sapi potong sehingga kandungan auksin hijauan dapat disekresikan lewat urin. Menurut Prawoto dan Suprijadji (1992), ternak yang banyak makan rumput serta hijauan lainnya mengeluarkan air seni yang cenderung banyak mengandung auksin dan GA. Kadar auksin urin sapi betina lebih tinggi daripada sapi jantan (Supriadji, 1985).
Tabel 2.2. Kandungan zat yang terdapat dalam urin sapi perah
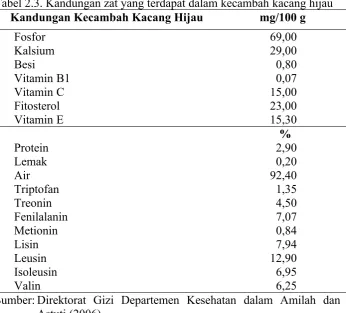
Kecambah memiliki bagian putih dengan panjang hingga tiga sentimeter. Kecambah berasal dari biji-bijian, seperti kacang hijau. Kacang hijau termasuk dalam famili Leguminoceae, sub famili Papilonaceae. Bentuk kecambah diperolah setelah biji diproses selama beberapa hari. Menurut Soeprapto (1992), komponen air pada kecambah kacang hijau (tauge) merupakan bagian yang terbesar bila dibandingkan dengan komponen lainnya. Gula kacang hijau didapatkan dalam bentuk sukrosa, fruktosa, dan glukosa. Asam amino esensial yang terkandung dalam protein kacang hijau antara lain triptofan 1,35 %, treonin 4,50 %, fenilalanin 7,07 %, metionin 0,84 %, lisin 7,94 %, leusin 12,90 %, isoleusin 6,95 %, valin 6,25 %. Selain itu, terdapat pula sistein, tirosin, arginin, histidin, alanin, glisin, prolin, serta serin. Menurut Rismunandar (1992), triptofan merupakan bahan baku sintesis IAA.
(Se). Ada pula kandungan beberapa antioksidan dan zat yang berhubungan dengan antioksidan. Kadar terbanyak dari kandungan tersebut dalam tauge adalah fitosterol dan vitamin E, walaupun fenol dan beberapa mineral (selenium, mangan, tembaga, zinc, dan besi) juga memiliki jumlah yang cukup bermakna (Amilah dan Astuti, 2006; USDA, 2009; Astawan, 2005).
Tabel 2.3. Kandungan zat yang terdapat dalam kecambah kacang hijau Kandungan Kecambah Kacang Hijau mg/100 g
Menurut Sandra (2011), ekstraksi senyawa bioaktif dapat dilakukan pada kecambah kacang hijau yang mengandung auksin. Penelitian yang dilakukan Mahanani (2003) membuktikan bahwa pemberian ekstrak kecambah kacang hijau pada tanaman kentang varietas granola yang diberikan dua kali menunjukkan pertumbuhan dan hasil yang terbaik dibandingkan dengan zat pengatur tumbuh alami lain atau tanpa zat pengatur tumbuh. Perlakuan frekuensi pemberian yang terbaik adalah dua kali, yaitu pada 24 hst dan 31 hst.
didapat, aman dipakai, dan efektif. Hal ini dibuktikan oleh Gardner et al. (1991) bahwa tanaman yang diperlakukan dengan bahan yang diekstrak dari biji kacang-kacangan tumbuhnya lebih tinggi dari tanaman yang tidak diperlakukan. Penelitian yang dilakukan oleh Murniati et al. (2007) juga menunjukkan bahwa perlakuan ekstrak kecambah kacang hijau dapat meningkatkan tinggi bibit nanas sebesar 71,45 % dan berat bibit sebesar 33,93 % dibandingkan dengan perlakuan giberelin sintetik (GA3).
E. Hipotesis
III. METODE PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Desember 2012 – April 2013 di Kebun Tridharma milik Jurusan Budidaya Pertanian Fakultas Pertanian UGM, Banguntapan, Bantul, D. I. Yogyakarta.
B. Bahan dan Alat
Bahan yang akan digunakan dalam penelitian ini yaitu klon tebu varietas Kidang Kencana yang berasal dari PT Madubaru, tanah pasir dari daerah pantai selatan Yogyakarta, pupuk urea, SP-36, KCl, air murni, air kelapa (mengandung sitokinin, auksin, dan giberelin organik), urin sapi (mengandung sitokinin, auksin, dan giberelin organik), ekstrak kecambah (mengandung auksin dan giberelin organik), dan kompos. Secara spesifik, air kelapa yang akan digunakan dalam penelitian ini diperoleh dari buah kelapa yang masih muda (“degan”), urin sapi diperoleh dari jenis sapi perah, dan ekstrak kecambah diperoleh dari jenis kecambah kacang hijau (Vigna radiata). Alat yang diperlukan yakni polibag ukuran 45 cm x 45 cm, penggaris atau meteran, gelas ukur, gembor, timbangan, kantong plastik, gunting, luxmeter, thermo-hygrometer, oven, alat-alat pertanian seperti cangkul dan alat bantu lainnya, serta alat tulis.
C. Rancangan Percobaan
D. Tata Laksana Penelitian 1. Persiapan media tanam
Media tanam yang digunakan berupa tanah pasir pantai yang diambil dari salah satu pantai di daerah selatan Yogyakarta. Pada tahap ini media pasir pantai dicampur kompos dengan takaran 20 ton/ha kompos. Kemudian campuran tersebut dimasukkan ke dalam polibag dengan volume yang sama. Polibag yang berisi media tanam tersebut kemudian diletakkan dan ditata di lahan sesuai dengan rancangan percobaan yang digunakan.
2. Persiapan bahan tanam
Bahan tanam yang digunakan berupa budset dengan panjang ± 3 cm dan satu mata tunas.
3. Persiapan larutan bahan organik sebagai sumber ZPT alami
4. Aplikasi bahan organik sebelum tanam
Sebelum ditanam, masing-masing bahan tanam (sesuai dengan perlakuannya) terlebih dahulu direndam selama 2 jam dalam larutan bahan organik yang telah disediakan sebagai sumber ZPT alami dan telah dicampur dithane.
5. Pemupukan
Pemupukan dasar dilakukan sebelum penanaman bibit. Takaran pupuk yang diberikan adalah Urea 300 kg/ha, SP-36 300 kg/ha, dan KCl 200 kg/ha. Pemupukan susulan dilaksanakan pada umur 60 hari setelah tanam (hst) dengan dosis pupuk Urea 200 kg/ha.
6. Penanaman
Bahan tanam berupa budset ditanam pada media pasir pantai di polibag sesuai perlakuan dengan kedalaman ± 5 cm. Masing-masing polibag ditanami 1 bahan tanam (1 mata tunas). Kemudian dilakukan penyiraman hingga kapasitas lapangan.
7. Penyiraman
Penyiraman dilakukan sewaktu-waktu sesuai kebutuhan tanaman. Penyiraman dilakukan sampai kapasitas lapangan.
8. Aplikasi bahan organik setelah tanam
Aplikasi selanjutnya dilakukan saat tunas sudah mulai muncul (1-2 minggu setelah tanam). Pemberian bahan organik sebagai sumber ZPT alami disesuaikan dengan perlakuannya masing-masing. Aplikasi dilakukan dengan cara penyemprotan di seluruh permukaan tajuk bibit dengan menggunakan hand sprayer, dilakukan secara rutin setiap 2 minggu sekali. Penyemprotan bahan organik sebagai sumber ZPT alami pada bibit dilakukan secara adil hingga seluruh permukaan tajuk terbasahi.
9. Pengendalian organisme pengganggu tanaman (OPT)
10.Panen
Panen dilakukan setelah tebu berumur 120 hari setelah tanam (hst). Pemanenan dilakukan secara hati-hati sampai semua organ dapat dipanen termasuk semua akar.
E. Pengamatan
Pengamatan dilakukan terhadap lingkungan tempat penelitian dan pertumbuhan bibit tebu. Pengamatan pertumbuhan tebu dilakukan pada tanaman sampel dan tanaman korban. Tanaman sampel terdiri dari 5 tanaman pada setiap kombinasi perlakuan. Pengamatan tanaman sampel dilakukan secara rutin setiap seminggu sekali. Pengamatan rutin dilakukan untuk mengetahui respon tanaman terhadap pemberian bahan organik yang berbeda sebagai sumber ZPT alami. Pengamatan tanaman korban dilakukan pada umur 40, 80, dan 120 hst atau saat panen.
a. Pengamatan lingkungan
Faktor lingkungan sangat berpengaruh terhadap pertumbuhan tanaman. Pengamatan lingkungan bertujuan untuk mengetahui pengaruh faktor lingkungan terhadap perlakuan aplikasi bahan organik sebagai sumber ZPT alami. Variabel pengamatan lingkungan meliputi:
a. Suhu udara
Suhu udara diukur menggunakan thermometer. Satuan yang digunakan adalah ºC (derajat celcius). Pengamatan dilakukan seminggu sekali sekitar pukul 08.00, 12.00, dan 16.00 WIB sampai pada minggu ke-17.
b. Kelembaban
Kelembaban udara diukur menggunakan hygrometer dalam satuan %. Pengamatan dilakukan seminggu sekali sekitar pukul 08.00, 12.00, dan 16.00 WIB sampai pada minggu ke-17.
c. Intensitas cahaya
d. Curah hujan
Data curah hujan selama berlangsungnya penelitian dapat diperoleh dari Badan Meteorologi Klimatologi dan Geofisika (BMKG) setempat setelah akhir masa tanam.
b. Variabel pengamatan tanaman sampel a. Waktu muncul tunas
Waktu muncul tunas diketahui dengan mengamati waktu munculnya tunas ke atas permukaan tanah pada awal masa tanam.
b. Tinggi tunas
Tinggi tunas diukur menggunakan meteran atau penggaris. Tinggi tunas diukur dari permukaan tanah hingga ujung daun tertinggi.
c. Jumlah daun pada tunas
Jumlah daun diamati dengan menghitung daun yang telah membuka sempurna.
d. Diameter tunas
Pengukuran diameter tunas menggunakan jangka sorong pada nodia terbawah, nodia tengah dan nodia teratas kemudian dibuat reratanya.
e. Jumlah ruas (internodia) pada tunas
Jumlah ruas pada tunas diketahui dengan menghitung seluruh ruas yang terdapat pada tunas dari dasar hingga ujung.
f. Panjang ruas (internodia) pada tunas
Panjang internodia pada tunas diukur dari tiga internodia yang letaknya di atas, tengah, dan bawah, kemudian dibuat reratanya.
c. Variabel pengamatan tanaman korban a. Luas daun
Rumus perhitungan adalah sebagai berikut:
L
d=
B
L
k kxB
dKeterangan: Ld = Luas pola daun (cm2)
Lk = Luas kertas pembanding (cm2) Bd = Berat pola daun (g)
Bk = Berat kertas pembanding (g) b. Panjang akar utama
Panjang akar utama diukur dari pangkal batang sampai ujung akar utama dengan menggunakan penggaris atau meteran.
c. Volume akar
Volume akar diketahui dengan memasukkan semua akar ke dalam gelas piala yang telah diisi air dan dilihat pertambahan volume yang terjadi. Selisih antara volume air awal dan volume air akhir merupakan nilai dari volume akar yang dinyatakan dalam ml.
d. Bobot segar total
Berat segar total diperoleh dengan menimbang seluruh bagian tanaman. Berat segar total dinyatakan dalam gram.
e. Bobot segar tajuk
Berat segar tajuk diperoleh dengan membagi tanaman menjadi dua bagian tajuk dan akar. Bagian tajuk kemudian ditimbang dan dinyatakan dalam gram.
f. Bobot segar akar
Berat segar akar diukur menggunakan timbangan dengan ketelitian dua angka di belakang koma.
g. Bobot kering total
h. Bobot kering tajuk
Bobot kering tajuk dilakukan dengan menimbang tajuk yang bobot keringnya telah konstan.
i. Bobot kering akar
Bobot kering akar diukur dengan cara yang sama dengan bobot kering total akan tetapi hanya bagian akar saja yang ditimbang.
j. Nisbah akar tajuk
Nisbah akar tajuk adalah perbandingan antara bobot kering akar dan bobot kering tajuk.
d. Analisis Pertumbuhan
Analisis pertumbuhan dilakukan terhadap variabel sebagai berikut: a. Laju Asimilasi Bersih (LAB)
Laju asimilasi bersih merupakan kemampuan tanaman menghasilkan bahan kering hasil asimilasi tiap satuan luas daun tiap satuan waktu. Rumus perhitungan adalah sebagai berikut:
LAB
=
W2
T2
−
W1
−
T1
x
ln La2
−
ln La1
La2
−
La1
g/cm2/minggu b. Laju Pertumbuhan Nisbi (LPN)Laju pertumbuhan nisbi merupakan kemampuan tanaman menghasilkan bahan kering hasil asimilasi tiap satuan bobot kering awal tiap satuan waktu. Rumus perhitungan adalah sebagai berikut:
LPN
=
ln W2
T2
−
ln W1
−
T1
g/g/mingguKeterangan:
F. Analisis Data
IV. HASIL DAN PEMBAHASAN
A. Kondisi Lingkungan
Penelitian ini dilakukan di Banguntapan selama musim penghujan, yaitu pada bulan Desember 2012 sampai April 2013. Berdasarkan data yang diperoleh dari BMKG (2013), curah hujan yang terjadi di daerah penelitian mencapai 409 mm pada bulan Desember, 366 mm pada bulan Januari, 268 mm pada bulan Februari, 160 mm pada bulan Maret, dan 155 mm pada bulan April. Kondisi curah hujan yang tinggi selama penelitian mampu mendukung terjadinya pertunasan dan pertumbuhan vegetatif tebu yang meliputi tinggi dan besar batang. Menurut Kuntohartono (1982), curah hujan yang ideal bagi pertumbuhan awal tebu adalah sekitar 200 mm selama 5-6 bulan. Menurut Soepardiman (1996), apabila musim kering tiba sebelum pertumbuhan vegetatif berakhir, maka tanaman tebu yang tidak diairi akan mati sebelum mencapai tingkat masak.
Faktor lingkungan lain yang diamati selama penelitian yaitu suhu, kelembaban udara, kecepatan angin, dan intensitas cahaya. Hasil rata-rata suhu yang dicapai sekitar 33,5 C, kelembaban udara sekitar 87,62 %, kecepatan angin sekitar 12,37 km/jam, dan intensitas cahaya sekitar 625,6 lux. Hal ini masih sesuai dengan syarat tumbuh tebu, terutama pada fase vegetatif. Kuntohartono (1982) menyatakan bahwa suhu udara minimum yang diperlukan untuk pertumbuhan tanaman tebu adalah 24 °C, suhu maksimum adalah 34 °C, dan suhu optimum adalah 30 °C. Apabila suhu dibawah 15 °C, pertumbuhan tanaman akan terhenti. Angin dengan kecepatan kurang lebih 10 km/jam di siang hari berdampak positif bagi pertumbuhan tebu. Suhu udara, intensitas cahaya, dan kelembaban yang tinggi dapat meningkatkan laju fotosintesis (Salisbury and Ross, 1995).
tersebut sehingga tebu masih dapat tumbuh dengan baik. Penggunaan bahan organik berupa kompos yang dicampurkan ke dalam media tanam juga dapat meningkatkan daya simpan air bagi tanaman.
B. Pengaruh Macam dan Konsentrasi Bahan Organik sebagai Sumber Zat Pengatur Tumbuh Alami terhadap Pertumbuhan Bibit Tebu
1. Panjang Akar Utama
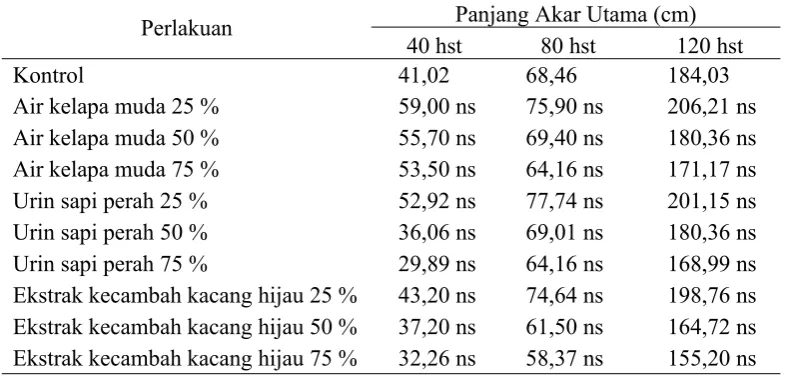
Tabel 4.1.Pengaruh macam dan konsentrasi bahan organik sebagai sumber zat pengatur tumbuh alami terhadap panjang akar utama bibit tebu
Perlakuan Panjang Akar Utama (cm)
40 hst 80 hst 120 hst
Kontrol 41,02 68,46 184,03
Air kelapa muda 25 % 59,00 ns 75,90 ns 206,21 ns
Air kelapa muda 50 % 55,70 ns 69,40 ns 180,36 ns
Air kelapa muda 75 % 53,50 ns 64,16 ns 171,17 ns
Urin sapi perah 25 % 52,92 ns 77,74 ns 201,15 ns
Urin sapi perah 50 % 36,06 ns 69,01 ns 180,36 ns
Urin sapi perah 75 % 29,89 ns 64,16 ns 168,99 ns
Ekstrak kecambah kacang hijau 25 % 43,20 ns 74,64 ns 198,76 ns
Ekstrak kecambah kacang hijau 50 % 37,20 ns 61,50 ns 164,72 ns
Ekstrak kecambah kacang hijau 75 % 32,26 ns 58,37 ns 155,20 ns
Keterangan: ns = tidak berbeda nyata dengan kontrol, * = berbeda nyata dengan kontrol
panjang akar utama bibit tebu apabila dibandingkan dengan perlakuan tanpa bahan organik. Panjang akar bibit tebu pada umur 40 hst rata-rata berkisar 29-59 cm. Panjang akar bibit tebu pada umur 80 hst rata-rata berkisar 58-77 cm, sedangkan panjang ruas bibit tebu pada umur 120 hst rata-rata berkisar 155-206 cm.
Hasil yang tidak berbeda nyata pada variabel panjang akar utama diduga dapat terjadi karena perakaran yang terdapat pada tebu merupakan perakaran serabut. Pada perakaran serabut, akar primer tidak dapat bertahan lama dalam pertumbuhan tanaman dan segera mengering, lalu dari pangkal akar tersebut akan muncul akar baru yang disebut akar adventif. Akar-akar adventif ini yang mempengaruhi besar kecilnya volume akar.
2. Volume Akar
Tabel 4.2.Pengaruh macam dan konsentrasi bahan organik sebagai sumber zat pengatur tumbuh alami terhadap volume akar bibit tebu
Perlakuan Volume Akar (ml)
40 hst 80 hst 120 hst
Kontrol 8,00 135,30 379,50
Air kelapa muda 25 % 38,00 * 302,00 * 3678,80 *
Air kelapa muda 50 % 30,40 * 230,00 ns 2485,20 *
Air kelapa muda 75 % 24,30 ns 194,00 ns 1507,00 ns
Urin sapi perah 25 % 25,30 ns 278,00 * 1173,80 ns
Urin sapi perah 50 % 11,50 ns 223,78 ns 609,00 ns
Urin sapi perah 75 % 9,66 ns 136,00 ns 341,90 ns
Ekstrak kecambah kacang hijau 25 % 11,20 ns 218,89 ns 533,50 ns
Ekstrak kecambah kacang hijau 50 % 7,50 ns 128,00 ns 488,10 ns
Ekstrak kecambah kacang hijau 75 % 5,90 ns 110,00 ns 253,30 ns
Keterangan: ns = tidak berbeda nyata dengan kontrol, * = berbeda nyata dengan kontrol
menghasilkan volume akar yang lebih kecil dan tidak berbeda nyata dengan kontrol (tanpa bahan organik), sedangkan untuk perlakuan urin sapi perah 50 %, urin sapi perah 75 %, ekstrak kecambah kacang hijau 25 %, ekstrak kecambah kacang hijau 50 %, dan ekstrak kecambah kacang hijau 75 %, nilai volume akar bibit tebu yang dihasilkan tidak berbeda nyata jika dibandingkan dengan kontrol (tanpa bahan organik) walaupun terlihat adanya kecenderungan penurunan nilai volume akar seiring dengan penambahan konsentrasi pada masing-masing bahan organik.
Pada umur tebu 80 hst, pemberian air kelapa muda 25 % secara nyata mampu menghasilkan volume akar bibit tebu yang lebih besar dibandingkan kontrol (tanpa bahan organik). Penambahan konsentrasi air kelapa muda hingga 50-75 % justru menurunkan nilai volume akar bibit tebu dan tidak berbeda nyata dengan kontrol (tanpa bahan organik). Sama halnya dengan perlakuan urin sapi perah dan ekstrak kecambah kacang hijau baik pada konsentrasi 25, 50, ataupun 75 %, volume akar yang dihasilkan tidak berbeda nyata dengan kontrol (tanpa bahan organik) walaupun terlihat adanya kecenderungan penurunan nilai volume akar seiring dengan penambahan konsentrasi pada masing-masing bahan organik.
3. Jumlah Daun
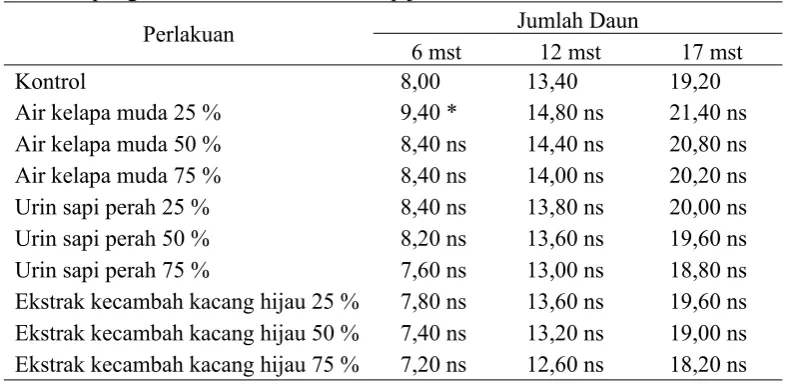
Tabel 4.3.Pengaruh macam dan konsentrasi bahan organik sebagai sumber zat pengatur tumbuh alami terhadap jumlah daun bibit tebu
Perlakuan Jumlah Daun
6 mst 12 mst 17 mst
Kontrol 8,00 13,40 19,20
Air kelapa muda 25 % 9,40 * 14,80 ns 21,40 ns
Air kelapa muda 50 % 8,40 ns 14,40 ns 20,80 ns
Air kelapa muda 75 % 8,40 ns 14,00 ns 20,20 ns
Urin sapi perah 25 % 8,40 ns 13,80 ns 20,00 ns
Urin sapi perah 50 % 8,20 ns 13,60 ns 19,60 ns
Urin sapi perah 75 % 7,60 ns 13,00 ns 18,80 ns
Ekstrak kecambah kacang hijau 25 % 7,80 ns 13,60 ns 19,60 ns
Ekstrak kecambah kacang hijau 50 % 7,40 ns 13,20 ns 19,00 ns
Ekstrak kecambah kacang hijau 75 % 7,20 ns 12,60 ns 18,20 ns
Pemberian bahan organik sebagai sumber zat pengatur tumbuh alami berpengaruh nyata terhadap variabel jumlah daun berdasarkan analisis varian baik pada umur tebu 6, 12, maupun 17 mst. Berdasarkan uji lanjut Dunnet (Tabel 4.3), perbedaan nyata hanya nampak pada umur tebu 6 mst. Pada umur tebu 6 mst, pemberian air kelapa muda 25 % secara nyata mampu menghasilkan bibit tebu dengan jumlah daun lebih banyak dibandingkan kontrol (tanpa bahan organik). Penambahan konsentrasi air kelapa muda hingga 50-75 % justru menurunkan nilai jumlah daun bibit tebu dan tidak berbeda nyata dengan kontrol (tanpa bahan organik). Sama halnya dengan perlakuan urin sapi perah dan ekstrak kecambah kacang hijau baik pada konsentrasi 25, 50, ataupun 75 %, jumlah daun bibit tebu yang dihasilkan tidak berbeda nyata dengan kontrol (tanpa bahan organik) walaupun terlihat adanya kecenderungan penurunan nilai jumlah daun seiring dengan penambahan konsentrasi pada masing-masing bahan organik.
Pada umur 12 dan 17 mst, tidak nampak adanya beda nyata berdasarkan uji lanjut Dunnet. Pada umur tersebut, pemberian air kelapa muda 25 %, air kelapa muda 50 %, air kelapa muda 75 %, urin sapi perah 25 %, urin sapi perah 50 %, urin sapi perah 75 %, ekstrak kecambah kacang hijau 25 %, ekstrak kecambah kacang hijau 50 %, dan ekstrak kecambah kacang hijau 75 % diketahui tidak berpengaruh nyata terhadap variabel jumlah daun jika dibandingkan dengan kontrol (tanpa bahan organik).
4. Luas Daun
Pada tanaman tingkat tinggi, daun berfungsi sebagai organ utama fotosintesis. Jaringan fotosintesis yang hijau pada daun ini secara efisien dapat menyerap radiasi matahari yang dibutuhkan oleh tanaman. Tanaman cenderung menginvestasikan sebagian besar awal pertumbuhan dalam bentuk penambahan luas daun (Gardner et al., 1991).
25 dan 50 % secara nyata mampu menghasilkan daun yang lebih luas dibandingkan dengan perlakuan tanpa bahan organik pada umur tebu 40, 80, dan 120 hst. Peningkatan konsentrasi air kelapa muda hingga 75 % justru menghasilkan daun yang lebih sempit dan tidak berbeda nyata dengan kontrol (tanpa bahan organik). Meskipun terlihat adanya kecenderungan penurunan nilai luas daun seiring dengan penambahan konsentrasi pada masing-masing bahan organik, baik perlakuan urin sapi perah 25 %, urin sapi perah 50 %, urin sapi perah 75 %, ekstrak kecambah kacang hijau 25 %, ekstrak kecambah kacang hijau 50 %, ataupun ekstrak kecambah kacang hijau 75 %, nilai luas daun bibit tebu yang dihasilkan tidak berbeda nyata jika dibandingkan dengan perlakuan tanpa bahan organik.
Tabel 4.4.Pengaruh macam dan konsentrasi bahan organik sebagai sumber zat pengatur tumbuh alami terhadap luas daun bibit tebu
Perlakuan Luas Daun (cm2)
40 hst 80 hst 120 hst
Kontrol 349,30 1572,70 4246,40
Air kelapa muda 25 % 961,10 * 2420,90 * 6519,90 *
Air kelapa muda 50 % 744,50 * 2407,10 * 6459,60 *
Air kelapa muda 75 % 726,50 ns 1960,60 ns 5564,60 ns
Urin sapi perah 25 % 719,70 ns 2113,60 ns 5677,50 ns
Urin sapi perah 50 % 558,00 ns 1830,90 ns 5265,00 ns
Urin sapi perah 75 % 436,60 ns 1667,30 ns 4942,30 ns
Ekstrak kecambah kacang hijau 25 % 421,70 ns 2059,30 ns 4679,60 ns
Ekstrak kecambah kacang hijau 50 % 411,20 ns 1744,80 ns 4504,30 ns
Ekstrak kecambah kacang hijau 75 % 280,80 ns 1306,20 ns 3527,70 ns
Keterangan: ns = tidak berbeda nyata dengan kontrol, * = berbeda nyata dengan kontrol
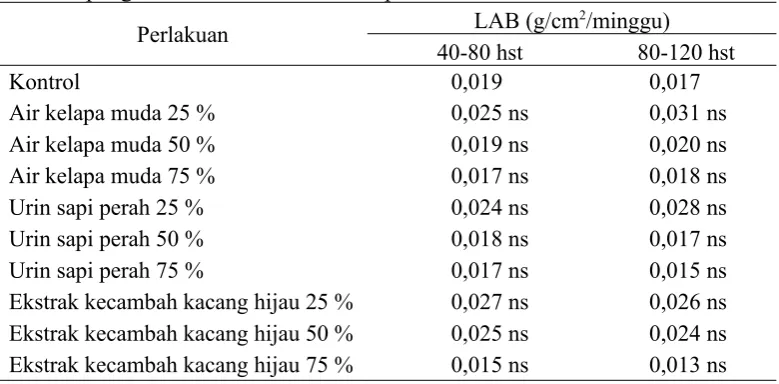
5. Laju Asimilasi Bersih (LAB)
50 %, urin sapi perah 75 %, ekstrak kecambah kacang hijau 25 %, ekstrak kecambah kacang hijau 50 %, dan ekstrak kecambah kacang hijau 75 % tidak berpengaruh secara nyata terhadap laju asimilasi bersih bibit tebu.
Tabel 4.5.Pengaruh macam dan konsentrasi bahan organik sebagai sumber zat pengatur tumbuh alami terhadap LAB bibit tebu
Perlakuan LAB (g/cm2/minggu)
40-80 hst 80-120 hst
Kontrol 0,019 0,017
Air kelapa muda 25 % 0,025 ns 0,031 ns
Air kelapa muda 50 % 0,019 ns 0,020 ns
Air kelapa muda 75 % 0,017 ns 0,018 ns
Urin sapi perah 25 % 0,024 ns 0,028 ns
Urin sapi perah 50 % 0,018 ns 0,017 ns
Urin sapi perah 75 % 0,017 ns 0,015 ns
Ekstrak kecambah kacang hijau 25 % 0,027 ns 0,026 ns
Ekstrak kecambah kacang hijau 50 % 0,025 ns 0,024 ns
Ekstrak kecambah kacang hijau 75 % 0,015 ns 0,013 ns
Keterangan: ns = tidak berbeda nyata dengan kontrol, * = berbeda nyata dengan kontrol
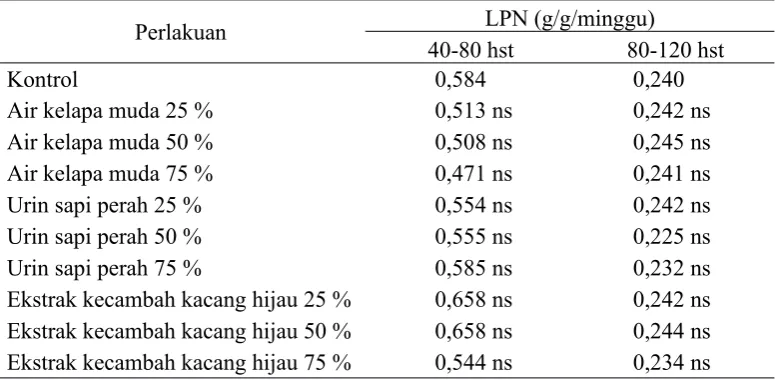
6. Laju Pertumbuhan Nisbi (LPN)
Laju pertumbuhan nisbi merupakan peningkatan bobot kering total dalam satuan interval waktu dalam hubungannya dengan berat awal (Gardner et al., 1991). Analisis varian menunjukkan hasil yang tidak berbeda nyata pada perlakuan macam dan konsentrasi bahan organik sebagai sumber zat pengatur tumbuh alami terhadap variabel laju pertumbuhan nisbi bibit tebu pada umur 40-80 hst, sedangkan hasil yang berbeda nyata ditunjukkan pada bibit tebu berumur 80-120 hst. Berdasarkan uji lanjut Dunnet pada umur tebu 80-120 hst, didapatkan pula hasil yang tidak berbeda nyata pada seluruh perlakuan yang dibandingkan dengan kontrol.
Tabel 4.6.Pengaruh macam dan konsentrasi bahan organik sebagai sumber zat pengatur tumbuh alami terhadap LPN bibit tebu
Perlakuan LPN (g/g/minggu)
40-80 hst 80-120 hst
Kontrol 0,584 0,240
Air kelapa muda 25 % 0,513 ns 0,242 ns
Air kelapa muda 50 % 0,508 ns 0,245 ns
Air kelapa muda 75 % 0,471 ns 0,241 ns
Urin sapi perah 25 % 0,554 ns 0,242 ns
Urin sapi perah 50 % 0,555 ns 0,225 ns
Urin sapi perah 75 % 0,585 ns 0,232 ns
Ekstrak kecambah kacang hijau 25 % 0,658 ns 0,242 ns
Ekstrak kecambah kacang hijau 50 % 0,658 ns 0,244 ns
Ekstrak kecambah kacang hijau 75 % 0,544 ns 0,234 ns
Keterangan: ns = tidak berbeda nyata dengan kontrol, * = berbeda nyata dengan kontrol
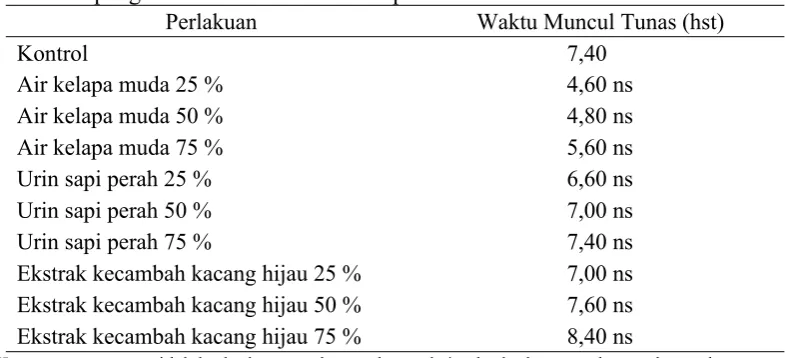
7. Waktu Muncul Tunas
Tabel 4.7.Pengaruh macam dan konsentrasi bahan organik sebagai sumber zat pengatur tumbuh alami terhadap waktu mucul tunas tebu
Perlakuan Waktu Muncul Tunas (hst)
Kontrol 7,40
Air kelapa muda 25 % 4,60 ns
Air kelapa muda 50 % 4,80 ns
Air kelapa muda 75 % 5,60 ns
Urin sapi perah 25 % 6,60 ns
Urin sapi perah 50 % 7,00 ns
Urin sapi perah 75 % 7,40 ns
Ekstrak kecambah kacang hijau 25 % 7,00 ns
Ekstrak kecambah kacang hijau 50 % 7,60 ns
Ekstrak kecambah kacang hijau 75 % 8,40 ns
Keterangan: ns = tidak berbeda nyata dengan kontrol, * = berbeda nyata dengan kontrol
8. Bobot Segar Akar
Tabel 4.8.Pengaruh macam dan konsentrasi bahan organik sebagai sumber zat pengatur tumbuh alami terhadap bobot segar akar bibit tebu
Perlakuan Bobot Segar Akar (g)
40 hst 80 hst 120 hst
Kontrol 5,66 119,82 318,44
Air kelapa muda 25 % 32,25 * 298,58 * 793,54 *
Air kelapa muda 50 % 24,90 * 219,14 * 582,42 *
Air kelapa muda 75 % 18,98 ns 179,14 ns 476,10 ns
Urin sapi perah 25 % 18,19 ns 211,44 ns 566,50 ns
Urin sapi perah 50 % 11,11 ns 182,10 ns 483,97 ns
Urin sapi perah 75 % 6,99 ns 135,76 ns 416,24 ns
Ekstrak kecambah kacang hijau 25 % 9,98 ns 181,88 ns 483,38 ns
Ekstrak kecambah kacang hijau 50 % 5,97 ns 156,62 ns 360,82 ns
Ekstrak kecambah kacang hijau 75 % 4,45 ns 114,27 ns 303,69 ns
Keterangan: ns = tidak berbeda nyata dengan kontrol, * = berbeda nyata dengan kontrol
9. Bobot Segar Tajuk
Tabel 4.9.Pengaruh macam dan konsentrasi bahan organik sebagai sumber zat pengatur tumbuh alami terhadap bobot segar tajuk bibit tebu
Perlakuan Bobot Segar Tajuk (g)
40 hst 80 hst 120 hst
Kontrol 21,62 157,63 625,00
Air kelapa muda 25 % 66,43 * 317,48 * 1256,20 *
Air kelapa muda 50 % 45,27 ns 308,06 * 1221,10 *
Air kelapa muda 75 % 43,58 ns 206,41 ns 816,70 ns
Urin sapi perah 25 % 44,60 ns 264,12 ns 1046,30 ns
Urin sapi perah 50 % 29,03 ns 221,28 ns 798,80 ns
Urin sapi perah 75 % 28,43 ns 201,50 ns 877,70 ns
Ekstrak kecambah kacang hijau 25 % 26,95 ns 250,55 ns 997,60 ns
Ekstrak kecambah kacang hijau 50 % 24,36 ns 180,51 ns 716,20 ns
Ekstrak kecambah kacang hijau 75 % 15,64 ns 124,09 ns 492,10 ns
Keterangan: ns = tidak berbeda nyata dengan kontrol, * = berbeda nyata dengan kontrol
Pada umur tebu 80 dan 120 hst, pemberian air kelapa muda 25 % dan 50 % secara nyata mampu menghasilkan nilai bobot segar tajuk yang lebih tinggi dibandingkan kontrol (tanpa bahan organik). Penambahan konsentrasi air kelapa muda hingga 75 % justru menurunkan nilai bobot segar tajuk bibit tebu dan tidak berbeda nyata dengan kontrol (tanpa bahan organik). Sama halnya dengan perlakuan urin sapi perah dan ekstrak kecambah kacang hijau baik pada konsentrasi 25, 50, ataupun 75 %, bobot segar tajuk yang dihasilkan tidak berbeda nyata dengan kontrol (tanpa bahan organik).
10. Bobot Segar Total
Tabel 4.10. Pengaruh macam dan konsentrasi bahan organik sebagai sumber zat pengatur tumbuh alami terhadap bobot segar total bibit tebu
Perlakuan Bobot Segar Total (g)
40 hst 80 hst 120 hst
Kontrol 27,28 277,44 943,50
Air kelapa muda 25 % 98,68 * 616,05 * 2049,80 *
Air kelapa muda 50 % 70,16 ns 527,20 * 1803,50 *
Air kelapa muda 75 % 62,55 ns 385,55 ns 1292,80 ns
Urin sapi perah 25 % 62,79 ns 475,56 * 1612,80 ns
Urin sapi perah 50 % 40,13 ns 403,38 ns 1282,70 ns
Urin sapi perah 75 % 35,41 ns 337,26 ns 1294,00 ns
Ekstrak kecambah kacang hijau 25 % 36,93 ns 432,42 ns 1480,90 ns
Ekstrak kecambah kacang hijau 50 % 30,33 ns 337,12 ns 1077,00 ns
Ekstrak kecambah kacang hijau 75 % 20,08 ns 238,36 ns 795,80 ns
Keterangan: ns = tidak berbeda nyata dengan kontrol, * = berbeda nyata dengan kontrol
perlakuan urin sapi perah 25 %, urin sapi perah 50 %, urin sapi perah 75 %, ekstrak kecambah kacang hijau 25 %, ekstrak kecambah kacang hijau 50 %, dan ekstrak kecambah kacang hijau 75 %, nilai bobot segar total bibit tebu yang dihasilkan tidak berbeda nyata jika dibandingkan dengan kontrol (tanpa bahan organik) walaupun nampak adanya kecenderungan penurunan nilai bobot segar total seiring dengan penambahan konsentrasi pada masing-masing bahan organik.
Pada umur tebu 80 hst, nilai bobot segar total yang secara signifikan lebih tinggi dibandingkan perlakuan tanpa bahan organik terdapat pada perlakuan air kelapa muda 25 %, air kelapa muda 50 %, dan urin sapi perah 25 %. Perlakuan air kelapa muda 75 %, urin sapi perah 50 %, urin sapi perah 75 %, ekstrak kecambah kacang hijau 25 %, ekstrak kecambah kacang hijau 50 %, dan ekstrak kecambah kacang hijau 75 % tidak berpengaruh nyata terhadap variabel bobot segar total jika dibandingkan dengan kontrol. Peningkatan konsentrasi pada masing-masing bahan organik cenderung menghasilkan nilai bobot segar total bibit tebu yang lebih rendah.
Pada umur tebu 120 hst, pemberian air kelapa muda 25 % dan 50 % secara nyata mampu menghasilkan nilai bobot segar total yang lebih tinggi dibandingkan kontrol (tanpa bahan organik). Penambahan konsentrasi air kelapa muda hingga 75 % justru menurunkan nilai bobot segar total bibit tebu dan tidak berbeda nyata dengan kontrol (tanpa bahan organik). Sama halnya dengan perlakuan urin sapi perah dan ekstrak kecambah kacang hijau baik pada konsentrasi 25, 50, ataupun 75 %, bobot segar total yang dihasilkan tidak berbeda nyata dengan kontrol walau nampak adanya kecenderungan penurunan nilai bobot segar total seiring dengan penambahan konsentrasi pada masing-masing bahan organik.
11. Bobot Kering Akar
nyata mampu menghasilkan nilai bobot kering akar yang lebih tinggi dibandingkan dengan perlakuan tanpa bahan organik pada umur tebu 40, 80, dan 120 hst. Peningkatan konsentrasi air kelapa muda hingga 50-75 % justru menghasilkan nilai bobot kering akar yang lebih rendah dan tidak berbeda nyata dengan kontrol (tanpa bahan organik). Meskipun terlihat adanya kecenderungan penurunan nilai bobot kering akar seiring dengan penambahan konsentrasi pada masing-masing bahan organik, baik perlakuan urin sapi perah 25 %, urin sapi perah 50 %, urin sapi perah 75 %, ekstrak kecambah kacang hijau 25 %, ekstrak kecambah kacang hijau 50 %, ataupun ekstrak kecambah kacang hijau 75 %, nilai bobot kering akar bibit tebu yang dihasilkan tidak berbeda nyata jika dibandingkan dengan perlakuan tanpa bahan organik.
Tabel 4.11. Pengaruh macam dan konsentrasi bahan organik sebagai sumber zat pengatur tumbuh alami terhadap bobot kering akar bibit tebu
Perlakuan Bobot Kering Akar (g)
40 hst 80 hst 120 hst
Kontrol 0,64 32,09 180,21
Air kelapa muda 25 % 4,67 * 90,90 * 510,16 *
Air kelapa muda 50 % 2,84 ns 68,11 ns 382,35 ns
Air kelapa muda 75 % 2,68 ns 48,06 ns 269,73 ns
Urin sapi perah 25 % 2,13 ns 75,96 ns 426,48 ns
Urin sapi perah 50 % 1,20 ns 33,30 ns 186,98 ns
Urin sapi perah 75 % 0,77 ns 31,19 ns 175,10 ns
Ekstrak kecambah kacang hijau 25 % 0,73 ns 64,46 ns 363,97 ns
Ekstrak kecambah kacang hijau 50 % 0,50 ns 55,63 ns 312,47 ns
Ekstrak kecambah kacang hijau 75 % 0,38 ns 20,82 ns 116,92 ns
Keterangan: ns = tidak berbeda nyata dengan kontrol, * = berbeda nyata dengan kontrol
12. Bobot Kering Tajuk
dan urin kelapa muda hingga 50-75 % justru menurunkan nilai bobot kering tajuk bibit tebu dan tidak berbeda nyata dengan kontrol (tanpa bahan organik). Perlakuan urin sapi perah dan ekstrak kecambah kacang hijau baik pada konsentrasi 25, 50, ataupun 75 %, bobot kering tajuk yang dihasilkan tidak berbeda nyata dengan kontrol meski terlihat adanya kecenderungan penurunan nilai bobot kering tajuk seiring dengan penambahan konsentrasi pada masing-masing bahan organik.
Tabel 4.12. Pengaruh macam dan konsentrasi bahan organik sebagai sumber zat pengatur tumbuh alami terhadap bobot kering tajuk bibit tebu
Perlakuan Bobot Kering Tajuk (g)
40 hst 80 hst 120 hst
Kontrol 2,40 52,60 149,62
Air kelapa muda 25 % 7,01 * 132,32 * 375,81 *
Air kelapa muda 50 % 5,72 * 85,04 ns 241,05 ns
Air kelapa muda 75 % 4,62 ns 72,00 ns 204,15 ns
Urin sapi perah 25 % 5,14 * 113,28 ns 322,86 ns
Urin sapi perah 50 % 3,17 ns 77,53 ns 219,79 ns
Urin sapi perah 75 % 3,01 ns 60,08 ns 171,00 ns
Ekstrak kecambah kacang hijau 25 % 3,05 ns 86,77 ns 237,36 ns
Ekstrak kecambah kacang hijau 50 % 2,55 ns 73,66 ns 209,53 ns
Ekstrak kecambah kacang hijau 75 % 2,24 ns 38,25 ns 108,42 ns
Keterangan: ns = tidak berbeda nyata dengan kontrol, * = berbeda nyata dengan kontrol
13. Bobot Kering Total
Tabel 4.13. Pengaruh macam dan konsentrasi bahan organik sebagai sumber zat pengatur tumbuh alami terhadap bobot kering total bibit tebu
Perlakuan Bobot Kering Total (g)
40 hst 80 hst 120 hst
Kontrol 3,03 84,69 329,80
Air kelapa muda 25 % 11,68 * 223,22 * 886,00 *
Air kelapa muda 50 % 8,56 * 153,16 ns 623,40 ns
Air kelapa muda 75 % 7,29 * 120,06 ns 473,90 ns
Urin sapi perah 25 % 7,27 * 189,24 * 749,30 *
Urin sapi perah 50 % 4,36 ns 110,83 ns 406,80 ns
Urin sapi perah 75 % 3,78 ns 91,27 ns 346,10 ns
Ekstrak kecambah kacang hijau 25 % 3,79 ns 151,23 ns 601,30 ns
Ekstrak kecambah kacang hijau 50 % 3,05 ns 129,29 ns 522,00 ns
Ekstrak kecambah kacang hijau 75 % 2,61 ns 59,07 ns 225,30 ns
Keterangan: ns = tidak berbeda nyata dengan kontrol, * = berbeda nyata dengan kontrol
Bobot kering total diperoleh dari penjumlahan bobot kering tajuk dengan bobot kering akar. Bobot kering total ini merupakan hasil penimbunan hasil bersih asimilat sepanjang pertumbuhan tanaman. Hasil bersih asimilat umumnya ditranslokasikan ke seluruh tubuh tanaman untuk pertumbuhan, perkembangan, cadangan makanan, dan pengelolaan sel (Gardner et al., 1991).
bobot kering total seiring dengan penambahan konsentrasi pada masing-masing bahan organik.
Pada umur tebu 80 dan 120 hst, pemberian air kelapa muda 25 % dan urin sapi perah 25 % secara nyata mampu menghasilkan nilai bobot kering total yang lebih tinggi dibandingkan kontrol (tanpa bahan organik). Penambahan konsentrasi air kelapa muda dan urin sapi perah hingga 50-75 % justru menurunkan nilai bobot kering total bibit tebu dan tidak berbeda nyata dengan kontrol (tanpa bahan organik). Sama halnya dengan perlakuan ekstrak kecambah kacang hijau baik pada konsentrasi 25, 50, ataupun 75 %, bobot kering total yang dihasilkan tidak berbeda nyata dengan perlakuan tanpa bahan organik.
14. Nisbah Akar Tajuk
Tabel 4.14. Pengaruh macam dan konsentrasi bahan organik sebagai sumber zat pengatur tumbuh alami terhadap nisbah akar tajuk bibit tebu
Perlakuan Nisbah Akar Tajuk
40 hst 80 hst 120 hst
Kontrol 0,37 0,72 1,43
Air kelapa muda 25 % 0,69 ns 0,72 ns 1,42 ns
Air kelapa muda 50 % 0,57 ns 0,80 ns 1,58 ns
Air kelapa muda 75 % 0,95 ns 0,73 ns 1,44 ns
Urin sapi perah 25 % 0,40 ns 1,01 ns 1,98 ns
Urin sapi perah 50 % 1,00 ns 0,47 ns 0,93 ns
Urin sapi perah 75 % 0,21 ns 0,62 ns 1,23 ns
Ekstrak kecambah kacang hijau 25 % 0,47 ns 0,79 ns 1,61 ns
Ekstrak kecambah kacang hijau 50 % 0,19 ns 0,93 ns 1,85 ns
Ekstrak kecambah kacang hijau 75 % 0,20 ns 0,59 ns 1,17 ns
Keterangan: ns = tidak berbeda nyata dengan kontrol, * = berbeda nyata dengan kontrol
akar tajuk juga sangat dipengaruhi oleh lingkungan yang kuat (Gardner et al., 1991).
Analisis varian menunjukkan hasil yang tidak berbeda nyata pada perlakuan macam dan konsentrasi bahan organik sebagai sumber zat pengatur tumbuh alami terhadap nisbah akar tajuk bibit tebu baik pada umur 40, 80, ataupun 120 hst (Tabel 4.14). Perlakuan air kelapa muda 25 %, air kelapa muda 50 %, air kelapa muda 75 %, urin sapi perah 25 %, urin sapi perah 50 %, urin sapi perah 75 %, ekstrak kecambah kacang hijau 25 %, ekstrak kecambah kacang hijau 50 %, dan ekstrak kecambah kacang hijau 75 % tidak berpengaruh secara signifikan terhadap variabel nisbah akar tajuk bibit tebu.
15. Jumlah Ruas
Tabel 4.15. Pengaruh macam dan konsentrasi bahan organik sebagai sumber zat pengatur tumbuh alami terhadap jumlah ruas bibit tebu
Perlakuan Jumlah Ruas
12 mst 17 mst
Kontrol 2,40 3,60
Air kelapa muda 25 % 3,00 ns 4,60 ns
Air kelapa muda 50 % 2,80 ns 4,00 ns
Air kelapa muda 75 % 2,80 ns 3,80 ns
Urin sapi perah 25 % 2,80 ns 4,00 ns
Urin sapi perah 50 % 2,60 ns 3,80 ns
Urin sapi perah 75 % 2,60 ns 3,60 ns
Ekstrak kecambah kacang hijau 25 % 2,80 ns 3,80 ns
Ekstrak kecambah kacang hijau 50 % 2,60 ns 3,60 ns
Ekstrak kecambah kacang hijau 75 % 2,40 ns 3,60 ns
Keterangan: ns = tidak berbeda nyata dengan kontrol, * = berbeda nyata dengan kontrol
16. Diameter Tunas
Tabel 4.16. Pengaruh macam dan konsentrasi bahan organik sebagai sumber zat pengatur tumbuh alami terhadap diameter tunas bibit tebu
Perlakuan Diameter Tunas (cm)
6 mst 12 mst 17 mst
Kontrol 0,77 2,38 3,58
Air kelapa muda 25 % 1,18 * 2,83 * 4,25 *
Air kelapa muda 50 % 1,04 * 2,61 ns 3,93 ns
Air kelapa muda 75 % 1,01 * 2,46 ns 3,70 ns
Urin sapi perah 25 % 0,95 ns 2,53 ns 3,81 ns
Urin sapi perah 50 % 0,91 ns 2,35 ns 3,54 ns
Urin sapi perah 75 % 0,88 ns 2,23 ns 3,36 ns
Ekstrak kecambah kacang hijau 25 % 0,89 ns 2,53 ns 3,80 ns
Ekstrak kecambah kacang hijau 50 % 0,71 ns 2,37 ns 3,56 ns
Ekstrak kecambah kacang hijau 75 % 0,58 ns 2,17 ns 3,26 ns
Keterangan: ns = tidak berbeda nyata dengan kontrol, * = berbeda nyata dengan kontrol
Hasil analisis varian menunjukkan bahwa pemberian bahan organik sebagai sumber zat pengatur tumbuh alami berpengaruh nyata terhadap variabel diameter tunas. Berdasarkan uji lanjut Dunnet (Tabel 4.16), perbedaan nyata ditunjukkan baik pada umur tebu 6, 12, maupun 17 mst. Pada umur tebu 6 mst, pemberian air kelapa muda 25, 50, dan 75 % secara nyata mampu menghasilkan diameter tunas bibit tebu yang lebih besar dibandingkan kontrol (tanpa bahan organik) walaupun terlihat adanya kecenderungan penurunan nilai diameter tunas seiring dengan penambahan konsentrasi air kelapa muda, sedangkan untuk perlakuan urin sapi perah dan ekstrak kecambah kacang hijau baik pada konsentrasi 25, 50, ataupun 75 %, hasilnya tidak berbeda nyata dengan kontrol (tanpa bahan organik) walaupun terlihat adanya kecenderungan penurunan nilai diameter tunas seiring dengan penambahan konsentrasi pada masing-masing bahan organik.
konsentrasi 25, 50, ataupun 75 %, hasilnya tidak berbeda nyata dengan perlakuan tanpa bahan organik. Meski nampak adanya kecenderungan penurunan nilai diameter tunas seiring dengan penambahan konsentrasi pada masing-masing bahan organik, pemberian air kelapa muda 50 %, air kelapa muda 75 %, urin sapi perah 25 %, urin sapi perah 50 %, urin sapi perah 75 %, ekstrak kecambah kacang hijau 25 %, ekstrak kecambah kacang hijau 50 %, dan ekstrak kecambah kacang hijau 75 % secara signifikan tidak mampu meningkatkan nilai diameter tunas bibit tebu jika dibandingkan dengan perlakuan tanpa bahan organik.
17. Panjang Ruas
Tabel 4.17. Pengaruh macam dan konsentrasi bahan organik sebagai sumber zat pengatur tumbuh alami terhadap panjang ruas bibit tebu
Perlakuan Panjang Ruas (cm)
12 mst 17 mst
Kontrol 9,81 13,90
Air kelapa muda 25 % 12,00 ns 17,01 ns
Air kelapa muda 50 % 11,77 ns 16,67 ns
Air kelapa muda 75 % 11,53 ns 16,34 ns
Urin sapi perah 25 % 10,83 ns 15,34 ns
Urin sapi perah 50 % 10,54 ns 14,94 ns
Urin sapi perah 75 % 9,47 ns 13,41 ns
Ekstrak kecambah kacang hijau 25 % 10,30 ns 14,59 ns
Ekstrak kecambah kacang hijau 50 % 10,07 ns 14,26 ns
Ekstrak kecambah kacang hijau 75 % 9,02 ns 12,78 ns
Keterangan: ns = tidak berbeda nyata dengan kontrol, * = berbeda nyata dengan kontrol
Hasil analisis varian menunjukkan tidak terdapat pengaruh yang signifikan pada perlakuan macam dan konsentrasi bahan organik sebagai sumber zat pengatur tumbuh alami terhadap panjang ruas tebu baik pada umur 6, 12, ataupun 17 mst (Tabel 4.17). Panjang ruas tebu pada umur 12 mst rata-rata berkisar 9-12 cm, sedangkan panjang ruas tebu pada umur 17 mst rata-rata berkisar 12-17 cm.
jumlah ini akan menurun dengan bertambahnya umur (tua). Fase ini berlangsung pada umur tanaman antara 3-9 bulan (Lukito, 2008).
18. Tinggi Tunas
Tabel 4.18. Pengaruh macam dan konsentrasi bahan organik sebagai sumber zat pengatur tumbuh alami terhadap tinggi tunas bibit tebu
Perlakuan Tinggi tunas (cm)
6 mst 12 mst 17 mst
Kontrol 119,00 175,54 207,44
Air kelapa muda 25 % 150,00 * 197,86 * 233,86 *
Air kelapa muda 50 % 146,26 * 191,02 ns 225,78 ns
Air kelapa muda 75 % 138,32 ns 184,40 ns 217,94 ns
Urin sapi perah 25 % 129,20 ns 186,16 ns 220,02 ns
Urin sapi perah 50 % 131,14 ns 177,28 ns 209,56 ns
Urin sapi perah 75 % 117,04 ns 174,22 ns 205,90 ns
Ekstrak kecambah kacang hijau 25 % 127,10 ns 183,76 ns 217,20 ns
Ekstrak kecambah kacang hijau 50 % 114,60 ns 176,14 ns 208,20 ns
Ekstrak kecambah kacang hijau 75 % 102,20 ns 172,06 ns 203,40 ns
Keterangan: ns = tidak berbeda nyata dengan kontrol, * = berbeda nyata dengan kontrol
Hasil analisis varian menunjukkan bahwa pemberian bahan organik sebagai sumber zat pengatur tumbuh alami berpengaruh nyata terhadap variabel tinggi tunas. Berdasarkan uji lanjut Dunnet (Tabel 4.18), hasilnya juga berbeda nyata baik pada umur tebu 6, 12, maupun 17 mst. Pada umur tebu 6 mst, pemberian air kelapa muda 25 % dan 50 % secara nyata mampu menghasilkan tunas tebu yang lebih tinggi dibandingkan kontrol (tanpa bahan organik). Penambahan konsentrasi air kelapa muda hingga 75 % justru menurunkan nilai tinggi tunas bibit dan tidak berbeda nyata dengan kontrol (tanpa bahan organik). Sama halnya dengan perlakuan urin sapi perah dan ekstrak kecambah kacang hijau baik pada konsentrasi 25, 50, ataupun 75 %, tinggi tunas yang dihasilkan tidak berbeda nyata dengan kontrol (tanpa bahan organik) walaupun terlihat adanya kecenderungan penurunan nilai tinggi tunas seiring dengan penambahan konsentrasi pada masing-masing bahan organik.
justru menghasilkan tunas tebu yang lebih pendek dan tidak berbeda nyata dengan kontrol (tanpa bahan organik). Begitu juga dengan perlakuan lainnya, yaitu perlakuan urin sapi perah dan ekstrak kecambah kacang hijau baik pada konsentrasi 25, 50, ataupun 75 %, hasilnya tidak berbeda nyata dengan kontrol (tanpa bahan organik). Jadi, dapat dikatakan bahwa perlakuan air kelapa muda 50 %, air kelapa muda 75 %, urin sapi perah 25 %, urin sapi perah 50 %, urin sapi perah 75 %, ekstrak kecambah kacang hijau 25 %, ekstrak kecambah kacang hijau 50 %, dan ekstrak kecambah kacang hijau 75 % baik pada umur 12 maupun 17 mst secara signifikan tidak mampu meningkatkan nilai tinggi tunas bibit tebu bila dibandingkan dengan kontrol (tanpa bahan organik) walaupun terlihat adanya kecenderungan penurunan nilai tinggi tunas seiring dengan penambahan konsentrasi pada masing-masing bahan organik.
C. Pembahasan Umum
Zat pengatur tumbuh dengan macam dan konsentrasi yang sesuai berpotensi untuk meningkatkan persentase keberhasilan pembibitan. Selain itu, dapat juga mempercepat pembentukan dan pertumbuhan akar serta tunas yang berasal dari bahan stek. Proses pertunasan tebu biasanya diawali dengan aktivitas imbibisi, yaitu aktivitas masuk dan terserapnya (absorpsi) air ke dalam bahan tanam. Kelembaban tanah pada kapasitas lapangan sangat mendukung proses ini. Menurut Gardner (1991), hidrasi jaringan akan terjadi setelah aktivitas imbibisi berlangsung. Selanjutnya akan terjadi absorpsi oksigen, pengaktifan dan reaksi enzim, transpor molekul yang terhidrolisis, peningkatan respirasi dan asimilasi, inisiasi pembelahan dan pembesaran sel, dan akhirnya terjadi pemunculan tunas. Menurut Leopold (1955), mata tunas pada stek sangat diperlukan untuk mendorong terjadinya perakaran stek. Pembentukan akar tidak akan terjadi bila mata tunas dihilangkan atau dalam keadaan dorman. Hal ini terjadi karena tunas berperan sebagai sumber auksin yang menstimulir pembentukan akar, terutama bila mata tunas mulai tumbuh. Menurut Hartmann dan Kester (1975), IAA diidentifikasikan sebagai senyawa alami yang menunjukkan aktivitas auksin yang mendorong pembentukan akar adventif.
informasi bahwa volume akar berkorelasi positif dengan jumlah dan luas daun secara sangat nyata. Volume akar bibit tebu yang semakin besar secara sangat nyata akan diikuti oleh pertambahan jumlah dan luas daun pada bibit tebu tersebut. Namun, pertambahan nilai pada variabel panjang akar utama tidak diikuti oleh pertambahan nilai pada variabel volume akar, jumlah daun, dan luas daun bibit tebu. Hal ini diduga terjadi karena perakaran yang terdapat pada tebu merupakan perakaran serabut. Pada perakaran serabut, akar primer tidak dapat bertahan lama dalam pertumbuhan tanaman dan segera mengering, lalu dari pangkal akar tersebut akan muncul akar baru yang disebut akar adventif.
Tabel 4.19. Nilai koefisien korelasi antara variabel panjang akar utama, volume akar, jumlah daun, dan luas daun bibit tebu
Variabel Panjang Akar
Keterangan: Tanda (*) menunjukkan adanya korelasi yang nyata antar variabel pengamatan pada tingkat kepercayaan 5%. Tanda (**) menunjukkan adanya korelasi yang sangat nyata antar variabel pengamatan pada tingkat kepercayaan 5%.
Secara umum, stek tebu yang mendapatkan perlakuan air kelapa muda 25 % volume akarnya lebih besar daripada perlakuan lainnya. Volume akar yang lebih besar menyebabkan kapasitas akar dalam menyerap air dan nutrisi juga lebih kuat sehingga jumlah air dan nutrisi yang ditranslokasikan menuju daun lebih banyak, terutama pada bibit tebu yang mendapatkan perlakuan air kelapa muda 25 %. Akar-akar adventif ini yang mempengaruhi nilai volume Akar-akar. Pasokan air dan nutrisi tanaman yang lebih kuat menyebabkan daun pada stek tebu yang mendapatkan perlakuan air kelapa muda 25 % jumlahnya lebih banyak serta lebih luas jika dibandingkan dengan stek tebu yang mendapatkan perlakuan lainnya.
(1991), tanaman cenderung menginvestasikan sebagian besar awal pertumbuhan dalam bentuk penambahan luas daun.
Akar berperan dalam penyerapan air dan hara dari dalam tanah. Semakin besar nilai volume akar, maka semakin terpenuhi kebutuhan hara dan air bagi tanaman karena meningkatnya kapasitas akar dalam penyerapan air maupun hara. Apabila kebutuhan air dan hara bagi tanaman tercukupi dengan optimal maka proses fotosintesis dapat berjalan dengan baik. Hasil fotosintesis tersebut selanjutnya ditranslokasikan ke seluruh organ tanaman, termasuk daun, untuk menunjang aktivitas pertumbuhan daun. Sama halnya dengan yang diungkapkan oleh Rogomulyo (1992), yaitu bahwa akar merupakan organ yang menentukan kelangsungan hidup suatu tanaman. Semakin cepat dan banyak akar terbentuk, maka semakin besar kemungkinan bibit tumbuh sehat dan kuat.
Tabel 4.20. Nilai koefisien korelasi antara variabel luas daun dan laju asimilasi bersih bibit tebu
Variabel Luas Daun Laju Asimilasi Bersih
Luas Daun 1
Laju Asimilasi Bersih 0,460 ** 1
Keterangan: Tanda (*) menunjukkan adanya korelasi yang nyata antar variabel pengamatan pada tingkat kepercayaan 5%. Tanda (**) menunjukkan adanya korelasi yang sangat nyata antar variabel pengamatan pada tingkat kepercayaan 5%.
25 % daunnya lebih luas jika dibandingkan dengan perlakuan lainnya. Daun yang lebih luas dengan laju asimilasi bersih per satuan luas daun yang sama besar merupakan penyebab utama lebih besarnya nilai laju asimilasi bersih per luas daun total suatu bibit tebu.
Tabel 4.21. Nilai koefisien korelasi antara variabel laju asimilasi bersih dan laju pertumbuhan nisbi bibit tebu
Variabel Laju Asimilasi Bersih Laju Pertumbuhan Nisbi
Laju Asimilasi Bersih 1
Laju Pertumbuhan Nisbi 0,452 ** 1
Keterangan: Tanda (*) menunjukkan adanya korelasi yang nyata antar variabel pengamatan pada tingkat kepercayaan 5%. Tanda (**) menunjukkan adanya korelasi yang sangat nyata antar variabel pengamatan pada tingkat kepercayaan 5%.
Tabel 4.21 menunjukkan adanya korelasi positif secara sangat nyata antara laju asimilasi bersih dengan laju pertumbuhan nisbi. Semakin tinggi laju asimilasi bersih, maka secara sangat nyata akan semakin tinggi juga laju pertumbuhan nisbi. Keduanya memang berperan dalam pembentukan bobot kering tanaman. Laju asimilasi bersih menunjukkan kemampuan tanaman untuk menyediakan asimilat melalui proses fotosintesis selama pertumbuhannya ditentukan oleh kemampuan per satuan luas daun dan luas daun total. Nilai laju asimilasi bersih yang tinggi menunjukkan bahwa sebagian besar daun mampu menyerap radiasi matahari dan hara untuk berfotosintesis secara optimal. Semakin tinggi hasil fotosintesis, berarti semakin besar pertambahan bahan kering tanaman. Pertambahan bahan kering tanaman ini yang biasanya disebut dengan laju pertumbuhan nisbi.
Tabel 4.22. Nilai koefisien korelasi antara variabel laju pertumbuhan nisbi, bobot kering akar, bobot kering tajuk, dan bobot kering total bibit tebu
Variabel
Bobot Kering Tajuk 0,146 0,412 ** 1
Bobot Kering Total 0,299 * 0,901 ** 0,803 ** 1
Keterangan: Tanda (*) menunjukkan adanya korelasi yang nyata antar variabel pengamatan pada tingkat kepercayaan 5%. Tanda (**) menunjukkan adanya korelasi yang sangat nyata antar variabel pengamatan pada tingkat kepercayaan 5%.