7
Tanaman kedelai ( L. Merr) merupakan salah satu tanaman
pangan yang sudah lama dibudidayakan oleh masyarakat Indonesia. Tanaman ini
mempunyai arti penting untuk memenuhi kebutuhan pangan dalam rangka
memperbaiki gizi masyarakat karena merupakan sumber protein nabati yang
relatif murah bila dibandingkan sumber protein lainnya seperti daging, susu dan
ikan (Mapegau, 2006).
Produktivitas kedelai per hektar tergantung pada varietas, cara bercocok
tanam dan kondisi lingkungan tempat bertanam. Penggunaan varietas yang tepat
pada kondisi lingkungan atau musim yang cocok diharapkan dapat mencapai
potensi hasilnya. Varietas kedelai yang diusahakan petani sangat beragam dengan
sifat dan potensi hasil yang beragam pula. Salah satu penyebab keadaan ini
dikarenakan kesulitan petani dalam mendapatkan benih kedelai yang akan
ditanam (Hapsoh, 2005).
Tanaman kedelai sebagian besar tumbuh di daerah yang beriklim tropis
dan subtropis. Sebagai barometer iklim yang cocok bagi kedelai adalah bila cocok
bagi tanaman jagung. Bahkan daya tahan kedelai lebih baik daripada jagung.
Iklim kering lebih disukai tanaman kedelai dibandingkan iklim lembab. Tanaman
kedelai dapat tumbuh baik di daerah yang memiliki curah hujan sekitar 100 + 400
mm/bulan. Sedangkan untuk mendapatkan hasil optimal, tanaman kedelai
membutuhkan curah hujan antara 100 + 200 mm/bulan. Suhu yang dikehendaki
tanaman kedelai antara 21 + 34ᵒC, akan tetapi suhu optimum bagi pertumbuhan
memerlukan suhu yang cocok sekitar 30ᵒC (Prihatman, 2000). Pada suhu yang
lebih tinggi dari 30ᵒC, fotorespirasi cenderung mengurangi hasil fotosintesis.
Tanaman ini pada umumnya dapat beradaptasi terhadap berbagai jenis tanah dan
menyukai tanah yang bertekstur ringan hingga sedang dan berdrainase baik.
Tanaman ini peka terhadap kondisi salin (Rubatzky dan Yamaguchi, 1998).
Pada dasarnya kedelai menghendaki kondisi tanah yang tidak terlalu
basah, tetapi air tetap tersedia. Kedelai tidak menuntut struktur tanah yang khusus
sebagai suatu persyaratan tumbuh. Bahkan pada kondisi lahan yang kurang subur
dan agak asam pun kedelai dapat tumbuh dengan baik, asal tidak tergenang air
yang akan menyebabkan busuknya akar. Toleransi pH yang baik sebagai syarat
tumbuh yaitu antara 5,8 – 7, namun pada tanah dengan pH 4,5 pun kedelai masih
dapat tumbuh baik. Dengan menambah kapur 2 – 4 ton per ha, pada umumnya
hasil panen dapat ditingkatkan (Prihatman, 2000).
Lahan salin atau pantai adalah lahan pasang surut yang terkena pengaruh
intrusi air laut atau payau. Lahan salin mendapatkan intrusi air laut lebih dari 3
bulan dalam setahun. Daya hantar listrik lebih dari 4 mmhos/cm dan persentase
Na dapat tukar 8 + 15% dan pH tanah kurang dari 8,5 (Horneck 2007;
Noor, 1996). Istilah salin digunakan untuk menggambarkan tanah yang kaya
kadar garam di dalam larutan tanah. Luas total lahan salin di Indonesia adalah
60,08 juta hektar yang terdiri dari lahan rawa dengan luas mencapai 39,98 juta
hektar dan lahan pasang surut seluas 20,1 juta hektar. Berdasarkan luas total lahan
salin tersebut diketahui bahwa lahan yang potensial untuk program pertanian
adalah seluas 9,5 juta hektar, sedangkan lahan potensial tersebut yang baru
9
memperoleh garam dalam jumlah yang cukup tinggi dari limpasan air laut
sehingga menjadi salin atau secara alami tingkat salinitas tanah akan menjadi
tinggi. Kondisi ini ditemukan pada daerah+daerah pantai (Delvian, 2003).
Masalah salinitas telah meluas akhir+akhir ini. Data dari FAO antara
pertengahan tahun 1960 sampai dengan tahun pertengahan 1980 memperlihatkan
hampir 50% lahan irigasi mengalami masalah salinitas. Setiap tahun beberapa
ratus ribu hektar lahan irigasi ditinggalkan karena mengalami salinisasi.
Fenomena ini juga terjadi secara luas di Indonesia (Sembiring dan Gani, 2005).
Salinitas pada umumnya bersumber pada tanah dan air tanah. Salin atau
tidaknya suatu tanah ataupun air diukur berdasarkan daya hantar listriknya yang
tergantung pada kadar garam yang terlarut dalam air ataupun dalam larutan yang
berhubungan dengan pertumbuhan tanaman. Tanah salin mengandung garam
terlarut yang dapat membahayakan tanaman. Karakteristik tanah salin adalah
adanya lapisan keras berwarna putih atau coklat muda pada bagian permukaan.
Tanah salin memiliki daya hantar listrik > 4,0 mmhos/cm. Garam yang biasa
terdapat pada tanah salin adalah NaCl, CaCl2, gipsum (CaSO4), magnesium sulfat,
potasium klorida dan sodium sulfat. Secara umum pH tanah salin adalah di bawah
8,5 (Provin dan Pitt, 2009).
Kadar garam terlarut dalam tanah akan mempengaruhi beberapa sifat fisik
tanah, antara lain pembentukan struktur, daya pegang air dan permeabilitas tanah.
Semakin tinggi pemberian Na2SO4 dan NaCl pada tanah akan semakin tinggi
tekanan osmotik tanah. Daya hantar listrik ( , EC) meningkat
semakin jauh dari permukaan tanah, hal ini disebabkan oleh akumulasi kation
garam ke bagian bawah solum akibat pencucian yang intensif (Jumin, 1989).
Namun salinitas tanah tidak hanya tergantung pada konsentrasi garam dalam
lima kali kapasitas memegang air dibandingkan tanah kasar, sehingga pada
kondisi tertentu larutan tanah kasar akan mengandung sampai lima kali
konsentrasi garam yang terkandung dalam tanah halus (Bernstein, 1981).
Walaupun demikian, pada kondisi seperti ini peluang untuk mengusahakan
tanaman serelia masih terbuka dengan memilih tanaman yang toleran atau semi
toleran. Kedelai merupakan salah satu serealia yang semi toleran (Jumberi dan
Yufdy, 2009).
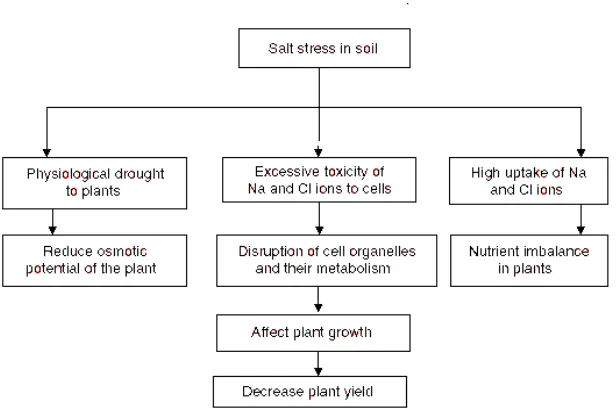
Penurunan produksi pertanian pada tanah salin yang sangat besar
dipengaruhi oleh gangguan pertumbuhan dan perkembangan tanaman. Pengaruh
salinitas secara langsung terhadap pertumbuhan tanaman meliputi :
a. Pengurangan potensial osmotik pada larutan tanah yang akan mengurangi
jumlah air yang tersedia bagi tanaman yang menyebabkan kering fisiologis,
untuk mengatasi masalah ini tanaman harus menjaga potensial osmotik
internal untuk mencegah air keluar dari akar ke tanah di sekitar tanaman.
b. Toksisitas akibat berlimpahknya ion Na+ dan Cl+ di dalam sel, pengaruh
keracunan meliputi terganggunya struktur enzim dan makromolekul lain,
kerusakan organel sel dan membran plasma, gangguan fotosintesis, respirasi
dan sintesis protein.
c. Ketidakseimbangan hara pada tanaman menyebabkan terganggunya
penyerapan dan/atau transport hara ke tajuk menyebabkan defisiensi hara
(Evelin 2009).
Salinitas mengurangi pertumbuhan dan hasil tanaman pertanian penting
dan pada kondisi terburuk dapat menyebabkan terjadinya gagal panen. Pada
11
akumulasi berlebihan Na dan Cl dalam sitoplasma menyebabkan perubahan
metabolisme di dalam sel. Aktivitas enzim terhambat oleh garam. Kondisi
tersebut juga mengakibatkan dehidrasi parsial sel dan hilangnya turgor sel karena
berkurangnya potensial air di dalam sel (Mahmood 2009).
Gambar 2.1. Pengaruh Cekaman Salinitas pada Tanaman (Evelin 2009).
Kedelai termasuk tanaman yang cukup toleran terhadap garam dan
produksi kedelai akan berkurang apabila tingkat salinitas tanah melebihi 5 dS/m.
Pada tanah dengan salinitas 14 + 15 dS/m produksi rata+rata 47,5% dibandingkan
pada tanah non salin dan pada salinitas 18+20 dS/m produksi rata+rata hanya
28,9% dibandingkan produksi kedelai pada tanah non salin (Phang 2008).
Tingginya konsentrasi garam menyebabkan gangguan pada seluruh siklus
hidup kedelai. Tingkat toleransi kedelai pada berbagai varietas kedelai bervariasi
menurut tingkat pertumbuhan. Perkecambahan biji kedelai akan terhambat pada
konsentrasi garam rendah. Konsentrasi garam yang lebih tinggi secara nyata akan
menurunkan persentase perkecambahan. Pengaruh garam pada tahap awal dan
penurunan persentase perkecambahan lebih menonjol pada varietas yang sensitif
oleh salinitas yang tinggi, diantaranya adalah pengurangan tinggi tanaman,
ukuran daun, biomassa, jumlah ruas, jumlah cabang, jumlah polong, bobot
tanaman dan bobot 100 biji, penurunan kualitas biji, penurunan kandungan protein
biji, menurunkan kandungan minyak pada biji kedelai, nodulasi kedelai,
mengurangi efisiensi fiksasi nitrogen, menurunkan jumlah dan bobot bintil akar
(Phang 2008)
Selain menunjukkan gangguan pertumbuhan, respon genotipe kedelai
sensitif pada kondisi salin juga terjadi pengurangan laju fotosintesis. Penurunan
laju fotosintesis mungkin diakibatkan penutupan stomata yang disebabkan
cekaman osmotik atau gangguan induksi garam pada organ+organ fotosintesis
(Kao 2006). Secara umum, varietas kedelai yang toleran garam
menunjukkan kemampuan untuk tumbuh dan berproduksi lebih baik dibandingkan
dengan varietas yang sensitif (Phang 2008).
!
Salinitas adalah salah satu faktor abiotik penting yang membatasi produksi
kedelai di seluruh dunia. Reklamasi tanah bukanlah pilihan ekonomis untuk
meningkatkan produksi kedelai yang mengalami cekaman salinitas. Oleh karena
itu, perbaikan genetik untuk toleransi garam merupakan pilihan yang lebih hemat
biaya. Pemuliaan konvensional telah memberikan kontribusi signifikan terhadap
peningkatan kedelai dalam 50 tahun terakhir. Melalui pemuliaan konvensional,
mudah untuk memanipulasi pewarisan sifat+sifat kualitatif yang kurang peka
terhadap perubahan lingkungan, tetapi sifat kuantitatif seperti hasil atau toleransi
terhadap stres abiotik secara signifikan dipengaruhi oleh lingkungan (Pathan
13
Beberapa tanaman mengembangkan mekanisme untuk mengatasi cekaman
tersebut di samping itu ada pula yang menjadi teradaptasi. Mayoritas tanaman
budidaya rentan dan tidak dapat bertahan pada kondisi salinitas tinggi, atau
sekalipun dapat bertahan tetapi dengan hasil panen yang berkurang. Studi
mengenai respon tanaman terhadap salinitas penting dalam usaha teknik
penapisan tanaman yang efektif. Varietas kedelai menunjukkan spektrum luas
dalam kemampuannya mentoleransi garam. Penapisan genotipe kedelai telah
dilakukan untuk mengidentifikasi sifat genetik yang menunjukkan toleransi tinggi
terhadap cekaman garam. Saat ini, pemuliaan merupakan strategi utama untuk
meningkatkan toleransi garam pada kedelai (Phang 2009).
Kedelai diklasifikasikan sebagai tanaman yang cukup toleran salinitas
tergantung dari perbedaan varietas (Katerji 2000). Penelitian Rahmawati
dan Rosmayati (2010) menunjukkan bahwa dari 20 varietas yang ditanam pada
tanah salin, hanya 5 varietas yang mampu menyelesaikan siklus hidupnya sampai
fase generatif dan menghasilkan biji, sedangkan 15 varietas lainnya hanya mampu
bertahan sampai pada fase vegetatif saja. Kelima varietas tersebut adalah
Grobogan, Anjasmoro, Bromo, Cikuray dan Detam 2.
Mekanisme toleransi garam pada kedelai dapat diklasifikasikan menjadi 4
kategori utama, yaitu :
1. Pemeliharaan ion homeostatis
2. Penyesuaian sebagai respon terhadap cekaman osmotik
3. Pemulihan keseimbangan oksidatif
4. Adaptasi struktural dan metabolik lain (Phang 2008)
Penelitian Valencia (2008) menunjukkan pengaruh pertumbuhan
tajuk dan akar pada kedelai yang mengalami cekaman garam pada beberapa
Tabel 2.1. Perbandingan Dua Metodologi Penapisan Klorida pada Tujuh Kultivar Kedelai
Kultivar Metode Gejala Visual Daun Metode Penapisan Reaksi Klorida
Klasifikasi Gejala Klasifikasi Cl– (mg kg+1)
Clark Sensitif Klorosis 14,104
Dare Sensitif Klorosis 14,612
Williams Sensitif Klorosis 13,868
HBK R4924 Sensitif Klorosis 14,152
HBK R5525 Toleran Hijau normal 3,096
Lee 68 Toleran Hijau normal 2,352
S+100 Toleran Hijau normal 2,724
(Sumber : Valencia , 2008)
Gambar 2.2. Gejala Visual pada Genotipe Kedelai Sensitif ( ) dan Varietas Kedelai Toleran pada NaCl 120 nM (Sumber : Valencia , 2008)
15
Cekaman salinitas pada sel menyebabkan perubahan metabolisme dan
perkembangan sel. Identifikasi karakteristik spesifik yang berhubungan dengan
toleransi garam seperti osmolite yang kompatibel (misalnya prolin dan gula) akan
menjadi penanda biologis potensial yang berguna dalam mengidentifikasi dan
manipulasi sel+sel tanaman yang tahan salinitas. Untuk melihat perubahan
biokimia terhadap cekaman osmotik dan menjelaskan mekanisme adaptasi pada
tingkat sel, perlu diteliti status pertumbuhan tanaman kedelai, kandungan gula,
dan prolin. Hasil penelitian menunjukkan kultivar kedelai toleran salinitas
memiliki bobot segar, prolin, protein dan kandungan gula yang lebih tinggi
dibandingkan kultivar kedelai yang tidak toleran salinitas (Aghaleh dan Niknam,
2009).
" # $
Kemajuan dalam bidang bioteknologi, khususnya pada biologi molekuler
membuka peluang penggunaannya dalam memecahkan berbagai masalah
pemuliaan tanaman. Dalam pemuliaan konvensional menggunakan hasil observasi
fenotipe, kadang+kadang didukung oleh statistika yang rumit dalam menyeleksi
individu unggul pada suatu populasi tanaman (Amris, 1988). Pemuliaan tanaman
di masa mendatang akan lebih mengarah kepada penggunaan teknik dan
metodologi pemuliaan molekuler dengan menggunakan penanda genetik.
Penggunaan “pemuliaan molekuler” ini telah menjanjikan kesederhanaan terhadap
kendala dan tantangan dalam pemuliaan tanaman yang rumit. Seleksi tidak
langsung dengan menggunakan penanda molekuler yang terikat dengan sifat+sifat
yang diinginkan telah memungkinkan studi individu pada tahap pertumbuhan dini,
ketidaktepatan pengukuran akibat ekspresi sifat yang disebabkan oleh faktor
eksternal lokus genetik ganda (Sudarmi, 2013).
Gen+gen yang diinduksi oleh cekaman abiotik seperti salinitas tinggi telah
ditemukan dan memberi peluang penting untuk memperbaiki sifat toleran
terhadap salinitas tinggi melalui pendekatan rekayasa genetik. Gen+gen target
tersebut meliputi gen+gen yang menyandikan enzim+enzim yang diperlukan untuk
biosintesis berbagai osmoprotektan, enzim+enzim yang mengelimasi reaktif
oksigen spesies, protein+protein embriogenesis akhir (LEA), enzim+enzim untuk
detoksifikasi dan faktor transkripsi (Santoso 2012).
Respon tanaman terhadap cekaman salinitas telah digunakan oleh para
ilmuwan untuk menghasilkan tanaman transgenik yaitu dengan cara mentransfer
gen responsif stres ke tanaman yang sensitif atau mengubah ekspresi gen yang
ada. Ada sejumlah gen yang diketahui bertanggung jawab mentoleransi cekaman
salinitas. Pendekatan molekuler melalui skrining dilakukan pada tanaman untuk
mengetahui gen+gen yang berperan dalam mekanisme ketahanan tersebut (Turan
2012; Ermawati, 2011).
Mekanisme utama untuk toleransi garam adalah dengan meminimalkan
garam diambil oleh akar, membaginya di tingkat sel dan jaringan sehingga tidak
mencapai konsentrasi yang bersifat toksik pada sitosol di daun. Gen+gen kandidat
antara lain untuk transportasi ion, osmoprotektan, dan membuat tanaman tumbuh
lebih cepat di tanah salin. Studi tentang ekspresi gen pada akar dan daun telah
banyak diulas dan berbagai saran telah disampaikan untuk meningkatkan
ketahanan tanaman di tanah salin (Munns, 2005). Beberapa peneliti telah
melaporkan beberapa gen yang terkait dengan toleransi kedelai terhadap cekaman
salinitas antara lain P5CS, GmCLC1, GmSOS1, GmNHX1, GmbZIP, GmDREB,
17
2011; Gao 2011; Zhang 2009; Li 2006; Liao 2003; Sun
2013).
% & #
$
Cekaman salinitas seperti faktor cekaman abiotik lainnya, diketahui
menginduksi kerusakan oksidatif sel+sel tanaman akibat senyawa reaktif oksigen
spesies (ROS) yang mempengaruhi proses fisiologi dan biokimia tanaman yang
dapat menyebabkan penurunan produksi tanaman (Azevedo+Neto 2006 ).
Tanaman yang mengalami cekaman salinitas melakukan adaptasi metabolisme
untuk mengatasi perubahan lingkungan. Kelangsungan hidup pada kondisi stres
tergantung pada kemampuan tanaman untuk memahami stimulus, menghasilkan
dan mengirimkan sinyal dan memicu perubahan biokimia yang mengatur
metabolisme yang sesuai ( Hasegawa 2000 ).
Senyawa reaktif oksigen seperti radikal superoksida (O2+), hidrogen
peroksida (H2O2) dan radikal hidroksil (OH+) juga diproduksi selama stres
salinitas, dan bertanggung jawab atas kerusakan membran dan makro molekul
penting lainnya seperti pigmen fotosintesis, protein, DNA dan lipid (Fahmy
1998). Sel kloroplas tanaman, mitokondria dan peroksisom adalah penghasil ROS
yang penting. Senyawa reaktif oksigen yang diproduksi sebagai hasil dari
berbagai cekaman abiotik harus dibuang untuk melindungi tanaman dari stres
oksidatif dan pemeliharaan pertumbuhan normal (Dolatabadian dan Jouneghani,
2009).
Stres oksidatif merupakan hasil dari ketidakseimbangan antara peroksidan
(ROS) dan antioksidan. Senyawa reaktif oksigen spesies (ROS) adalah radikal
bebas dan senyawa yang cenderung reaktif dan mudah bereaksi dengan senyawa
menimbulkan reaksi berantai yang menimbulkan kerusakan jaringan (Agarwal,
2005).
Salah satu upaya untuk meningkatkan toleransi terhadap stres oksidatif
adalah dengan aplikasi asam askorbat (vitamin C). Asam askorbat adalah molekul
yang berukuran kecil, larut dalam air, merupakan anti+oksidan yang bertindak
sebagai substrat utama dalam jalur siklik detoksifikasi enzimatik hidrogen
peroksida. Asam askorbat adalah zat pertama dalam detoksifikasi dan menetralkan
radikal superoksida (Noctor dan Foyer, 1998). Asam askorbat juga berperan
penting dalam fotoproteksi, regulasi fotosintesis, serta proses pertumbuhan
tanaman seperti pembelahan sel dan ekspansi dinding sel (Smirnoff, 2000;
Pignocchi dan Foyer, 2003).
Asam askorbat merupakan salah satu senyawa yang penting dalam proses
selular termasuk pembelahan dan pembesaran sel serta dalam mengaktifkan
aktivitas metabolisme ketika proses perkecambahan dimulai. Asam askorbat juga
berfungsi menetralisir racun, melindungi sel dari senyawa oksigen reaktif dan
radikal bebas serta mencegah kematian sel (Conklin dan Barth, 2004).
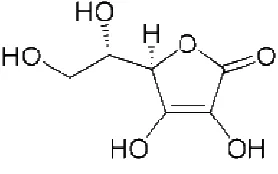
Gambar 2.4. Struktur Kimia Asam Askorbat
Dehghan (2011) melaporkan aplikasi asam askorbat eksogenous
dengan dosis 400 ppm pada kondisi cekaman salinitas dapat meningkatkan
persentase perkecambahan kedelai, bobot kering akar dan tajuk. Ejaz (2012)
19
meningkatkan pertumbuhan vegetatif, aktifitas enzim antioksidan (POD dan
SOD), dan kandungan prolin pada cekaman salinitas. Aplikasi asam askorbat pada
kacang hijau yang mengalami stres salinitas juga dapat meningkatkan aktivitas
enzim antioksidan dan mencegah aktivitas senyawa reaktif oksigen. Selain itu
asam askrobat juga meningkatkan kandungan klorofil pada kacang hijau
(Dolatabadian dan Jouneghani, 2009).
' ( # ) &
Asosiasi simbiotik antara jamur dengan akar tanaman yang membentuk
jalinan interaksi yang kompleks dikenal dengan mikoriza yang secara harfiah
berarti “akar jamur” (Atmaja, 2001). Mikoriza adalah merupakan asosiasi
simbiotik antara akar tanaman dengan jamur. Secara umum mikoriza di daerah
tropika tergolong ke dalam dua Endomikoriza pada umumnya termasuk ke dalam
ordo Glomales (Zyangomycetes), yang terbagi ke dalam subordo Glominae dan
Gigasporinae. Gigasporineae dengan famili Gigasporaceae mempunyai dua genus
yaitu Gigaspora dan Scutellospora. Glomaceae mempunyai 4 famili yaitu famili
Glomaceae dengan genus Glomus, famili Acaulospora dengan genus Acaulospora
dan Entrophospora, Paraglomacear dengan genus Paraglomus, dan
Archaeosporaceae dengan genus Achaespora (INVAM, 2003).
Perkembangan suatu infeksi mikoriza dimulai dengan pembentukan
apresorium pada permukaan akar oleh hifa eksternal yang berasal dari spora
mikoriza dalam tanah. Hifa dari apresorium menembus sel+sel epidermis dan
menjalar di antara sel atau dalam sel sepanjang akar korteks. Akar bermikoriza
membentuk jaringan hifa luar (eksternal) yang merupakan kelanjutan dari hifa
dalam (internal) menjalar ke dalam tanah. Gambar 2.5 menunjukkan struktur
jaringan akar tanaman yang terinfeksi mikoriza terdiri atas hifa yang tidak
bercabang yang terletak di ruangan antara sel. Selain itu terdapat pula hifa
intraseluler yang membengkok menjadi bulat atau bulat memanjang yang disebut
vesikel (Anas, 1992).
Gambar 2.5. Penampang Melintang Akar yang Menunjukkan Karakteristik Struktur Fungi Mikroriza Arbuskular (Habte dan Osorio, 2001)
Vesikel merupakan suatu struktur berbentuk lonjong atau bulat,
mengandung cairan lemak, yang berfungsi sebagai organ penyimpanan makanan
atau berkembang menjadi klamidospora yang berfungsi sebagai organ reproduksi
dan struktur tahan. Vesikel selain dibentuk secara interseluler ada juga yang
secara intraseluler. Pembentukan vesikel diawali dengan adanya perkembang
sitoplasma hifa yang menjadi lebih padat, multinukleat dan mengandung partikel
lipid dan glikogen. Sitoplasma menjadi semakin padat melalui proses kondensasi,
dan organel semakin sulit untuk dibedakan sejalan dengan akumulasi lipid selama
maturasi (proses pendewasaan). Vesikel biasanya dibentuk lebih banyak di luar
jaringan korteks pada daerah infeksi yang sudah tua dan terbentuk setelah
pembentukan arbuskul. Arbuskul adalah struktur hifa yang bercabang+cabang
21
berfungsi sebagai tempat pertukaran nutrisi antara tanaman inang dengan jamur.
Struktur ini mulai terbentuk 2+3 hari setelah infeksi, diawali dengan penetrasi
cabang hifa lateral yang dibentuk oleh hifa ekstraseluler dan intraseluler ke dalam
dinding sel inang (Feronika, 2003).
Manfaat FMA dalam ekosistem sangat penting, yaitu berperan dalam
siklus hara, memperbaiki struktur tanah dan menyalurkan karbohidrat dari akar
tanaman ke organisme tanah yang lain (Brundrett 1996). Sedangkan
manfaat bagi tanaman yaitu dapat meningkatkan penyerapan unsur hara, terutama
P (Bolan, 1991), di mana FMA dapat mengeluarkan enzim fosfatase dan asam+
asam organik, khususnya oksalat yang dapat membantu membebaskan P. Sasli
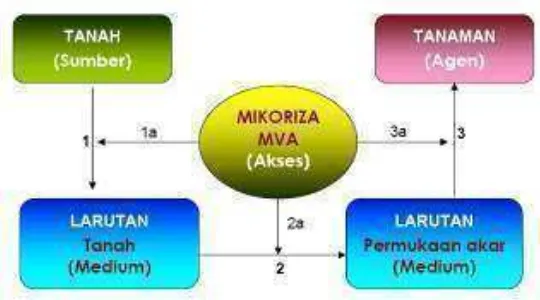
(2004) menggambarkan peranan FMA dalam meningkatkan ketersediaan dan
serapan unsur hara dan unsur hara lainnya seperti pada Gambar 6.
Gambar 2.6 . Pengaruh Mikoriza Arbuskular pada Ketersediaan dan Penyerapan Unsur Hara (Sasli, 2004)
*
Pada tahap ini, terjadi modifikasi kimia oleh mikoriza terhadap akar tanaman,
sehingga tanaman mengeksudasi asam+asam organik dan enzim fosfatase asam
tanaman terhadap kondisi tanah yang kahat P, yang mempengaruhi kimia rizosfer
(Marschner, 1995).
Mekanisme utama bagi pergerakan P ke permukaan akarah melalui difusi yang
terjadi akibat adanya gradien konsentrasi, serta merupakan proses yang sangat
lambat. Menurut Bolan (1991), jarak difusi ion+ion fosfat tersebut dapat
diperpendek dengan hifa eksternal FMA yang juga dapat berfungsi sebagai alat
penyerap dan translokasi fosfat (Jakobsen, 1992).
Konsentrasi P yang ada di larutan tanah dapat menjadi sangat rendah dan
mencapai konsentrasi minimum yang dapat diserap akar, hal ini terjadi sebagai
akibat terjadinya proses penyerapan ion fosfat yang ada di permukaan akar
(Marschner, 1995). Di bawah konsentrasi minimum tersebut akar tidak mampu
lagi menyerap P dan unsur hara lainnya, sedangkan pada akar bermikoriza,
penyerapan tetap terjadi sekalipun konsentrasi ion fosfat berada di bawah
konsentrasi minimum yang dapat diserap oleh akar (Bolan, 1991). Proses ini ini
terjadi karena afinitas hifa eksternal yang lebih tinggi atau peningkatan daya tarik
menarik ion+ion fosfat yang menyebabkan pergerakan P lebih cepat ke dalam hifa
FMA (Smith dan Read, 1997).
Selain berperan penting dalam peningkatan serapan P, serapan unsur hara
lain seperti kalium, kalsium, magnesium, besi, tembaga, mangan, seng, dan boron
seringkali meningkat akibat adanya FMA (Santosa, 1990). Pengaruh FMA dalam
pertumbuhan tanaman telah pula diinformasikan yaitu tanaman yang bermikoriza
menjadi lebih tenggang terhadap salinitas dan kemasaman tanah, keracunan logam
23
dalam pertumbuhan, merangsang nodulasi dan penambatan nitrogen pada legum
dan memberikan perlindungan akar dari infeksi patogen (Lynch, 1983; Mosse,
1991). Munyanzuza (1997) menyatakan bahwa tanaman yang bermikoriza
lebih tahan kekeringan daripada yang tidak bermikoriza dan akan cepat kembali
pulih setelah periode kekeringan berakhir. Hal ini dimungkinkan karena hifa FMA
masih mampu menyerap air pada pori+pori tanah pada saat akar tanaman sudah
tidak mampu. Selain penyebaran hifa di dalam tanah sangat luas sehingga hifa
dapat mengambil air relatif lebih banyak.
Secara umum dinyatakan pertumbuhan tanaman yang bermikoriza lebih
baik dari tanaman tanpa mikoriza (Mosse, 1981). Walaupun demikian setiap
spesies FMA mempunyai kemampuan berbeda dalam meningkatkan penyerapan
dan pertumbuhan tanaman. Kemampuan FMA dalam meningkatkan pertumbuhan
tanaman pada kondisi kurang menguntungkan disebut keefektifan. Ada beberapa
faktor yang berhubungan dengan keefektifan suatu spesies FMA yaitu :
kemampuan FMA untuk membentuk hifa yang ekstensif dan penyebaran hifa
yang baik di dalam tanah, kemampuan FMA untuk membentuk infeksi yang
ekstensif pada seluruh sistem perakaran yang berkembang dari suatu tanaman,
kemampuan hifa FMA untuk menyerap fosfor dari larutan tanah dan umur dari
mekanisme transpor sepanjang hifa ke dalam akar tanaman (Daniels dan Menge,
1981; Abbot dan Robson, 1984)
+ ( # ) & $
Tanaman pada lingkungan alami dikolonisasi oleh mikroorganisme
eksternal dan internal. Beberapa mikroorganisme menguntungkan terutama
bakteri dan jamur dapat meningkatkan pertumbuhan dan produksi tanaman pada
FMA telah ketahui dapat meningkatkan pertumbuhan dan toleransi
tanaman terhadap salinitas. FMA meningkatkan toleransi salinitas dengan
berbagai mekanisme, seperti meningkatkan serapan hara (Al+Karaki dan Al+
Raddad, 1997), memproduksi hormon pertumbuhan tanaman, memperbaiki
kondisi rizosfer dan tanah (Lindermann, 1994), mengubah sifat fisiologis dan
biokimia tanaman inang (Smith dan Read, 1995) dan mempertahankan akar dari
serangan patogen tanah (Dehne, 1982). Selain itu, FMA dapat meningkatkan
proses fisiologis inang seperti kapasitas penyerapan air tanaman dengan
meningkatkan konduktivitas hidrolik akar dan menyesuaikan keseimbangan
osmotik yang baik dan komposisi karbohidrat (Rosendahl dan Rosendahl, 1991;
Al+Karaki dan Clark, 1998; Ruiz+Lozano dan Azcon, 2000; Ruiz+Lozano, 2003).
Hal ini dapat menyebabkan pertumbuhan tanaman meningkat dan mengurangi
efek ion toksik (Juniper dan Abbott, 1993). Manfaat ini telah mendorong FMA itu
untuk menjadi bio+ameliorasi yang sesuai untuk tanah salin.
Fungi mikoriza arbuskular telah diketahui secara alami terdapat pada
lingkungan salin (Yamato 2008). Penelitian Aliasgharzadeh (2001)
menunjukkan beberapa spesies FMA dominan di tanah salin di dataran Tabriz
(EC 162 dS/m) adalah dan .
Peneliti juga menyatakan bahwa jumlah spora FMA tidak menurun secara nyata
dengan meningkatnya salinitas tanah dan dilaporkan jumlah spora relatif tinggi
(rata+rata 100 per 10 g tanah). Tingkat kepadatan spora jamur pada tanah salin
kemungkinan disebabkan sporulasi yang distimulasi cekaman salin, hal ini
menunjukkan bahwa FMA dapat menghasilkan spora pada tingkat kolonisasi akar
yang rendah pada kondisi salinitas tinggi. Sebaliknya beberapa peneliti
menyatakan bahwa salinitas tidak hanya mempengaruhi tanaman inang tetapi juga
25
Ada hubungan antara populasi spora FMA dengan beberapa faktor edapik.
Korelasi positif antara kerapatan spora dengan pH tanah, karbon organik, dan
kandungan pasir pada tanah. Korelasi negatif antara kepadatan spora dengan
ketersediaan Mg, Ca, Cl, liat, daya hantar listrik, SO4 dan rasio absorpsi natrium
(Aliasgharzadeh 2001; Mohammad 2003; Mathur , 2007).
Salinitas, tidak hanya berpengaruh pada tanaman inang tetapi juga pada
FMA yaitu dapat menghambat kemampuan kolonisasi, perkecambahan spora dan
pertumbuhan hifa. Beberapa peneliti melaporkan salinitas memberikan efek
negatif terhadap FMA (Hirrel, 1981; Estaun, 1989; McMillen 1998;
Jahromi 2008). Kolonisasi pada akar tanaman oleh beberapa spesies FMA
berkurang bila terpapar NaCl (Giri 2007; Sheng 2008) karena efek
langsung dari NaCl terhadap fungi yang menekan pertumbuhan mikoriza
arbuskular (Tian 2004; Sheng 2008; Juniper dan Abbott, 2006).
Panjang hifa cenderung menurun dengan meningkatnya konsentrasi salinitas
tanah. Pertumbuhan hifa jamur dapat lebih sensitif terhadap NaCl dari
perkecambahan spora (Juniper dan Abbott, 2006). Jahromi (2008)
melaporkan bahwa tingkat salinitas medium akan mengurangi jumlah spora yang
dihasilkan oleh . Penurunan ini menunjukkan bahwa jika
salinitas berlanjut, ada pengurangan kolonisasi pada tanaman dengan mengurangi
kemampuan inokulum (yaitu spora). Peningkatan salinitas akan mengurangi
panjang hifa yang akan menghambat kolonisasi dan kemampuan simbiosis FMA.
FMA yang paling banyak diteliti pada tanah salin adalah spp.
(Wang 2004). Porras+Sariano (2009) yang menguji kemampuan tiga
spesies FMA yaitu dan untuk
kemampuan FMA untuk melindungi tanaman dari pengaruh cekaman salinitas
yang merugikan tergantung dari kemampuan masing+masing spesies.
Penelitian Sharifi (2007) menunjukkan bahwa FMA yang diberi
perlakuan pendahuluan NaCl dengan peningkatan konsentrasi bertahap dan
kemudian diberi cekaman salinitas efisiensinya meningkat. Hal ini kemungkinan
disebabkan aklimatisasi FMA terhadap salinitas.
, -. / ( # ) & # 0
$
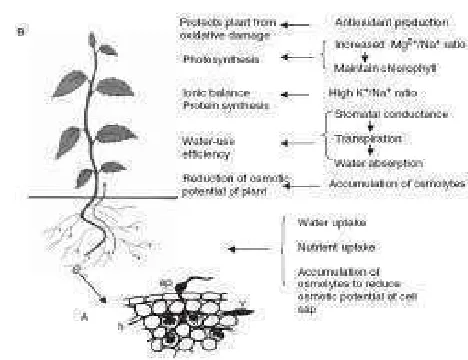
Evelin (2009) menyatakan bahwa peran FMA dalam meningkatkan
toleransi tanaman inang terhadap cekaman salinitas meliputi peningkatan serapan
hara (P, N, Mg dan Ca), menjaga rasio K+/Na+, perubahan biokimia (akumulasi
prolin, betain, poliamina, karbohidrat dan antioksidan), perubahan fisiologi
(fotosintesis, efisiensi, permeabilitas relatif, status air, akumulasi asam absisat,
nodulasi dan fiksasi nitrogen), perubahan molekular (ekspresi gen PIP, Na+/H+
antipoters, Lsnced, Lslea, dan LsPC5CS) dan perubahan ultra+struktural (Gambar
7).
27
, &
Mikoriza telah diketahui meningkatkan kemampuan tanaman inang
dengan meningkatnya pertumbuhan dan biomassa. Beberapa peneliti melaporkan
bahwa tanaman yang diinokulasi FMA tumbuh lebih baik daripada tanaman yang
tidak diinokulasi pada kondisi salin (Zuccarini dan Okurowska, 2008; Al+Karaki
dan Al+Raddad, 1997; Lindermann, 1994).
Colla (2008) melaporkan peningkatan pertumbuhan, produksi, status
air, kandungan hara dan mutu buah tanaman yang dikolonisasi
oleh yang mengalami cekaman salinitas. Peningkatan
pertumbuhan tanaman bermikoriza disebabkan kemampuan mikoriza
meningkatkan pengambilan hara khususnya fosfor (Sharifi 2007).
Beberapa penelitian mengenai pengaruh FMA pada tanaman kedelai yang
mengalami cekaman salinitas menunjukkan pertumbuhan tanaman kedelai yang
diinokulasi FMA lebih baik dibandingkan yang tidak diinokulasi (Ghorbanli
2004; Sharifi 2007). Sharifi (2007) menyatakan bahwa kedelai yang
diinokulasi dengan FMA secara nyata meningkatkan bobot basah dan bobot
kering, prolin akar, P, K dan Zn.
, $
FMA menunjukkan pengaruh positif pada komposisi hara mineral
(terutama hara dengan mobilitas rendah seperti fosfor) pada tanaman yang tumbuh
pada kondisi cekaman salinitas. Hal ini terutama disebabkan oleh ketersediaan
hara di sistem perakaran dan meningkatnya transportasi (penyerapan dan/atau
translokasi) oleh FMA (Sharifi 2007). Ketergantungan terhadap mikoriza
semakin meningkat dengan meningkatnya konsentrasi garam. Keadaan ini
( .
Salinitas tanah secara signifikan mengurangi penyerapan nutrisi mineral,
terutama fosfor (P), karena ion fosfat terjerap dengan ion Ca2+, Mg2+ dan Zn2+
pada tanah salin dan menjadi tidak tersedia untuk tanaman. Inokulasi mikoriza
dapat meningkatkan konsentrasi P dalam tanaman dengan meningkatkan serapan
yang difasilitasi oleh luas hifa fungi yang memungkinkan hifa tersebut
mengeksplorasi volume tanah lebih banyak dibandingkan dengan tanaman tidak
bermikoriza. Diperkirakan bahwa hifa eksternal memberikan hingga 80% dari
kebutuhan P suatu tanaman (Ruiz+Lozano dan Azcon, 2000). Peningkatan hara P
pada tanaman yang diinokulasi FMA dapat meningkatkan laju pertumbuhan
tanaman, meningkatkan produksi antioksidan dan meningkatkan bintil akar dan
fiksasi nitrogen dalam kacang+kacangan (Garg dan Manchdana, 2008).
Peningkatan serapan P oleh FMA pada tanaman yang tumbuh di pada
kondisi cekaman garam dapat mengurangi efek negatif dari ion Na dan Cl dengan
mempertahankan integritas membran vakuolar yang memudahkan
kompartementasi ke dalam vakuola dan selektifitas asupan ion sehingga
mencegah ion masuk ke dalam jalur metabolisme untuk pertumbuhan (Cantrell
dan Lindermann, 2001).
&
Salinitas mengganggu penyerapan nitrogen (N) dan pemanfaatannya yang
mempengaruhi tahapan yang berbeda dari metabolisme N, seperti serapan NO3+
dan sintesis protein (Frechill 2001). Pemberian FMA dapat membantu
asimilasi nitrogen yang lebih baik pada tanaman inang. Khaliel (2010)
menyatakan bahwa serapan nitrogen meningkat pada kacang tanah yang
29
mengambil nitrogen anorganik dari tanah dalam bentuk nitrat dan berasimilasi
melalui reduktase nitrat yang terletak dalam sel yang memiliki arbuskular.
Cliquet dan Stewart (1993) mengamati meningkatnya serapan N pada
tanaman bermikoriza yang disebabkan oleh perubahan metabolisme N akibat
perubahan enzim yang berhubungan dengan metabolisme nitrogen. Giri dan
Mukerji (2004) telah melaporkan bahwa peningkatan nutrisi N dapat membantu
mengurangi efek toksik dari ion Na dengan mengurangi penyerapan ion tersebut,
mekanisme ini secara tidak langsung dapat membantu dalam mempertahankan
kandungan klorofil tanaman.
1 2 3
Ketika Na+ atau konsentrasi garam dalam tanah tinggi, tanaman
cenderung mengambil lebih banyak Na+ yang mengakibatkan penurunan
penyerapan K+. Ion Na+ bersaing dengan K+ untuk menjadi bagian terpenting
pada berbagai fungsi selular. Kalium memainkan peranan penting dalam
metabolisme tanaman. K+ mengaktifkan berbagai enzim dan memainkan peranan
penting dalam pergerakan stomata dan sintesis protein. Konsentrasi tinggi K+
diperlukan dalam sintesis protein di mana K digunakan dalam pengikatan tRNA
pada ribosom. Fungsi+fungsi ini tidak dapat digantikan oleh ion Na+, lebih
tingginya rasio Na+ : K+ disebabkan karena salinitas akan mengganggu
keseimbangan ion dalam sitoplasma, akibatnya akan mengganggu berbagai jalur
metabolik (Giri 2007.).
Kolonisasi mikoriza pada tanaman dengan FMA bisa membalikkan
pengaruh salinitas terhadap nutrisi K dan Na. Kolonisasi mikoriza dapat
meningkatkan penyerapan K pada kondisi salin (Giri 2007; Sharifi
Serapan Na+ mungkin juga dipengaruhi oleh sintesis dan penyimpanan polifosfat
oleh kation lain terutama K (Giri 2003.).
Penyerapan K+ meningkat pada tajuk tanaman yang diberi mikoriza
bahkan pada tingkat salinitas tinggi (9,5 dS/m). Hal ini akan meningkatkan rasio
K : Na di akar dan tunas pada tanaman bermikoriza (Giri 2007). Tingginya
rasio K : Na membantu untuk mencegah berbagai gangguan proses enzimatis
dan penghambatan sintesis protein. Tingginya rasio K : Na juga bermanfaat dalam
mempengaruhi keseimbangan ion pada sitoplasma atau pengeluaran Na+ dari
tanaman (Colla 2008).
Pada salinitas tinggi, akumulasi Cl sangat meningkat, meskipun tetap
konstan dalam akar. Tingginya konsentrasi Cl pada jaringan bisa menjadi racun
bagi tanaman dan akan membatasi budidaya di daerah salin. Masalah ini dapat
diatasi oleh aplikasi mikoriza arbuskular yang dapat mengurangi penyerapan ion
Cl (Zuccarini dan Okurowska, 2008). Ion Cl dapat dipindahkan ke dalam
membran vakuolar sehingga mencegah ion tersebut mengganggu jalur metabolik
dalam tanaman (Cantrell dan Lindermann, 2001).
#
Studi menunjukkan bahwa FMA sangat mempengaruhi kalsium (Ca)
dalam tanaman. Cantrell dan Linderman (2001) melaporkan meningkatkan
serapan Ca pada selada yang diberi mikoriza. Tingginya Ca memiliki efek
menguntungkan pada efek racun dari NaCl dengan memfasilitasi tingginya
selektivitas K/Na dan menyebabkan meningkatnya adaptasi terhadap garam.
Selain itu, Ca yang tinggi juga dibutuhkan untuk meningkatkan kolonisasi dan
31
Biosintesis klorofil dihambat oleh cekaman salinitas yang menghalangi
menyerapan cahaya dan menyebabkan penurunan laju fotosintesis. Mikoriza dapat
meningkatkan serapan Mg dan meningkatkan konsentrasi klorofil. Efektifitas
serapan Mg2+ membantu meningkatkan konsentrasi klorofil dan dengan
demikian meningkatkan efisiensi fotosintesis dan pertumbuhan tanaman (Giri dan
Mukerji, 2004).
, &
Jika tanah mengering dan potensi air tanah berkurang, tanaman harus
mengurangi potensi air untuk menjaga gradien yang menguntungkan bagi aliran
air dari tanah ke akar. Untuk mencapai efek seperti itu, kebanyakan tanaman
mengembangkan mekanisme penyesuaian osmotik yang paling penting atau
osmoregulasi yang mungkin memerlukan penurunan potensial osmotik dalam
tanaman yang diminimalisir oleh akumulasi senyawa ion organik aktif atau zat
terlarut. Sejumlah senyawa yang mengandung nitrogen menumpuk di tanaman
yang terkena cekaman salinitas. Senyawa yang paling umum meliputi asam
amino, amida dan protein, senyawa amonium kuartener (betain) dan poliamina.
Senyawa ini umumnya ada dalam konsentrasi rendah ketika tanaman tidak
terkenan cekaman garam. Osmoregulasi memungkinkan sel untuk menjaga turgor
dan proses+proses yang tergantung turgor termasuk ekspansi dan pertumbuhan
sel, membuka stomata dan fotosintesis, serta menjaga gradien potensial air yang
menguntungkan untuk air masuk ke tanaman (Rabie dan Almadini, 2005).
Akumulasi prolin paling sering dilaporkan sebagai modifikasi yang
disebabkan oleh cekaman air dan garam pada tanaman. Dalam kondisi salin,
pelindung untuk menjaga keseimbangan osmotik pada potensi air rendah (Ashraf
dan Foolad, 2007; Sannazzaro 2007). Prolin juga bertindak sebagai
cadangan energi dan nitrogen untuk digunakan selama stres garam (Goas
1982; Sharifi 2007), dilaporkan juga konsentrasi prolin lebih tinggi dalam
kedelai yang diberi mikoriza dibandingkan dengan tanaman tanpa mikoriza pada
tingkat salinitas yang berbeda (0, 50, 100, 150 dan 200 mM NaCl). Peneliti juga
mengamati bahwa pada tanaman bermikoriza, tingkat konsentrasi prolin lebih
tinggi ditemukan di dalam akar dari pada tajuk. Hal ini mungkin disebabkan
karena akar adalah bagian utama penyerapan air dan karenanya harus menjaga
keseimbangan osmotik antara sel akar yang menyerap air dan media eksternal.
Wang (2004) menyatakan bahwa akumulasi prolin pada tanaman mungkin
merupakan gejala stres dalam spesies yang kurang toleran garam dan
kontribusinya untuk penyesuaian osmotik.
&
Akumulasi betain pada tanaman yang mengalami cekaman garam
umumnya terjadi. Betain adalah senyawa amonium quartener turunan N+alkohol
amino asam. Setelah terbentuk, betain jarang dimetabolisme. Oleh karena itu,
betain dapat digunakan sebagai indikator yang efektif pada cekaman garam (Duke
1986). Betain tidak hanya osmolite seluler yang tidak beracun tetapi juga
dapat menstabilkan struktur dan aktifitas enzim dan komplek protein dan menjaga
integritas membran terhadap efek merusak dari kelebihan garam. Akumulasi
betain pada cekaman garam meningkat jika tanaman dikolonisasi oleh FMA. Hal
ini ditemukan pada tingkat salinitas tinggi di mana kandungan glisin betain pada
tanaman bermikoriza dua kali lipat lebih besar daripada tanaman yang tidak
33
1
Poliamina bebas adalah kation organik kecil yang diperlukan untuk
pertumbuhan sel eukariotik. Kation ini diperkirakan berperan penting dalam
respon tanaman pada berbagai cekaman lingkungan seperti salinitas osmolaritas
tinggi dan stres anti+oksidatif. Poliamina diduga berperan dalam regulasi
perkembangan akar pada kondisi salin (Coue'e 2004.). Dalam kondisi salin,
pool poliamina bebas akan menurun, namun inokulasi tanaman dengan FMA
meningkatkan konsentrasi poliamina bebas. Sannazzaro (2007) melaporkan
peningkatan total pool poliamina bebas pada tanaman yang
dikolonisasi oleh . Peneliti tersebut mengamati poliamina
pada berbagai individu sebagai respon terhadap salinitas dan inokulasi mikoriza
tergantung pada genotipa tanaman dan organ (akar atau tajuk). Disimpulkan
bahwa pool poliamina bisa menjadi salah satu mekanisme yang digunakan oleh
FMA untuk meningkatkan adaptasi tanaman terhadap tanah salin.
&
Beberapa penelitian melaporkan akumulasi gula terlarut untuk mengatur
potensi osmotik tumbuhan selama stres garam menurunkan potensial osmotik
pada tanaman yang merupakan mekanisme penting dalam perlindungan tanaman
terhadap stres. Kadar gula larut pada yang dikolonisasi
secara nyata meningkat dengan meningkatnya konsentrasi
NaCl (Thanna dan Nawar, 1994; Al+Garni, 2006). Porcel (2003) juga
melaporkan konsentrasi gula meningkat pada akar kedelai yang dikolonisasi oleh
.
Korelasi positif antara kadar gula dan mikoriza disebabkan efek sink
pada fungi yang mengambil gula dari jaringan tajuk. Proses+proses yang terlibat
dan senyawa karbon pada sistem akar tanaman inang. Akumulasi gula meningkat
kemungkinan disebabkan hidrolisis pati menjadi gula dalam bibit yang
diinokulasi dengan mikoriza (Finlay dan Soderstro, 1992).
Reaktif oksigen spesies seperti oksigen tunggal, anion superoksida (O2+),
hidrogen peroksida dan radikal hidroksil (OH+) adalah produk yang tidak
terhindarkan pada interaksi antara oksigen dan elektron yang bocor dari rantai
transport elektron di dalam kloroplas dan mitokondria selama metabolisme
aerobik normal (Moller, 2001). Semua reaktif oksigen spesies dapat bereaksi
dengan DNA, protein dan lipid dan jika tidak ada mekanisme perlindungan akan
dapat merusak struktur dan fungsi sel (Alguacil 2003.). Pada tanaman yang
mempunyai mekanisme perlindungan tanaman untuk menghindar dari kerusakan
oksidatif akan melibatkan molekul antioksidan dan enzim (Jiang dan Zhang,
2002; Nunez 2003). Hubungan antara kapasitas antioksidan dan toleransi
NaCl telah dibuktikan dalam beberapa jenis tumbuhan (Benavides 2000;
Nunez 2003).
Tanaman dengan konsentrasi antioksidan tinggi telah dilaporkan memiliki
ketahanan yang lebih besar terhadap kerusakan oksidatif (Jiang dan Zhang, 2002).
Antioksidan termasuk superoksida dismutase (SOD), katalase (CAT) peroksidase,
askorbat (APOX), glutathione reduktase, dehidroaskorbat, onodehidroaskorbat
reduktase), peroksidase guaiakol, glutathione teroksidasi, glutathione peroksidase,
dan enzim yang terlibat dalam siklus askorbat+glutathione (Ghorbanli , 2004;
Alguacil 2003.).
Beberapa studi menunjukkan bahwa simbiosis FMA membantu tanaman
untuk mengurangi cekaman salinitas dengan meningkatkan aktivitas enzim
35
(2004) menunjukkan peningkatan enzim antioksidatif enzim pada kedelai yang
diinokulasi dengan . Aktivitas superoksida dismutase (SOD),
peroksidase (POD) dan askorbat peroksidase meningkat pada kedelai bermikoriza
pada kondisi salin.
, & (
Cekaman salinitas dapat mempengaruhi tanaman dengan mengganggu
mekanisme fisiologisnya seperti penurunan efisiensi fotosintesis, pertukaran gas,
gangguan membran, status air, dan lain+lain . Ada bukti menunjukkan bahwa
simbiosis FMA dapat mengurangi efek seperti yang disebutkan di atas dengan
menggunakan berbagai mekanisme yang dibahas berikut ini :
.
Peningkatan salinitas menyebabkan penurunan kandungan klorofil karena
menekan enzim tertentu yang bertanggung jawab untuk sintesis pigmen
fotosintetik. Pengurangan penyerapan mineral (seperti Mg) yang diperlukan untuk
biosintesis klorofil juga mengurangi konsentrasi klorofil dalam daun (Sheng ,
2008).
Kandungan klorofil lebih tinggi pada daun tanaman bermikoriza dalam
kondisi salin telah diamati oleh berbagai penulis (Giri dan Mukerji, 2004;
Sannazzaro 2006;. Zuccarini, 2007; Colla 2008.; Sheng 2008).
Hal ini menunjukkan garam tidak mengganggu sintesis klorofil pada tanaman
bermikoriza dibandingkan tanaman tidak bermikoriza (Giri dan Mukerji, 2004).
Dengan keberadaan mikoriza, efek antagonistik penyerapan Na+ dapat
diimbangi dan ditekan oleh Mg2+ (Giri 2003). Tanaman yang diinokulasi
FMA pada cekaman garam memiliki kapasitas fotosintesis (dihitung dengan
cekaman, hal ini menunjukkan bahwa mikoriza mampu sepenuhnya
menyeimbangkan kondisi yang disebabkan cekaman (Zuccarini, 2007).
& & .
FMA yang diinokulasi tanaman inang memungkinkan tanaman untuk
mempertahankan konsentrasi elektrolit lebih tinggi dibandingkan dengan tanaman
yang tidak bermikoriza dengan mempertahankan integritas dan stabilitas
membran. Akibatnya, konduktivitas listrik pada akar mikoriza ditemukan lebih
tinggi dari pada akar yang tidak bermikoriza (Garg dan Manchdana, 2008).
Garg dan Manchdana (2008) menjelaskan bahwa akar tanaman
bermikoriza menunjukkan permeabilitas lebih tinggi dari
tanaman tidak bermikoriza pada berbagai tingkat salinitas tanah (DHL 4, 6 dan 8
dS/m). Kaya (2009) melaporkan bahwa kebocoran elektrolit dalam daun
yang diberi perlakuan NaCl dengan konsentrasi dengan 50 mM
dan 100 mM adalah 31,66 dan 42,45, sedangkan tanaman yang diinokulasi FMA
memiliki kebocoran elektrolit yang relatif lebih rendah masing+masing 26,87 dan
30,98, ini menunjukkan bahwa membran plasma pada akar tumbuhan
bermikoriza memiliki permeabilitas elektrolit yang jauh lebih rendah
dibandingkan dengan tanaman tidak mikoriza. Stabilitas membran meningkat
dikaitkan dengan peran mikoriza melalui peningkatan serapan P dan
meningkatkan produksi antioksidan (Feng 2002).
1 & 4 5
Mikoriza dapat mengubah tingkat ABA pada tanaman inang. Sannazzaro
(2007) melaporkan kandungan ABA lebih tinggi pada tanaman
dikolonisasi oleh dibandingkan tanaman yang tidak
bermikoriza. Tetapi sebaiknya Jahromi (2008) melaporkan kadar ABA
37
pada tanaman tidak bermikoriza, hal ini menunjukkan bahwa tanaman
bermikoriza sedikit mengalami cekaman dibandingkan tanaman tidak
bermikoriza sehingga akumulasi ABA berkurang. Kemungkinan pengaruh FMA
terhadap kandungan ABA berbeda dengan berbagai tanaman inang.
Tanaman pada tanah salin mengalami kekeringan fisiologis karena ion
Na dan Cl yang terikat pada air yang dibutuhkan dan ikut dimobilisasi oleh
tanaman (Fuzy 2008). Penelitian menunjukkan bahwa kolonisasi dengan
FMA dapat membantu tanaman pada keadaan ini. Banyak penulis telah
melaporkan bahwa tanaman yang diinokulasi dengan FMA mempertahankan
kadar air yang relatif lebih tinggi dibandingkan dengan tanaman yang tidak
diinokulasi (Colla, 2008; Jahromi 2008; Sheng 2008). Hal ini
difasilitasi oleh peningkatan konduktivitas hidrolik akar pada potensial air rendah
(Kapoor 2008). Meningkatnya konduktansi akar dikaitkan dengan panjang
akar dan sistem morfologi akar yang diubah oleh FMA (Dehne, 1982; Kothari
1990). Tanaman yang diberi FMA menunjukkan konduktansi stomata lebih
tinggi sehingga meningkatkan transpirasi (Jahromi 2008; Sheng
2008). Tanaman bermikoriza juga memiliki potensi osmotik lebih rendah
disebabkan akumulasi zat terlarut, sehingga menghasilkan penyesuaian osmotik
tanaman dapat ditingkatkan. Defisit kejenuhan air yang lebih rendah rendah dan
potensi turgor yang lebih tingggi pada tumbuhan bermikoriza juga meningkatkan
status air tanaman. Semua hal tersebut difasilitasi kolonisasi mikoriza sehingga
memungkinkan tanaman inang untuk menggunakan air lebih efisien yang
memungkinkan tanaman untuk mempertahankan konsentrasi karbon dioksida
yang lebih rendah antar sel sehingga meningkatkan kapasitas tukar gas dalam
, " (
Nodul yang dibentuk melalui simbiosis dengan bakteri pengikat nitrogen
sangat rentan terhadap cekaman salinitas dan simbiosis menurun karena cekaman
garam (Garg dan Manchdana, 2008). Hal ini mungkin karena penuaan nodul dini
dipicu oleh cekaman garam yang menyebabkan pembentukan pigmen hijau dari
leghaemoglobin dan kehilangan fiksasi nitrogen (Delgado 1994.).
Aplikasi FMA dapat menangkal efek salinitas yang berbahaya terhadap
bintil akar dan fiksasi nitrogen pada kacang+kacangan. Giri dan Mukerji (2004)
melaporkan pengaruh inokulasi mikoriza dalam pembentukan bintil pada
cekaman. Kolonisasi FMA pada legum dapat meningkatkan jumlah bintil (Giri
dan Mukerji, 2004; Garg dan Manchdana, 2008). Hal ini menunjukkan pengaruh
positif FMA pada simbiosis bakteri penambat nitrogen dengan leguminosa.
Tanaman bermikoriza juga memiliki aktivitas nitrogenase yang lebih tinggi.
Penelitian Garg dan Chandel (2011) menunjukkan terjadi peningkatan aktivitas
nitrogenase, jumlah nodul dan fiksasi nitrogen pada yang
dikolonisasi pada kondisi salin.
Semua parameter berkontribusi terhadap kemampuan fiksasi nitrogen yang
lebih tinggi pada tanaman bermikoriza, aktivitas nitrogenase meningkat dan
fiksasi nitrogen meningkat terkait dengan penyerapan P dan unsur mikro esensial
yang menyebabkan peningkatan pertumbuhan tanaman. Oleh karena itu
disarankan bahwa mikoriza dan simbiosis bintil sering bertindak sinergis pada
tingkat infeksi, nutrisi mineral dan pertumbuhan tanaman yang mendukung
kebutuhan untuk N dan P dan meningkatkan toleransi tanaman terhadap cekaman
salinitas (Rabie dan Almadini, 2005).
39
6 $
Lahan pasang+surut terdapat di sepanjang daerah pantai Sumatera,
Kalimantan, Irian dan pulau lainnya, terdiri dari berbagai ekosistem yang
dipengaruhi oleh pergerakan air pasang dan salinitas dengan tingkat bervariasi.
Salinitas merupakan salah satu cekaman abiotik yang sangat mempengaruhi
kuantitas dan kualitas produksi tanaman. Persoalan lahan salin yang utama
adalah tingginya kandungan Na+ dan Cl+ di medium perakaran tanaman
sehingga tekanan osmotik larutan tanah naik. Hal tersebut mengakibatkan
gangguan terhadap penyerapan air dan unsur hara yang dapat cepat
menurunkan laju pertumbuhan tanaman. Pertumbuhan akar, batang dan luas
daun berkurang karena cekaman salinitas yaitu ketidakseimbangan metabolik
yang disebabkan oleh keracunan ion, cekaman osmotik dan kekurangan hara yang
pada akhirnya akan menurunkan produksi tanaman.
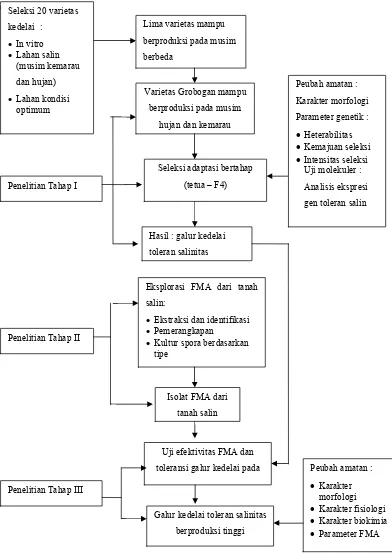
Untuk mengatasi permasalahan pada budidaya tanaman di tanah salin
termasuk budidaya kedelai ada beberapa upaya yang dapat dilakukan, diantaranya
dengan penggunaan varietas kedelai toleran salinitas. Upaya untuk mendapatkan
varietas kedelai toleran salinitas telah dimulai dengan melakukan penelitian
penapisan 20 varietas kedelai di lahan salin di Kecamatan Percut Sei Tuan (DHL
5,6 – 5,9 mmhos/m) pada musim kemarau dan musim penghujan. Hasil penelitian
menunjukkan ada lima varietas yang mampu berproduksi pada lahan salin tersebut
yaitu Grobogan, Anjasmoro, Bromo, Cikuray dan Detam 2. Kelima varietas
tersebut masing+masing berproduksi pada musim yang berbeda dan produksi
kedelai yang diperoleh masih sangat rendah baik dari segi kuantitas maupun
kualitas. Hasil penelitian ini juga sesuai dengan penelitian pendahuluan yang
kelima varietas tersebut termasuk varietas yang toleran dan agak toleran terhadap
cekaman salinitas.
Penelitian pendahuluan tersebut menunjukkan bahwa kedelai varietas
Grobogan adalah varietas yang mampu berproduksi pada musim kemarau dan
hujan, memiliki produksi tertinggi dan persentase penurunan produksi terendah
dibdaningakan empat varietas lainnya. Varietas Grobogan dianggap paling
berpotensi untuk ditingkatkan toleransinya terhadap cekaman salinitas.
Peningkatan toleransi kedelai terhadap salinitas dapat dilakukan dengan
memperbaiki potensi produksi secara genetis melalui seleksi adaptasi bertahap
sampai beberapa generasi yaitu melalui seleksi massa. Dari hasil seleksi tersebut
diharapkan diperoleh galur+galur kedelai yang toleran terhadap salinitas.
Rendahnya produksi kedelai di lahan salin diduga disebabkan berbagai
gangguan yang dialami tanaman tersebut, terutama gangguan penyerapan hara,
keracunan ion, cekaman osmotik dan gangguan oksidatif. Upaya yang dapat
dilakukan untuk membantu tanaman mengatasi berbagai cekaman yang dialami
akibat tingginya tingkat salinitas adalah melalui aplikasi asam askorbat dan
inokulasi fungi mikoriza arbuskular (FMA). Berbagai penelitian menunjukkan
respon positif tanaman kedelai yang diberi perlakuan asam askorbat eksogenous
dam inokulasi FMA untuk mengatasi berbagai gangguan yang terjadi akibat
cekaman salinitas, melalui mekanisme fisiologi dan biokimia tanaman.
Diharapkan peran FMA untuk mengatasi cekaman salinitas ini akan lebih baik
jika digunakan isolat FMA indigenous yang berasal dari lahan salin. FMA
indigenous akan lebih adaptif pada kondisi salin sehingga efektivitasnya lebih
baik. Isolasi dan identifikasi FMA indigenous akan menunjukkan potensi berbagai
tipe FMA sebagai pupuk hayati untuk meningkatkan produksi kedelai di lahan
41
Diharapkan penggunaan galur kedelai toleran salinitas yang diinokulasi
dengan FMA dan aplikasi asam askorbat dapat mengoptimalkan produksi kedelai
pada di lahan salin. Bagan alir penelitian disajikan pada Gambar 5.
0 $
1. Ada peningkatan ketahanan genotipa kedelai terhadap cekaman salinitas
melalui seleksi adaptasi bertahap.
2. Aplikasi asam askorbat dapat mengatasi stres oksidatif akibat cekaman
salinitas.
3. Terdapat isolat FMA yang efektif yang dapat dimanfaatkan untuk budidaya
kedelai pada lahan salin.
4. Terdapat peningkatan produksi genotipa kedelai toleran salinitas melalui