PENELITIAN PERTANIAN TANAMAN PANGAN VOL. 28 NO. 2 2009
Seleksi Dini Toleransi Genotipe Jagung terhadap Kekeringan
Roy Efendi1, Sudarsono2, Satriyas Ilyas2, dan Eko Sulistiono21
Balai Penelitian Tanaman Serealia Jl. Dr. Ratulangi 274, Maros, Sulawesi Selatan 2Departemen Agronomi dan Hortikultura, Faperta IPB
Kampus Dramaga, Bogor, Jawa Barat
ABSTRACT. Early Selection for Drought Tolerance in Maize Genotypes. Method of early selection is required to shorten
selection duration and to reduce the number of lines being selected. The objectives of this research were to evaluate (a) effectiveness of polyethylene glycol (PEG) 6000 to screen the maize genotypes tolerat e to drought stres s, (b) t o det ermine the ef fect ive concentration of PEG and (c) to select growth variables at germination stages as an indicator for drought tolerance. The study used fifteen maize genotypes, germinated on PEG supplemented medium, at concentrations of 0; 5; 10; 15; and 20% which were equal to 0; 0,03; 0,19; 0,41; and 0,61 MPa. Results of the experiment indicated that selective medium using 10% PEG in the germination stage was effective for differentiating among drought tolerance and sensitive maize genotypes. Tolerant genotypes produced root dry weight higher than that of the drought sensitive genotypes. Early selection method using 10% PEG and measurement of root dry weight and proline accumulation in primary root could be used to predict the degree of tolerance among maize genotypes, and had high similarity with the result of selection on the field. Similarity proportion of the tolerant genotypes was 71% while that of sensitive genotypes was 87%.
Keywords: Maize, root dry weight, selection traits, polyethylene glycol (PEG)
ABSTRAK. Metode seleksi dini diperlukan untuk mempersingkat
waktu seleksi dan mengurangi jumlah galur yang diseleksi. Penelitian bertujuan untuk (a) mengevaluasi efektivitas penggunaan larutan PEG 6000 untuk menapis toleransi genotipe jagung terhadap kekeringan, (b) menentukan konsentrasi PEG yang efektif untuk digunakan dalam seleksi, dan (c) memilih karakter seleksi sebagai indikator toleransi genotipe jagung terhadap kekeringan (pada fase perkecambahan). Sebanyak 15 genotipe jagung dikecambahkan pada media perkecambahan (kertas merang) yang diberi larutan PEG 6.000 dengan konsentrasi 0%, 5%, 10%, 15%, dan 20%, masing-masing setara dengan 0, -0,03, -0,19, -0,41 dan -0,67 MPa. Hasil penelitian menunjukkan bahwa pemberian larutan PEG 10% ke dalam media perkecambahan merupakan kondisi yang efektif untuk menyeleksi dan mengelompokkan toleransi genotipe jagung terhadap kekeringan. Genotipe toleran kekeringan memiliki karakter bobot kering akar yang lebih besar dibanding genotipe peka, baik pada kondisi kekeringan maupun optimum, sehingga dapat digunakan sebagai k arak ter s eleks i. Metode seleks i dini pada fase perkecambahan dapat dilakukan dengan menggunakan larutan PEG 10% sebagai kondisi cekaman kekeringan dan pengukuran bobot kering akar dan kandungan prolin pada akar primer kecambah. Metode tersebut mampu memprediksi toleransi genotipe jagung terhadap kekeringan dengan tingkat kesesuaian pengelompokan di lapang cukup baik. Proporsi kesesuaian genotipe toleran adalah 71,4% dan genotipe peka 87,5%.
Kata kunci: Jagung, bobot kering akar, karakter seleksi, polietilen glikol (PEG)
D
genotipe jagung terhadap cekaman kekeringanalam seleksi untuk menentukan toleransi selalu dihadapkan pada banyaknya galur yang diuji di lapang, sehingga perlu dicari suatu metode seleksi dini, salah satunya adalah pada fase perkecambahan. Seleksi dini bertujuan untuk mengurangi jumlah galur dan lamanya waktu yang dibutuhkan dalam melakukan seleksi di lapang (Longenberger 2005). Seleksi pada fase perkecambahan dapat dilakukan dengan memberikan larutan polietilena glikol (polyethylen glycol, PEG) 6000 ke dalam media tanam (Verslues et al. 2006).PEG 6000 merupakan senyawa polimer dari ethylene oxyde yang dapat digunakan untuk meniru besarnya potensial air tanah atau tingkat cekaman kekeringan. Penurunan potensial air bergantung pada konsentrasi dan bobot molekul PEG yang terlarut dalam air (Michel and Kaufman 1973; Verslues et al. 2006). Larutan PEG 6000 tidak dapat masuk ke dalam jaringan tanaman, sehingga tidak bersifat racun bagi tanaman. Keunggulan sifat tersebut memungkinkan PEG 6000 dapat digunakan sebagai alternatif metode seleksi toleransi genotipe jagung terhadap cekaman kekeringan pada fase perkecambahan dengan memberikan larutan PEG pada media perkecambahan seperti pasir atau kertas (Chazen and Newman 1994; Ogawa and Yamauchi 2006).
Beberapa hasil penelitian menunjukkan bahwa hasil seleksi pada fase perkecambahan dapat menduga kemampuan tanaman untuk beradaptasi pada kondisi cekaman kekeringan di lapang. Seleksi genotipe alfalfa (Medicago sativa L.) pada fase perkecambahan menunjukkan bahwa genotipe yang mampu ber-kecambah pada kondisi potensial air sebesar -0,67 MPa (PEG 20%) memiliki kemampuan tumbuh yang lebih baik pada kondisi cekaman kekeringan di lapang (Rumbough and Jhonson 1999). Hal yang sama juga terjadi pada seleksi toleransi genotipe jagung berdasarkan karakter akar pada fase perkecambahan yang menunjukkan genotipe jagung yang memiliki akar lebih panjang, jumlah cabang akar, dan bobot kering akar yang besar ternyata mampu tumbuh dan berproduksi lebih tinggi dibanding genotipe yang memiliki bobot akar yang lebih kecil (Bruce et al. 2002).
Strategi tanaman toleran dalam menghadapi kondisi cekaman kekeringan dimulai pada fase perkecambahan sampai pertumbuhan vegetatif dengan (a) membentuk formasi akar yang dalam dan percabangan akar yang banyak (Dubrovsky and Gomez-lomeli 2003), dan (b) mempertahankan turgor melalui peningkatan potensial osmotik sel atau menurunkan potensial air tanpa membatasi fungsi enzim dalam sel dengan cara meningkatkan akumulasi prolin pada akar primer jagung (Raymond and Smirnoff 2002; Sharp et al. 2004; Ogawa and Yamauchi 2006; Mohammadkhan dan Heidari 2008). Sharp dan Davies (1979) serta Raymond dan Smirnoff (2002) menyatakan bahwa prolin ter-akumulasi lebih dari 50% pada ujung akar primer jagung. Tujuan percobaan ini adalah untuk (a) mengevaluasi efektivitas penggunaan larutan PEG 6000 untuk menduga toleransi genotipe jagung terhadap cekaman kekeringan, (b) menentukan konsentrasi PEG yang efektif untuk diacu dalam seleksi, dan (c) menentukan karakter seleksi toleransi genotipe jagung terhadap cekaman kekeringan pada fase perkecambahan.
BAHAN DAN METODE
Percobaan dilaksanakan di Laboratorium Benih Institut Pertanian Bogor pada bulan Agustus-September 2007 dengan menggunakan rancangan acak lengkap faktorial. Faktor pertama adalah 15 genotipe jagung yang sudah diketahui toleransinya terhadap kekeringan, sedangkan faktor kedua adalah pemberian PEG 6000 dengan konsentrasi 5%, 10%, 15%, dan 20% yang masing-masing setara dengan -0,03, -0,19, -0,41 dan -0,67 MPa (Mexal et al. 1975), dan 0 PEG sebagai pembanding. Dengan demikian terdapat 75 kombinasi perlakuan dan tiap perlakuan diulang tiga kali. Pada fase per-kecambahan dilakukan tiga set pengujian.
Benih dari masing-masing genotipe dipilih ber-dasarkan ukuran dan bentuk yang seragam, kemudian dikecambahkan dengan metode uji kertas gulung dalam plastik (UKDdp). Benih jagung sebanyak 20 biji disusun di atas tiga lembar kertas merang berukuran 30 cm x 20 cm dan ditutup dengan tiga lembar kertas merang yang telah dilembabkan dengan larutan PEG sesuai dengan perlakuan. Kertas merang yang berisi benih digulung dan diinkubasi dalam germinator tipe IPB 72-1 selama 5 hari.
Pengamatan dilakukan pada saat kecambah jagung berumur 5 hari setelah tanam (HST). Pengamatan meliputi panjang akar dan tunas, bobot kering akar dan tunas, rasio bobot kering akar/tajuk, jumlah akar seminal, kandungan prolin pada akar primer, dan indeks sensitivitas cekaman kekeringan. Analisis terhadap
kandungan prolin menggunakan metode yang dikembangkan oleh Bates et al. (1973) dengan menggunakan spektrometer dan prolin murni sebagai standar. Indeks sensitivitas cekaman kekeringan (S) dihitung dengan rumus yang dikemukakan oleh Fischer dan Maurer (1978):
)
X
/
Xp
(
1
)
Y
/
Yp
(
1
S
Yp adalah rata-rata suatu genotipe yang mendapat cekaman kekeringan, Y adalah rata-rata nilai peubah suatu genotipe yang tidak mendapat cekaman kekeringan, Xp adalah rata-rata dari seluruh genotipe yang mendapat cekaman kekeringan, dan X adalah rata-rata dari seluruh genotipe yang tidak mendapat cekaman kekeringan.
Peubah yang digunakan untuk mengukur tingkat sensitivitas kekeringan adalah bobot kering akar. Kriteria untuk menentukan tingkat toleransi kekeringan adalah jika nilai S<0,5 untuk genotipe toleran, 0,5<S<1,0 untuk genotipe medium toleran, dan S>1,0 untuk genotipe peka.
Pemilihan peubah yang memiliki keragaman besar terhadap pengelompokan toleransi dan sebagai karakter seleksi genotipe jagung terhadap cekaman kekeringan dilakukan setelah melalui Analisis Komponen Utama (AKU) dan Diskriminan.
HASIL DAN PEMBAHASAN
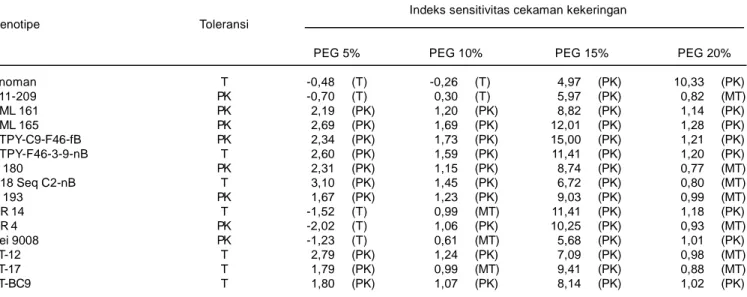
Pendugaan toleransi genotipe jagung terhadap ke-keringan dengan menggunakan larutan PEG sebagai metode seleksi dapat dilakukan jika dapat me-ngelompokkan genotipe jagung yang toleran dan peka kekeringan. Berdasarkan nilai indeks sensitivitas cekaman kekeringan (ISK) yang dihitung berdasarkan peubah bobot kering akar kecambah diketahui bahwa perlakuan PEG 10% pada media perkecambahan merupakan kondisi cekaman kekeringan yang dapat mengelompokkan genotipe toleran, medium toleran, dan peka kekeringan. Hal ini menunjukkan bahwa perlakuan pemberian larutan PEG 10% ke dalam media perkecambahan merupakan kondisi yang efektif untuk menyeleksi toleransi genotipe jagung terhadap kekeringan pada fase perkecambahan, sedangkan pada konsentrasi PEG 15% dan 20% merupakan kondisi tingkat cekaman kekeringan yang berat, sehingga pengelompokan toleransi genotipe jagung hanya menjadi 1-2 kelompok, yaitu genotipe peka dan medium toleran (Tabel 1). Kondisi tersebut tidak efektif digunakan sebagai lingkungan cekaman kekeringan pada fase perkecambahan.
Seleksi genotipe jagung yang efektif pada kondisi kekeringan dapat membedakan genotipe toleran dan peka kekeringan, sehingga dapat diketahui karakter morfologi dan fisiologi yang terkait dengan kemampuan tanaman beradapatsi pada kondisi kekeringan. Hasil analisis diskriminan menunjukkan bahwa dengan mengukur bobot kering akar, kandungan prolin pada akar, rasio bobot kering akar/tunas, jumlah akar seminal, panjang akar, bobot kering tunas, dan panjang tunas pada kondisi cekaman PEG 10% dapat diseleksi toleransi
genotipe jagung terhadap kekeringan, dengan kesesuaian hasil seleksi di lapang 87,5% untuk genotipe peka dan 85,7% untuk genotipe toleran (Tabel 2). Beberapa dari peubah tersebut menunjukkan bahwa bobot kering akar memiliki peranan yang paling besar dalam pengelompokan toleransi genotipe jagung terhadap kekeringan. Kesesuaian pengelompokan toleransi kekeringan dengan hanya mengukur bobot kering akar cukup baik, yaitu 87,5% untuk genotipe peka dan 71,4% untuk genotipe toleran dengan hasil
Tabel 1. Indeks sensitivitas kekeringan (ISK) yang dihitung menggunakan bobot kering akar jagung pada kondisi cekaman PEG 6.000.
Indeks sensitivitas cekaman kekeringan Genotipe Toleransi
PEG 5% PEG 10% PEG 15% PEG 20% Anoman T -0,48 (T) -0,26 (T) 4,97 (PK) 10,33 (PK) B11-209 PK -0,70 (T) 0,30 (T) 5,97 (PK) 0,82 (MT) CML 161 PK 2,19 (PK) 1,20 (PK) 8,82 (PK) 1,14 (PK) CML 165 PK 2,69 (PK) 1,69 (PK) 12,01 (PK) 1,28 (PK) DTPY-C9-F46-fB PK 2,34 (PK) 1,73 (PK) 15,00 (PK) 1,21 (PK) DTPY-F46-3-9-nB T 2,60 (PK) 1,59 (PK) 11,41 (PK) 1,20 (PK) G 180 PK 2,31 (PK) 1,15 (PK) 8,74 (PK) 0,77 (MT) G18 Seq C2-nB T 3,10 (PK) 1,45 (PK) 6,72 (PK) 0,80 (MT) G 193 PK 1,67 (PK) 1,23 (PK) 9,03 (PK) 0,99 (MT) MR 14 T -1,52 (T) 0,99 (MT) 11,41 (PK) 1,18 (PK) MR 4 PK -2,02 (T) 1,06 (PK) 10,25 (PK) 0,93 (MT) Nei 9008 PK -1,23 (T) 0,61 (MT) 5,68 (PK) 1,01 (PK) PT-12 T 2,79 (PK) 1,24 (PK) 7,09 (PK) 0,98 (MT) PT-17 T 1,79 (PK) 0,99 (MT) 9,41 (PK) 0,88 (MT) PT-BC9 T 1,80 (PK) 1,07 (PK) 8,14 (PK) 1,02 (PK) Genotipe jagung dikelompokkan sebagai toleran (T) jika nilai ISK <0,5, medium toleran (MT) jika 0,5<ISK<1,0 dan peka (PK) kekeringan jika ISK>1,0.
Tabel 2. Penyaringan peubah-peubah pada fase perkecambahan untuk mengelompokkan genotipe jagung yang peka dan toleran kekeringan berdasarkan analisis diskriminan.
No Persamaan fungsi diskriminan linier *Peluang kesesuaian pengelompokan peka dan toleran (%) 1 P = -183,08 -20,92 X1 + 0,00 X2 + 232,69 X3 + 48,53 X4 + 9,66 X5 + 17,23 X6 - 16,33 X7 87,5 T = -188,77 - 20,76 X1 + 0,01 X2 + 226,40 X3 + 50,73 X4 + 10,16 X5 + 17,27 X6 - 17,29 X7 85,7 2 P = -162,98 - 16,86 X1 - 0,01 X2 + 201,54 X3 + 35,23 X4 + 9,40 X5 + 10,82 X6 75,0 T = -166,25 -16,46 X1 - 0,00 X2 + 193,43 X3 + 36,64 X4 + 9,89 X5 + 10,48 X6 71,4 3 P = -63,38 - 4,09 X1 - 0,01 X2 + 15,48 X3 + 25,53 X4 + 9,07 X5 75,0 T = -72,71 - 4,09 X1 - 0,00 X2 + 13,12 X3 + 27,25 X4 + 9,57 X5 57,1 4 P = -6,06 - 0,53 X1 + 0,01 X2 + 6,03 X3 + 4,96 X4 75,0 T = -8,89 - 0,33 X1+ 0,02 X2 + 3,14 X3 + 5,54 X4 71,4 5 P = -3,37 + 0,08 X1 - 0,001 X2 + 8,29 X3 62,5 T = -5,54 + 0,35 X1 + 0,002 X2 + 5,67 X3 71,4 6 P = -2,34 + 0,36 X1 + 0,005 X2 87,5 T = -5,06 + 0,54 X1 + 0,006 X2 71,4 7 P = -2,21 + 0,43 X1 87,5 T = -4,83 + 0,64 X1 71,4
P= peka, T = toleran, X1 = bobot kering akar, X2 = kandungan prolin pada akar, X3 = rasio bobot kering akar/tunas, X4 = jumlah akar seminal, X5 = panjang akar, X6 = bobot kering tunas, X7 = panjang tunas,
pengelompokan seleksi di lapang (Tabel 2). Hal tersebut menunjukkan bahwa bobot kering akar merupakan karakter utama untuk seleksi genotipe jagung toleran kekeringan pada fase perkecambahan.
Hasil analisis menunjukkan komponen utama pertama memiliki proporsi keragaman sebesar 46,2% dan peubah bobot kering akar serta kandungan prolin pada akar primer memiliki nilai koefisien yang paling besar terhadap keragaman toleransi genotipe jagung terhadap kekeringan, masing-masing 0,97 dan 0,79. Hal ini menunjukkan bahwa bobot kering akar dan kan-dungan prolin akar primer merupakan karakter morfologi dan fisiologi yang berperan terhadap kemampuan genotipe jagung untuk beradapatsi pada kondisi kekeringan (Tabel 3), sehingga dapat digunakan sebagai karakter seleksi genotipe jagung pada kondisi kekeringan pada fase perkecambahan. Metode seleksi toleransi genotipe jagung pada fase perkecambahan dengan menggunakan larutan PEG 10% (potensial air -0,41 Mpa) pada fase perkecambahan dan mengukur bobot kering akar dan kandungan prolin pada akar primer kecambah jagung merupakan metode seleksi yang cukup baik untuk mengelompokkan genotipe peka dan toleran kekeringan. Kesesuaian hasil seleksi metode tersebut dengan hasil seleksi di lapang adalah 87,5% untuk genotipe peka dan 71,4% untuk genotipe toleran kekeringan (Tabel 2).
Keunggulan seleksi pada kondisi terkendali seperti di laboratorium dapat mengurangi pengaruh lingkungan di luar faktor yang diinginkan dan tingkat cekaman kekeringan dapat diatur sesuai kebutuhan, namun hasil seleksi tidak selalu berkorelasi dengan penampilan genotipe atau hasil seleksi di lapang. Hal ini juga dapat dilihat pada Tabel 4, di mana terdapat kesalahan
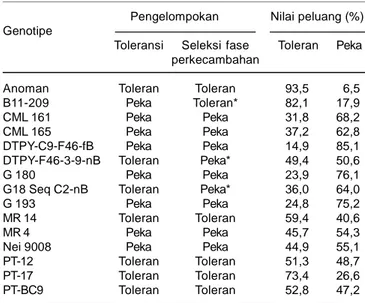
pendugaan toleransi kekeringan pada genotipe B11-209 yang peka menjadi toleran, dan genotipe DTPY-F46-3-9-nB dan G18 Seq C2-DTPY-F46-3-9-nB yang toleran menjadi peka kekeringan.
Konsistensi toleransi suatu genotipe terhadap cekaman kekeringan dengan menggunakan peluang > 75% untuk genotipe yang konsisten toleran atau peka kekeringan ternyata genotipe Anoman merupakan genotipe konsisten toleran dan genotipe DTPY-C9-F46-fB, G 180 dan G 193 konsisten peka, sedangkan peluang 50-70% untuk genotipe kurang konsisten terdapat pada CML 161, CML 165, MR 14, MR 4, Nei 9008, PT-12, PT-17, dan PT-BC9 (Tabel 4). Genotipe yang tidak konsisten sebaiknya diuji lebih lanjut untuk memastikan tingkat toleransinya terhadap kekeringan.
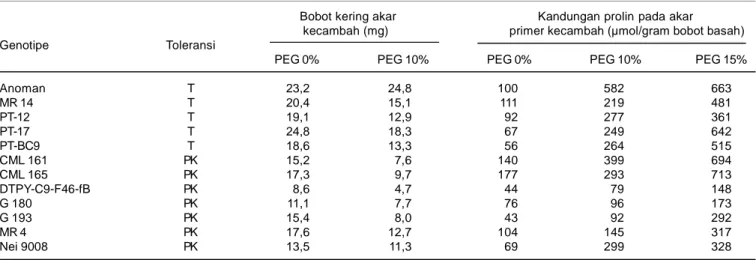
Genotipe Anoman yang toleran kekeringan pada kondisi cekaman PEG 10% meningkat bobot kering akarnya (Tabel 5). Kemampuan tersebut merupakan bentuk adaptasi tanaman terhadap kondisi cekaman kekeringan di mana pertumbuhan akar yang intensif akan memberi peluang yang lebih besar untuk absorbsi air pada lapisan tanah yang lebih dalam. Menurut Matsura et al. (1996) serta Wu dan Cosgrove (2000) terdapat keterkaitan yang positif antara bobot kering akar yang besar dengan kemampuan genotipe sorgum dan millet untuk beradaptasi pada kondisi kekeringan.
Bobot kering akar dan kandungan prolin akar primer kecambah merupakan karakter konstitutif dan adaptif. Karakter konstitutif merupakan karakter yang
ter-Tabel 3. Nilai komponen utama beberapa peubah saat fase perkecambahan pada kondisi cekaman PEG 10%.
Komponen utama Peubah
1 2 3 4
Bobot kering akar 0,97* 0,04 0,13 0,11 Panjang akar 0,57 0,16 -0,74 0,29 Jumlah akar seminal 0,69 -0,14 0,67 0,07 Bobot kering tunas 0,55 -0,78 -0,22 0,01 Panjang tunas 0,39 -0,89 -0,01 -0,13 Rasio bobot kering akar/tunas 0,72 0,61 0,25 0,07 Prolin pada akar primer 0,79* 0,43 -0,30 -0,44 Akar cirri 3,23 2,00 1,22 0,32 Proporsi keragaman (%) 46,18 28,54 17,39 4,56 Kumulatif keragaman (%) 46,18 74,72 92,11 96,67 * Peubah yang besar pengaruhnya terhadap keragaman untuk
pengelompokan toleransi genotipe jagung terhadap cekaman kekeringan pada komponen 1
Tabel 4. Nilai peluang pengelompokan toleransi genotipe jagung terhadap kekeringan berdasarkan analisis diskriminan pada fase perkecambahan.
Pengelompokan Nilai peluang (%) Genotipe
Toleransi Seleksi fase Toleran Peka perkecambahan
Anoman Toleran Toleran 93,5 6,5 B11-209 Peka Toleran* 82,1 17,9 CML 161 Peka Peka 31,8 68,2 CML 165 Peka Peka 37,2 62,8 DTPY-C9-F46-fB Peka Peka 14,9 85,1 DTPY-F46-3-9-nB Toleran Peka* 49,4 50,6 G 180 Peka Peka 23,9 76,1 G18 Seq C2-nB Toleran Peka* 36,0 64,0 G 193 Peka Peka 24,8 75,2 MR 14 Toleran Toleran 59,4 40,6 MR 4 Peka Peka 45,7 54,3 Nei 9008 Peka Peka 44,9 55,1 PT-12 Toleran Toleran 51,3 48,7 PT-17 Toleran Toleran 73,4 26,6 PT-BC9 Toleran Toleran 52,8 47,2 * Tidak sesuai dengan pengelompokan toleran kekeringan di
ekspresi tanpa pengaruh kekeringan, seperti bobot kering akar, sedangkan karakter adaptasi adalah karakter yang terekspresi sebagai respons terhadap cekaman, yaitu kandungan prolin pada jaringan tanaman (Blum 2002).
Tabel 5 menunjukkan bahwa bobot kering akar genotipe toleran lebih tinggi dibanding genotipe peka, baik pada kondisi optimum maupun cekaman kekeringan. Pada kondisi PEG 0% (optimum), genotipe toleran seperti Anoman, MR 14, 17, 12, dan PT-BC9 memiliki bobot kering akar yang lebih besar, berkisar antara 18,6-24,8 mg, sedangkan genotipe peka seperti CML 161, CML 165, DTPY-C9-F46-fB, G 180, G 193, dan Nei 9008 hanya memiliki bobot kering akar 8,6-17,6 mg. Pada kondisi cekaman PEG 10%, genotipe toleran juga memiliki bobot kering akar yang lebih tinggi, berkisar antara 12,9-24,8 mg, sedangkan genotipe peka hanya 4,7-12,7 mg. Bobot kering akar genotipe toleran lebih tinggi dibanding genotipe peka pada kondisi optimum. Hal ini berimplikasi terhadap metode seleksi tanaman toleran kekeringan, di mana karakter bobot kering akar dapat diseleksi pada lingkungan optimum (Blum 2002). Pada Tabel 5 ditunjukkan bobot kering akar genotipe toleran lebih tinggi dibanding genotipe peka, namun akumulasi prolin pada akar primer jagung tidak selalu lebih tinggi dibanding genotipe peka. Hal ini menunjukkan bahwa karakter bobot kering akar secara kuantitatif lebih besar peranannya dalam toleransi terhadap kekeringan dibanding karakater adaptasi, seperti kemampuan mengakumulasi prolin pada jaringan tanaman yang berperan penting dalam mengatur tekanan osmotik sel.
KESIMPULAN
Metode seleksi cekaman kekeringan dengan pemberian larutan PEG 10% ke dalam media perkecambahan merupakan kondisi yang efektif untuk menyeleksi dan mengelompokkan genotipe jagung yang toleran dan peka kekeringan. Pengukuran bobot kering akar dan kandungan prolin pada akar primer kecambah pada kondisi cekaman PEG 10% mampu memprediksi toleransi genotipe jagung terhadap kekeringan dengan tingkat kesesuaian hasil seleksi di lapang cukup baik, yaitu 71,4% untuk genotipe toleran dan 87,5% untuk genotipe peka.
Genotipe jagung toleran kekeringan memiliki bobot kering akar kecambah yang lebih tinggi dibanding genotipe peka, baik pada kondisi kekeringan maupun optimum. Namun akumulasi kandungan prolin pada akar primer tidak selalu lebih tinggi dibanding genotipe peka.
DAFTAR PUSTAKA
Bates L.S., R.P. Waldren, and I.D. Teare. 1973. Rapid determination of free proline for water-stress studies. Plant and Soil (39):205-207.
Blum, A. 2002. Drought tolerance is it a complex trait? Field screening for drought tolerance in crop plants with emphasis on rice. p. 17-22. In N.P. Saxena and J.C. O’Toole (eds.). Field screening for drought tolerance in crop plants with emphasis on rice. Int. Workshop on Field Screening for Drought Tolerance in Rice, Patancheru, India. 11-14 Dec. 2000. ICRISAT, Patancheru, India, and the Rockefeller Foundation, New York.
Bruce, W.B., G.O. Edmeades, and T.C. Barker. 2002. Molecular and physiological approaches to maize improvement for drought tolerance. J. of Experimental Botany 53(366):13-25.
Tabel 5. Bobot kering akar dan kandungan prolin akar primer kecambah jagung pada kondisi optimum dan cekaman PEG.
Bobot kering akar Kandungan prolin pada akar
kecambah (mg) primer kecambah (µmol/gram bobot basah)
Genotipe Toleransi
PEG 0% PEG 10% PEG 0% PEG 10% PEG 15%
Anoman T 23,2 24,8 100 582 663 MR 14 T 20,4 15,1 111 219 481 PT-12 T 19,1 12,9 92 277 361 PT-17 T 24,8 18,3 67 249 642 PT-BC9 T 18,6 13,3 56 264 515 CML 161 PK 15,2 7,6 140 399 694 CML 165 PK 17,3 9,7 177 293 713 DTPY-C9-F46-fB PK 8,6 4,7 44 79 148 G 180 PK 11,1 7,7 76 96 173 G 193 PK 15,4 8,0 43 92 292 MR 4 PK 17,6 12,7 104 145 317 Nei 9008 PK 13,5 11,3 69 299 328
Chazen, O. and P.M. Newman. 1994. Hydraulic signal from roots and rapid cell wall hardening in growing maize (Zea Mays
L.) leaves are primar y responses to polyethylene glycol-induced water deficits. Plant Physiol.104:1385-1392. Dubrovsky, J.G. and L.F. Gomez-lomeli. 2003. Water deficit
accelerates determinate developmental program of the primary root and does not affect lateral root initiation in a sonorant desert cactus (Pachycereus pringlei, cactaceae). American J. Botany (90):823-831.
Fischer, R.A. and R. Maurer. 1978. Drought resistance in spring wheat cultivar: I. Grain yield response. Aust. J. Agric. Res. (29): 897-912.
Longenberger, P.S. 2005. Development of a screening method for drought tolerance in cotton seedlings. [Thesis]. The Pennsylvania State University.
Matsura, A., S. Inanaga, and Y. Sugimoto. 1996. Mechanism of interspecific differences among four graminaceous crops in growth response to soil drying. Japanese J. of Crop Science. (65):352-360.
Mexal, J., J.T. Fisher, J. Osteryoung, and C.P. Patrick. 1975. Oxygen availability in polyethylene glycol solutions and its implications in plant-water relations. Plant Physiol. (55):20-24.
Michel, B.E. and M.R. Kaufman. 1973. The osmotic potential of polyethylene glycol 6000. Plant Physiol. 57:914-916.
Mohammadkhan, N. and R. Heidari. 2008. drought-induced accumulation of soluble sugars and proline in two maize varieties. World Applied Sci. J. (3):448-453.
Ogawa, A. and A. Yamauchi. 2006. Root osmotic adjustment osmotic stress in maize seedling, 1.Transient change of growth and water relation in roots in response to osmotic stress. Plant Prod. Sci. 9(1):27-38.
Raymond M.J. and N. Smirnoff. 2002. Proline metabolism and transport in maize seedling at low water potential. Annals of Botany 89:813-823.
Rumbough, M.D. and D.A. Jhonson. 1999. Screening alfalfa germplasm for seedilng drought resistance. Crop Sci. 21:709-713.
Sharp, R.E., V. Poroyko, G. Lindsey, Hejlek, G. William, Spollen, K. Gordon, Springer, H.J. Bohnert, and H.T. Nguyen. 2004. Root growth maintenance during water deficits: physiology to functional genomics. J. Exper. Botany 55:407, 2343-2351. Sharp, R.E. and W.J. Davies. 1979. Solute regulation and growth by
roots and shoots of water-stressed maize plants. Planta147: 43-49.
Verslues, P.E., M. Agarwal, K.S. Agarwal, and J. Zhu. 2006. Methods and concepts in quantifying resistance to drought, salt and freezing, abiotic stresses that affect plant water status. The Plant Journal 45:523-539.
Wu, Y. and D.J. Cosgrove. 2000. Adaptation of root to low water potentials by changes in cell wall extensibility and cell wall proteins.J. Exper. Botany (51):1543-1553.