35 BAB IV
HASIL DAN PEMBAHASAN
A. Karakterisasi Morfologi Bakteri Resisten Logam Krom
Karakterisasi morfologi bakteri resisten logam krom diketahui dengan melakukan beberapa pengamatan, diantaranya pengamatan morfologi, pewarnaan Gram dan endospora, uji biokimiawi, serta identifikasi isolat bakteri. Pengamatan morfologi yang dilakukan meliputi warna koloni, bentuk koloni bakteri, tepian koloni, elevasi (kenaikan permukaan koloni), kenampakan koloni, dan kepekatan koloni. Hasil pengamatan morfologi koloni menunjukkan bahwa ke 12 isolat bakteri resisten logam krom memiliki karakteristik yang berbeda. Perbedaan tersebut dapat dilihat pada Tabel 4.1.
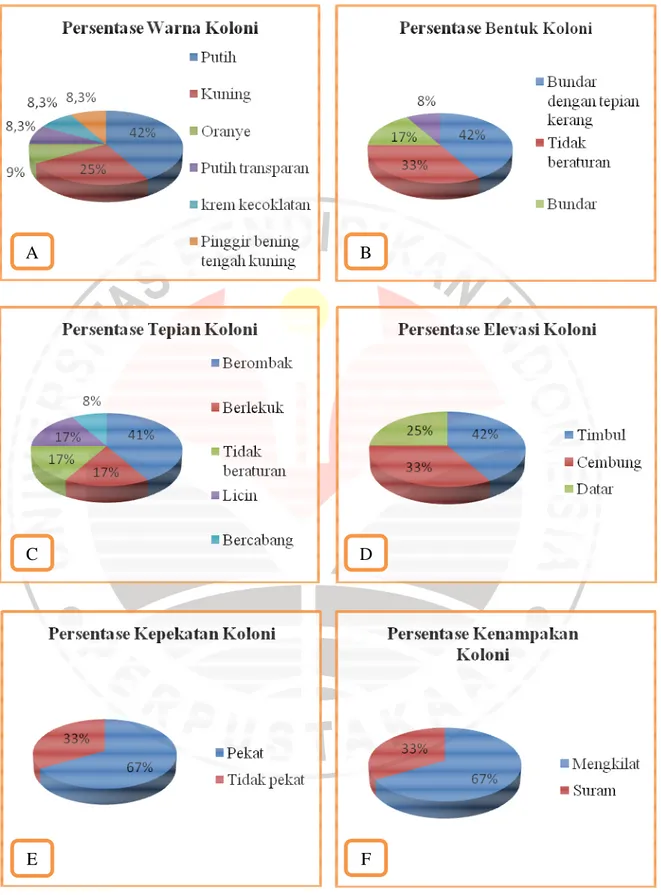
Pengamatan morfologi dimulai dengan pengamatan warna koloni isolat. Warna koloni ke 12 isolat bakteri resisten logam krom cukup bervariasi. Warna isolat bakteri yang ditemukan berdasarkan persentase jumlah terbanyak secara berurutan terdiri dari warna putih sebanyak 42%, warna kuning 25%, kemudian oranye 8,3%, krem kecoklatan 8,3%, pinggir bening tengah kuning 8,3%, dan putih transparan sebanyak 8,3%. Persentase warna koloni dapat dilihat pada Gambar 4.1. Perbedaan warna koloni ini terjadi karena pigmen intraseluler yang dihasilkan oleh bakteri (Cappuccino & Sherman, 2005).
Dua belas koloni bakteri resisten logam krom yang ditemukan yaitu berbentuk bundar dengan tepian kerang sebanyak 42% pada isolat bakteri Pt2, Pt3, Pt4, Kn1, dan Kn2, tidak beraturan 33% pada isolat Pt6, Kr, Bn1 dan Kc1,
bundar 17% pada isolat Pt5 dan Kn3, dan berbenang-benang sebanyak 8% pada isolat Bn1. Koloni berbentuk bundar dengan tepian kerang mendominasi diantara bentuk yang lainnya. Persentase bentuk koloni dapat dilihat pada Gambar 4.1.
Menurut Cappuccino & Sherman (2005), tepian koloni yang terlihat pada cawan agar dapat berupa tepian licin, tak beraturan, berbenang, bergerigi dan berombak, sedangkan yang telihat pada 12 koloni bakteri resisten logam krom terdapat lima jenis tepian koloni yang ditemukan yaitu, berombak, berlekuk, tidak beraturan, licin, dan bercabang dengan nilai persentase masing-masing secara berurutan yaitu, 41%, 17%, 17%, 17%, dan 8%. Kenampakan koloni bakteri didominasi oleh kenampakan koloni yang mengkilat dengan presentase 67% sedangkan kenampakan koloni yang suram hanya 33%. Elevasi (kenaikan permukaan) koloni juga merupakan salah satu karakteristik dari koloni bakteri. Terdapat tiga jenis elevasi koloni bakteri yang ditemukan, yaitu timbul sebanyak 42%, cembung 33% dan datar sebanyak 25%. Persentase tepian, kenampakan, dan elevasi koloni bakteri resisten logam krom dapat dilihat pada Gambar 4.1, sedangkan keragaman bentuk, warna, tepian, kenampakan dan kepekatan 12 koloni bakteri resisten logam krom dapat dilihat pada Gambar 4.2.
Keberadaan isolat bakteri yang memiliki keragaman warna koloni seperti yang telah dipaparkan di atas sesuai dengan yang dikemukakan oleh Raja et al. (2009), bahwa bakteri resisten logam krom memiliki warna koloni kuning, putih dan cokelat muda, sedangkan Basu et al. (1997) menyebutkan warna koloni bakteri resisten logam krom terdiri dari kuning, putih agak bening dan putih krem.
35
No Isolat Warna Bentuk Tepian Elevasi Kenampakan Kepekatan
1. Pt1 Putih Berbenang-benang Bercabang Timbul Mengkilat Pekat
2. Pt2 Putih Bundar dengan tepian
kerang Berlekuk Timbul Suram Pekat
3. Pt3 Putih Bundar dengan tepian
kerang Berombak Timbul Mengkilat Pekat
4. Pt4 Putih Bundar dengan tepian
kerang Tidak Beraturan Datar Mengkilat Tidak pekat 5. Pt5 Pinggir bening tengah
kuning Bundar Licin Cembung Mengkilat Tidak Pekat
6. Pt6 Putih Tidak beraturan Tidak Beraturan Datar Suram Tidak pekat
7. Kn1 Kuning Bundar dengan tepian
kerang Berombak Cembung Mengkilat Pekat
8. Kn2 Kuning Bundar dengan tepian
kerang Berombak Cembung Mengkilat Pekat
9. Kn3 Kuning Bundar Licin Cembung Mengkilat Pekat
10. Kr Oranye Tidak beraturan Berombak Timbul Suram Pekat
11. Bn1 Putih transparan Tidak beraturan Berlekuk Datar Suram Tidak pekat
12. Kc1 Krem kecoklatan Tidak beraturan Berombak Timbul Mengkilat Pekat
Gambar 4.1 Persentase Warna Koloni (A), Persentase Bentuk Koloni (B), Persentase Tepian Koloni (C), Persentase Elevasi Koloni (D), Persentase Kepekatan Koloni (E), Persentase Kenampakan Koloni (F)
B
D
E F
C A
Gambar 4.2 Keragaman Bentuk, Warna, Tepian, Kenampakan dan Kepekatan 12 Koloni Bakteri Resisten Logam Krom
B. Karakterisasi Bakteri Resisten Logam Krom Berdasarkan Pewarnaan Gram dan Keberadaan Endospora
1. Pewarnaan Gram
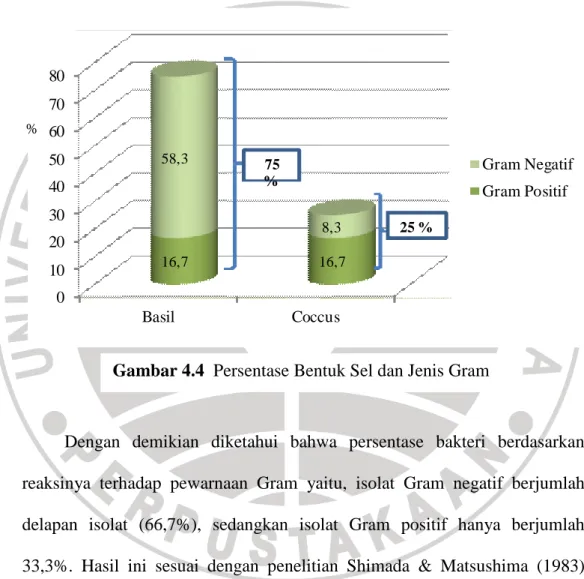
Selain pengamatan morfologi koloni bakteri, diamati pula bentuk sel dan jenis Gram dari isolat bakteri resisten logam krom. Setelah dilakukan pembiakan kultur murni selama 24-48 jam, kemudian dilakukan pewarnaan Gram. Hasil pewarnaan menunjukkan bahwa isolat bakteri memiliki dua jenis bentuk sel, yaitu bentuk batang (basil) dan bulat (coccus). Bentuk sel bakteri yang mendominasi yaitu bentuk batang (basil) sebanyak 75% dengan jumlah Gram positif dua isolat (16,7%) dan Gram negatif tujuh isolat (58,3%),
Pt5 Pt6 Kr Kn3 Kn2 Kn1 Kc1 Bn1 Pt1 Pt2 Pt3 Pt4
(+) Isolat Pt1 streptobasil (+) Isolat Pt2 streptobasil (-) Isolat Pt3 diplobasil (-) Isolat Pt4 Diplobasil (-) Isolat Pt5 diplobasil (-) Isolat Pt6 diplobasil (+) Isolat Kn1 staphylococcus (+) Isolat Kn2 staphylococcus (-) Isolat Kn3 diplococcus (-) Isolat Kr Diplobasil (-) Isolat Bn1 diplobasil (-) Isolat Kc1 diplobasil
Gambar 4.3 Hasil Pewarnaan Gram 12 Isolat Bakteri Resisten Logam Krom, Umur Kultur 24-48 Jam pada Perbesaran 1000X
Keterangan :
0 10 20 30 40 50 60 70 80 Basil Coccus 16,7 16,7 58,3 8,3 Gram Negatif Gram Positif 75 % 25 %
sedangkan isolat bakteri berbentuk sel bulat (coccus) hanya memiliki persentase 25% dengan jumlah Gram positif dua isolat (16,7%) dan Gram negatif satu isolat (8,3%). Hasil pewarnaan dapat dilihat pada Gambar 4.3, sedangkan persentase bentuk sel dan jenis Gram dapat dilihat pada Gambar 4.4.
Dengan demikian diketahui bahwa persentase bakteri berdasarkan reaksinya terhadap pewarnaan Gram yaitu, isolat Gram negatif berjumlah delapan isolat (66,7%), sedangkan isolat Gram positif hanya berjumlah 33,3%. Hasil ini sesuai dengan penelitian Shimada & Matsushima (1983) juga Raja et al. (2009) bahwa bakteri resisten krom berjenis Gram negatif dengan bentuk sel basil, sedangkan penelitian yang telah dilakukan Basu et al. (1997) menyatakan bahwa bakteri resisten logam krom dapat pula berjenis Gram positif dengan bentuk sel bulat (coccus) yang berpasangan dan batang
Gambar 4.4 Persentase Bentuk Sel dan Jenis Gram %
(basil) berpasangan maupun basil pendek. Persentase banyaknya Gram negatif terkait dengan keberadaan lipopolisakarida (LPS) yang terdapat pada membran luar sel bakteri Gram negatif dan merupakan bentuk pertahanan bakteri Gram negatif terhadap stres lingkungan, seperti limbah penyamakan kulit yang mengandung logam krom. LPS terdiri dari dearah O-antigen, Core (Outer core dan inner core), dan daerah hidrofobik yang diketahui sebagai lipid A dan terdiri dari glukosamin dan fosfolipid (Raetz & Whitfield, 2002).
LPS diduga akan berikatan dengan logam yang dianggap toksik oleh bakteri tersebut (Langley & Beveridge, 1999). Hal inilah yang mungkin menyebabkan persentase banyaknya bakteri Gram negatif lebih dominan daripada bakteri Gram positif dalam limbah penyamakan kulit yang mengandung logam krom tersebut, meskipun demikian hasil identifikasi menunjukkan terdapatnya bakteri Gram positif dalam limbah penyamakan kulit. Keadaan ini dapat disebabkan karena adanya bakteri-bakteri Gram positif yang mampu menyesuaikan diri terhadap lingkungan yang ekstrim seperti Bacillus sp. dan Staphylococcus sp. (Tabel 4.3). Bacillus diketahui sebagai bakteri yang paling kuat terhadap cekaman lingkungan karena mampu membentuk endospora (Pelczar & Chan, 2006), sedangkan pada beberapa jenis Staphylococcus sp. diketahui dapat memiliki kapsul polisakarida yang setara fungsinya dengan LPS pada bakteri Gram negatif (Lammler et al., tanpa tahun).
2. Pewarnaan Endospora
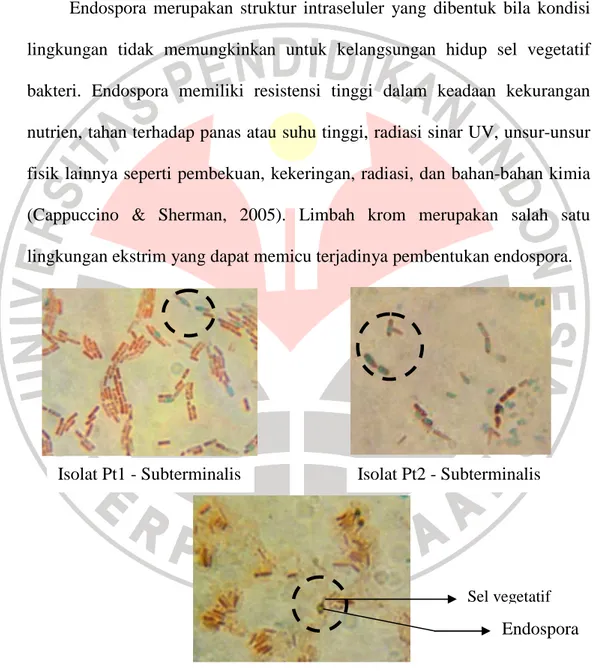
Hasil pewarnaan endospora hanya terlihat pada tiga isolat dengan letak endospora terminalis pada isolat Bn1 dan subterminalis pada isolat Pt1 dan Pt2. Foto hasil pewarnaan endospora dapat dilihat pada Gambar 4.5.
Endospora merupakan struktur intraseluler yang dibentuk bila kondisi lingkungan tidak memungkinkan untuk kelangsungan hidup sel vegetatif bakteri. Endospora memiliki resistensi tinggi dalam keadaan kekurangan nutrien, tahan terhadap panas atau suhu tinggi, radiasi sinar UV, unsur-unsur fisik lainnya seperti pembekuan, kekeringan, radiasi, dan bahan-bahan kimia (Cappuccino & Sherman, 2005). Limbah krom merupakan salah satu lingkungan ekstrim yang dapat memicu terjadinya pembentukan endospora.
Gambar 4.5 Hasil Pewarnaan Endospora dan Letak Endospora pada Tiga Isolat Bakteri Resisten Logam Krom, Umur Kultur 24-48 Jam pada Perbesaran 1000X Isolat Pt1 - Subterminalis Isolat Bn1 - Terminalis Isolat Pt2 - Subterminalis Sel vegetatif Endospora
C. Uji Biokimiawi
Uji aktivitas biokimia ini dilakukan untuk mengetahui karakteristik yang dimiliki oleh 12 isolat bakteri resisten krom yang telah diisolasi Tahapan uji biokimia ini sangat mempengaruhi dalam membedakan spesies yang ditemukan. Adapun uji biokimia yang dilakukan terdiri dari uji biokimia yang berhubungan dengan eksoenzim, yaitu hidrolisis pati, hidrolisis kasein, hidrolisis lipid, hidrolisis gelatin. Sedangkan uji biokimia yang berhubungan dengan endoenzim, yaitu uji katalase, fermentasi karbohidrat (dekstrosa, sukrosa, dan laktosa), reduksi nitrat, IMVIC (Indol, Methyl-red, Voges-Proskauer, dan Sitrat), uji urease, produksi H2S, dan motilitas (Cappuccino & Sherman, 2005). Hasil uji aktivitas
biokimia 12 Isolat bakteri resisten logam krom dipaparkan sebagai berikut.
1. Uji Hidrolisis (Pati, Kasein, Lipid, Gelatin) a. Hidrolisis Pati
Berdasarkan pengamatan yang telah dilakukan, terdapat satu isolat yang bereaksi positif terhadap uji hidrolisis pati yaitu isolat Kr. Sedangkan Kesebelas isolat lainnya yaitu Isolat Pt1, Pt2, Pt3, Pt4, Pt5, Pt6, Kn1, Kn2, Kn3, Bn1, dan Kc1 menunjukkan hasil negatif yang mengindikasikan bahwa kesebelas isolat tersebut tidak mampu menghidrolisis pati. Perwakilan foto hasil uji hidrolisis pati dapat dilihat pada Gambar 4.6.
Reaksi positif ditandai dengan adanya zona bening di sekitar koloni bakteri setelah ditetesi dengan larutan iodium (Cappuccino & Sherman, 2005). Artinya isolat bekteri tersebut dapat menghidrolisis pati menjadi
Gambar 4.6 Hasil Uji Hidrolisis Pati pada Medium Agar Pati A. Negatif (Isolat Pt6), B. Positif (Isolat Kr)
dekstrin dengan adanya enzim amilase. Enzim amilase bekerja menghidrolisis molekul besar seperti pati (amilum) dengan bantuan air menjadi molekul yang lebih sederhana sehingga molekul yang lebih sederhana tersebut dapat masuk ke dalam sel. Zona bening tersebut tampak sangat jelas karena medium di sekitar koloni telah terpecah menjadi bentuk yang lebih sederhana yaitu dekstrin. Hasil penelitian Raja et al. (2009) mengenai bakteri resisten krom menyatakan bahwa terdapat dua isolat dari empat isolat yang memiliki enzim amilase, sedangkan penelitian bakteri resisten krom lainnya yang dilakukan oleh Shimada & Matsushima (1983) menyatakan hasil yang berbeda, yakni negatif untuk untuk hidrolisis pati oleh bakteri resisten krom.
b. Hidrolisis Kasein
Berdasarkan pengamatan yang telah dilakukan, terdapat tujuh isolat bakteri yang bereaksi positif terhadap uji hidrolisis kasein yaitu isolat Pt1, Pt3, Pt4, Pt6, Kn1, Kn2, Kn3, sedangkan kelima isolat lainnya yaitu Isolat
A B
Zona Bening
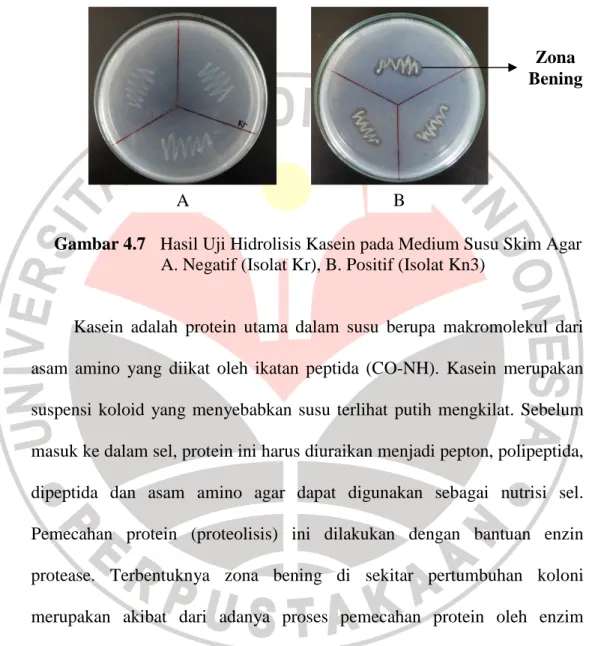
Pt2, Pt5, Kr, Bn1 dan Kc1 menunjukkan hasil negatif yang mengindikasikan bahwa kesebelas isolat tersebut tidak mampu menghidrolisis kasein. Perwakilan foto hasil uji hidrolisis kasein dapat dilihat pada Gambar 4.7.
Gambar 4.7 Hasil Uji Hidrolisis Kasein pada Medium Susu Skim Agar A. Negatif (Isolat Kr), B. Positif (Isolat Kn3)
Kasein adalah protein utama dalam susu berupa makromolekul dari asam amino yang diikat oleh ikatan peptida (CO-NH). Kasein merupakan suspensi koloid yang menyebabkan susu terlihat putih mengkilat. Sebelum masuk ke dalam sel, protein ini harus diuraikan menjadi pepton, polipeptida, dipeptida dan asam amino agar dapat digunakan sebagai nutrisi sel. Pemecahan protein (proteolisis) ini dilakukan dengan bantuan enzin protease. Terbentuknya zona bening di sekitar pertumbuhan koloni merupakan akibat dari adanya proses pemecahan protein oleh enzim protease yang dihasilkan bakteri tersebut (Cappuccino & Sherman, 2005).
c. Hidrolisis Lipid
Berdasarkan pengamatan yang telah dilakukan, terdapat sembilan isolat yang bereaksi positif terhadap uji hidrolisis lipid yaitu isolat Pt3, Pt4,
A B
Zona Bening
Pt5, Pt6, Kn1, Kn2, Kn3, Kr dan Kc1. Sedangkan tiga isolat lainnya yaitu Isolat Pt1, Pt2, dan Bn1 menunjukkan hasil negatif yang mengindikasikan bahwa ketiga isolat tersebut tidak mampu menghidrolisis lipid. Perwakilan foto hasil uji hidrolisis lipid dapat dilihat pada Gambar 4.8.
Gambar 4.8 Hasil Uji Hidrolisis Lipid pada Medium Agar Lipid A. Positif (Isolat Kr), B. Negatif (isolat Bn1)
Reaksi positif ditandai dengan terbentuknya warna merah dan merah muda (pink) pada koloni dan daerah di sekitar koloni. Warna merah tersebut terjadi karena isolat bakteri dapat menghidrolisis lipid pada medium agar lipid dengan indikator neutral red, sehingga mengakibatkan terbentuknya asam lemak dan menyebabkan pH medium menurun.
Lipid (trigliserida) dihidrolisis menjadi asam lemak dan gliserol dengan adanya bantuan enzim lipase. Isolat yang bereaksi positif terhadap uji hidrolisis lipid dapat diartikan bahwa isolat tersebut memiliki enzim lipase (Cappuccino & Sherman, 2005).
d. Hidrolisis Gelatin
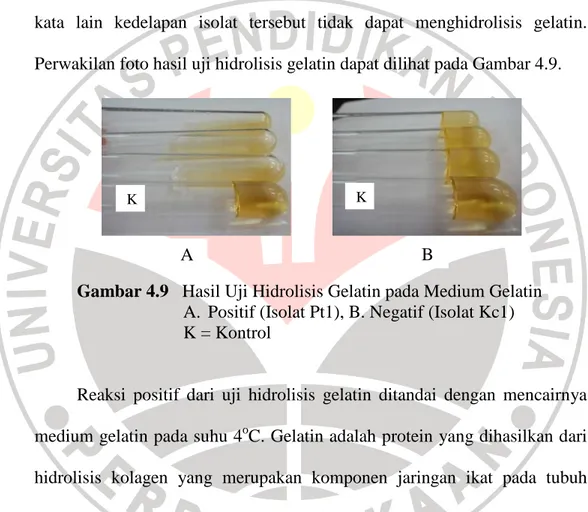
Berdasarkan pengamatan yang telah dilakukan, terdapat empat isolat yang bereaksi positif terhadap uji hidrolisis gelatin yaitu Pt1, Pt2, Pt4, Pt6, sedangkan delapan isolat lainnya yaitu isolat Pt3, Pt5, Kn1, Kn2, Kn3, Bn1, Kr, dan Kc1 menunjukkan reaksi negatif terhadap uji hidrolisis atau dengan kata lain kedelapan isolat tersebut tidak dapat menghidrolisis gelatin. Perwakilan foto hasil uji hidrolisis gelatin dapat dilihat pada Gambar 4.9.
Gambar 4.9 Hasil Uji Hidrolisis Gelatin pada Medium Gelatin A. Positif (Isolat Pt1), B. Negatif (Isolat Kc1) K = Kontrol
Reaksi positif dari uji hidrolisis gelatin ditandai dengan mencairnya medium gelatin pada suhu 4oC. Gelatin adalah protein yang dihasilkan dari hidrolisis kolagen yang merupakan komponen jaringan ikat pada tubuh manusia dan hewan, Gelatin merupakan protein yang belum sempurna karena tidak adanya asam amino triptophan. Ciri yang lainnya dari gelatin yaitu gelatin akan membeku/padat pada suhu kurang dari 25oC, Sebaliknya akan mencair pada suhu di atas 25oC (Cappuccino & Sherman, 2005).
Mencairnya medium gelatin setelah diinkubasi pada suhu 37oC dan disimpan pada suhu 4oC menunjukkan bahwa bakteri tersebut dapat
A B
menghasilkan eksoenzim gelatinase dan memecah gelatin menjadi molekul yang lebih sederhana yaitu asam amino. Isolat bakteri yang dapat menghidrolisis gelatin menunjukkan bahwa isolat tersebut menggunakan asam amino hasil hidrolisis gelatin sebagai sumber energinya dengan bantuan enzim gelatinase tersebut.
2. Uji Motilitas
Berdasarkan pengamatan yang telah dilakukan, terdapat sembilan isolat yang menunjukkan hasil positif yaitu, Pt1, Pt2, Pt3, Pt4, Pt5, Pt6, Kc1, Bn1 dan Kr sedangkan tiga isolat lainnya menunjukkan hasil negatif terhadap uji motilitas. Uji motilitas positif ditandai dengan adanya pertumbuhan koloni bakteri yang meluas dari daerah tusukan (inokulasi) dan diikuti dengan perubahan warna medium menjadi keruh. Perwakilan foto hasil uji motilitas pada medium Sulfide Indol Motily (SIM) agar dapat dilihat pada Gambar 4.10.
Gambar 4.10 Hasil Uji Motilitas pada Medium SIM Agar A & B Positif (Isolat Bn1 dan Kr)
C. Negatif (Isolat Kn3)
Beberapa bakteri bersifat “motil” artinya dapat melakukan pergerakan. Pergerakan pada bakteri didukung dengan adanya struktur yang menyerupai
benang panjang yang disebut flagelum yang tumbuh dalam membran sel (Pelczar & Chan, 2006). Studi yang telah dilakukan oleh Abskharon et al. (2009) dan Raja et al. (2009) pun menyatakan bahwa bakteri resisten krom umumnya bersifat motil.
3. Uji Produksi H2S
Berdasarkan hasil pengamatan terdapat tiga isolat bakteri yang menunjukkan hasil positif uji H2S, yaitu isolat Pt3, Pt4, Pt6, sedangkan
sembilan isolat bakteri lainnya menunjukkan hasil negatif. Reaksi positf dari uji ini adalah adanya perubahan warna medium dari kuning menjadi hitam atau kehitaman. Perwakilan foto hasil uji produksi H2S pada medium Sulfide Indol
Motily (SIM) agar dapat dilihat pada Gambar 4.11.
Gambar 4.11 Hasil Uji Produksi H2S dalam Medium SIM Agar
A.Negatif (Isolat Bn1), B. Positif (Isolat Pt3)
Gas H2S dihasilkan oleh reduksi senyawa sulfur anorganik seperti
thiosulfat (S2O32-). Medium yang mengandung thiosulfat akan dirubah menjadi
sulfit oleh enzim reduktase dengan melepaskan H2S.
3 S2O32- + 4 H+ 2SO32- + 2 H2S
A B
Medium Berwarna Kehitaman
H2S yang dilepaskan akan berikatan dengan Fe3+ yang berasal dari
ferrous ammonium sulfat pada medium SIM agar akan berikatan membentuk endapan ferrous hitam yang tidak dapat dipecahkan, endapan ini terlihat disepanjang tusukan atau inokulasi dan menunjukkan reaksi positif. Sebaliknya jika tidak terjadi perubahan apapun pada media, maka menunjukkan reaksi negatif (Cappuccino & Sherman, 2005). Studi bakteri resisten krom yang telah dilakukan Shimada & Matsushima (1983) menyatakan bahwa bakteri resisten krom mampu menghasilkan H2S.
4. Uji Reduksi Nitrat
Berdasarkan pengamatan yang telah dilakukan, terdapat 50% atau enam isolat yang bereaksi positif terhadap uji nitrat, yaitu Pt1, Pt2, Pt3, Pt4, Pt6 dan Bn1, sedangkan enam isolat lainnya yaitu isolat Pt5, Kr, Kc1, Kn1, Kn2 dan Kn3 menunjukkan hasil negatif. Reaksi positif dari uji ini ditandai dengan terjadinya perubahan warna medium menjadi merah bata. Perwakilan foto hasil uji reduksi nitrat dapat dilihat pada Gambar 4.12.
Gambar 4.12 Hasil Uji Reduksi Nitrat dalam Medium Kaldu Nitrat A & B Positif (Isolat Pt2 & Pt4), C. Negatif (Isolat Kn1)
Nitrat adalah senyawa yang sangat potensial untuk menggantikan peran oksigen sebagai akseptor hidrogen final selama pembentukan energi. (Cappuccino & Sherman, 2005). Penelitian mengenai bakteri resisten krom yang telah dilakukan oleh Abskharon et al. (2009) pun menunjukkan hasil positif terhadap uji nitrat. Berikut ini merupakan reaksi oksidasi senyawa nitrat menjadi nitrit oleh enzim nitrat reduktase.
Nitrat reduktase
NO3- + 2 H+ + e- NO2- + H2O
(nitrat) Hidrogen (nitrit) elektron
5. Uji Katalase
Reaksi positif dari uji katalase ini ditandai dengan terbentuknya gelembung-gelembung oksigen pada permukaan koloni setelah ditetesi dengan H2O2 3%. Seluruh isolat menunjukkan reaksi katalase positif. Perwakilan foto
hasil uji katalase dapat dilihat pada Gambar 4.13.
Gambar 4.13 Hasil Positif Uji Katalase pada Medium Nutrient Agar
Uji katalase yang dilakukan pada cawan Petri bertujuan untuk mengetahui kemampuan mikroorganisme dalam menghasilkan enzim katalase
Gelembung-Gelembung Oksigen
atau peroksidase yang dapat menguraikan H2O2 menjadi air dan oksigen.
Hidrogen peroksida ini dihasilkan oleh mikroorganisme aerobik, fakultatif aerobik dan mikroaerofilik yang menggunakan jalur respirasi aerobik, yaitu oksigen bertindak sebagai akseptor elektron selama proses penguraian karbohidrat untuk menghasilkan energi. Akumulasi peroksida pada mikroorganisme dapat menyebabkan kematian pada mikroorganisme tersebut karena tidak adanya enzim yang dapat menguraikannya.
Reaksi positif dari uji katalase ini ditandai dengan terbentuknya gelembung-gelembung oksigen di permukaan koloni setelah ditetesi dengan H2O2 3%. Terbentuknya gelembung-gelembung oksigen tersebut
mengindikasikan adanya reaksi penguraian hidrogen peroksida oleh enzim katalase yang dihasilkan oleh mikroorganisme (Cappuccino & Sherman, 2005). Hasil positif pada uji katalase ini sesuai dengan penelitian bakteri resisten krom yang telah dilakukan Shimada & Matsushima (1983).
6. Uji Urease
Berdasarkan pengamatan yang dilakukan terdapat satu isolat bakteri yaitu Kn3 yang menunjukkan hasil positif, sedangkan sebelas isolat bakteri lainnya yaitu Pt1, Pt2, Pt3, Pt4, Pt5, Pt6, Kn1, Kn2, Kr, Bn1, dan Kc1 menunjukkan reaksi negatif. Reaksi positif ditandai dengan perubahan medium menjadi merah muda (sangat merah muda). Perwakilan foto hasil uji urease dapat dilihat pada Gambar 4.14.
Perubahan warna dapat terjadi saat enzim urease memutus ikatan karbon dan nitrogen untuk membentuk amoniak. Adanya amoniak menyebabkan suasana medium menjadi alkali/basa sehingga indikator phenol red akan berubah menjadi merah muda pada medium, hal ini mengindikasikan terjadinya reaksi positif atau dihasilkannya urease (Cappuccino & Sherman, 2005).
Gambar 4.14 Hasil Uji Urease dalam Medium Urea Broth A.Negatif (Isolat Pt4), B. Positif (Isolat Kn3)
Studi bakteri resisten krom yang telah dilakukan Shimada & Matsushima (1983) serta Abskharon (2009) menyatakan bahwa sebagian besar bakteri resisten krom tidak memiliki enzim urease yang dapat mengubah urea menjadi amoniak.
Berikut ini merupakan reaksi hidrolisis urea menjadi amoniak yang dikatalisis oleh urease.
NH2 NH2 Enzim urease C + 2 H2O CO2 + H2O + 2 NH3 O
Urea Air Amoniak
7. Uji IMVIC (Indol, Methyl Red, Voges Proskauer & Sitrat)
Uji IMVIC merupakan uji mendasar yang digunakan untuk membedakan grup Enterobacteriaceae. Berikut ini hasil dari masing-masing uji.
a. Uji Indol
Berdasarkan hasil pengamatan seluruh isolat menunjukkan hasil negatif terhadap uji indol. Reaksi positif ditandai dengan terbentuknya cincin merah pada permukaan medium, sedangkan reaksi negatif ditandai dengan terbentuknya cincin kuning. Perwakilan foto hasil uji Indol dapat dilihat pada Gambar 4.15.
Gambar 4.15 Hasil Negatif Uji Indol dalam Medium Tryptone Broth
Menurut Cappuccino & Sherman (2005), tryptophan merupakan asam amino esensial yang dapat mengalami oksidasi melalui proses enzimatis pada beberapa bakteri dengan bantuan enzim tryptophanase. Adanya indol dapat dideteksi dengan menggunakan reagen Kovac’s yang akan membentuk lapisan atau cincin merah pada permukaan medium. Warna tersebut terbentuk karena indol yang berada dalam medium diekstrak ke dalam lapisan reagent oleh komponen asam butanol dan membentuk kompleks dengan p-dimethylaminobenzaldehid. Ada tidaknya
indol yang diproduksi oleh bakteri resisten krom dapat menunjukkan hasil yang bervariasi. Penelitian yang dilakukan oleh Raja et al. (2009) menunjukkan hanya satu dari empat isolat yang mampu menghasilkan indol sedangkan penelitian Abskharon (2009), Shimada & Matsushima (1983) menunjukkan hasil positif terhadap seluruh isolat bakteri yang diuji.
b. Uji Methyl Red (MR)
Berdasarkan hasil pengamatan terdapat dua isolat yang menunjukkan reaksi positif terhadap uji methyl red ini, yaitu isolat Pt1 dan Pt2. Reaksi positif ditandai dengan berubahnya warna medium menjadi merah, sedangkan bila medium tetap berwarna kuning maka reaksi negatif. Perwakilan foto hasil uji methyl red dapat dilihat pada Gambar 4.16.
Gambar 4.16 Hasil Uji Methyl Red dalam Medium MR-VP Broth A. Positif (Isolat Pt2), B. Negatif (Isolat Pt4)
Tujuan dilakukannya uji methyl red adalah untuk mengetahui kemampuan mikroorganisme yang mampu memproduksi asam organik hasil metabolisme glukosa. Jumlah asam (H2) dideteksi oleh indikator
methyl red (Cappuccino & Sherman, 2005). Kemampuan bakteri dalam memproduksi asam organik tentunya sangat bervariasi, hasil positif uji Methyl Red ini dikemukakan oleh Abskharon (2009) pada penelitiannya mengenai bakteri resisten krom, sedangkan Shimada & Matsushima (1983) menunjukkan hasil negatif pada isolat bakteri yang diuji. Penelitian lain yang dilakukan oleh Raja et al. (2009) menunjukkan hanya dua dari empat isolat yang mampu memproduksi asam organik.
c. Uji Voges-Proskauer (VP)
Berdasarkan hasil pengamatan terdapat empat isolat yang bereaksi positif terhadap uji Voges-Proskauer, yaitu isolat Pt1, Pt2, Kn2, Bn1. Reaksi positif ditandai dengan berubahnya warna medium menjadi merah mawar, sedangkan bila medium tetap berwarna kuning maka reaksi negatif. Perwakilan foto hasil uji Voges-Proskauer dapat dilihat pada Gambar 4.17.
Gambar 4.17 Hasil Uji Voges-Proskauer dalam Medium MR-VP Broth A.Positif (Isolat Pt1), B. Negatif (Isolat Kn1)
Uji ini dilakukan untuk mengetahui kemampuan mikroorganisme dalam memproduksi hasil metabolisme glukosa yang tidak bersifat asam
(produk akhir yang netral) seperti aseton (acetylmethylcarbinol).
Reagen Barritt’s yang digunakan mengandung alfa naftol dan akan berikatan dengan aseton (acetylmethylcarbinol) yang kemudian akan dioksidasi oleh reagen KOH 40% menjadi senyawa diasetil. Adanya guanidin dari pepton dalam medium MR-VP broth akan berikatan dengan diasetil menyebabkan terbentuknya kompleks merah muda pada medium, ini menunjukkan reaksi positif. Reaksi negatif terjadi jika medium tidak mengalami perubahan warna (Cappuccino & Sherman, 2005). Hasil negatif pada pengujian Voges-Proskauer ditemukan pada penelitian Raja et al. (2009) dan Abskharon et al. (2009), sedangkan penelitian Shimada & Matsushima (1983) menunjukkan hasil positif pada pengujian Voges-Proskauer.
d. Uji Sitrat
Berdasarkan hasil pengamatan terdapat lima isolat bakteri yang menunjukkan hasil positif terhadap uji sitrat, yaitu isolat Pt1, Pt2, Kr, Bn1 dan Kc1. Reaksi positif ditandai dengan berubahnya warna medium menjadi biru tua, sedangkan bila medium tetap berwarna hijau maka reaksi dikatakan negatif. Perwakilan foto hasil uji sitrat dapat dilihat pada Gambar 4.18.
Tidak adanya glukosa atau laktosa untuk difermentasikan, beberapa mikroorganisme mampu menggunakan sitrat (6C) sebagai sumber carbon untuk energinya.
Gambar 4.18 Hasil Uji Sitrat dalam Medium Simmon’s Sitrat A. Positif (Isolat Kc1), B. Negatif (Isolat Pt5)
Sitrat merupakan salah satu komponen utama dalam siklus krebs yang merupakan hasil reaksi antara asetil koenzim A (CoA) dengan asam oksaloasetat (4C). Sitrat dibuat oleh enzim sitrase yang menghasilkan asam oksaloasetat dan asetat kemudian melalui proses enzimatis diubah menjadi asam piruvat dan karbon dioksida. Selama reaksi tersebut medium menjadi bersifat alkali (basa) karena karbondioksida yang berikatan dengan sodium (Na) dan air (H2O) membentuk membentuk sodium carbonat (Na2CO3).
Adanya sodium karbonat inilah yang akan mengubah indikator bromthymol blue pada medium menyebabkan medium berubah warna dari hijau menjadi biru tua (biru prusia) (Cappuccino & Sherman, 2005). Penggunaan sitrat oleh bakteri sebagai sumber karbon dimungkinkan erat kaitannya dengan proses reduksi krom. Penelitian yang telah dilakukan oleh Zaman (Tanpa Tahun) mengenai reduksi Cr6+ oleh Bacillus coagulans, menyatakan bahwa salah satu sumber karbon yang yang digunakan sebagai elektron donor untuk reduksi Cr6+ yaitu sitrat. Reduksi sitrat berperan penting dalam pembentukan formasi NADH karena NADH dan NADPH yang telah
dihasilkan melalui proses metabolisme terlibat sebagai donor elektron dalam proses reduksi Cr6+.
8. Fermentasi Karbohidrat (Dekstrosa, Sukrosa, dan Laktosa)
Uji Fermentasi karbohidrat dilakukan dengan menggunakan tiga jenis karbohidrat tertentu sebagai substrat untuk mengetahui kemampuan fermentasi isolat bakteri yang diuji. Karbohidrat tersebut yaitu, sukrosa, laktosa dan dekstrosa. Selama proses inkubasi, karbohidrat yang difermentasi akan menghasilkan asam yang menyebabkan indikator brom cressol purple (bcp) berubah dari warna ungu menjadi kuning dan dapat pula diikuti dengan pembentukan gas dalam tabung durham (reaksi positif), bila tidak terjadi perubahan warna medium maka reaksi negatif.
Berdasarkan hasil pengamatan terdapat tujuh isolat yang dapat memfermentasi dekstrosa, yaitu isolat Pt1, Pt2, Kn1, Kn2, Kn3, dan isolat Bn1, sedangkan enam isolat lainnya menunjukkan hasil negatif. Perwakilan foto hasil uji fermentasi dekstrosa dapat dilihat pada Gambar 4.19.
Gambar 4.19 Hasil Uji Fermentasi Dekstrosa pada Medium Kaldu Dextrosa A. Positif (Isolat Pt1), B. Negatif (Isolat Pt4)
Uji Fermentasi karbohidrat berikutnya yaitu sukrosa. Berdasarkan hasil pengamatan terdapat enam isolat yang dapat memfermentasi sukrosa, yaitu isolat Pt4, Pt6, Kn1, Kn2, Kn3, dan Bn1, sedangkan enam isolat lainnya menunjukkan hasil negatif. Perwakilan foto hasil uji fermentasi sukrosa dapat dilihat pada Gambar 4.20.
Uji Fermentasi karbohidrat yang lainnya yaitu laktosa. Berdasarkan hasil pengamatan yang telah dilakukan seluruh isolat bakteri menunjukkan hasil negatif terhadap uji fermentasi laktosa. Hal itu dibuktikan dengan tidak berubahnya warna ungu pada medium. Perwakilan foto hasil uji fermentasi laktosa dapat dilihat pada Gambar 4.21.
Gambar 4.20 Hasil Uji Fermentasi Sukrosa pada Medium Kaldu Sukrosa A.Positif (Isolat Bn1), B. Negatif (Isolat Pt5)
Gambar 4.21 Hasil Negatif Uji Fermentasi Laktosa pada Medium Kaldu
Laktosa
Substrat seperti alkohol dan karbohidrat dapat mengalami disimilasi secara anaerob menghasilkan asam organik dan dapat disertai dengan pembentukan gas (Cappuccino & Sherman, 2005).
Dekstrosa atau D-glukosa merupakan monosakarida yang berperan penting sebagai nutrien utama sel dalam respirasi sel (Poedjiadi & Supriyanti, 2007). Bakteri yang dapat memfermentasikan dekstrosa tidak sedikit karena dekstrosa sudah merupakan monosakarida yang dapat langsung digunakan sebagai substrat dalam fermentasi, sedangkan sukrosa (C12H22O11) merupakan
disakarida yang terdiri atas glukosa dan fruktosa. Sukrosa juga dicerna melalui reaksi hidrolisis asam (Alamsyah, 2010). Laktosa merupakan disakarida yang tersusun atas glukosa dan galaktosa (Campbell et al., 2003). Tidak adanya isolat yang mampu memfermentasi laktosa disebabkan komposisi karbon yang ada dalam laktosa masih berbentuk kristal α sehingga sukar didegradasi oleh bakteri (Albert et al. dalam Slamet, 2009)
Walaupun demikian dekstrosa dan sukrosa mempunyai efektifitas paling rendah sebagai elektron donor jika dibandingkan dengan sitrat. Kedua substrat tersebut dikatabolis menjadi piruvat, kemudian masuk kedalam jalur fermentasi anaerob menghasilkan produk berupa asam laktat atau ethanol dan CO2 dengan
menggunakan NADH, sedangkan sitrat berada dalam siklus Kreb’s dengan
kontribusi yang besar terhadap pembentukan 6 NADH dan proses reduksi Cr6+ (Zaman, Tanpa Tahun). Kemampuan isolat bakteri dalam memfermentasi karbohidrat sangat terbatas karena beberapa alasan di atas serta disebabkan masih tersedianya sumber energi lain di lingkungannya.
D. Identifikasi Bakteri
Berdasarkan hasil karakterisasi morfologi, pewarnaan Gram dan endosprora, serta uji biokimiawi yang telah dilakukan, kemudian diidentifikasi menggunakan Bergey’s Manual of Determinative Bacteriology Ninth Edition (1994) dan Cowan and Steel's Manual for the Identification of Medical Bacteria Third Edition (1993). Berikut jenis maupun genus bakteri yang ditemukan, yaitu :
1. Bacillus sp
Isolat Pt1 dan Pt 2 mempunyai kemiripan dengan jenis Bacillus sp yang memiliki ciri-ciri, yaitu bakteri gram positif, bentuk batang (basil) dengan rangkaian sel berbentuk rantai (streptobasil) dan letak endospora subterminal. Katalase positif, motil, hidrolisis pati negatif, urease dan indol negatif, uji sitrat dan Voges-Proskauer positif, serta mampu memfermentasi glukosa. Beberapa anggota genus Bacillus dapat menghidrolisis kasein.
2. Pseudomonas sp
Isolat Pt3 mempunyai kemiripan dengan jenis Pseudomonas sp yang memiliki ciri-ciri, yaitu bakteri gram negatif, bentuk batang (basil), Kalatase positif, respirasi aerob dengan oksigen sebagai akseptor elektron terakhir, namun pada beberapa kasus nitrat dapat digunakan sebagai alternatif akseptor elektron. Sebagian besar genus Psedomonas tidak mampu menghidrolisis pati.
3. Agrobacterium sp
Isolat bakteri Pt4 dan Pt6 mempunyai kemiripan dengan jenis Agrobacterium sp yang memiliki ciri-ciri, yaitu bakteri gram negatif, bentuk
batang (basil), tidak membentuk endospora, motil, respirasi aerob, namun beberapa strains dapat bersifat anaerob jika terdapat nitrat. Koloni biasanya berbentuk konveks, bulat, tak berpigmen hinga berwarna krem terang. Uji katalase positif, tidak memfermentasi glukosa, dapat menghidrolisis kasein dan gelatin, tetapi tidak dapat menghidrolisis pati, dan dapat mengunakan nitrat sebagai sumber energi pada beberapa spesies.
4. Erwinia sp
Isolat bakteri Pt5 mempunyai kemiripan dengan jenis Erwinia sp yang memiliki ciri-ciri, yaitu bakteri gram negatif, tidak motil, bentuk bulat (diplococcus), indol negatif. Methyl red, Voges-Proskauer dan Simmon citrate negatif. Tidak menghasilkan H2S, urease negatif, tidak dapat
mereduksi nitrat. Serta dapat menghidrolisis lipid. 5. Staphylococcus sp
Isolat bakteri Kn1 mempunyai kemiripan dengan jenis Staphylococcus sp yang memiliki ciri-ciri, yaitu bakteri gram positif, berbebtuk bulat dengan rangkaian seperti anggur (staphylococcus), mampu menghidrolisis kasein karena memiliki enzim protease, uji katalase positif, Voges-Proskauer dan urease negatif, tidak memfermentasi laktosa dan sukrosa.
6. Neisseria sp
Isolat bakteri Kn3 mempunyai kemiripan dengan jenis Neisseria sp yang memiliki ciri-ciri, yaitu bakteri gram negatif, berbentuk bulat (diplococcus), tigak motil, indol negatif. Methyl red, Voges-Proskauer dan Simmon citrat
negatif. Tidak menghasilkan H2S, urease negatif, katalase positif dan tidak
dapat mereduksi nitrat. 7. Alcaligenes sp
Isolat Kr mempunyai kemiripan dengan jenis Alcaligenes sp yang memiliki ciri-ciri, yaitu bakteri gram negatif, bentuk batang (basil), Kalatase dan Simmon citrat positif, tidak membentuk endospora, motil, tidak memfermentasi glukosa dan tidak mereduksi nitrat, dapat menghidrolisis pati, tetapi tidak dapat menghidrolisis kasein dan gelatin.
8. Acinetobacter sp
Isolat Kc1 mempunyai kemiripan dengan jenis Acinetobacter sp yang memiliki ciri-ciri, yaitu bakteri gram negatif, bentuk batang (basil), tidak membentuk endospora, motil, kalatase dan Simmon citrat positif, dapat memfermentasi glukosa, uji H2S, urease, dan reduksi nitrat negatif.
9. Enterobacter sp
Isolat bakteri Bn1 mempunyai kemiripan dengan jenis Enterobacter sp yang memiliki ciri-ciri, yaitu bakteri gram negatif, bentuk batang (basil), bakteri ini mampu mereduksi nitrat, tidak dapat menghidrolisis gelatin dan kasein, dapat memfermentasi karbohidrat dengan menghasilkan asam dan gas, uji sitrat dan Voges-Proskauer positif, motil, katalase positif, urease, H2S, indol, dan Methyl-Red negatif.
Data Hasil Uji Aktivitas Biokimiawi dan Identifikasi 12 Bakteri Resisten Logam Krom dapat dilihat pada Tabel 4.2. Dari sembilan jenis bakteri resisten logam krom yang ditemukan, terdapat tujuh jenis bakteri yang juga ditemukan
pada penelitian sebelumnya. Bakteri tersebut yaitu Bacillus sp. (Camargo et al., 2003), Agrobacterium radiobacter EPS-916 (Llovera et al., 1993), Staphylococcus sp., Pseudomonas spp. (Mistry, 2010; Ezaka & Anyanwu, 2011), Alcaligenes eutrophus (Nies et al., 1990), Acinetobacter radioresistens (Raja et al., 2009), Enterobacter cloacae (Wang et al., 1990).
Pertumbuhan optimum bakteri tentunya tidak lepas dari beberapa faktor lingkungan seperti, suhu, pH dan DO.
Suhu air limbah penyamakan kulit berkisar antara 29–31oC. hal ini disebabkan oleh adanya penambahan bahan-bahan buangan dari limbah industri penyamakan kulit yang berpengaruh terhadap peningkatan suhu, seperti kapur dan H2SO4. Hal
tersebut juga telah dikemukakan oleh Rahayu, (2002) pada penelitiannya mengenai dampak limbah cair industri penyamakan kulit terhadap kualitas air di Sungai Ciwalen Sukaregang, Garut. Berdasarkan hasil pengukuran suhu, maka semua isolat bakteri resisten logam krom yang ditemukan tergolong bakteri mesofil karena ditemukan pada rentang suhu 25-40oC (Pelczar & Chan, 2006). Suhu sangat mempengaruhi laju pertumbuhan mikroorganisme serta morfologi sel melalui proses metaboliknya karena suhu dapat mempengaruhi kerja enzim yang berperan dalam proses metabolisme (Adyana, 2009).
Selain suhu, pH (potential hydrogen) juga berperan dalam pertumbuhan bakteri. Umumnya pH pertumbuhan bakteri berkisar antara pH 4-9 dengan pH optimum pertumbuhan bakteri yaitu pH 6,5-7,5. Adapun pH medium yang digunakan adalah pH 9 dan 10, pH tersebut disesuaikan dengan pH kondisi lingkungan bakteri tumbuh pada saat optimasi pH. Penggunaan pH 9 pada
Keterangan:
Iso
Uji Aktivitas Biokimiawi
Rangkaian
sel Genus/Spesies
Hidrolisis
Mot H2S R.nit Kat Ure
IMViC Fermentasi KH
P K L G Ind MR VP Sit Dex Suk Lak
Pt1 - + - + + - + + - - + + + A - - Streptoba Bacillus sp. Pt2 - - - + + - + + - - + + + A - - Streptoba Bacillus sp. Pt3 - + + - + + + + - - - - - - A - Diploba Pseudomonas sp. Pt4 - + + + + + + + - - - - - - A - Diploba Agrobacterium sp. Pt5 - - + - + - - + - - - - - - - - Diploba Erwinia sp. Pt6 - + + + + + + + - - - - - - A - Diploba Agrobacterium sp. Kn1 - + + - - - - + - - - - - A A - Staphyloco Staphylococcus sp. Kn2 - + + - - - - + - - - + - A A - Staphyloco Staphylococcus sp. Kn3 - + + - - - - + + - - - - A A - Diploco Neisseria sp. Kr + - + - + - - + - - - - + - - - Diploba Alcaligenes sp. Kc1 - - + - + - - + - - - - + A - - Diploba Acinetobacter sp. Bn1 - - - - + - + + - - - + + A A - Diploba Enterobacter sp. Iso = Isolat P = Pati K = Kasein L = Lipid G = Gelatin Mot = Motilitas
R.nit = Reduksi nitrat Kat = Katalase Ure = Urease Ind = Indol MR = Methyl-Red VP = Voges-Proskauer
Sit = Simmon’s Sitrat Dex = Dextrosa Suk = Sukrosa Lak = Laktosa A = Asam Streptoba = Streptobasil Diploba = Diplobasil Staphyloco = Staphylococcus Diploco = Diplococcus 67
medium didasarkan pada kondisi air limbah penyamakan kulit saat dilakukan uji pH. Adanya hasil buangan dari proses pengapuran pada limbah industri penyamakan kulit seperti Ca(OH)2 menyebabkan pH air limbah menjadi basa.
Pengukuran kadar oksigen terlarut (Dissoved Oxygen) pada air limbah penyamakan kulit yaitu sebesar 2,52 mg/L. Data Kualitas air (PP No.20 Tahun 1990) menyatakan bahwa untuk kegiatan perikanan diisyaratkan >3 mg/L dan untuk kegiatan pertanian ≥ 3 mg/L. Hal ini membuktikan bahwa minimnya oksigen terlarut pada limbah disebakan oleh proses respirasi organisme perairan dan oksidasi limbah. Semua makhluk hidup di air sangat tergantung pada oksigen terlarut (DO) karena sangat esensial bagi pernafasan dan merupakan salah satu komponen utama bagi metabolisme organisme perairan pada umumnya, sehingga konsentrasi DO dapat digunakan sebagai indikator mutu air (Rahayu, 2002).