KKC « K
FF 7> r
Wvv\
P
PIEPJET WOERI YUNARNIPENENTUAN NILAI EFEK ELEKTRONIK (
a P
) GUGUS
HIDROKSI DARI AMPISILIN • AMOKSISILIN DAN
SEFALEKSIN-SEFADROKSIL MELALUI PENDEKATAN SIGMA HAMMETT
FAKULTAS FAftMASI UNIVERSlTAS AIRLANGGA S U R A B A Y A
S K R I P S I
M I L IK
fERPUSTAKAAN WWITERSITAS A IR L A N O O A ' S U R A B A Y APENENTUAN NILAI EFEK ELEKTRONIK C )
GUGUS HIDROKSI DARI AMPISILIN - AMOKSISILIN DAN
SEFALEKSIN - SEFADROKSIL MELALUI PENDEKATAN SIGMA HAMMETT
SKRIPSI
DIBUAT UNTUK MEMENUHI SYARAT
MENCAPAI GELAR SARJANA SAINS PADA FAKULTAS FARMASI
UNIVERSITAS AIRLANGGA
1 9 9 5
Oleh
PIEPIET WOERI YUNARNX
059011216
disetuiui oleh .-Dembimbing
DR.Bambang Soekardio, SU.
/ Pembimbing Utama
D r s . Robby Sondakh, MS Pembimbing Serta
Ir. Hi. Rullv Susilouati, MS Pembimbing Serta
KATA PENGANTAR
Dengan segala puji syukur kepada Tuhan Yang Maha Kuasa
atas segala karunia dan rahmat-Nya sehingga penulis dapat
menyelesaikan skripsi ini. Adapun skripsi ini dibuat untuk
memenuhi persyaratan mencapai gelar sarjana Farmasi pada
Fakultas Farnasi Universitas Airlangga.
Pada kesempatan yang baik ini perkenankanlah penulis
menyampaikan terima kasih dan penghargaan yang sebesar-
besarnya kepada :
1. Bapak DR. Bambang Soekardjo, SU, Bapak Drs. Robby
Sondakh, MS dan Ibu Ir. Hj . Rully Susilowati, MS. atas
segala bimbingan, saran-saran dan bantuan yang telah
diberikan selama penelitian dan penyusunan skripsi ini.
2. Kepala Laboratorium Kimia Medisinal Fakultas Farmasi
Universitas Airlangga, beserta staf dan karyawan.
3. Ketua Jurusan Kimia Farnasi Fakultas Farnasi Universitas
Airlangga, beserta staf dan karyawan.
4. Tim penilai skripsi yang telah berkenan memeriksa skripsi
ini.
5. Orang tua, kedua kakak dan adik penulis tercinta yang
telah menbantu sehingga skripsi ini dapat terselesaikan
dengan baik.
6. Rekan-rekan mahasiswa dan semua pihak yang baik secara
skripsi ini.
Akhir kata, penulis berharap semoga hasil penelitian
ini bernanfaat bagi perkembangan ilmu kefarnasian dimasa
nrendatang, neskipun penulis menyadari skripsi ini masih jauh
dari sespurna.
Surabaya, Januari 1995
DAFTAR ISI
Halaman
KATA P E N G A N T A R ... i
DAFTAR ISI ... iii
DAFTAR TABEL ... ... vii
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xi
BAB I. PENDAHULUAN ... 1
1. Latar belakang masalah ... 1
2. Perumusan masalah ... 5
3. Tujuan penelitian ... 5
4 . Hipotesis ... ... 6
5. Manfaat penelitian ... 6
BAB II. TINJAUAN PUSTAKA ... 7
1. Tinjauan tentang hubungan antara struktur kimia dan aktivitas biologis ... 7
2. Tinjauan tentang pengaruh sifat fisika-kimia terhadap aktivitas biologis ... 8
3. Tinjauan tentang efek elektronik ... 12
3.1 Tetapan sigma (c r ) Hammett ... 13
3.2 Faktor-faktor yang mempengaruhi nilai efek elektronik ... 15
3.2.1 Pengaruh suhu terhadap nilai efek elektronik ... 15
3.2.2 Pengaruh pH terhadap nilai efek
elektronik ... 15
3.3 Pengaruh nilai efek elektronik ter hadap aktivitas biologis ... 16
4. Tinjauan tentang spektrofotometri ... 19
4.1 Tinjauan umum . ... 19
4.2 Penentuan tetapan kesetimbangan reaksi secara spektrofotometri .... 20
5. Tinjauan tentang sifat-sifat fisika- kimia dari ampisilin, amoksisilin, sefaleksin dan sefadroksil ... 24
5.1 Sifat fisika-kimia ampisilin .... 24
5.2 Sifat fisika-kimia amoksisilin ... 25
5.3 Sifat fisika-kimia sefaleksin .... 26
5.4 Sifat fisika-kimia sefadroksil ... 27
BAB III. METODE PENELITIAN ... 28
1. Bahan penelitian yang digunakan ... 28
2. Alat penelitian yang digunakan ... 28
3. Cara pengerjaan ... 29
3.1 Analisis kualitatif terhadap bahan penelitian ... 29
3.1.1 Pemeriksaan organolep.tis ... 29
3.1.2 Reaksi warna ... 29
3.1.2.1 Reaksi warna untuk ampisilin 29
3.1.2.2 Reaksi warna untuk amoksisilin 29
3.1.2.4 Reaksi warna untuk sefadroksil 30
3.1.3 Penentuan titik lebur... 31
3.2 Penentuan nilai pK ... 31
3.2.1 Pembuatan larutan dapar pada pH
yang diperlukan ... 31
3.2.2 Penentuan panjang gelombang
terpilih ... 33
3.2.3 Penentuan pK secara
spektro-fotometr i ... ... 35
3.3 Perhitungan nilai efek elektronik .... 37
3.4 Analisis data ... 38
BAB IV HASIL PENELITIAN ... 41
1. Analisis kualitatif terhadap bahan
penelitian ... ... 41
2. Penentuan nilai pK ... 42
2.1. Pembuatan larutan dapar pada pH yang
diperlukan ... 42
2.2 Ponentuan panjang gelombang terpilih 44
2.3 Penentuan nilai pK ampisilin, amoksi
silin, sefaleksin dan sefadroksil
secara spektrofotometri ... 51
2.3.1 Nilai pK ampisilin pada pH 4,20;
7,20; dan 9,20 ... 53
2.3.2 Nilai pK amoksisilin pada pH
4,00; 7,00 dan 8,00 ... 54
2.3.3 Nilai pK sefaleksin pada pH
4,50; 7,50 dan 10,50 ... 55
2.3.4 Nilai pK sefadroksil pada pH 3,30; 7,30 dan 9,30 ... 56
3. Perhitungan nilai efek elektronik (nilai sigma (o') Hammett) ... 57
3.1 Penentuan nilai sigma (o ) Hammett dari gugus hidroksi (-0H) pada posisi para dari ampisilin-amoksisilin .... 57
3.2 Penentuan nilai sigma (o’) Hammett dari gugus hidroksi(-OH) pada posisi para dari sefaleksin-sefadroksil .... 58
4. Analisis data ... 59
BAB V PEMBAHASAN ... 61
BAB VI KESIMPULAN ... tS9 BAB VII SARAN ... 70
BAB VIII RINGKASAN ... 71
DAFTAR PUSTAKA... 75
DAFTAR TABEL
Halaman
Tabel I. Hasil analisis kualitatif bahan
penelitian ... 41
Tabel II. Larutan dapar untuk ampisilin,
dengan volume 200 ml ... 42
Tabel III. Larutan dapar untuk amoksisilin
dengan volume 200 ml ... 43
Tabel IV. Larutan dapar untuk sefaleksin dengan
volume 200 ml ... 43
Tabel V. Larutan dapar untuk sefadroksil
dengan volume 200 ml ... 43
Tabel VI. Nilai serapan larutan ampisilin
konsentrasi 600 ppm pada pH 7,20 dan
dalam suasana asam (pH 4,20), suasana
basa (pH 9,20) untuk penentuan
panjang gelombang (X.) terpilih ... 45
Tabel VII. Nilai serapan l a r ut an amoksisilin
konsentrasi 207,9 ppm pada pH 7,00
dan dalam suasana asam (pH 4,00),
'suasana basa (pH 8,00) untuk
penentuan panjang gelombang (\)
terpilih ... 47
Tabel VIII. Nilai serapan larutan sefaleksin
konsentrasi 30 ppm pada pH 7,50 dan
Tabel
Tabel
Tabel
* Tabel
basa (pH 10,50) untuk penentuan
panjang gelombang (X) terpilih ... 49
IX. Nilai serapan larutan sefadroksil
konsentrasi 31,3 ppm pada pH 7,30 dan
dalam suasana asam (pH 3,30), suasana
basa (pH 9,30) untuk penen- tuan
panjang gelombang (X) terpilih ... 51
X. Serapan larutan ampisilin konsentrasi
600 ppm pada pH larutan yang terpilih
(pH 7,20) dan dalam pH 4,20 (suasana
asam ) pH 9,20 (suasana basa) pada
panjang gelombang terpilih 256 nm
untuk penentuan nilai pK ... 53
XI. Serapan larutan amoksisilin konsen
trasi 207,9 ppm pada pH larutan yang
terpilih (pH 7,00) dan dalam pH 4,00
(suasana asam), pH 6,00 (suasana
(basa) pada panjang gelombang terpilih
272 nm untuk penentuan nilai pK ... 54
XII. Serapan larutan sefaleksin konsen
trasi 30 ppm pada pH larutan yang
terpilih (pH 7,50) dan dalam pH 4,50
(suasana asam), pH 10,50 (suasana
basa) pada panjang gelombang terpilih
ix
Tabel XIII. Serapan larutan sefadroksil konsen
trasi 31,3 ppm pada pH larutan yang
terpilih (pH 7,30) dan dalam pH 3,30
(suasana asam), pH 9,30 (suasana
basa) pada panjang gelombang terpilih
262 nm untuk penentuan nilai pK .... 56
Tabel XIV. Penentuan nilai sigma (c r ) Hammett dari
gugus hidroksi (-0H) pada posisi para
dari ampisilin-amoksisilin ... 57
Tabel XV. Penentuan nilai sigma ( & ) Hammett dari
gugus hidroksi (-0H) pada posisi para
DAFTAR GAMBAR
Gambar 1. Kurva serapan dari larutan ampisilin
600 ppm dalam pH 1,20 - pH 11,20 pada
panjang gelombang terpilih 256 n m ... 46
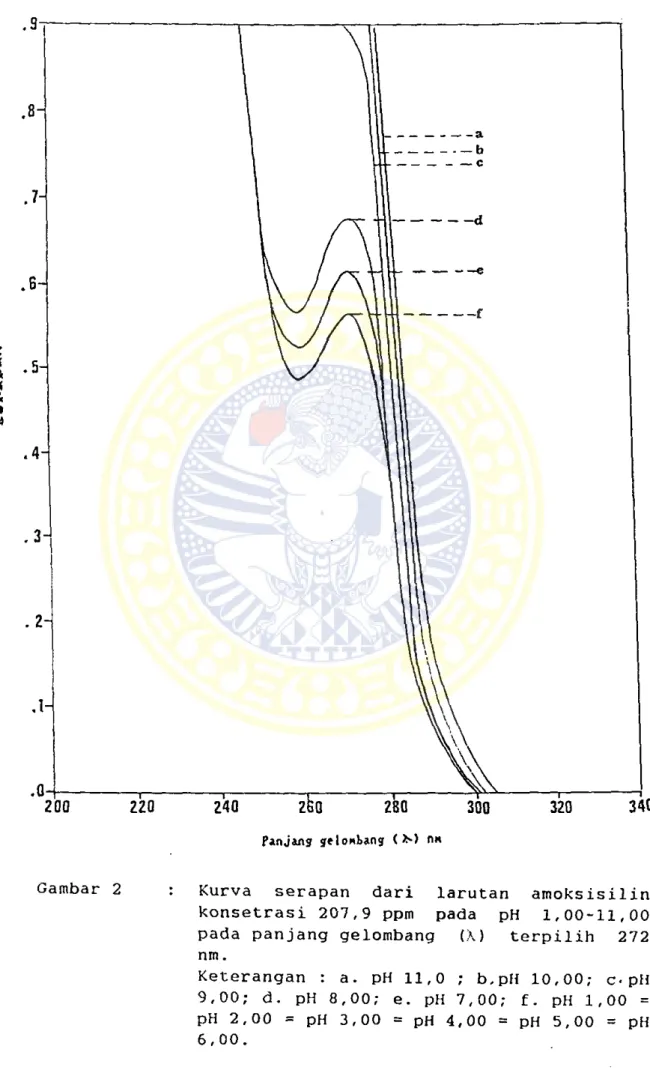
Gambar 2. Kurva serapan dari larutan amoksisilin
207,9 ppm dalam pH 1,00 - pH 11,00 pada
panjang gelombang terpilih 272 n m ... 48
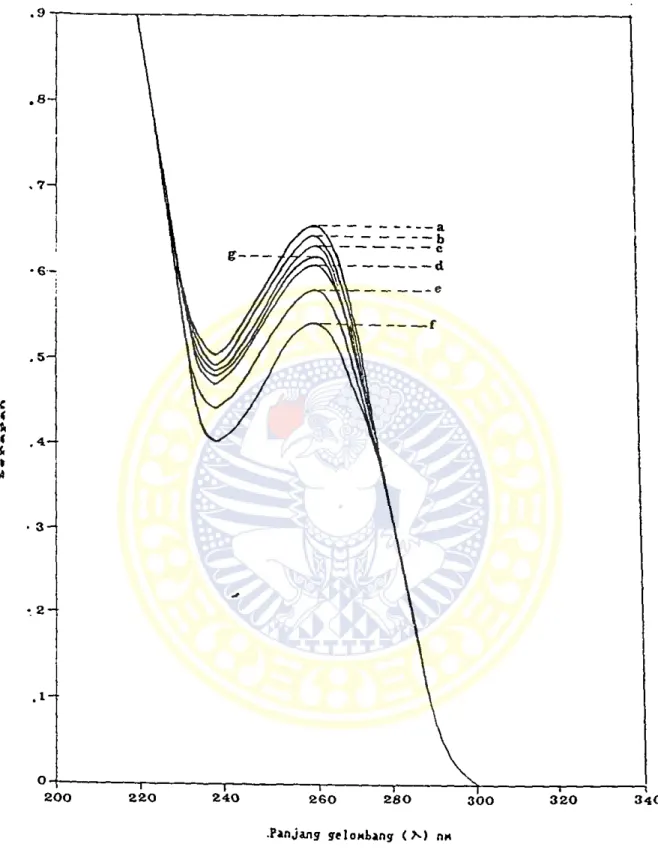
Gambar 3. Kurva serapan dari larutan sefaleksin
30 ppm dalam pH 1,50 - pH 11,50 pada
panjang gelombang terpilih 261 n m ... 50
Gambar 4. Kurva serapan dari larutan sefadroksil
31,3 ppm dalam pH 1,30 - pH 11,30 pada
panjang gelombang terpilih 262 n m ... 52
Halaman
DAFTAR LAMPIRAN Lampiran Lamp i ran Lampiran Lampiran Lampiran Lampiran 6 Lampiran Lampiran Hal
Sertif ikat analisis dari ampisi1 in
Sertif ikat analisis dari amoksisilin
Sertif ikat analisis' dari sefaleksin
Sertifikat analisis dari sefadroksil
Perhitungan standart deviasi (SD)
nilai sigma (c r ) Hammett dari gugus
hidroksi (-0H) pada posisi para dari
ampisilin-amoksisilin ...
Perhitungan standart deviasi ( S D )
nilai sigma (c r ) Hammett dari gugus
hidroksi (-0H) pada posisi para dari
sefaleksin- sefadroksil ...
Uji "t pooled dua pihak" antara
nilai sigma (c r ) Hammett dari gugus
hidroksi (-0H) pada posisi para dari
ampisilin-amoksisilin dan sefaleksin
-sefadroksil ...
Uji "t satu pihak" antara nialai
sigma (o') Hammett dari gugus
hidroksi (-0H) pada posisi para dari
ampisisilin-amoksisilin dan nilai
Lampiran 9. Uji "t satu pihak*' antara nilai
sigma (o-) Hammett dari gugus
hidroksi (-0H) pada posisi para dari
sefaleksin-sefadroksil dan nilai
sigma (o') Hammett pada tabel ... 86
Lampiran 10. Tabel nilai sigma (a) Hammett ... 87
BAB I PENDAHULUAN
1 . L a l a r B e la lca n g M a s a la h
Struktur kimia memberikan ciri-ciri sifat fisika-
kimia yang khas dari suatu senyawa, yang dapat berubah
apabila struktur senyawa tersebut mengalami perubahan.
Perubahan gugus pada senyawa induk dapat menyebabkan
perubahan dalam hal kelarutan senyawa tersebut dalam
pelarut polar atau non polar, distribusi muatan molekul
dan kekuatan elektrostatik atau dalam pengaturan ruang
gugus-gugus dalam molekul senyawa tersebut- Perubahan
gugus pada senyawa induk akhirnya dapat mengakibatkan
perubahan aktivitas biologis yang dihasilkan (1).
Aktivitas biologis dari suatu senyawa dipengaruhi
oleh sifat fisika-kimia, struktur sistem reseptor dan
letak suatu gugus dalam struktur molekul senyawa
tersebut. Berdasarkan hubungan antara struktur kimia dan
aktivitas biologis, obat-obatan dapat dibagi dalam dua
golongan utama yaitu obat yang berstruktur spesifik dan
obat yang berstruktur tidak spesifik.
Struktur kimia sangat menentukan aktivitas biologis dari
obat-obat yang berstruktur spesifik, sedangkan sifat-sifat
fisika-kimia lebih menentukan aktivitas biologis dari obat
Dalam mencari hubungan antara struktur kimia dan
aktivitas biologis dapat dilakukan pendekatan-pendekatan
dengan menggunakan parameter fisika-kimia. Dengan
mengetahui hubungan kuantitatif antara parameter
fisika-kimia dan aktivitas biologis, maka dapat diketahui
peranan dari gugus yang menyebabkan perubahan sifat
fisika-kimia yang berhubungan dengan aktivitas
biologisnya. Disamping itu, dapat digunakan untuk
merancang suatu obat baru yang lebih aktif dari senyawa
induknya dan menyimpulkan cara kerja untuk macam-macam
obat yang berbeda (3,4).
Parameter fisika-kimia meliputi parameter hidrofobik,
elektronik dan sterik. Parameter hidrofobik yaitu
parameter yang berhubungan dengan kelarutan suatu senyawa
dalam pelarut nonpolar dan polar, antara lain koefisien
partisi lemak-air, tetapan pi ( n ) dari Hansch, dan
tetapan f dari Rekker ( 5 ). Parameter elektronik yaitu
parameter yang berhubungan dengan distribusi muatan
listrik dari substituen, antara lain tetapan sigma ( cr )
Hammett untuk senyawa aromatik, tetapan sigma bintang
(o'*) dari Taft untuk senyawa alifatik dan pKa. Parameter
sterik yaitu parameter yang menggambarkan konformasi dalam
ruang dari berbagai gugus dalam molekul dan memainkan
peranan dalam halangan ruang pada tingkat intra molekul,
Charton dan molar refraksi ( MR ) ( 1 ).
Parameter elektronik memberikan nilai yang merupakan
ukuran tingkat kekuatan menyumbangkan elektron atau
menarik elektron.
Dari parameter-parameter elektronik yang ada, yang banyak
dipakai untuk menghubungkan struktur kimia dan aktivitas
biologis adalah tetapan sigma ( cr ) dari Hammett. Tetapan
sigma ( cr ) Hammett merupakan ukuran dukungan substituen
terhadap efek elektronik senyawa induk. Tetapan substituen
Hammett digunakan untuk memprediksi tetapan keseimbangan
dan tetapan laju reaksi kimia. Nilai sigma (cr) tergantung
pada sifat dan posisi substituen pada senyawa induk ( 1,
2, 4 ).
Hubungan nilai efek elektronik dengan aktivitas
biologis dinyatakan dengan persamaan Kopecky et.al, dimana
dengan ditentukannya nilai sigma ( cr ) Hammett dari suatu
gugus yang tersubtitusi pada senyawa induk, dapat
digunakan untuk menentukan konsentrasi obat yang
diperlukan untuk menimbulkan aktivitas biologis ( 6 ).
Pada penelitian ini akan ditentukan nilai sigma ( cr )
Hammett dari gugus hidroksi (-0H) pada posisi para.
Hidrogen mempunyai nilai sigma ( cr ) = 0,00. Nilai sigma
(o') Hammett dari gugus hidroksi ( -OH ) pada posisi para
pada tabel yaitu -0,37 ( 7 ). Dalam hal ini, nilai sigma
bernilai negatif menunjukkan bahwa substituen atau gugus
hidroksi tersebut merupakan pendorong elektron yang lebih
kuat daripada hidrogen ( elektron donor ). Jika nilai
sigma ( cr ) positif berarti bahwa substituen atau gugus
tersebut merupakan penarik elektron yang lebih kuat
daripada hidrogen (elektron aseptor) (8). Nilai sigma (o')
Hammett pada tabel digunakan sebagai pembanding terhadap
nilai sigma ( cr ) Hammett dari hasil penelitian.
Penentuan nilai efek elektronik dilakukan dengan
menentukan nilai tetapan disosiasi (pK) senyawa induk dan
senyawa dengan gugus hidroksi pada posisi para. Nilai
tetapan disosiasi ( pK ) ditentukan dengan menggunakan
alat spektrofotometri ultra lembayung dan pH diatur dengan
penambahan larutan dapar. Karena metode spektro- fotometri
ultra lembayung mempunyai ketelitian yang cukup tinggi (9,
10 }.
Bahan penelitian yang digunakan adalah bahan yang
merupakan senyawa induk ( tak tersubstitusi ) dan senyawa
yang mempunyai gugus hidroksi (-0H) pada posisi para
(seyawa tersubtitusi).
Pada penelitian ini digunakan dua pasang senyawa, yaitu
ampisilin ( sebagai senyawa induk ) dengan amoksisilin
(sebagai senyawa tersubtitusi ) dan sefaleksin ( sebagai
senyawa induk ) dengan sefadroksil (sebagai senyawa
golongan antibiotika berspektrum luas yang banyak
digunakan dalam masyarakat.
2. Perumusan Kasalah
Berdasarkan masalah di atas, maka dapat dirumuskan
sebagai berikut. :
1. Berapa nilai sigma ( cr ) Hammett dari gugus hidroksi
(-0H) pada posisi para dari ampisilin dengan amoksi—
silin dan sefaleksin dengan sefadroksil ?
2. Apakah ada perbedaan yang bermakna antara nilai sigma
(c r ) Hammett dari gugus hidroksi (-0H) pada posisi para
dari ampisilin dengan amoksisilin dan sefaleksin dengan
sefadroksil ?
3. Apakah ada perbedaan yang bermakna antara nilai sigma
(c r ) Hammett dari gugus hidroksi ( -OH ) pada posisi
para yang diperoleh dari hasil penelitian (ampisilin
dengan amoksisilin dan sefaleksin dengan sefadroksil)
dan nilai sigma ( cr ) Hammet pada tabel ?
3. Tu j u a n Penelitian
Penelitian ini bertujuan untuk :
1. Mengetahui nilai sigma ( o ) Hammett dari gugus
hidroksi ( -OH ) pada posisi para dari ampisilin
dengan amoksilin dan sefaleksin dengan sefadroksil.
hidroksi pada posisi para dari ampi3ilin dengan
amoksisilin terhadap nilai sigma ( cr ) Hammett dari
sefaleksin dengan sefadroksil.
3. Membandingkan nilai sigma ( cr ) Hammett dari gugus
hidroksi ( -OH ) pada posisi para yang diperoleh
dari ampisilin dengan amoksisilin dan sefaleksin
dengan sefadroksil ( hasil penelitian ) terhadap
nilai sigma ( cr ) Hammett pada tabel.
4. Hipotesis
1. Tidak ada perbedaan yang bermakna antara nilai sigma
(cr) Hammett dari gugus hidroksi ( -OH ) pada posisi
para dari ampisilin dengan amoksisilin dan
sefaleksin dengan sefadroksil.
2. Tidak ada perbedaan yang bermakna antara nilai sigma
(cr) Hammett dari gugus hidroksi ( -OH ) pada posisi
para yang diperoleh dari hasil penelitian (ampisilin
dengan amoksisilin dan sefaleksin dengan
sefadroksil) dan nilai sigma (cr) Hammett pada tabel.
5. Manfaat Penelitian
Penelitian ini bermanfaat untuk menunjukkan cara mem—
peroleh nilai sigma ( cr ) Hammett pada tabel dan dengan di
ketahuinya nilai sigma (c r) Hammett, maka dapat dipakai
dalam menilai ukuran tingkat elektronik dari suatu
BAB II
TINJAUAN PUSTAKA
1. Tinjauan tentang hubungan antara struktur kimia dan
aktivitas biologis
Penyelidikan tentang hubungan antara sifat fisika-
kimia dari suatu senyawa kimia dan aktivitas biologis
yang ditimbulkannya telah dilakukan oleh Troube pada tahun
1904. Sampai kira-kira pertengahan abad ke 20 masih banyak
dipelaoari hubungan tersebut secara empirik dan
kualitatif (2).
Kemudian dengan berkembangnya kimia medisinal,
berbagai prosedur hubungan kuantitatif struktur dengan
aktivitas telah dikembangkan dari senyawa yang aktif
secara biologis. Kimia medisinal menguraikan hubungan
antara struktur kimia dan aktivitas biologis, identifikasi
metabolit obat dan penoelasan biokimia dari transport dan
aksi obat (6).
Diantara prosedur tersebut, pendekatan Hansch yang
terbanyak telah digunakan secara luas dan efektif. Menurut
pendekatan Hansch, hubungan strukutur kimia dengan
aktivitas biologis dapat dinyatakan secara kuantitatif
melalui parameter fisika-kimia. Sifat-sifat fisika-kimia
yang menguntungkan aktivitas, modifikasi struktur yang
menghasilkan senyawa yang aktivitasnya kuat. Jadi,
seoumlah usaha telah dibuat untuk menerapkan pendekatan
Hansch untuk merancang- senyawa yang mempunyai struktur
optimal diantara senyawa seturunan (11).
Hubungan matematik antara struktur kimia dan aktivitas
biologis pada suatu seri obat dapat dituliskan sebagai
berikut :
# = f (C) ... Cl]
dimana $ adalah ukuran efek biologis dan C menggolongkan
ciri-ciri struktural obat. Jadi aktivitas biologis suatu
obat merupakan fungsi dari struktur kimianya. Hubungan
tersebut dapat digunakan untuk merancang suatu senyawa
baru (3,10).
3. Tinjauan tentang pengaruh sifat fisika-kimia terhadap aktivitas biologis
Aktivitas biologis dari suatu senyawa dipengaruhi
oleh sifat fisika-kimia senyawa itu, struktur sistem resep
tor ( tempat aktif obat tersebut bekerja ) dan pengaruh
letak suatu gugus dalam struktur molekul. Berdasarkan
hubungan antara struktur kimia dan aktivitas biologis,
obat-obat dapat dibagi dalam dua golongan utama yaitu obat
yang berstruktur tidak spesifik dan obat yang berstruktur
spesifik.
aksi farmakologisnya tidak secara langsung dipengaruhi
oleh struktur kimia, tetapi dipengaruhi oleh sifat-sifat
fisika-kimia. Diantara sifat-sifat ini dapat disebutkan
antara lain : kelarutan, pKa, potensial reduksi-oksidasi
yang dapat mempengaruhi permeabilitas, depolarisasi
membran, koagulasi protein dan pembentukan komplek.
Obat yang berstruktur spesifik adalah obat yang aksi
biologisnya pada dasarnya diakibatkan oleh struktur
kimianya, yang akan menyesuaikan diri menjadi struktur
reseptor tiga dimensi melalui pembentukan kompleks dengan
reseptor. Oleh karena itu di dalam reaktivitas kimia
obat-obat ini, bentuk, ukuran, pengaturan stereokimia
molekul dan distribusi gugus fungsional, juga efek induksi
dan resonansi, distribusi elektronik, interaksi dengan
reseptor memegang peranan penting dalam aksi biologis (7).
Ada dua pendekatan dalam hubungan kuantitatif
struktur-aktivitas (QSAR = Quantitative Sturture Activity
Relationship), yaitu :
1. Model De Novo atau model Free-Wilson, yang merupakan
pendekatan statistik, tidak tergantung pada sifat-sifat
fisika-kimia untuk menggolongkan sumbangan gugus
substituen kepada aktivitas biologis.
2. Model Linear Free Energy Relationship (LFER) atau model
extratermodinamik disebut juga model Hansch, yang meng—
aktivitas biologisnya.
Model De Novo mendefinisikan respon biologis ( BR =
Biological Response ) sama dengan jumlah sumbangan gugus
substituen kepada aktivitas ditambah dengan aktivitas
rata-rata keseluruhan ( fj ) yang dapat dihubungkan dengan
sumbangan aktivitas senyawa struktur induk (3).
BR = Z (sumbangan gugus substituen) + (j ... [2]
dimana BR adalah respon biologis.
Model Linear Free Energy Relationship (LFER)
merupakan penerapan model matematik hubungan kuantitatif
struktur aktivitas yang didasarkan pada persamaan Hammett
untuk laju hidrolisa turunan asam benzoat, sebagai
berikut :
Log K = p cr + log Kq ... [3]
dimana K dan Ko adalah tetapan keseimbangan reaksi senyawa
tersubstitusi dan senyawa tak tersubstitusi. Sigma (o’)
adalah tetapan elektronik yang sepenuhnya tergantung pada
sifat dan posisi substituen. Rho ( p ) adalah tetapan
reaksi yang merupakan ukuran sensitivitas reaksi terhadap
efek substitusi yang tergantung pada jenis dan kondisi
reaksi maupun sifat senyawa. Hal ini menggambarkan
hubungan yang linier antara tetapan substituen sigma ( cr )
dan logaritma dari reaktivitas senyawa (K). Karena
logaritma suatu tetapan keseimbangan berbanding lurus
A G° = - 2,303 R T log K ... C43
Maka dengan demikian persamaan log K = P <r + log KQ
dapat dikatakan berkaitan dengan energi bebas atau sering
disebut Linear Free Energy Relationship (LFER).
AG° adalah perubahan energi bebas Gibbs, R adalah tetapan
gas ideal, T adalah temperatur absolut dan K adalah
tetapan keseimbangan reaksi (3).
Model Linear Free Energy Relationship (LFER) ternyata
lebih berkembang dan banyak dipakai oleh para peneliti.
Untuk menghubungkan struktur molekul dengan aktivitas
biologis, model Linear Free Energy Relationship (LFER)
ini menggunakan beberapa parameter fisika-kimia antara
lain (3,4) :
1. Parameter hidrofobik
Yaitu parameter yang berhubungan dengan kelarutan
suatu senyawa dalam pelarut non polar dan polar.
Antara lain : koefisien partisi (P), tetapan n
dari Hansch-Fujita, tetapan fragmentasi (f) dari
Rekker, tetapan kromatografi (R ) m 2. Parameter elektronik
Yaitu parameter yang berhubungan dengan distribusi
muatan listrik dari substituen. Antara lain :
tetapan sigma ( o' ) dari Hammett, tetapan sigma
bintang ( cr* ) dari Taft, pKa.
3. Parameter sterik
Yaitu parameter yang menggambarkan konformasi
spesial dari berbagai gugus dalam molekul dan
memainkan peranan dalam halangan ruang pada
tingkat intramolekul. Lokasi, ukuran, volume dan
muatan gugus-gugus yang khusus mempunyai peranan
dlaini. Antara lain : berat molekul (BM), molar
refraksi (MR), parachor (P), tetapan Es dari Taft,
dimensi Van der Waals, konnektivitas molekul,
tetapan sterik dari Charton, parameter sterimol.
3. Tinjauan Tentang Efek Elektronik
Pada tahun 1930, Hammett telah mempelajari hubungan
antara struktur dan aktivitas biologik dari suatu senyawa
seturunan. Ternyata, adanya perubahan gugus pada senyawa
induk dapat menyebabkan perubahan pada lipofilitas,
elektronik atau sterik suatu senyawa, sehingga dapat
menyebabkan perubahan pada aktivitas biologik yang
ditimbulkannya (1,4).
Hammett mengemukakan bahwa efek elektronik dari suatu
gugus dapat mempengaruhi tetapan kesetimbangan atau
tetapan kecepatan reaksi suatu senyawa. Parameter
elektronik memberikan sebuah nilai yang merupakan ukuran
tingkat kekuatan menyumbangkan elektron atau tnenarik
elektron.
13
kekuatan elektronik pada pusat reaksi (4).
3.1. Tetapan sigma CoO Hammett
Parameter elektronik yang digunakan secara luas
adalah konstanta substituen Hammett ( cr ). Tetapan sigma
(c r ) adalah ukuran efek elektronik dari substituen tertentu
pada pusat reaksi dari molekul dalam sebuah seri
senyawa yang berhubungan secara struktural. Nilai sigma
(o’) ini dapat digunakan untuk menghubungkan struktur kimia
dengan aktivitas biologis (3,4).
Hammett memperkenalkan tetapan substituennya untuk
memprediksi tetapan keseimbangan dan tetapan laju reaksi
kimia. Persamaan yang digunakan untuk menyatakan nilai
efek elektronik ini dirumuskan oleh Hammett, sebagai
berikut :
p <y ~ pKo - pK ... [5]
Dimana pK dan pKQ adalah negatif logaritma dari K (tetapan
keseimbangan reaksi senyawa tersubstitusi) dan Kq (tetapan
keseimbangan reaksi senyawa tak tersubstitusi).Sigma {c r )
adalah tetapan elektronik yang sepenuhnya tergantung pada
sifat dan posisi substituen. Rho ( p ) adalah tetapan
reaksi yang merupakan ukuran sensitivitas reaksi terhadap
efek substitusi yang tergantung pada jenis dan kondisi
reaksi maupun sifat senyawa.
suhu 25° C adalah 1,00. Oleh karena itu reaksi ini
digunakan sebagai standart untuk menetapkan nilai sigma
(c r) dari substituen baru (1).
Pada umumnya persamaan Hammett berlaku untuk sistem
aromatis hanya untuk reaksi-reaksi dimana substituen dan
pusat reaksi terisolasi, sehingga tidak terjadi interaksi
resonansi. K adalah tetapan keseimbangan reaksi yang
menunjuk kepada turunan meta atau para, sedangkan Kq
menunjuk ke senyawa induk. Karena pada turunan orto lazim
terjadi interaksi sterik, maka persamaan Hammett tidak
berlaku untuk senyawa-senyawa turunan orto (4).
Sesuai dengan persamaan [5], yang merupakan persamaan
Hammett, maka nilai sigma ( cr ) positif nenunjukkan bahwa
substituen atau gugus tersebut merupakan penarik elektron
yang lebih kuat daripada hidrogen (elektron aseptor),
sedangkan nilai sigma ( cr ) negatif menunjukkan substituen
atau gugus tersebut merupakan pendorong elektron yang
lebih kuat daripada hidrogen (elektron donor). Hidrogen
mempunyai nilai sigma( c ) = 0,00 (3,7,11).
Nilai sigma ( a ) Hammett tergantung pada sifat gugus
pengganti dan posisinya pada senyawa induk (5,12).
Nilainya tidak tergantung pada sifat reaksi (12) serta
3.2. Faktor-faktor yang mempengaruhti riilai efek elektronik 3.2.1. Pengaruh suhu terhadap nilai efek elektronik.
Nilai efek elektronik diperoleh dari persamaan
[3] yang merupakan persamaan Hammett. Tetapan disosiasi K
dan Kq memepunyai nilai yang tetap pada suhu yang tetap.
Dengan kata lain, apabila suhu berubah maka nilai K dan Kq
akan berubah. Akibatnya nilai efek elektronik yang
diperoleh melalui nilai K juga akan berubah.
Pengaruh suhu terhadap nilai K tidak dinyatakan
menjadi aturan yang sederhana. Sebagai contoh adalah nilai
K dari senyawa yang bersifat basa kuat cenderung naik
sekitar 0,1 unit setiap kenaikan suhu 10° C. Sebaliknya
menurut Krahl, asam barbiturat yang bersifat asam lemah
nilai K nya akan berkurang 0,1 unit apabila suhu
bertambah 5° C (14).
3.2.2. P e ngaruh pH terhadap nilai efek elektronik
Nilai efek elektronik diperoleh dari persamaan
Hammett yang melibatkan nilai K. Oleh karena itu, hubungan
antara pH dan nilai K sama dengan hubungan antara pH dan
nilai efek elektronik.
Suatu senyawa asam lemah HA apabila terion, menjadi :
HA + H O tc* — H 0+ + A"3
Tetapan disosiasinya : ,
( H 0+ ) (A" )
K = --- — ... [6]
(HA)
Pada nilai K tertentu perubahan pH dapat
mengakibatkan jumlah senyawa yang terion dan tidak terion
akan berubah pula. Demikian juga pada nilai efek
elektronik tertentu bila pH berubah, maka jumlah senyawa
yang terion dan yang tidak terion akan berubah pula.
Apabila nilai efek elektronik suatu gugus negatif,
maka senyawa dengan gugus R bersifat kurang asam daripada
senyawa induknya. Pada pH asam, maka jumlah yang terion
dari senyawa dengan gugus R lebih banyak dari jumlah yang
tidak terionkan. Pada pH basa jumlah yang tidak terion
lebih banyak dari jumlah yang tidak terionkan.
Suatu gugus yang mempunyai nilai efek elektronik
positif berarti senyawa dengan gugus R tersebut bersifat
lebih asam dari senyawa induknya. Pada pH asam jumlah yang
tidak terionkan lebih banyak dari jumlah yang terionkan
tetapi pada pH basa jumlah yang terion lebih banyak dari
jumlah yang tidak terion (15).
3.3. P engaruh nilai efek elektronik terhadap aktivitas
Biologis
IT
suatu senyawa tergantung pada nilai efek elektroniknya
sesuai dengan persamaan di bawah ini (6) :
Log 1/C = p <7 + c ... C73
dimana C adalah konsentrasi obat yang diperlukan untuk
menimbulkan aktivitas biologis. Sigma (<?) adalah nilai
efek-elektronik. Rho ( p ) adalah tetapan reaksi yang
merupakan ukuran sensitivitas reaksi terhadap efek
substitusi, sedangkan c adalah suatu tetapan reaksi.
Sebagian besar obat merupakan suatu senyawa yang
bersifat asam lemah atau basa lemah, yang diabsorbsi
melalui proses difusi pasif, dimana bentuk tidak terionkan
lebih mudah menembus membran biologis daripada bentuk
terionnya (16). Jumlah yang terionkan dan tidak terionkan
dari suatu senyawa ditentukan oleh pH disekitar membran
biologik dan pKa senyawa tersebut, yang akan mempengaruhi
absorbsinya melalui membran biologik (16). Suatu obat
yang bersifat asam lemah, lebih aktif pada pH yang rendah,
karena pada pH rendah jumlah yang tidak terion lebih
banyak dari jumlah yang terionkan, sehingga lebih mudah
menembus membran biologik. Untuk obat yang bersifat basa
lemah lebih aktif pada pH yang tinggi karena jumlah yang
tidak terionkan lebih banyak dari jumlah yang terionkan,
sehingga lebih mudah menembus membran biologik (16).
Apabila suatu gugus R mempunyai nilai efek elektronik
daripada hidrogen) maka senyawa dengan gugus R tersebut
bersifat kurang asam daripada senyawa induknya. Pada pH
tertentu, misal pada pH asam maka jumlah yang terionkan
dari senyawa dengan gugus R lebih banyak dari jumlah yang
tidak terionkan dibandingkan dengan senyawa induknya.
Sedangkan pada pH basa, oumlah yang tidak terionkan lebih
banyak dari jumlah yang terionkan dibandingkan dengan
senyawa induknya. Apabila aktivitas biologiknya diakibat-
kan oleh bentuk terionnya, maka pada pH asam senyawa
dengan gugus R lebih aktif dari senyawa induknya. Pada pH
basa senyawa dengan gugus R kurang aktif dari senyawa
induknya. Apabila aktivitas biologisnya diakibatkan oleh
bentuk yang tidak terionkan maka pada pH asam senyawa
dengan gugus R kurang aktif dari senyawa induknya.
Sedangkan pada pH basa senyawa dengan gugus R menjadi
lebih aktif dari senyawa induknya (7).
Suatu gugus R yang mempunyai nilai efek elektronik
positif (merupakan penarik elektron yang lebih kuat
daripada hidrogen) berarti senyawa dengan gugus R tersebut
lebih asam dari senyawa induknya. Pada pH asam jumlah yang
tidak terionkan lebih banyak dari senyawa induknya
sedangkan pada pH basa jumlah yang terionkan dari senyawa
dengan gugus R lebih banyak dari senyawa induknya. Apabila
aktivitas biologisnya diakibatkan oleh bentuk yang
aktif dari senyawa induknya, sedangkan pada pH basa
senyawa dengan gugus R menjadi lebih aktif dari senyawa
induknya. Apabila aktivitas biologisnya diakibatkan oleh
bentuk tidak terionnya, maka pada pH asam senyawa dengan
gugus R lebih aktif dari senyawa induknya sedangkan pada
pH basa senyawa dengan gugus R menjadi kurang aktif dari
senyawa induknya
(7).-4. Tinjauan Tentang Spektrofotometri 4.1. Tinjauan umum
Spektrofotometri dapat dianggap sebagai perluasan
suatu pemeriksaan visual yang lebih mendalam dari absorbsi
energi radiasi oleh macam-macam zat kimia memperkenankan
dilakukannya pengukuran ciri-cirinya serta kuantitatifnya
dengan ketelitian yang besar. Semua atom dan molekul mampu
menyerap energi sesuai dengan pembatasan tertentu, batasan
ini tergantung pada struktur zat. Energi disediakan dalam
bentuk radiasi elektromagnetik (cahaya). Cahaya yang
dipakai sebagai sumber cahaya pada spektrofotometer adalah
sinar ultra violet (uv) dan sinar tampak (visibel), yang
keduanya merupakan radiasi elektromagnetik.
Macam dan jumlah radiasi yang diabsorbsi oleh molekul
tergantung pada jumlah molekul yang berinteraksi dengan
radiasi (9,17).
Spektrofotometri adalah suatu metode yang menggunakan
spektrofotometer untuk menganalisa zat, baik secara
kuaiitatif maupun kuantitatif. Analisa kuantitatif dengan
spektrofotometer berdasarkan pemakaian hukum Lambert Beer
yang menyatakan : Jika cahaya radiasi monokromatis
dilewatkan melalui medium penyerap yang homogen yakni
sebuah lapisan larutan yang tebalnya db, tnaka pengurangan
intensitaf cahaya (dl), sebagai akibat melewati lapisan
larutan, berbanding lurus dengan intensitas radiasi (I)
konsentrasi zat pengabsorbsi (c) dan tebalnya lapisan
larutan (db), dapat dinyatakan dengan persamaan berikut :
- dl = kl c db ... C8]
Persamaan di atas dapat ditulis dalam bentuk :
A = a b c ... [93
dimana A adalah absorbansi, a adalah absorpsivitas, b
adalah tebalnya lapisan larutan dan c adalah
konsentrasi.(17).
4.2. Penentuan tetapan kesetimbangan reaksi secara spektro fotometri
Tetapan kesetimbangan reaksi dapat ditentukan secara
spektrofotometri dimana prinsip penentuan tetapan
kesetimbangan reaksi tersebut adalah aplikasi dari hukum
Lambert Beer yang dinyatakan dengan kesetimbangan asam
basa, tetapi prinsip ini dapat dipakai pada kesetimbangan
21
Dissosiasi asam lemah (HA) dalam larutan air adalah :
Tetapan kesetimbangan termodinamik dari reaksi ini
dapat ditulis sebagai tetapan kesetimbangan reaksi (K) :
pH larutan dikontrol dengan penambahan larutan dapar dan
dapat diukur secara potensiometri, perbandingan [A 3/[HA]
dapat ditentukan secara spektrofotometri jika spektra
absorbs! A dan HA berbeda. Hal ini disebabkan karena
sensitivitas analisa spektra yang besar sangat tergantung
pada konsentrasi dari asam dan basa konyugasi yang
digunakan.
Andaikata A dan HA mempunyai spektra absorbsi yang
berbeda bermakna dan panjang gelombang yang dipilih yaitu
pada panjang gelombang analitik dimana absorbsivitas ke
dua zat itu berbeda. Menurut hukum Beer : HA *
aH+ . [A~
3
K = [10]
[HA
3
Bentuk logaritma persamaan tersebut adalah :
pK = pH - log
[113
C, HA
AHA “ aHA b °HA
V
= aA~ b CA"[12] [133
dimana persamaan ini menunjuk pada panjang gelombang yang
sama.
a h a adalah serapan dari larutan HA
V
adalah serapan dari larutan A"CHA adalah konsentrasi larutan HA
c a- adalah konsentrasi larutan A"
Serapan yang terlihat dari larutan yang mengandung HA dan
A diberikan oleh persamaan berikut :
Aobs = AHA + AA~ = b (aHA CHA + aA~ CA_) ... C14:i
Dengan demikian dapat ditetapkan absorbsivitas nyata a0k s
dari campuran zat sesuai dengan :
dimana c adalah :
Karena serapan yang diberikan oleh persamaan [14] sama
dengan persamaan [15], maka mereka dapat dibuat sama dan
digabungkan dengan persamaan [163 untuk memberikan
persamaan berikut ini :
aobs (CHA + CA _) = aHA CHA + aA~ CA~ ... C17;1
23
cfl _ aoba ~ aHfl [18j
°HA aA~ " aHA
CA~ _ aHA aobs flgj
CHA aobs aA
Persamaan [18] digunakan bila a^- lebih besar dari a ^ ,
sedangkan bila a ^ lebih besar dari a^- maka digunakan
persamaan [19]. Kedua persamaan tersebut bila masing-
masing disubstitusikan pada persamaan [11] maka akan
terjadi : PK = pH - log - -~°- s---- ... ... [20] aA _ “ aobs atau pK = pH - log - ^ ---- a?bs- ... C21] aobs " aA “
Bila konsentrasi total zat terlarut (c) dibuat tetap dalam
semua pengukuran ini, maka serapan A^A , A^- dan Aobs
adalah sama dengan absorbsivitas a ^ , a^~ dan dalam
persamaan [20] atau [21]. Jadi pada persamaan [20] atau
[21] tersebut : pK adalah negatif logaritma dari tetapan
keseimbangan reaksi, a obs adalah serapan zat pada pH
larutan dalam air, adalah serapan zat pada asam,
adalah serapan zat pada pH basa.
penentuan tetapan keseimbangan reaksi (K) secara spektro-
fotometri. Nilai logaritma dari tetapan keseimbangan
reaksi (pK) dapat digunakan untuk menentukan nilai sigma
(cr) Hammett dengan menggunakan persamaan [5]. Untuk pH
asam ditentukan dengan jalan sekurang-kurangnya 2 (dua)
unit pH di bawah pH larutan dalam air, sedangkan pH basa
ditentukan dengan jalan sekurang-kurangnya 2 (dua) unit
pH di atas pH larutan dalam air. Sedangkan panjang
gelombang terpilih yaitu pada panjang gelombang dimana
terdapat perbedaan serapan terbesar antara larutan zat
dalam suasana asam dan basa.
S. Tinjauan Tentang Sifat Fisika-Kimia dari Ampisilin,
Amoksisilin, Sefaleksin dan Sefadroksil
5.1. Sifat fisika-kimia ampisilin C ampisilin trihidrat } Cl8, 19, 20, 24)
Ampisilin dikenal juga sebagai aminobensil penisilin,
mempunyai struktur molekul sebagai berikut :
COOH
Rumus molekul : C lg H ig N30 4S.3H20
Berat molekul : 403, 4
25 Ampisilin adalah serbuk hablur sangat halus, putih
yang hampir tidak berbau dan berasa pahit.
Kelarutan : 1 bagian dalam 150 bagian air, praktis tidak
larut dalam alkohol, aseton, kloroform, eter, karbontetra-
klorida dan minyak. Larutan 0,25% dalam air mempunyai pH 3,5
sampai 5,5.
1,15 g apisilin trihidrat setara dengan 1 g ampisilin.
pKa : 2,5 ( - COOH ) pada 25° C
7,3 ( - NH2 ) pada 25° C
Khasiat dan penggunaan ampisilin sebagai antibiotik.
5.2. Sifat fisika-kimia amoksisilin Camoksisilin trihidrat!) CIS, 20, 243
Amoksisilin dikenal juga sebagai D(-) amino hidroksil
bensil penisilin. Mempunyai struktur molekul sebagai
berikut :
Rumus molekul : C^gH^gNgO^S.3H20
Berat molekul : 419,4
Amoksisilin adalah serbuk hablur sangat halus, warna putih
yang hampir tidak berbau dan berasa pahit.
H 0 H H H
2
Kelarutan : 1 bagian dalam 400 bagian air, 1 bagian dalam
1000 bagian alkohol, 1 bagian dalam 200 bagian metil alko-
hol dan praktis tidak larut dalam kloroform, eter, karbon
tetraklorida dan minyak. Larutan 0,2 % dalam air mempunyai
pH 3,5 - 5,5
1,15 g amoksisilin trihidrat setara dengan 1 g amoksisilin
pKa : 2,4 ; 7,4 ; 9,6
Khasiat dan penggunaan amoksisilin sebagai antibiotik.
5.3. Sifat fisika kimia sefaleksin C19,20, 24)
Sefaleksin mempunyai struktur molekul sebagai berikut :
H 0 H H H 0 C C00H Rumus molekul : C 16H 17N30 4S.H20 Berat molekul : 365,4 Titik lebur : 190° C
Sefaleksin adalah serbuk hablur putih sampai putih
kuning gading, sedikit higroskopis, berbau khas.
Kelarutan : larut dalam 100 bagian air, larut dalam 30
bagian asam klorida 0,2%,sukar larut dalam dioxan, dimeti
etanol (95%)P, kloroform dan eter, larut dalam alkal
encer.
Larutan 0,5% dalam air mempunyai pH 3,5-5,5.
pKa : 5,2 ; 7,3
Khasiat dan penggunaan sefaleksin sebagai antibiotik.
5.4. Sifat fisika kimia sefadroksil 0 8 , 2 1 ) Mempunyai struktur molekul sebagai berikut :
Larutan 5% dalam air mempunyai pH 4 - 6
Khasiat dan penggunaan sefadroksil sebagai antibiotik.
H 0 H H H W | I I i NH2 c n 0 COOH Rumus molekul : Berat molekul : 399,4 Titik lebur : 197° C
Sefadroksil adalah serbuk kristal warna putih.
M ETODE PENEL.ITIAN
1. Bahan penelltian yang digunakan :
- Atnpisilin trihidrat (P.T. Medifarma
Laboratories.Inc.)
- Amoksisilin trihidrat (P.T. Sandoz Biochemic
Farma Indonesia )
- Sefaleksin monohidrat (P.T Meiji Indonesian
Pharmaceutical Industries)
- Sefadroksil monohidrat (P.T. Dankos
Laboratories)
- Asam klorida (HC1) p.a (E.Merck)
- Asam borat (H3B03> p.a (E.Merck)
- Natrium klorida (NaCl) p.a (E.Merck)
- Natrium borat dekahidrat (Na B O .10 H O ) p.a2 4 ? 2
E.Merck)
- Natrium karbonat (Na CO.) p.a (E.Merck) mm <«
- Natrium hidroksida (NaOH) p.a (E.Merck)
- Aquadest
2* Alat penel l t i a n yang digunakan :
- Spektrofotometer UV ''Hitachi'* dual wavelength
double beam type 557
- Fischer melting point apparatus
- Neraca analitik Sartorius-Werke GMBH Type 2472
- Aiat-alat gelas
29
3. Cara pengerjaan
3.1. Pemeriksaan kualitatif terhadap bahan perielitian 3.1.1. Pemeriksaan organoleptis
Meliputi pemeriksaan bentuk, warna,bau dan rasa (20)
3. 1.2. Reaksi warna
3. 1.2.1. Reaksi warna untuk a m p i s l l i h C19, 23!) s
1. Ke dalam suspensi 10 mg zat dalam 1 ml air
ditambahkan 2 ml larutan Fehling encer (2 : 6)
2. Larutkan 15 mg zat ke dalam 3,0 ml 1 N NaOH
ditambahkan 0,3 g hidroksilamin hidroklorida
dan dibiarkan selama 5 menit. Larutan
diasamkan dengan beberapa tetes 6 N
HCl,kemudian ditambahkan 1,0 ml besi (III)
klorida 1%.
3. Larutkan 10 mg bahan dalam 1,0 ml air dan
ditambah 2 ml dari campuran yang terdiri dari
2 ml larutan kalium kupritatrat dan 6,0 ml
air.
3.1.2.2. Reaksi warna untuk a m o k s i s i l i n C21D s
ditambah 2,0 ml campuran yang terdiri dari 2,0
ml larutan kalium kupritatrat 6,0 ml air.
3.1.2.3. Reaksi warna untuk sefaleksin C23)
1. 5 mg bahan dilarutkan dalam 3,0 ml air,
difcambahkan 0,1 g hidroksilamin hidroklorida
dan 1,0 ml natrium hidroksida (80 g/1) dan
dibiarkan selama 5 menit. Kemudian ditambahkan
1,3 ml asam klorida (70 g/1) dan 10 tetes besi
(III) klorida (25 g/1).
2. 10 mg bahan dilarutkan dalam 1,0 ml air dan
ditambahkan 2,0 ml campuran yang terdiri dari
2,0 ml kalium kupritatrat dan 6 ml air.
3. 5 mg bahan dilarutkan dalam 1,0 ml air dan
ditambahkan 1-2 tetes besi (III) klorida (25
g/l>.
4. 20 mg bahan ditambah 5 tetes larutan asam
asetat glasial 1% (v/v) lalu ditambah 2 tetes
larutan tembaga (XI) sulfat 1% (b/v) dan 1
tetes natrium hidroksida 2 N.
3.1.2.4. Reaksi warna untuk sefadroksil C21}
- 10 mg bahan dilarutkan dalam 1 ml air dan
ditambahkan 2 ml campuran yang terdiri 2,0 ml
3.1.3. Penentuan titik lebur
Bahan berbentuk serbuk sekitar 1 mg dimasukkan ke
dalam pipa kapiler gelas dengan diameter kurang lebih 1
mm, tinggi 8 cm dan tertutup ujung lainnya. Usahakan
sampel dapat mencapai ujung pipa yang tertutup dengan cara
diketuk-ketuk.Pasang pipa kapiler, panaskan
perlahan-lahan. Pada suhu kurang lebih 15°C dibawah titik
lebur yang tercantum pada pustaka, atur laju kenaikan suhu
sampai 1-2° C permenit (24).
3* 2. Penentuan nilai pK
3.2.1. P e m buatan larutan dapar pada pH yang diperlukan : Penentuan pH dilakukan dengan jalan mengurangi
minimum dua satuan pH dibawah nilai pH larutan dalam air
untuk pH suasana asam dan menambah minimum dua satuan pH
diatas nilai pH larutan dalam air untuk pH suasana basa
pada masing-masing bahan penelitian.
Konsentrasi yang dibuat untuk masing-masing bahan
adalah ekuimolar dan tetap untuk berbagai pH. Larutan
ampisilin dibuat konsentrasi 600 ppm sedangkan larutan
amoksisilin dibuat konsentrasi 207,9 ppm, larutan
sefaleksin dibuat konsentrasi 30 ppm sedangkan larutan
sefadroksil dibuat konsentrasi 31,3 ppm.
Cara pembuatan larutan ini adalah sebagai berikut :
ditimbang serbuk ampisilin seberat 0,1000 g, kemudian
dilarutkan dalam aqua bebas C02 sampai tepat 50,0 ml dalam
labu ukur (larutan induk) dan dikocok sampai homogen.
Dipipet 3,0 ml larutan induk, ditambah aqua bebas C02
sampai tepat 10,0 ml dalam labu ukur dan dikocok sampai
homogen lalu diukur pH larutan ini. Untuk larutan
amoksisilin, ditimbang serbuk amoksisilin seberat 0,0520
g. Kemudian dilarutkan dalam aqua bebas C02sampai tepat
50,0 ml dalam labu ukur (larutan induk) dan dikocok sampai
homogen. Dipipet 2,0 ml larutan induk, ditambah aqua
bebas C02sampai tepat 10,0 ml dalam labu ukur, dikocok
sampai homogen, lalu diukur pH larutan ini.Sedangkan
untuk sefaleksin dan sefadroksil masing-masing ditimbang
seberat 0,0500 g dan 0,0522 g. Kemudian masing-masing
bahan dilarutkan dalam aqua bebas C02sampai tepat 500,0
ml dalam labu ukur (larutan induk) dan dikocok sampai
homogen. Dipipet 3,0 ml larutan induk ditambah aqua bebas
C02sampai tepat 10,0 ml dalam labu ukur dan dikocok
sampai homogen, lalu diukur pH larutan ini.
Hasil pengukuran pH larutan ampisilin, amoksisilin,
sefaleksin dan sefadroksil dengan konsentrasi
masing-masing : 600 ppm, 207,9 ppm, 30 ppm dan 31,3 ppm
dalam aqua bebas C0zadalah: pH 6,20; pH 6 ?00; pH 6,50 dan
pH 6,30.
. Sedangkan pH terpilih pengganti pH larutan dalam air yang
masing-masing bahan penelitian tersebut adalah pH 7,20;
7,00; 7,50 dan 7,30. Sehingga pH yang dibutuhkan
untuk penentuan nilai pK adalah : 4,20; 7,20; 9,20 untuk
ampisilin, 4,00; 7,00; 8,00 untuk amoksisilin, 4,50; 7,50;
10,50 untuk sefaleksin dan 3,30; 7,30; 9,30 untuk
sefadroksil. Untuk pembuatan larutan dapar adalah sebagai
berikut: ditimbang bahan dapar sesuai dengan pH yang akan
dibuat (lihat tabel II, III, IV dan V). Kemudian dilarutkan
dalam aqua bebas C0z sampai volume 200 ml, lalu diaduk
sampai homogen. Sebelum digunakan pH larutan diperiksa dulu
dengan pH meter.
3.2.2. Penentuan panjang gelombang terpilih
Konsentrasi yang dibuat untuk masing-masing bahan
adalah ekuimolar dan tetap untuk berbagai pH. Larutan
ampisilin dibuat konsentrasi 600 ppm sedangkan larutan
amoksisilin dibuat konsentrasi 207,9 ppm, larutan
sefaleksin dibuat konsentrasi 30 ppm sedangkan larutan
sefadroksil dibuat konsentrasi 31,3 ppm.
Cara pembuatan larutan ini adalah sebagai berikut :
ditimbang serbuk ampisilin seberat 0,1000 g, kemudian
dilarutkan dalam aqua bebas C02 sampai tepat 50,0 ml dalam
labu ukur (larutan induk) dan dikocok sampai homogen.
Dipipet 3,0 ml larutan induk, ditambah larutan dapar
sesuai pH yang ditentukan sebagai penggganti pH larutan 33
dalam air yaitu pH 7,20 sampai tepat 10,0 ml dalam labu
ukur, dikocok sampai homogen.
Untuk larutan ampisilin pH asam : dipipet 3,0 ml
larutan induk, ditambah larutan dapar pH 4,20 sampai tepat
10.0 ml dalam labu ukur dan dikocok sampai homogen. Untuk
larutan pH basa : dipipet 3,0 ml larutan induk, ditambah
larutan dapar pH 9,20 sampai tepat 10,0 ml dalam labu ukur
dan dikocok sampai homogen.
Untuk larutan amoksisilin, ditimbang serbuk
amoksisilin seberat 0,0520 g kemudian dilarutkan dalam
aq.ua bebas C02 sampai tepat 50,0 ml dalam labu ukur
(larutan induk) dan dikocok sampai homogen. Dipipet 2,0 ml
larutan induk, ditambah larutan dapar pH 7,00 sampai tepat
10.0 ml dalam labu ukur dikocok sampai homogen. Untuk
larutan amoksisilin pH asam dan pH basa dilarutkan dengan
cara yang sama dan larutan dapar yang digunakan adalah pH
4.00 dan pH 8,00. Sedangkan sefaleksin ditimbang seberat
0,0500 g dan sefadroksil seberat 0,0522 g dengan seksama.
Kemudian masing-masing bahan dilarutkan dalam aqua bebas
C02 sampai tepat 500,0 ml dalam labu ukur (larutan induk)
dan dikocok sampai homogen. Dipipet 3,0 ml larutan induk
ditambah larutan dapar pH 7,50 sampai tepat 10,0 ml dalam
labu ukur dan dikocok sampai homogen.
Untuk larutan sefaleksin pH asam : dipipet 3,0 ml
10,50 ml dalam labu ukur dan dikocok sampai homogen. Untuk
larutan pH basa : dipipet 3,0 ml larutan induk ditambah
larutan dapar ph 9,30 sampai tepat 10,0 ml dalam labu ukur
dan dikocok sampai homogen. Untuk larutan sefadroksil pH
asam dan pH basa dilakukan dengan cara yang sama dan
larutan dapar yang digunakan adalah pH 3,30 dan pH 9,30.
Masing-masing larutan diatas diamati serapannya pada
panjang gelombang 250 nm - 270 nm untuk ampisilin,
sefaleksin dan sefadroksil. Sedangkan larutan amoksisilin
diamati serapannya pada panjang gelombang 260 nm - 280 nm.
Sehingga diperoleh serapan antara 0,2 - 0,8. Suhu yang
dipergunakan adalah suhu 25,0°C. Panjang gelombang
terpilih adalah panjang gelombang dimana terdapat
perbedaan serapan terbesar antara larutan zat dalam
suasana asam dan basa. Blangko yang digunakan adalah
larutan daparnya masing-masing untuk larutan zat dalam
suasana asam, suasana netral ( larutan zat dalam air) dan
suasana basa.
3.2.3. Penentuan pK secara spektrofotometri
Konsentrasi larutan yang dibuat untuk masing-masing
bahan adalah ekuimolar dan tetap untuk masing-masing pH.
Jadi untuk masing-masing bahan konsentrasinya adalah
ampisilin 600 ppm, amoksisilin 207,9 ppm sedangkan
sefaleksin 30 ppm dan sefadroksil 31,3 ppm. Cara pembuatan 35
larutan ini adalah sebagai berikut : Untuk ampisilin dan
amoksisilin masing-masing ditimbang seberat 0,1000 g dan
0,0520 g. Kemudian dilarutkan dalam aqua bebas C02 sampai
tepat 50,0 ml dalam labu ukur(larutan induk) dan dikocok
sampai homogen. Untuk ampisilin dipipet 3,0 ml larutan
indukditambah larutan dapar pH 7,20 sampai tepat 10,6 ml
dalam labu ukur dan dikocok sampai homogen. Untuk pH
asamdan basa dilakukan cara yang sama dan larutan dapar
yang digunakan adalah pH 4,20 dan pH 9,20.
Sedangkan untuk amoksisilin dipipet 2,0 ml dari
larutan induk ditambah larutan dapar pH 7,00 sampai tepat
10,0 ml dalan labu ukur dan dikocok sampai homogen. Untuk
pH asam dan pH basa dilakukan cara yang sama dan larutan
dapar yang digunakan adalah pH 4,00 dan pH 8,00.
Untuk sefaleksin dan sefadroksil masing-masing
ditimbang seberat 0,0500 g dan 0,0522 g. Kemudian
dilarutkan dalam agua bebas C02 sampai tepat 500,0 ml
dalam labu ukur (larutan induk) dan dikocok sampai
homogen. Untuk sefaleksin dipipet 3,0 ml larutan induk,
ditambah larutan dapar pH 7,50 sampai tepat 10,0 ml dalam
labu ukur yang dikocok sampai homogen. Untuk pH asam dan
pH basa dilakukan cara yang sama dan larutan dapar yan
digunakan adalah pH 4,50 dan 10,50.
Untuk larutan sefadroksil dipipet 3,0 ml dari larutan
dalam labu ukur yang dikocok sampai homogen. Untuk pH
asam dan pH basa dilakukan cara yang sama dan larutan
dapar yang digunakan adalah pH 3,30 dan pH 9,30.
Pada penentuan pK secara spektrofotometri, serapan
masing-masing larutan bahan diatas diamati pada panjang
gelombang terpilih dan pada suhu 25,0°C. Blangko yang
digunakan adalah larutan daparnya masing-masing untuk
larutan zat dalam suasana asam, suasana netral (larutan
dalam air) dan suasana basa. Nilai pK dapat diperoleh
dengan menggunakan persamaan [20] bila a^->aHA dan
persamaan [21] bila a^A >aA~. Masing-masing larutan
diamati dua kali pengamatan dan dilakukan
replikasisebanyak empat kali.
37
3.3. Perhitungan nilai efek elektronik
Nilai efek elektronik dapat diperoleh dengan
menggunakan persamaan [5]. Dari nilai pK ampisilin
(senyawa induk(pKo >) dan pK amoksisilin (senyawa
tersubstitusi (pK)) serta nilai pK sefaleksin (senyawa
induk (pKQ )) dan pK sefadroksil (senyawa tersubstitusi
(pK)>, dapat diketahui nilai efek elektronik gugus
hidroksi (-0H) pada posisi para dengan memasukkan
masing-masing harga pK pada persamaan diatas.
I- *** I - PK ampisilin - pK amoksisilin ... [22]
3. 4. Analisis data
Untuk mengetahui apakah terdapat perbedaan yang
bermakna atau tidak antara nilai sigma (& ) Hammet dari
gugus -OH pada posisi para dari ampisilin-amoksisilin dan
dari sefaleksin-sefadroksil yang dilakukan pada kondisi
yang sama, maka data yang diperoleh dianalisis dengan
menggunakan uji "t" pooled dua pihak.
Dengan rumus sebagai berikut :
t = 2 2 sp sp n. n. [24] Sp2 =
s =
1s =
2 (n± - 1 > S * + < n 2 " l > S 2 n i + n, - 2 n L i= l (x. -v 2 n t -1 n E i= l (x. -V 2 n2 ~ 1 [25] [26] [27]39
Derajat bebas (d.b) = (n -1) + (n2-l) ... C281
dimana x = nilai rata-rata dari p er I
_ P
xz = nilai rata-rata dari per II
St = simpangan baku dari per I
S2 = simpangan baku dari per II
nt = jumlah sampel I
n2 = oumlah sampel II
Sp = Simpangan baku pooled "t"
Apabila "t" percobaan lebih besar dari pada "t" tabel
pada a = 0,05 (dua sisi) maka nilai efek elektronik dari
gugus - OH pada posisi para dari ampisilin-amoksisilin dan
dari sefaleksin- sefadroksil yang dilakukan pada kondisi
yang sama tersebut mempunyai perbedaan yang bermakna.
Sebaliknya apabila "t" percobaan lebih kecil dari pada *'t”
tabel maka perbedaan kedua nilai tersebut tidak bermakna.
Untuk mengetahui apakah terdapat perbedaan yang
bermakna antara harga sigma Hammet gugus hidroksi pada
posisi para ( cr ) dari hasil penelitian dengan harga sigma
Hammett gugus hidroksi pada posisi para (cr ) yang ada
p
dalam tabel, maka data yang diperoleh dianalisis dengan
uoi "t” satu sampel dengan rumus sebagai berikut :
(x - <i)
t = ... C29]
S = i n __ . L U.- x)' i=l n - 1 C30] Derajat bebas (d.b) = n~l ... C31]
dimana x = nilai rata-rata dari per
= nilai per pada tabel
s = simpangan baku dari per
n = oumlah sampel
Apabila harga "t” penelitian lebih besar dari harga
"t" tabel pada a = 0.05 (satu sisi) maka terdapat
perbedaan yang bermakna antara nilai sigma Hammett gugus
hidroksi pada posisi para (o' ) hasil penelitian dengan
nilai sigma (cr ) yang ada pada tabel. Sebaliknya apabila
harga "t" penelitian lebih kecil dari "t" tabel, maka
tidak ada perbedaan yang bermakna antara nilai sigma ( cr )
p
Hammett hasil penelitian dengan nilai sigma (cr ) Hammett
p yang ada pada tabel.
BAB IV
HASIL PENELITIAN
1. Analisis Kualitatif terhadap Bahan Penelitian
(19,20,21,23).
Tabel I
Hasil Analisis Rualitatif Bahan Penelitian
If.
P eieri^ sa fi r «‘ &*
fapisilin Trihidro 2*c*5i5iliri trifcidrat Sefaleksin aonofcidret fefa d ra isi! asn h i'ira t Plistsfcs ffesii Pusta<a Basil Pustaka Hasil ft e U U Hasil Orgsfioieptis 3. BentiiJ Bcii C. WS.TIS i. - serisjk hablur - tidsk feer bSli - putih - pahit - serbuk ha&iur - tidsk terfcci; - pctin - w h it - ssrtok (*c« *gf - f:s r b a u ♦*j t i r - serbufc habicr - t'berfeaii - ju tih - sar.ii - serbuk hablur - t'3'j khas - putih - pahit - Serbufc hablur * isau ktes puiih gating - pahit - seris.li t o l a r - ftert-au p jtih - pahit - sertak h c s ljr * t K 'b 3 u 3iitih - pa'ut •y Resfisi Wofr.i ;
i . + fe M ir^ er.c^r STidwy-iin « r a h feta sftdspsn » r a h b it a - - - -x JfeSH 4 * L - FsCLS •-* * U n jt i'; sfiiim kupritsrtrst w csr * a ir saling '2 ;6 ; eers1; ungi; ur^u ■Jterafc J/igU UTiQU iiiijtj kf a^'shars itfsgu ke aerahan Kf&fc ufiga hijau ku rung dari coU at se teU h 30* serah un §u hi j&i ku dan coklat setelah 30 biru *id i bird au va
4. * Hfic c:a si£ l -A r-Aj
- - - . iu j ali Mjait -
2. P e n e ntuan nilai pK
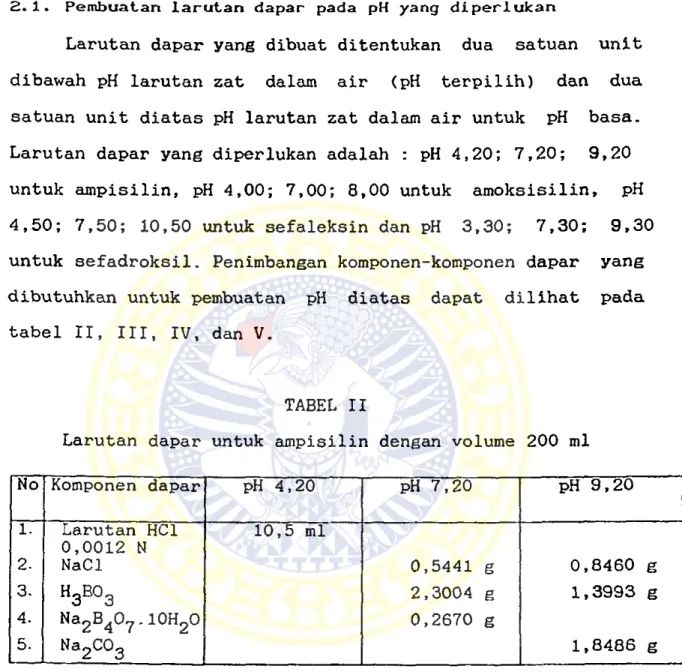
2.1. Pembuatan larutan dapar pada pH yang diperlukan
Larutan dapar yang dibuat ditentukan dua satuan unit
dibawah pH larutan zat dalam air (pH terpilih) dan dua
satuan unit diatas pH larutan zat dalam air untuk pH basa.
Larutan dapar yang diperlukan adalah : pH 4,20; 7,20; 9,20
untuk ampisilin, pH 4,00; 7,00; 8,00 untuk amoksisilin, pH
4,50; 7,50; 10,50 untuk sefaleksin dan pH 3,30; 7,30; 9,30
untuk sefadroksil. Penimbangan komponen-komponen dapar yang
dibutuhkan untuk pembuatan pH diatas dapat dilihat pada
tabel II, III, IV, dan V.
TABEL II
Larutan dapar untuk ampisilin dengan volume 200 ml
No Komponen dapar pH 4,20 pH 7,20 pH 9,20 1. Larutan HC1 10,5 ml 0,0012 N 2- NaCl 0,5441 g 0,8460 g 3. H3B03 2,3004 g 1,3993 g 4. Na2B4°7'l0H2° 0,2670 g 5. Na2c° 3 1,8486 g
43
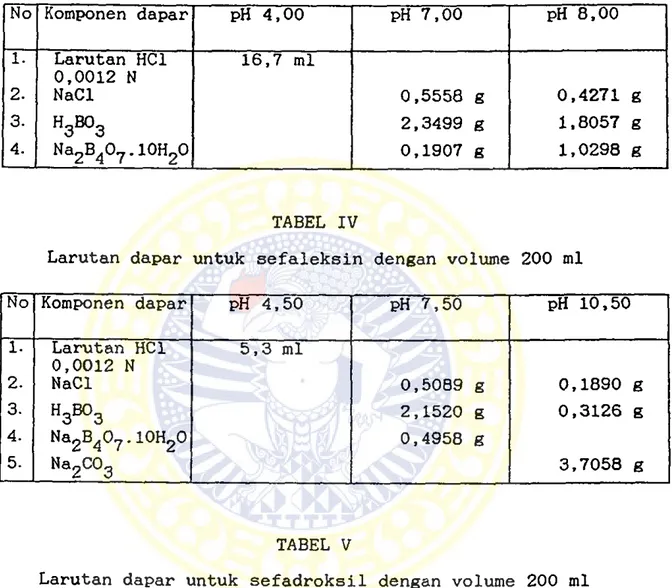
TABEL III
Larutan dapar untuk amoksisilin dengan volume 200 ml
No Komponen dapar pH 4,00 pH 7,00 pH 8,00 1. Larutan HC1 16,7 ml 0,0012 N 2- NaCl 0,5558 g 0,4271 g 3. 2,3499 g 1.8057 g 4. Na2B407 .10H20 0,1907 g 1,0298 g TABEL IV
Larutan dapar untuk sefaleksin dengan volume 200 ml
No Komponen dapar pH 4,50 PH 7,50 pH 10,50 1. Larutan HC1 5,3 ml 0,0012 N 2. NaCl 0,5089 g 0,1890 g 3. 2,1520 g 0,3126 g 4. Na2B40? .10H20 0,4958 g 5. Na2c°3 3,7058 g TABEL V
Larutan dapar untuk sefadroksil dengan volume 200 ml
No Komponen dapar pH 3,30 pH 7,30 pH 9,30 1. Larutan HC1 83,53 ml 0,0012 N 2. NaCl 0,5324 g 0,7958 g 3. 2,2509 g 1,3162 g 4. Na2B40? .10H20 0,3433 g 5. Na2c°3 1,9907 g
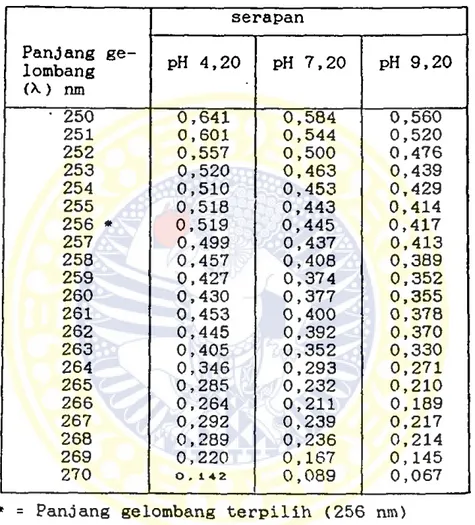
2.2 Penentuan panjang gelombang terpilih
Panjang gelombang terpilih ditentukan pada panjang
gelombang dimana terdapat perbedaan serapan terbesar antara
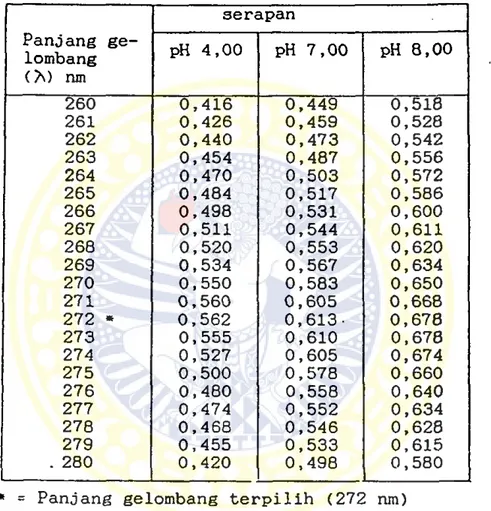
larutan zat dalam suasana asam dan basa.
Data yang diperoleh dari percobaan dapat dilihat pada
tabel VI, VII, VIII dan IX, sedangkan kurva serapannya dapat
dilihat pada gambar 1, 2, 3 dan 4.
Dari kurva serapan terhadap panjang gelombang diperoleh
hasil sebagai berikut : panjang gelombang terpilih dari
larutan ampisilin konsentrasi 600 ppm pada pH 4,20; 7,20;
9,20 adalah 256 nm, panjang gelombang terpilih dari larutan
amoksisilin konsentrasi 207,9 ppm pada pH 4,00; 7,00; 8,00
adalah 272 nm. Sedangkan panjang gelombang terpilih da£i
larutan sefaleksin konsentrasi 30 ppm pada pH 4,50; 7,50;
10,50 adalah 261 nm, panjang gelombang terpilih dari larutan
sefadroksil konsentrasi 31,3 ppm pada pH 3,30; 7,30; 9,30
adalah 262 nm. Selanjutnya serapan zat untuk penentuan nilai
pK masing-masing zat diamati pada panjang gelombang terpilih
45 TABEL VI
Nilai serapan larutan ampisilin konsentrasi 600 ppm pada pH 7,20 dan dalam suasana asam (pH 4,20), suasana basa (pH 9,20) untuk penentuan panjang gelombang (X) terpilih.
Panjang ge lombang (X) nm serapan pH 4,20 pH 7,20 pH 9,20 ■ 250 0,641 0,584 0,560 251 0,601 0,544 0,520 252 0,557 0,500 0,476 253 0,520 0,463 0,439 254 0,510 0,453 0,429 255 0,518 0,443 0,414 256 * 0,519 0,445 0,417 257 0,499 0,437 0,413 258 0,457 0,408 0,389 259 0,427 0,374 0,352 260 0,430 0,377 0,355 261 0,453 0,400 0,378 262 0,445 0,392 0,370 263 0,405 0,352 0,330 264 0,346 0,293 0,271 265 0,285 0,232 0,210 266 0,264 0,211 0,189 267 0,292 0,239 0,217 268 0,289 0,236 0,214 269 0,220 0,167 0,145 270 0.142 0,089 0,067
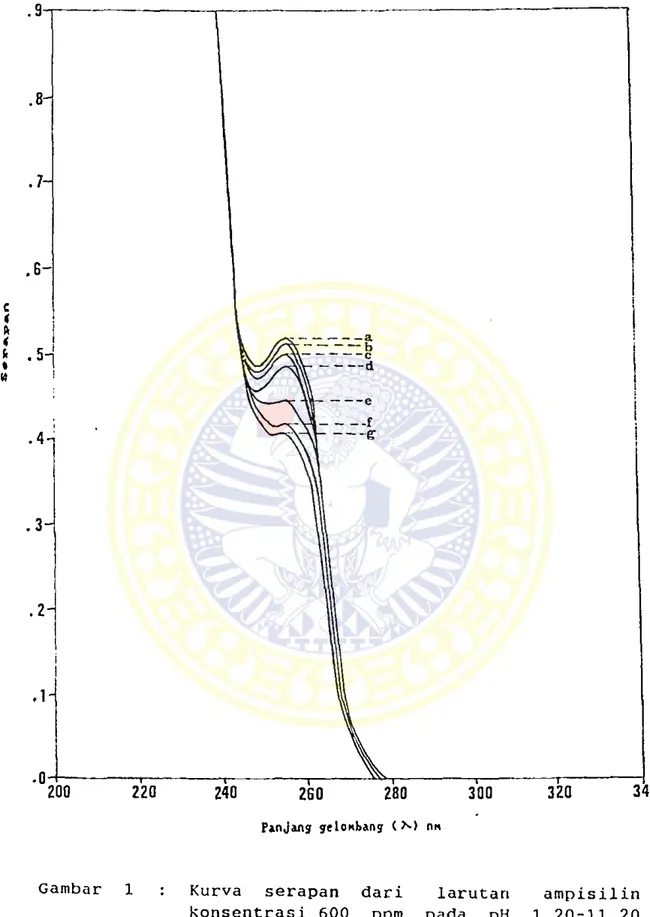
Gambar 1 : Kurva serapan dari larutan ampisilin konsentrasi 600 ppm pada pH 1,20-11,20
47
TABEL VII
Nilai 3erapan larutan amoksisilin konsentrasi 207,9 ppm
pH 7,00 dan dalam suasana asam (pH 4,00), suasana basa
8,00} untuk penentuan panjang gelombang ( M terpilih.
Panjang ge lombang (7\) nm serapan pH 4,00 pH 7,00 pH 8,00 260 0,416 0,449 0,518 261 0,426 0,459 0,528 262 0,440 0,473 0,542 263 0,454 0,487 0,556 264 0,470 0,503 0,572 265 0,484 0,517 0,586 266 0,498 0,531 0,600 267 0,511 0,544 0,611 268 0,520 0,553 0,620 269 0,534 0,567 0,634 270 0,550 0,583 0,650 271 0,560 0,605 0,668 272 » 0,562 0,613- 0,678 273 0,555 0,610 0,678 274 0,527 0,605 0,674 275 0,500 0,578 0,660 276 0,480 0,558 0,640 277 0,474 0,552 0,634 278 0,468 0,546 0,628 279 0,455 0,533 0,615 . 280 0,420 0,498 0,580 pada (pH
Gambar 2 : Kurva serapan dari larutan amoksisilin konsetrasi 207,9 ppm pada pH 1,00-11,00
49
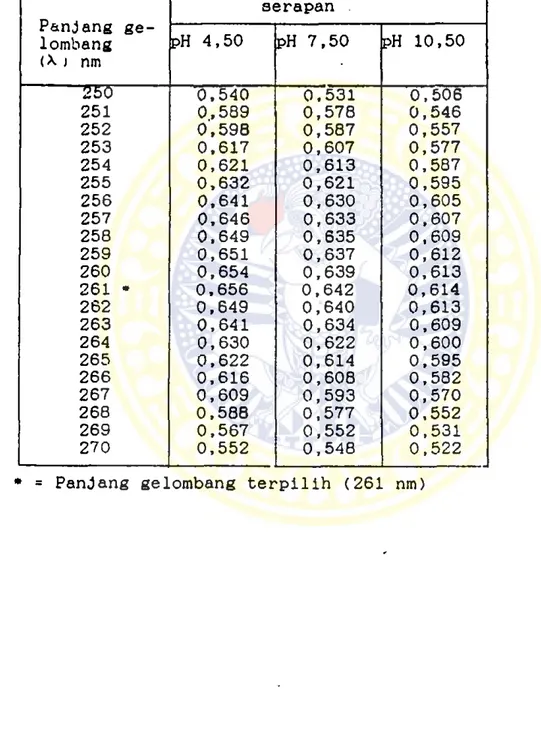
TABEL VIII
Nilai serapan larutan sefaleksin konsentrasi 30 ppm pada pH
7,50 dan dalam suasana asam (pH 4,50), suasana basa (pH
10,50) untuk penentuan panjang gelombang (X) terpilih
Panjang ge lombang (X j nm serapan pH 4,50 pH 7,50 pH 10,50 0,540 0.531 0,506 251 0,589 0,578 0,546 252 0,598 0,587 0,557 253 0,617 0,607 0,577 254 0,621 0,613 0,587 255 0,632 0,621 0,595 256 0,641 0,630 0,605 257 0,646 0,633 0,607 258 0,649 0,635 0,609 259 0,651 0,637 0,612 260 0,654 0,639 0,613 261 * 0,656 0,642 0,614 262 0,649 0,640 0,613 263 0,641 0,634 0,609 264 0,630 0,622 0,600 265 0,622 0,614 0,595 266 0,616 0,608 0,582 267 0,609 0,593 0,570 268 0,588 0,577 0,552 269 0,567 0,552 0,531 270 0,552 0,548 0,522
•Panjanj greloxbansr <>■) nn
Gambar 3 : Kurva serap a n dari larutan sefaleksin
konsentrasi 30 ppm pada pH 1,50-11,50 pada panjang gelombang (X) terpilih 261 n m .