PEMBUATAN GAS KLORIN (Cl2) DAN NATRIUM HIDROKSIDA (Naoh)
DARI HASIL PEMURNIAN GARAM JANGKA ACEH: Artikel Review Ridwan*), Halim Zaini*)
ABSTRAK
Garam Jangka mengandung NaCl, CaCl2, MgCl2, CaSO4, MgSO4, Na2SO4, H2O, debu, tanah, dan pasir
halus dengan kadar NaCl kurang dari 78%, tergolong garam kualitas rendah. Garam ini dapat ditingkatkan kadar NaClnya hingga 92% -100% melalui pemurnian bertahap secara fisika, kimia, serta dengan resin penukar ion, menghasilkan garam kualitas tinggi. Salah satu keuntungan garam berkualitas tinggi adalah dapat digunakan sebagai bahan baku pembuatan gas klorin dan natrium hidroksida melalui proses elektrolisis. Hasilnya dapat digunakan pada berbagai industri sebagai bahan pengolahan air bersih, pembuatan sabun, plastik, industri kertas, dan industri kimia lainnya.
Kata kunci: Gas klorin, natrium hidroksida, garam, pemurnian, elektrolisis.
PENDAHULUAN
Sebagian besar wilayah Indonesia terdiri dari laut yang mengandung garam NaCl dengan kadar tertentu. Garam tersebut belum dimanfaatkan secara maksimal baik untuk konsumsi rumah tangga maupun untuk industri. Kebutuhan garam yang berkualitas tinggi dengan kadar NaCl antara 92% - 100% untuk bahan baku industri kimia masih tergantung dari luar negeri.
Industri garam dalam negeri seperti garam yang berasal dari garam rakyat Jangka Kabupaten Aceh Utara Nanggroe Aceh Darussalam (NAD), jika dikembangkan ke arah produk yang berkualitas tinggi akan mempunyai prospek cerah serta dapat memasok kebutuhan lokal dan eksport. Garam berkualitas tinggi hasil pemurnian garam seperti garam Jangka dapat dimanfaatkan sebagai bahan baku pembuatan gas klorin dan natrium hidroksida. Pada industri, gas klor dan NaOH dibutuhkan untuk berbagai keperluan seperti pada industri pulp, industri air bersih, industri bahan-bahan pembersih, industri
sabun, mentega, industri obat-obatan hama tanaman dan lainnya.
JENIS GARAM DAN PENGGUNAANNYA Menurut Prayitno (1999), produk garam dapat dikembangkan menjadi berbagai jenis produk seperti garam curah, briket, garam meja, garam industri makanan, garam untuk pengeboran minyak, garam industri farmasi dan laboratorium. Penggunaan garam yang bermutu tinggi seperti garam industri adalah untuk bahan baku pembuatan gas klor (Cl2), natrium hidroksida
(NaOH), dan kaporit (NaOCl).
Garam lokal yang berasal dari industri garam di Madura Jawa Timur yang telah lama digunakan oleh PT. Kertas Leces untuk bahan baku proses klor alkali sebelum digunakan, terlebih dahulu mengalami proses pemurnian fisika, kimia, dan proses pertukaran ion, dapat digunakan untuk bahan baku proses elektrolisis dengan spesifikasinya dapat ditampilkan pada Tabel 1 dan Tabel 2.
Tabel 1. Spesifikasi larutan garam industri untuk proses elektrolisis
No Nama Komponen Rumus Kimia Kadar (%) Keterangan
1. 2. 3. 4. 5. Natrium klorida Kadar kalsium Kadar magnesium Kadar sulfat Zat tak larut
NaCl Ca++ Mg++ SO4= CaCl2 100 < 0.20 ppm < 0.20 ppm 0.00 0.00 Sekitar Maksimal Maksimal Nihil Nihil Sumber: Unit Chlor Alkali Plant PT. Kertas Leces, 1997
Tabel 2. Spesifikasi garam industri untuk proses elektrolisis
No Nama Komponen Rumus Kimia Kadar (%) Keterangan 1. 2. 3. 4. 5. Natrium klorida Kadar air Kadar kalsium Kadar magnesium Kadar sulfat NaCl H2O Ca++ Mg++ SO4= > 98.50 < 4.00 < 0.10 < 0.06 < 0.20 Minimal Maksimal Maksimal Maksimal Maksimal Sumber: Prayitno, 1999, Spesifikasi pada SII atau SNI no. 139 – 76
Reaksi Elektrolisa
Garam yang sudah mengalami proses pemurnian dapat diuraikan secara proses elektrolisis menghasilkan gas Cl2 dan NaOH.
Reaksi elektrolisis berlangsung dengan memanfaatkan energi listrik melalui elektroda-elektroda menguraikan natrium klorida dengan reaksi:
Anoda: Oksidasi: 2 Cl- Cl2 + 2 e- Eo oks = - 1.36 V (1)
2 H2O O2(g) + 4H+ + 4e- Eo oks = - 1.23 V (2)
Katoda: Reduksi: 2 Na+ + 2 e- 2 Na(p) Eored = - 2.71 V (3) 2 H2O + 2 e
H2(g) + 2 OH
Eored = - 0.83 V (4) Potensial elektroda untuk setengah reaksi (1) dan
(2) sama besarnya. Harga yang tepat tergantung pada konsentrasi Cl- dalam satu persamaan dan konsentrasi H+ dalam persamaan yang lain. Bila larutan NaCl dipekatkan, cenderung terjadi setengah-reaksi (1); bila sangat encer terjadi reaksi (2). Sejauh masih berhubungan dengan setengah-reaksi reduksi, reduksi air terjadi lebih mungkin daripada Na+ dan umumnya hanya setengah-reaksi (4) yang terjadi.
Pembuatan Gas Cl2 dan NaOH
Larutan garam NaCl yang sudah murni bersumber dari garam Lam Cok atau garam Jangka (mendekati kadar 100 %) dipergunakan
sebagai bahan baku pembuatan gas klor (Cl2) dan
natrium hidroksida (NaOH) melalui proses elektrolisis. Menurut Eni (1989) pengaliran arus listrik ke dalam sel elektrokimia yang berisi larutan elektrolit akan terjadi reaksi kimia, larutan garam NaCl akan mengalami elektrolisis menghasilkan gas klor (Cl2) dan soda (NaOH).
Reaksi elektrokimia memerlukan sepasang elektroda, anoda dan katoda. Elektroda dipisahkan oleh selaput pemisah atau membran.
Pembuatan gas klorin - alkali dari larutan NaCl, merupakan proses elektrolisis menggunakan larutan NaCl pekat dan menurut Hiskia Ahmad (2001) reaksi yang terjadi sebagai berikut:
Anoda: Oksidasi: 2 Cl- Cl2 + 2 e- Eo oks = - 1.36 V (1)
Katoda:Reduksi: 2 H2O + 2 e- H2(g) + 2 OH- Eored = - 0.83 V (4) +
Reaksi: 2 Cl-(aq) + 2 H2O 2 OH-(aq) + H2(g) + Cl2(g) Eosel = - 2.19 V
Sumber ion klorida adalah NaCl, hasil reaksi selain gas hidrogen (H2) adalah gas klor (Cl2) dan
alkali NaOH. Proses yang menghasilkan produk ini dinamakan proses klor – alkali, lebih jelasnya dapat dilihat pada Gambar 1.
Menurut Petrucci dan Suminar (1989), salah satu sel elektrolisa klor alkali adalah sel diafragma. Sel ini terdiri dari sebuah ruangan anoda, tempat gas klor (Cl2) diproduksi, dan
sebuah ruangan katoda tempat gas hidrogen (H2)
dan NaOH(aq) diproduksi. Gas klor dan hidrogen harus dipisahkan, sebab kedua gas tersebut bila tercampur dapat meledak. Kontak antara Cl2 dan
NaOH(aq) harus juga dicegah. Pencegahan ini
diatasi dengan suatu penyekat atau pembatas yang disebut diafragma. Bila gas Cl2 dan NaOH(aq)
bercampur akan membentuk senyawa NaOCl dan NaClO3.
Perbedaan dalam permukaan larutan dipertahankan sedemikan rupa sehingga natrium klorida NaCl(aq) mengalir perlahan dari ruangan anoda ke katoda. Hal ini mengurangi aliran balik dari natrium hidroksida NaOH(aq) ke dalam ruangan anoda. Larutan dari ruangan katoda harus dipekatkan dengan penguapan air dan pemurnian dengan pengkristalan NaCl(p). Hasil akhir dalam proses klor-alkali adalah cairan soda dengan
kadar 50% NaOH(aq) dan gas klor (Cl2) dengan sekitar 1% NaCl berupa residu. + - I I I I I Cl2 (g) H2(g) OOO OOOOO OOO OOOOO OOOO O O
NaCl(aq) NaCl(aq) + NaOH(aq)
ANODA KATODA
Gambar 1. Sketsa sel elektrolisa klor alkali
PEMURNIAN GARAM
Garam Jangka belum layak dikonsumsi sebagai bahan baku industri kimia sehingga terlebih dahulu harus dimurnikan melalui berbagai tahapan proses secara reaksi kimia dan pemisahan secara fisik karena masih mengandung bahan-bahan selain NaCl seperti garam Ca, Mg. Pada proses soda elektrolisis bahan baku mengandung NaCl 92 – 98 %.
Pemurnian Garam Secara Fisika
Garam Jangka yang tergolong tinggi kadar impuritiesnya dimurnikan dengan penyaringan larutan garam, yang tertahan pada saringan sebagai pengotor, sedangkan yang lolos saringan direkristalisasi untuk mendapatkan garam yang lebih murni. Cara ini tidak dapat memisahkan komponen-komponen garam yang tidak saling bercampur secara fisik. Komponen kimia garam yang saling bercampur tidak terpisah seperti Ca++, Mg++, dan SO4= masih tetap ada dalam kristal atau larutan garam. Menurut
Syafruddin, dkk (2002), garam lokal Lam Chok dan Jangka Aceh Utara yang dimurnikan secara filtrasi (fisika) dapat menghasilkan kadar garam NaCl sekitar 94 s/d 98 %.
Perbandingan kualitas garam Lam Cok dan garam Jangka dengan garam lokal yang berasal dari Madura dengan spesifikasinya yang digunakan oleh PT. Kertas Leces dapat dilihat pada Tabel 3 dan Tabel 4.
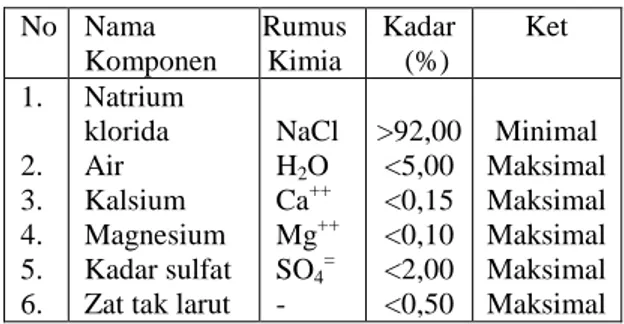
Tabel 3. Spesifikasi garam lokal (Madura) untuk PT.Kertas Leces No Nama Komponen Rumus Kimia Kadar (%) Ket 1. 2. 3. 4. 5. 6. Natrium klorida Air Kalsium Magnesium Kadar sulfat Zat tak larut
NaCl H2O Ca++ Mg++ SO4= - >92,00 <5,00 <0,15 <0,10 <2,00 <0,50 Minimal Maksimal Maksimal Maksimal Maksimal Maksimal Sumber: Unit CAP PT.Kertas Leces, 1997.
Tabel 4. Spesifikasi garam lokal (Madura) untuk PT.Kertas Leces
No Nama Komponen Rumus Kimia Kadar (%) Keterangan
1. 2. 3. 4. 5. 6. 7. Natrium klorida Magnesium klorida Magnesium sulfat Kalsium sulfat Natrium sulfat Kalsium klorida Zat tak larut
NaCl MgCl2 MgSO4 CaSO4 Na2SO4 CaCl2 - > 92.00 < 1.85 < 0.51 < 0.41 < 2.01 < 0.22 < 3.00 Minimal Maksimal Maksimal Maksimal Maksimal Maksimal Maksimal Sumber: Laporan PKL TK-UGM PT.Kertas Leces, 1997.
Pemurnian Garam Secara Kimia
Larutan garam selain NaCl seperti Ca++, Mg++, dan SO4 = diminimalisasikan atau diendapkan dengan penambahan senyawa kimia tertentu, seperti Na2CO3, dan BaCl2. Reaksi
pengendapan merupakan cara yang sangat berharga untuk memisahkan suatu sampel menjadi bagian-bagian komponen-komponennya.
Bahan yang tertahan pada filtrasi adalah zat yang akan dipisahkan digunakan untuk membuat suatu fasa baru yaitu endapan padatan, sedangkan filtratnya adalah larutan garam natrium klorida yang telah mengalami proses pemurnian primer. (Day and Underwood: 1990).
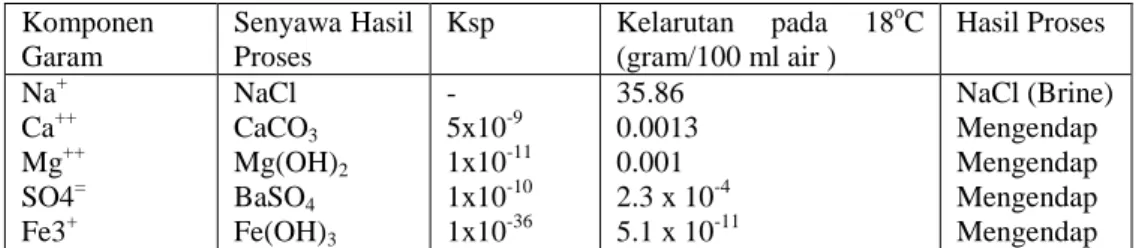
Tabel 5. Hasil kali kelarutan dan kelarutan beberapa garam Komponen Garam Senyawa Hasil Proses Ksp Kelarutan pada 18oC (gram/100 ml air ) Hasil Proses Na+ Ca++ Mg++ SO4= Fe3+ NaCl CaCO3 Mg(OH)2 BaSO4 Fe(OH)3 - 5x10-9 1x10-11 1x10-10 1x10-36 35.86 0.0013 0.001 2.3 x 10-4 5.1 x 10-11 NaCl (Brine) Mengendap Mengendap Mengendap Mengendap Sumber: Vogel , 1985, dan Day and Underwood, 1990
Menurut Vogel, 1985, terjadi reaksi pengendapan dari ion-ion komponen garam yang
berbentuk larutan dalam suatu bejana (reaktor) pengendapan sebagai berikut:
Ca++ + Na2CO3 CaCO3 + 2Na+
Mg++ + 2NaOH Mg(OH)2 + 2Na+
SO4= + BaCl2 BaSO4 + 2Cl-
Fe3+ + 3NaOH Fe(OH)3 + 3Na+
Garam-garam ini dapat mengendap karena hasil kali kelarutan (Ksp) dan kelarutannya sangat kecil dibandingkan garam NaCl yang kelarutannya jauh lebih besar, sehingga garam NaCl dapat dimurnikan.
Semua senyawa yang terbentuk seperti kalsium karbonat, magnesium hidroksida, barium sulfat, dan besi hidroksida mengendap, sehingga kadar ion-ion tersebut berkurang. Untuk lebih memaksimalkan pengendapan ion-ion impurities maka dilakukan penambahan pengendap berlebih, NaOH berlebih 0,5 –1,0 gram/liter, Na2CO3
berlebih 0,5 –1,0 gram/liter.
Pemurnian Garam dengan Resin Penukar Ion Pemurnian lanjutan dilakukan pada kolom resin penukar ion (ion exchanger). Resin diperlukan untuk mengikat ion-ion yang tidak
dikehendaki yang masih tersisa pada proses pemurnian primer. Larutan garam yang keluar dari ion exchanger kandungan Ca++ dan Mg++ masing-masing harus kurang dari 0,2 ppm. Bila melebihi angka tersebut segera dilakukan pencucian resin. Untuk mengaktifkan resin, diperlukan air demineral yang dialirkan dari bawah kolom resin, HCl 4 % dialirkan dari atas kolom resin kemudian ditiriskan sampai habis, air demineral dialirkan ditiriskan sampai habis, dicuci dengan NaOH 5 %, selanjutnya dialirkan air demineral lagi dan dibilas sekali lagi dengan air demineral.
Reaksi pertukaran ion dilakukan sampai dipenuhi persyaratan kandungan Ca++ dan Mg++ masing-masing harus kurang dari 0,2 ppm dan reaksi yang terjadi selama pencucian adalah sebagai berikut:
Pencucian Resin: 2 R-Na+ + Ca++ R2Ca
Regenerasi Resin: R2Ca + HCl R-H
Reversi (pengaktifan) Resin: 2 R-H + 2 NaOH 2 R-Na+ + 2 H2O
PEMBAHASAN
Pemurnian garam lokal yang bersumber dari Lam Cok dan Jangka secara fisika hanya
dapat memisahkan komponen-komponen pengotor garam seperti debu, tanah, dan pasir dapat menghasilkan NaCl dengan kadar 94 % - 98%. Hal ini lebih baik dibandingkan dengan
garam yang berasal dari Madura dengan kadar NaCl-nya hanya mencapai 92%. Dengan metode ini komponen kimia yang masih tercampur dengan NaCl seperti garam-garam CaCl2, MgCl2,
CaSO4, MgSO4, dan Na2SO4, tidak dapat
dipisahkan dan masih bergabung dengan NaCl. Garam-garam CaCl2, MgCl2, CaSO4,
MgSO4, dan Na2SO4 yang terkandung dalam
larutan garam Jangka dapat dipisahkan secara kimia melalui proses pengendapan. Pengendapan dilakukan dengan menambahkan bahan kimia pengendap yang sesuai untuk masing-masing garam yang akan dipisahkan. Pemisahan menghasilkan kadar NaCl di atas 99%.
Untuk mereduksi bahan-bahan kimia pengotor yang masih terkandung dalam larutan garam dengan kadar NaCl di atas 99% dapat dilakukan dengan proses pertukaran ion (ion exchange) pada kolom resin. Pada proses ini kadar pengotor yang tersisa berupa logam Ca dan Mg dapat direduksi hingga kadarnya tersisa dalam larutan di bawah 0,2 ppm.
Larutan garam NaCl dengan kadar Ca dan Mg 0,2 ppm yang telah murni dengan kandungan pengotor di bawah 0,2 ppm selanjutnya dapat digunakan sebagai bahan baku untuk pembuatan gas klorin (Cl2) dan natrium
hidroksida (NaOH) melalui proses elektrolisis. Pembuatan gas klorin dan NaOH dari larutan garam NaCl dengan kadar Ca dan Mg dibawah 0,2 ppm dengan sel elektrolisis akan berlangsung secara kontinu dengan pembatasan atau pemisahan produk yang terjadi antara gas klorin dan NaOH tidak boleh terjadi kontak langsung satu dengan lainnya. Jika terjadi kontak langsung gas klorin dan NaOH dapat menimbulkan ledakan yang dahsyat, karena dapat membentuk bahan oksidator sperti NaOCl dan NaOCl3. Hasil akhir proses klor alkali
menghasikan kadar NaOH 50% dan gas Klorin serta sisa larutan garam NaCl sebesar 1%.
Garam Jangka Aceh Utara dengan kadar garam 94 % - 98% secara ekonomis tidak kalah kualitasnya dibandingkan dengan garam lokal yang berasal dari Madura dengan kadar garamnya sekitar 92%. Namun kemungkinan kendalanya terletak pada kuantitas produksinya yang masih rendah dibandingkan dengan garam yang diproduksi di Madura. Meskipun demikian untuk perkembangan industri dalam negeri sudah sepantasnya mengembangkan industri yang berbasis bahan baku lokal.
KESIMPULAN
1. Pembuatan gas klor (Cl2) dan natrium
hidroksida (NaOH) dari garam industri lokal hasil proses rekristalisasi, dapat dilakukan setelah garam tersebut dilakukan pemurnian primer dan sekunder, sehingga dihasilkan NaCl dengan kadar 100%.
2. Pembuatan gas klor (Cl2) dan natrium
hidroksida dari bahan baku garam rakyat dari industri lokal (Jangka dan Lam Cok) dapat dilakukan dengan proses elektrolisis.
3. Proses elektrolis larutan garam NaCl dengan kadar 100% menghasikan larutan 50% NaOH dan gas klorin (Cl2), serta 1% sisa larutan
garam NaCl. DAFTAR PUSTAKA
Ahmad, Hiskia, 2001, Reaksi Redoks dan Sel Elektrokimia, Praktikum Kimia Dasar, http://alat.dikit.org/lab/kidas/lima.htm. Austin, G.T., dan Jasjfi, E, 1996, Industri Proses
Kimia, edisi 5, jilid I, Penerbit Erlangga, Jakarta.
Christensen, K, 1991, Pulp Technology, Trondein, John Willey, New York.
Petrucci, RH dan Suminar, 1989, Kimia Dasar Prinsip dan Terapan Modern, Edisi 4, Jilid 3, Penerbit Erlangga, Jakarta.
PT.Kertas Leces, 1997, Sistem & Manajemen Mutu Dalam Produksi pada Unit CAP. Prayitno, 1999, Proses Pemurnian Garam Untuk
Garam Konsumsi Mutu Tinggi, J. BISTEK, edisi no. 07 / Th.VII / April, Politeknik Unibraw Malang.
Syafruddin, Ratni Dewi, 2002, Pemurnian Garam Rakyat Untuk Meningkatkan Konsentrasi NaCl, Politeknik Negeri Lhokseumawe-Depdiknas.
Universitas Gajah Mada, 1995, Laporan Praktek Kerja Lapangan (PKL) Mahasiswa FT/Teknik Kimia, PT.Kertas Leces. ---.1989., Ensiklopedi Indonesia (ENI)
Elektrokimia, Jakarta, hal: 68.
Vogel, Svehla, G, 1985, Buku Teks Analisis An Organik Kualitatif Makro dan Semi Mikro, edisi 5, bagian I, PT. Kalman Media Pustaka, Jakarta.