STUDI BIOEKIVALENSI AMOKSISILIN GENERIK DAN DAGANG
MENGGUNAKAN MATRIKS URIN
BIOEQUIVALENT STUDY OF GENERIC AND BRANDED AMOXICILLIN
USING URIN MATRIX
Elly Wahyudin, Tadjuddin Naid dan Dwi Wahyuni Leboe
Fakultas Farmasi Universitas Hasanuddin Makassar
Alamat Korespondensi
Dwi wahyuni
Fakultas farmasi
Universitas hasanuddin
Makassar 90245
HP. 085242550032
ABSTRAK
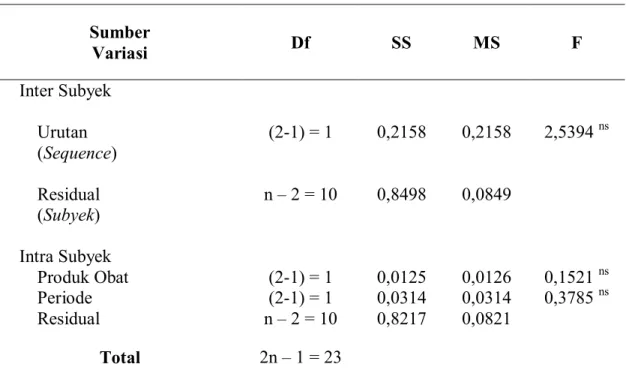
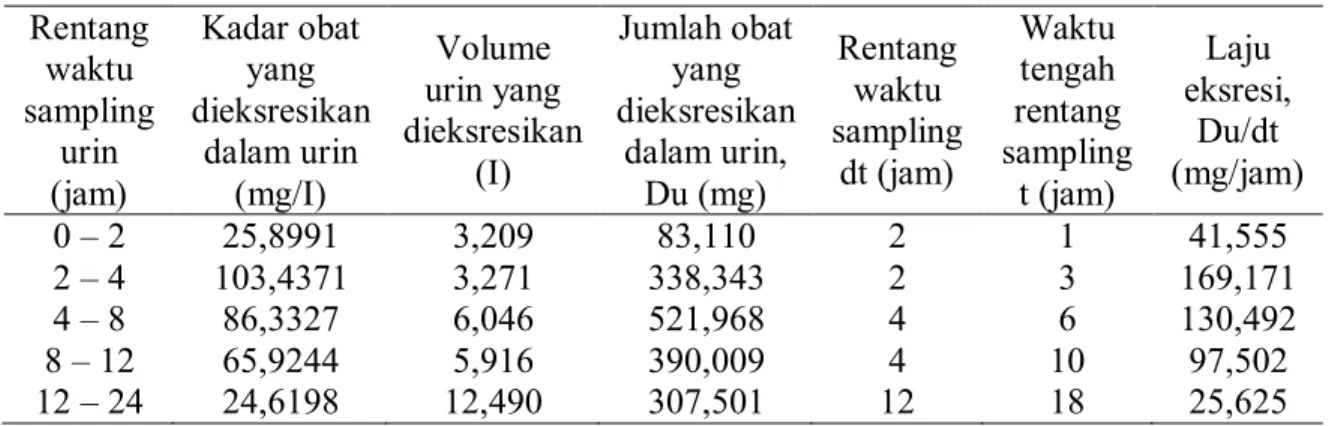
Telah dilakukan studi bioekivalensi amoksisilin yang berasal dari obat generik (OGB) sebagai produk uji dengan obat dagang sebagai pembanding menggunakan matriks urin. Tujuan penelitian ini ialah mengukur parameter bioavailabilitas berdasarkan urin 24 jam, sehingga diketahui bioekivalen atau bioinekivalen.Berdasarkan pendekatan obat generik yang murah dan bermutu, serta mengacu pada pedoman uji bioekivalensi BPOM RI maka penelitian ini menggunakan 12 orang sehat berusia 18 -21 tahun sebagai subyek. Desain penelitian adalah desain menyilang 2 arah ( 2 way) untuk 2 periode perlakuan pada 2 produk obat, demikian dengan pemilihan matriks urin 24 jam dan penetapan kadar amoksisilin secara spektrofotometri UV Vis pada panjang gelombang 273 nm, sedangkan parameter bioavailabilitas ditetapkan dengan menggunakan kadar profil kadar amoksisilin kumulatif dalam urin 24 jam dan laju ekskresinya.Hasil nilai rasio rata-rata geometrik dan rasio CI 90% berdasarkan kadar amoksisilin kumulatif adalah 104,67% dan 117,65%, sedangkan berdasarkan laju ekskresi amoksisilin dalam urin 24 jam adalah 105,23% dan 118,29% semua berada dalam rentang 80-125% sebagai obat dengan indeks terapi yang luas.Berarti produk amoksisilin generik (OGB) yang diteliti bioekivalen dengan produk amoksisilin dagang.
Kata Kunci: Bioekivalensi, Amoksisilin, Urin.
ABSTRACT
Bioequivalencestudies of amoxicillin which derivedfromgenericdrugs(OGB) had been done as aproducttest withbranded amoxicillinas a comparisonusing urinematrix. The purposeof this studyis tomeasure thebioavailabilityparametersbased on24 hours urine, so itis known as bioequivalentorbioinequivalent.Based onapproach to cheap and quality generic drugs, and referring to the BPOM RI guidelines forbioequivalence, so this studyusing 12healthy peopleaged 18-21years as asubject. The study designis the designcrossedtwo-way (2way)for 2periods oftreatmentintwodrug products, according to the selection of 24-hoururine matrix and determination of amoxicillin level by spectrophotometry UV at wavelength of273 nm, whereas thebioavailabilityparametersdeterminedby using the cumulative profile ofamoxicillin in the 24 hours urine andthe rate ofexcretion.The results ofthegeometric mean and ratio CI 90%based oncumulativelevels ofamoxicillinwere104.67% and117.65%, while based onthe rate of amoxicillin excretion in 24 hours urineis105.23% and118.29%. Allwithin the range80-125% as a drugwitha broadtherapeutic index.Means that amoxicillingenericproduct(OGB) which had been studied is bioequivalenwith the productbranded amoxicillin. Key words : Bioequivalence, amoxicillin, urine