i SKRIPSI
SINTESIS ZEOLIT NaP DARI KAOLIN: PENGARUH WAKTU LEACHING KAOLIN
SITI AMINAH NRP. 1413 100 103
Dosen Pembimbing
Prof. Dr. Didik Prasetyoko, M. Sc.
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT TEKNOLOGI SEPULUH NOPEMBER
ii SCRIPT
SYNTHESIS OF ZEOLITE NaP FROM KAOLIN: THE EFFECT OF KAOLIN LEACHING TIME
SITI AMINAH NRP. 1413 100 103
Supervisor
Prof. Dr. Didik Prasetyoko, M. Sc.
DEPARTEMENT OF CHEMISTRY
FACULTY OF MATHEMATICS AND SCIENCES SEPULUH INSTITUT TEKNOLOGI SEPULUH NOPEMBER
iii
SINTESIS ZEOLIT NaP DARI KAOLIN: PENGARUH WAKTU LEACHING KAOLIN
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Sains
pada
Program Studi S-1 Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Teknologi Sepuluh Nopember
Oleh: SITI AMINAH NRP. 1413 100 103
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT TEKNOLOGI SEPULUH NOPEMBER
iv
v
SINTESIS ZEOLIT NaP DARI KAOLIN: PENGARUH WAKTU LEACHING KAOLIN
Nama : Siti Aminah
NRP : 1413100103
Departemen : Kimia FMIPA-ITS
Dosen Pembimbing : Prof. Dr. Didik Prasetyoko, M.Sc.
Abstrak
Penelitian ini bertujuan untuk mengetahui pengaruh waktu leaching kaolin terhadap sintesis zeolit NaP. Padatan hasil leaching kaolin dikarakterisasi dengan XRF (X-ray Flourosence) dan
padatan hasil sintesis dikarakterisasi dengan spektroskopi inframerah (FTIR), difraksi sinar-X (XRD), dan Scanning Electron Microscopy–Energy Dispersive X-ray (SEM-EDX). Hasil karakterisasi XRF menunjukan bahwa rasio Si/Al pada waktu leaching 4, 8, dan 12 jam mengalami peningkatan dari 1,53 menjadi 2,82; 3,18; dan 3,68. Hasil karakterisasi XRD dan FTIR menunjukan bahwa zeolit NaP terbentuk pada waktu leaching dan hidrotermal masing-masing 4 dan 72 jam. Fase sodalit terbentuk pada waktu leaching dan hidrotermal masing-masing 4 dan 12-48 jam. Sedangkan pada sintesis zeolit NaP dengan variasi leaching 8 dan 12 jam masih terdapat fase lain yaitu zeolit NaY.
Kata kunci: Zeolit NaP, zeolit NaY, sodalit, kaolin, leaching,
vi
SYNTHESIS OF ZEOLITE NaP FROM KAOLIN: THE EFFECT OF KAOLIN LEACHING TIME
Name : Siti Aminah
NRP : 1413100103
Department : Chemistry -ITS
Supervisor : Prof. Dr. Didik Prasetyoko, M.Sc.
Abstract
The purpose of this research is to study the effect of kaolin leaching time on the synthesis of zeolite NaP. Solid products of leached kaolin were characterized with XRF (X-ray Flourosence) and solid products of synthesized were characterized with infrared spectroscopy (FTIR), X-ray diffraction (XRD) and Scanning Electron Microscopy-Energy Dispersive X-ray (SEM-EDX). The result of XRF characterization indicate that ratio of Si/Al for kaolin leached time 4, 8, and 12 hours increased from 1,53 to 2,82; 3,18; dan 3,68. The result of XRD and FTIR characterization show that the zeolite NaP formed with 4 hours kaolin leached and hydrothermal time of 72 hours. Phase impurities sodalite formed in 12-48 hours. There was some impurity on the synthesized for 8 and 12 hours kaolin leached like zeolite NaY.
vii
KATA PENGANTAR
Puji syukur kehadirat Tuhan Yang Maha Esa yang selalu melimpahkan Rahmat dan Karunia-Nya, sehingga penulis dapat menyelesaikan dengan baik naskah tugas akhir yang berjudul “Sintesis Zeolit NaP dari Kaolin: Pengaruh Waktu Leaching Kaolin”.
Tulisan ini tidak akan terwujud tanpa bantuan, dukungan, doa, serta dorongan semangat dari semua pihak. Penulis sangat berterima kasih kepada:
1. Bapak Prof. Dr. Didik Prasetyoko, M.Sc. selaku dosen pembimbing sekaligus Kepala Departemen Kimia yang telah memberikan pengarahan dan bimbingan selama proses penyusunan naskah tugas akhir ini.
2. Bapak Hamzah Fansuri, S.Si., M.Si., Ph.D. selaku dosen wali yang telah membantu dan membimbing saya dalam hal akademik selama kuliah di Departemen Kimia ITS.
3. Bapak Dr. Djoko Hartanto, M.Si. selaku Kepala Laboratorium Kimia Material dan Energi yang telah memberikan fasilitas selama pengerjaan tugas akhir ini.
4. Kedua orang tua, keluarga besar dan orang-orang yang berjasa dalam hidup saya yang selalu memberikan dukungan, semangat, serta doa yang tiada henti.
5. Teman-teman Kimia angkatan 2013, DPRG, Kemendagri BEM ITS, LPM 1.0, Bidadari Surga, Teman Kostan Blok W20 dan J35 yang telah membantu menyelesaikan naskah ini.
Penulis menyadari bahwa penulisan naskah tugas akhir ini tidak lepas dari kekurangan, oleh karena itu penulis mengharapkan kritik dan saran yang membangun untuk dapat meningkatkan kualitas dan perbaikan. Semoga naskah tugas akhir ini dapat membantu penulis dan pembaca.
viii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Permasalahan ... 4
1.3 Batasan Penelitian ... 4
1.4 Tujuan Penelitian ... 4
1.5 Manfaat ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Kaolin ... 6
2.2 Zeolit ... 9
2.3 Zeolit NaP ... 11
2.3.1 Sintesis Zeolit NaP ... 11
2.3.2 Pengaruh Waktu Hidrotermal ... 12
2.4 Leaching ... 14
2.5 Karakterisasi Padatan ... 16
2.5.1 X-Ray Flourensence (XRF) ... 16
2.5.2 Difraksi sinar-X (X-Ray Diffraction / XRD) ... 17
2.5.3 Spektrokopi Fourier Transform Infrared (FTIR) ... 19
2.5.4 Scanning Electron Microscopy-Enegy Dispersive X-ray (SEM-EDX) ... 21
BAB III METODOLOGI PENELITIAN ... 24
3.1 Alat dan Bahan ... 24
3.1.1 Alat ... 24
3.1.2 Bahan ... 24
ix
3.2.1 Leaching ... 24
3.2.2 Sintesis Zeolit NaP ... 25
3.3 Karakterisasi Hasil Sintesis ... 25
3.3.1 X-ray Flourosence (XRF) ... 25
3.3.2 Difraksi Sinar-X (XRD) ... 25
3.3.3 Spektroskopi Fourier Transform Infrared (FTIR) ... 26
3.3.4 Scanning Electron Microscopy-Enegy Dispersive X-ray (SEM-EDX) ... 26
BAB IV HASIL DAN PEMBAHASAN ... 28
4.1 Leaching ... 28
4.2 Sintesis Zeolit NaP ... 30
4.3 Hasil Karakterisasi Padatan ... 32
4.3.1 Difraksi Sinar-X (XRD) ... 32
4.3.2 Spektroskopi Fourier Transform Infrared (FTIR) ... 43
4.3.3 Scanning Electron Microscopy-Enegy Dispersive X-ray (SEM-EDX) ... 49
BAB V KESIMPULAN ... 52
5.1 Kesimpulan ... 52
5.2 Saran ... 52
DAFTAR PUSTAKA ... 54
LAMPIRAN ... 64
x
DAFTAR GAMBAR
Gambar 2.1 Serbuk kaolin ... 7
Gambar 2.2 Struktur kaolin (Cheng dkk., 2012) ... 8
Gambar 2.3 Kerangka zeolit (Smart dan Moore, 1993) ... 10
Gambar 2.4 Kerangka tipe gismondine (Win, 2004) ... 12
Gambar 2.5 Pengaruh waktu hidrotermal terhadap kristalinitas zeolit NaP (Wang dkk., 2007) ... 13
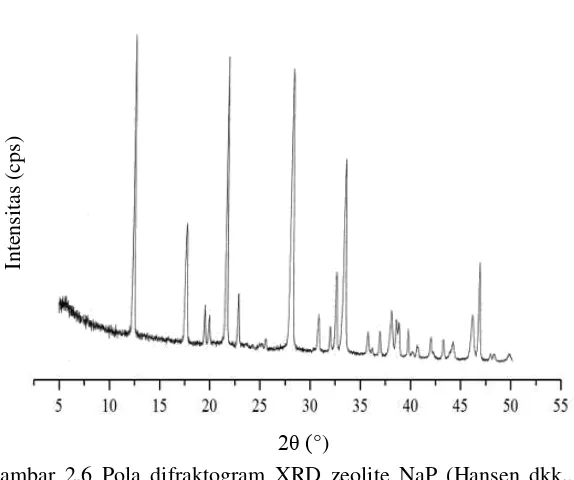
Gambar 2.6 Pola difraktogram XRD zeolite NaP (Hansen dkk., 1993) ... 19
Gambar 2.7 Spektra inframerah zeolit NaP (Bohra dkk., 2013) 21 Gambar 2.8 Mikrograf SEM zeolit NaP (Behin dkk., 2015) ... 23
Gambar 4.1 Aluran hubungan waktu leaching kaolin terhadap rasio Si/Al ... 30
Gambar 4.2 Aluran hubungan persentase rasio berat pada variasi waktu leaching kaolin 4, 8, dan 12 jam terhadap waktu hidrotermal... 32
Gambar 4.3 Pola difraktogram XRD sintesis NaP dengan variasi waktu hidotermal 3, 6, 12, 24, 48 dan 72 jam dan waktu leaching 4 jam ... 33
Gambar 4.4 Aluran waktu hidrotermal terhadap intensitas fase pada variasi leaching 4 jam ... 35
Gambar 4.5 Pola difraktogram XRD sintesis NaP dengan variasi waktu hidotermal 3, 6, 12, 24, 48 dan 72 jam dan waktu leaching 8 jam ... 37
Gambar 4.6 Aluran waktu hidrotermal terhadap intensitas fase pada variasi leaching 8 jam ... 39
xi
Gambar 4.8 Aluran waktu hidrotermal terhadap intensitas fase pada variasi leaching 12 jam ...42 Gambar 4.9 Aluran waktu hidrotermal terhadap intensitas fase
pada setiap variasi waktu leaching ...42 Gambar 4.10 Spektra inframerah kaolin dan hasil sintesis
dengan variasi hidrotermal 3, 6, 12, 24, 48 dan 72 jam dengan waktu leaching 4 jam ...44 Gambar 4.11 Spektra inframerah kaolin dan hasil sintesis
dengan variasi hidrotermal 3, 6, 12, 24, 48 dan 72 jam dengan waktu leaching 8 jam ...45 Gambar 4.12 Spektra inframerah kaolin dan hasil sintesis
dengan variasi hidrotermal 3, 6, 12, 24, 48 dan 72 jam dengan waktu leaching 12 jam ...46 Gambar 4.13 Mikrograf SEM zeolit NaP dengan (a) perbesaran
xii
DAFTAR TABEL
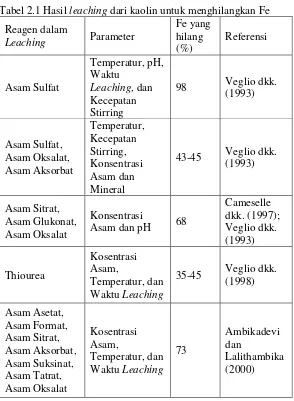
Tabel 2.1 Hasil leaching dari kaolin untuk menghilangkan Fe .. 15 Tabel 4.1 Komposisi dan rasio Si/Al pada kaolin awal dan
leaching kaolin ... 29 Tabel 4.2 Puncak dengan sudut 2θ hasil sintesis dengan variasi
waktu hidrotermal 3, 6, 12, 24, 48 dan 72 jam dan waktu leaching 4 jam ... 34 Tabel 4.3 Puncak dengan sudut 2θ hasil sintesis dengan variasi
waktu hidrotermal 3, 6, 12, 24, 48 dan 72 jam dan waktu leaching 8 jam ... 38 Tabel 4.4 Puncak dengan sudut 2θ hasil sintesis dengan variasi
waktu hidrotermal 3, 6, 12, 24, 48 dan 72 jam dan waktu leaching 12 jam ... 40 Tabel 4.5 Bilangan gelombang puncak serapan spektra
inframerah dengan variasi waktu hidrotermal 3, 6, 12, 24, 48 dan 72 jam dan waktu leaching 4 jam ... 47 Tabel 4.6 Bilangan gelombang puncak serapan spektra
inframerah dengan variasi waktu hidrotermal 3, 6, 12, 24, 48 dan 72 jam dan waktu leaching 8 jam ... 48 Tabel 4.7 Bilangan gelombang puncak serapan spektra
xiii
DAFTAR LAMPIRAN
1 BAB I
PENDAHULUAN
1.1 Latar Belakang
Zeolit merupakan material kristal aluminosilikat hidrat dari logam alkali atau alkali tanah yang saling terhubung dengan adanya atom-atom oksigen, sehingga membentuk kerangka tiga dimensi yang dibentuk oleh tetrahedral [SiO4]4- dan [AlO4]5-serta mengandung rongga-rongga berisi ion logam (Gougazeh dan Buhl, 2013). Rongga tersebut biasanya diisi oleh ion logam alkali atau alkali tanah dan molekul air yang dapat bergerak bebas (Chetam, 1992). Ion logam tersebut menyeimbangkan muatan negatif yang dimiliki oleh [AlO4]5- dan dapat berpindah posisi melalui pertukaran kation (Flanigen dkk., 2010). Zeolit banyak digunakan dalam bidang katalisis heterogen, pemisahan dan pertukaran ion, adsorpsi, dan membran (Huang dkk., 2010).
Zeolit secara alamiah dapat terbentuk di alam yang disebut zeolit alam. Selain zeolit alam, zeolit juga bisa disintesis dari berbagai bahan yang mengandung alumina dan silika. Saat ini, zeolit sintetis lebih banyak digunakan secara komersial daripada zeolit alam karena zeolit sintetis memiliki tingkat kemurnian kristal yang tinggi dan keseragaman ukuran partikel (Breck, 1974; Szoztak, 1998). Sintetis zeolit pertama kali dilakukan oleh peneliti St. Claire-Deville pada tahun 1862, yang diikuti oleh beberapa peneliti lainnya seperti Bassaldella (1990) dan Musyoka (2009). Penelitian sebelumnya telah berhasil mensintesis zeolit, salah satu jenisnya adalah zeolit NaP.
Zeolit NaP merupakan salah satu jenis zeolit yang tersusun dari kerangka (framework) tipe gismondine (GIS) dengan
2
0.49 nm dalam [010] (Albert, 1998). Umumnya, Zeolit NaP disintesis pada suhu antara 70dan 250°C dengan waktu 96 jam (Zobuwa dkk., 2008). Berdasarkan prosedur penelitian Hildrebarando dkk. (2013), sintesis dilakukan pada suhu 100°C selama 60 jam dengan kaolin yang berasal dari Region Amazon sebagai bahan dasar penghasil silika dan alumina. Zeolit NaP memiliki ukuran pori yang lebih kecil daripada zeolit tipe FAU, LTA, dan MF1. Oleh karena itu, zeolite NaP banyak digunakan untuk pemisahan gas molekul kecil (Kakansson, 1990), dapat juga digunakan untuk penghilangan racun dan limbah radioaktif seperti Cs, Sr, Ba, Pb, U, logam berat, ammonium dari air limbah, ekstraksi natrium air laut, dan deterjen ramah lingkungan (Atkins, 1995; Nerry, 2003).
Pada umumnya, sintesis zeolit NaP dilakukan dengan metode kristalisasi secara hidrotermal, yaitu teknik kristalisasi partikel prekursor pada temperatur dan tekanan uap yang tinggi dengan media pelarut air (Lobachev, 1973). Waktu hidrotermal merupakan salah satu faktor penting yang mempengaruhi sintesis zeolit. Semakin lama waktu hidrotermal, kristalinitas produk yang dihasilkan semakin meningkat. Hal ini juga berlaku dalam sintesis zeolit NaP, peningkatan waktu hidrotermal dapat meningkatkan pembentukan fasa zeolit NaP. Hal tersebut sesuai dengan penelitian yang dilakukan oleh Bohra dkk. (2013) dimana zeolit NaP disintesis dari abu sekam padi dengan rasio molar 2,1 Na2O: Al2O3: 3,8 SiO2: 50 H2O melalui proses hidrotermal pada suhu 100°C selama 48-96 jam.
3
menyebabkan biaya produksi yang tinggi. Terdapat alternatif bahan (raw material) lain yang murah dan tersedia melimpah di alam, khususnya di Indonesia. Penelitian tentang sintesis zeolit dari bahan alam sudah banyak dilakukan sebelumnya, misalnya penggunaan abu layang (Molina dan Poole, 2004; Tanaka dkk., 2008; Musyoka dkk., 2013; Belviso dkk., 2014; Jha dan Singh, 2014), kaolin (Mackinnon dkk., 2010; Belviso dkk., 2013), mineral-mineral tanah liat, dan sekam padi. Beberapa bahan alam tersebut merupakan limbah yang banyak mengandung silika dan alumina sehingga dapat dijadikan sebagai bahan baku sintesis zeolit. (Saija dkk., 1983; Querol dkk., 1997; Tanaka dkk., 2004; Adamczyk dan Bialecka, 2005; Walek dkk., 2008; Wang dkk., 2008).
Salah satu sumber daya alam Indonesia yang melimpah yaitu kaolin. Kaolin adalah jenis mineral tanah liat berwarna putih yang mengandung 10-95% mineral dan sebagian besar terdiri dari kaolinit (85-95%), aluminosilikat hidrat dengan komposisi 2H2O: Al2O3: 2SiO2 (Grim, 1968). Kaolin banyak digunakan untuk aplikasi industri, seperti produksi semen, keramik, porselen, bahan kimia, kosmetik, obat-obatan, tekstil, dan yang terbesar adalah untuk industri kertas (Rashad, 2013). Selain itu, kandungan SiO2 dan Al2O3 dalam kaolin juga dapat digunakan sebagai bahan sintesis zeolit (Barrer, 1982).
Penggunaan kaolin sebagai bahan baku (raw material)
4
tersebut diperkuat dengan penelitian yang dilakukan oleh Panda dkk. (2010) dimana kaolin dileaching dengan asam sulfat dengan variasi konsentrasi dan waktu yang berbeda menghasilkan rasio kandungan Si/Al meningkat dari 0,65 menjadi 8,09.
1.2 Permasalahan
Sintesis zeolit NaP menggunakan kaolin sebagai bahan alam yang dimodifikasi agar memenuhi syarat sebagai bahan baku untuk sintesis zeolit NaP. Metode leaching digunakan untuk meningkatkan kandungan Si/Al dari kaolin. Oleh Karena itu, perlu adanya penelitian tentang pengaruh waktu leaching kaolin terhadap rasio Si/Al dari kaolin dan waktu hidrotermal terhadap sintesis zeolit NaP menggunakan kaolin yang telah dileaching. 1.3 Batasan Penelitian
Batasan masalah dalam penelitian ini adalah:
1. Sintesis zeolit NaP menggunakan bahan baku kaolin yang telah dileaching asam sulfat 4 M dengan variasi waktu 4, 8, dan 12 jam.
2. Proses hidrotermal (kristalisasi) dalam sintesis zeolit NaP dilakukan dengan variasi waktu 3, 6, 12, 24, 48, dan 72 jam.
1.4 Tujuan Penelitian
5 1.5 Manfaat
6 BAB II
TINJAUAN PUSTAKA
2.1 Kaolin
Kaolin merupakan nama yang diberikan untuk sebuah bukit dekat Jau-chau Fu, China, dimana kaolin pertama kali ditambang. Nama “kaolin” sendiri berasal dari kata Kau-Ling atau pegunungan tinggi (Sepulveda dkk., 1983). Kaolin, yang biasa disebut tanah liat cina, sebagian besar mengandung kaolinit (10-95%). Selain kaolinit, kaolin biasanya berisi kuarsa dan mika, lebih jarang feldspar, illite, montmorillonite, ilmenit, anastase, hematit, bauksit, zirkon, rutil, kyanit, sillimanite, grafit, atapulgit, dan haloisit (Rees dkk., 1992).
Kaolin merupakan bahan tambang berwujud serbuk berwarna putih. Material ini digunakan sebagai keramik selama berabad-abad yang lalu. Unsur utama pada kaolin adalah air, aluminium, dan silikat dengan komposisi 2H2O.Al2O3.2SiO2. Secara struktur, kaolin mengandung oktahedral alumina, tetrahedral silika, dan mempunyai rumus secara teori (OH)8Si4Al4O10 dengan komposisi secara teori mengandung 46,54% SiO2, 39,5% Al2O3, dan 13,96% H2O (Prasad dkk, 1991).
Proses pembentukan kaolin disebut kaolinization (Grim, 1968). Pembentukan Kaolinit terjadi dalam tiga cara yaitu remukan atau reruntuhan dan transformasi batu karena efek dari faktor iklim (tipe Zettlitz), transformasi batu karena efek hidrotermal (tipe Cornwall), pembentukan oleh efek iklim dan hidrotermal (tipe campuran). Jenis mineral lempung yang terbentuk selama peluruhan batuan yang mengandung silikat aluminium dipengaruhi oleh iklim, rasio Si/Al, dan pH (Parker, 1988).
7
beberapa faktor, seperti kondisi geologi dimana kaolin yang terbentuk dan total komposisi mineralogi deposit kaolin. Kaolin memiliki ukuran sekitar 0,2 sampai 15 µm dengan area spesifik 10.000-29.000 m/kg. Kaolin kasar biasanya digunakan sebagai bahan pengisi (filler) sedangkan kaolin halus sebagai pelapis (coater), barang-barang tahan api dan isolator. Kegunaan kaolin sangat tergantung pada karakteristiknya karena akan berpengaruh terhadap kualitasnya (Rashad, 2013).
Sifat fisik dan kimia kaolin dapat diubah dengan perlakuan termal dan kimiawi. Pada proses kalsinasi kaolin dengan suhu diatas 500°C terjadi penataan ulang ikatan ion Si dan Al serta pembentukan ion Al berkoordinasi 4 dan 5 dengan mengubah Al koordinasi 6. Reaktivitas kaolin meningkat seiring dengan penurunan jumlah Al koordinasi 6. Menurut Prasad dkk. (1991), proses kalsinasi kaolin pada suhu 650-700°C akan memutus ikatan gugus hidroksi dalam struktur kaolin dan melepaskan sejumlah molekul air membentuk fasa amorf yang disebut metakaolin. Sementara itu, kalsinasi kaolin diatas suhu 900°C akan mengubah
8
metakaolin menjadi γ-Al2O3. Metakaolin banyak digunakan sebagai bahan dasar sintesis zeolit karena bersifat semikristalin dan lebih reaktif dibandingkan kaolin. Konversi metakaolin menjadi zeolit melibatkan dua langkah yaitu pembentukan gel aluminosilikat dan nukleasi kristal dan pertumbuhan (Akolekar dkk., 1997). 1x
Struktur kaolinit adalah lembaran tetrahedral silika dengan lembar alumina oktahedral. Lembaran-lembaran ini diatur sedemikian rupa sehingga ujung-ujung tetrahedron silika dan lapisan yang berdekatan dengan lembar oktahedral membentuk lapisan umum (Grim, 1968). Pada Gambar 2.2, struktur kaolin dibentuk oleh struktur tetrahedral SiO4, Al(OH)6([Si2O5]2-, dan [AlOH4]2+) komposisi oktahedral dengan pseudo heksagonal simetri [O6Si4O4(OH)2Al4(OH)6] (Cheng dkk., 2012). Unit dasar lapisan tetrahedral adalah silika tetrahedral (SiO4) dimana satu
9
silikon mengikat empat atom oksigen. Sementara itu, lapisan oktahedral tersusun atas unit dasar aluminium oktahedral dan ion hidroksida dimana satu aluminium mengikat enam atom oksigen. Lapisan tetrahedral dan oktahedral ini tersusun 1:1 dengan ketebalan unit sebesar 7,13 Å (Murray, 2000).
2.2 Zeolit
10
terdiri dari fase sodalite. Aplikasi komersial pertama adalah sebagai agen pengeringan dan masih umum digunakan (Puppe, 1999).
Zeolit mempunyai kerangka yang tersusun dari satuan-satuan tetrahedral [SiO4]4- dan [AlO4]5- dengan atom oksigen sebagai penghubung antara atom silikon dan aluminium yang digabungkan secara tiga dimensi, ditunjukkan sebagai TO4, T = Si atau Al. Penggabungan satuan tetrahedron satu dengan lainnya terjadi adanya pemakaian bersama satu atom oksigen oleh dua tetrahedral, seperti yang ditunjukkan dalam Gambar 2.3 Tetrahedral [AlO4]5- bermuatan negatif, sehingga zeolit alam dan zeolit sintesis memerlukan kation logam alkali (Na+, K+) dan atau alkali tanah (Ca2+, Ba2+) sebagai pusat penyeimbang muatan untuk menjaga kenetralan muatan zeolit (Smart dan Moore, 1993).
Tetrahedron TO4 (T = Si atau Al) merupakan unit pembangun primer (primary building units, PBU) yang dapat digabungkan dengan berbagai cara untuk membentuk unit pembangun sekunder (secondary building units, SBU). Contohnya struktur cincin-4 (dibangun oleh 4 unit TO4), ganda cincin-4 (dibangun oleh dua cincin-4) dan sebagainya. Penomoran SBU dihubungkan dengan jumlah ikatan tetrahedron TO4 (Baerlocher, 2001).
11 2.3 Zeolit NaP
Zeolit NaP yang merupakan mineral yang terdiri dari muatan negatif, kerangka tiga dimensi tetrahedral SiO4 dan AlO4 yang bergabung membentuk oktahedral. Salah satu jenis zeolit ini mempunyai susunan kerangka (framework)tipe gismondine
(GIS) dengan memotong saluran 0.31 nm x 0.44 nm dalam [100] dan 0.26 nm x 0.49 nm dalam [010] (Albert, 1998). Zeolit NaP memiliki ukuran pori yang lebih kecil daripada zeolit tipe FAU, LTA, dan MF1, sehingga banyak digunakan untuk pemisahan molekul kecil gas (Brown, 1989; Kakansson, 1990), dapat digunakan untuk menghilangkan racun dan limbah radioaktif seperti Cs, Sr, Ba, Pb, U, logam berat, menghilangkan ammonium dari air limbah, ekstraksi natrium air laut, dan deterjen ramah lingkungan (Atkins, 1995; Nerry, 2003).
2.3.1 Sintesis Zeolit NaP
Pada umumnya, zeolit NaP dapat disintesis dengan berbagai macam prekusor dan berbagai macam metode. Zeolit NaP dapat disintesis dengan kaolin (Sathuphunya dkk., 2002) dengan Na2SiO2 (Murayama dkk., 2002) dan dengan abu layang (Kazemian dkk., 2010). Metode yang banyak digunakan seperti teknik sol-gel, hidrotermal, pemanasan microwave. Menurut penelitian yang dilakukan oleh Hansen (1993), zeolit NaP memiliki komposisi molar Al2O3 : 2.2 SiO2 : 5.28 NaF : 105.6 H2O. Zeolit NaP juga banyak ditemukan sebagai pengator dalam sintesis zeolit A, X, dan mordanit (Hansen dkk., 1993).
12
dkk. (2014) menggunakan limbah kaolin dan limbah metakaolin dari Amazon dengan rasio molar 3Na2O : Al2O3 : 3,5-5 SiO2 : H2O yang dihidrotermal pada suhu 90, 95, 100 dan 115°C selama 20 jam dan dihidrotermal pada suhu 90°C selama 6, 20, 24 dan 48 jam. Sintesis tersebut menghasilkan zeolit NaP kristalisasi pada hidtotermal 100°C selama 20 jam dengan rasio Si/Al yang rendah. Berbeda dengan Aldhari dkk. (2016) mensintesis zeolit NaP dari abu layang dengan metode thermo-sonochemical.
Gambar 2.4 Kerangka tipe gismondine (Win, 2004) 2.3.2 Pengaruh Waktu Hidrotermal
13
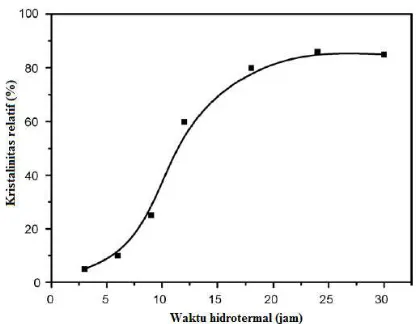
Gambar 2.5 Pengaruh waktu hidrotermal terhadap kristalinitas zeolit NaP (Wang dkk., 2007)
14
(Johnson dan Arshad, 2014). Gambar 2.5 merupakan aluran hubungan antara waktu hidrotermal dengan kristalinitas. Pada umumnya semakin lama waktu hidrotermal dalam sintesis zeolit kristalinitasnya akan semakin meningkat dan relatif kontan setelah mencapai titik maksimum (Wang dkk., 2007).
2.4 Leaching
Leaching dalam ilmu kimia disebut sebagai pelarutan padatan oleh larutan tertentu. Leaching pada umumnya melibatkan pelarut yang selektif dengan atau tanpa difusi. Metode yang digunakan untuk leaching biasanya ditentukan oleh jumlah konstituen yang akan dilarutkan, distribusi konstituen dalam padatan, dan sifat padatan dan ukuran partikel. Mekanisme proses leaching pada umumnya adalah zat terlarut ditransfer dari larutan ke permukaan padatan kemudian berdifusi kedalam padatan, pelarut yang berada didalam padatan akan larut oleh zat terlarut kemudian terdifusi menjadi campuran solut-solven ke permukaan padatan dan ditransfer keluar/ kedalam larutan zat terlarut (Geankoplis, 2003). Terdapat beberapa faktor yang mempengaruhi leaching, diantaranya: Ukuran partikel, Pelarut, Suhu, Pengadukan (Budhikarjono, 1996).
Dalam proses leaching dapat dilakukan dengan menggunakan asam organik seperti asam oksalat, asam sitrat, dan asam askorbat. Dapat juga digunakan dengan asam anorganik seperti hidrofluorat, asam hidroklorida, asam sulfat, dan asam perklorat (Tuncuk, dkk., 2013) 1x
15
tersebut didapatkan Si/Al sebesar 0,81; 1,3; 1,63 dan 8,09 untuk masing-masing konsentrasi asam sulfat 1, 3, 5, dan 10 M.
16 2.5.1 X-Ray Flourensence (XRF)
Uji XRF bertujuan menentukan jenis dan presentase komponen unsurunsur penyusun braket sebelum direndam dalam saliva buatan. XRF merupakan teknik analisa non-destruktif yang digunakan untuk identifikasi serta penentuan konsentrasi elemen yang ada pada sampel padat, bubuk ataupun cair. Secara umum, XRF spektrometer, mengukur panjang gelombang komponen material secara individu, dari emisi fluorosensi yang dihasilkan sampel saat diradiasi dengan sinar-X (West, 1984).
17
merusak sampel, metode ini dipilih untuk aplikasi di lapangan dan industri untuk kontrol material. Tergantung pada penggunaannya, XRF dapat dihasilkan tidak hanya oleh sinar-X tetapi juga sumber eksitasi primer yang lain seperti partikel alfa, proton atau sumber elektron dengan energi yang tinggi.
Keunggulan dari metode ini adalah sampel yang dianalisis tidak perlu dirusak, memiliki akurasi yang tinggi, dapat menentukan unsur dalam material tanpa adanya standar, serta dapat menentukan kandungan mineral dalam bahan biologik maupun dalam tubuh secara langsung.
2.5.2 Difraksi sinar-X (X-Ray Diffraction / XRD)
Difraksi Sinar-X merupakan salah satu metode karakterisasi material yang sangat penting dan membantu untuk mengidentifikasi fasa kristalin atau struktur kristal material padatan seperti ukuran kristalin, dan komposisi fasa. XRD menggunakan sinar-X sebagai sumber sinar dalam teknik karakterisasinya. Sinar-X adalah bagian dari radiasi gelombang elektromagnetik dengan panjang gelombang berkisar antara 10-10 m sampai dengan 10-8 m (1-100 Å), terletak diantara panjang gelombang sinar gamma (γ) dan sinar ultraviolet. Namun hanya 0,3 – 0,25 Å yang digunakan sebagai sumber sinar untuk difraksi sinar-X. Sinar-X dihasilkan akibat adanya perbedaan potensial antara filamen yang bertindak sebagai katoda dengan anoda berupa logam pada suatu ruang vakum, sehingga terjadi adanya pergerakan elektron dengan energi besar diantara kedua elektroda tersebut (West, 1984).
18
permukaan dengan sudut pantul yang sama dengan sudut datangnya. Secara matematik, hukum Bragg dinotasikan dalam persamaan berikut:
nλ = 2d sin θ ...(2.1)
Dimana: n adalah bilangan bulat suatu fasa, λ adalah panjang gelombang sinar-X, d adalah jarak antara dua bidang kisi dan θ adalah sudut datang pada bidang normal. Berdasarkan persamaan 2.3, difraksi X terjadi ketika pantulan dari sinar-X memiliki sudut yang memenuhi hukum Bragg. Apabila sudut pantul melewati sudut tersebut maka akan terjadi interferensi destruktif (Cullity, 1956).
Karakterisasi menggunakan XRD banyak digunakan pada padatan kristalin karena padatan kristalin memiliki atom penyusun dengan susunan teratur sehingga membentuk bidang-bidang dengan jarak antar bidang tertentu dan tiap atomnya dapat memantulkan berkas sinar-X. Padatan amorf memiliki atom-atom penyusun yang tersusun acak sehingga tidak akan memunculkan pola difraksi yang khas karena strukturnya yang tidak beraturan (Prasetyoko dkk., 2016).
19 2θ (o)
2.5.3 Spektrokopi Fourier Transform Infrared (FTIR)
FTIR digunakan untuk mengidentifikasi material, menentukan komposisi dari campuran, dan membantu memberikan informasi dalam memperkirakan struktur molekul. Sampel yang digunakan biasanya berupa material dalam keadaan padat, cair, atau gas. Analisa dengan metode ini didasarkan pada fakta bahwa molekul memiliki frekuensi spesifik yang dihubungkan dengan vibrasi internal dari atom gugus fungsi. Ketika sampel diletakkan dalam berkas radiasi IR, sampel mengabsorpsi radiasi pada frekuensi yang sesuai dengan frekuensi vibrasional molecular dan meneruskan seluruh frekuensi yang lain. Spektrometer IR mengukur frekuensi dari radiasi yang terabsorp, dan plot hasil dari energi terabsorp versus frekuensi
Int
ensi
ta
s (
cps
)
Gambar 2.6 Pola difraktogram XRD zeolite NaP (Hansen dkk., 1993)
20
dikenal sebagai spectrum IR dari material yang dianalisis. Identifikasi senyawa dapat dilakukan karena perbedaan struktur kimia material akan memberikan vibrasi karakteristik dan menghasilkan spectra IR yang unik, yaitu, daerah sidik jari untuk tiap-tiap material. Keuntungan dari metode FTIR ini yaitu radiasi sumber sinat yang lebih tinggi, perbandingan sinyal atau noise ditingkatkan, mengurangi waktu pengukuran, dan akurasi pengukuran yang lebih tinggi dengan spektrometer dispersif cahaya konvensional (Sibilia, 1996).
Prinsipnya dari FTIR ketika suatu material berinteraksi dengan sinar inframerah, ikatan dalam molekul akan mengalami vibrasi ulur (stretching) atau bending (tekuk). Hasilnya, sinar inframerah akan diabsorb oleh gugus fungsi pada rentang panjang gelombang yang spesifik. Keunggulan spektroskopi FTIR yaitu radiasi sumber sinar lebih tinggi, perbedaan sinyal dan noise ditingkatkan, mengurangi waktu pengukuran dan akurasi pengukuran yang lebih tinggi (Sibilia, 1996). Selain itu, spektrometer FTIR juga memiliki sensitivitas yang baik, kalibrasi panjang gelombang lebih akurat dan desain mekanik yang sederhana (Skoog dkk., 1998).
Hasil analisis spektroskopi inframerah digambarkan dalam bentuk spektrum yang menampilkan plot absorbansi atau transmitan energi dari sinar yang dipancarkan versus frekuensi. Analisis spektroskopi inframerah standar dilakukan pada rentang frekuensi 7000-400 cm-1, tetapi dapat pula mencapai 50 cm-1, dengan menggunakan tambahan sumber sinar, optik, dan detektor. (Sibilia, 1996).
21
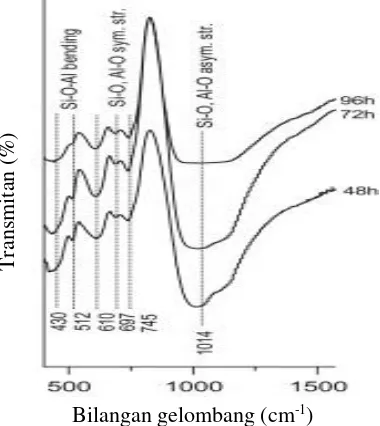
dari vibrasi ulur asimetris Al-O-Si. Puncak serapan pada 610 cm-1, 697 cm-1, dan 745 cm-1 yang merupakan serapan dari vibrasi ulur simetris kerangka Al-O-Si. Puncak serapan pada 578 cm-1 menunjukkan vibrasi eksternal cincin ganda yang berhubungan dengan struktur FAU. Pita serapan pada 430-512 cm-1 menunjukkan vibrasi tekuk simetris kerangka TO4 (T – Si, Al). 1x
Bilangan gelombang (cm-1)
Gambar 2.7 Spektra inframerah zeolit NaP (Bohra dkk., 2013) 2.5.4 Scanning Electron Microscopy-Enegy Dispersive X-ray
(SEM-EDX)
Scanning Electron Microscopy (SEM) merupakan alat sejenis mikroskop yang digunakan untuk melihat benda dengan menggunakan elektron sebagai pengganti dari cahaya (Gedde, 1995). Kelebihan SEM terletak pada fleksibilitas yang melekat karena pembangkitan sinyal ganda, proses pembentukan gambar
Tra
ns
m
itan
(
%
22
yang mudah, rentang pembesaran yang lebar, dan bidang kedalaman yang luar biasa. Berkas sinar elektron diperoleh dari penembak elektron, gelombang elektron yang terkondensasi pada lensa kondensor akan terfokus sebagai titik yang jelas oleh lensa objektif. Scanning coil yang telah memperoleh energi akan menyediakan medan magnetik bagi sinar elektron yang mengenai sampel menghasilkan elektron sekunder dan akan dikumpulkan oleh detektor sekunder. Foto yang dihasilkan terdiri dari ribuan titik dengan berbagai intensitas pada permukaan Cathode Ray Tube sebagai topografi gambar. Tempat sampel diletakkan dalam ruang vakum untuk menghilangkan udara ataupun gas yang ada dan dapat bereaksi dengan sinar elektron. (Gedde, 1995).
Prinsip kerja dari SEM adalah elektron ditembakkan dari katoda filamen ke arah sampel. Saat terjadi interaksi antara elektron dengan sampel, elektron kehilangan sejumlah energi sehingga terjadi pemantulan dan emisi elektron. Hasil pemantulan dan emisi elektron akan terdeteksi oleh detektor yang dapat divisualisasikan menjadi gambar morfologi dari suatu krsital. Tipe-tipe sinyal yang dapat dihasilkan oleh SEM dapat berupa Secondary Electron (SE), Back-Scattered Electron (BSE), dan sinar X. SEM dapat merekam permukaan suatu material dengan perbesaran sekitar 10-200.000x dengan ketajaman fokus yang tinggi sehingga permukaan yang kasar dapat digambarkan (Smith dan Oatley, 1995).
23
energinya dapat diukur oleh EDX. Energi sinar-X ini sesuai dengan perbedaan energi antar kedua kulit suatu unsur. Sehingga, komposisi unsur dari suatu sampel dapat diketahui (Behera, 2009).
Contoh mikrograf SEM zeolit NaP ditunjukkan oleh Gambar 2.8 yang merupakan hasil penelitian yang dilakukan oleh Behin (2015). Zeolit NaP hasil sintesis pada mikrograf tersebut memiliki bentuk kristal bola tidak beraturan dengan ukuran partikel kurang dari 5 μm.
24 BAB III
METODOLOGI PENELITIAN
3.1 Alat dan Bahan 3.1.1 Alat
Peralatan yang digunakan dalam penelitian ini adalah gelas beaker, botol High Density Polyethylene (HDPE), kertas pH, kertas saring, botol semprot, magnetic stirrer, timbangan analitik, corong, labu ukur, labu leher tiga, kondensor, hotplate, dan oven. Instrumen yang digunakan untuk sampel dan hasil sintesis adalah PANanalytical Minipal 4 untuk X-ray Flourosence (XRF), Philips Xpert MPD untuk X-ray Diffraction (XRD), Shimadzu Instrument Spectrum One 8400S untuk spektroskopi Fourier Transform Infrared (FTIR), Zeiss EVO MA 10 dan BRUKER 129 untuk Scanning Electron Microscopy-Energy Dispersive X-ray (SEM-EDX).
3.1.2 Bahan
Bahan-bahan yang digunakan pada penelitian ini adalah kaolin Bangka Belitung, aqua demineralisasi (aqua DM), natrium hidroksida (NaOH, Merck, 99%), dan asam sulfat (H2SO4, Pal Chemistry, 98%).
3.2 Prosedur Penelitian 3.2.1 Leaching
25
padatan yang telah kering ditimbang dan dikarakterisasi menggunakan XRF (X-ray Flourosence) dan FTIR (Fourier
Transform Infrared).
3.2.2 Sintesis Zeolit NaP
Metode zeolit mengacu pada penelitian yang dilakukan oleh Bohra dkk. (2013). Komposisi rasio molar zeolit NaP yang dibuat yaitu 2,1Na2O: Al2O3: 3,8SiO2: 50H2O. Natrium hidroksida sebanyak 1,68 gram dilarutkan dalam aquademin sebanyak 9 gram dalam botol HDPE, ditambahkan serbuk leaching kaolin sebanyak 4,37 gram, kemudian distirer selama 15 jam. Selanjutnya, dilakukan kristalisasi melalui proses hidrotermal pada suhu 100°C dengan variasi waktu 3, 6, 12, 24, 48 dan 72 jam. Setelah proses hidrotermal selesai, botol HDPE didinginkan dan hasil sintesis disaring untuk memisahkan padatan dan filtratnya. Padatan yang diperoleh dicuci dengan akuademin hingga pH 7 dan dikeringkan pada suhu 80°C selama 4 jam. Selanjutnya, padatan yang telah kering ditimbang dan dikarakterisasi menggunakan XRD (Difraktometer Sinar-X), FTIR (Fourier Transform Infrared), dan SEM-EDX (Scanning Electron Microscopy – Energy Dispersive X-ray).
3.3 Karakterisasi Hasil Sintesis 3.3.1 X-ray Flourosence (XRF)
Karakterisasi dengan XRF dilakukan pada sampel awal kaolin dan kaolin setelah dileaching untuk mengetahui unsur yang terkandung dalam kaolin serta untuk menentukan kadar persen dari tiap senyawa.
3.3.2 Difraksi Sinar-X (XRD)
26
gelombang 1,5406 Å, tegangan 40 kV, kuat arus 30 mA dan rentang sudut 2θ = 5-50°. Hasil karakterisasi difraksi sinar-X digunakan untuk menentukan fase-fase yang terdapat pada padatan. Sebanyak ± 1 gram padatan hasil sintesis dihaluskan kemudian dimasukkan ke dalam sample holder hingga padat dan permukaannya rata. Kemudian padatan diukur difraksinya dengan radiasi CuKα (λ=1,5405Å) pada 40 kV dan 30 m.
3.3.3 Spektroskopi Fourier Transform Infrared (FTIR)
Hasil sintesis dikarakterisasi dengan spektroskopi inframerah untuk mengidentifikasi gugus fungsi yang terdapat dalam metrial. Karakterisasi padatan dilakukan dengan teknik pelet KBr menggunakan instrumen FTIR Shimadzu Spectrum One 8400S. Sebanyak 0,1 gram sampel padatan hasil sintesis dicampur dengan padatan KBr, kemudian digerus. Campuran padatan selanjutnya ditekan hingga membentuk pelet kemudian diletakkan pada tempat sampel. Pelet yang telah terbentuk kemudian diukur serapan vibrasinya pada bilangan gelombang 4000-400 cm-1. 3.3.4 Scanning Electron Microscopy-Enegy Dispersive X-ray
(SEM-EDX)
27
28 BAB IV
HASIL DAN PEMBAHASAN
Pada penelitian ini, telah dilakukan sintesis zeolit NaP dari kaolin yang telah dileaching dengan metode hidrotermal. Kaolin dileaching dengan variasi waktu 4, 8, dan 12 jam, serta metode hidrotermal dengan variasi waktu 3, 6, 12, 24, 48, dan 72 jam. Hal tersebut dilakukan untuk mempelajari pengaruh leaching terhadap produk sintesis yang dihasilkan. Hasil kaolin setelah leaching dikarakterisasi dengan X-Ray Fluorosence (XRF) untuk mengetahui persen kandungan pada kaolin. Hasil sintesis juga dikarakterisasi dengan X-Ray Diffraction (XRD) untuk mengetahui fasa, kristalinitas, dan ukuran partikel kristal, lalu dikarakterisasi dengan Fourier Transform Infrared (FTIR) untuk mengetahui gugus fungsi yang terdapat pada kristal, dan dikrakterisasi dengan Scanning Electron Microscopy Energy Dispersive X-Ray (SEM-EDX) untuk mengetahui morfologi dan kandungan unsur yang ada didalam padatan hasil sintesis.
4.1 Leaching
29
dkk. 2009). Hal tersebut dilakukan agar larutan dalam labu tersebut tidak ada yang hilang. Lalu dimasukan magnetic stirrer kedalam labu leher tiga yang berfungsi untuk mencampurkan campuran tersebut. Setelah suhu dalam sistem 110°C dan stabil, dimasukan kaolin kedalam labu leher tiga dan direfluks. Variasi waktu refluks yang digunakan sebesar 4, 8, dan 12 jam.
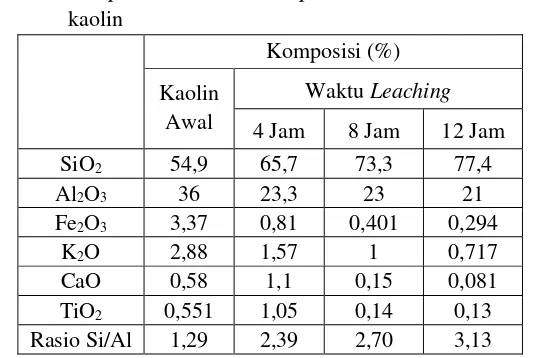
Tabel 4.1 Komposisi dan rasio Si/Al pada kaolin awal dan leaching kaolin
Komposisi (%) Kaolin
Awal
Waktu Leaching 4 Jam 8 Jam 12 Jam
SiO2 54,9 65,7 73,3 77,4
Al2O3 36 23,3 23 21
Fe2O3 3,37 0,81 0,401 0,294
K2O 2,88 1,57 1 0,717
CaO 0,58 1,1 0,15 0,081
TiO2 0,551 1,05 0,14 0,13
Rasio Si/Al 1,29 2,39 2,70 3,13
30
Pada Tabel 4.1 dapat diketahui bahwa masih terdapat senyawa lainnya seperti Fe, K, Ca, dan Ti pada kaolin awal dengan persen komposisi tertinggi yaitu Fe2O3. Dari hasil XRF menunjukan bahwa kadar dari senyawa selain Si dan Al semakin turun dengan meningkatnya waktu leaching. Hasil tersebut sesuai dengan penelitian Tuncuk, dkk. (2013) dimana semakin berkurangnya Fe dan senyawa lainnya dengan meningkatnya waktu leaching.
4.2 Sintesis Zeolit NaP
Pada penelitian ini, sintesis zeolit NaP berasal dari campuran kaolin yang telah dileaching, NaOH, dan aqua demineralisasi. Kaolin yang setelah dileaching juga lebih murni kandungannya dan mudah beraksi sehingga pembentukan inti kristal akan lebih sempurna. Sumber alkali yaitu Na+ berasal dari NaOH, serta aqua demineralisasi sebagai sumber H2O. Tahap awal yang dilakukan, NaOH pelet dilarutkan terlebih dahulu dengan
0 1 2 3 4
0 4 8 12
R
asio
Si/
A
l
Waktu Leaching (jam)
31
aqua demineralisasi dalam botol HDPE menggunakan magnetic stirrer pada suhu ruang. NaOH pada tahap ini berfungsi sebagai agen mineralisasi yang dapat meningkatkan kelarutan silika dan alumina sehingga kristalisasi akan menjadi lebih cepat (Cejka dkk., 2010; Chareonpanich dkk., 2004). Setelah NaOH pelet tercampur sempurna, dimasukan kaolin yang telah dileaching dan di strirer selama 15 jam pada suhu ruang. Pada tahap ini terjadi interaksi antara garam silikat dan aluminat membentuk aluminosilikat.
Tahap berikutnya dilakukan kristalisasi melalui proses hidrotermal pada suhu 100°C dengan variasi waktu hidrotermal 3, 6, 12, 24, 48, dan 72 jam. Pada proses ini terjadi penyempurnaan kristal yang dibentuk oleh spesi silikat dan aluminat. Struktur molekular gel aluminosilikat primer diubah menjadi aluminosilikat sekunder. Setelah proses hidrotermal, hasil sintesis didinginkan dan disaring untuk memisahkan padatan dan filtratnya. Padatan tersebut dicuci dengan akuademineralisasi hingga pH 7 untuk menghilangkan sisa NaOH. Setelah itu, padatan dikeringkan pada suhu 80°C selama 4 jam untuk mengeliminasi pelarut air yang tersisa. Padatan yang telah kering dikarakterisasi dengan difraksi sinar-X (XRD) dan spektroskopi inframerah (FTIR).
Aluran presentase rasio berat terhadap waktu hidrotermal ditampilkan Gambar 4.2 menunjukan pada waktu 3 jam terjadi penurunan sangat signifikan. Hal tersebut karena pada sampel terdapat kandungan air yang belum bereaksi, sehingga ketika dicuci dan dikeringkan, air akan hilang. Pada waktu 6 jam terjadi peningkatan karena mulai terbentuknya kristalin. Semakin meningkatnya waktu kristalinitas maka kecepatan dan
AlxSiyOz(OH)c(s) (kaolin) + H2O (l) + NaOH (aq) →
32
pertumbuhan inti semakin cepat sehingga kristalinitas menjadi meningkat.
4.3 Hasil Karakterisasi Padatan
4.3.1 Difraksi Sinar-X (XRD)
Karakterisasi difraksi sinar-X (XRD) dilakukan pada 2θ = 5-50° untuk mengetahui fase yang terdapat di dalam padatan. Pada pola difraktogram yang diperoleh dapat dilakukan identifikasi fasa kristal dan intensitas dari sampel dengan variasi waktu leaching 4, 8, dan 12 jam dan variasi waktu hidrotermal 3, 6, 12, 24, 48, dan 72 jam. Hasil difraktogram XRD setiap variasi ditunjukan pada Gambar 4.3, Gambar 4.5, dan Gambar 4.7.
0 20 40 60 80 100
0 10 20 30 40 50 60 70
R
asio
B
er
at
(%)
Waktu Hidrotermal (Jam)
12 Jam 8 Jam 4 Jam
34
Tabel 4.2 Puncak dengan sudut 2θ hasil sintesis dengan variasi waktu hidrotermal 3, 6, 12, 24, 48 dan 72 jam dan waktu leaching 4 jam
Sampel 2θ (°)
Zeolit NaP Sodalit Kaolinit
3 Jam - - 12,45; 19,95;
35
semakin kecil dengan bertambahnya waktu hidrotermal. Hal tersebut mengindikasikan bahwa kaolin telah bereaksi secara sempurna. Terdapat juga fase lainnya yaitu fase sodalit (disimbolkan dengan huruf S) teridentifikasi pada 2θ = 14,15; 32,1; 35,19°. Pembentukan sodalit tersebut sesuai pada penelitian Li dkk., (2015) yang disintesis dari kaolin terobservasi pada sudut refleksi 2θ = 14,16; 24,65; 28,53; 31,99 dan 35,13° namun dengan waktu kristalisasi lebih lama yaitu 24 jam. Intensitas puncak khas sodalit pada waktu hidrotermal 12-24 jam relatif konstan, lalu mengalami penurunan setelah 48 jam. Hal tersebut mengindikasikan bahwa sodalit mengalami transformasi fase.
Pada variasi waktu leaching 4 jam, difraktogram XRD sampel hasil sintesis memiliki puncak khas zeolit NaP pada waktu hidrotermal 72 jam yaitu 2θ = 12,6; 17,8; 21,7; 28,2; 33,4 ;33,5;
0 400 800 1200 1600 2000
0 10 20 30 40 50 60 70
Int
ens
itas
(cps
)
Waktu Hidrotermal (jam)
Zeolite NaP Kaolinit Sodalit
36
38,1; 46,1°. Hasil ini sesuai dengan penelitian Hilderbando dkk. (2014), dimana puncak khas zeolit NaP teridentifikasi pada 2θ = 12,36; 17,33; 21,71; 28,03; 34,98; 46,65°. Pembentukan zeolit NaP pada variasi ini terjadi mulai waktu krsitalisasi 12 jam, lebih cepat dari penelitian Hilderbando dkk., (2014) yang memerlukan waktu lebih lama yaitu 48 jam untuk membentuk zeolit NaP. Pola XRD sampel zeolit NaP pada 12 sampai 72 jam juga menunjukkan intensitas puncak khas zeolit NaP yang semakin meningkat seiring bertambahnya waktu kristalisasi. Kristal terbentuk semakin sempurna saat waktu kristalisasi 48 dan 72 jam.
38
Tabel 4.3 Puncak dengan sudut 2θ hasil sintesis dengan variasi waktu hidrotermal 3, 6, 12, 24, 48 dan 72 jam dan waktu leaching 8 jam
Sampel 2θ (°)
Zeolit NaP Kaolinit Zeolit NaY
3 Jam - 12,42; 24.91;
39
menunjukkan intensitas puncak khas zeolit NaP yang semakin meningkat seiring bertambahnya waktu kristalisasi.
Pola difraktogram XRD sampel zeolit NaP dengan variasi waktu leaching 12 jam menunjukan puncak spesifik zeolit NaP. Sebagian muncul puncak lain seperti fase kaolinit (disimbolkan dengan huruf K) dan puncak tidak teridentifikasi (disimbolkan dengan huruf O). Pada Gambar 4.5 menunjukkan bahwa puncak karakteristik kaolinit pada 2θ = 12,53; 21,05; 25,07; 26,98: 37,83; dan 45,28° yang intensitasnya semakin kecil dengan bertambahnya waktu hidrotermal. Sedangkan puncak tak teridentifikasi pada 2θ = 26,81 dan 28,72° yang intensitasnya muncul pada waktu hidrotermal 24 jam dan semakin tinggi sampai 72 jam.
Difraktogram XRD sampel hasil sintesis dengan waktu leaching 12 jam memiliki puncak khas zeolit NaP pada 2θ = 12,51;
0
Zeolite NaP Kaolinit Zeolite NaY
40
17,68; 21,75; 27,92; 33,25°. Pembentukan zeolit NaP pada variasi ini terjadi mulai waktu kristalisasi 24 jam, lebih lambat dari variasi waktu leaching 4 dan 8 jam. Pola XRD sampel zeolit NaP pada 24-72 jam menunjukkan intensitas puncak khas zeolit NaP yang semakin meningkat seiring bertambahnya waktu kristalisasi. Pola tersebut ditunjukkan oleh Tabel 4.4 dan Gambar 4.6.
Tabel 4.4 Puncak dengan sudut 2θ hasil sintesis dengan variasi waktu hidrotermal 3, 6, 12, 24, 48 dan 72 jam dan waktu leaching 12 jam
Sampel 2θ (°)
Zeolit NaP Kaolinit
3 Jam - 12,53; 21,05; 25,07;
26,98: 37,83; 45,28 6 Jam - 12,45; 24,83; 25.05; 26,86: 37,85; 45,49
12 Jam - 12,55; 24,94; 25.06;
26,78: 37,78; 45,61 24 Jam 12,59; 17,79; 21,84;
28,12; 33,57 25,10; 38,78; 46.33 48 Jam 12,65; 17,75; 21,83;
28,14; 33,44 25,08 72 jam 12,51; 17,68; 21,75;
41 waktu hidotermal 3, 6, 12, 24, 48 dan 72 jam dan waktu leaching 12 jam
2θ (°)
O
O
42
Gambar 4.8 Aluran waktu hidrotermal terhadap intensitas fase pada variasi leaching 12 jam
43
4.3.2 Spektroskopi Fourier Transform Infrared (FTIR) Hasil karakterisasi padatan dengan spektroskopi inframerah (FTIR) digunakan untuk mengetahui vibrasi gugus fungsi pada sampel hasil sintesis. Spektra inframerah kaolin dan keenam sampel zeolit NaP dengan variasi waktu leaching 4, 8, dan 12 jam dengan variasi waktu hidrotermal 3, 6, 12, 24, 48, dan 72 jam ditunjukkan pada Gambar 4.10, Gambar 4.11, dan Gambar 4.12. Pada spektra, kaolin teridentifikasi puncak karakteristik pada bilangan gelombang 430, 468, 538, 698, 756, 792, 912, 1031, dan 1114 cm-1. Menurut chandrasekar (1996) puncak khas kaolin muncul pada bilangan gelombang 541 cm-1 yang merupakan vibrasi Al-O pada Al[O(OH)]6, sedangkan pada 430, 693, 752, 794, 1035, 1096 dan 1114 cm-1 merupakan vibrasi Si-O pada SiO
4. Spektra inframerah sampel hasil sintesis pada Gambar 4.10, Gambar 4.11, dan Gambar 4.12 juga menunjukkan puncak serapan spesifik zeolit NaP pada daerah sekitar 430-470, 605-744, dan 1001-1006 cm-1. Puncak serapan pada bilangan gelombang 430-470 menunjukkan vibrasi tekuk gugus TO4, dimana T = Si, Al (Liu dkk., 2003). Sedangkan vibrasi ikatan dari Si-O dan Al-O ditunjukan pada gelombang bilangan pada daerah 605-744 cm-1. Adanya serapan pada 1001-1006 cm-1 menunjukkan vibrasi ulur internal asimetris tetrahedron TO4 (Bohra dkk., 2014).
44
Gambar 4.10 Spektra inframerah kaolin dan hasil sintesis dengan variasi hidrotermal 3, 6, 12, 24, 48 dan 72 jam dengan waktu leaching 4 jam
Tra
45
Gambar 4.11 Spektra inframerah kaolin dan hasil sintesis dengan variasi hidrotermal 3, 6, 12, 24, 48 dan 72 jam dengan waktu leaching 8 jam
46
Gambar 4.12 Spektra inframerah kaolin dan hasil sintesis dengan variasi hidrotermal 3, 6, 12, 24, 48 dan 72 jam dengan waktu leaching 12 jam
Tra
Bilangan Gelombang (cm-1)
47
Tabel 4.5 Bilangan gelombang puncak serapan spektra inframerah dengan variasi waktu hidrotermal 3, 6, 12, 24, 48 dan 72 jam dan waktu leaching 4 jam
Bilangan gelombang (cm-1) 3 Jam 6 Jam 12 Jam 24
48
Tabel 4.6 Bilangan gelombang puncak serapan spektra inframerah dengan variasi waktu hidrotermal 3, 6, 12, 24, 48 dan 72 jam dan waktu leaching 8 jam
Bilangan gelombang (cm-1)
49
Tabel 4.7 Bilangan gelombang puncak serapan spektra inframerah dengan variasi waktu hidrotermal 3, 6, 12, 24, 48 dan 72 jam dan waktu leaching 12 jam
Bilangan gelombang (cm-1)
4.3.3 Scanning Electron Microscopy-Enegy Dispersive X-ray
(SEM-EDX)
50
karakterisasi XRD dan FTIR sampel dengan variasi leaching 4 jam dengan waktu hidrotermal 72 jam menunjukkan pola difraktogram dan pola spektra inframerah yang seragam dengan NaP. Oleh karena itu, karakterisasi SEM-EDX dilakukan pada sampel zeolit NaP dengan waktu leaching 4 jam dengan waktu hidrotermal 72 jam.
(a)
(b)
51
Pada Gambar 4.13 hasil sintesis zeolit NaP dengan waktu leaching 4 jam dan waktu hidrotermal 72 jam memilki morfologi yang seragam. Zeolit NaP hasil sintesis memiliki bentuk partikel tidak spesifik (seperti bola pecah) dengan ukuran agregat partikel 150-300 nm (lingkaran kuning). Bentuk tersebut sama seperti pada hasil penelitian Behin (2015) dimana zeolit P yang disintesis dari kaolin memiliki morfologi seperti bola pecah. Hal tersebut memperkuat informasi yang ditunjukkan oleh data XRD dimana terdapat puncak khas zeolit P pada 2θ = 12,6; 17,8; 21,7; 28,2; 33,4 ;33,5; 38,1; 46,1° dan puncak serapan IR 430-470, 605-744, dan 1001-1006 cm-1.
Analisis EDX digunakan untuk mengetahui komposisi unsur yang terdapat pada sampel zeolit NaP waktu leaching 4 jam dengan waktu hidrotermal 72 jam. Hasil karakterisasi EDX sampel tersebut ditampilkan pada Tabel 4.8. Dari hasil EDX diketahui bahwa dua sampel zeolit NaP yang dianalisis mengandung unsur-unsur yang digunakan sebagai prekursor yaitu Si, Al, Na dan O. Dari hasil perhitungan dengan data presentase atom Si dan Al diperoleh rasio mol Si/Al sebesar 1,46 untuk sampel variasi leaching 4 jam dengan waktu hidrotermal 72 jam.
Distribusi komposisi unsur hasil sintesis dapat diketahui dari hasil pemetaan (mapping) pada SEM-EDX. Tabel 4.8 menunjukkan distribusi hasil sintesis zeolit NaP variasi leaching 4 jam dengan waktu hidrotermal 72 jam yang menunjukkan bahwa unsur Si dan Al terdistribusi pada sampel hasil sintesis. Sampel zeolit NaP memiliki distribusi Si dan Al yang merata.
Tabel 4.8 Hasil analisis EDX sampel zeolit NaP
Sampel % Atom Rasio mol
SiO2/Al2O3
Si Al Na O
52 BAB V KESIMPULAN
5.1 Kesimpulan
Sintesis zeolit NaP dilakukan dari kaolin yang telah dileaching dengan variasi waktu leaching kaolin. Berdasarkan hasil karakterisasi dengan X-Ray Fluorusense (XRF), menunjukkan bahwa rasio Si/Al mengalami peningkatan dengan meningkatnya waktu leaching kaolin dengan asam sulfat 4 M. Rasio Si/Al pada waktu leaching 4, 8, dan 12 jam mengalami peningkatan dari 1,53 menjadi 2,82; 3,18; dan 3,68. Hasil karakterisasi dengan X-Ray Diffraction (XRD) dan Fourier Transform Infrared (FTIR), menunjukan kristal zeolit NaP dengan leaching selama 4 jam mulai terbentuk pada waktu hidrotermal 12 jam. Intensitas kristal terus meningkat hingga waktu hidrotermal 72 jam dan terbentuk zeolit NaP. Semakin meningkatnya rasio Si/Al mengakibatkan semakin lama waktu hidrotermal dalam pembentukan kristalin zeolit NaP. Hasil data SEM didapatkan morfologi dan ukuran agregat partikel sampel zeolit NaP pada kaolin leaching 4 jam dan hidrotermal 72 jam memiliki bentuk partikel yang tidak spesifik seperti bola pecah dengan ukuran agregat partikel 150-300 nm. Hasil analisis EDX menunjukkan bahwa zeolit NaP hasil sintesis memiliki rasio SiO2/Al2O3 sebesar 1,46.
5.2 Saran
53
54
DAFTAR PUSTAKA
Adamczyk, Z., and Bialecka, B. (2005). "Hydrothermal synthesis of zeolites from polish coal fly ash". Polymer Journal Enviroment Study, 713-719.
Akolekar, D., Chaffee, A., and Howe, R. (1997). "The Transformations of Kaolin to Low-Silica X Zeolite". Zeolite, 359-365.
Albert, B. R., Cheetham, A.K., Stuart, J.A., and Adams, C.J. (1998). “Investigations of P zeolites: synthesis, characterisation, and structure of highly crystalline low-silica NaP”. Microporous Mesoporous Matery, 21:133– 142.
Aldahri, T., Behin, T., Kazemin, H., and Rohani, S. (2016). “Synthesis of Zeolite NaP from coal fly ash by thermos-sonochemical treatment”. Fuel, 12:44-501.
Ambikadevi, V.R., and Lalithambika, M. (2000). “Effect of organic acids on ferric iron removal from iron-stained kaolinite”. Applied Clay Science, 16:133–145.
Atkins, M., Glasser, F. P., and Jack, J. J. (1995). “Zeolite P in cements: its potential for immobilizing toxic and radioactive waste species”. Waste Manage. 15:127–135. Baerlocher, C. (2001). Atlas of Zeolite Framework of TypesFifth
revised edition. USA.
Barrer, R.M. (1982). Hydrothermal Chemistry of Zeolites. London: Academic Press.
55
Behin, J., Kazemian, H., and Rohani, S. (2016). “Sonochemical synthesis of zeolite NaP from clinoptilolite”. Ultrasonics Sonochemistry, 28: 400–408.
Belver, C.M.A. and Vicente, C.M.A. (2002). “Preparation of Porous Silika by Acis Activation of Metakaolins”. Studies in Surface Science and Catalysis, 144:307-314.
Belver, C.M.A., Munoz, B., and Vicente, M.A. (2002). “Chemical activation of a kaolinite under acid and alkaline conditions”. Chemistry Matery. 14:2033-2043.
Belviso, C., Cavalcante, F., Lettino, A., and Fiore, S. (2013). "A and X-type zeolites synthesised from kaolinite at low temperature". Applied Clay Science, 162-168.
Bohra, S., Kundu, D., and Naskar, M.K. (2013). “One-pot synthesis of NaA and NaP zeolite powders using agro-waste material and other low cost organic-free precursors”. Ceramics International, 40:122-1234.
Breck, D. W. (1984). Zeolite Molecular Sieves: Structure, Chemistry, and Use. New York: John Wiley & Sons Inc. Budhikarjono, K. (1996). Diktat Kuliah Alat Industri Kimia edisi
pertama. 99-101, Institut Sepuluh Nopember, Surabaya. Calderon, G.D.T., Rodriguez, J.I., Ortiz-Mendez, U., Torres
Martinez, L.M. (2005). “Iron leaching of a Mexican clay of industrial interest by oxalic acid”. Journal Material Online, 1:1–8.
Cameselle, C., Nunez, M.J., Lema, J.M. (1997). “Leaching of kaolin iron-oxides with organic acids”. Journal Chemistry Technology Biotechnology, 70:349–354.
56
Cheng, H., Liu, Q., Yang, J., Ma, S., and Frost, R. L. (2012). "The thermal behavior of kaolinite intercalation complexes-a review”. Thermochim, 545:1-13.
Cullity, B. D. (1956). Elements of X-Ray Diffractio”. Massachusetts: Addison-Wesley Publishing Company. Flanigen, E.M., Robert, W.B., and Stephen, T.W. (2010). “Zeolite
in industrial separation and catalyst”, In: Kulprathipanja, S. (Ed.)., Introduction. Wiley-VCH Verlag Gmbh and Co. K Ga A, 1-26.
Geankoplis, C.J. (2003). Transport Processes and Separation Process Principles (includes Unit Operations) fourth edition. pp 776-777, 802-806, Prentice Hall, New Jersey. Gedde, U. (1995). Polimer Physics. London: Chapman & Hall. Gougazeh, M. and Buhl, J.C. (2013). "Synthesis and
characterization of zeolite A by hydrotermal transformatio of natural jordanian kaolin", Journal of the Association of Arab Universities for Basic and Applied Sciences, page 35-42.
Grim, R. E. (1968). Clay mineralogy second edition. New York: Mc Graw-Hill.
Hay, R. L. (1966). Zeolites and zeolitic reactions in sedimentary rocks. California: Dept. Geology and Geophysics, University of California.
Hansen, S., Angel, R., Canovas, R., Filth, L. (1993). “On the crystal chemistry of NaP zeolites”. Zeolites, 13:276 280. Harahsheh, M.A. (2005). “The Influence of Microwaves On the
Leaching Kinetics of Chalcopyrites”. Journal of Mineral Engineering. 18:1259-1268.
57
Hildebrando, E. A., Gianesi, C., Augusto, C., Simões, R., Rolando, F., and Roberto. (2013). “Synthesis and Characterization of Zeolite NaP Using Kaolin Waste as a Source of Silicon and Aluminum”. Materials Research.
Hriljac, J.J., Eddy, M.M., Chetham, A.K., Donohue and G. J. Ray. (1993). Journal Solid State Chemistry. 106:66–72. Jha, B. and Singh, D. N. (2014). "A three step process for
purification of fly ash zeolites by hydrotermal treatment", Appied Clay Science, 122-129.
Kakansson, L., Falth, S., and Hansen. (1990). “Structure of a high silica variety of zeolite NaP”. Acta Crystal, C46, 1363. Kartimi, R., Bayati, B., Aghdam, N.C., Ejtemaee, M., and Babaluo,
A.A. (2012). “Studies of the Effect of Synthesis Parameters on ZSM-5 Nanocrystalline Material During Template-hydrothermal Synthesis in the Presence of Chelating Agent”. Powder Technology, 229:229-236. Kazemian, H., Naghdali, Z., Kashani, T.G., and Farhadi, F. (2010).
“Conversion of high silicon fly ash to NaP1 zeolite: alkaline fusion followed by hydrothermal crystallization”. Adv Powder Technology, 21: 279-283.
Lee, S.O., Tran, T., Park, Y.Y., Kim, S.J., ve Kim, M.J. (2006). “Study on the kinetics of iron oxide leaching by oxalic acid”. International Journal Mineralogy Process, 80:144– 152.
Lobachev, A.N. (1973). Crystallization Processes Under Hydrothermal Conditions. New York: Consultants Bureau.
58
Molina, A., and Poole, C. (2004). "A comparative study using two methods to produce zeolites from fly ash", Mineralogy Engineering, page 167-173.
Morey, G. W., and Niggli, P. (1913). "The Hydrothermal Formation of Silicates", A Review, Journal American Chemistry Society, 35:1086–1130.
Murray, H.H. (2000). "Traditional and New application for Kaolin, smectite, and Palygorskite: a general Overview", Applied Clay Science, 17:207-221.
Musyoka, N. M., Petrik, L., Fatoba, O. O., and Hums, E. (2013). "Synthesis of zeolites from coal fly ash using mine water", Mineralogy Engineering, page 9-15.
Murayama, N., Yamamoto, H., and Shibata, J. (2002). “Mechanism of zeolite synthesis from coal fly ash by alkali hydrothermal reaction” International Journal Mineralogy Proccess, 64: 1-17.
Nery, J.G., Mascarenhas, Y.P., and Cheetham, A.K. (2013). “A study of the highly crystalline, low-silica, fully hydrated zeolite P ion exchanged with (Mn2+, Cd2+, Pb2+, Sr2+, Ba2+) cations”. Micropory Mesopory Matererial, 57:229-248. Querol, X., Plana, F., Alastuey, A., and Lopez-Soler, A. (1997).
"Synthesis of Na-zeolites from fly ash", Fuel, page 793-799.
Pagnanelli, F., Garavini, M., Veglio, F., and Toro, L. (2004). “Preliminary Screening of Purification Processes of Liquor Leach Solutions Obtained from Reductive Leaching of Low Grade Manganes Ore”. Journal of Hydrometallurgy, 71:319-327.
59
Surfaces A: Physicochemistry Engineering Aspects, 363:98-104.
Parker, S.P. (1988). McGraw-Hill encyclopedia of the geological sciences, 2nd ed. New York, McGraw-Hill, pp 32–33, 69– 72, 400–401.
Prasad, M. S., Reid, K. J., and Murray, H. H. (1991). "Kaolin: processing, properties and applications", Applied Clay Science, page 87-119.
Prasetyoko, D., Fanzuri, H., Y.L., N., and Fadlan, A. (2016). Karakterisasi Padatan Difraksi Sinar X, Spektroskopi SEM, Analisis Termal, Struktur Pori Edisi pertama. Yogyakarta.
Puppe, W. (1999). Catalysis and Zeolit. Springer, Berlin.
Querol, X., Plana, F., Alastuey, A., and Lopez-Soler, A. (1997). "Synthesis of Na-zeolites from fly ash", Fuel, page 793-799.
Rashad, A.M. (2013). “Metakaolin as Cementitious Material: History, Scours, Production and Composition A Comprehensive Overview”. Construction and Building Materials, 41, 303-318.
Rees, D., Cronje, R., and du Toir, RSJ. (1992). “Dust exposure and pneumoconiosis in a South African pottery.1. Study objectives and dust exposure”. Br J Ind Med, 49: 459-464. Rhodes C.N., Franks, M., Parkes, G.M.B., and Brown, D.R. (1991). “The effect of acid treatment on the activity of clay supports for ZnCl2 alkylation catalysts”, Journal Chemistry Society Chemistry Community, 12:804–807. Rodrigues M.G.F. (2003). “Physical and catalytic characterization
60
Rustam. (2013)."Direct Synthesis of ZSM-5 from Kaolin the Presence of TPABr and TPAOH as Organic Templates", Thesis Kimia ITS, Surabaya.
Saija, L., Ottana, R., and Zipelli, C. (1983). "Zeolitization of pumice in ash-sodium salt solutions", Material Chemistry Physisc, page 207-216.
Saikia, N.J., Bharali, D.J., Sengupta, P., Bordoloi, D., Goswamee, R.L., Saikia, P.C., and Borthakur, P.C. (2003). “Characterization, beneficiation and utilization of a kaolinite clay from Assam, India”. Applied Clay Science, 24:93–103
Sathupunya, M., Gulari, E., and Wongkasemjit, S. (2002). “ANA and GIS zeolite synthesis directly from alumatrane and silatrane by sol-gel process and microwave technique”. Journal Europe Ceramics Society, 22: 2305–2314. Sepulveda, M.J., Vallyathan, V., Attfield M.D., Piacitelli, L., and
Tucker, J.H. (1983). “Pneumoconiosis and lung function in a group of kaolin workers”. Am Rev Respir Dis, 127: 231–235.
Sibilia, P. (1996). Guide to Material characterization and chemical analysis second edition. John Willey-VCH, New York. Skoog, D., Holler, F., and Nieman, T. (1998). "Principles of
Instrumental Analysis (2nd ed.)", Saunders College Publishing, Philadelphia.
Smart, L., dan Moore, E. (1993). Solid State Chemistry First edition. Chapman and Hall University and Proffesional Division, London.
61
Szoztak, R. (1998). Molecular Sieves: Principles of Synthesis and Identification 2nd edition. London: Blackie Academic and Professional.
Tanaka, H., Miyagawa, A., Eguchi, H., and Hino, R. (2004). "Synthesis of a pure-form Zeolite A from coal fly ash by dialysis". Industry Engineering Chemistry Resume, page 6090-6094
Tanaka, H., Fujii, A., Fujimoto, S., and Tanaka, Y. (2008). "Microwave-assisted two-step process for the synthesis of a single-phase NaA zeolite from coal fly ash", Adv. Powder Technology, page 83-94.
Thoriils, C.L., Hickey, J., and Stecke, G. (1950). “Chemistry of clay racking catalysts”, Journal Industry Engineering Chemistry, 42:866–871.
Tuncuk, A., Ciftlik, S., and Akcil, A. (2013). “Factorial experiments for iron removal from kaolin by using single and two-step leaching with sulfuric acid”, Hydrometallurgy, 134-135: 80–86.
Veglio, F., Toro, L. (1994). “Process development of kaolin bleaching using carbohydrates in acid media”. International Journal Mineralogy Process, 41:239–255. Veglio, F., Pagliarini, A., Toro, L. (1993). “Factorial experiments
for the development of a kaolin bleaching process”. International Journal Mineralogy Process, 39: 87–99. Veglio, F., Passariello, B., Toro, L., Marabini, A.M. (1996).
62
Veglio, F., Passariello, B., Barbaro, M., Plescia, P., Marabini, A.M. (1998). “Drum leaching tests in iron removal from quartz using oxalic and sulphuric acids”. International Journal Mineralogy Process, 54:183–200.
Walek, T. T., Saito, F., and Zhang, Q. (2008). "The effect of low solid/liquid ratio on hydrothermal synthesis of zeolites from fly ash", Fuel, page 3194-3199.
Wang, B., and Ma, H. Z. (1998). "Microporous Mesoporous Mater", page 131.
Wang, P., Shen, B., Shen, D., Peng, T., and Gao, J. (2007). "Synthesis of ZSM-5 Zeolite from Expanded Perlite/Kaolin and Its Catalytic Performance for FCC Naphtha Aromatization", Catalysis Communications, 8, 1452–1456.
Wang, C. F., Li, J. S., Wang, L. J., and Sun, X. Y. (2008). "Influence of NaOH concentrations on synthesis of pure-form zeolite A from fly ash using two-stage method", Journal Hazard. Material, page 58-64.
West A.R. 1984. Solid state chemistry and its applications. John Wiley & Sons, New York.
Xu, R., Pang, W., Yu, J., Qisheng, H., and Chen, J. (2007). Chemistry of Zeolites and Related Porous Materials: Synthesis and Structure. Singapore, Asia: John Wiley and Sons.
63
64 LAMPIRAN
A. Prosedur Sintesis Zeolit NaP A1. Leaching
50 gram kaolin 500 mL H2SO4
direfluks pada suhu 100°C selama 4, 8, dan 12 jam
didinginkan disaring
Filtrat Padatan
dicuci dengan aqua DM sampai pH netral
dioven pada suhu 100°C selama 1,5 jam
Hasil
dikarakterisasi XRF dan FTIR
65 A2. Sintesis Zeolit NaP
Aqua DM NaOH Leaching Kaolin
di stirrer selama 15 jam
di hidrotermal pada suhu 100°C selama 3, 6, 12, 24, 48, dan 72 jam
disaring
Filtrat Padatan
dicuci dengan aqua DM sampai pH netral
dioven pada suhu 80°C selama 4 jam
Hasil
Data