PEMISAHAN PROTEIN ALBUMIN DAN GLOBULIN DARI LARUTAN GARAM merupakan penyusun utama makhluk hidup. Selain itu, protein merupakan salah satu molekul yang paling banyak diteliti dalam biokimia. Dua jenis protein globular yaitu globulin dan albumin. Percobaan ini bertujuan untuk memisahkan protein dari serum sapi dengan metode salting out kemudian memurnikan protein dari garam yang terlarut dengan teknik dialisis. Metode yang digunakan adalah salting out untuk pemisahan protein dari serum, dialisis untuk pemurnian protein, dan elektroforesis Helena untuk melihat adanya protein. Hasil yang didapatkan adalah dialisis dapat membersihkan protein dari garam-garam yang terlarut, serta adanya pita-pita protein yang muncul dari hasil elektroforesis.
PENDAHULUAN
Protein merupakan salah satu dari biomolekul raksasa, selain polisakarida, lipid, dan polinukleotida, yang merupakan penyusun utama makhluk hidup. Selain itu, protein merupakan salah satu molekul yang paling banyak diteliti dalam biokimia. Protein ditemukan oleh Jöns Jakob Berzelius pada tahun 1838. Protein sederhana dapat dibagi menjadi dua bagian menurut bentuk molekulnya, yaitu protein globular yang berbentuk bulat dan protein fiber yang mempunyai bentuk panjang seperti serat.
Dua jenis protein globular yaitu globulin dan albumin. Albumin adalah protein yang dapat larut dalam air serta terkoagulasi oleh panas. Larutan albumin dalam air dapat diendapkan dengan penambahana monium sulfat hingga jenuh. Albumin antara lain terdapat pada serum darah dan putih telur. Globulin mempunyai sifat sukar larut dalam air murni, tetapi dapat larut dalam larutan garam netral, misalnya NaCl encer. Larutan globulin dapat diendapkan dengan penambahan garama monium sulfat hingga setengah jenuh. Globulin akan mengendap dan dapat dipisahkan. Seperti albumin, globulin antara lain terdapat dalam serum darah, pada otot, dan jaringan lain. Molekul globulin mempunyai berbagai macam bentuk. Ada molekul globulin yang terdiri atas rantai tunggal polipeptida saja, seperti albumin. Akan tetapi, cukup banyak juga yang terdiri atas beberapa subunit, seperti hemoglobin. Ada pula molekul globulin oligomer (yang terdiri atas beberapa subunit polipeptida) yang mempunyai susunan yang lebih rumit lagi daripada hemoglobin, karena subunit penyusunannya tidak sama panjang. Molekul seperti ini misalnya ialah berbagai jenis imunoglobulin (Ig). Bahkan ada lagi globulin yang juga tergolong ke dalam kelompok Ig ini, yang mempunyai susunan sangat rumit, seperti imunoglobulin M (IgM).
tertahan di dalam kantung membran. Metode dialsis banyak digunakan dalam pemurnian protein (terutama enzim). Dalam proses ini, dialisis digunakan untuk menghilangkan molekul garam, seperti amonium sulfat, sebelum dilanjutkan dalam proses pemurnian berikutnya ataupun pada tahap akhir pemurnian. Pada praktikum kali ini, albumin dan globulin diambil dari serum sapi yang dipisahkan dengan teknik Salting Out. Setelah dipisahkan dari serum, albumin dan globulin dibersihkan dari larutan garam dengan cara dialisis. Percobaan ini bertujuan untuk memisahkan protein dari serum kemudian memurnikan protein dari garam yang terlarut dengan teknik dialisis.
BAHAN DAN METODE
Bahan dan alat dalam praktikum ini antara lain, serum sapi, ammonium sulfat kristal, BaCl, HCl, aquades, kertas saring, corong, gelas kimia, selofan, dan alat elektroforesis Helena.
Gambar 1. Bagan kerja praktikum
1. Pemisahan Protein dengan Teknik Salting Out
Dalam praktikum ini, 25 ml serum sapi ditambahkan 7,28 gram amonium sulfat Kristal, diaduk terus hinga ammonium sulfat larut. Setelah itu, larutan disaring dengan menggunakan kertas saring. Endapan yang tertinggal di kertas saring disebut Presipitat 50%, presipitat ini berupa globulin, sedangkan filtrat yang tertampung dinamakan Filtrat 50%, filtrat ini berupa albumin. Kemudian, 10 ml fitrat 50% dicampurkan dengan 3,48 gram ammonium sulfat, diaduk terus hingga larut, setelah itu disaring. Endapan yang tertinggal di kerta saring disebut presipitat 100% sedangkan filtrat yang tertampung dinamakan filtrate 100%. Presipitat 50%, filtrate 50%, presipitat 100%, dan filtrate 100% diuji dengan biuret untuk membuktikan ada atau tidaknya protein.
2. Pemisahan Protein dari Garam dengan Teknik Dialisis
Gambar 2. Selofan yang direndam dalam aquades
3. Elektroforesis
Elektroforesis ini dilakukan untuk menguji keberadaan protein albumin dan globulin yang didapat dari serum. Dalam praktikum ini, dilakukan berdasarkan prosedur elektroforesis Helena. Elektroforesis menggunakan prosedur elektroforesis Helena. Cairan protein dikeluarkan dari selofan lalu dimasukkan ke dalam sumur (sumur 1: blank, sumur 2:serum, sumur 3: pesipitat 50%, sumur 4: filtrate 50%, sumur 5: presipitat 100% dan sumur 6: filtrate 100%). Kemudian protein ditempelkan ke dalam kertas selulosa asetat dengan bantuan aplikator. Aplikator ditekan ke dalam sumur-sumur tersebut sebanyak 3-4 kali lalu ditempelkan pada kertas selulosa asetat. Kertas selulosa asetat harus direndam dengan larutan buffer Electra HR terlebih dahulu selama 5 menit sebelum ditempelkan protein. Kertas selulosa asetat tersebut kemudian dimasukkan ke dalam alat elektroforesis yang telah berisi buffer yang sama dan dialiri listrik 180 V, 500 mA dan 400 W selama 15 menit. Setelah itu, kertas selolusa asetat tersebut direndam dalam asam asetat 5% selama 5 menit hingga timbul pita-pita protein hasil elektroforesis berwarna pink, lalu dikeringkan.
HASIL DAN PEMBAHASAN
1. Pemisahan Protein dengan Teknik Salting Out
muatan berat jenis yang lebih besar dibanding protein, sehingga ketika ditambahkan dan berikatan dengan molekul air, dapat memaksa molekul protein berinteraksi dan ketika penambahan ammonium sulfat dalam jumlah cukup menyebabkan protein terpresipitasi.
Prinsip pengendapan dengan amonium sulfat berdasarkan pada kelarutan protein yang merupakan interaksi antara gugus polar dengan molekul air, interaksi ionik protein dengan garam dan daya tolak menolak protein yang bermuatan sama. Berdasarkan fenomena ini, proses kelarutan protein terbagi dua yaitu: proses salting in dan salting out. Kelarutan protein pada pH dan suhu tertentu akan meningkat saat konsentrasi garam meningkat sampai pada konsentrasi tertentu (salting in). Selanjutnya pada penambahan garam dengan konsentrasi tertentu, kelarutan protein akan menurun (salting out).
Gambar 2. Proses pengendapan protein
Endapan protein dapat dipisahkan dari filtratnya dengan cara penyaringan biasa dengan kertas saring. Endapan yang didapat kemudian diuji dengan uji biuret yang merupakan uji warna untuk identifikasi protein. Dimana larutan protein dibuat alkalis dengan NaOH kemudian ditambahkan larutan CuSO4 encer. Uji ini untuk mendeteksi adanya ikatanikatan peptide dimana Cu2+ dari CuSO
4 akan direduksi menjadi Cu+ yang akan bereaksi dengan gugus –CO dan –NH2 pada protein sehingga membentuk suatu kompleks berwarna ungu.
Dalam praktikum ini, dilakukan pengujian biuret terhadap presipitat 50%, filtrate 50%, presipitat 100%, dan filtrate 100%. Keempatnya menunjukkan hasil yang positif terhadap adanya protein. Seharusnya, filtrate 100% sudah tidak mengandung protein lagi. Adanya hasil yang berwarna ungu dari uji biuret pada filtrate 100% mungkin dikarenakan oleh kertas saring yang pori-porinya tidak sesuai untuk memisahkan protein, sehingga albumin dan globulin masih tercampur. Untuk membuktikan adanya protein atau tidaknya dilakukan uji elektroforesis. Sebelum melakukan elektroforesis, presipitat dan filtrate dibersihkan dari garam ammonium sulfat terlebih dahulu dengan teknik dialisis.
2. Pemisahan Protein dari Garam dengan Teknik Dialisis
Dialisis merupakan metode yang paling dikenal untuk menghilangkan molekul pengganggu, seperti garam atau ion-ion lain yang berukuran kecil.
Gambar 3. Proses pemisahan protein dengan dialisis
Proses dialisis ini dapat terjadi karena konsentrasi garam lebih tinggi di dalam membran dialisis daripada di luar membran, sehingga menyebabkan larutan penyangga atau air masuk ke dalam dialisat. Hal ini terjadi pada awal proses dialisis. Selanjutnya garam akan keluar melalui membran hingga tercapai kondisi keseimbangan. Tetapi setelah proses dialisis kadang terjadi penurunan aktivitas enzim yang kemungkinan disebabkan oleh hilangnya ion penting yang dapat berfungsi mengaktifkan enzim atau disebut sebagai kofaktor.
Dalam praktikum ini, dilakukan proses dialisis dengan menggunakan selofan yang direndam dalam aquades. Setiap harinya aquades diganti dan dites dengan HCl dan BaCl untuk mengetahui adanya sulfat yang terkandung dalam aquades. Sulfat ini merupakan ion yang keluar dari dalam selofan. Apabila hasil pengujian dengan HCl dan BaCl menunjukkan warna bening atau tidak ada perubahan warna menjadi putih, artinya sulfat telah keluar semua dari selofan, dan dapat disimpulkan bahwa protein yang terdapat di dalam selofan telah murni.
3. Elektroforesis
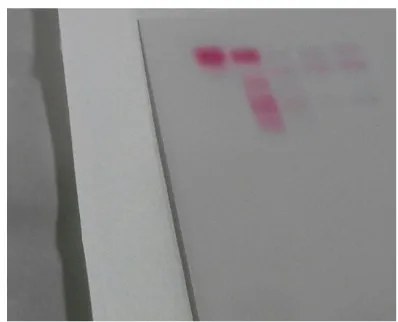
Gambar 4. Hasil elektorforesis presipitat dan filtrat
Dari hasil elektroforesis, terlihat bahwa pada presipitat 50% terdapat globulin, filtrate 50% terdapat albumin, presipitat 100% terdapat albumin, dan filtrate 100% masih terdapat sisa-sisa albumin, seharusnya filtrate 100% sudah tidak mengandung protein lagi. Adanya protein yang masih lolos ini dikarenakan ukuran pori-pori kertas saring yang tidak sesuai untuk menyaring protein.
KESIMPULAN
Dalam serum terdapat dua jenis protein, yaitu albumin dan globulin. Protein ini dapat dipisahkan dengan cara melarutkan serum dengan garam Amonium sulfat hingga jenuh sehingga protein dapat mengendap. Untuk memisahkan albumin dan globulin dilakukan dengan cara penyaringan. Protein yang mengendap pada kertas saring merupakan globulin, dan filtrate yang tertampung merupakan albumin. Albumin dan globulin ini dapat dimurnikan dari garam ammonium sulfat dengan teknik dialisis. Dialisis dapat memisahkan garam dari protein karena konsentrasi garam lebih tinggi daripada membran selofan, sehingga garam keluar dari dalam selofan dan protein terbebas dari garam ammonium sulfat.
DAFTAR PUSTAKA
Fessenden, Ralp J. dan Joan S. Fessenden. 2007. Kimia Organik Jilid 2. Jakarta: Erlangga.
Hemoglobin Electrophoresis Procedure. Helena Laboratorium. Kimball, John W. 2007. Biologi Jilid 2. Jakarta: Erlangga.
Lehninger, Albert. 2008. Dasar-dasar Biokimia Jilid I. Jakarta:Erlangga