Rinaldi Idroes Khairan
Novi Wulan Nurisma Nurul Mawaddah
Rd. Rhegyn Gheisyara Pradysta Rofina
Skrining Aktivitas Tumbuhan Yang Berpotensi
Sebagai Bahan Antimikroba Di Kawasan Ie Brôk
(Upflow Geothermal Zone) Aceh Besar
Skrining Aktivitas Tumbuhan Yang Berpotensi Sebagai Bahan Antimikroba Di Kawasan Ie Brôk (Upflow Geothermal Zone) Aceh Besar
Penulis : Prof. Dr.rer.nat. Rinaldi Idroes, S.Si Dr.rer.nat. Khairan, S.Si., M.Si Novi Wulan Nurisma, S.Farm Nurul Mawaddah, S.Farm
Rd. Rhegyn Gheisyara Pradysta, S.Farm Rofina, S.Farm
Desain Sampul dan Penata Letak :
Rivansyah Suhendra, S.Kom Zahriah, S.T., M.T
Cetakan Pertama 2019
© 2019 Syiah Kuala University Press
Penerbit
Syiah Kuala University Press Jl. Teuku Chik Pante Kulu,
Kopelma Darussalam, Banda Aceh Aceh, Indonesia, 23111
ISBN 978-623-7086-29-1
Hak Cipta Dilindungi Undang-Undang
Dilarang memperbanyak, mencetak dan menerbitkan sebagian atau seluruh isi buku ini dengan cara dan dalam bentuk apapun juga, tanpa izin tertulis dari editor.
iii
KATA PENGANTAR
Syukur Alhamdulillah penulis panjatkan ke hadirat Allah SWT yang telah melimpahkan rahmat dan hidayah-Nya, sehingga penulis dapat menyelesaikan buku monograf yang berjudul “Skrining
Aktivitas Tumbuhan yang Berpotensi Sebagai Bahan Antimikroba di Kawasan Ie Brôk (Upflow Geothermal Zone) Aceh Besar”. Shalawat
dan salam penulis sanjungkan kepada Nabi Muhammad SAW, beserta para sahabat dan keluarga beliau yang telah membawa umat manusia dari zaman kebodohan ke zaman yang berilmu pengetahuan seperti saat ini.
Buku monograf ini berisi tentang beberapa tumbuhan yang mampu tumbuh serta beradaptasi di lingkungan panas bumi dengan kondisi yang ekstrim. Tumbuhan di kawasan ini juga diduga memiliki potensi sebagai bahan obat, terutama sebagai antimikroba. Informasi serta data penelitian terkait tumbuhan di kawasan panas bumi baik biodiversitasnya maupun potensinya yang dapat digunakan dalam bidang kesehatan masih sangat kurang hingga saat ini. Harapan penulis semoga buku monograf ini dapat membantu pemerintah maupun ilmuwan dalam pengembangan obat baru dari kawasan panas bumi serta bermanfaat bagi perkembangan ilmu pengetahuan.
Penulis menyadari masih banyak kesalahan maupun
iv
kritikan dan saran demi kesempurnaan buku monograf ini sangat diharapkan.
Banda Aceh, April 2019
v
DAFTAR ISI
Halaman
KATA PENGANTAR... iii
DAFTAR ISI ... v
DAFTAR TABEL... viii
DAFTAR GAMBAR... ix
DAFTAR LAMPIRAN ... xi
BAB I. PENDAHULUAN ... 1
BAB II. KAWASAN MANIFESTASI IE BRÔK ... 9
2.1. Panas Bumi ... 9
2.2. Karakteristik Permukaan Manifestasi Ie Brôk ... 11
2.3. Penyebaran Vegetasi di Sekitar Manifestasi Ie Brôk... 16
BAB III. KLASIFIKASI TUMBUHAN ... 18
3.1. Tumbuhan di Kawasan Ie Brôk ... 18
3.1.1. Ficus Dimorpha King... 18
3.1.2. Baccaurea pyriformis Gage ... 19
3.1.3. Donax canniformis (G. Forst.) K. Schum ... 21
3.1.4. Sumbaviopsis albicans (Blume) J.J. Sm. ... 23
3.1.5. Streblus asper Lour... 24
3.1.6. Salacia sp... 26
3.1.7. Antidesma montanum Blume ... 27
3.1.8. Choromolaena odorata (L) R.M.King & H.Rob ... 29
3.2. Uji Mikroskopik dan Makroskopik... 31
BAB IV. METABOLIT SEKUNDER ... 36
4.1. Alkaloid ... 38
vi
4.3. Saponin ... 44
4.4. Tanin ... 45
4.5. Terpen ... 49
4.6. Steroid ... 54
BAB V. METODE PENGUJIAN ... 60
5.1. Teknik Pengambilan Sampel ... 60
5.2. Makroskopis dan Mikroskopis ... 65
5.3. Metode Ekstraksi... 65
5.4. Metode Skrining Fitokimia ... 68
5.4.1. Uji Alkaloid ... 69
5.4.2. Uji Flavonoid ... 69
5.4.3. Uji saponin ... 70
5.4.4. Uji tanin ... 70
5.4.5. Uji triterpenoid/steroid... 70
5.5. Metode Uji Aktivitas Antimikroba ... 70
5.5.1. Macam-macam Metode Uji Aktivitas ... 71
5.5.2. Uji Aktivitas Antimikroba ... 81
BAB VI. REIDENTIFIKASI MIKROBA ... 87
6.1. Bakteri Staphylococcus aureus... 87
6.1.1. Pewarnaan Gram ... 87
6.1.2. Uji Katalase... 88
6.1.3. Hasil Reidentifikasi Bakteri Staphylococcus aureus ... 88
6.2. Bakteri Escherichia coli ... 90
6.2.1. Pewarnaan Gram ... 90
6.2.2. Uji Triple Sugar Iron Agar (TSIA) ... 91
6.2.3. Uji Simmons Citrate Agar (SCA) ... 92
6.2.4. Hasil Reidentifikasi Bakteri Escherichia coli ... 92
6.3. Jamur ... 95
6.3.1. Pewarnaan Gram ... 95
6.3.2. Hasil Reidentifikasi Jamur Candida albicans ... 96
BAB VII. HASIL UJI MAKROSKOPIK DAN MIKROSKOPIK TUMBUHAN KAWASAN IE BRÔK ... 98
vii
7.1. Hasil Makroskopik dan Mikroskopik Tumbuhan
Kawasan Ie Brôk ... 98
7.1.1. Hasil Pengamatan Makroskopik... 98
7.1.2. Hasil Pengamatan Mikroskopik... 100
BAB VIII. HASIL UJI SKRINING TUMBUHAN KAWASAN IE BRÔK ... 110
8.1. Hasil Skrining Fitokimia Tumbuhan Kawasan Ie Brôk ... 110
8.2. Hasil Skrining Aktivitas Antimikroba Tumbuhan Kawasan Ie Brôk ... 117
BAB IX. PENUTUP... 129
9.1. Kesimpulan ... 129
viii
DAFTAR TABEL
Halaman
Tabel 2.1. Pengukuran suhu, pH, konduktivitas, elevasi,
konsentrasi anion dan kation pada fluida
manifestasi kawasan Ie Brôk ... 11
Tabel 5.1. Kategori diameter zona hambat antibakteri dan antijamur... 84
Tabel 7.1. Hasil pengamatan mikroskopik terhadap epidermis ... 101
Tabel 7.2. Hasil pengamatan mikroskopik stomata ... 102
Tabel 7.3. Hasil pengamatan mikroskopik trikoma (rambut) ... 104
Tabel 7.4. Hasil pengamatan mikroskopik resin ... 106
Tabel 7.5. Hasil pengamatan mikroskopik sel parenkim, pembuluh kayu (xylem), dan trakea ... 109
Tabel 8.1. Hasil Skrining fitokimia ekstrak n-heksana, etil asetat, dan etanol sampel tumbuhan... 110
Tabel 8.2. Hasil pengukuran diameter rata-rata zona hambat esktrak n-heksana, etil asetat, dan etanol beberapa tumbuhan kawasan Ie Brôk terhadap bakteri Staphylococcus aureus ATCC 25923... 118
Tabel 8.3. Hasil pengukuran diameter rata-rata zona hambat esktrak n-heksana, etil asetat, dan etanol beberapa tumbuhan kawasan Ie Brôk terhadap bakteri Escherichia coli ATCC 25922... 119
Tabel 8.4. Hasil pengukuran diameter rata-rata zona hambat esktrak n-heksana, etil asetat, dan etanol beberapa tumbuhan kawasan Ie Brôk terhadap jamur Candida albicans 10231 ... 120
ix
DAFTAR GAMBAR
Halaman
Gambar 2.1. Model konseptual sistem geotermal ... 10
Gambar 2.2. Diagram segitiga ternary Cl-, SO42-, dan HCO3 -pada manifestasi Ie Brôk ... 13
Gambar 2.3. Geoindikator Na-K-Mg ... 15
Gambar 3.1. Tumbuhan Ficus dimorpha King ... 19
Gambar 3.2. Tumbuhan Baccaurea pyriformis Gage ... 20
Gambar 3.3. Tumbuhan Donax canniformis (G.Forst.) K.Schum. .. 22
Gambar 3.4. Tumbuhan Sumbaviopsis albicans (Blume) J.J. Sm. .. 23
Gambar 3.5. Tumbuhan Streblus asper Lour ... 25
Gambar 3.6. Tumbuhan Salacia sp ... 27
Gambar 3.7. Tumbuhan Antidesma montanum Blume... 28
Gambar 3.8. Tumbuhan Chromolaena odorata (L.) R.M.King & H.Rob... 30
Gambar 4.1. Jalur Biosintesis Metabolit ... 37
Gambar 4.2. Klasifikasi senyawa alkaloid berdasarkan kerangka strukturnya ... 39
Gambar 4.3. Klasifikasi senyawa alkaloid berdasarkan bentuk dan asal usulnya ... 40
Gambar 4.4. Kerangka dasar flavonoid... 42
Gambar 4.5. Senyawa-senyawa flavonoid... 42
Gambar 4.6. Senyawa saponin... 44
Gambar 4.7. Senyawa tanin ... 46
Gambar 4.8. Jalur pembentukan asam galat ... 47
Gambar 4.9. Jalur biosintesis ellagitanin ... 48
Gambar 4.10. Senyawa-senyawa terpenoid ... 50
Gambar 4.11. Unit isopren... 51
Gambar 4.12. Reaksi biosintesis isopren melalui jalur asam mevalonat ... 52
Gambar 4.13. Biosintesis senyawa-senyawa terpenoid ... 53
x
Gambar 4.15. Reaksi jalur biosintesis steroid ... 56
Gambar 5.1. Peta lokasi pengambilan sampel geotermal kawasan Ie Brôk... 61
Gambar 5.2. Sketsa plot pengambilan sampel ... 62
Gambar 5.3. Simplisia tumbuhan... 64
Gambar 5.4. Proses uji antimikroba dengan metode difusi cakram ... 72
Gambar 5.5. Isolat Staphylococcus aureus diuji dengan metode difusi gradien (E-test).. ... 73
Gambar 5.6. Metode difusi agar sumuran... 74
Gambar 5.7. Metode difusi agar plug... 75
Gambar 5.8. Penghambatan bakteri Pseudomonas aeruginosa dengan metode cross-streak ... 76
Gambar 5.9. Skema bioautografi kontak ... 77
Gambar 5.10. Skema proses bioautografi langsung ... 78
Gambar 5.11. Diagram skema metode Agar Overlay Bioassay ... 79
Gambar 5.12. Plat mikrotitrasi pada metode Broth microdilution 80 Gambar 5.13. Metode mikrodilusi Broth untuk pengujian antibakteri ... 81
Gambar 6.1. Hasil uji reidentifikasi bakteri Staphylococcus aureus. ... 90
Gambar 6.2. Hasil uji reidentifikasi bakteri Escherichia coli. ... 95
Gambar 6.3. Hasil uji reidentifikasi Candida albicans... 96
xi
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat Keterangan Hasil Identifikasi Tumbuhan ... 131 Lampiran 2. Sertifikat Mikroba ... 135
1
BAB I
PENDAHULUAN
erhatian dunia terhadap obat-obatan yang berasal dari bahan alam terus mengalami peningkatan, baik di negara maju maupun di negara berkembang. Indonesia termasuk negara berkembang yang memiliki sumber daya alam yang sangat melimpah, terutama sebagai bahan obat. Indonesia merupakan negara urutan kedua setelah Brazil yang memiliki tingkat keanekaragaman hayati terbesar didunia dengan 30.000 spesies tumbuhan (Depkes RI, 2007). Semakin berkembang ilmu pengetahuan dan teknologi, berbagai penemuan keanekaragaman hayati baru untuk berbagai kegunaan akan terus berkembang (Royana, 2013). Panas bumi termasuk salah satu potensi sumber daya mineral dan energi yang melimpah di Indonesia. Geotermal merupakan pembentukan energi panas yang terbentuk secara alami di bawah permukaan bumi (Arrahman, 2015).
Daerah yang memiliki potensial sebagai panas bumi merupakan daerah yang memiliki temperatur 200 sampai 300oC pada
kedalaman 5 km di bawah permukaan bumi. Gunung Seulawah Agam merupakan salah satu gunung berapi yang masih aktif yang terdapat di Kabupaten Aceh Besar. Gunung Seulawah Agam diketahui memiliki potensi panas bumi yang tersebar dibeberapa kawasan diantaranya kawasan Ie Seu-um, Ie Jue, dan Ie Brôk (Marwan, 2014). Kondisi
7 rata-rata >255oC dan cocok untuk pengembangan pembangkit listrik
(Idroes, 2018).
Referensi:
Alatas, M. 2017. Kajian Geokimia Air Panas Bumi Manifestasi Ie Jue Daerah Upflow Lamteuba Seulawah Agam, Aceh Besar. Skripsi. Universitas Syiah Kuala, Banda Aceh.
Arrahman, R. dan Putra, A. 2015. Perkiraan Suhu Reservoir Panas Bumi Dari Sumber Mata Air Panas Di Nagari Panti, Kabupaten Pasaman Menggunakan Persamaan Geotermometer Sebagai Dasar Penentuan Potensi Panas Bumi.
Jurnal Fisika Unand 4 (4): 391-396.
Borges, C. V., Minatel I. O., Gomez-Gomez, H. A., and Lima, G. P. P. 2017. Medicial Plants: Influence of Environmental Factors on the Content of Secondary Metabolites, p.259-277. In Medicinal Plants and Environmental Challenges (Eds: M. Ghorbanpour and A. Varma). Springer International Publishing, Brazil.
Burns, B. 1997. Vegetation Change along geothermal Stress Gradient at the Te Kopia Steamfield. Journal of The Royal Society of New Zealand 27 (2): 279-295. Compean, K.L., and Ynalvez, R.A. 2014. Antimicrobial Activity of Plant Secondary
Metabolites. Res. J. Med. Plant. Rev. 8 (5): 204-213.
Depkes RI. 2007. Kebijakan Obat Tradisional. Departemen Kesehatan RI, Jakarta. GNC. 2015. Some like it hot: Life in New Zealand’s Gheothermal Environments. GNC
Science, New Zealand.
Haghighi, Z., Modarresi, M., & Mollayi, S. 2012. Enhancement of compatible solute and secondary metabolites production in Plantago ovata Forsk. by Salinity Stress. J. Med. Plants. Res. 6 (18): 3495-3500.
Hochstein, M. P. 1990. Classification and assessment of geothermal resources, p.31-59. In Small Geothermal Resources (Eds: M. H. Dickson and M. Fanelli). UNITAR/UNDP Centre on Small Energy Sources, Italy.
8
Idroes, R., Khairan, Fakri, F., dan Zulfendi. 2016. Skrining aktivitas Tumbuhan Yang
Berpotensi Sebagai Bahan Antimikroba di Kawasan Ie Seu-um (Outflow Geotermal Zone) Aceh Besar. Syiah Kuala University Press, Banda Aceh.
Idroes, R., Khairan, dan Fakri, F. 2017. Skrining aktivitas Tumbuhan Yang Berpotensi
Sebagai Bahan Antimikroba di Kawasan Ie Jue (Opflow Geotermal Zone) Aceh Besar. Syiah Kuala University Press, Banda Aceh.
Idroes, G. M. 2018. Potensi Panas Bumi pada Manifestasi Ie Brôk Lamteuba. Gunung Seulawag Agam, Aceh Besar secara Geokimia. Skripsi. Universitas Syiah Kuala, Banda Aceh.
Marwan. 2014. Study of Seulawah Agam’s Geothermal Source Using Gravity Method.
Jurnal Natural 14 (2): 1-5.
Royana, R. 2013. Panduan Kelestarian Ekosistem untuk Pemanfaatan Panas Bumi. WWF-Indonesia, Jakarta.
Sampaio, B. L., Edrada-Ebel, R., and Batista F. Da Costa. 2015. Effect of the environment on the secondary metabolic profile of Tithonia diversifolia: a model for enviromental metabolomics of plants (Reports). Scientific Reports 6: 1-9.
Subhan. 2017. Kajian Geokimia Air Panas Bumi Manifestasi Ie Seu-um Daerah Outflow Seulawah Agam, Aceh Besar. Skripsi. Universitas Syiah Kuala, Banda Aceh.
Utami. 2011. Antibiotika, Resistensi, Dan Rasionalitas Terapi. El-Hayah. 1 (4): 191-198.
9
BAB II
KAWASAN MANIFESTASI
IE BRÔK
2.1. Panas Bumi
ndonesia memiliki total energi 28.100 megawatt electrical (MWe) yang tersebar pada 265 titik lokasi panas bumi. Indonesia memiliki sekitar 40 persen potensi panas bumi dunia, akan tetapi pemanfaatnya baru sekitar 4 persen. Sedangkan pemanfaatan panas bumi di negara Filipina telah mencapai sebesar 44,5 persen (Suhartono, 2012). Indonesia termasuk kedalam sistem panas bumi hidrotermal yang memiliki temperatur >225oC. Sistem panas bumi
hidrotermal terdapat dikawasan Sumatera, Jawa, dan Sulawesi. Jenis sistem hidrotermal yang terdapat dibawah permukaan bumi dapat menunjukkan manifestasi panas bumi dipermukaan seperti mata air, geyser, dan sebagainya. Sistem panas bumi yang memiliki temperatur tinggi, berpotensi untuk dikembangkan sebagai pembangkit listrik (Royana, 2013). Aceh, merupakan provinsi yang memiliki beberapa kawasan sumber panas bumi, salah satu kawasan sumber panas bumi yang terdapat di Provinsi Aceh adalah Kawasan Geotermal Gunung Seulawah Agam yang terletak di Kabupaten Aceh Besar (Wangsa et al., 2017).
17 Berdasarkan pengamatan di sekitar manifestasi panas bumi kawasan Ie Brôk vegetasi tumbuhan yang paling banyak terdapat disekitar kawasan ini berupa perdu, herba, dan tumbuhan tingkat pohon.
Referensi:
Cumming, W. 2009. Geotermal Resource Conseptual Models Using Surface Exploration Data. Proceedings Thirty-Fourth Workshop on Geothermal
Reservoir Engineering. Standford, California.
Hochstein, M. P. and Browne, P. R. L., 2000. Surface manifestation of geothermal system with volcanic heat sources, p.835-855. In Encyclopedia of Volcanoes (Ed: Sigurdsson). Academic Press, New York.
Idroes, G. M. 2018. Potensi Panas Bumi pada Manifestasi Ie Brôk Lamteuba. Gunung Seulawah Agam, Aceh Besar secara Geokimia. Skripsi. Universitas Syiah Kuala, Banda Aceh.
Ochieng, L. 2013. Overview of Geothermal Surface Exploration Methods in Explor.
Geotherm. Resour. pp. 1-13.
Royana, R. 2013. Panduan Kelestarian Ekosistem untuk Pemanfaatan Panas Bumi. WWF-Indonesia, Jakarta.
Smale, M. C. and Wiser, S. K. 2015. A Classification of the Geothermal Vegetation of the Taupo Volcanic Zone, New Zealand. Proceedings World Geothermal
Congress. New Zealand, 1-11.
Suhartono, N. 2012. Pola Sistim Panas Dan Jenis Geotermal Dalam Estimasi Cadangan Daerah Kamojang. Jurnal Ilmiah MTG 5 (2).
Wangsa, A. and Ismail, N. 2017. Quantitative Interpretation of Gravity Anomaly Data in Geothermal Field Seulawah Agam, Aceh Besar. Journal of Aceh Physics
18
BAB III
KLASIFIKASI TUMBUHAN
3.1. Tumbuhan di Kawasan Ie Brôk
3.1.1. Ficus Dimorpha King
icus merupakan salah satu salah tumbuhan yang sangat penting dari ekosistem hutan, karena beberapa dari organisme hidup seperti serangga bergantung pada tumbuhan ini (Whitmore, 1978 dalam Nuraini et al., 2013). Masyarakat umum mengenal tumbuhan ficus dengan sebutan beringi, aro/ara. Ficus terdiri dari 800 jenis yang tersebar diseluruh dunia, tetapi tumbuhan ini banyak terdapat pada daerah tropis dan sebagian besar terdapat di daerah Indonesia-Malaysia (Ridley, 1925 dalam Nuraini et al., 2013). Tumbuhan F. dimorpha King merupakan tumbuhan dengan jenis pohon yang memiliki tinggi sekitar 10 m. F. dimorpha King berasal dari famili Moraceae dan pertumbuhannya tersebar dikawasan Sumatera
(Gambar 3.1). F. septica dan F. benjamina merupakan salah satu
tumbuhan yang berasal dari genus Ficus. Secara tradisional, daun tumbuhan ini dapat dimanfaatkan sebagai obat sakit pinggang dan maag (Kemenkes RI, 2015).
32
mikroskopik, dan uji histokimia. Uji mikroskopik dilakukan dengan menggunakan mikroskop yang derajat pembesarannya disesuaikan dengan keperluan. Simplisia yang diuji dapat berupa sayatan melintang, radial, paradermal maupun membujur atau berupa serbuk. Pada uji mikroskopik, dilakukan pencarian fragmen jaringan yang khas dari suatu simplisia tumbuhan. Dari pengujian ini akan diketahui jenis simplisia berdasarkan fragmen pengenal yang spesifik dari masing -masing simplisia. Sedangkan uji makroskopik dilakukan dengan menggunakan kaca pembesar atau tanpa menggunakan alat. Cara ini dilakukan untuk mencari khususnya morfologi, ukuran, dan warna simplisia yang diuji (Depkes RI, 1979).
Referensi:
Ami, A. A. 2007. Pharmacological Investigation of Leaves of Streblus asper. Thesis. East West University Departement of Pharmacy, Aftabnagor, Dhaka. Azliza, M. A., Ong, H. C., Vikineswary, S., Noorlidah, A., and Haron, N. W. 2012.
Ethno-medicinal Resources Used by the Temuan in Ulu Kuang Village. Ethno. Med. 6 (1): 17-22.
Bangun, A. 2011. Uji Aktivitas Penghambatan Enzim Alfa -Glukosidase dan Penapisan Fitokimia Pada Beberapa Tanaman Famili Euphorbiaceae. Skripsi. Universitas Indonesia, Depok.
Bharti, R., Ahuja, G., Ganapathy, S., and Dakappa, S. S. 2012. A review on medicinal plants having Antioxidant potential. Journal of Pharmacy Research Review 5 (8): 4278-4287.
Depkes RI. 1979. Farmakope Indonesia Edisi Ketiga. Direktorat Jenderal Pengawasan Obat dan Makanan, Jakarta.
Chakraborty, A.K., Rambhade, S., and Patil, U.K. 2011. Chromolaena odorata (L.) : An Overview. Journal of Pharmacy Research 4(3): 573-576.
33 Global Biodiversity Information Facility. Baccaurea pyriformis Gage.
https://www.gbif.org/species/3082088. Tanggal akses 13 Februari 2019. Global Biodiversity Information Facility. Choromolaena odorata (L).
https://plants.jstor.org/stable/10.5555/al.ap.specimen.k000061456 . Tanggal akses 13 Februari 2019.
Global Biodiversity Information Facility. Choromolaena odorata (L). https://www.gbif.org/species/3087725. Tanggal akses 13 Februari 2019. Global Biodiversity Information Facility. Ficus dimorpha King.
https://www.gbif.org/species/145833673/verbatim. Tanggal akses 13 Februari 2019.
Global Biodiversity Information Facility. Streblus asper Lour. https://www.gbif.org/species/5569628. Tanggal akses 13 Februari 2019. Gunawan, Chikmawati, T., Sobir, dan Sulistijorini. 2016. Review: Fitokimia genus
Baccaurea spp. Bioeksperimen 2(2): 96-110.
Haegens, R. M. A. P. 2000. Taxonomy, Phylogeny, and Biogeography of Baccaurea,
Distichirhops, and Nothobaccaurea (Euphorbiaceae). Dissertation.
University of Leiden, Netherlands.
Harishekar, M., Kiran, B., and Lalitha, V. 2016. Investigation of Antibacterial Activity of Salacia reticulatta (Root) Against some Important Pathogenic Bacteria.
European Journal of Pharmaceutical and Medical Research 3 (6): 316-321.
Hariyadi, B. and Tickin, T. 2012. Uras: Medicinal and Ritual Plants of Serampas, Jambi Indonesia. Ethnobotany Research and Applications vol 10: 133-149. Hendra, M. 2009. Etnoekologi Perladangan dan Kearifan Botani Lokal Masyarakat
Dayak Benuaq di Kabupaten Kutai Barat Kalimantan Timur. Disertasi. Institut Pertanian Bogor, Bogor.
Integrated Taxonomic Information System. Sumbaviopsis albicans (Blume) J.J. Sm. https://www.itis.gov/servlet/SingleRpt/SingleRpt?search_topic=TSN&sear ch_value=1027283#null . Tanggal akses 13 Februari 2019.
Kementerian Kesehatan RI. 2015. Riset Khusus Eksplorasi Pengetahuan Lokal
Etnomedisin dan Tumbuhan Obat Berbasis Komunitas di Indonesia.
34
Koch, M., Kehop, D. A., Kinminja, B., Sabak, M., Wavimbukie, G., Barrows, K. M., Matainaho, T. K., Barrows, L. R., and Rai, P. P. 2015. An ethnobotanical survey of medicinal plants used in the East Sepik province of Papua New Guinea. J. Ethnobiol. Ethnomedic. 11 (79): 1-26.
Nuraini, Syamsuardi, dan Arbain, A. 2013. Tumbuhan Ficus L. (Moraceae) di hutan konservasi Prof. Soemitro Djojohadikusumo, PT. Tidar Kerinci Agung (TKA), Sumatera Barat. J. Bio. UA. 2 (4): 235-241.
Nurrohman, Oman. 2011. Potensi Tumbuhan Berguna Pada Areal HCV (High Conservation Value) di Perkebunan Kelapa Sawit Kabupaten Ketapang, Kalimantan Barat. Skripsi. Institut Pertanian Bogor, Bogor.
Plant Data Base. Donax canniformis (G. Forst.) K. Schum. https://plants.sc.egov.usda.gov/core/profile?symbol=DOCA5 . Tanggal akses 13 Februari 2019.
Pratap, S. S. 2015. A brief study on Streblus asper L.- A Review. Research Journal of
Phytomedicine 01(02): 65-71.
Rahayu, M., Sunarti, S., Sulistiarini, D., dan Prawiroatmodjo, S. 2006. Pemanfaatan Tumbuhan Obat secara Tradisional oleh Masyarakat Lokal di Pulau Wawonii, Sulawesi Tenggara. Biodiversitas 7 (3): 245-250.
Sirinthipaporn, A. and Jiraungkoorskul, W. 2017. Wound Healing Property Review of Siam Chromolaena odorata. Pharmacogn. Rev. 11 (21): 35-38.
Suksthan, P., Madulid, D. A., and Borchsenius, F. 2010. Marantaceae in the Philippines. Taiwania 55(1): 28-36.
Sunarty, S., Arief H, Rugayah, 2008. Keanekaragaman Tumbuhan di Hutan Pegunungan Waworete, Kecamatan Wawonii Timur, Pulau Wawonii, Sulawesi Tenggara. Biodiversitas 9 (3): 194-198.
Susiarti, S. dan Setyowati, F. M. 2005. Bahan Rempah Tradisional dari Masyarakat Dayak Kenyah di Kalimantan Timur. Biodiversitas 6 (4): 285-287.
Susilo, A. dan Denny. 2016. Keragaman tumbuhan dan potensi pemanfaatannya di kawasan hutan alam sekunder RPH Cisujen KPH Sukabumi, Jawa Barat.
Prosiding Seminar Nasional Masyarakat Biodiversitas Indonesia. Jawa Barat,
35 Udayan, P.S., Raghu A.V., Sreekumar V.B., and Muraleedaran, E.M. 2014. A New Variety Of Salacia (Celastraceae) From the Western Ghats Of Kerala, South India. International Journal of Plant, Animal and Encironmental Sciences 4 (3): 100-103.
36
BAB IV
METABOLIT SEKUNDER
umbuhan berpotensi menghasilkan senyawa-senyawa kimia yang berguna dibidang kesehatan. Metabolit pada makhluk hidup dibagi menjadi metabolit primer dan metabolit sekunder. Metabolit primer merupakan metabolit pembatas (chemical building block) untuk memproduksi metabolit sekunder. Pada umumnya tumbuhan mengandung metabolit sekunder, beberapa diantaranya terdapat dalam jumlah terbatas, dan beberapa diantara lainnya terdapat dalam satu famili, serta ada tumbuhan tertentu yang dapat menghasilkan metabolit spesifik yang tidak ditemukan pada tumbuhan lainnya. Pemanfaatan tumbuhan yang berpotensi menghasilkan senyawa-senyawa kimia yang berguna dibidang kesehatan terus dikembangkan oleh para peneliti. Tumbuhan dapat menghasilkan senyawa metabolit primer dan metabolit sekunder dari serangkaian proses jalur metabolisme (pathway metabolism) (Gambar
4.1). Metabolit primer terlibat secara langsung dalam pertumbuhan
dan perkembangan tumbuhan. Sementara itu, metabolit sekunder tidak terlibat dengan pertumbuhan dan perkembangan tumbuhan, tetapi metabolit sekunder memiliki fungsi sebagai pertahanan diri untuk melawan predator, parasit, dan penyakit.
57 FPP dan dikatalisis oleh enzim squalen sintase menghasilkan senyawa squalen. Selanjutnya senyawa ini dikatalisis oleh enzim squalen epoksidase menjadi 2,3-oksidosqualen (squalen epoksid). Proses ini merupakan langkah awal dalam mengkonversi rantai squalen C30
menjadi kerangka sterol tetrasiklik. Selanjutnya enzim 2,3-oksidosqualen siklase mengubah senyawa 2,3-2,3-oksidosqualen menjadi lanosterol yang merupakan prekursor untuk semua struktur steroid. Setelah itu juga terjadi beberapa transformasi untuk membentuk senyawa kolesterol pada mamalia dan ergosterol pada trypanosomatida dan jamur (Souza and Rodrigues, 2009).
Referensi:
Abdallah, I. I., and Quax, W. J. 2017. A Glimpse into the Biosynthesis of Terpenoids.
Natural Resources and Life Sciences. Conference Proceedings. Netherlands,
Vol. 2017:81-89.
Aniszewski, T. 2007. Alkaloids – Secrets of Life. Elsevier, Amsterdam.
Anulika, N. P., Ignatius, E. O., Raymond, E. S., Osasere, O. I., and Abiola, A. H. 2016. The Chemistry of Natural Product: Plant Secondary Metabolites. Inter. J. of
Tech. Enhanhc. and Emerg. Engineer. Res. 4 (8): 1-8.
Barnes, J., Anderson, L. A., and Phillipson, J. D. 2007. Herbal Medicines Third edition. Pharmaceutical Press, London.
Compean, K. L., and R. A. Ynalvez. 2014. Antimicrobial Activity of Plant Secondary Metabolites: A Review. Res. J. Med. Plant, 8 (5): 204-213.
Cook, N. C. and Samman, S. 1996. Flavonoid-Chemistry, metabolism, cardioprotective effects, and dietary sources. J. Nutr. Biochem. Rev. 7:66-76.
58
Costa, T.A., Vieira, R.F., Bizzo, H. R., Silveira, D. and Gimenes, M.A. 2012. Chromatography and its Applications. In Thech, Europe.
Cowan, M. M. 1999. Plant Products as Antimicrobial Agents. Clin. Microbiol. Rev. 12 (4): 564-582.
Dewick, P. M. 2002. Medicinal Natural Products: A Biosynthetic Approach Second
Edition. John Wiley and Sons, UK.
Farnsworth, N.R. 1966. Biological and Phytochemical Screening of Plants. J. Pharma.
Sci. 55 (3): 225-276.
Gross, G.G. 1992. Enzymes in the Biosynthesis of Hydrolyzable Tannins, p.43 -60. In
Plant Polyphenols Synthesis, Properties, Significance (Eds: R. W. Hemingway
and P. E. Laks). Plenum Press, New York.
Harborne, J. B. 1973. Phytochemical Methods. Chapman and Hall in association, USA. Heinrich, M., Barnes, J., Gibbons, S., dan Williamson, E. M. 2009. Farmakognosi dan
Fitoterapi. EGC, Jakarta.
Hostettmann, K. and Marston, A. 1995. Saponins. Cambridge University Press, Cambridge.
Jones, W.P. and Kinghorn, A.D. 2012. Extraction of Plant Secondary Metabolites.
Methods Mol. Biol. 20: 323-351.
Mendoza, N. and Silva, E. M. E. 2018. Introduction to Phytochemichals: Secondary Metabolites from Plants with Active Principles for Pharmacological Importance, p.25-47. In Phytochemical – Source of Antioxidant and Role in
Disease Prevention (Eds: T. Asao and M. Asaduzzaman). Intech Open,
London.
Panche, A. N., Diwan, A. D., and Chandra, S. R. 2016. Flavonoids: an overview. Journal
of Nutritional Science 5 (47): 1-15.
Robinson, T. 1995. Kandungan Organik Tumbuhan Tinggi. Terjemahan dari The Organic Constituents of Higher Plants , oleh Kosasih Padmawinata, ITB, Bandung.
Saifudin, A. 2014. Senyawa Alam Metabolit Sekunder Teori, Konsep, dan Teknik
59 Sandjo, L. P. and Kuete, V. 2013. Triterpenes and Steroids from the medical Plants of
Africa. Medical Plant Research in Africa, p.136-202.
Souza, W. and Rodrigues, J. C. F. 2009. Sterol Biosynthesis Pathway as Target for Anti -trypanosomatid Drugs – A Review. Interdiscliplinary Perspectives on Infections Diseases, 2009: 1-19.
Sultan, A. and Raza, A. R. 2015. Steroids : A Diverse Class of Secondary Metabolites.
60
BAB V
METODE PENGUJIAN
5.1. Teknik Pengambilan Sampel
ampel tumbuhan di kawasan Ie Brôk yang terletak di bagian utara Gunung Api Seulawah Agam, tepatnya di Desa Meurah, Kecamatan Mesjid Raya, Kabupaten Aceh Besar diambil berdasarkan lokasi manifestasi geotermal. Pengambilan sampel tumbuhan dilakukan disekitar lokasi manifestasi geotermal. Ada dua lokasi manifestasi geotermal dikawasan Ie Brôk yaitu lokasi B1 dan B2.
Lokasi B1 selanjutnya dibagi menjadi dua area pengambilan sampel
yaitu B1-1 dan B1-2, sementara, lokasi B2 menjadi B2-1 dan B2-2 (Gambar
5.1).Penamaan Ie Brôk berasal dari Bahasa Aceh, dimana Ie artinya air, sementara Brôk artinya busuk. Air dikawasan manifestasi ini mengeluarkan bau atau aroma busuk akibat semburan belerang. Untuk memudahkan dalam pengamatan selanjutnya keempat lokasi ini ditentukan titik koordinanya dengan menggunakan sistem GPS (Global Positioning System) untuk menentukan posisi Lintang Utara (LU) dan Bujur Timur (BT) serta ketinggian lokasi meter diatas permukaan laut (mdpl). Area B1-1 terletak pada titik koordinat GPS
05º31’04.8” LU dan 095º37’01.7” BT dengan ketinggian 209 mdpl (di atas permukaan laut), area B1-2 terletak pada titik koordinat GPS
84
menggunakan jangka sorong (mm) (Singh et al., 2018). Hasil pengukuran zona hambat tersebut diinterpretasikan berdasarkan kategori zona hambat pertumbuhan mikroba seperti pada Tabel 5.1.
Tabel 5.1. Kategori diameter zona hambat antibakteri dan antijamur
Kategori aktivitas
Diameter zona hambat (mm) Zona hambat antibakteri Zona hambat antijamur Lemah 6-10 8-13 Sedang 11-20 14-19 Kuat 21-30 20-25 Sangat kuat >30 >25
Sumber: Morales et al. (2003); Sytykiewicz et al.(2015)
Referensi:
Balouiri, M., Sadiki, M., and Ibnsouda, S. K. 2016. Methods for in vitro evaluating antimicrobial activity: A review. J. Pharmaceutical Analysis 6: 71-79. Bismark, M. 2011. Prosedur Operasi Standar (SOP) untuk Survei Keragaman Jenis
pada Kawasan Konservasi. Badan Penelitian dan Pengembangan
Kehutanan, Bogor.
Compean, K. L., and Ynalvez, R. A. 2014. Antimicrobial Activity of Plant Secondary Metabolites: A Review. Res. J. Med. Plant 8 (5): 204-213.
Depkes RI. 1977. Materia Medika Indonesia Jilid 1 dan 2. Direktorat Jenderal Pengawasan Obat dan Makanan, Jakarta.
Dewanjee, S. Gangopadhyay, M., Bhattacharya, N., Khanra, R., and Dua, T. K. 2015. Bioautography and its scope in the field of natural product chemistry. J.
Pharmaceutical Analysis 5 (2): 75-84.
Harborne, J. B. 1973. Phytochemical Methods. Chapman and Hall in association, USA. Idroes, R., Khairan, dan Fakri, F. 2017. Skrining Aktivitas Tumbuhan yang Berpotensi
sebagai Bahan Antimikroba di Kawasan Ie Jue (Upflow Geothermal Zone) Aceh Besar. Syiah Kuala University Press, Banda Aceh.
85 Jorgensen, J.H. and Ferraro, M. J. 2009. Antimicrobial Susceptibility Testing: A Review of General Principles and Contemporary Practices. Medical Microbiology 49: 1749-1755.
Misna dan Diana, K. 2016. Aktivitas Antibakteri Ekstrak Kulit Bawang Merah ( Allium
cepa L.) Terhadap Bakteri Staphylococcuc aureus. Galen. J. of Pharm. 2 (2):
138-144.
Morales, G., Sierra, P., Mancilla, A., Paredes, A., Loyola, L.A., Gallardo, O., and Borquez J. 2003. Secondary Metabolites From Four Medicinal Plants From Northern Chile: Anti microbial Activity And Biotoxicity Against Artemia
salina. J. Chil. Chem. Soc. 49 (1): 44-49.
Najib, A. 2018. Ekstraksi Senyawa Bahan Alam. Deepublish, Yogyakarta.
Prasetyo dan Inoriah, E. 2013. Pengelolaan Budidaya Tanaman Obat-obatan (Bahan
Simplisia). Badan Penerbitan Fakultas Pertanian UNIB, Bengkulu.
Safitri, R. dan Novel, S. S. 2010. Medium Analisis Mikroorganisme. Trans Info Media, Jakarta.
Sandjo, L. P. and Kuete, V. 2013. Triterpenes and Steroids from the medical Plants of Africa. Medical Plant Research in Africa, p. 136-202.
Singh, A., Tiwari, A., Bajpai, J., and Bajpai, A. K. 2018. Polymer-Based Antimicrobial Coatings as Potential Biomaterials : From Action to Application, p. 27-61. In
Handbook of Antimicrobial Coating (Eds: Atul Tiwari). Matthew Deans, USA.
Sytykiewicz, H., Chrzanowski, G., Czerniewicz, P., Leszczynski, B., Sprawka, I., Krzyzanowski, R., and Matok H. 2015. Antifungal Activity of Juglans regia (L.) Leaf Extracts Against Candida albicans Isolates. Pol. J. Environ. Stud. 24 (3): 1339-1348.
Xu, L., Wang, F., Shen, Y., Hou, H., Liu, W., Liu, C., Jian, C., Wang, Y., Sun, M., and Sun, Z. 2014. Pseudomonas aeruginosa inhibits the growth of pathogenic fungi:
In vitro and in vivo studies. Experimental and Therapeutic Medicine 7:
1516-1520.
Yadav, R. N. S. and Agarwala, M. 2011. Phytochemical analysis of some medicinal plants. J. of Phytol. 3 (12): 10-14.
World Health Organization. 2003. Manual for the Laboratory Identification and
86
Importance in the Developing World. Centers for Disease Control and
Prevention, USA.
World Health Organization. 2009. Laboratory Manual For Diagnosis Of Fungal
Opportunistic Infections In HIV/AIDS Patients. Regional Office for South-East
87
BAB VI
REIDENTIFIKASI MIKROBA
eidentifikasi mikroba dilakukan untuk memastikan bahwa mikroba yang digunakan pada penelitian ini adalah mikroba yang diinginkan, yaitu bakteri Staphylococcus aureus (S. aureus), Escherichia coli (E. coli), dan jamur Candida albicans (C. albicans). Reidentifikasi terhadap bakteri S. aureus meliputi uji pewarnaan Gram dan uji Katalase, sementara itu bakteri E. coli meliputi uji pewarnaan Gram, uji TSIA (Triple Sugar Iron Agar), dan uji SCA (Simmons Citrate Agar) sedangkan jamur C. albicans hanya pewarnaan Gram saja. Pengujian terhadap reidentifikasi mikroba ini tidak dilakukan secara spesifik dengan beberapa uji lainnya dikarenakan telah adanya sertifikat mikroba yang menjadi acuan keakuratan mikroba yang digunakan tersebut.
6.1. Bakteri Staphylococcus aureus
6.1.1. Pewarnaan GramProsedur yang dilakukan yaitu mencuci kaca objek dengan alkohol 70% dan dikeringkan di atas pembakaran spiritus. Bakteri dioleskan pada kaca preparat tersebut menggunakan jarum Ose yang telah dipijarkan dan didinginkan. Preparat difiksasi diatas nyala api
96
gambaran seperti sekumpulan jamur dalam bentuk blastospora, hifa atau pseudohifa, atau campuran keduanya (Mutiawati, 2016).
6.3.2. Hasil Reidentifikasi Jamur Candida albicans
Hasil yang diperoleh yaitu morfologi jamur berbentuk oval yang didominasi oleh warna ungu. Sel jamur C. albicans mampu mempertahankan kompleks kristal violet-iodin karena memiliki lapisan peptidoglikan yang tebal di dinding sel (Haw et al., 2013). Hasil ini positif terhadap jamur C. albicans (Gambar 6.3). Bukti bahwa jamur yang digunakan adalah C. albicans juga dapat dilihat pada Lampiran 2.
Gambar 6.3. Hasil uji reidentifikasi C. albicans dengan pewarnaan Gram
Referensi:
Bhavan, P. S., Rajkumar, R., Radhakrishnan, S., Seenivasan, C., Kannan, S. 2010. Culture and Identification of Candida albicans from Vaginal Ulcer and Separation of Enolase on SDS-PAGE. Inter. J. Biol. 2 (1): 84-93.
Brooks, G. F., Carroll, K. C., Butel, J. S., Morse, S. A., and Mietzner, T. A. 2013. Jawetz,
Melnick & Adelberg's Medical Microbiology 26th ed. McGraw-Hill Company,
New York.
97 Haw, B. P., Asma, I., Eugene, O. and Sasidharan, S. 2013. Phenotyping identification of Candida albicans for the production of in house helicase for nucleic acid-based detections for fast diagnosis. Res. J. Pharm. Biol. Chem. Sci. 4 (2): 576-583.
Joel, T. J. and Sreejit, N. 2016. Antimicrobial Assay of Medicinal Plant Extracts Against Oral Pathogens. Int. J. Pharm. Bio. Sci. 7 (1): 610-621.
Mutiawati, V. K. 2016. Pemeriksaan Mikrobiologi pada Candida albicans. Jurnal
Kedokteran Syiah Kuala 16 (1): 53-63.
Percival, S. T. and Williams, D. W. 2014. Escherichia coli. Microbiology of Waterborne Diseases p.89-117. UK.
Safitri, R. dan Novel, S. S. 2010. Medium Analisis Mikroorganisme. Trans Info Media, Jakarta.
Safitri, R., Novel, S. S., dan Wulandari, A. P. 2010. Praktikum Mikrobiologi Dasar. Trans Info Media, Jakarta.
Zimbro, M. J., Power, D. A., Miller, S. M., Wilson, G. E., Johnson, J. A. 2009. DifcoTM
and BBLTM Manual, Manual of Microbiological Culture Media Second
98
BAB VII
HASIL UJI MAKROSKOPIK DAN
MIKROSKOPIK TUMBUHAN
KAWASAN IE BRÔK
7.1. Hasil Makroskopik dan Mikroskopik Tumbuhan
Kawasan Ie Brôk
engamatan makroskopik dan mikroskopik dilakukan terhadap simplisia tumbuhan kawasan Ie Brôk, yang bertujuan untuk mengetahui karakteristik spesifik dari masing-masing simplisia tersebut. Pengamatan makroskopik dilakukan secara visual untuk mengetahui morfologi tumbuhan, sedangkan mikroskopik dilakukan dengan menggunakan mikroskop untuk mengetahui fragmen pengenal masing-masing simplisia menggunakan perbesaran 40x.
7.1.1. Hasil Pengamatan Makroskopik
Hasil pengamatan secara makroskopik menunjukkan bahwa simplisia daun D. canniformis (G. Forst.) K. Schum memiliki bentuk daun yang lonjong, bentuk pinggiran daun bergulung, berwarna hijau pudar, mudah rapuh, dan bau seperti daun pada umumnya, sedangkan kulit batangnya memiliki bentuk kulit batang yang licin, berwarna hijau
109
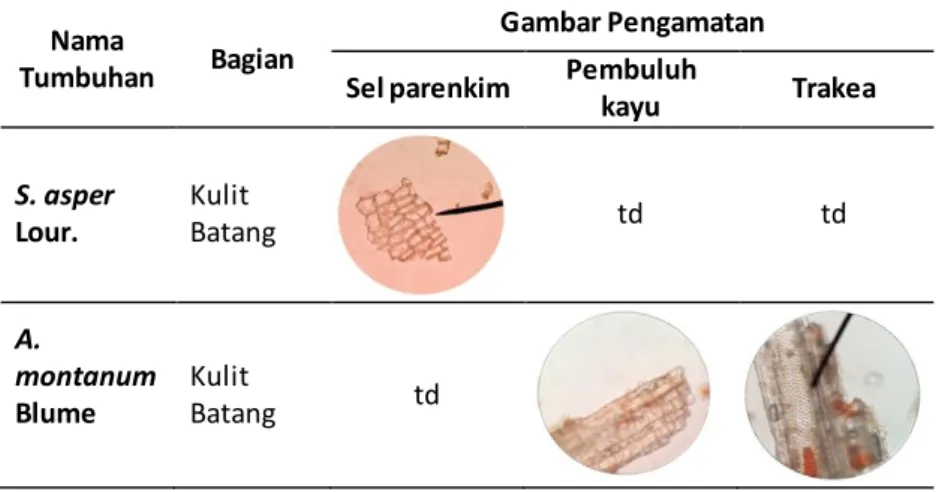
Tabel 7.5. Hasil pengamatan mikroskopik sel parenkim, pembuluh kayu
(xylem), dan trakea
Nama
Tumbuhan Bagian
Gambar Pengamatan Sel parenkim Pembuluh
kayu Trakea S. asper Lour. Kulit Batang td td A. montanum Blume Kulit Batang td
Keterangan: td = tidak diidenfikasi
Referensi:
110
BAB VIII
HASIL UJI SKRINING TUMBUHAN
KAWASAN IE BRÔK
8.1. Hasil Skrining Fitokimia Tumbuhan Kawasan Ie Brôk
krining fitokimia yang diidentifikasi meliputi senyawa alkaloid, flavonoid, saponin, steroid, triterpenoid, dan tanin yang diuji secara kualitatif menggunakan larutan pereaksi. Hasil yang diperoleh berdasarkan perubahan warna maupun endapan yang terjadi antara ekstrak sampel tumbuhan dengan pereaksi pada masing-masing uji. Hasil skrining fitokimia pada penelitian ini menunjukkan hasil yang berbeda-beda pada setiap jenis tumbuhan di kawasan Ie Brôk yang dapat dilihat pada Tabel 8.1.
Tabel 8.1. Hasil Skrining fitokimia ekstrak n-heksana, etil asetat, dan etanol
sampel tumbuhan
Nama
Tumbuhan Bagian Ekstrak
Kandungan Fitokimia A F S T St Tt D. canniformis (G. Forst.) K. Schum. Daun n-heksana - - - + + - etil asetat - - - + + - Etanol + - + + - + Kulit Batang n-heksana - - - - + - etil asetat - - - + - + Etanol + - - + + - S. albicans (Blume) J.J.Sm. Daun n-heksana - - - - + - etil asetat - - - + + - Etanol - - + + + -
S
126
Gambar 8.1. Diameter zona hambat; (a) ekstrak etil asetat kulit batang D.
canniformis (G. Forst.) K. Schum. terhadap bakteri S. aureus,
(b) ekstrak etil asetat daun S. albicans (Blume) J.J.Sm. terhadap bakteri S. aureus, (c) ekstrak etil asetat daun S. albicans (Blume) J.J.Sm. terhadap bakteri E. coli, (d) zona hambat ekstrak etil asetat kulit batang F. dimorpha King terhadap bakteri S. aureus, (e) zona hambat ekstrak etil asetat kulit batang F. dimorpha King terhadap bakteri E. coli, (f) zona hambat ekstrak etanol daun A. montanum Blume terhadap S.
aureus, (g) zona hambat ekstrak etil asetat daun Salacia sp
terhadap bakteri S. aureus, (h) zona hambat ekstrak etanol kulit batang S. asper Lour terhadap bakteri S. aureus, (i) zona hambat etil asetat daun Salacia sp terhadap E. coli, (j) zona hambat ekstrak etil asetat C. odorata (L.) R.M.King & H.Rob terhadap bakteri S. aureus, (k) zona hambat ekstrak etanol daun A. montanum Blume terhadap E. coli, (l) zona hambat yang dihasilkan oleh ekstrak etil asetat dan etanol daun Salacia sp terhadap jamur C.albicans.
Keterangan gambar :1 = ekstrak n-heksana; 2 = pelarut n-heksana (kontrol negatif); 3 = ekstrak etil asetat; 4 = pelarut etil asetat (kontrol negatif); 5 = ekstrak etanol; 6 = pelarut etanol (kontrol negatif); 7 = suspensi ciprofloxacin (kontrol positif).
Referensi:
Chaffin, W. L., Martinez, J. P., Gil, M. L., Lopez-Ribot, J. L. 1998. Serological Response to Cell Wall Mannoproteins and Protein of Candida albicans. Clin. Microbiol.
127 Farnsworth, N.R. 1996. Biological and phytochemical screening of plants. J. Pharm.
Sci. 55 (3):225-276.
Kukula-Koch, W. A. and Widel ski, J. 2017. Alkaloids, p.163-198. In Pharmacognosy (Eds: S. Badal and R. Delgoda). Academic Press, United States.
Marliana, S. D., Suryanti, V., dan Suyono. 2005. Skrining Fitokimia dan Analisis Kromatografi Lapis Tipis Komponen Kimia Buah Labu Siam (Sechium edule Jacq. Swartz.) dalam Ekstrak Etanol. Biofarmasi 3 (1): 26-31.
Maroszyńska, M., Kunicka-Styczyńska, A., Rajkowska, K. and Maroszyńska, I. 2013. Antibiotics sensitivity of Candida clinical and food-borne isolates. Acta
Biochim. Pol. 60 (4): 719-724.
Prayoga, E. 2013. Perbandingan Efek Ekstrak Daun Sirih Hijau (Piper betle L.) dengan Metode Difusi Disk Sumuran terhadap Pertumbuhan Bakteri Staphylococcus
aureus. Skripsi. Universitas Islam Negeri Syarif Hidayatullah, Jakarta.
Quan-zhen Lv, Lan Yan, and Yuan-ying Jiang. 2016. The synthesis, regulation, and functions of sterols in Candida albicans: Well-known but still lots to learn.
Virulence 7 (6): 649-659.
Robinson, T. 1995. Kandungan Organik Tumbuhan Tinggi. Terjemahan dari The Organic Constituents of Higher Plants, oleh Kosasih Padmawinata, ITB, Bandung.
Sangi, M. S., Momuat, L. I., dan Kumaunang, M. 2012. Uji Toksisitas dan Skrining Fitokimia Tepung Gabah Pelepah Aren (Arenga pinnata). Jurnal Ilmiah Sains 12 (2): 127-134.
Sieniawska, E. and Baj, T. 2017. Tannins, p.199-232. In Pharmacognosy (Eds: S. Badal and R. Delgoda). Academic Press, United States.
Sytykiewicz, H., Chrzanowski, G., Czerniewicz, P., Leszczynski, B., Sprawka, I., Krzyzanowski, R., and Matok H. 2015. Antifungal Activity of Juglans regia (L.) Leaf Extracts Against Candida albicans Isolates. Pol. J. Environ. Stud. 24 (3): 1339-1348.
Taleb-Contini, S. H., Salvador, M. J., Watanabe, E., Ito, I. Y., and Olievera, D. C. R. 2003. Antimicrobial Activity of Flavonoids and Steroids Is olated from Two
128
Woźniak, L., Skapska, S., and Marzalek, K. 2015. Ursolic Acid-A Pentacyclic Triterpenoid with a Wide Spectrum of Pharmacological Activities.
129
BAB IX
PENUTUP
9.1. Kesimpulan
erdasarkan hasil dari uraian diatas, maka dapat disimpulkan bahwa:
1. Tumbuhan di kawasan Ie Brôk mempunyai aktivitas sebagai antimikroba, terutama sebagai antibakteri. Hanya daun dari tumbuhan Salacia sp yang memiliki aktivitas antijamur terhadap C. albicans ATTC 10231 dengan kategori diameter zona hambat sangat kuat (>20 mm).
2. Kandungan metabolit sekunder ekstrak n-heksana, etil asetat, dan etanol tumbuhan di kawasan Ie Brôk umumnya mengandung senyawa tanin dan steroid.
3. Tumbuhan yang mempunyai aktvitas sebagai antimikroba di kawasan Ie Brôk didominasi oleh tumbuhan berpohon, perdu, dan herba.
9.2. Kepentingan Monograf
Biodiversitas spesies yang tersebar dipermukaan bumi kini terancam punah, karena adanya aktivitas manusia yang dapat mengganggu kelangsungan hidup keanekaragaman hayati.