15
PRODUKSI N-ASETILGLUKOSAMIN DENGAN KITINASE INTRASELULER DARI Providencia stuartii YANG DIIMOBILISASI MENGGUNAKAN κ-KARAGENAN [PRODUCTION OF N-ACETYLGLUCOSAMINE USING INTRACELLULAR CHITINASE
FROM Providencia stuartii IMMOBILIZED IN κ-CARRAGEENAN]
Yuniwaty Halim1*, Freddy Chayadi1, Hardoko2, Ratna Handayani1
1Program Studi Teknologi Pangan, Universitas Pelita Harapan, Tangerang, Indonesia 2Fakultas Perikanan dan Ilmu Kelautan, Universitas Brawijaya, Malang, Indonesia
*Korespondensi penulis: yuniwaty.halim@uph.edu
ABSTRACT
β-1,4-N-acetyl-D-glucosamine or N-acetylglucosamine is a product of chitin depolimerization that has been used in health application, one of them is to cure osteoarthritis. In this research, N-acetylglucosamine was obtained from chitin that was isolated from black Tiger shrimp shells using intracellular chitinase of Providencia stuartii. The aims of this research were to determine the best ratio between enzyme and support, and optimum fermentation cycle of intracellular chitinase from Providencia stuartii that was immobilized by κ-carrageenan using entrapment method. Ratio of enzyme and support used was 1:1; 1.5:1; 2:1, and the best ratio was used in 3 fermentation cycles to determine the optimum enzyme activity and N-acetylglucosamine produced. Results showed that the best ratio between enzyme and support was 2:1 with N-acetylglucosamine produced was 7,573.34 ± 285.97 ppm and chitinase activity of 11.41 ± 0.43 U/mL. Chitinase enzyme can be used up to 3 cycles of fermentation, retaining its activity of about 27%.
Keywords : chitinase, intracellular enzyme, immobilization, κ-carrageenan, Providencia stuartii ABSTRAK
β-1,4-N-asetil-D-glukosamin atau N-asetilglukosamin merupakan hasil depolimerisasi kitin yang telah banyak dimanfaatkan dalam bidang kesehatan, salah satunya untuk mengobati osteoarthritis. Pada penelitian ini, N-asetilglukosamin dihasilkan dari kitin yang diisolasi dari cangkang udang windu menggunakan kitinase intraseluler dari bakteri Providencia stuartii. Tujuan dari penelitian ini adalah menentukan rasio terbaik antara enzim dan support, dan siklus fermentasi optimum kitinase intraseluler Providencia stuartii yang diimobilisasi menggunakan κ-karagenan dengan metode entrapment. Rasio enzim dan support yang digunakan adalah 1:1; 1,5:1; 2:1, dan rasio terbaik digunakan dalam 3 siklus fermentasi untuk menentukan aktivitas enzim dan produksi N-asetilglukosamin optimum. Hasil menunjukkan bahwa rasio terbaik antara enzim dan support adalah 2:1 dengan N-asetilglukosamin yang dihasilkan sebesar 7.573,34 ± 285,97 ppm dan aktivitas kitinase sebesar 11,41 ± 0,43 U/mL. Enzim kitinase dapat digunakan sampai 3 siklus fermentasi dengan mempertahankan aktivitasnya sebesar 27%.
16
PENDAHULUAN
Udang merupakan salah satu hasil budidaya perikanan yang digemari di Indonesia, dilihat dari kenaikan produksi udang di Indonesia pada tahun 2010-2014 yang mencapai 13,83%. Komoditas udang yang memiliki peningkatan produksi rata-rata terbesar adalah udang windu (3,32%), dan udang vaname (20,49%) (DJPB, 2016). Produksi udang yang tinggi tidak diimbangi dengan pemanfaatan limbah cangkang udang yang besarnya 25% dari total produksi, yaitu hanya 30% limbah cangkang udang yang dimanfaatkan (Dompeipen et
al., 2016).
Kitin yang merupakan salah satu komponen utama pada cangkang udang yang tidak dapat diserap oleh tubuh dengan baik karena kelarutannya yang rendah. Walaupun demikian, glukosamin hasil depolimerisasi kitin dapat dimanfaatkan oleh manusia sebagai peringan rasa sakit akibat osteoarthritis, memperbarui cairan sinovial, dan memperbaiki sendi yang terkena osteoartritis (Hauselman, 2001).
Bakteri Providencia stuartii
merupakan salah satu bakteri yang dapat dimanfaatkan untuk mendegradasi kitin menjadi glukosamin secara alami. Kelebihan dari fermentasi enzimatis dibandingkan fermentasi dengan
mikroorganisme adalah waktunya yang lebih singkat, reaksinya spesifik dengan rendemen glukosamin yang lebih tinggi, yaitu sebesar 91,3% menggunakan enzim α-amilase komersial dan 86,2% menggunakan enzim glukoamilase komersial (Pan et al., 2011). Selanjutnya, untuk meningkatkan efisiensi dan produktivitas kitinase dalam memproduksi glukosamin, salah satu metode yang dapat dilakukan adalah dengan melakukan imobilisasi enzim.
Imobilisasi enzim dapat dilakukan dengan berbagai metode seperti adsorpsi,
entrapment, enkapsulasi, dan ikatan silang
(cross-linking) (Datta et al., 2013). Metode
entrapment merupakan salah satu metode
yang umum digunakan, yaitu dengan memerangkap enzim melalui ikatan kovalen maupun non-kovalen menggunakan gel atau serat (Singh, 2009). Metode ini menggunakan beberapa polisakarida, seperti κ-karagenan, alginat, dan agarosa, namun salah satu yang paling sering digunakan adalah κ-karagenan (Girigowda et al., 2007). κ-karagenan merupakan support untuk imobilisasi yang murah dan telah diketahui dapat meningkatkan stabilitas lipase, yaitu dapat digunakan hingga 40 kali siklus reaksi dengan aktivitas enzim tersisa sebesar 22% (Tümtürk et al., 2007) dan 𝛽-galaktosidase, yaitu dapat digunakan hingga
17 20 kali siklus reaksi dengan aktivitas enzim
tersisa sebesar 60% (Elnashar et al., 2014). Selain itu, penelitian sebelumnya juga melaporkan bahwa lipase yang diimobilisasi dengan κ-karagenan menggunakan metode
entrapment bersifat termostabil dan tahan
terhadap pelarut organik, yaitu metanol (Tűmtűrk et al., 2007; Jegannathan et al., 2010).
Penelitian ini dilakukan untuk untuk menentukan rasio enzim : support terbaik untuk imobilisasi kitinase dari Providencia
stuartiii dengan metode entrapment. Selain
itu, penelitian ini juga bertujuan untuk menentukan jumlah siklus fermentasi optimum yang dapat dilakukan dengan menggunakan kitinase yang diimobilisasi dengan κ-karagenan.
BAHAN DAN METODE Bahan dan Alat
Bahan utama yang digunakan dalam penelitian ini adalah kitin yang diisolasi dari cangkang udang windu (Penaeus monodon) yang diperoleh dari PT. Lola Mina, Muara Baru, Jakarta Utara, Indonesia, kultur
Providencia stuartii, κ-karagenan, dan
standar N-asetilglukosamin (Sigma Aldrich). Bahan-bahan lain yang digunakan dalam analisis adalah kalium dihidrogen fosfat (KH2PO4), di-kalium fosfat
(K2HPO4), magnesium sulfat heptahidrat
(MgSO4.7H2O), amonium sulfat
((NH4)2SO4), buffer sitrat pH 5, buffer lisis,
buffer fosfat, buffer kalium fosfat pH 8, KCl, DNS (3,5- Dinitrosalicylic acid) (Sigma Aldrich), dan kalium natrium tartarat (Na-K-Tartarat).
Alat yang digunakan dalam penelitian ini adalah neraca analitik (Ohaus), sieve shaker (Retsch), shaker
incubator (Heidolph 22 Unimax 1010),
mikropipet, centrifuge (Hettich), inkubator (Memmert BE600), laminar air flow (ESCO ECH-4), sonikator (Krisbow), spektrofotometer UV-VIS (Hitachi U-1800), pH meter (Metrohm 913), suntikan medis, dan alat-alat gelas.
Metode Penelitian
Produksi dan Isolasi Enzim Kitinase Intraseluler
Produksi enzim kitinase dilakukan dengan menggunakan media Nutrient Broth yang sudah difortifikasi dengan 1% kitin, 0,03% KH2PO4, 0,07% K2HPO4, 0,01%
MgSO4.7H2O, dan 0,7% (NH4)2SO4.
Volume media fermentasi yang digunakan adalah 300 mL. Media kemudian diinokulasi dengan kultur kerja Providencia
stuartii sebanyak 60 mL dan diinkubasi
pada suhu 40oC selama 18 jam menggunakan shaker incubator. Pemisahan
18 sel bakteri dilakukan dengan menggunakan
centrifuge pada kecepatan 3500 rpm selama
15 menit pada suhu 4oC untuk mencegah denaturasi enzim. Supernatan yang diperoleh merupakan enzim ekstraseluler kasar, dan endapan yang didapatkan adalah sel bakteri yang mengandung kitinase intraseluler (Lestari et al., 2017; Kubota et
al., 2004).
Sel yang mengendap dipisahkan dari supernatan dengan dekantasi. Endapan yang diperoleh (sel bakteri) kemudian dilarutkan kembali dalam 4 mL larutan buffer lisis (per 80 mL kultur bakteri yang digunakan). Sel bakteri kemudian dipecah secara sonikasi pada frekuensi 47KHz selama 10 menit, kemudian disentrifugasi. Supernatan yang didapatkan dari sentrifugasi kemudian diendapkan dengan penambahan ammonium sulfat 70% pada suhu rendah. Suspensi kemudian didiamkan selama 18 jam pada suhu 4oC. Suspensi kemudian dipisahkan dengan sentrifugasi. Endapan kemudian dilarutkan kembali dengan 8 mL
buffer kalium fosfat 0,05 M pH 8 (per
150mL kultur bakteri yang digunakan). Endapan akhir yang diperoleh merupakan kitinase intraseluler semi murni.
Imobilisasi Kitinase Intraseluler Semi Murni dan Fermentasi Enzimatis untuk Produksi N-asetilglukosamin
Imobilisasi enzim kitinase (entrapment) dengan κ-karagenan sebagai
support dilakukan dengan menggunakan
metode yang dilakukan oleh Sankalia et al. (2006) yang dimodifikasi. Sebanyak 3,5% κ-karagenan dilarutkan dalam 100 mL akuades pada suhu 70-80oC. Larutan κ-karagenan kemudian didinginkan hingga suhunya menjadi 40oC. Setelah suhunya turun, larutan κ-karagenan ditambahkan dengan enzim dan support pada rasio 1:1; 1,5:1; dan 2:1 dengan total volume sebesar 2 mL. Penentuan rasio ini berdasarkan penelitian sebelumnya oleh Zusfahair et al. (2017). Campuran kemudian diteteskan pada larutan KCl 2% secara konstan dengan menggunakan suntikan medis. Gel yang terbentuk kemudian digunakan untuk fermentasi enzimatis.
Media fermentasi enzimatis yang digunakan sebanyak 5 mL yang terdiri dari 1% isolat kitin dalam 0,2 M buffer sitrat pH 5. Inkubasi dilakukan selama 6 jam pada suhu 40oC. Setelah inkubasi, dilakukan filtrasi dengan kertas saring untuk memisahkan gel kitinase dari hasil fermentasi enzimatis. Filtrat kemudian dianalisis kadar N-asetilglukosamin dan
19 aktivitas enzimnya (Rahmansyah dan
Sudiana, 2003 dengan modifikasi).
Rasio enzim dan support terbaik yang diperoleh kemudian digunakan untuk menentukan pengaruh jumlah siklus fermentasi terhadap aktivitas kitinase dan produksi N-asetilglukosamin. Penentuan pengaruh jumlah siklus dilakukan dengan cara menambahkan gel kitinase sebanyak ± 72 beads ke dalam media fermentasi enzimatis. Inkubasi dilakukan selama 6 jam pada suhu 40oC dan prosedur ini dilakukan sebanyak 3x untuk menentukan aktivitas enzim dari gel kitinase yang digunakan sebanyak 3x. Setiap selesai inkubasi, dilakukan filtrasi dengan kertas saring untuk memisahkan gel kitinase dengan media fermentasi enzimatis. Filtrat kemudian dianalisis kadar N-asetilglukosamin dan aktivitas enzimnya (Rahmansyah dan Sudiana, 2003 dengan modifikasi).
Analisis Kadar N-asetilglukosamin dan Aktivitas Kitinase Intraseluler Semi Murni
Analisis aktivitas enzim ditentukan dengan menggunakan metode Rahmansyah dan Sudiana (2003) yang dimodifikasi. Aktivitas kitinase dihitung berdasarkan konsentrasi N-asetilglukosamin (NAG) yang terbentuk, sehingga dilakukan juga
pembuatan kurva standar N-asetilglukosamin.
Sebanyak 1 mL larutan N-asetilglukosamin standar (konsentrasi 200, 400, 600, 800, dan 1000 ppm) ditambahkan 2 mL reagen DNS modifikasi, dan Na-K-tartarat 4% sebanyak 1 mL. Campuran tersebut dipanaskan selama 15 menit pada suhu 100oC. Setelah pemanasan, campuran didinginkan dan diencerkan 5-10 kali dengan akuades. Absorbansi campuran yang sudah diencerkan kemudian diukur pada panjang gelombang 540 nm.
Aktivitas kitinase maupun kitinase yang diimobilisasi ditentukan dengan cara mencampurkan 1mL cairan hasil fermentasi dengan 2 mL reagen DNS modifikasi, dan 1 mL Na-K-tartrat 4%, lalu diinkubasi selama 15 menit pada suhu 100oC. Campuran kemudian diencerkan sebanyak 5-10 kali dan diukur absorbansinya pada panjang gelombang 540 nm dengan spektrofotometer. Penentuan aktivitas kitinase semi murni dan kitinase semi murni yang diimobilisasi dihitung dengan menggunakan rumus sebagai berikut.
20
Rancangan Percobaan dan Analisis Data
Rancangan percobaan yang digunakan dalam penelitian ini adalah Rancangan Acak Lengkap (RAL) 1 faktor dengan tiga kali pengulangan. Faktor yang digunakan adalah jumlah siklus fermentasi dengan 3 level, yaitu 1 kali, 2 kali, dan 3 kali. Data yang diperoleh kemudian dianalisis dengan ANOVA dan uji lanjut Duncan dengan menggunakan software SPSS versi 22.0.
HASIL DAN PEMBAHASAN
Pengaruh Rasio Enzim: Support
Terhadap Aktivitas Kitinase dan Produksi N-asetilglukosamin
Pengukuran aktivitas kitinase intraseluler semi murni dilakukan untuk membandingkan aktivitas enzim sebelum dan sesudah diimobilisasi. Penentuan aktivitas kitinase dilakukan pada pH 5 dan suhu 40oC, karena merupakan kondisi optimum bagi kitinase dari bakteri (Cheba
et al., 2015). Adapun aktivitas kitinase
intraseluler semi murni yang diperoleh pada penelitian ini adalah 4,95 ± 0,20 U/mL.
Penentuan rasio enzim dan support terbaik diperlukan karena support yang digunakan untuk imobilisasi memiliki kapasitas tertentu untuk mengikat enzim. Penggunaan formulasi pada penelitian ini
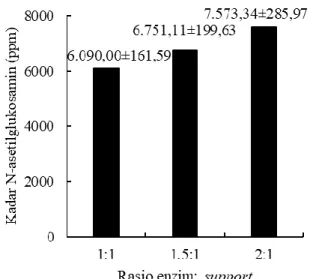
dilakukan dengan menggunakan metode yang dilakukan oleh Zusfahair et al. (2017). Kadar N-asetilglukosamin dan aktivitas enzim yang dihasilkan dengan berbagai rasio enzim : support dapat dilihat pada Gambar 1 dan Gambar 2.
Gambar 1. Pengaruh rasio enzim: support terhadap kadar N-asetilglukosamin
Gambar 1 menunjukkan rasio enzim : support berpengaruh terhadap kadar N-asetilglukosamin yang diproduksi. Semakin tinggi rasio enzim : support yang digunakan maka semakin tinggi juga kadar N-asetilglukosamin yang diproduksi. Hal ini disebabkan oleh semakin banyak enzim kitinase intraseluler kasar yang diimobilisasi oleh κ-karagenan. Menurut Chen et al. (2013), semakin tinggi konsentrasi enzim
21 yang diimobilisasi maka semakin tinggi
juga aktivitas enzim yang diperoleh yang berdampak pada meningkatnya produk yang diperoleh dari reaksi enzimatis yang dilakukan selama fermentasi.
Xun et al. (2012) melaporkan bahwa jika jumlah enzim yang terikat pada support terlalu banyak, yaitu lebih dari rasio 3:1, aktivitas enzim dapat menurun, sehingga produk yang dihasilkan juga menurun. Pada penelitian ini, rasio enzim : support terbaik untuk untuk menghasilkan N-asetilglukosamin adalah 2:1, dengan kadar N-asetilglukosamin yang dihasilkan adalah sebesar 7573,34 ± 285,97 ppm. Hasil ini lebih tinggi dibandingkan dengan imobilisasi kitinase menggunakan kalsium alginat dengan kadar N-asetilglukosamin yang dihasilkan adalah 1347,78 ± 27,22 ppm (Halim et al., 2019).
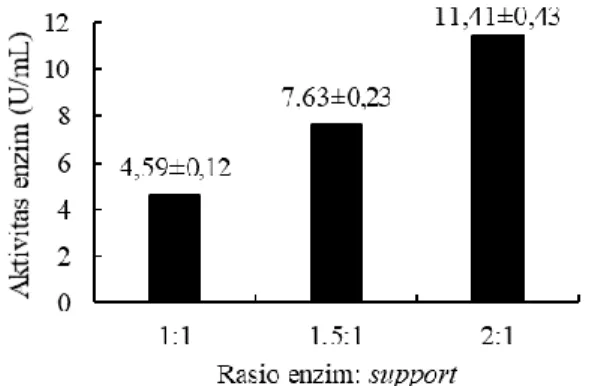
Gambar 2 menunjukkan rasio enzim:
support juga berpengaruh terhadap aktivitas
kitinase. Rasio enzim : support sebesar 2:1 memberikan aktivitas enzim yang tertinggi karena semakin tinggi konsentrasi enzim yang diimobilisasi, maka aktivitas enzim yang diperoleh juga semakin tinggi (Chen et
al., 2013).
Gambar 2. Pengaruh rasio enzim: support terhadap aktivitas kitinase Penelitian sebelumnya oleh Rathan dan Thayumanavan (2017) menunjukkan bahwa imobilisasi kitinase dari
Pseudomonas putida dengan kitosan pada
konsentrasi 7% (w/v) memiliki aktivitas enzim sebesar 3,5 U/mL. Hal ini menunjukkan bahwa imobilisasi enzim dengan κ-karagenan pada penelitian ini pada rasio terendah hingga tertinggi memiliki nilai aktivitas enzim yang lebih besar.
Hasil penelitian juga menunjukkan bahwa proses imobilisasi menghasilkan kitinase dengan aktivitas yang lebih tinggi, yaitu sekitar 3 kali lipat jika dibandingkan dengan kitinase yang tidak diimobilisasi. Hal ini sesuai dengan penelitian oleh Zhang
et al. (2016) bahwa imobilisasi dapat
meningkatkan aktivitas β-galaktosidase hingga 2-3 kali lipat dibandingkan dengan enzim yang tidak diimobilisasi.
22
Pengaruh Jumlah Siklus Fermentasi Terhadap Aktivitas Kitinase dan Produksi N-asetilglukosamin
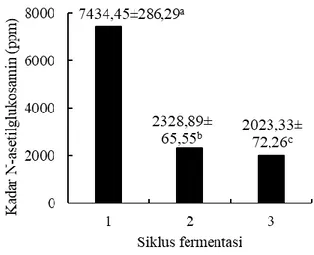
Penentuan siklus fermentasi optimum dilakukan dengan mengimobilisasi kitinase dari Providencia stuartii pada rasio terbaik, yaitu 2:1. Pada penelitian ini, dilakukan siklus fermentasi sebanyak 3 kali sesuai dengan penelitian sebelumnya oleh Won et al. (2005). Hasil uji statistik menggunakan ANOVA menunjukkan bahwa jumlah siklus fermentasi memberikan pengaruh signifikan terhadap kadar N-asetilglukosamin yang dihasilkan dan aktivitas kitinase (p<0,05). Gambar 3 menunjukkan hasil uji lanjut Duncan dari pengaruh siklus fermentasi terhadap kadar N-asetilglukosamin yang dihasilkan.
Hasil uji lanjut Duncan menunjukkan adanya perbedaan signifikan pada hasil dari tiap siklus fermentasi. Siklus fermentasi optimum dari enzim kitinase intraseluler kasar dari Providencia stuartii yang diimobilisasi dengan κ-karagenan adalah 1 siklus walaupun kitinase intraseluler ini masih dapat digunakan hingga 3 siklus reaksi, dilihat dari masih adanya N-asetilglukosamin yang diproduksi hingga akhir siklus reaksi. Akan tetapi, penurunan kadar N-asetilglukosamin yang signifikan ini menunjukkan ketidakstabilan
κ-karagenan dalam mengimobilisasi kitinase intraseluler semi murni.
Keterangan: Notasi yang berbeda menunjukkan adanya perbedaan signifikan (p<0,05) Gambar 3. Pengaruh jumlah siklus
penggunaan enzim terhadap kadar N-asetilglukosamin
Penurunan signifikan dari kadar N-asetilglukosamin yang diproduksi dapat disebabkan oleh terjadinya sineresis pada gel κ-karagenan yang menyebabkan keluarnya enzim dan cairan yang terperangkap di dalam matriks beads κ-karagenan. κ-karagenan dapat digunakan untuk enkapsulasi enzim, akan tetapi kebocoran enzim dapat terjadi (Zhang et al., 2016).
Jumlah siklus fermentasi optimum yang didapatkan dari penelitian ini juga lebih rendah jika dibandingkan dengan penelitian Elnashar et al. (2014) yang menunjukkan bahwa imobilisasi enzim 𝛽-galaktosidase ke dalam gel beads
κ-23 karagenan dapat digunakan sebanyak 20
siklus dan dapat mempertahankan 60% aktivitas enzim semula. Akan tetapi, pada penelitian Elnashar et al. (2014), metode imobilisasi yang digunakan adalah metode kimiawi dengan aktivasi gel κ-karagenan secara 2 tahap, yaitu menggunakan larutan
polyethyleneimine dan glutaraldehid.
Keterangan: Notasi yang berbeda menunjukkan adanya perbedaan signifikan (p<0,05) Gambar 4. Pengaruh jumlah siklus
penggunaan enzim terhadap aktivitas kitinase
Gambar 4 menunjukkan hasil uji lanjut Duncan dari pengaruh siklus fermentasi terhadap aktivitas kitinase. Hasil uji Duncan menunjukkan semakin banyak siklus fermentasi yang dilakukan, maka aktivitas kitinase juga semakin menurun. Hal ini dapat disebabkan sineresis gel κ-karagenan, sehingga menyebabkan keluarnya enzim dari sistem gel. Jumlah siklus fermentasi optimum dari kitinase
intraseluler semi murni dari Providencia
stuartii yang diimobilisasi dengan
κ-karagenan adalah 1 siklus, tetapi enzim masih menunjukkan aktivitasnya hingga 3 siklus fermentasi.
Aktivitas enzim antar siklus kemudian dihitung dengan cara mengasumsikan pada siklus 1 aktivitas enzim adalah 100% untuk digunakan sebagai pembanding (Sharma et al., 2014). Pada siklus fermentasi ke-2, aktivitas enzim kitinase yang diimobilisasi turun menjadi 31% dan pada siklus ke-3 menjadi 27%. Hal ini dapat disebabkan oleh diameter dari
beads imobilisasi yang >0,71 mm. Menurut
Sharma et al. (2014) jika diameter beads yang digunakan untuk imobilisasi adalah sebesar 0,71–1,40 mm akan menyebabkan penurunan aktivitas enzim secara cepat.
Penelitian lain oleh Desai et al. (2004) juga menunjukkan bahwa enzim lipase yang diimobilisasi dengan karagenan dapat digunakan hingga 5 siklus fermentasi dengan mempertahankan 50% dari aktivitas enzimnya. Hal ini menunjukkan walaupun kitinase yang diimobilisasi dapat digunakan hingga 3 siklus fermentasi, diperlukan metode imobilisasi lain selain metode
entrapment apabila support yang digunakan
adalah κ-karagenan untuk mempertahankan aktivitas enzimnya.
24
KESIMPULAN
Rasio enzim : support terbaik untuk imobilisasi kitinase intraseluler Providencia
stuartii adalah sebesar rasio 2:1 dengan
aktivitas enzim sebesar 11,41 ± 0,43 U/mL dan menghasilkan kadar N-asetilglukosamin sebesar 7573,34 ± 285,97 ppm. Imobilisasi menghasilkan aktivitas kitinase yang lebih tinggi dibandingkan dengan kitinase yang tidak diimobilisasi, yaitu sebesar 4,95 ± 0,20 U/mL. Siklus fermentasi memengaruhi aktivitas kitinase dan kadar N-asetilglukosamin yang dihasilkan. Produksi N-asetilglukosamin tertinggi diperoleh setelah 1 siklus fermentasi, yaitu 7434,45 ± 286,29 ppm dengan aktivitas kitinase sebesar 11,20 ± 0,43 U/mL. Kitinase intraseluler semi murni dari Providencia
stuartii dapat digunakan hingga 3 siklus
fermentasi dengan mempertahankan 27% dari aktivitas enzim semula.
UCAPAN TERIMA KASIH
Penulis ingin mengucapkan terima kasih kepada Laboratorium Mikrobiologi, Laboratorium Penelitian dan Inovasi Pangan, Universitas Pelita Harapan yang memfasilitasi penelitian ini. Penulis juga ingin mengucapkan terima kasih kepada Lembaga Penelitian dan Pengabdian Masyarakat (LPPM), Universitas Pelita
Harapan yang telah mendanai penelitian ini berdasarkan skema penelitian No. P-008-FaST/VI/2018.
DAFTAR PUSTAKA
Cheba, B. A., Zaghloul, T. I., El-Mahdy, A. R. and El-Massry, M. H. 2015. Effect of pH and temperature on Bacillus sp. R2 chitinase activity and stability. Procedia Technology 22 : 471-477. Chen, J. K., Shen, C. R. and Liu, C. L.
2010. N-acetylglucosamine: production and applications. Marine Drugs 8 (9) : 2493-2516. DOI: 10.3390/md8092493. Datta, S., Christena, L. R. and Rajaram, Y.
R. S. 2013. Enzyme immobilization: an overview on techniques and support materials. Biotech 3 (1) : 1-9. DOI: 10.1007/s13205-012-0071-7.
Desai, P. D., Dave, A. M. and Devi. S. 2004. Entrapment of lipase into K-carrageenan beads and its use in hydrolysis of olive oil in biphasic system. Journal of Molecular Catalysis B: Enzymatic 31 (4-6) : 143-150. Direktorat Jenderal Perikanan Budidaya
(DJPB). 2016. Udang vaname dan udang windu masih andalan ekspor Indonesia. Pakan. Downloaded from http://www.djpb.kkp.go.id/arsip/c/246/ Udang-Vannamei-dan-Udang-Windu-
Masih-AndalanEkspor-Indonesia/?category_id=13 on 14/7/2018.
Dompeipen, E. J., Kaimudin, M. dan Dewa, R. P. 2016. Isolasi kitin dan kitosan dari limbah kulit udang. Majalah Biam 12 (1) : 32-29. DOI: 10.29360/mb.v12i1.2326
25 Ehiowemwenguan, G., Emoghene, A. O.
and Inetianbor, J.E. 2014. Antibacterial and phytochemical analysis of banana fruit peel. IOSR Journal of Pharmacy 4 (8) : 18-25. DOI: 10.9790/3013-0408018025.
Elnashar, M. M., Awad, G. E., Hassan, M. E., Eldin, M. S. M., Haroun, B. M. and El-Diwany, A. I. 2014. Optimal immobilization of 𝛽-galactosidase onto 𝜅-carrageenan gel beads using response surface methodology and its applications. The Scientific World Journal : 1-7. DOI: 10.1155/2014/571682
Girigowda, K., Kapnoor, S. S., Kulkarni, D. and Mulimani, V. H. 2007. Degradation of raffinose oligosaccharides in soymilk by immobilized α-galactosidase of Aspergillus oryzae. Journal of Microbiology and Biotechnology 17 (9) : 1430-1436. Halim, Y., Hendarlim, B. D., Hardoko,
Handayani, R. and Rosa, D. 2019. Imobilisasi kitinase Providencia stuartii dengan kalsium alginat dan
aplikasinya dalam produksi N-asetilglukosamin. FaST-Jurnal Sains dan Teknologi 3 (2) : 35-44.
Hauselman, H. J. 2001. Nutripharmaceuticals for osteoarthritis. Best Practice & Research Clinical Rheumatology 15 (4) : 595-607.
Jegannathan, K. R., Jun-Ye, L., Chan, E. S. and Ravindra, P. 2010. Production of biodiesel from palm oil using liquid core lipase encapsulated in κ-carrageenan. Fuel 89 : 2272–2277. DOI: 10.1016/j.fuel.2010.03.016
Kubota, T., Miyamoto, K., Yasuda, M., Inamori, Y. and Tsujibo, H. 2004. Molecular characterization of an intracellular
β-N-acetylglucosamini-dase involved in the chitin degradation system of Streptomyces thermoviolaceus OPC-520. Bioscience,
Biotechnology, and Biochemistry 68 (6) : 1306-1314. DOI: 10.1271/bbb.68.1306.
Lestari, P., Prihatiningsih, N. and Djatmiko, H. A. 2017. Partial biochemical characterization of crude extract extracellular chitinase enzyme from
Bacillus subtilis B298. Proceeding 11th
Joint Conference on Chemistry in Conjunction with the 4th Regional Biomaterials Scientific Meeting, p. 1-9. Purwokerto, Indonesia: FMIPA, Universitas Jenderal Soedirman. Pan, S., Wu, S. J. and Kim, J. M. 2011.
Preparation of glucosamine by hydrolysis of chitosan with commercial α-amylase and glucoamylase. Journal of Zhejiang University 12 (11) : 931-934. DOI: 10.1631/jzus.B1100065 Rahmansyah, M. dan Sudiana, I.M. 2003.
Optimasi analisis amilase dan glukanase yang diekstrak dari miselium
Pleurotus ostreatus dengan asam 3,5
dinitrosalisilat. Berkalah Penelitian Hayati 9 : 7-12. DOI: 10.23869/bphjbr.9.1.20032.
Rathan, S. and Thayumanavan, T. 2017. Immobilization of chitinase from
Pseudomonas putida on biocompatible
chitosan beads and the properties of the immobilized enzyme. Journal of Global Biosciences 6 (5) : 5032-5045.
Sankalia, M. G., Mashru, R. C., Sankalia, J. M. and Sutariya, V. B. 2006. Stability improvement of alpha-amylase entrapped in kappa-carrageenan beads: physicochemical characterization and optimization using composite index. International Journal of Pharmaceutics 312 (1-2) : 1-14. DOI: 10.1016/j.ijpharm.2005.11.048
26 Sharma, M., Sharma, V. and Majumdar,
D.K. 2014. Entrapment of 𝛼-amylase in agar beads for biocatalysis of macromolecular substrate. Hindawi: International Scholarly Research Notices 2014 : 1-8. DOI: 10.1155/2014/936129
Singh, B. D. 2009. Biotechnology Expanding Horizons. India: Kalyani Publishers.
Tümtürk, H., Karaca, N., Demirel, G. and Sahin, F. 2007. Preparation and application of poly (N, N-dimethylacrylamide-co-acrylamide) and poly (N-isopropylacrylamide-co-acrylamide)/κ-Carrageenan hydrogels for immobilization of lipase. International Journal of Biological Macromolecules 40 (3) : 281–285. DOI: 10.1016/j.ijbiomac.2006.07.004 Won, K., Kim, S., Kim, K. J., Park, H. W.
and Moon, S. J. 2005. Optimization of lipase entrapment in Ca-alginate gel beads. Process Biochemistry 40 (6) :
2149-2154. DOI:
10.1016/j.procbio.2004.08.014.
Xun, E., Lu, X., Kang, W., Wang, J., Zhang, H., Wang, L. and Wang, Z. 2012. Immobilization of Pseudomonas
fluorescens lipase onto magnetic nanoparticles for resolution of 2-octanol. Applied Biochemistry and Biotechnology 168 : 697-707. DOI: 10.1007/s12010-012-9810-9.
Zhang, Z., Zhang, R., Chen, L. and McClements, D. J. 2016. Encapsulation of lactase (β-galactosidase) into κ-carrageenan-based hydrogel beads: Impact of environmental conditions on enzyme activity. Food Chemistry 200
(6) : 69-75. DOI:
10.1016/j.foodchem.2016.01.014.
Zusfahair, Ningsih, D. R., Fatoni, Kartika, D., Fatoni, A. and Zuliana, A. L. 2017.
Bacillus thuringiensis HCB6 amylase
immobilization by chitosan beads. Proceeding 11th Joint Conference on
Chemistry in Conjunction with the 4th Regional Biomaterials Scientific Meeting, p. 1-9. Purwokerto, Indonesia: FMIPA, Universitas Jenderal Soedirman.