BAB 1
PENDAHULUAN
1.1 Latar Belakang
Dalam analisis kimia, pengukuran potensial sel merupakan hal yang cukup penting dimana potensial sel gavani bergantung pada aktivitas spesies ion tertentu dalam larutan sel. Dalam banyak kasus, suatu sel dapat direka sehingga potensialnya bergantung pada aktivitas suatu spesies ion tunggal dalam larutan itu. Penetapan pH secara potensiometri. Salah satu penerapan utama potensiometri langsung adalah penetapan pH dari larutan air. Terdapat dua metode yang digunakan dalam melakukan pengukuran eksperimen. Pertama, dilakukan pengukuran tunggal terhadap potensial itu. Kedua, ion itu dapat dititrasi dan potensialnya diukur sebagai fungsi volume titran. Metode pertama disebut potensiometri langsung dan terutama telah digunakan dalam pengukuran pH larutan air. Pengukuran potensiometri langsung sangat berguna untuk menetapkan aktivitas suatu spesies dalam suatu campuran kesetimbangan, karena kesetimbangan tidak dikacaukan oleh pengukuran itu. Potensiometri langsung sangat menarik karena cepat, tidak terlalu mahal, mudah di automasikan dan tidak mudah merusak sampel.
Pengukuran potensiometri langsung sangat berguna untuk menetapkan aktivitas suatu spesies dalam suatu campuran kesetimbangan, karena kesetimbangan tidak dikacaukan oleh pengukuran itu. Misalnya, pH suatu larutan 0,10 F asam asetat mungkin diukur dari konsentrasi ion hidrogen dijumpai sebesar 0,0013 M. Di pihak lain, jika larutan ini dititrasi, kita akan menjumpai konsentrasi sebesar 0,10 M. Titrasi menghasilkan informasi stoikiometri mengenai jumlah total proton yang tersedia. Sedangkan pengukuran langsung memberikan aktivitas kesetimbangan proton dalam larutan itu pada saat kapan saja.
Oleh karena itu dilakukan percobaan ini untuk menetapkan besarnya tetapan hidrolisa (Kh) dari larutan Pb(NO3)2 dalam air, serta besarnya nilai Ksp dari garam PbI2 dan PbSO4 pada temperatur kamar secara potensiometri langsung.
1.2 Tujuan Percobaan
Mengetahui nilai tetapan hasil kali kelarutan PbI2 dan PbSO4 dalam percobaan.
Mengetahui tetapan ionisasi basa (Kb) larutan Pb(NO3)2 dengan berbagai konsentrasi pada percobaan. Mengetahui tetapan hidrolisa (Kh) larutan Pb(NO3)2 dengan berbagai konsentrasi pada percobaan.
BAB 2
TINJAUAN PUSTAKA
Potensial dalam titrasi potensiometri dapat diukur sesudah penambahan sejumlah kecil volume titrasi secara berturut-turut atau secara kontinu dengan perngkat automatik. Presisi dapat dipertinggi dengan sel konsentrasi. Elektroda indikator yang digunakan dalam titrasi potensiometri tentu saja akan bergantung pada macam reaksi yang diselidiki. Jadi untuk suatu titrasi asam basa, elektroda indikator dapat berupa elektroda hidrogen atau sesuatu elektroda lain yang peka akan ion hidrogen, untuk titrasi pengendapan halida dengan perak nitrat, atau perak dengan klorida akan digunakan elektroda perak, dan untuk titrasi redoks (misalnya besi (II)) dengan dikromat digunakan kawat platinum semata-mata sebagai elektroda redoks (Khopkar, 1990).
Reaksi-reaksi yang berperan dalam pengukuran titrasi potensiometri yaitu reaksi pembentukan kompleks reaksi netralisasi dan pengendapan dan reaksi redoks. Pada reaksi pembentukan kompleks dan pengendapan, endapan yang terbentuk akan membebaskan ion terhidrasi dari larutan. Umumnya digunakan elektroda Ag dan Hg, sehingga berbagai logam dapat dititrasi dengan EDTA. Reaksi netralisasi terjadi pada titrasi asam basa dapat diikuti dengan elektroda indikatornya elektroda gelas. Tetapan ionisasi harus kurang dari 10-1. Sedangkan reaksi redoks dengan elektroda Pt atau elektroda inert dapat digunakan pada titrasi redoks. Oksidator kuat (KMnO4, K2Cr2O7, Co(NO3)3) membentuk lapisan logam oksida yang harus dibebaskan dengan reduksi secara katoda dalam satuan encer (Khopkar, 1990).
Potensial sel gavanik tergantung pada aktivitas zat-zat ionik tertentu di dalam larutan sel, maka pengukuran potensial sel merupakan hal yang sangat penting dalam kimia analitik. Dalam banyak hal suatu sel dapat disusun yang potensialnya tergantung pada aktivitas suatu macam zat ionik tunggal dalam larutan. Salah satu elektroda sel harus sedemikian rupa hingga potensialnya tergantung pada aktivitas ion yang akan ditentukan, ini disebut elektroda
indikator. Elektroda yang lainnya merupakan sebuah pembanding, seperti kalomel, yang potensialnya diketahui dan tetap selama pengukuran (Underwood, 1986).
Suatu eksperimen dapat diukur dengan menggunakan dua metode yaitu, pertama (potensiometri langsung) yaitu pengukuran tunggal terhadap potensial dari suatu aktivitas ion yang diamati, hal ini terutama diterapkan dalam pengukuran pH larutan air. Kedua (titrasi langsung), ion dapat dititrasi dan potensialnya diukur sebagai fungsi volume titran. Potensial sel, diukur sehingga dapat digunakan untuk menentukan titik ekuivalen. Suatu potensial sel gavani bergantung pada aktivitas spesies ion tertentu dalam larutan sel, pengukuran potensial sel menjadi penting dalam banyak analisis kimia (Basset, 1994).
Proses titrasi potensiometri dapat dilakukan dengan bantuan elektroda indikator dan elektroda pembanding yang sesuai. Dengan demikian, kurva titrasi yang diperoleh dengan menggambarkan grafik potensial terhadap volume pentiter yang ditambahkan, mempunyai kenaikan yang tajam di sekitar titik kesetaraan. Dari grafik itu dapat diperkirakan titik akhir titrasi. Elektroda indikator adalah elektroda yang potensialnya bergantung pada konsentrasi ion yang akan ditetapkan dan dipilih berdasarkan jenis senyawa yang hendak ditentukan. Sedangkan elektroda pembanding adalah elektroda yang potensialnya diketahui dan selama pengukuran tetap konstan. Elektroda pembanding yang banyak digunakan adalah elektroda kalomel karena konstannya potensial yang dihasilkan. Antara elektroda pengukur (elektroda pengukur) dan elektroda pembanding terdapat jembatan arus atau garam dengan larutan elektrolit yang di dalamnya terdapat transport ion arus (Widjaja, 2008).
Cara potensiometri ini bermanfaat bila tidak ada indikator yang cocok untuk menentukan titik akhir titrasi, misalnya dalam hal larutan keruh atau bila daerah kesetaraan sangat pendek dan tidak cocok untuk penetapan titik akhir titrasi dengan indikator (Rivai, 1995).
Keuntungan dari metode potensiometri adalah biayanya yang relatif murah dan sederhana. Voltameter dan elektroda jauh lebih murah daripada instrumen saintifik yang paling modern. Selain itu kelebihan dari metode
potensiometri yaitu pada saat potensial sel dibaca tidak ada arus yang mengalir dalam larutan (arus residual tatanan sel dan efek polarisasi dapat diabaikan). Manfaat potensiometri juga untuk menetapkan tetapan kesetimbangan. Potensial-potensial yang stabil sering diperoleh dengan cukup cepat dan tegangan yang mudah dicatat sebagai fungsi waktu, sehingga potensiometri kadang juga bermanfaat untuk pemantauan yang kontinyu dan tidak diawasi (Skoog, 1998).
Potensiometri pada dasarnya bersifat nondestruktif terhadap sampel, dalam pengertian bahwa penyisipan elektroda tidak mengubah komposisi larutan uji (kecuali untuk sedikit kebocoran elektrolit dari elektroda acuan) (Khopkar, 1990).
Metode potensiometri merupakan salah satu metode yang banyak digunakan untuk menentukan kandungan ion-ion tertentu dalam suatu larutan, titrasi terhadap vitamin c (bersifat asam) mungkin juga bersifat basa. Selain itu, metode potensiometer dapat juga digunakan dalam penetapan nikel dan kobalt dengan pengkomplekskan dengan sianida, penetapan fluida dengan metode titik nol, penetapan besi (III) dengan EDTA dan standarisasi larutan kalium permaganate dengan kalium iodide (Vogel, 1994).
Titik akhir dalam titrasi potensiometri dapat dideteksi dengan menetapkan volume pada mana terjadi perubahan potensial yang relatif besar ketika ditambahkan titran. Dalam titrasi secara manual, potensial diukur setelah penambahan titran secara beruntun, dan hasil pengamatan ditambahkan pada suatu kertas grafik terhadap volume titran untuk diperoleh suatu kurva titrasi. Dalam banyak hal, suatu potensiometer sederhana dapat digunakan, namun jika tersangkut elektroda g elas, maka akan digunakan pH meter khusus. Karena pH meter ini telah menjadi demikian biasa, maka pH meter ini dipergunakan untuk semua jenis titrasi, bahkan apabila penggunaannya tidak diwajibkan (Basset, 1994).
Berdasarkan reaksi titrasi dapat diikuti dengan pengukuran potensiometri. Reaksinya harus meliputi penambahan atau pengurangan beberapa ion yang sesuai dengan jenis elektrodanya. Potensial diukur sesudah penambahan sejumlah kecil volume titran secara berturut-turut atau secara kontinyu dengan perangkat automatik. Presisi dapat dipertinggii dengan sel konsentrasi:
a) Reaksi netralisasi: Titrasi asam basa dapat diikuti dengan elektroda indikatornya elektroda gelas. Tetapan ionisasi harus kurang dari 10-8.
b) Reaksi pembentukan kompleks dan pengendapan: Pembentukan endapan atau kompleks akan membebaskan ion terhidrasi dari larutan. Biasanya digunakan elektroda Ag dan Hg. Berbagai logam dapat dititrasi dengan EDTA.
c) Reaksi redoks: Elektroda Pt atau elektroda inert dapat digunakan pada titrasi redoks. Oksidator kuat (KMnO4, K2Cr2O7, Co(NH3)2 membentuk lapisan logam oksida yang harus dibebaskan dengan reduksi secara katoda dalam larutan encer (Khopkar, 1990).
Semua potensial elektroda dikutip relatif terhadap potensial elektroda hidrogen standar sebagai elektroda rujukan primer. Elektroda yang paling meluas penggunaannya adalah elektroda kalomel, disebabkan oleh mudahnya pembuatn dan konstan potensial sebuah sel-paruh kalomel adalah sel paruh dalam mana merkurium dan kalomel (merkurium (I) klorida) ditutup dengan konsentrasi tertentu, dapat 0,1 N, 1,0 N, 3,5 N, atau jenuh. Larutan kalium klorida haruslah dijenuhi oleh kalomel. Potensial elektroda kalomel pada 25oC relatif terhadap elektroda hidrogen normal untuk 0,1 N, 1,0 N, dan jenuh masing-masing adalah 0,3371, 0,2846 dan 0,2458 volt (Basset, 1994).
Elektroda indikator suatu sel adanya elektroda yang potensialnya bergantung pada aktivitas (dan karena itu pada konsentrasi) spesi ion tertentu yang konsentrasinya akan ditentukan. Dalam potensiometri langsung atau titrasi potensiometri suatu ion logam, sebuah elektroda indikator sederhana biasanya akan terdiri dari batang atau kawat yang dibersihkan dengan seksama yang terbuat dari logam yang tepat, paling penting adalah permukaan logam yang akan ditetapkan ke dalam larutan itu bebas dari lapisan tipis oksida atau hasil korosi apa saja. Dalam beberapa kasus elektroda yang lebih memuaskan dapat disiapkan dengan menggunakan kawat platinum yang telah disalut dengan lapisan tipis logam yang tepat dengan cara pengendapan secara listrik (Basset, 1994).
Persamaan Nernst memberikan hubungan antara potensial relatif suatu elektroda dan konsentrasi spesies ioniknya yang sesuai dalam larutan. Potensiometri merupakan aplikasi langsung dari persamaan Nernst dengan cara pengukuran potensial dua elektroda tidak terpolarisasi pada kondisi kondisi arus
nol. Dengan pengukuran potensial reversibel suatu elektroda, maka perhitungan aktivitas atau konsentrasi suatu komponen dapat dilakukan (Rivai, 1995).
Potensial dalam titrasi potensiometri dapat diukur sesudah penambahan sejumlah kecil volume titran secara berturut-turut atau secara kontinu dengan perangkat automatik. Presisi dapat dipertinggi dengan Cu konsentrasi. Elektroda indikator yang digunakan dalam titrasi potensiometri tentu saja akan bergantung pada macam reaksi yang sedang diselidiki. Jadi untuk suatu titrasi asam basa, elektroda indikator dapat berupa elektroda hidrogen (Khopkar, 1990).
BAB 3
METODOLOGI PERCOBAAN
3.1 Alat dan Bahan
3.1.1 Alat Beaker glass Corong kaca Botol semprot Labu ukur 100 mL Pipet tetes Botol reagen pH meter Pipet mikro Kalkulator 3.1.2 Bahan Alumunium foil Aquadest Tissue Kertas Label Larutan Pb-asetat 1,0 x 10-1 M Larutan Pb-asetat 2,0 x 10-2 M Larutan Pb-asetat 4,0 x 10-3 M Larutan Pb-asetat 8,0 x 10-4 M Larutan Pb-asetat 1,5 x 10-5 M Larutan Pb-asetat 3,5 x 10-5 M Larutan Pb-asetat 6,5 x 10-5 M Larutan PbI2 Larutan PbSO4 Sunlight 3.2 Prosedur Percobaan
Dibuat Larutan Pb-asetat berbagai macam variasi dari larutan induk 0,1 M menjadi 2,0 x 10-2 M; 4,0 x 10-3 M; 8,0 x 10-4 M; 1,5 x 10-5 M; 3,5 x 10-5 M; 6,5 x 10-5 M
Dimasukkan larutan yang telah dibuat dengan berbagai macam variasi konsentrasi kedalam beaker glass yang telah diberi label
Dihidupkan pH meter
Diukur pH dari masing-masing larutan Pb-asetat dan larutan PbSO4 serta larutan PbI2
Dicatat hasil pengukuran kedalam tabel pengamatan
BAB 4
HASIL DAN PEMBAHASAN
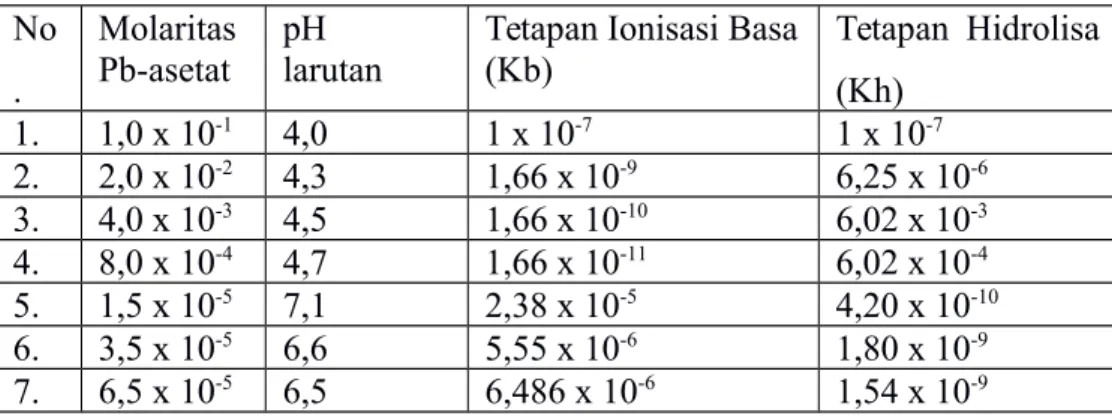
4.1 Hasil Pengamatan No . Molaritas Pb-asetat pH larutan
Tetapan Ionisasi Basa (Kb) Tetapan Hidrolisa (Kh) 1. 1,0 x 10-1 4,0 1 x 10-7 1 x 10-7 2. 2,0 x 10-2 4,3 1,66 x 10-9 6,25 x 10-6 3. 4,0 x 10-3 4,5 1,66 x 10-10 6,02 x 10-3 4. 8,0 x 10-4 4,7 1,66 x 10-11 6,02 x 10-4 5. 1,5 x 10-5 7,1 2,38 x 10-5 4,20 x 10-10 6. 3,5 x 10-5 6,6 5,55 x 10-6 1,80 x 10-9 7. 6,5 x 10-5 6,5 6,486 x 10-6 1,54 x 10-9 4.2 Grafik 0 0.02 0.04 0.06 0.08 0.1 0.12 0 2 4 6 8 f(x) = - 20.06x + 5.74 R² = 0.33
Grafik hubungan konsentrasi ion Pb2+ vs pH Pb-asetat
Konsentrasi pH
4.3 Perhitungan
4.3.1 Tetapan Ionisasi basa (Kb) dan Tetapan Hidrolisis (Kh)
Konsentrasi 1,0 x 10-1
Log Kb = 2 pH – pKw + log [ garam ] Log Kb = 2.4,0 – 14 + log [ 1,0 x 10-1 ] Log Kb = 8,0 – 14 + (-1) Log Kb = -7 Kb = 1 x 10-7 Kh = Kw Kb = 10 −14 1 x 10−7 = 1 x 10-7
Konsentrasi 2,0 x 10-2
Log Kb = 2 pH – pKw + log [ garam ] Log Kb = 2.4,3 – 14 + log [ 2,0 x 10-2 ] Log Kb = 8,6 – 14 + (-1,69) Log Kb = -8,78 Kb = 1,66 x 10-9 Kh = Kw Kb = 10 −14 1,66 x 10−9 = 6,25 x 10-6 Konsentrasi 4,0 x 10-3
Log Kb = 2 pH – pKw + log [ garam ] Log Kb = 2.4,5 – 14 + log [ 4,0 x 10-3 ] Log Kb = 9 – 14 + (-2,39) Log Kb = -9,78 Kb = 1,66 x 10-10 Kh = Kw Kb = 10 −14 1,66 x 10−10 = 6,02 x 10-3 Konsentrasi 8,0 x 10-4
Log Kb = 2 pH – pKw + log [ garam ] Log Kb = 2.4,7 – 14 + log [ 8,0 x 10-4 ] Log Kb = 9,4 – 14 + (-3,09) Log Kb = -10,78 Kb = 1,66 x 10-11 Kh = KwKb = 10 −14 1,66 x 10−11 = 6,02 x 10-4 Konsentrasi 1,5 x 10-5
Log Kb = 2 pH – pKw + log [ garam ] Log Kb = 2.7,1 – 14 + log [ 1,5 x 10-5 ] Log Kb = 14,2 – 14 + (-4,824)
Log Kb = -4,624 Kb = 2,38 x 10-5
Kh = KwKb = 10 −14 2,38 x 10−5 = 4,20 x 10-10 Konsentrasi 3,5 x 10-5
Log Kb = 2 pH – pKw + log [ garam ] Log Kb = 2.6,6 – 14 + log [ 3,5 x 10-5 ] Log Kb = 13,2 – 14 + (-4,456) Log Kb = -5,256 Kb = 5,55 x 10-6 Kh = KwKb = 10 −14 5,55 x 10−6 = 1,80 x 10-9 Konsentrasi 6,5 x 10-5
Log Kb = 2 pH – pKw + log [ garam ] Log Kb = 2.6,5 – 14 + log [ 6,5 x 10-5 ] Log Kb = 13 – 14 + (-4,188) Log Kb = -5,188 Kb = 6,486 x 10-6 Kh = KwKb = 10 −14 6,486 x 10−6 = 1,54 x 10-9
4.3.2 Tetapan Hasil Kali Kelarutan (Ksp) dari larutan PbI2 pH PbI2= 4,5 y = 4,5 dimana y = pH x = konsentrasi y = -20,059x + 5,7437 4,5 = -20,059x + 5,7437 -20,059x = 4,5 – 5,7437 -20,059x = -1,2437 x = 0,062 M
PbI2 ↔ Pb2+ 2I -Ksp = [s] [2s] Ksp = 4s2 Ksp = 4 (0,062)2 Ksp = 9,533 x 10-4
4.3.3 Tetapan Hasil Kali Kelarutan (Ksp) dari Larutan PbSO4 pH PbI2= 1,6 y = 1,6 dimana y = pH x = konsentrasi y = -20,059x + 5,7437 1,6 = -20,059x + 5,7437 -20,059x = 1,6 – 5,7437 -20,059x = -4,1437 x = 0,2066 M PbSO4 ↔ Pb2+ SO4 2-Ksp = [s] [s] Ksp = s2 Ksp = (0,2066)2 Ksp = 0,0427 4.4 Pembahasan
Prinsip percobaan ini adalah penentuan tetapan hidrolisa (Kh) dari larutan Pb(NO3)2 dalam air, pada suhu kamar dengan potensiometri langsung yaitu mengukur pH larutan Pb(NO3)2 tersebut pada berbagai konsentrasi: dari nilai pH dan konsentrasi ini dibuat grafik untuk menentukan tetapan hasil kali kelarutan (Ksp) PbI2 dalam larutan jenuh.
Pada percobaan ini digunakan larutan induk Pb(NO3)2 yang kemudian diencerkan menjadi larutan Pb(NO3)2 dengan konsentrasi 1,0 x 10-1; 2,0 x 10-2; 4,0 x 10-3; 8,0 x 10-4; 1,5 x 10-5; 3,5 x 10-5; 6,5 x 10-5. Kelima larutan tersebut kemudian diukur pHnya menggunakan pH meter. Setelah pH diketahui, dapat dihitung nilai Kb dengan rumus:
Log Kb = 2 pH – pKw + log [ garam ]
Yang selanjutnya dapat digunakan untuk menghitung tetapan hidrolisa (Kh) dengan rumus:
Setelah dilakukan perhitungan tetapan ionisasi basa (Kb) dan tetapan hidrolisa (Kh) didapat hasil pada Molaritas Pb(NO3)2 1.0 x 10-1 didapat pH larutan 4,0, tetapan ionisasi basa (Kb) 1 x 10-7 dan Kh = 1,0 x 10-7. Pada molaritas Pb(NO3)2 2,0 x 10-2 didapat pH larutan 4,3, tetapan ionisasi basa (Kb) 1,66 x 10-9 dan Kh = 6,25 x 10-6. Pada molaritas Pb(NO3)2 4,0 x 10-3 didapat pH larutan 4,5 , tetapan ionisasi basa (Kb) 1,66 x 10-10 dan Kh = 6,02 x 10-3. Pada molaritas Pb(NO3)2 8,0 x 10-4 didapat pH larutan 4,7 , tetapan ionisasi basa (Kb) 1,66 x 10-11 dan Kh = 6,02 x 10-4. Pada molaritas Pb(NO3)2 1,5 x 10-5 didapat pH larutan 7,1 , tetapan ionisasi basa (Kb) 2,38 x 10-5 dan Kh = 4,20 x 10-10. Pada molaritas Pb(NO3)2 3,5 x 10-5 didapat pH larutan 6,6 , tetapan ionisasi basa (Kb) 5,55 x 10-6 dan Kh = 1,80 x 10-9. Pada molaritas Pb(NO3)2 6,5 x 10-5 didapat pH larutan 6,5 , tetapan ionisasi basa (Kb) 6,486 x 10-6 dan Kh = 1,54 x 10-9.
Selain itu, dilakukan pula pengukuran pH pada larutan PbI2 dan PbSO4 untuk menentukan besarnya konsentrasi ion Pb2+. Didapat pada larutan PbI2 pHnya sebesar 4,5 dan pada larutan PbSO4 pHnya sebesar 1,6. Setelah dilakukan pengukuran setelah itu dibuat terlebih dahulu grafik hubungan antara konsentrasi ion Pb2+ dalam Pb(NO3)2, sehingga didapat persamaan kurva y = -20,05x + 5,743 dan R2 = 0,329. Dari persamaan kurva inilah, konsentrasi ion Pb2+ dapat diketahui dengan cara perhitungan. Setelah konsentrasi Pb2+ diketahui, dapat pula dihitung hasil kali kelarutan dari larutan PbI2 dan PbSO4. Pada larutan PbI2 didapat Ksp sebesar 9,533 x 10-4 dan pada larutan PbSO4 didapat Ksp sebesar 0,0427.
Larutan Pb(NO3)2 yang digunakan pada percobaan ini merupakan suatu garam yang tersusun dari asam kuat dan basa lemah, sehingga jika dilarutkan dalam air maka didalam larutannya akan terjadi kesetimbangan hidrolisa sebagai berikut:
Pb2+ + H2O ↔ Pb(OH) + H+
Pada percobaan ini metode yang digunakan adalah metode potensiometri langsung. Potensiometri langsung merupakan metode pengukuran pH berdasarkan pengukuran tegangan gerak elektrik suatu sel elektrokimia yang mengandung larutan yang tak diketahui pHnya sebagai elektrolit dan dua buah elektroda. Elektroda-elektroda ini dihubungkan dalam terminal-terminal sebuah voltmeter elektronik.
Keuntungan dari metode potensiometri adalah biayanya yang relatif murah dan sederhana. Voltmeter dan elektroda jauh lebih murah daripada instrument saintifik yang paling modern. Selain itu kelebihan dari metode potensiometri yaitu pada saat potensial sel dibaca tidak ada arus yang mengalir dalam larutan (arus residual tatanan sel dan efek polarisasi dapat diabaikan). Manfaat potensiometri juga untuk menetapkan tetapan kesetimbangan. Potensial-potensial yang stabil serius diperoleh dengan cukup cepat dan tegangan yang mudah dicatat sebagai fungsi waktu, sehingga potensiometri kadang juga bermanfaat untuk pemantauan yang kontinyu dan tidak diawasi.
Adapun istilah-istilah dalam percobaan dijelaskan sebagai berikut:
pH: eksponen ion hidrogen. Besarnya pH adalah sama dengan logaritma dari konsentrasi ion hidrogen dengan diberi tanda negatif atau logaritma dari kebalikan konsentrasi ion hidrogen.
Kw: hasil kali ion air/tetapan autoprotolisis air (1.01 x 10-14 pada 25ºC) yaitu tetapan kesetimbangan untuk reaksi dalam mana satu molekul pelarut menyerahkan proton kepada sebuah molekul pelarut lain.
Kh: tetapan hidrolisa yaitu tetapan kesetimbangan untuk reaksi hidrolisis dimana pada saat pelarutan garam dalam air, maka molekul air menjadi terionisasi karena menghilangnya ion hidrogen dari fase timbangan.
Ksp: tetapan hasil kali kelarutan yaitu tetapan kesetimbangan dimana nilai akhir yang dicapai oleh hasil kali ion ketika kesetimbangan tercapai antara fase padat dari garam yang hanya sedikit larut dalam larutan itu.
pH meter adalah sebuah alat elektronik yang berfungsi untuk mengukur pH (derajat keasaman atau kebasaan) suatu cairan ada elektroda khusus yang berfungsi untuk mengukur pH bahan-bahan semi padat. Sebuah pH meter terdiri dari sebuah elektroda (probe pengukur) yang terhubung kesebuah alat elektronik yang mengukur dan menampilkan nilai pH.
BAB 5
PENUTUP
5.1 Kesimpulan
Berdasarkan pada percobaan yang dilakukan, didapat hasil nilai tetapan hasil kali kelarutan (Ksp) pada larutan PbI2 sebesar 9,533x10-4 dan nilai tetapan hasil kali kelarutan (Ksp) pada larutan PbSO4 sebesar 0,0427.
Berdasarkan pada perhitungan pada percobaan, didapat nilai tetapan ionisasi basa (Kb) larutan Pb(NO3)2 pada konsentrasi 1,0 x 10-1 Kb sebesar 1 x 10-7, konsentrasi 2,0 x 10-2 Kb sebesar 1,66 x 10-9, konsentrasi 4,0 x 10-3 Kb sebesar 1,66 x 10-10, konsentrasi 8,0 x 10-4 Kb sebesar 1,66 x 10-11, konsentrasi 1,5 x 10-5 Kb sebesar 2,38 x 10-5, konsentrasi 3,5 x 10-5 Kb sebesar 5,55 x 10-6 dan konsentrasi 6,5 x 10-5 Kb sebesar 6,486 x 10-6.
Berdasarkan pada perhitungan pada percobaan, didapat nilai tetapan hidrolisa (Kh) larutan Pb(NO3)2 pada konsentrasi 1,0 x 10-1 Kh sebesar 1 x 10-7, konsentrasi 2,0 x 10-2 Kh sebesar 6,25 x 10-6, konsentrasi 4,0 x 10-3 Kh sebesar 6,02 x 10-3, konsentrasi 8,0 x 10-4 Kh sebesar 6,02-4, konsentrasi 1,5 x 10-5 Kh sebesar 4,20 x 10-10, konsentrasi 3,5 x 10-5 Kh sebesar 1,80 x 10-9, dan konsentrasi 6,5 x 10-5 Kh sebesar 1,54 x 10-9.
5.2 Saran
Sebaiknya pada praktikum selanjutnya menggunakan larutan Pb(NO3)2 agar dapat mengetahui perbandingannya.
DAFTAR PUSTAKA
Basset, J. Dkk. 1994. Buku Ajar Vogel Kimia Analisis Kualitatif Anorganik. Jakarta: EGC.
Khopkar. 1990. Konsep Dasar Kimia Analitik Jakarta: Universitas Indonesia Press.
Rivai. 1995. Asas Pemeriksaan Kimia. Jakarta: UI Press.
Skoog, D. A. F. J. Holler and T. A. Nieman. 1998. Principles of Instrumental
Analysis, 5th edition. USA, Sauders College Publishing.
Underwood, A. L. dan R. A. Day. 1986. Analisa Kimia Kuantitatif. Jakarta: Erlangga.
Vogel. 1985. Analisis Anorganik Kuantitatif Makro dan Semimikro. Jakarta: Kaiman Media Pustaka.
Widjaja, I. N. K., K. W. Astuti. 2006. Buku Ajar Analisis Farmasi Fisika Kimia. Jimbaran: Jurusan Farmasi FMIPA UNUD.