PENENTUAN KADAR PARASETAMOL DALAM SAMPEL DENGAN MENGGUNAKAN METODE KROMATOGRAFI CAIR KINERJA TINGGI
(HPLC)
LAPORAN PRAKTIKUM KIMIA INSTRUMEN Tanggal Praktikum : 12 November 2010
Disusun Oleh : Kelompok 7
Risa Nurkomarasari (0800530) Ersan Yudhapratama (0801357)
Redi Ahmad Fauzi (0805450)
JURUSAN PENDIDIKAN KIMIA
FAKULTAS PENDIDIKAN MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS PENDIDIDKAN INDONESIA 2010
Tanggal Praktikum : 12 November 2010
PENENTUAN KADAR PARASETAMOL DALAM SAMPEL DENGAN MENGGUNAKAN METODE KROMATOGRAFI CAIR KINERJA TINGGI
(HPLC)
A. Tujuan
1. Mahasiswa memahami cara kerja instrument HPLC untuk analisis kuantitatif. 2. Mahasiswa dapat melakukan preparasi dengan tepat dan akurat, serta dapat
mengikuti manual pengoperasian HPLC.
3. Mahasiswa dapat menentukan/menghitung kadar parasetamol dalam sampel.
B. Tinjauan Pustaka
Kromatografi cairan kinerja tinggi atau dalam bahasa inggrisnya dikenal dengan sebutan HPLC (High Performance Liquid Chromatography) merupakan salah satu teknik pemisahan campuran secara modern. Teknik HPLC ini merupakan salah satu teknik kromatografi cair-cair, yang dapat digunakan baik untuk keperluan pemisahan maupun analisis kuantitatif. Analisis kuantitatif dengan teknik HPLC didasarkan pada pengukuran luas/area puncak analit dalam kromatogram, dibandingkan dengan luas/area standar. Pada prakteknya, pembandingan kurang menghasilkan data yang akurat bila hanya melibatkan satu standar. Oleh karena itu, maka pembandingan dilakukan dengan menggunakan teknik kurva kalibrasi.
(Tim Kimia Analitik Instrumen. 2010:11) Kromatografi cair kinerja tinggi (KCKT) merupakan sistem pemisahan dengan kecepatan dan efisiensi yang tinggi. Hal ini karena didukung oleh kemajuan dalam teknologi kolom, sistem pompa tekanan tinggi, dan detektor yang sangat sensitif dan beragam. KCKT mampu menganalisa berbagai cuplikan secara kualitatif maupun kuantitatif, baik dalam komponen tunggal maupun campuran. KCKT merupakan teknik pemisahan yang diterima secara luas untuk analisis dan pemurnian senyawa tertentu dalam suatu sampel pada sejumlah bidang antara lain; farmasi, lingkungan dan industri-industri makanan. Kegunaan umum
KCKT adalah untuk pemisahan sejumlah senyawa organik, anorganik, maupun senyawa biologis, analisis ketidakmurnian (impurities) dan analisis senyawa-senyawa yang tidak mudah menguap (nonvolatil). KCKT paling sering digunakan untuk: menetapkan kadar senyawa-senyawa tertentu seperti asam-asam amino, asam-asam nukleat dan protein-protein dalam cairan fisiologis, menentukan kadar senyawa-senyawa aktif obat dan lain-lain.
Beberapa senyawa organik yang mudah terurai (labil) pada pemanasan dapat dianalisis dengan cara kromatografi cairan kinerja tinggi atau HPLC karena HPLC dilakukan pada suhu kamar. Selain senyawa organic teknik HPLC juga dapat menganalisis senyawa anorganik, cuplikan yang mempunyai berat molekul tinggi atau titik didihnya tinggi seperti polimer.
Kelebihan KCKT antara lain:
Mampu memisahkan molekul-molekul dari suatu campuran
Resolusinya baik
Mudah melaksanakannya
Kecepatan analisis dan kepekaannya tinggi
Dapat dihindari terjadinya dekomposisi/kerusakan bahan yang dianalisis
Dapat digunakan bermacam-macam detektor
Kolom dapat digunakan kembali
Mudah melakukan rekoveri cuplikan
Tekniknya tidak begitu tergantung pada keahlian operator dan reprodusibilitasnya lebih baik
Instrumennya memungkinan untuk bekerja secara automatis dan kuantitatif
Waktu analisis umumnya singkat
Kromatografi cair preparatif memungkinkan dalam skala besar
Ideal untuk molekul besar dan ion
(Putra, Effendy De Lux. 2004 :8) Keterbatasan metode KCKT adalah untuk identifikasi senyawa, kecuali jika KCKT dihubungkan dengan spektrometer massa (MS). Keterbatasan lainnya adalah jika sampelnya sangat kompleks, maka resolusi yang baik sulit diperoleh.
Prinsip kerja HPLC adalah sebagai berikut dengan bantuan pompa, fasa gerak cair dialirkan melalui kolom ke detektor, cuplikan dimasukkan ke dalam fasa
gerak dengan penyuntikan. Didalam kolom terjadi pemisahan kompenen-komponen campuran karena perbedaan kekuatan interaksi antara solut-solut terhadap fasa diam. Solut-solut yang kurang kuat interaksinya dengan fasa diam akan keluar dari kolom terlebih dahulu, sebaliknya solut-solut yang kuat interaksinya dengan fasa diam akan keluar dari kolom lebih lama. Setiap komponen campuran yang keluar dideteksi oleh detector kemudian direkam dalam bentuk kromatogram. Kromatogram HPLC serupa dengan kromatogram gas. (Hendayana, Sumar.2006:69)
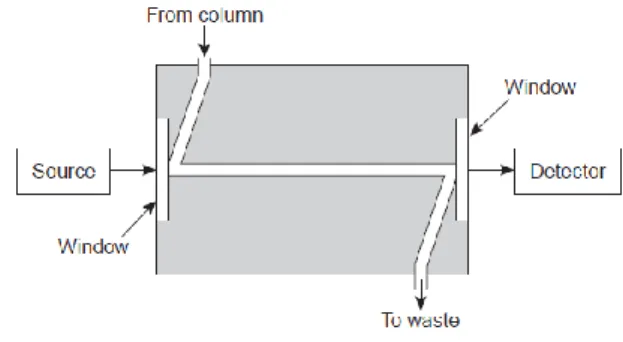
Gambar B.1 Diagram kromatografi Cairan Kinerja Tinggi atau HPLC
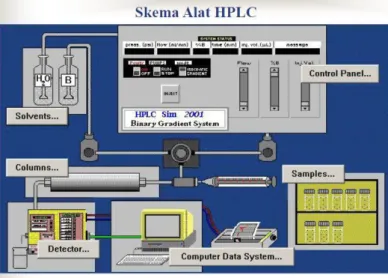
Gambar B.2 Skema Alat HPLC
Konsentrasi Solut dalam setiap fasa dinyatakan sebagai koefisien partisi, K. Cs dan Cm adalah konsentrasi Solut dalam fasa diam dan fasa gerak.
𝐾 = 𝐶𝑠 𝐶𝑚
Sebagai alternative, distribusi Solut-solut di antara dua fasa-fasa tersebut dinyatakan dengan satuan massa atau waktu keluarnya solut atau volume fasa gerak:
𝐾′ = 𝑔𝑠 𝑔𝑚 𝐾′= (𝑡𝑅 − 𝑡𝑜) 𝑡𝑜 = (𝑉𝑟 − 𝑉𝑜) 𝑉𝑜
K‟ adalah factor kapasitas, gs dan gm adalah masssa Solut dlam fasa diam dan fasa gerak dan Tr dan t0 adalah waktu yang diperlukan untuk elusi solut yang
berikatan dan solut yang tidak berikatan dengan fasa diam. Perkalian waktu-waktu ini dengan kecepatan alir fasa gerak menghasilkan volume retensi, Vr dan volume hampa Vo. Walaupun K‟ dan K merupakan kuantitas yang berbeda, tetapi keduanya berhubungan secara linier.
K‟=KΦ
Ketika senyawa-senyawa dipisahkan dalam kolom maka masing-masing senyawa menyebar dan menjadi encer. Peristiwa ini dikenal dengan istilah “band broadening” yang terlihat dari puncak yang melebar. Diffusi Eddy merupakan salah satu penyebab pelebaran peak. Penyebab kedua berasal dari transfer massa, Solut selalu berpindah-pindah di antara fasa gerak dan fasa diam.
Gambar B.3 Diffusi Eddy
Efisiensi kolom biasanya dinyatakan secara matematika dengan istilah plat teori. Penerapannya pada kromatografi, jumlah teori plat, N, untuk kolom ditentukan dari lebar peak dan waktu retensi. Suatu persamaan yang analog dengan persamaan Van Deemter dari kromatografi gas telah dikembangkan untuk HPLC. Persamaan ini dikenal sebagai persamaan knox, yang menyatakan pengaruh-pengaruh tiap proses “band broadening” terhadap efisiensi.
Resolusi pada HPLC dipengaruhi oleh tiga factor yaitu efisiensi (N), selektivitas(a), dan retensi (k‟). α adalah selektivitas, k‟1 dan k‟2 adalah masing0masing factor kapasitas senyawa 1 dan senyawa 2.
𝛼 =𝑘′2 𝑘′1
Jenis retensi Solut merupakan dasar dalam HPLC karena pemisahan senyawa bergantug pada jenis dan kekuatan interaksi Solut dengan fasa diam. Mekanisme retensi dapat dikelompokan menjadi lima, yaitu :
a. Kromatografi adsorpsi
Kromatografi ini sangat cocok untuk pemisahan senyawa-senyawa yang agak polar. Kromatografi yang menggunakan fasa gerak nonpolar dan fasa diam polar biasanya HPLC fasa normal. Partikel-partikel silika atau alumina digunakan sebagai adsorben. Untuk mengontrol retensi solut, biasanya ditambahkan sedikit senyawa polar kepada fasa gerak sebagai modifier. Modifier bersaing dengan molekul-molekul solut untuk merebut tempat adsorpsi.
b. Kromatografi partisi
Kromatografi partisi merupakan kromatografi fasa terbalik dimana fasa gerak lebih polar daripada fasa diamnya. Fasa geraknya harus dijenuhkan dengan zat cair fasa diam untuk mengurangi erosi lapisan fasa diam. Pada kromatografi ini terdapat keterbatasan selektivitas sehingga ketidak campuran kedua fasa. Fasa gerak dan fasa diam beberapa senyawa sangat kuat atau tidak tertahan sama sekali pada fasa diam.
c. Kromatografi fasa terikat
Kromatografi ini adalah krimatgrafi yang sering digunakan, kromatografi fasa terikat memiliki persamaan dengan kromatografi partisi. Pada kromatografi ini, adsorben fasa terikat terdiri dari partikel silika yang dimodifikasi secara kimia dengan rantai alkil. Fasa terikat merupakan fasa yang stabil. Oleh karena itu, kolom akan bertahan dan keterulangan waktu retensi yang baik.
d. Kromatografi penukar ion
Karakteristik fasa gerak dalam kromatografi penukaran ion seperti yang diperlukan oleh jenis kromatografi lain. Fasa gerak harus melarutkan cupllikan, mempunyai kekuatan pelarut yang memberikan waktu retansi yang cocok,
berinteraksi dengan solut sehingga memberikan harga selektivitas yang tepat. Fasa gerak dalam kromatografi penukaran ion adalah larutan dalam air dapat mengandung sedikit metanol atau pelarut organik lain ynag bercampur dengan air. Pelarut ini juga mengandung senyawa-senyawa ionisasi dalam bentuk buffer. Kekuatan pelarut dan selektivitas ditentukan oleh jenis dan konsentrasi bahan-bahan tambahan ini. Umunya, ion-ion dari fasa gerak bersaing dengan ion analit untuk memperebutkan tempat paking panukaran ion. Fasa diam dalam kromatografi penukaran ion dapat berupa penukaran ion asam sulfonat untuk kation atau penukar ion amin untuk anion.
e. Kromatografi eksklusi ukuran
Ukuran molekul merupakan criteria utama dalam pemisahan ini. Pemisahan terjadi karena Solut-solut berdifusi masuk dan keluar pori-pori material paking kolom.Molekul-molekul yang lebih besar dari diameter pori-pori akan melewati kolom secara cepat, dan molekul kecil menempati volume pori dan tertahan lebih lama.
(Hendayana, Sumar.2006:71-77) Komponen-komponen atau instrumentasi dari HPLC ialah sebagai berikut : 1. Fasa gerak
Berupa zat cair yang disebut eluen (pelarut) dalam HPLC, fasa gerak selain bertugas membawa komponen-komponen campuran menuju detektor, juga dapat berinteraksi dengan solut-solut.
Zat cair yang akan digunakan sebagai fasa gerak HPLC harus memenuhi beberapa persyaratan berikut :
1). Zat cair harus bertindak sebagai pelarut yang baik untuk cuplikan yang akan dianalisis.
2). Zat cair harus murni sekali untuk menghindarkan masuknya kotoran yang dapat mengganggu interpretasi kromatogram.
3). Zat cair harus jernih sekali untuk menghindarkan penyumbata pada kolom. Biasanya pelarut disaring dengan saringan nilon berukuran diameter 0,45 µm. Pompa vakum biasanya digunakan untuk menyaring partikel kotoran sekaligus menghilangkan gas dari pelarut karena gas dapat mengganggu base line.
4). Zat cair harus mudah diperoleh, murah, tidak mudah terbakar dan tidak beracun.
5). Zat cair tidak kental. Umumnya keketalan tidak melebihi 0,5 cP (centi Poise).
6). Sesuai dengan detektor.
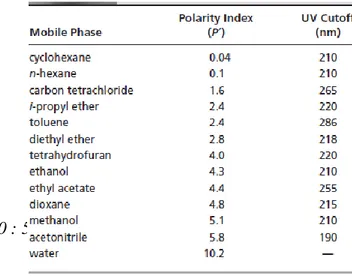
Pemilihan zat cair sebagai fasa gerak ini merupakan hal yang kritis dalam keberhasilan pemisahan. Seyangnya, teori interaksi fasa gerak dengan sejumlah solut kurang jelas sehingga para pakar hanya dapat memilih sekelompok pelarut. Jadi, pada akhirnya, pemilihan fasa gerak didasarkan atas eksperimen trial-and error dengan berbagai jenis dan krom posisi pelarut hingga diperoleh kromatogram yang diharapkan. Dengan kata lain, fasa gerak yang baik memberikan faktor kapasitas k‟ pada rentang yang seesuai. Untuk cuplikan dengan 2-3 komponen, sebaliknya dicari fasa gerak yang memberikan k‟ antara 2-5. Sedangkan untuk campuran multikomponen, waktu cukup untuk pemisahan semua komponen. Biasanya beberapa pelarut atau kombinasi pelarut dapat ditemukan untuk memberikan faktor kapasitas yang cocok. Pemilihan pelarut-pelarut juga bergantung pada faktor selektifitas (α) untuk komponen cuplikan. Gelembung udara (degassing) yang ada harus dihilangkan dari pelarut, karena udara yang terlarut keluar melewati detektor dapat menghasilkan banyak noise sehingga data tidak dapat digunakan.
Tabel 1. Properties of HPLC mobile phase
(Harvey, David. 2000 : 581) 2. Pompa
Pompa dalam HPLC berfungsi untuk mengalirkan fasa gerak cair malalui kolom yang berisi serbuk halus. Pompa yang dapat digunakan dalam HPLC harus memenuhi persyaratan :
1. Menghasilkan tekanan sampai 600psi. 2. Kelluara bebas pulsa
3. Kecepatan alir berkisar antara 0,1-10 mL/menit. 4. Bahan tahan korosi.
Dikenal tiga jenis pompa yang masing-masing memiliki keuntungan dan kerugian yaitu pompa reciprocating, displacement dan pneumatic.
Gambar B.4 Pompa Pompa reciprocating
Jenis pompa ini sekarang paling banyak dipakai. Popa ini terdiri dari ruangan kecil tempat pelarut yang dipompa dengan cara gerakan piston mundur-maju yang dijalankan oleh motor. Piston berupa batang gelas dan berkontak langsung dengan pelarut.
Ketika piston mundur maka bola gelas bawah terangkat dan pelarut masuk, sebaliknya ketika piston maju bola bawah menutup saluran pelarut dan pelarut yang telah berada diruang pompa didorong masuk ke dalam kolom. Gerakan piston mundur dan maju terjadi secara terus menerus sehingga memeberikan aliran eluen konstan. Pompa ini menghasilkan pulsa yang dapat mengganggu base-line kromatogram, karena itu dipasang peredam pulsa untuk menghilangkan gangguan base-line sedangkan keuntungan pompa ini adalah memiliki volume internal yang kecil. Untu mengurangi bond broadening. Selain
itu, pompa ini menghasilkan tekanan tinggi, kecepatan alir konstan yang tidak brgantung pada tekanan balik kolom dan viskositas pelarut.
Pompa displacement
Pompa ini menyerupai syringe (alat suntik) terdiri dari tabung yang dilengkapi pendorong yang digerakkan oleh motor. Pompa ini juga menghasilkan aliran yang cenderung tidakbergantung tekanan balik klom dan visikositas pelarut. Selain itu, keluaran pompa ini bebas pulsa. Akan tetapi pompa ini keterbatasan kapasitas pelarit dan tidak mudah untu mealkukan pergantian pelarut.
Pompa pneumatic
Dalam pompa ini pelarut didorong oleh gas bertekanan tinggi. Pompa jenis murah dan bebeas pulsa. Akan tetapi mempunyai keterbatasab kapasitas dan tekanan yang dihasilkan serta kecepatan alir bergantung pada viskositas pelarut dan tekanan balik kolom.
3. Pemasukan cuplikan
Kebanyakan pemasukan cuplikan ke dalam kolom dapat menyebabkan band broadening. Oleh karena itu, cuplikan yang dimasukan harus sekecil mungkin, beberapa puluh miroliter. Teknik pemasukan cuplikan kedalam sistem HPLC melalui injeksi srynge, injeksi “stop-flow”, dan kran cuplikan.
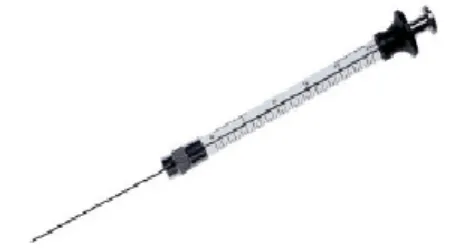
Gambar B.5 Syringe Injeksi syringe
Alat yang paling dulu ada dan paling paling mudah untuk memasukkan cuplikan adalah syringe. Syringe disuntikkan melalui septum (seal karet) dan untuk ini dirancang syringe yang tahan tekanan sampai 1500 psi. Akan tetapi keterulangan injeksi syringe ini sedikit labih baik dari2-3% dan sering lebih jelek.S
Injeksi ‘stop-flow’
Injeksi stop-flow adalah jenis injeksi syringe kedua tapi di sini aliran pelarut dihentikan sementara, asambungan pada ujung kolom dibuka dan cuplikan disuntikan langsung ke dalam ujung kolom. Setelah menyambungkan kembali kolom maka pelarut dialirkan kembali.
Kran cuplikan
Jenis pemasukan cuplikan ini disebut juga loop dan paling banyak digunakan. Untuk memasukan cuplikan ke dalam aliran fasa gerak perlu dua langkah :
1. Sejumlah volume cuplikan disuntikkan ke dalam loop dalam posisi “load”, cuplikan masih berada dalam loop.
2. Kran diputar untuk mengubah cuplikan “load” menjadi posisi “injeksi” dan fasa gerak membawa cuplikan ke dalam kolom. Loop dapat diganti-ganti dan tersedia berbagai ukuran volume dari 5 hingga 500 µL. Dengan sistem pemasukan cuplikan ini memungkinkan memasukan cuplikan pada tekanan 7000 psi denga ketelitian tinggi. Juga loop mikro tersedia dengan volume 0,5 hingga 5µL.
Gambar B.6 Tipe injector katup putaran 4. Kolom
Kolom HPLC biasanya terbuat dari stainless steel walaupun ada juga yang terbuat dari gelas berdinding tebal. Kolom utma berisi fasa diam, tepat teradinya pemisahan camppuran menjadi komonen-komponennya. Bergantung keperluannya koom utama dapat digunkan untuk analisis atau preparatif. Untuk keperluan preparatif, setiap komponen yang keluar kolom ditampung pada
tabung yang berbeda dan keluaran HPLC dihubungkan dengan fraction colector. Selain kolom utama dikenal pula kolom pengaman (guard kolom).
Kolom utama berisi fasa diam dan jenisnya bervariasi bergantung keperluan, misalnya dikenal kolom C-18, C-8, cyanopropyl, penularan ion. Kolom jenis C-18 dan C-8 paling banyak dipakai dalam HPLC. Fasa diam jenis terikat ini dapat dibuat dengan mereaksikan silika dengan alkilklorosilana yang dikenal dengan reaksi silanisasi.
Fasa Diam
Dalam kromatografi cair-cair, fasa diam adalah cairan film yang dilapiskan pada material kemasan yang terdiri dari partikel silica berpori 3-10 . fasa diam mungkin sebagian akan larut dalam fasa gerak. Untuk mencegah hilangnya fasa diam ini, maka fasa diam diikat secara kovalen pada partikel silica. Ikatan fasa diam diperoleh dengan mereaksikan partikel silica dengan organochlorosilane dengan bentukumu Si (CH3)2 RCl dimana R adalah alkil atau alkil yang
tersubstitusi.
Untuk mencegah interaksi antara zat terlarut dengan gugus –SiOH, silica sering direaksikan dengan Si(CH3)3Cl. Sifat dari fasa diam ditentukan oleh sifat
organosilane‟s gugus alkil. Jika R adalah gugus fungsional polar, maka fasa diam akan polar. Contoh fasa diam polar, dimana R terdiri dari cyano (-C2H4CN), diol (-C3H6OCH2CHOHCH2OH), atau amino (-C3H6NH2). Karena
fasa diam polar, fasa bergerak adalah nonpolar atau pelarut yang cukup polar. Kombinasi dari fasa diam polar dan fasa gerak non polar disebut kromatografi fasa normal. Dalam kromatografi fasa terbalik, sering ditemui dalam HPLC, fasa diam non-polar dan fasa gerak polar. Fasa diam non-polar paling umum menggunakan organochlorosilane dengan R adalah n-octyl (C8) atau
Kolom pengaman disebut juga pra-kolom karena diletakkan sebelum sisem pemasukan cuplikan. Kolom ini berukuran pendek, 5 cm dengan diameter 4,6 mm dan biasanya dipaking dengan partikel silika berukuran lebih besar dari ukuran partikel kolom utama. Kolom pengaman mempunyai dua fungsi yaitu untuk menyaring kotoran yang terbawa dalamfasa diam dan untuk menjenuhkan fasa diam dalam rangka menghindarkan terjadinya erosi fasa diam oleh aliran pelarut. Dengan demikian, kerusakan kolom utama yang mahal dapat dihindarkan.
5. Detektor
Berbagai detektor untuk HPLC telah tersedia, walaupun demikian detektor harus memenuhi persyaratan berikut :
1. Cukup sensitif
2. Stabilitas dan ketrulangan tiggi 3. Respon linear terhadap solut
4. Waktu respon pendek sehingga tidak bergantung alir 5. Reliabilitas tinggi dan mudah digunakan
6. Tidak merusak cuplikan.
Detektor HPLC dikelompokkan ke dalam tiga jenis detektor yaitu detektor umum memberi respon terhadap fasa gerak yang dimodulasi dengan adanya solut. Sebaliknya, detektor spesifik memberi respon terhadap beberapa sifat solut yang tidak dimiliki oleh fasa gerak. Terakhir, detektor yang brsifat umum terhadap solut setelah fasa gerak dihilangkan dengan penguapan.
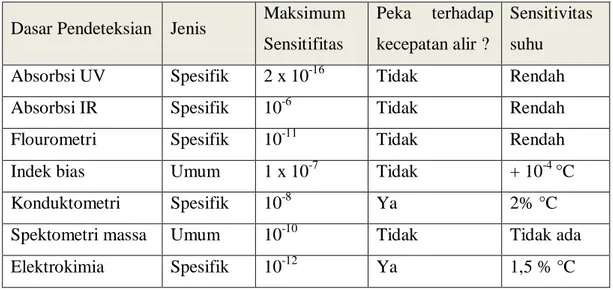
Tabel 2 Karakteristik detector HPLC
Dasar Pendeteksian Jenis Maksimum Sensitifitas
Peka terhadap kecepatan alir ?
Sensitivitas suhu Absorbsi UV Spesifik 2 x 10-16 Tidak Rendah Absorbsi IR Spesifik 10-6 Tidak Rendah Flourometri Spesifik 10-11 Tidak Rendah Indek bias Umum 1 x 10-7 Tidak + 10-4 °C Konduktometri Spesifik 10-8 Ya 2% °C Spektometri massa Umum 10-10 Tidak Tidak ada Elektrokimia Spesifik 10-12 Ya 1,5 % °C
Detektor UV
Detektor UV terutama digunakan untuk pendeteksian senyawa-senyawa organik. Detektor UV dilengkapi dengan pengatur panjang gelombang sehingga panjang gelombang UV yang digunakan dapat dipilih disesuaikan dengan jenis cuplikan yang diukur. Walaupun demikian, biasanya panjang gelombang UV yang digunakan adalah pada 254 nm karena kebanyakan senyawa organik menyerap sinar UV pada sekitar panjang gelombang tersebut.
Gambar B.7 Diagram detector UV Detektor elektrokomia
Detektor elektrokimia biasanya didasarkan pada daya hantar listrik dan poligrafi. Detektor jenis konduktometri biasanya digunakan untuk mendeteksi solut-solut yang dapat mengalami reaksi redoks baik senyawa organik maupun anorganik.
(Hendayana, Sumar.2006:83-94)
Detektor yang paling banyak digunakan dalam kromatografi cair modern kecepatan tinggi adalah detektor spektrofotometer UV 254 nm. Bermacam-macam detektor dengan variasi panjang gelombang UV-Vis sekarang menjadi populer karena mereka dapat digunakan untuk mendeteksi senyawa-senyawa dalam rentang yang luas. Detektor indeks refraksi juga secara luas digunakan, terutama dalam kromatografi eksklusi, tetapi umumnya kurang sensitif dari pada detektor spektrofotometer UV. Detektor lainnya, antara lain: detektor fluometer, detektor ionisasi nyala, detektor elektrokimia dan lain-lain juga telah digunakan. (Putra, Effendy De Lux. 2004 :6)
Untuk mencetak hasil percobaan pada lembaran kertas berupa kumpulan puncak (kromatogram).
Komponen yang terelusi mengalir ke detektor dan dicatat sebagai puncak-puncak yang secara keseluruhan disebut sebagai kromatogram.
Fungsi dari kromatogram antara lain: 1. Kualitatif
Waktu retensi selalu konstan dalam setiap kondisi kromatografi yang sama dapat digunakan untuk identifikasi.
2. Kuantitatif
Luas puncak proporsional dengan jumlah sampel yang diinjeksikan dan dapat digunakan untuk menghitung konsentrasi.
3. Kromatogram dapat digunakan untuk mengevaluasi efisiensi pemisahan dan kinerja kolom (kapasitas „k‟, selektifitas „α‟, jumlah pelat teoritis „N‟, jarak setara dengan pelat teoritis „HETP‟ dan resolusi „R‟).
Penerapan kromatografi cairan kinerja tinggi dapat dilakukan dengan dua mode oprasional, yaitu :
Mode isokratik
Mode isokratik serupa dengan mode isotermal dalam kromatografi gas, hanya dalam HPLC komposisi fasa geraknya yang sama selama pengukuran berlangsung. Tidak perlu mengatur komposisi campuran fasa gerak.
Mode gradien
Komposisi fasa geraknya divariasikan selama pengukuran berlangsung.
Elusi gradien didefinisikan sebagai penambahan kekuatan fase gerak selama suatu analisis kromatografi berlangsung. Digunakan untuk meningkatkan resolusi campuran yang kompleks terutama jika sampel mempunyai kisaran polaritas yang luas. Pengaruh yang menguntungkan dari elusi gradien adalah memperpendek waktu analisis senyawa-senyawa yang secara kuat ditahan di dalam kolo.
Elusi Gradien menawarkan beberapa keuntungan : a. Total waktu analisis dapat direduksi
b. Resolusi persatuan waktu setiap senyawa dalam campuran bertambah c. Ketajaman Peak bertambah (menghilangkan tailing)
d. Efek sensitivitas bertambah karena sedikit variasi pada peak
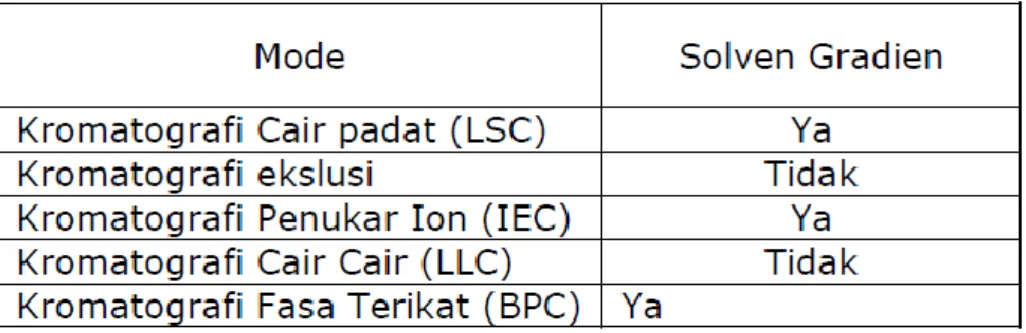
Gradien dapat dihentikan sejenak atau dilanjutkan. Optimasi Gradien dapat dipilih dengan cara trial and error. Tabel berikut ini menunjukkan kompatibilitas dari bermacam-macarn mode kromatografi cair dengan analisis gradien. Dalam praktek, gradien dapat diformasi sebelum dan sesudah pompa. Tabel 3. Mode Kompatibilitas dengan Gradien
(Putra, Effendy De Lux. 2004 :7)
Parasetamol Struktur parasetamol :
Parasetamol adalah senyawa yang memiliki sifat polar, dan gugus kromofor yang dimilikinya menyebabkan senyawa ini dapat menyerap sinar UV. Karakteristik senyawa ini memungkinkan analisis dengan teknik HPLC menggunakan kolom non polar seperti C-18 dan fasa gerak agak polar seperti methanol/air.
(Tim Kimia Analitik Instrumen. 2010:11) C. Alat dan Bahan Praktikum
1. Alat
Perangkat alat HPLC 1 set
Lumpang dan alu 1 buah
Spatula 1 buah
Labu ukur 25 mL dan 10 mL 6 buah
Neraca analitik 1 set
Corong pendek 1 buah
Pipet tetes 3 buah
Gelas kimia 100 mL 1 buah
Gelas ukur 500 mL 1 buah
Ultrasonik Vibrator 1 set 2. Bahan
Parasetamol p.a 6,2 mg
Metanol 20 mL
Sampel obat oskadon 1 strip
KH2PO4 420 mL
Isopropil alcohol 30 mL
Asetonitril 30 mL
Membran 2 buah
D. Prosedur Kerja Praktikum 1. Pembuatan Fasa Gerak
Dicampur KH2PO4 : Isopropil alcohol : methanol : asetonitril yang telah disaring
dengan sel membran dengan perbandingan masing-masing (420:30:20:30)mL. Setelah itu, dihomogenkan dengan ultrasonic vibrator selama 15 menit.
2. Pembuatan Larutan Induk Parasetamol
Ditimbang parasetamol sebanyak 6,25 mg, setelah itu dilarutkan dengan 10 mL fasa gerak (dilakukan secara kuantitatif dalam gelas kimia 20 mL). Kemudian dimasukan ke dalam labu ukur 10 mL dan dihomogenkan selama 5 menit menggunakan ultrasonic vibrator, ditanda bataskan secara kuantitatif.
3. Pembuatan Deret Larutan Standar
Dibuat deret standar 25,0; 50,0; 75,0; 100,0 dan 125,0 ppm dengan melakukan pengenceran dari larutan induk yang telah dibuat kedalam labu ukur 10,0 mL, kemudian didegassing selama 5 menit. Semua larutan standar masing-masing disaringdengan menggunakan membrane PTFE, filtrate ditempatkan ke dalam vial tertutup yang telah diberi label.
4. Pembuatan Larutan Sampel Parasetamol
Ditimbang satu per satu tablet parasetamol dalam 1 strip, kemudian digerus. Setelah halus ditimbang 12,5 mg, dilarutkan dalam labu ukur 25 mL, ditambah sedikit pelarut lalu dihomogenkan dengan ultrasonic vibrator selama 5 menit. Setelah 5 menit, sampel di tandabataskan kemudian dihomogenkan. Sampel yang sudah homogen dipipet sebanyak 1 mL dan dimasukan ke dalam labu takar 10 mL, setelah itu disaring dengan kertas saring milipore, dan membrane PTFE, filtrate dimasukan ke dalam botol vial. sebelum diinjekkan, larutan didegassing terlebih dahulu selama 5 menit.
5. Prosedur Mengoperasikan HPLC
Instrumen HPLC dihidupkan kemudian dan kondisikan instrument HPLC sesuai dengan:
Fasa gerak : KH2PO4 : Isopropil alcohol : methanol : asetonitril
(420:30:20:30) Kolom : C-18 = 15 cm
Panjang gelombang : 234 nm Laju alir : 0,5 mL/menit Volume injeksi : 20 μL
Pastikan kabel penghubung listrik telah tersambung dengan benar. Setelah itu tekan tombol “ON” pada sakelar listrik. Isi botol fasa gerak dengan volume memadai dan kosongkan botol penampung. Tekan tombol “ON” pada alat, berturut-turut untuk power, detektor dan pompa. Lakukan pemograman alat dengan computer. Ikuti langkahnya sesuai dengan instruksi computer. Pilih mode yang digunakan sesuai dengan parameter kondisi instrument. Apabila kromatogram telah menunjukkan base line mendatar, maka instrument siap digunakan. Injeksikan larutan standar secarea berurutan (mulai dari konsentrasi terendah) dan larutan sampel. Cetak hasil pengukuran dan catat kondisi percobaannya. Stelah selesai digunakan, matikan pompa dengan menyoroti tanda pompa pada computer. Tutup file sesuai petunjuk, lalu matikan computer. Untuk mematikan, tekan tombol “OFF” pada pompa, detektor dan power secara berurutan. Terakhir, putuskan sambungan listrik.
E. Hasil dan Analisi Data
Hasil Percobaan
Data hasil analisis larutan standar I
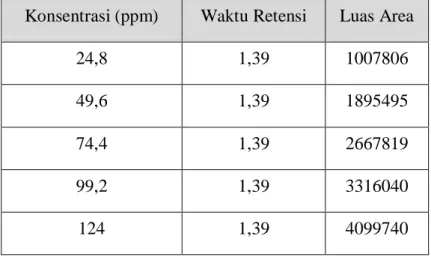
Tabel Data Pengukuran Larutan deret Standar I
Konsentrasi (ppm) Waktu Retensi Luas Area
24,8 1,39 1007806
49,6 1,39 1895495
74,4 1,39 2667819
99,2 1,39 3316040
Kurva kalibrasi larutan deret standar I
Data hasil analisis larutan standar 2
Tabel Data Pengukuran Larutan deret Standar 2 Konsentrasi Waktu Retensi Luas Area
24,8 1,39 813607 49,6 1,39 1351640 74,4 1,39 2036587 99,2 1,39 2638557 124 1,39 3227353 y = 30662,9556x + 316072,10000 R² = 0.9974 0 500000 1000000 1500000 2000000 2500000 3000000 3500000 4000000 4500000 24,8 49,6 74,4 99,2 124
Kurva konsentrasi standar terhadap luas
area
Konsentrasi standar (ppm) Lu as A reaKurva kalibrasi larutan deret standar 2
Penentuan Kadar Paracetamol dalam sampel obat
Berdasarkan kurva yang dihasilkan, maka persamaan garis yang digunakan adalah kurva dari larutan standar 2 karena memberikan regresi paling tinggi, persamaan garisnya yaitu :
y = 24654,8750x + 179226,1000 R2 = 0,999
Karena pada data pengukuran luas area sampel I dan sampel II memiliki waktu retensi yang sama yaitu 1,39 sehingga luas area sampel dirata-ratakan.
Larutan sampel Luas Area
I 1246385
II 1307825 Rata-rata 1277105 Massa Sampel 12,5 mg
Dari hasil perhitungan (terlampir), diperoleh kadar parasetamol dalam sampel %Parasetamol dalam sampel adalah 89,05% dan massa parasetamol dalam oskadon adalah 626,217 mg/tablet.
y = 24654,8750x + 179226,1000 R² = 0.999 0 500000 1000000 1500000 2000000 2500000 3000000 3500000 24,8 49,6 74,4 99,2 124
Kurva konsentrasi Standar terhadap
luas area
Konsentrasi standar (ppm) Lu as A rea Analisis Data
Instrumen yang dipilih pada percobaan ini dalam penentuan kadar parasetamol dalam sampel obat adalah kromatografi cairan kinerja tinggi (HPLC). Teknik HPLC merupakan salah satu teknik kromatografi cair-cair, yaitu suatu metode pemisahan dari suatu analit berdasarkan perbedaan interaksi antara fasa diam dengan fasa geraknya. Teknik HPLC ini dapat digunakan untuk analisis kuantitatif dan kualitatif. Analisis kuantitatif dapat dilihat dari pengukuran luas puncak/area dari analit pada kromatogram yang dibandingkan dengan luas area standar dengan menggunakan kurva kalibrasi, pada percobaan kali ini digunakan dua deret larutan standar. Analisis Kualitatif dapat dilihat dari waktu retensinya yang dibandingkan dengan standar.
Instrumen HPLC ini dipilih untuk percobaan ini karena ada beberapa pertimbangan dan keefektifan pekerjaan yang dilakukan dilaboratorium. Pertimbangan itu antara lain dilihat dari sampel yang akan dianalisis nantinya. Sampel yang dianalisis adalah obat yang memiliki kandungan parasetamol, parasetamol merupakan zat yang tidak mudah menguap. Parasetamol mudah larut ketika dilarutkan dalam air karena parasetamol merupakan senyawa yang bukan ionik. Parasetamol memiliki berat molekul yang ringan. Dari beberapa data yang menginformasikan sifat sampel, maka instrumentasi yang tepat digunakan adalah HPLC dengan jenis kromatografi partisi (fasa terbalik).
Penggunaan jenis kromatografi fasa terbalik ini karena sampel yang akan kita pisahkan bersifat polar, oleh karena itu dalam jenis kromatografi ini fasa gerak yang digunakan memiliki sifat yang polar yaitu campuran antara KH2PO4 :
Isopropil alcohol : methanol : asetonitril dengan perbandingan 420:30:20:30 dan fasa diamnya bersifat nonpolar biasanya fasa diam yang memiliki rantai alkil 8 (C-8) atau 18 (C-1(C-8).
Pada perhitungan konsentrasi parasetamol,data yang terhitung adalah 248 ppm. Data seharusnya adalah 250 ppm,hal ini terjadi karena pada penimbangan sampel adalah 6,2 mg yang seharusnya 6,25 mg, hal ini terjadi disebabkan Karena digit dibelakang koma hanya satu angka, bukan dua angka. Sehingga pada penimbangan sampel yang terbaca adalah 6,2 mg.Jadi hal ini perlu menghitung lagi konsentrasi pada deret standar.
Pada percobaan kali ini, dalam analisisnya perlu diperhatikan setiap tahapnya agar kesalahan yang terjadi menjadi seminimal mungkin. Sampel uji harus disaring dahulu dengan membrane PTFE agar tidak terjadi penyumbatan dalam kolom dan menghilangkan udara atau gas dari pelarutnya. Karena jika sampel masih ada gas yang terlarut dapat menyebabkan gangguan pada sistem pengatur gradient dari eluennya.
Didalam Kolom itu komponen-komponen dipisahkan berdasarkan perbedaan kekuatan interaksi solute terhadap fasa diamnya. Solut yang berinteraksi kurang kuat maka akan keluar lebih lambat dari kolom daripada solut yang lebih kuat interaksinya. Komponen itu selanjutnya keluar dari kolom dengan kecepatan yang berbeda dan dideteksi oleh detector. Detektor yang digunakan adalah detector UV.
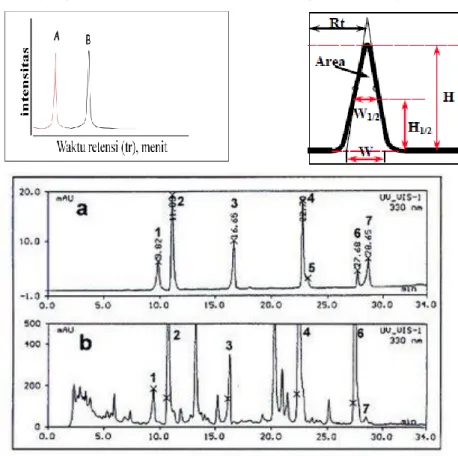
Read out dari hasil analisis dengan HPLC adalah suatu kromatogram. Kromatogram adalah grafik yang menghubungkan antara intensitas komponen yang dibawa oleh fasa gerak terhadap waktu retensi. Banyaknya puncak menunjukkan jumlah komponen,sedangkan luas peak menyatakan konsentrasi.
Dari data kromatogram larutan standar, didapatkan waktu retensi 1,39. Waktu retensi tersebut merupakan jangka waktu yang terukur saat sampel melewati kolom HPLC. Dari data kromtogram sampel didapatkan dua puncak yaitu puncak untuk paracetamol dan kafein. Puncak dari kafein lebih kecil dari pada puncak paracetamol, karena kadar dari kafein dalam sampel obat oskadon juga lebih sedikit. Pada percobaan kali ini,injeksi sampel dilakukan dua kali untuk mendapatkan data yang akurat.
Setelah sampel diukur, didapat kromatogram dari sampel.Luas area yang diperoleh dalam dua kali pengukuran yaitu 1246385 dan 1307825. Kemudian dibuat kurva kalibrasi dari larutan standar yang menghasilkan persamaan y = 24654,8750x + 179226,1000 dengan regresi 0,999.
Setelah dilakukan pengolahan data, maka didapatlah kadar parasetamol dalam obat oskadon adalah 89,05%. Dari berat rata-rata tablet oskadon sebesar 703,22 mg terkandung parasetamol sebesar 626,21741 mg. Sedangkan dalam kemasan tertera bahwa kadar paracetamol dalam obat oskadon adalah 500 mg.
F. Kesimpulan
Berdasarkan percobaan penetuan kadar parasetamol dalam sampel obat oskadon menggunakan instrument HPLC didapatkan kadar parasetamol sebesar 89,05%,sehingga massa parasetamol dalam oskadon sebesar 626,21741 mg.
G. Daftar Pustaka
Harvey, David. (2000). Modern Analytical Chemistry. USA: The McGraw-Hill Companies.
Hendayana, Sumar. (1994). Kmia Instrumen Edisi Kesatu. Semarang : IKIP Semarang Press.
Hendayana, Sumar. (2006). KIMIA PEMISAHAN Metode Kromatografi dan Elektroforensis Modern. Bandung : PT. Remaja Rosdakarya.
Clark, Jim. (2007). “Kromatografi Cair Kinerja Tinggi (HPLC)”. [Online]. Tersedia: http://www.chem-istry.org yang direkam pada 6-10-2007. [16 Desember 2010].
Putra, Effendy De Lux. (2004). Kromatografi Cair Kinerja Tinggi Dalam Bidang Farmasi. Sumatera Utara : Jurusan Farmasi FMIPA USU.
Suhanda, Hokcu. (2001). Handout Perkuliahan Kimia Analitik Instrumen : KCKT/HPLC. Jurusan Pendidikan Kimia UPI : tidak diterbitkan.
Tim Kimia Analitik Instrumen. (2010). Penuntun Praktikum Kimia Analitik Instrumen (KI-431). Bandung : Jurusan Pendidikan Kimia FPMIPA UPI.
LAMPIRAN
1. Perhitungan Pembuatan Larutan :
a. Perhitungan massa parasetamol dari konsentrasi parasetamol 248 ppm. : Ppm = mg / L
248 ppm = mg / 2,5 x 10-3L Massa = 6,2 mg
Jadi massa parasetamol adalah 6,2 mg. b. Perhitungan massa KH2PO4 Diketahui : V = 420 mL M = 0,01 M Mr = 137 Penyelesaian : M = g Mr x 1000 V 0,01 = g 137 x 1000 420 g = 0,5754
c. Pembuatan larutan deret standar :
V1 = 1 mL V1.M1 = V2.M2 1 mL x 248 ppm = 10 mL x M2 M2 = 24,8 ppm V1 = 2 mL V1.M1 = V2.M2 2 mL x 248 ppm = 10 mL x M2 M2 = 49,6 ppm V1 = 3 mL V1.M1 = V2.M2 3 mL x 248 ppm = 10 mL x M2 M2 = 74,4 ppm V1 = 4 mL V1.M1 = V2.M2
4 mL x 248 ppm = 10 mL x M2 M2 = 99,2 ppm V1 = 5 mL V1.M1 = V2.M2 5 mL x 248 ppm = 10 mL x M2 M2 = 124 ppm 2. Prosedur Mengoperasikan HPLC
Instrumen HPLC dihidupkan kemudian dan kondisikan instrument HPLC sesuai dengan:
Fasa gerak : KH2PO4 : Isopropil alcohol : methanol : asetonitril
(420:30:20:30) Kolom : C-18 = 15 cm Panjang gelombang : 234 nm Laju alir : 0,5 mL/menit Volume injeksi : 20 μL
Temperatur : 33°C
Pastikan kabel penghubung listrik telah tersambung dengan benar. Setelah itu tekan tombol “ON” pada sakelar listrik. Isi botol fasa gerak dengan volume memadai dan kosongkan botol penampung. Tekan tombol “ON” pada alat, berturut-turut untuk power, detektor dan pompa. Lakukan pemograman alat dengan computer. Ikuti langkahnya sesuai dengan instruksi computer. Pilih mode yang digunakan sesuai dengan parameter kondisi instrument. Apabila kromatogram telah menunjukkan base line mendatar, maka instrument siap digunakan. Injeksikan larutan standar secarea berurutan (mulai dari konsentrasi terendah) dan larutan sampel. Cetak hasil pengukuran dan catat kondisi percobaannya. Stelah selesai digunakan, matikan pompa dengan menyoroti tanda pompa pada computer. Tutup file sesuai petunjuk, lalu matikan computer. Untuk mematikan, tekan tombol “OFF” pada pompa, detektor dan power secara berurutan. Terakhir, putuskan sambungan listrik.
3. Data Pengamatan dan Pengolahan Data
Larutan Deret Standar I Konsentrasi (ppm) Waktu Retensi Luas Area 24,8 1,39 1007806 49,6 1,39 1895495 74,4 1,39 2667899 99,2 1,39 3316040 124 1,39 4099740
Kurva kalibrasi larutan deret standar I
Larutan Deret Standar II
Konsentrasi Waktu Retensi Luas Area
24,8 1,39 813607 49,6 1,39 1351640 74,4 1,39 2036587 99,2 1,39 2638557 124 1,39 3227353 y = 30662,9556x + 316072,10000 R² = 0.9974 0 500000 1000000 1500000 2000000 2500000 3000000 3500000 4000000 4500000 24,8 49,6 74,4 99,2 124
Kurva konsentrasi standar terhadap luas
area
Konsentrasi standar (ppm) Lu as A reaKurva kalibrasi larutan deret standar II
Data Pengukuran Sampel Larutan
sampel Waktu Retensi
Luas Area
I 1,39 1246385
II 1,39 1307825
Massa sampel obat oskadon Tablet Massa (mg) 1 711,1 2 705,2 3 702,4 4 694,2 Jumlah 2812,9 Massa rata-rata 703,2 y = 24654,8750x + 179226,1000 R² = 0.999 0 500000 1000000 1500000 2000000 2500000 3000000 3500000 24,8 49,6 74,4 99,2 124
Kurva konsentrasi Standar terhadap
luas area
Konsentrasi standar (ppm) Lu as A reaBerdasarkan kurva yang dihasilkan, maka yang digunakan untuk penentuan kadar parasetamol dalam sampel adalah kurva dari larutan standar II mempunyai persamaan :
y = 24654,8750x + 179226,1000 R2 = 0,999
Karena pada data pengukuran luas area sampel I dan sampel II memiliki waktu retensi yang sama yaitu 1,39 sehingga luas area sampel dirata-ratakan.
Larutan sampel Luas Area
I 1246385
II 1307825
Rata-rata 1277105 Massa Sampel 12,5 mg
Berdasarkan persamaan dari larutan standar II yang dihasilkan : y = 24654,8750x + 179226,1000
1277105 = 24654,8750x + 179226,1000 24.654,8750X = 1.277.105 – 179.226,1 X = 44,52989 ppm
Jadi konsentrasi parasetamol dalam 10 mL larutan adalah 44,52989 ppm. Konsentrasi parasetamol dalam 25 mL (sebelum pengenceran) : V1.M1 = V2.M2
1 mL x M1 = 10 mL x44,52989 ppm
M1 = 445,2989 ppm
Jadi konsentrasi parasetamol dalam 25 mL larutan (sebelum pengenceran) adalah 445,2989 ppm.
Massa parasetamol dalam sampel : Mg = 445,2989 ppm x 2,5 x 10-3L
Mg = 11,1324 mg
Jadi massa parasetamol dalam sampel adalah 11,1324 mg. Kadar parasetamol dalam sampel :
%Parasetamol = (Massa parasetamol / Massa sampel) x 100% %Parasetamol = (11,1324 mg / 12,5 mg) x 100%
%Parasetamol = 89,05 %
Jadi %Parasetamol dalam sampel adalah 89,05%. Massa parasetamol dalam obat oskadon : Massa rata-rata tablet oskadon = 703,22 mg Massa parasetamol = 89,05% x 703,22 mg Massa parasetamol = 626,21741 mg
Jadi massa parasetamol dalam oskadon adalah 626,21741 mg. 4. Dokumentasi Foto Praktikum
Kolom
Penginjeksian Proses Injeksi
Instrumen HPLC