BAB 2
TINJAUAN PUSTAKA
2.1 Tumbuhan Jambu Air ( Syzygium aquea (Burm.f.)Alston)
2.1.1 Morfologi Tumbuhan Jambu Air
Syzygium aquea asli dari Malaysia dan Indonesia yang tergolong ke dalam family Myrtaceae dan dikenal sebagai jambu air. Tangkai jambu air pendek. Bentuk daunnya bulat telur sampai lonjong atau elips. Ciri khas bentuk daun itu ialah, makin ke ujung makin runcing. Lebar daun setengah dari panjangnya,. Warnanya hijau buram. Bila dibiarkan sosok pohonnya akan terus tumbuh walaupun tanpa pemangkasan. Paling tidak tingginya mencapai 3 m bahkan bisa sampai 10 m. Mahkota pohonnya agak rendah dan tidak teratur. Batangnya licin dan bengkok-bengkok dengan garis tengah 10-15 cm. Cabang-cabangnya berwarna merah kecoklatan yang umumnya berbentuk bulat dan gundul. Kulit daun bila diraba agak tebal. Melihat keadaan permukaan daun itu, orang lalu membedakan permukaan daun yang licin seperti daun kopi dan gundul seperti daun jambu air (Tjitrosoepomo, 2001).
2.1.2 Sistematika Tumbuhan Jambu Air
Sistematika tumbuhan jambu air adalah sebagai berikut: Kingdom : Plantae
Divisi : Spermatophyta Class : Dicotyledoneae Ordo : Myrtales Family : Myrtaceae Genus : Syzygium
2.1.3 Manfaat Tumbuhan Jambu Air
Beberapa jenis tumbuhan ini telah digunakan sebagai obat tradisional dan sebagai antibiotik. (Panggabean,1992). Di Malaysia, serbuk daun yang telah kering digunakan untuk merawat lidah yang patah dan akarnya digunakan untuk menyembuhkan penyakit kudis dan mengurangi bengkak (Osman, 2009). Manfaat dari buah jambu air yaitu untuk membersihkan ginjal dari asam urine dan urea serta vitamin C yang terkandung dalam jambu air berfungsi sebagai antioksidan ( Susan, 2001).
2.2 Senyawa Flavonoida
Istilah flavonoida dikenakan pada suatu golongan besar senyawa yang yang berasal dari kelompok senyawa yang paling umum yaitu flavon. Suatu jembatan oksigen terdapat diantara cincin A dalam kedudukan orto dan atom karbon benzil yang terletak di sebelah cincin B membentuk cincin baari tipe 4-piron. Senyawa heterosiklik ini pada tingkat oksidasi yang berbeda terdapat dalam kebanyakan tumbuhan. Flavon adalah bentuk yang mempunyai cincin C dengan tingkat oksidasi yang paling rendah dan dianggap sebagai struktur induk dalam nomenklatur kelompok senyawa ini (Manitto, 1992).
Senyawa flavonoida sebenarnya terdapat pada semua bagian tumbuhan termasuk daun, akar, kayu, kulit, tepung sari, bunga, buah, dan biji. Kebanyakan flavonoida ini berada di dalam tumbuh-tumbuhan, kecuali alga. Namun ada juga flavonoida yng terdapat pada hewan, misalnya dalam kelenjar bau berang-berang dan sekresi lebah. Dalam sayap kupu - kupu dengan anggapan bahwa flavonoida berasal dari tumbuh-tumbuhan yang menjadi makanan hewan tersebut dan tidak dibiosintesis di dalam tubuh mereka. Penyebaran jenis flavonoida pada golongan tumbuhan yang tersebar yaitu angiospermae, klorofita, fungi, briofita (Markham, 1988).
Dalam tubuh manusia, flavonoida berfungsi sebagai antioksidan sehingga sangat baik untuk pencegahan kanker. Manfaat lain lain flavonoida adalah melindungi struktur sel, meningkatkan efektivitas vitamin C, antiinflamasi, mencegah keropos tulang dan sebagai anti bioktik (Muhammad, 2011). Dalam dosis kecil flavon bekerja sebagai stimulan pada jantung, hesperidin mempengaruhi pembuluh darah kapiler, flavon terhidroksilasi bekerja sebagai diuretik dan antioksidan pada lemak. Kegunaan flavonoida pada tumbuhan adalah untuk menarik serangga yang membantu proses penyerbukan, membantu menarik perhatian binatang yang membantu penyebaran biji (Sirait, 2007).
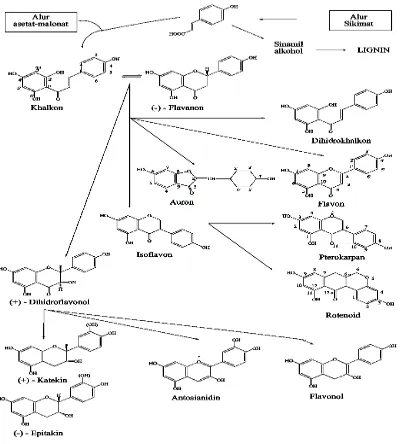
Gambar 2.1 Biosintesa hubungan antara jenis monomer flavonoida dari alu
asetat-malonat dan alur sikimat
(Markham, 1988)
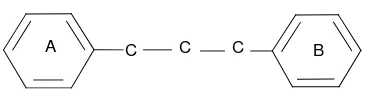
2.2.1 Struktur Dasar Flavonoida
C C C
A B
Gambar 2.2 Kerangka Dasar Flavonoida
(Sastrohamidjojo, 1996).
2.2.3 Klasifikasi Senyawa Flavonoida
Flavonoida mengandung sistem aromatik yang terkonjugasi sehingga menunjukkan pita serapan kuat pada daerah spektrum sinar ultraviolet dan spektrum sinar tampak, umumnya dalam tumbuhan terikat pada gula yang disebut dengan glikosida (Harborne, 1996).
Dalam tumbuhan, flavonoida terdapat dalam berbagai struktur. Keragaman ini disebabkan oleh perbedaan tahap modifikasi lanjutan dari struktur dasar flavonoida tersebut, antara lain :
1. Flavonoida O-glikosida, satu gugus hidroksil flavonoida (atau lebih) terikat pada satu gula (lebih) dengan ikatan hemiasetal yang tak tahan asam. Pengaruh glikosilasi menyebabkan flavonoida menjadi kurang reaktif dan lebih mudah larut dalam air. Glukosa merupakan gula yang paling umum terlibat dan gula lain yang sering juga terdapat adalah galaktosa, ramnosa, xilosa, dan arabinosa. Gula lain yang kadang-kadang ditemukan adalah alosa, manosa, fruktosa, apiosa, dan asam glukoronat serta galakturonat.
O O
OH
flavonol
3. Flavonoida sulfat, senyawa ini mengandung satu ion sulfat, atau lebih, yang terikata pada hidroksil fenol atau gula. Senyawa ini sebenarnya bisulfat karena terdapat sebagai garam, yaitu flavon-O-SO3K. Banyak yang berupa glikosida bisulfat, bagian bisulfat terikat pada hidroksil fenol yang mana saja yang masih bebas atau pada gula.
4. Biflavonoida, yaitu flavonoida dimer. Flavonoida yang biasanya terlibat adalah flavon dan flavanon yang secara biosintesis mempunyai pola oksigenasi yang sederhana 5,7,4’ dan ikatan antar flavonoida berupa ikatan-ikatan karbon atau kadang-kadang eter. Monomer flavonoida yang digabungkan menjadi biflavonoida dapat berjenis sama atau berbeda, dan letak ikatannya berbeda-beda. Biflavonoida jarang ditemukan sebagai glikosida, dan penyebarannya terbatas, terdapat terutama pada gimnospermae.
5. Aglikon flavonoida yang aktif-optik, sejumlah aglikon flavonoida mempunyai atom karbon asimetrik dan dengan demikian menunjukkan keaktifan optik (yaitu memutar cahaya terpolarisasi-datar). Yang termasuk dalam golongan flavonoida ini adalah flavanon, dihidroflavonol, katekin, rotenoid, dan lain-lain (Markham, 1988).
Menurut Robinson (1995), flavonoida dapat dikelompokkan berdasarkan keragaman pada rantai C3
1. Flavonol
yaitu :
2. Flavon
Flavon berbeda dengan flavonol dimana pada flavon tidak terdapat gugusan 3-hidroksi. Hal ini mempunyai serapan UV-nya, gerakan kromatografi, serta reaksi warnanya. Flavon terdapat juga sebagai glikosidanya lebih sedikit daripada jenis glikosida pada flavonol. Flavon yang paling umum dijumpai adalah apigenin dan luteolin. Luteolin merupakan zat warna yang pertama kali dipakai di Eropa. Jenis yang paling umum adalah 7-glukosida dan terdapat juga flavon yang terikat pada gula melalui ikatan karbon-karbon. Contohnya luteolin 8-C-glikosida. Flavon dianggap sebagai induk dalam nomenklatur kelompok senyawa flavonoida.
3. Isoflavon
Isoflavon merupakan isomer flavon, tetapi jumlahnya sangat sedikit dan sebagai fitoaleksin yaitu senyawa pelindung yang terbentuk dalam tumbuhan sebagai pertahanan terhadap serangan penyakit. Isoflavon sukar dicirikan karena reaksinya tidak khas dengan pereaksi warna manapun. Beberapa isoflavon (misalnya daidzein) memberikan warna biru muda cemerlang dengan sinar UV bila diuapi amonia, tetapi kebanyakan yang lain tampak sebagai bercak lembayung yang pudar dengan amonia berubah menjadi coklat.
O O
flavon
O O
4. Flavanon
Flavanon terdistribusi luas di alam. Flavanon terdapat di dalam kayu, daun dan bunga. Flavanon glikosida merupakan konstituen utama dari tanaman genus prenus dan buah jeruk ; dua glikosida yang paling lazim adalah neringenin dan hesperitin, terdapat dalam buah anggur dan jeruk.
5. Flavanonol
Senyawa ini berkhasiat sebagai antioksidan dan hanya terdapat sedikit sekali jika dibandingkan dengan flavonoida lain. Sebagian besar senyawa ini diabaikan karena konsentrasinya rendah dan tidak berwarna.
6. Katekin
Katekin terdapat pada seluruh dunia tumbuhan, terutama pada tumbuhan berkayu. Senyawa ini mudah diperoleh dalam jumlah besar dari ekstrak kental Uncaria gambir dan daun teh kering yang mengandung kira-kira 30% senyawa ini. Katekin berkhasiat sebagai antioksidan.
O O
flavanon
O O
OH
7. Leukoantosianidin
Leukoantosianidin merupakan senyawa tan warna, terutama terdapat pada tumbuhan berkayu. Senyawa ini jarang terdapat sebagai glikosida, contohnya melaksidin, apiferol.
8. Antosianin
Antosianin merupakan pewarna yang paling penting dan paling tersebar luas dalam tumbuhan. Pigmen yng berwarna kuat dan larut dalam air ini adalah penyebab hampir semua warna merah jambu, merah marak , ungu, dan biru dalam daun, bunga, dan buah pada tumbuhan tinggi. Secara kimia semua antosianin merupakan turunan suatu struktur aromatik tunggal yaitu sianidin, dan semuanya terbentuk dari pigmen sianidin ini dengan penambahan atau pengurangan gugus hidroksil atau dengan metilasi atau glikosilasi.
Antosianin
O HO
OH
OH OH
OH
katekin
O
OH
HO OH
O
9.Khalkon
Khalkon adalah pigmen fenol kuning yang berwarna coklat kuat dengan sinar UV bila dikromatografi kertas. Aglikon khalkon dapat dibedakan dari glikosidanya, karena hanya pigmen dalam bentuk glikosida yang dapat bergerak pada kromatografi kertas dalam pengembang air (Harborne, 1996).
10. Auron
Auron berupa pigmen kuning emas yang terdapat dalam bunga tertentu dan briofita. Dalam larutan basa senyawa ini berwarna merah ros dan tampak pada kromatografi kertas berupa bercak kuning, dengan sinar ultraviolet warna kuning kuat berubah menjadi merah jingga bila diberi uap ammonia (Robinson, 1995).
Auron
Menurut Harborne (1996), dikenal sekitar sepuluh kelas flavonoida dimana semua flavonoida, menurut strukturnya, merupakan turunan senyawa induk flavon dan semuanya mempunyai sejumlah sifat yang sama yakni:
Tabel 2.1. Sifat dari golongan-golongan flavonoida menurut Harborne Golongan
flavonoida
Penyebaran Ciri khas
Antosianin
Proantosianidin
Pigmen bunga merah marak, dan biru juga dalam daun dan jaringan lain.
Terutama tidak berwarna, dalam daun tumbuhan yang berkayu.
Larut dalam air, λ maks 515-545 nm, bergerak dengan BAA pada kertas.
Flavonol
Terutama ko-pigmen tidak berwarna dalam bunga sianik dan asianik tersebar luas dalam daun.
Seperti flavonol
Seperti flavonol
Tidak berwarna dan hampir seluruhnya terbatas pada gimnospermae
Pigmen bunga kuning, kadang-kadang terdapat juga dalam jaringan lain
Tidak berwarna, dalam daun dan buah (terutama dalam Citrus)
Tidak berwarna, sering kali dalam akar, hanya terdapat dalam suku Leguminosae
Setelah hidrolisis, berupa bercak kuning murup pada kromatogram Forestal bila disinari sinar UV, maksimal spektrum pada 330 – 350 nm. Setelah hidrolisis, berupa bercak coklat redup pada kromatogram Forestal mak-simal spektrum pada 330-350 nm.
Mengandung gula yang terikat melalui ikatan C-C, bergerak dengan pengembang air, tidak seperti flavon biasa. Pada kromatogram BAA berupa bercak redup dengan RF
Dengan amonia berwarna merah (perubahan warna dapat diamati in situ), maksimal spektrum 370-410 nm.
tinggi .
Berwarna merah kuat dengan Mg/HCl, kadang – kadang sangat pahit .
Bergerak pada kertas dengan pengembang air, tidak ada uji warna yang khas.
(Markham, 1988).
2.2.2 Sifat Kelarutan Senyawa Flavonoida
glikosida. Sebaliknya, aglikon yang kurang polar seperti isoflavon, flavanon, flavon serta flavonol yang termetoksilasi cenderung lebih mudah larut dalam pelarut seperti eter dan kloroform (Markham, 1988).
2.3 Teknik Pemisahan
Tujuan dari teknik pemisahan adalah untuk memisahkan komponen yang akan ditentukan berada dalam keadaan murni, tidak tercampur dengan komponen-komponen lainnya. Ada 2 jenis teknik pemisahan:
1. Pemisahan kimia adalah suatu teknik pemisahan yang berdasarkan adanya perbedaan yang besar dari sifat-sifat fisika komponen dalam campuran yang akan dipisahkan.
2. Pemisahan fisika adalah suatu teknik pemisahan yang didasarkan pada perbedaan-perbedaan kecil dari sifat-sifat fisik antara senyawa-senyawa yang termasuk dalam suatu golongan (Muldja, 1995).
2.3.1Ekstraksi
Ekstraksi adalah suatu proses pemisahan substansi atau zat dari campurannya dengan menggunakan pelarut yang sesuai. Ekstraksi dapat digolongkan berdasarkan bentuk campuran yang diekstraksi dan proses pelaksanaannya. Berdasarkan bentuk campuran yang diekstraksi, suatu ekstraksi dibedakan menjadi:
1. Ekstraksi padat-cair
Zat yang diekstrasi terdapat di dalam campuran yang berbentuk padatan. Ekstraksi jenis ini banyak dilakukan di dalam usaha mengisolasi zat berkhasiat yang terkandung di dalam bahan alam.
2. Ekstraksi cair-cair
Zat yang diekstraksi terdapat di dalam campuran yang berbentuk cair. Ekstraksi cair-cair sering juga disebut ekstraksi pelarut untuk memisahkan logam-logam tertentu didalam air.
1. Ekstraksi berkesinambungan (kontinyu)
Pada ekstraksi kontinyu, pelarut yang sama digunakan secara berulang-ulang sampai proses ekstraksi selesai. Tersedia berbagai alat untuk jenis ekstraksi ini, seperti alat soklet.
2. Ekstraksi bertahap
Pada ekstraksi bertahap, setiap kali ekstraksi selalu digunakan pelarut yang baru sampai proses ekstraksi selesai. Alat yang biasanyadigunakan adalah corong pisah (Yazid, 2005).
2.3.2Kromatografi
Kromatografi merupakan metode umum dalam pemisahan campuran berdasarkan fase diam dan fase gerak. Fase gerak dapat berupa gas atau cairan dan fase diam berupa padatan atau lapisan cairan yang disokong oleh padatan. Fase gerak akan bergerak melewati fase diam dan senyawa-senyawa dalam campuran akan bergerak secara kontiniu diantara kedua fase sesuai dengan koefisien distribusi (Rodig, 1997).
Berdasarkan pada mekanisme pemisahannya, kromatografi dapat dibedakan menjadi kromatografi adsorbsi, kromatografi partisi, kromatografi pasangan ion, kromatografi penukar ion dan kromatografi ekslusi ukuran. Berdasarkan pada alat yang diguanakan kromatografi dapat dibagi atas kromatografi kertas, kromatografi lapis tipis, kromatografi cair kinerja tinggi, kromatografi gas dan kromaatografi kolom (Gandjar, 2007).
2.3.2.1Kromatografi Lapis Tipis
Pada umumnya fase diam bersifat polar dan senyawa polar akan melekat lebih kuat pada lempeng daripada senyawa tak polar akibat interaksi tarik menarik dipole. Senyawa tak polar kurang melekat erat pada fase diam polar sehingga bergerak naik lebih jauh ke atas lempeng. Jarak tempuh ke atas lempeng merupakan cermin polaritas senyawa. Peningkatan polaritas pelarut akan menurunkan interaksi senyawa dengan fase diam sehingga senyawa dalam fase gerak bergerak lebih jauh pada lempeng (Bresnick, 2005).
Fase diam yang digunakan pada kromatografi lapis tipis merupakan penyerap berukuran kecil dengan diameter partikel 10-30 μm. Semakin kecil ukuran rata-rata partikel fase diam maka semakin baik kinerja kromatografi lapis tipis dalam hal efesiensi dan resolusi (Gandjar, 2007).
Nilai utama kromatografi lapis tipis pada penelitian flavonoida adalah sebagai cara analisis cepat yang memerlukan bahan sangat sedikit. Menurut Markham, Kromatografi Lapis Tipis terutama berguna untuk tujuan berikut:
1. Mencari pelarut untuk kromatografi kolom
2. Analisis fraksi yang diperoleh dari kromatografi kolom 3. Identifikasi flavonoida secara ko-kromatografi
4. Isolasi flavonoida murni skala kecil
5. Penyerap dan pengembang yang digunakan umumnya sama dengan penyerap dan pengembang pada kromatografi kolom dan kromatografi kertas (Markham, 1988).
Faktor reterdasi merupakan parameter karakteristik kromatografi kertas dan kromatografi lapis tipis. Harga Rf adalah ukuran kecepatan migrasi suatu komponen pada kromatogram. Rf didefenisikan sebagai perrbandingan jarak yang ditempuh komponen terhadap jarak yang ditempuh pelarut atau fase gerak.
��= jarak yang ditempuh komponen jarak yang ditempuh pelarut
2.3.2.2Kromatografi Kolom
Kolom kromatografi biasanya terbuat dari gelas. Panjang kolom disesuaikan dengan jumlah komponen yang akan dianalisis dan lebar kolom disesuaikan dengan jumlah senyawa yang akan akan dianalisis (Bintang, 2011). Pada kromatografi kolom fase diam dan zat cair ditempatkan didalam tabung kaca berbentuk silinder, pada bagian bawah tertutup dengan katup atau keran dan fase geraknya dibiarkan mengalir ke bawah malalui gaya berat.
Kromatografi kolom biasanya dibuat dengan menuangkan suspensi fasa diam dan pelarut yang sesuai kedalam kolom dan dibiarkan memadat. Selanjutnya pelarut diturunkan sampai tepat pada bagian atas penyerap dan cuplikan yang akan dipisahkan diletakkan pada bagian atas penyerap kemudian fase gerak dimasukkan dan dibiarkan mengalir melewati kolom dan komponen campuran turun berupa pita dengan laju yang berlainan kemudian hasil pemisahan dari kolom dikumpulkan sebagai fraksi. Kromatografi kolom merupakan bentuk kromatografi cair (Gritter, 1991).
2.3.2.3Kromatografi Lapis Tipis Preparatif
Metode kromatografi juga dapat dilakukan dengan metode kromatografi lapis tipis preparatif yaitu pemisahan yang terdiri atas sejumlah senyawa serupa dengan kromatografi jenis yang sukar dan kadang-kadang lama dipisahkan. KLT preparatif adalah cara ideal untuk memisahkan cuplikan kecil (50 mg sampai 1 g). Penyerap yang dipakai adalah silika gel dan dipakai untuk pemisahan campuran senyawa lipofil maupun campuran senyawa hidrofil. Ketebalan adsorben yang sering dipakai 0,5 – 2 mm. Ukuran plat kromatografi biasanya 20x20 cm atau 20x40 cm.
bebaerapa pita. Pita penyerap tersebut diharapkan mengandung komponen campuran murni kemudian dikerok dari pelat kaca dengan spatula dan ditampung dengan logam tipis atau kertas lilin. Penyerap diletakkan dalam corong kaca memakai kertas saring lalu dielusi beberapa kali dengan pelarut yang cocok (Gritter, 1991).
2.4 Teknik Spektroskopi
Teknik spektroskopi adalah salah satu teknik analisis kimia-fisika yang mengamati tentang interaksi atom atau molekul dengan radiasi elektromagnetik. Ada dua macam instrumen pada teknik spektroskopik yaitu spektrometer dan spektrofotometer. Instrumen yang memakai monokromator celah yang tetap pada bidang fokus disebut spektrometer. Apabila spektrometer tersebut dilengkapi dengan detektor yang bersifat fotoelektrik disebut sebagai spektrofotometer (Muldja, 1995).
Panjang gelombang pada suatu senyawa organik yang menyerap energi cahaya bergantung pada struktur senyawa itu. Oleh karena itu teknik spektroskopi dapat digunakan untuk menentukan struktur senyawaan yang tidak diketahui dan untuk mempelajari karakteristik ikatan dari senyawaan yang diketahui (Fessenden, 1982).
Rumus molekul dapat ditentukan dari spektrum massa dan bentuk fragmentasinya. Gugus fungsi alami ditentukan dari spektrum inframerah. Gugus fungsi terkonjugasi dapat ditentukan dari spektrum elektronik. Struktur dapat ditentukan berdasarkan inti proton dan karbon yang dihasilkan molekul dari spektrum 1
H dan 13C NMR (Brown, 1937).
2.4.1Spektrofotometer Ultraviolet-Visibel (UV-Vis)
Spektrofotometer ultraviolet-visible adalah anggota tenik analisis spektroskopik yang memakai sumber radiasi elektromagnetik ultraviolet dekat dan sinar tampak dengan memakai instrumen spektrofotometer. Spektrofotometer ultraviolet-visibel dapat melakukan penentuan terhadap sampel yang berupa larutan, gas atau uap.
radiasi elektromagnetik akan mengabsopsi radiasi elektromagnetik yang energinya sesuai. Interaksi tersebuat akan meningkatkan energi potensial elektron pada tingkat keadaan eksitasi. Apabila pada molekul sederhana tersebut hanya terjadi transisi elektronik pada satu macam gugus maka akan terjadi suatu absorpsi yang merupakan garis spektrum (Muldja,1995). Panjang gelombang cahaya ultraviolet bergantung pada mudahnya promosi electron. Molekul-molekul yang memerlukan lebih banyak energy untuk promosi electron, akan menyerap pada panjang gelombang yang lebih pendek (Supratman, 2010).
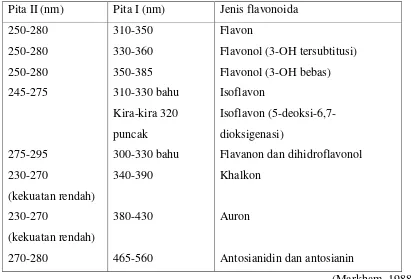
Isoflavon, flavanon dan dihidroflavonol dikelompokkan dalam satu grup karena sama-sama memiliki kekurangan konjugasi antara cincin A dan B. Spektrum UV berbeda dengan flavon yang menunjukkan serapan yang rendah pada pita I yang ditunjukkan dalam bentuk bahu dan pita II berbentuk puncak. Spektrum dari senyawa ini dipengaruhi oleh oksigen dan substitusi dari cincin B. Penambahan oksigen pada cincin A membuatnya ke pergeseran batokromik pada pita II, contohnya 7,4’-dihidroksiisoflavon (249 nm), 5,7,4’-trihidroksiisoflavon (261 nm) dan 5,6,7,4’-tetrahidroksiisoflavon (270 nm ). Flavanon dan dihidroflavonol memiliki serapan maksimal (Pita II) pada 270-295, seperti isoflavon, hidroksil bebas terletak pada 10-15 nm (J.Harborne, 1975).
Tabel 2.2 Rentang serapan spektrum UV-Visible flavonoida
2.4.2 Spektrofotometer Infra Merah (FT-IR)
Cahaya tampak terdiri dari beberapa range frekuensi elektomagnetik yang berbeda dimana setiap frekuensi bisa dilihat sebagai warna yang berebeda. Radiasi inframerah juga mengandung beberapa range frekuensi tetapi tidak dapat dilihat oleh mata. Pengukuran pada spektrum inframerah dilakukan pada daerah cahaya inframerah tengah yaitu pada panjang gelombang 2,5-50 μm atau bilangan gelombang 4000-200 cm-1. Energi yang dihasilkan oleh radiasi ini akan menyebabkan vibrasi atau getaran pada molekul. Pita absorbsi inframerah sangat khas dan spesifik untuk setiap tipe ikatan kimia atau gugus fungsi.
grafik yang akan menunjukkan persentase transmitan yang bervariasi pada setiap frekuensi radiasi inframerah. Satuan frekunsi yang digunakan dinyatakan dalam bilangan gelombang (Dachriyanus, 2004).
Terdapat dua macam getaran molekul, yaitu getaran ulur dan getaran tekuk. Getaran ulur adalah suatu gerakan berirama di sepanjang sumbu ikatan sehingga jarak antar atom bertambah atau berkurang. Getaran tekuk dapat terjadi karena perubahan sudut-sudut ikatan antara ikatan-ikatan pada sebuah atom atau karena gerakan sebuah gugusan atom terhadap sisa molekul tanpa gerakan nisbi atom-atom dalam gugusan (Silverstein, 1986). Instrumen yang digunakan untuk mengukur resapan radiasi inframerah pada berbagai macam panjang gelombang disebut spektrofotometer inframerah (Fessenden, 1982). Spektrofotometer inframerah pada umumnya digunakan untuk:
1. Menentukan gugus fungsi suatu senyawa organik
2. Mengetahui informasi struktur suatu senyawa organik dengan membandingkan daerah sidik jarinya (Dachriyanus, 2004).
2.4.3 Spektrometer Resonansi Magnetik Inti proton (1H-NMR)
Spektrometer Resonansi Magnetik Inti (Nuclear Magnetic Resonance, NMR) merupakan alat yang berguna pada penentuan struktur molekul organik. Teknik ini memberikan informasi mengenai berbagai jenis atom hidrogen dalam molekul. Spektrum Resonansi Magnetik Inti memberikan informasi mengenai lingkungan kimia atom hidrogen, jumlah atom hidrogen dalam setiap lingkungan dan struktur gugusan yang berdekatan dengan setiap atom hidrogen (Creswell, 1982). Semua proton dalam molekul yang identik dalam lingkungan kimia akan memiliki pergerseran kimia yang sama. Dengan demikian, semua proton dari TMS atau semua proton dalam benzen , siklopentana, atau aseton memiliki nilai resonansi yang
masing-masing peak adalah proporsional dengan jumlah dari hidrogen yang ada pada peak tersebut (Pavia, 1979).
Spektrum Resonansi Mangeti Inti pada umunya digunakan untuk:
1. Menentukan jumlah proton yang memiliki lingkungan kimia yang sama pada suatu senyawa organik
2. Mengetahui informasi mengenai struktur suatu senyawa organik (Dachriyanus, 2004).
Terperisai dan tak terperisai merupakan istilah relatif. Untuk memperoleh pengukuran yang kuantitatif diperlukan suatu titik rujukan. Senyawa yang dipilih untuk rujukan adalah Tetrametilsilana (CH3)4
1. TMS mempunyai 12 atom hidrogen yang keseluruhannya mempunyai lingkungan kimia yang sama, sehingga menghasilkan sinyal singlet yang kuat karena mengandung banyak atom hidrogen.
Si, yang proton-protonnya menyerap pada ujung kanan spektrum NMR (Fessenden, 1982). Pada beberapa spektrum NMR akan terlihat sinyal TMS pada angka nol sehingga sinyal ini tidak perlu dianalisa. TMS dipilih sebagai standart karena:
2. Elektron-elektron pada ikatan C-H dalam senyawa ini berada dekat dengan hidrogen jia dibanding dengan senyawa lain. Ini berarti inti hidrogen sangat terlindungi dari medan magneteksternal sehingga dibutuhkan medan magnet yang besar untuk membawa atom hidrogen ke kondisi resonansi (Dachriyanus, 2004). 3. TMS merupakan cairan yang volatile, dapat ditambahkan dalam jumlah sedikit
pada larutan sampel dapat diperoleh kembali dengan menguapkan pelarutnya. 4. TMS bersifat inert dan tidak larut dalam air (Supratman, 2010).