CATATAN HARIAN
PENELITIAN KERJASAMA ANTAR PERGURUAN TINGGI
(PAKERTI)
DANA ITS 2020
Modifikasi Enzimatik Laccase sebagai Alternatif Teknologi Pasca Panen
Biji Kakao (Theobroma Cacao Linn)
Tim Peneliti :
Ketua: Dr. techn. Endry Nugroho Prasetyo, S.Si., MT (Biologi/FSAD)
Anggota 1
Siti Zullaikah ST.,MT.,Ph.D (Teknik Kimia/F)
Anggota 2 Maharani Pertiwi K, Ph.D. (UNUSA Surabaya)
Anggota 3
Isdiantoni,SP.MP. (UNIJA Sumenep)
Anggota 4
Dr. Ida Ekawati,MP (UNIJA Sumenep)
DIREKTORAT RISET DAN PENGABDIAN KEPADA MASYARAKAT
INSTITUT TEKNOLOGI SEPULUH NOPEMBER
SURABAYA
No
Tanggal
Kegiatan
1
20 Maret 2020
Catatan:
Pembuatan Medium Subkultur Jamur
Medium yang digunakan untuk subkultur Trametes versicolor adalah
medium padat PDA (Potato Dextrose Agar) dan medium cair PDB
(Potato Dextrose Broth). Medium PDA diambil sebanyak 39 gram
dan dilarutkan dalam 1 liter akuades dengan menggunakan magnetic
stirrer sampai homogen. Medium yang sudah homogen disterilisasi
dengan autoklaf pada suhu 121°C dan tekanan 1.5 atm selama 15
menit. Medium dituang pada Cawan Petri masing-masing sebanyak
6 ml (Woo-Shik et al., 2010). Subkultur jamur juga dilakukan
menggunakan medium cair, yaitu medium Potato Dextrose Broth
(PDB). Medium PDB diambil sebanyak 24 gram dan dilarutkan
dalam 1 liter aquades sampai homogen. Medium disterilisasi
menggunakan autoklaf dengan suhu 121°C tekanan 1 atm selama 15
menit (Agustini et al., 2011).
Pembuatan Medium Fermentasi
Media yang digunakan untuk produksi enzim adalah medium
fermentasi modifikasi dari metode Fukushima dan Kirk (1995);
Nyanhongo et al., (2002). Berikut komposisi medium produksi
laccase berdasarkan Fukushima dan Kirk (1995) dan Nyanhongo et
al., (2002) pada Tabel 3.1.
Tabel 3.1 Komposisi Medium Produksi laccase
Bahan
Variasi Jumlah Komposisi (gr)
Medium I
Medium II
Sekam padi
0,45
0,45
Ekstrak yeast
0,15
0,15
Glukosa
0,1
0,1
Ammonium
klorida
0,5
0,5
KH
2PO
40,2
0,2
MgSO
4.7H
2O
0,05
0,05
CaCl
22H
2O
0,01
0,01
KCL
0,05
0,05
CuSO
40,01
-
Keterangan :
Medium I : Medium fermentasi berdasarkan Fukushima dan Kirk
(1995).
Medium II : Medium fermentasi berdasarkan Nyanghongo et al.
(2002).
menggunakan autoklaf dengan suhu 121°C tekanan 1.5 atm selama
15 menit (Fukushima and Kirk, 1995; Nyanhongo et al., 2002).
Dokumen Pendukung:
2
21 Maret 2020
Catatan:
Peremajaan Isolat Trametes versicolor
Peremajaan isolat Trametes versicolor dilakukan dengan
menumbuhkan kembali isolat Trametes versicolor pada medium
PDA dan diinkubasi pada suhu ruang selama 12 hari. Kemudian
disimpan pada suhu 28°C (Nyanhongo et al., 2002; Pereira et al.,
2005). Setelah 12 hari Tremetes versicolor diinokulasikan pada
medium fermentasi 100 ml dan dilakukan inkubasi selama 3 hari, 4
hari, dan 5 hari pada suhu ruang menggunakan rotary shaker dengan
kecepatan 130 rpm (Qin et al., 2017).
Produksi dan Isolasi laccase
Produksi enzim dilakukan dengan menggunakan medium
fermentasi yang dimodifikasi dari metode Fukushima dan Kirk
(1995) dan Nyanhongo et al., (2002). Kultur jamur dari medium
PDA diambil sebanyak 1x1 cm dan diinokulasikan pada 100 ml
medium fermentasi. Inkubasi kultur jamur dilakukan pada suhu
ruang menggunakan rotary shaker dengan kecepatan 130 rpm. Isolasi
laccase dilakukan pada hari ke-3, hari ke-4, dan hari ke-5 (Fauzi dan
Nugroho Prasetyo, 2015). Setelah diinkubasi, kultur jamur disaring
dengan kertas Whatman no.1. Supernatan yang diperoleh digunakan
sebagai ekstrak kasar laccase untuk uji aktivitas laccase, kandungan
protein total, dan titik isoelektrik (Irshad et al., 2011; Vantamuri dan
Kaliwal, 2015; Cielrdzic et al., 2016).
Dokumen Pendukung:
Karakterisasi Laccase
Uji Aktivitas Laccase
Uji aktivitas laccase dilakukan dengan memasukkan 1 ml
larutan buffer sitrat 10mM pH 4,5, 10μl crude laccase dan 300μl
ABTS (2,2’-azino-bis(3-ethylbenzothiazoline-6sulfonate)) sebagai
substrat. Kemudian diukur menggunakan spektrofotometer dengan
panjang gelombang 436 nm (Nugroho Prasetyo et al., 2010).
Aktivitas laccase dihitung berdasarkan kurva standart ABTS yang
tertera pada Lampiran 2 (Irshad et al., 2011).
Dokumen Pendukung:
4
21 Juni 2020
Catatan:
Uji Titik Isoelektrik
Titik isoelektrik merupakan titik jumlah muatan positif dan
negatif protein dalam posisi sama, sehingga protein pada enzim tidak
bergerak apabila diletakkan pada medan listrik. Pada pH isoelektrik
(pI), protein memiliki daya kelarutan minimal, sehingga
menyebabkan protein mengendap (Burgess and Thomson, 2002). Uji
titik isoelektrik dilakukan dengan menyiapkan 6 tabung reaksi.
Laccase 1 ml dimasukkan ke dalam masing-masing tabung reaksi,
kemudian ditambahkan buffer fosfat dengan pH masing-masing 3, 4,
5, 6, 7, dan 8. Selanjutnya tabung reaksi dihomogenkan dengan
vortex dan dicatat kekeruhannya. Waktu yang diperlukan larutan
untuk mengendap dicatat. Pembentukan endapan kekeruhan tercepat
atau endapan terbanyak merupakan pH titik isoelektrik. Titik
isolelektrik tercapai bila jumlah dari muatan positif dan negatif
protein sama besar sehingga terjadi pengendapan pada pH tersebut
(Xia et al., 2018)
5
30 Juni 2020
Catatan:
Uji Kandungan Protein Total
Kandungan protein pada laccase ditentukan dengan
menggunakan metode Bradford (1976) dengan Bovine Serum
Albumin sebagai standar. Uji kandungan protein total dengan metode
Bradford adalah suatu uji untuk mengukur konsentrasi protein total
dalam suatu larutan. Dalam uji Bradford melibatkan pewarna
Coomassie Brilliant Blue (CBB) yang berikatan dengan protein
dalam suatu larutan yang bersifat asam sehingga memberikan warna
(kebiruan) yang dapat diukur absorbansinya dengan menggunakan
spektrofotometri pada panjang gelombang 595 nm (Bradford, 1976).
Uji kandungan protein dilakukan dengan membuat reagen Bradford
yaitu dengan melarutkan 10 mg Coomassie Brilliant Blue G-250
dalam 5 ml etanol 95%, kemudian ditambahkan 10 ml asam fosfor
85%. Setelah itu, ditambahkan dengan akuades sampai volume 100
ml. Uji protein dilakukan dengan memasukkan 0,1 ml crude laccase
dalam tabung reaksi, kemudian ditambahkan reagen Bradford
sebanyak 5 ml. Setelah itu, absorbansi diukur menggunakan
spektrofotometer dengan panjang gelombang 595 nm (Bradford,
1976). Larutan blanko yang digunakan yaitu 0,1 ml akuades sebagai
pengganti enzim. Hasil absorbansi kemudian dibandingkan dengan
kurva standar BSA (Bovine Serum Albumin) yang tertera pada
Lampiran 2. Larutan standar dibuat dengan melarutkan 10 mg BSA
pada 50 ml akuades, kemudian dibuat konsentrasi 0,1-1 mg/ml. Nilai
yang diperoleh dibuat grafik dengan persamaan Y=Ax+b, Y
merupakan nilai absorbansi dan x merupakan nilai konsentrasi
protein.
6
2 Juli 2020
Catatan:
Penentuan Kinetika Laccase (Km dan Vmax)
Parameter kinetik enzim (Km dan Vmax) ditentukan dengan mengukur aktivitas laccase menggunakan berbagai konsentrasi ABTS sebagai substrat. Variasi konsentrasi ABTS yang digunakan adalah 0,025, 0,150, 0,200, 0,250, 0,400, 0,500, 0,900, 0,100. Hubungan antara konsentrasi substrat dan kecepatan reaksi enzim digambarkan pada kurva persamaan Michaelis-Menten. Kurva Michaelis-Menten selanjutnya ditransformasikan menjadi persamaan linear Lineweaver-Burk untuk memperoleh nilai Km dan Vmaks (Ashger et al., 2012).
7
17 Agustus 2020
Fermentasi Biji KakaoFermentasi dilakukan dengan metode fermentasi tradisional/tumpukkan. Metode fermentasi tumpukkan dilakukan dengan cara menimbun/menumpuk biji kakao segar diatas daun pisang hingga membentuk kerucut. Permukaan atas biji ditutup karung goni yang memungkinkan udara masuk. Selanjutnya dilakukan pengadukan setelah 48 jam fermentasi dengan cara memindahkan ke tempat lain atau diaduk di tempat yang sama kemudian ditutup kembali dan dibiarkan hingga fermentasi selesai. Fermentasi dilakukan selama 5-7 hari (Puslit Kopi dan Kakao Indonesia, 2015).
8
22 Agustus 2020
Catatan:
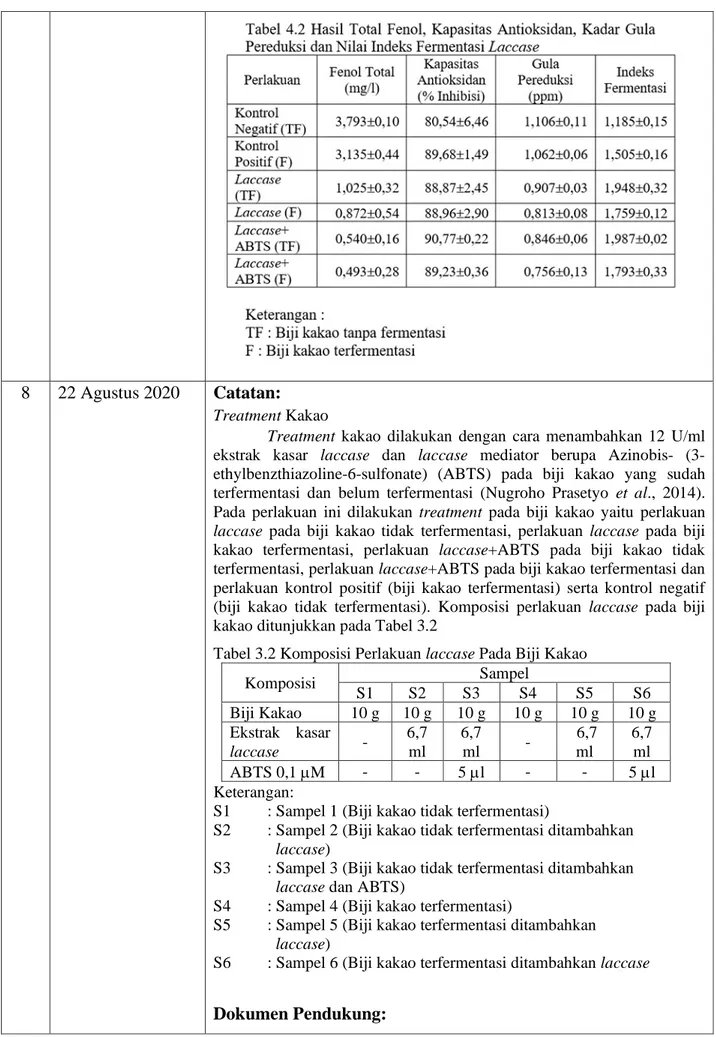
Treatment Kakao
Treatment kakao dilakukan dengan cara menambahkan 12 U/ml ekstrak kasar laccase dan laccase mediator berupa Azinobis- (3-ethylbenzthiazoline-6-sulfonate) (ABTS) pada biji kakao yang sudah terfermentasi dan belum terfermentasi (Nugroho Prasetyo et al., 2014). Pada perlakuan ini dilakukan treatment pada biji kakao yaitu perlakuan laccase pada biji kakao tidak terfermentasi, perlakuan laccase pada biji kakao terfermentasi, perlakuan laccase+ABTS pada biji kakao tidak terfermentasi, perlakuan laccase+ABTS pada biji kakao terfermentasi dan perlakuan kontrol positif (biji kakao terfermentasi) serta kontrol negatif (biji kakao tidak terfermentasi). Komposisi perlakuan laccase pada biji kakao ditunjukkan pada Tabel 3.2
Tabel 3.2 Komposisi Perlakuan laccase Pada Biji Kakao
Komposisi Sampel S1 S2 S3 S4 S5 S6 Biji Kakao 10 g 10 g 10 g 10 g 10 g 10 g Ekstrak kasar laccase - 6,7 ml 6,7 ml - 6,7 ml 6,7 ml ABTS 0,1 µM - - 5 µl - - 5 µl Keterangan:
S1 : Sampel 1 (Biji kakao tidak terfermentasi)
S2 : Sampel 2 (Biji kakao tidak terfermentasi ditambahkan laccase)
S3 : Sampel 3 (Biji kakao tidak terfermentasi ditambahkan laccase dan ABTS)
S4 : Sampel 4 (Biji kakao terfermentasi)
S5 : Sampel 5 (Biji kakao terfermentasi ditambahkan laccase)
S6 : Sampel 6 (Biji kakao terfermentasi ditambahkan laccase
9
23 Agustus 2020
Catatan:
Perendaman dan Pencucian Biji Kakao
Pencucian terhadap biji kakao dilakukan karena jumlah pulp pada kulit yang masih tebal, sehingga menurunkan kadar kulit biji kering. Sebelum dilakukan pencucian, dilakukan terlebih dahulu perendaman biji kakao dengan air selama 1-3 jam, kemudian dilakukan proses pencucian biji secara manual (Puslit Kopi dan Kakao Indonesia, 2015).
Pengeringan Biji Kakao
Pengeringan dilakukan untuk mengurangi kadar air biji kakao sekitar 50-55% menjadi 6-7%. Tahapan pengeringan adalah tahapan lanjutan dari proses fermentasi. Pengeringan dilakukan dengan menggunakan oven. Suhu yang digunakan diatur pada kisaran 50-60°C. Proses pengeringan dilakukan selama ± 40-50 jam (Puslit Kopi dan Kakao Indonesia, 2015).
10
25 Agustus2020
Catatan:
Sortasi dan Pengemasan
Sortasi dilakukan untuk memilah biji kakao agar sesuai dengan persyaratan Standar Nasional Indonesia (SNI) biji kakao dan menghindari biji cacat serta terdapat benda sing. Sortasi dilakukan dengan memilah kotoran-kotoran, pecahan biji, biji lengket, biji berjamur dan biji berkecambah. Setelah itu dilakukan pengelompokkan secara manual untuk mendapatkan ukuran biji yang seragam (Puslit Kopi dan Kakao Indonesia, 2015).
Penyangraian atau Roasting
Penyangraian atau roasting adalah salah satu tahapan dalam proses pengolahan kakao yang dibutuhkan untuk mengembangkan rasa, aroma dan warna biji kakao yang dihasilkan. Penyangraian dilakukan secara konvensional pada suhu 190-225°C dan waktu sangrai berkisar antara 10-30 menit. Selanjutnya biji kakao melewati proses pendinginan biji (tempering) selama 8-10 menit (Puslit Kopi dan Kakao Indonesia, 2015). Penghalusan Biji Kakao
Penghalusan merupakan metode yang dilakukan untuk mendapatkan sampel kakao bubuk. Penghalusan pada penelitian ini dilakukan dengan metode penumbukkan dan penggilingan menggunakan blender sehingga didapatkan struktur yang lebih halus (Puslit Kopi dan Kakao Indonesia, 2015).
Analisis Uji dan Mutu Biji Kakao Analisis Fenol Total
Analisis fenol total dalam penelitian ini berfungsi untuk mengetahui perubahan total fenol pada setiap perlakuan. Sampel disiapkan sesuai dengan teknik yang dijelaskan oleh Genovese dan Lannes (2009), dimana sampel sebanyak 10 gram diekstraksi menggunakan metanol murni
Selanjutnya pengukuran kadar fenol total dilakukan berdasarkan Kwak et al., (2016) dan dimodifikasi. Analisis fenol total dilakukan degan reagen Folin-Ciocalteu. Ekstrak kakao diambil sebanyak 1 ml lalu ditambahkan reagen Follin Ciocalteu sebanyak 1 ml dihomogenkan dan diinkubasi selama 10 menit. Setelah 10 menit, ditambahkan 1 ml 𝑁𝑁𝑁𝑁2𝐶𝐶𝐶𝐶3. Campuran tersebut disimpan pada suhu kamar selama 45 menit. Blanko disiapkan dengan mengganti reagen dengan akuades. Setelah inkubasi, nilai absorbansi sampel diukur dengan spektrofotometer pada panjang gelombang 750 nm. Total fenol dihitung berdasarkan kurva standar asam galat (Lampiran 6). Pembuatan kurva standar asam galat didahului dengan membuat larutan standar 1 mg/ml dengan cara menimbang 10 mg asam galat lalu dilarutkan dalam 10 ml methanol murni. Selanjutnya larutan standar dibuat berbagai macam konsentrasi yaitu 0,005; 0,01; 0,015; dan 0,02. Larutan diukur absorbansinya dengan spektrofotometer UV-Vis pada panjang gelombang 750 nm dengan menggunakan blanko methanol murni sebagai pengganti asam galat.
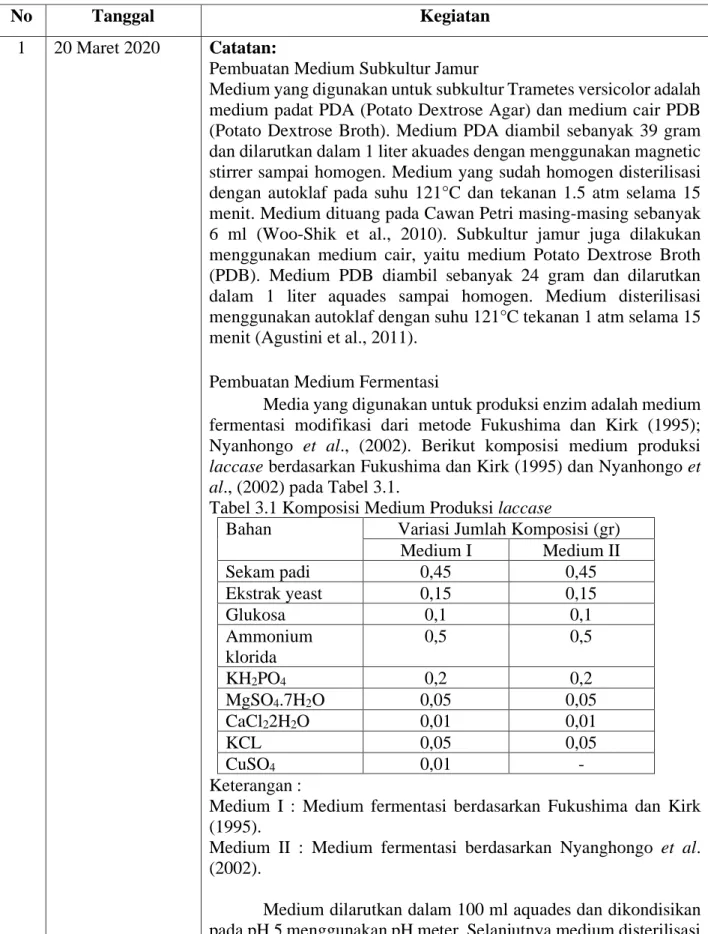
Analisis Antioksidan
Prinsip dari metode uji aktivitas antioksidan ini adalah pengukuran aktivitas antioksidan secara kuantitatif dengan melakukan pengukuran penangkapan radikal DPPH oleh senyawa yang memiliki antioksidan dengan menggunakan spektrofotometri UV-Vis, sehingga akan diketahui nilai aktivitas peredaman radikal bebas (Ridho et al.,2013). Pembuatan ekstrak ekstrak kakao untuk sampel pengujian antioksidan dilakukan berdasarkan teknik yang dijelaskan oleh Genovese dan Lannes (2009), dimana sampel sebanyak 10 g diekstraksi menggunakan metanol murni (100 mL), kemudian disaring menggunakan kertas saring Whatman No 1. Supernatan ekstrak kakao digunakan sebagai sampel untuk uji antioksidan. Selanjutnya penentuan aktivitas antioksidan dilakukan berdasarkan Shimamura et al. (2014) dan dimodifikasi. Ekstrak kakao diambil sebanyak 300μl lalu ditambahkan 900μl larutan DPPH (2,2-diphenyl-1-picrylhydrazyl) dan dihomogenkan menggunakan vortex. Selanjutnya larutan diinkubasi selama 30 menit pada tempat gelap. Absorbansi diukur menggunakan spektrofotometer UV-VIS pada panjang gelombang 517 nm. Sebanyak 300μl methanol murni ditambah 900μl DPPH digunakan sebagai blanko. Hasil absorbansi dianalisa persentase aktivitas antioksidannya menggunakan persamaan:
Absorbansi DPPH − Absorbansi Sampel
Absorbansi DPPH X 100%
(Shimamura et al., 2014) Analisis Gula Pereduksi dengan Metode DNS
Metode DNS adalah teknik kolorimetri yang terdiri dari reaksi redoks antara asam 3,5-dinitrosalisilat dan gula pereduksi yang ada dalam sampel untuk penentuan gula pereduksi (Miller, 1959). Analisis uji ini didasarkan pada pengurangan asam 3,5-dinitrosalisilat (warna kuning) menjadi senyawa asam 3-amino-5-nitrosalisilat berwarna merah kecoklatan, melalui oksidasi reduksi monosakarida dalam media alkali dan dikuantifikasi dengan spektrofotometri pada 540 nm menggunakan glukosa sebagai standar analitik (Da silva et al., 2014). Pembuatan reagen DNS dilakukan berdasarkan metode yang dikembangkan Miller (1959) dengan mencampurkan NaOH 1% sebanyak 100 ml dengan reagen DNS 1 gram, crystalin fenol 200 mg dan NaSO4 50mg. Kemudian dimasukkan kedalam Erlenmeyer yang telah dilakpisi dengan alumunium foil dan dihomogenkan
dilakukan terlebih dahulu ekstraksi sampel gula total pada biji kakao dengan menghomogenkan 2 gram bubuk kakao dengan 10 ml air mendidih selama 1-3 menit kemudian disaring menggunakan kertas saring. Supernatan ekstrak kakao digunakan sebagai sampel untuk uji kadar gula pereduksi. Pengujian kadar gula pereduksi dilakukan dengan menambahkan 3 ml sampel ekstrak kakao dengan 3 ml reagen DNS. Sampel dihomogenkan dan dipanaskan dalam air mendidih selama 5 menit hingga terjadi perubahan warna dan segera didinginkan pada suhu ruang. Kadar gula pereduksi pada sampel ekstrak kakao di ukur menggunakan spektrofotometer pada panjang gelombang 540 nm. Sebanyak 3ml methanol murni ditambah 3 ml reagen DNS digunakan sebagai blanko. Hasil absorbansi kemudian dibandingkan dengan kurva standar glukosa seperti pada Lampiran 10untuk mengetahui hasil kadar gula pereduksi. Analisis Menggunakan FTIR
Analisis Fourier Transform Infrared Spectroscopy (FTIR) bertujuan untuk mengidentifikasi perubahan gugus fungsi dan senyawa yang terkandung dalam suatu sampel dengan metode spektroskopi inframerah (Tamimi dan Herdyastuti, 2013). Analisis FTIR (Fourier Transform Infrared Spectrosopy) pada penelitian ini dilakukan di Laboratorium Karakterisasi Material, Departemen Teknik Material Metalurgi, Fakultas Teknologi Industri, Institut Teknologi Sepuluh Nopember (ITS) Surabaya. Pengukuran gugus fungsi diawali dengan persiapan sampel berupa sampel bubuk kakao. (Amir et al., 2013). Masing-masing sampel biji kakao diuji pada panjang gelombang 400–4000 cm-1.
Panjang gelombang tersebut merupakan kisaran panjang gelombang yang dibutuhkan untuk mengidentifikasi senyawa fenol pada sampel kakao (Hu et al., 2016).
Analisis Warna Keping Biji
Analisis warna keping biji bertujuan untuk mengetahui apakah biji telah mengalami fermentasi berdasarkan warna biji dengan mengukur indeks fermentasi (IF). Warna keping biji kakao pasca fermentasi adalah cokelat dan warna ungu (purple) menjadi hilang. Biji terfermentasi penuh yang berwarna coklat dapat diukur menggunakan nilai Indeks Fermentasi (IF) menggunakan perangkat analisis spektrofotometer untuk memastikan tingkat keberhasilan fermentasi. Analisis warna keping biji dilakukan dengan menimbang 0,5 gram sampel biji kakao yang telah dihaluskan. Kemudian sampel diekstrak menggunakan 50 ml larutan campuran metanol dengan HCl dengan rasio 97 : 3. Campuran sampel dengan larutan kemudian dibiarkan homogen di dalam refrigerator (8°C) selama 16–19 jam. Filtrat selanjutnya disaring menggunakan kertas Whatmann No 1. Absorpsi spektrum diamati menggunakan Spektrofotometer UV-vis. Indeks fermentasi dihitung berdasarkan rasio nilai absorbansi pada panjang gelombang 460 nm dan absorbansi 530 nm (Atmaja et al., 2016). Warna coklat pada biji kakao fermentasi sempurna akan terbaca serapan / absorbansi (OD) pada Panjang gelombang 460 nm sedangkan warna ungu terbaca pada Panjang gelombang 530 nm, sehingga indeks fermentasi dirumuskan sebagai perbandingan nilai OD pada 460 nm dengan nilai OD pada 530 nm (IF=A460/A530). Jika nilai IF ≥ 1 maka biji telah terfermentasi sempurna (Puslit Kopi dan Kakao Indonesia, 2015).