STUDI MORFOLOGI ORGAN REPRODUKSI KANCIL
(Tragulus javanicus) DENGAN TINJAUAN KHUSUS
PADA OVARIUM, PERKEMBANGAN FOLIKEL
DAN PEMATANGAN OOSIT IN VITRO
HAMNY
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2006
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Studi Morfologi Organ Reproduksi Kancil (Tragulus javanicus) dengan Tinjauan Khusus pada Ovarium,
Perkembangan Folikel dan Pematangan Oosit In Vitro adalah karya saya sendiri
dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juni 2006
Hamny NRP B151030021
ABSTRAK
HAMNY.Studi Morfologi Organ Reproduksi Kancil (Tragulus javanicus) dengan
Tinjauan Khusus pada Ovarium, Perkembangan Folikel dan Pematangan Oosit In
Vitro. Dibimbing oleh SRIHADI AGUNGPRIYONO dan ITA DJUWITA.
Kancil (Tragulus javanicus) merupakan salah satu kekayaan biodiversitas
yang dimiliki Indonesia. Hewan ini didistribusi di kawasan Asia Tenggara dan India. Kancil merupakan ruminansia terkecil yang memiliki potensi untuk dikaji lebih lanjut. Selain sebagai salah satu kekayaan biodiversitas yang dimiliki Indonesia, kancil juga potensial untuk dimanfaatkan sebagai alternatif sumber protein hewani dan sebagai model pada penelitian biomedis maupun ruminansia yang lebih besar karena penggunaannya dapat mengurangi biaya penelitian dan dosis bahan yang dipakai. Populasi kancil cenderung semakin menurun karena perusakan habitat dan perburuan sehingga upaya konservasi sangat penting untuk dilakukan. Salah satu usaha untuk mendukung upaya tersebut adalah dengan meningkatkan pemahaman tentang fisiologi reproduksi kancil betina. Penelitian ini bertujuan untuk mempelajari morfologi organ reproduksi kancil betina khususnya pada ovarium, perkembangan folikel dan pematangan oosit in vitro.
Penelitian dilakukan terhadap morfologi dan morfometri ovarium (n=6) dan salurannya yang terdiri dari tuba Fallopii, uterus, serviks, dan vagina (n=7). Ovarium dan salurannya difiksasi dalam larutan Bouin dan diproses secara standar
histologi. Preparat diwarnai dengan pewarnaan HE, AB, PAS, dan histokimia lektin. Sebanyak 18 oosit dengan morfologi normal dikultur dalam 100 µl drop MEM untuk proses pematangan in vitro.
Morfologi organ reproduksi kancil relatif sama dengan ruminansia lainnya seperti domba dan sapi. Ovarium memiliki panjang sebesar 7.53±0.90 mm (kanan) dan 5.57±1.17 mm (kiri), lebar sebesar 4.45±0.50 mm (kanan) dan 3.55±0.50 mm (kiri). Ovarium memiliki berat 0.0570±0.0149 g (kanan) dan 0.0364±0.0061 g (kiri). Pada ovarium fase luteal, perkembangan folikel diklasifikasikan menjadi 10 tahapan perkembangan folikel berdasarkan bentuk dan lapis sel granulosa, zona pelusida dan ada tidaknya antrum folikuli. Jumlah folikel yang berkembang pada ovarium kiri lebih banyak dibandingkan ovarium kanan. Di antara folikel yang berkembang, diketahui diameter folikel dan oosit paling besar masing-masing sebesar 841.92±177.53 µm dan 85.71±4.59 µm. Oosit, matriks ekstraseluler dan zona pelusida kancil mengandung karbohidrat dengan residu gula manosa, glukosa, β-galaktosa, asetilgalaktosamin, N-asetilglukosamin, dan asam sialat, sedangkan cairan folikuli mengandung
karbohidrat dengan residu gula β-galaktosa, asetilglukosamin, N-asetilgalaktosamin dan asam sialat. Pada kultur in vitro, terdapat 56% oosit yang
© Hak cipta milik Institut Pertanian Bogor, tahun 2006
Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari Institut Pertanian Bogor, sebagian atau seluruhnya dalam bentuk apa pun, baik cetak, fotokopi, mikrofilm, dan sebagainya
STUDI MORFOLOGI ORGAN REPRODUKSI KANCIL
(Tragulus javanicus) DENGAN TINJAUAN KHUSUS
PADA OVARIUM, PERKEMBANGAN FOLIKEL
DAN PEMATANGAN OOSIT IN VITRO
HAMNY
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Sains Veteriner
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2006
Judul Tesis : Studi Morfologi Organ Reproduksi Kancil
(Tragulus javanicus) dengan Tinjauan Khusus pada
Ovarium, Perkembangan Folikel dan Pematangan Oosit In Vitro
Nama : Hamny NRP : B151030021
Disetujui, Komisi Pembimbing
Dr. drh. Srihadi Agungpriyono Dr.drh. Ita Djuwita, MPhil Ketua Anggota
Diketahui,
Ketua Program Studi Dekan Sekolah Pascasarjana Sains Veteriner
Dr. drh. Bambang P.Priosoeryanto, M.S Dr. Ir. Khairil Anwar Notodiputro, MS
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat dan karuniaNya sehingga penulis dapat menyelesaikan penelitian dan penulisan tesis dengan judul ” Studi Morfologi Organ Reproduksi Kancil (Tragulus javanicus)
dengan Tinjauan Khusus pada Ovarium, Perkembangan Folikel dan Pematangan Oosit In Vitro”.
Penulis ingin mengucapkan terima kasih yang sebesar-besarnya kepada Bapak Dr. drh. Srihadi Agungpriyono, selaku ketua komisi pembimbing atas segala bimbingan, nasehat serta dorongan semangat yang begitu besar kepada penulis sehingga penulis dapat menyelesaikan penelitian dan tesis ini, Ibu Dr. drh. Ita Djuwita, MPhil selaku anggota komisi pembimbing yang begitu sabar memberikan nasehat, bimbingan, dan dengan senang hati bersedia menjadi tempat melepaskan semua masalah penulis dan banyak memberikan solusi atas permasalahan tersebut. Penulis juga ingin mengucapkan terima kasih kepada Ibu Dr. drh. Chairun Nisa’, MS, atas bantuan bimbingannya selama selama penelitian berlangsung, Bapak Dr. drh. M. Fahrudin atas bantuan dalam pencarian jurnal dan referensi. Tak lupa penulis mengucapkan terima kasih kepada Prof. Dr. drh. Koeswinarning Sigit, MS, Dr. drh. Nurhidayat, drh. Kusdiantoro M, M.Si, Dr. drh. Arief Boediono, drh. I Ketut Mudite Adnyane, M.Si, drh. Wahono Esthi Prasetyaningtyas M.Si, drh. Chandramaya SD, drh. Supratikno atas dorongan semangat dan bantuannya.
Ungkapan terima kasih yang sebesar-besarnya penulis hanturkan kepada Bapak, Ibu (Alm), Kak Netty (Alm), Kak Ivany (Alm), Wahyuni (Alm), Rahmat, Rahmi (Alm) dan Hidayat (Alm) atas dukungan moril maupun materiil serta kasih sayang yang sangat luar biasa diberikan kepada penulis. Meskipun Ibu, kedua kakak dan ketiga adik penulis sudah menghadap Allah SWT terlebih dahulu, tetapi kasih sayang mereka masih penulis rasakan.
Terima kasih pula penulis ucapkan buat kakak-kakakku : drh. Sri Wahyuni dan drh. Savitri Novelina, M.Si, Saida Rasnovi, M.Si dan Dr. Kartini Eriani, M.Si atas semangat, bantuan dan dorongan yang diberikan. Tak lupa rasa terima kasih buat teman-teman semua : Nur, Kak Ita, Eko Nur, Putut, Santi, Ika, Andi, Elih,
Dede, Bu Yusfi, Bu Laura, Pak Batan, Bu Eni, Pak Thomas, Pak Bayu, Mbak Maya, Anovia, dan Nadia yang telah banyak membantu dan memberikan semangat kepada penulis dalam menyelesaikan penelitian dan tesis ini.
Penulis mengharapkan tulisan ini dapat bermanfaat bagi pembaca pada umumnya dan penulis pada khususnya. Oleh karena itu, kritik dan saran sangat penulis harapkan demi kesempurnaan tesis ini. Akhir kata penulis juga mengharapkan agar tesis ini menjadi langkah awal penulis dalam pelaksanaan tugas penulis di masa mendatang.
Bogor, Juni 2006
RIWAYAT HIDUP
Penulis dilahirkan di Banda Aceh pada tanggal 24 Desember 1978 dari ayah Drs. Sofyan Muchtar, MM dan ibu Nursyidah Ibrahim (Alm). Penulis merupakan putri ketiga dari tujuh bersaudara.
Tahun 1997 penulis lulus dari SMUN 1 Banda Aceh dan masuk Fakultas Kedokteran Hewan, Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis lulus sebagai Sarjana Kedokteran Hewan (SKH) pada tahun 2001 dan mendapat gelar Dokter Hewan pada tahun 2003. Pada tahun yang sama, penulis diangkat menjadi staf pengajar di Laboratorium Anatomi Fakultas Kedokteran Hewan Universitas Syiah Kuala, Banda Aceh dan pada tahun tersebut pula penulis memulai studi Pascasarjana di Program Studi Sains Veteriner, Sekolah Pascasarjana IPB.
DAFTAR ISI
Halaman
DAFTAR TABEL... .xi
DAFTAR GAMBAR... xii
DAFTAR LAMPIRAN...xiii
PENDAHULUAN... .1
Latar Belakang ... 1
Tujuan Penelitian ... 3
Manfaat Penelitian ... 4
TINJAUAN PUSTAKA... 5
Gambaran Umum Kancil ... 5
Klasifikasi ... 5
Tingkah Laku ... 6
Habitat... 7
Penyebaran ... 7
Reproduksi Kancil Betina ... 8
Gambaran Umum Organ Reproduksi Ruminansia Betina... .9
Karakteristik Ovarium Ruminansia Berkaitan dengan Proses Perkembangan Folikel (Folikulogenesis) ... 11
Pematangan Oosit In Vitro... 15
BAHAN DAN METODE... 17
Tempat dan Waktu Penelitian ... 17
Sampel yang Digunakan ... 17
Metode Penelitian ... 17
Morfologi dan Morfometri Organ Reproduksi Kancil Betina ... 17
Karakteristik Histologi, Distribusi Karbohidrat dan Residu Gula pada Perkembangan Folikel Ovarium ... 18
Pembuatan Preparat Histologi... 18
Karakteristik Histologi Perkembangan Folikel... 18
Morfologi dan Pematangan Oosit In Vitro... 20
HASIL DAN PEMBAHASAN... 21
Morfologi dan Morfometri Organ Reproduksi Kancil Betina ... 21
Karakteristik Histologi, Distribusi Karbohidrat dan Residu Gula pada Perkembangan Folikel Ovarium ... 24
Karakteristik Histologi Perkembangan Folikel... 24
Distribusi Karbohidrat dan Residu Gula ... 37
Morfologi dan Pematangan Oosit In Vitro... 44
SIMPULAN DAN SARAN... 47
DAFTAR PUSTAKA... 48
DAFTAR TABEL
Halaman 1 Jenis, spesifisitas, dan dosis lektin yang digunakan... 19 2 Ukuran ovarium kancil, domba, rusa dan sapi... 22 3 Ukuran panjang saluran reproduksi betina pada kancil, domba,
rusa dan sapi... 23 4 Karakteristik berbagai tahapan perkembangan folikel pada ovarium fase luteal kancil (T. javanicus) ... 29
5 Ukuran diameter folikel dan oosit pada kancil, tikus, sapi dan babi... 36 6 Distribusi karbohidrat dan residu gula pada folikel ovarium kancil
DAFTAR GAMBAR
Halaman 1 Salah satu kancil (T. javanicus) yang dipelihara di Unit Rehabilitasi
Ruminansia (URR) FKH IPB, Bogor ... 6
2 Penyebaran kancil di Indonesia dan beberapa negara tetangga ... 8
3 Gambaran skematis organ reproduksi ruminansia betina ... 9
4 Gambaran melintang ovarium mamalia... 11
5 Organ reproduksi kancil betina setelah dikeluarkan dari rongga tubuh ... 21
6 Gambaran histologi ovarium kancil... 24
7 Folikel tipe 1 ... 25 8 Folikel tipe 2 ... 25 9 Folikel tipe 3 ... 26 10 Folikel tipe 4 ... 26 11 Folikel tipe 5 ... 26 12 Folikel tipe 6 ... 27 13 Folikel tipe 7 ... 27 14 Folikel tipe 8 ... 27 15 Folikel tipe 9 ... 28 16 Folikel tipe 10 ... 28
17 Persentase jumlah folikel yang berkembang pada ovarium kancil fase luteal... 33
18 Diameter folikel dan oosit yang berkembang pada ovarium kancil fase luteal... 34
19 Distribusi karbohirat asam pada struktur folikel ovarium kancil... 39
20 Distribusi karbohirat netral pada struktur folikel ovarium kancil... 40
21 Pola distribusi lektin PHA, LCA, WGA dan RCA pada folikel ovarium kancil... 43
22 Oosit hasil pematangan in vitro... 44
DAFTAR LAMPIRAN
Halaman
1 Prosedur pewarnaan hematoksilin-eosin (HE)...55
2 Prosedur pewarnaan alcian blue (AB) pH 2.5 ...56
3 Prosedur pewarnaan periodic acid schiff (PAS) ...57
PENDAHULUAN
Latar Belakang
Indonesia dengan 17.508 pulau besar dan kecil merupakan negara kepulauan terbesar di dunia. Meskipun luas wilayahnya hanya 1.3% dari luas bumi, namun Indonesia memiliki keanekaragaman hayati yang cukup tinggi, bahkan nomor tiga tertinggi di dunia setelah Brazil dan Zaire, sehingga Indonesia disebut sebagai salah satu negara megabiodiversity. Hal ini ditunjukkan dengan
dimilikinya koleksi 10% dari jenis tumbuhan berbunga dunia (20.000 spesies), 12% dari jenis mamalia dunia (800 spesies), 17% dari jenis burung dunia (1.300 spesies), 16% dari reptil dan ampibi dunia (3.000 spesies) serta 25% atau lebih dari jenis ikan dunia (2.500 spesies). Selain itu, Indonesia memiliki tingkat endemisme (keaslian) spesies yang tinggi yang tersebar pada beragam tipe ekosistem. Mamalia diperkirakan ada 36% endemik, serangga 44% endemik dan burung sekitar 28% endemik (Anonim 2003; Muntasib& Masy’ud 2003). Salah satu dari keanekaragaman hayati tersebut adalah kancil.
Kancil (Tragulus sp) atau yang biasa disebut pelanduk dalam Bahasa
Melayu merupakan salah satu keanekaragaman hayati yang dimiliki oleh Indonesia. Di Indonesia terdapat dua spesies kancil yaitu Tragulus javanicus dan Tragulus napu. Pada saat ini, populasi kancil diduga semakin menurun. Beberapa
faktor yang diduga sebagai penyebab menurunnya populasi kancil adalah maraknya penebangan hutan, perburuan liar, dan pembakaran hutan untuk pembukaan lahan perkebunan. Oleh karena itu, upaya konservasi kancil sangat penting dilakukan. Hal ini didukung oleh keputusan Direktorat Jenderal Perlindungan Hutan dan Konservasi Alam (Dirjen PHKA) yang menetapkan kancil sebagai salah satu hewan langka yang dilindungi di Indonesia (Alikodra 1993; BKSDA 2000).
Usaha penyelamatan dan pelestarian kancil dapat dilakukan pada kawasan
in situ (habitat aslinya) seperti Taman Nasional, Cagar Alam, dan Suaka
Margasatwa maupun kawasan ex situ (di luar habitat aslinya) seperti Kebun
Binatang, Kebun Raya, Taman Safari dan lain-lain. Sejauh ini, upaya pemeliharaan kancil di kawasan ex situ tidaklah mudah karena hewan ini memiliki
tingkat stres yang tinggi terhadap lingkungan yang berbeda dengan habitat aslinya. Nurhidayat et al. (1993) melaporkan bahwa usaha pemeliharaan kancil di
beberapa kebun binatang seperti Kebun Binatang Ragunan Jakarta, Bandung, dan Surabaya belum menunjukkan hasil yang menggembirakan. Oleh sebab itu, diperlukan suatu manajemen penangkaran kancil yang tepat untuk menyediakan kondisi lingkungan yang optimal untuk mengurangi stres pada kancil sehingga berdampak pada kemampuan reproduksi yang lebih baik pada kawasan ex situ.
Selain itu, faktor yang tidak kalah pentingnya untuk meningkatkan populasi kancil adalah status reproduksi yang dipengaruhi oleh tingkat keberhasilan proses fertilisasi yang ditentukan dari kualitas kedua sel gamet (oosit dan spermatozoa). Hal ini sangat penting terutama pada proses produksi dengan memanfaatkan kemajuan teknologi reproduksi seperti fertilisasi dan produksi embrio in vitro. Muntasib dan Masy’ud (2003) menyatakan bahwa proses
penyelamatan dan perlindungan suatu keanekaragaman hayati (saving) baik
hewan maupun tumbuhan harus didukung oleh kajian-kajian (studying) tentang
kondisi fisiologi dari keanekaragaman hayati itu sendiri. Oleh karena itu, penelitian ini diharapkan bisa memberikan informasi tentang kondisi fisiologis organ reproduksi kancil betina terutama berkaitan dengan proses folikulogenesis untuk menghasilkan sel gamet (oosit atau sel telur).
Kancil merupakan ruminansia terkecil yang memiliki potensi untuk dikaji lebih lanjut. Selain sebagai salah satu kekayaan biodiversitas yang dimiliki Indonesia, kancil juga dapat dimanfaatkan sebagai alternatif sumber protein hewani dan sebagai model pada penelitian biomedis maupun ruminansia yang lebih besar karena penggunaannya dapat mengurangi biaya penelitian dan dosis bahan yang dipakai. Beberapa hasil penelitian yang telah dilakukan pada hewan kancil diantaranya telah dilaporkan Snyder dan Weathers (1977), Whittow et al.
(1977), Vidyadaran et al. (1979), Terai et al. (1998), Jumaliah (1999), Abdullah et al. (1999), Haron et al. (1999), Matsubayashi et al. (2003), Farida et al. (2002,
2003, 2004), Agungpriyono et al. (1992, 1994, 1995a, 1995b, 1997, 2001, 2002,
2005, 2006), Kimura et al. (2004), dan Prasetyaningtyas (2005). Namun
demikian, penelitian yang ada masih terbatas pada informasi tentang perilaku kancil, kesukaan terhadap makanan, fungsi respirasi, saluran pencernaan,
hematologi, regulasi suhu tubuh, morfologi cranium dan mandibula, organ reproduksi kancil jantan dan karakteristik semen kancil. Penelitian mengenai biologi reproduksi kancil betina belum banyak dilaporkan. Kimura et al. (2004)
telah melakukan penelitian pada gambaran anatomi dan struktur histologi organ reproduksi kancil betina terutama ovarium, tuba Fallopii, uterus dan plasenta. Dari hasil penelitian tersebut diketahui bahwa ovarium kancil memiliki struktur yang relatif sama dengan ruminansia lainnya seperti domba dan sapi. Ovarium terdiri dari epitel germinativum, tunika albuginea, bagian korteks dan medula. Tuba Fallopii terdiri dari ampula, isthmus, dan fimbriae. Uterus terdiri dari dua kornua uteri dan satu korpus uteri. Pada permukaan dalam uterus tidak ditemukan karunkula sehingga kancil memiliki tipe plasenta difusa seperti pada babi dan kuda (Senger 1999). Namun pada penelitian tersebut belum dilaporkan secara mendalam tentang morfologi perkembangan folikel dan oosit (folikulogenesis dan oogenesis). Sejauh ini juga belum ada laporan tentang proses pematangan oosit kancil secara in vitro. Oleh sebab itu, pada penelitian ini dilakukan beberapa
kajian untuk meningkatkan pemahaman tentang biologi reproduksi kancil (T. javanicus) betina melalui studi morfologi organ reproduksi kancil betina
terutama ovarium yang berkaitan dengan tahapan perkembangan folikel dan proses pematangan oosit in vitro. Hasil penelitian diharapkan dapat melengkapi
data-data yang telah ada yang nantinya dapat digunakan sebagai landasan pemikiran bagi pemeliharaan dan peningkatan populasi kancil baik secara alami (kawin alam) maupun dengan bantuan manusia (melalui penerapan teknologi reproduksi seperti fertilisasi in vitro maupun embrio in vitro).
Tujuan Penelitian
1. Mempelajari morfologi dan morfometri organ reproduksi kancil betina dengan tinjauan khusus pada ovarium.
2. Mempelajari karakteristik histologi, distribusi karbohidrat dan residu gula pada perkembangan folikel ovarium (folikulogenesis).
3. Mempelajari morfologi dan pematangan oosit pada kancil betina secara in vitro.
Manfaat Penelitian
1. Sebagai data untuk mendapatkan pemahaman yang lebih baik tentang fisiologi reproduksi kancil betina.
2. Sebagai landasan awal dalam penerapan teknologi reproduksi pada kancil betina.
TINJAUAN PUSTAKA
Gambaran Umum Kancil Klasifikasi
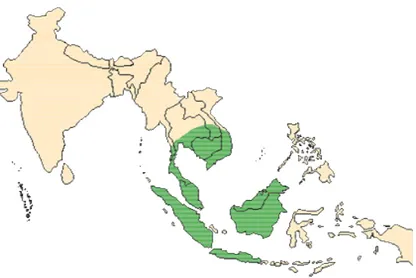
Kancil termasuk ke dalam ordo Artiodactyla, famili Tragulidae dan genus Tragulus. Famili Tragulidae terdiri dari dua genus yaitu genus Tragulus yang terdiri dari tiga spesies yaitu Tragulus javanicus, Tragulus napu, dan Tragulus meminna dan genus Hyemoschus yang terdiri dari satu spesies yaitu Hyemoschus aquaticus. Genus Tragulus menghuni hutan-hutan tropis dan hutan sekunder di
Asia Tenggara dan India sedangkan genus Hyemoschus terdapat di Afrika Tengah dan Afrika Barat. Di Indonesia hanya ditemukan dua spesies kancil yaitu T. javanicus dan T. napu. Spesies T. javanicus merupakan ungulata terkecil dengan
panjang tubuh sekitar 45-55 cm, tinggi bahu 20-25 cm, panjang ekor 5 cm dan berat tubuh 1.5-2.5 kg (Lekagul & McNeely 1977; Payne et al. 1985; Farida et al.
2004). T. napu memiliki ukuran tubuh yang lebih besar dibandingkan dengan T. javanicus dengan tinggi bahu 30-35 cm dan berat badan 4-6 kg (Francis 2001).
Tubuh kancil tampak pendek dengan kepala yang kecil, moncongnya panjang dan lancip, serta kaki yang kurus. Hewan ini memiliki hidung berwarna hitam, mata yang besar dan lidah yang panjang jika dijulurkan (Hoogerwerf 1970 diacu dalam
Farida et al. 2004). Kancil mempunyai bulu dengan warna dasar coklat dengan spot atau belang berwarna putih dan ada juga yang memiliki bulu warna coklat
kemerahan dengan garis-garis halus berwarna hitam (DEPDIKNAS 1992; Farida
et al. 2004). Secara umum, kancil betina memiliki ukuran tubuh yang lebih kecil
dibandingkan dengan kancil jantan. Kancil tidak memiliki tanduk dan sebagai gantinya kancil jantan memiliki sepasang gigi taring (canini) yang menonjol
keluar dari rahang atasnya yang dipergunakan sebagai senjata pada saat berkelahi dengan lawannya. Pada kancil betina, gigi taring tidak tumbuh memanjang. Kancil memiliki gigi sebanyak 34 gigi dengan formula 0/3, 1/1, 3/3, 3/3. Seperti halnya dengan hewan berkuku genap lainnya, kancil memiliki dua buah kuku besar di tengah dan berat badannya dipikul oleh bagian ini. Bagian samping dari dua kukunya terbentuk cukup baik dan benar-benar menyentuh tanah ketika berjalan. Ini merupakan suatu kondisi primitif dan menunjukkan suatu tahap
permulaan dari evolusi hewan berkuku genap seperti pada rusa yang bagian samping dari kukunya tidak lagi dipergunakan (Lekagul & McNeely 1977; Nowak et al. 1983 diacudalam Strawder 2000; Myers 2001).
Meskipun termasuk hewan ruminansia, pada lambung kancil tidak ditemukan omasum, serta bagian internal mukosa memperlihatkan struktur yang berbeda dengan distribusi papila yang subur (Agungpriyono et al. 1992).
Gambar 1 Kancil (T. javanicus) yang dipelihara di Unit Rehabilitasi Ruminansia
(URR) FKH IPB, Bogor
Tingkah Laku
Pada umumnya kancil memiliki sifat pemalu, hidup soliter, sering terlihat sendiri kecuali pada musim kawin dan cenderung bersembunyi agar tidak terlihat. Terkadang hewan ini mengeluarkan lengkingan bila merasa ketakutan (Lekagul & McNeely 1977; Strawder 2000). Kancil jantan menandai daerah kekuasaan dan pasangannya melalui cairan yang dikeluarkan oleh kelenjar bau (glandula intermandibularis) yang terletak di daerah dagunya (Ralls et al. 1975;
Agungpriyono et al. 2006). Biasanya aktivitas ini bersamaan dengan aktivitas
urinasi dan defekasi kancil tersebut. Kancil jantan menggunakan gigi taringnya untuk berkelahi dan membela diri serta melindungi dirinya dari ancaman predator (Nowak et al. 1983 diacu dalam Strawder 2000). Kancil juga memiliki
terkecoh oleh kancil sebab hewan ini dapat bertingkah seolah-olah mati tetapi setelah dilepas dari jeratannya, segera bangun dan melarikan diri dengan cepat.
Habitat
Kancil memiliki habitat di hutan tropis dan hutan sekunder yang cukup lebat, dengan kontur tanah yang kering, baik di dataran rendah maupun di kaki-kaki bukit. Hewan ini menyukai tempat-tempat kering seperti celah bebatuan dan pepohonan yang tidak jauh dari sungai dengan vegetasi yang rapat (DEPHUT 1993; Suyanto 2002; Farida et al. 2002, 2003). Kancil aktif pada malam hari atau
nokturnal dan siang hari atau diurnal (Matsubayashi et al. 2003). Kancil selektif
terhadap pemilihan pakan atau makanannya. Hewan ini memakan jenis makanan tertentu seperti daun muda dari semak belukar, kecambah, sayuran dan buah-buahan (Kudo et al. 1995 diacu dalam Abdullah et al. 1999; Myers 2001). Kancil
juga dilaporkan sebagai pemencar biji karena kebiasaannya suka memakan buah-buahan yang jatuh atau yang tumbuh didekat permukaan tanah dan pada saat memamah biak, biji yang termakan akan dimuntahkan kembali (Suyanto 2002).
Penyebaran
Penyebaran kancil di Indonesia cukup luas yaitu di hutan tropis dan sekunder di sepanjang Pulau Sumatera, Jawa, dan Kalimantan. Selain itu juga tersebar di beberapa negara seperti Malaysia, Thailand, Indocina (Vietnam, Laos dan Kamboja) sampai Cina (Suyanto 2002). Pada saat ini, kancil memiliki status dilindungi oleh pemerintah Indonesia berdasarkan Peraturan Perlindungan Binatang Liar 1931 No. 266 dan UU No. 5 Tahun 1990 yang dipertegas dengan Surat Keputusan Menteri Kehutanan tanggal 10 Juni 1991 No. 301/Kpts-II/1991 dan SK MenHut tanggal 6 September 1992 No. 882/Kpts-II/92 (DEPHUT 1993).
Gambar 2 Penyebaran kancil di Indonesia dan beberapa negara tetangga ( ) (Robin 1990 diacu dalam Huffman 2004)
Reproduksi Kancil Betina
Fisiologi dari sistem reproduksi pada kancil betina belum banyak dilaporkan baik pada aspek perilaku reproduksi maupun organ reproduksinya. Beberapa hal yang telah dilaporkan diantaranya adalah kancil umumnya mampu memperoleh keturunannya satu kali dalam setahun dan kadang-kadang bisa dua kali dalam setahun. Hewan ini mengalami pubertas pada umur 4-5 bulan, memiliki siklus estrus 16 hari, dan periode estrus selama 35-48 jam (Kudo et al.
1997), lama kebuntingan hewan ini sekitar 140-177 hari (Lekagul & McNeely 1977), dan biasanya hanya melahirkan satu ekor anak dengan berat lahir sekitar 375 gram. Anak yang baru lahir cenderung disembunyikan oleh induknya. Anak yang baru dilahirkan segera disusui oleh induk betina yang memiliki dua pasang kelenjar mamae dan mulai disapih setelah berumur 10-13 minggu. Kancil dapat hidup selama 12 tahun (Strawder 2000). Oleh karena informasi reproduksi kancil masih sangat sedikit maka dalam penelitian ini digunakan informasi reproduksi hewan ruminansia lainnya seperti domba dan sapi sebagai acuan dan bahan komparasi untuk mempelajari morfologi dan fisiologi reproduksi kancil.
Penelitian terhadap reproduksi kancil jantan relatif lebih banyak dilaporkan dibandingkan kancil betina. Prasetyaningtyas (2005) melaporkan bahwa spermatozoa kancil merupakan spermatozoa terkecil dibandingkan dengan
spermatozoa ruminansia lainnya dengan ukuran panjang 36.52±5.6 µm. Kancil jantan menghasilkan ejakulat dengan volume relatif sedikit yaitu sekitar 19.44±6.8 µl dengan konsentrasi spermatozoa 47.44±4.9x106 sel/ml dan motilitas spermatozoa 36.43±1.1%. Semen memiliki warna krem, putih, kuning dengan konsentrasi kental.
Gambaran Umum Organ Reproduksi Ruminansia Betina
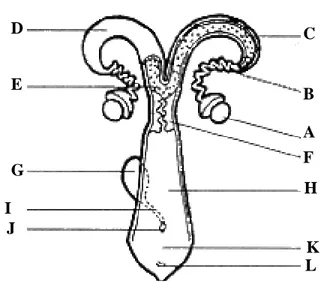
Hewan ruminansia betina memiliki organ reproduksi yang terdiri dari sepasang ovarium, tuba Fallopii, uterus, serviks, vagina, dan vulva. Ovarium merupakan organ reproduksi primer yang memiliki ukuran yang bervariasi tergantung kepada spesies, umur dan status reproduksinya. Ovarium memiliki dua fungsi yaitu sebagai kelenjar eksokrin maupun endokrin, masing-masing karena kemampuannya menghasilkan oosit dan hormon-hormon estrogen serta progesteron (Hafez & Hafez 2000).
Gambar 3 Gambaran skematis organ reproduksi ruminansia betina. A. Ovarium, B. Tuba Fallopii, C. Karunkula, D. Kornua uteri, E. Korpus uteri, F. Serviks, G. Vesika urinaria, H. Vagina, I. Uretra, J. Divertikulum suburetrale, K. Vulva, L. Klitoris.
Ovarium terletak retroperitoneal di dalam rongga pelvis, menggantung dan bertaut melalui mesovarium ke uterus. Bentuk ovarium juga sangat bervariasi sesuai dengan spesies dan jumlah anak yang mampu dilahirkan. Pada kelompok
A E D C B F I H G J K L
hewan yang melahirkan anak lebih dari satu (multipara), ovarium biasanya berbentuk seperti buah beri sedangkan pada kelompok hewan melahirkan tunggal (unipara), bentuk ovarium mendekati bulat telur (ovoid). Ukuran ovarium juga bervariasi antar spesies. Pada sapi, ovarium berukuran antara 0.8-5 cm, sedangkan pada domba dan kambing, ovarium berukuran kurang lebih 1.2 cm (Sukra et al.
1989).
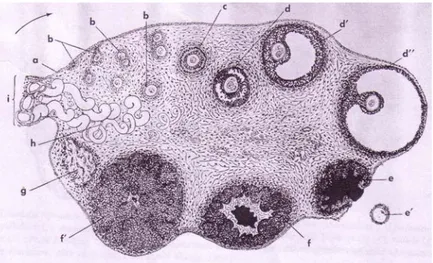
Struktur histologi ovarium tergantung pada spesies, umur dan fase siklus estrus dari hewan tersebut. Gambaran histologis sayatan melintang ovarium mamalia disajikan pada Gambar 4. Ovarium terdiri dari dua bagian yaitu korteks (bagian lateral) dan medula (bagian medial). Pada bagian korteks banyak ditemukan folikel-folikel pada berbagai tahap perkembangan dan juga korpus luteum, sedangkan pada bagian medula terdapat pembuluh darah dan syaraf yang masuk (ke bagian medula ovarium) melalui hillus yaitu pertautan antara ovarium
dan mesovarium (Toelihere 1979). Bagian korteks dilapisi oleh satu lapisan epitelium kuboid rendah. Stroma pada bagian korteks terdiri atas jaringan ikat longgar. Tunika albuginea terdiri atas jaringan ikat yang terdapat pada bagian profundal lapisan epitel germinativum.
Tuba Fallopii merupakan saluran kecil perluasan dari uterus yang berperan dalam transpor gamet jantan dan betina, serta sebagai tempat terjadinya proses fertilisasi, kapasitasi sperma dan terjadinya proses pembelahan zigot. Uterus memegang peranan penting dalam sistem reproduksi sebagai tempat implantasi dan perkembangan embrio dan fetus, sedangkan kontraksi uterus penting untuk transpor spermatozoa. Bentuk uterus pada beberapa spesies hewan berbeda-beda. Pada ruminansia, uterus memiliki dua tanduk uterus yang besar, badan uterus dan serviks yang disebut uterus bikornua (Sukra et al. 1989). Uterus terdiri atas tiga
lapisan yaitu endometrium, miometrium dan perimetrium. Mukosa endometrium akan mengalami penebalan pada saat berahi.
Gambar 4 Gambaran histologis sayatan melintang ovarium mamalia memperlihatkan beberapa struktur ovarium. (a) Epitel germinativum, (b) folikel primer, (c) folikel sekunder, (d’) folikel tertier, (d”) folikel de Graff, (e) korpus hemarogikum, (f’) korpus luteum, (g) korpus albikan, (h) pembuluh darah, (i) mesovarium. (Sumber: Dellmann & Brown : Textbook of Veterinary Histology, 1976).
Serviks terdiri atas bagian mukosa dan lapisan otot. Mukosa serviks menghasilkan lendir yang pada saat berahi menjadi lebih cair sedangkan pada saat hewan bunting membentuk sumbatan. Vagina berfungsi sebagai tempat penumpahan semen, jalur keluar fetus dan plasenta pada kelahiran. Vulva terdiri dari labia dan vestibula. Sedangkan klitoris merupakan bagian dari vestibula yang homolog dengan penis pada hewan jantan (Banks 1993).
Karakteristik Ovarium Ruminansia Berkaitan dengan Proses Perkembangan Folikel (Folikulogenesis)
Proses perkembangan folikel di dalam ovarium dikenal dengan nama folikulogenesis. Folikulogenesis merupakan proses perkembangan folikel yang berawal dari terbentuknya folikel primordial sampai berkembang menjadi folikel matang dan siap melakukan proses ovulasi. Folikel primordial akan berkembang menjadi folikel primer, sekunder, tertier dan folikel de Graaf yang pada akhirnya oosit akan diovulasikan. Proses folikulogenesis ini disertai dengan proses pertumbuhan dan pematangan oosit yang merupakan bagian dari proses oogonesis
yaitu proses yang menghasilkan oosit yang haploid. Berikut karakteristik dari masing-masing tahapan perkembangan folikel :
1) Folikel primordial merupakan folikel yang pertama kali ditemukan pada hewan setelah lahir dengan jumlah tertentu pada setiap spesies (Hafez & Hafez 2000). Folikel ini ditandai dengan oosit yang dikelilingi oleh satu lapis sel pregranulosa yang berbentuk pipih (Hartono 1992; Cushman et al. 2000). Folikel
ini berkembang di bagian korteks ovarium (Hartono 1992).
2) Folikel primer ditandai dengan adanya perubahan bentuk dari satu lapis sel pregranulosa yang berbentuk pipih menjadi sel granulosa yang berbentuk kuboid (Bearden et al. 1997; Cushman et al. 2000; Hafez & Hafez 2000; Guerin
2003). Perkembangan folikel primordial menjadi folikel primer terjadi pada saat hewan mencapai pubertas (Hafez & Hafez 2000).
3) Folikel sekunder ditandai dengan terbentuknya dua atau lebih lapisan sel-sel granulosa dan telah terbentuk sebuah membran (zona pelusida) yang mengelilingi oosit (Nalbandov 1990; Bearden et al. 1997; Cushman et al. 2000).
Oosit dan sel granulosa berperan dalam proses pembentukan zona pelusida yang mengandung glikoprotein yang berperan pada proses pelekatan spermatozoa pada oosit (Junqueira et al. 1995). Folikel sekunder juga dikelilingi oleh lapisan sel
yang tidak beraturan yang berasal dari diferensiasi sel-sel epiteloid dari fibroblast. Sel-sel epiteloid ini akan membentuk sel teka interna dari folikel. Folikel sekunder dengan sel teka interna disebut folikel preantral (Guerin 2003). Pada akhir tahap perkembangan folikel sekunder mulai terbentuk antrum folikuli yang berisi cairan folikel yang mengandung transudat dari plasma dan produk yang disekresi oleh sel granulosa dan hormon steroid seperti estrogen, progresteron, dan androgen (Junqueira et al. 1995).
4) Folikel tertier (folikel antral) ditandai dengan terbentuknya lebih dari lima lapis sel granulosa yang mengelilingi oosit, antrum folikuli semakin meluas, sel teka eksterna menyusun diri mengitari folikel, dan sel yang mengitari zona pelusida mulai membentuk korona radiata (Hartono 1992; Junqueira et al. 1995;
Cushman 2000). Diameter folikel semakin meningkat akibat adanya proliferasi sel granulosa dan sel teka, serta pembentukan antrum folikuli yang semakin membesar karena produksi cairan folikuli yang semakin meningkat pula sehingga
oosit terdesak ke bagian tepi folikel. Dinding folikel semakin menipis dan akan menjadi stigma yang nantinya akan robek pada saat ovulasi. Pada kondisi inilah, folikel yang terbentuk disebut dengan folikel de Graaf (Hartono 1992; Hafez & Hafez 2000).
Setelah ovulasi, jaringan folikel de Graaf membentuk massa padat yang disebut korpus luteum. Jika oosit mengalami pembuahan dan embrio yang terbentuk berhasil mengadakan implantasi pada endometrium uterus, maka jaringan folikel de Graaf akan membentuk korpus luteum graviditatum yang juga mensekresikan tambahan estrogen dan progesteron, namun bila proses pembuahan tidak terjadi, maka terbentuklah korpus luteum periodikum yang sel-sel luteinnya tidak meneruskan perkembangannya dan mengalami degenerasi. Baik korpus luteum graviditatum maupun periodikum akan mengalami degenerasi dan membentuk korpus luteum albikan yang beraspek putih (Hartono 1992; Hafez & Hafez 2000; Campbell et al. 2004).
Glikoprotein merupakan karbohidrat yang berikatan secara kovalen pada protein, misalnya mukopolisakarida. Komponen karbohidrat berupa residu gula pada glikoprotein dapat berupa glukosa, galaktosa, manosa, N-asetilglukosamin, N-asetilgalaktosamin, fukosa dan asam sialat (Kiernan 1990). Ovarium merupakan salah satu organ hewan betina yang mengalami perkembangan dan perubahan morfologi yang dinamis seperti adanya perkembangan folikel, ovulasi dan luteinisasi. Semua proses tersebut merupakan hasil dari proses pembelahan sel, kematian sel, migrasi sel dan perlekatan (adesi) dari sel-sel ovarium (Kimura
et al. 1999). Selama proses tersebut berlangsung, terjadi perubahan glikoprotein
pada setiap tahapan perkembangan folikel. Namun informasi mengenai jenis glikoprotein yang berperan pada perkembangan folikel ruminansia masih sangat sedikit. Menurut Tadano dan Yamada (1978), zona pelusida, cairan folikel dan matriks ekstraselular dari lapisan granulosa mengandung kompleks karbohidrat 1.2 glycol dan grup acidic serta residu manosil dan glukosil.
Zona pelusida merupakan salah satu struktur pada folikel ovarium yang banyak diteliti karena kaitannya dengan proses fertilisasi. Zona pelusida merupakan lapisan ekstraselular yang dapat ditemukan pada oosit yang sedang tumbuh dan yang telah mengalami ovulasi. Zona pelusida berperan penting dalam
interaksi antara spermatozoa dengan oosit selama proses fertilisasi dan tahap awal perkembangan zigot (Parillo et al. 2001; Mulyati et al. 2003). Zona pelusida ini
terlibat dalam perlekatan sperma dengan oosit yang akan menimbulkan reaksi akrosom, blokade post-fertilisasi terhadap polyspermy dan melindungi embrio
selama embrio di dalam tuba Fallopii atau sebelum implantasi (Parillo et al.
2001). Berdasarkan hasil penelitian Parillo et al. (2001) diketahui bahwa secara
umum distribusi karbohidrat (glikoprotein) pada zona pelusida yang berperan pada proses binding oosit dengan spermatozoa adalah sama antar spesies hewan.
Namun urutan karbohidrat (rantai oligosakarida) dan konsentrasi karbohidrat pada permukaan zona pelusida pada setiap spesies hewan berbeda. Hal ini berkaitan dengan spesifisitas masing-masing spesies terhadap ikatan sperma dengan oosit dan juga salah satu proteksi setiap hewan terhadap terjadinya fertilisasi interspesies.
Untuk mempelajari distribusi karbohidrat dan residu gula tersebut maka pada penelitian ini digunakan metode pewarnaan alcian blue (AB) dan periodic acid Schiff (PAS) serta histokimia lektin. Metode pewarnaan AB akan mendeteksi
karbohidrat asam (gugus karboksil dan sulfat ester). Reaksi positif AB akan diperlihatkan dengan warna biru yang ditimbulkan akibat ikatan yang terjadi antara zat warna AB dengan gugus karboksil atau dengan grup sulfat ester yang terdapat pada jaringan. Pewarnaan PAS akan mendeteksi karbohidrat netral (glukosa, galaktosa, manosa, fukosa, dan residu monosakarida yang tidak memiliki gugus sulfat ester dan asam karboksilat). Reaksi positif PAS akan diperlihatkan dengan warna merah muda-ungu atau magenta. Pada pewarnaan PAS ini terjadi dua reaksi yaitu : 1) terjadi oksidasi dari α-amino alkohol (pada glukosamin dan galaktosamin) atau 1.2 grup glikol (pada gula netral) menjadi aldehid, dan 2) reaksi antara aldehid dengan Schiff reagent sehingga membentuk
warna magenta (Kiernan 1990).
Lektin merupakan protein atau glikoprotein yang dapat diisolasi dari tanaman dan hewan yang dapat berikatan dengan gugus gula spesifik atau polisakarida, glikoprotein dan glikolipid yang berikatan dengan glycosidic
(Sharon et al. 1989 diacu dalam Munoz et al. 1999). Pada jaringan biologi, gugus
ikatan lektin. Lektin dapat berikatan dengan dua atau lebih karbohidrat tanpa menyebabkan terjadinya perubahan enzimatik (Steup 2003). Lektin mempunyai afinitas terhadap residu monosakarida dari glikoprotein. Prinsip ikatan lektin dengan gugus gula mirip dengan ikatan antara antigen dan antibodi yang spesifik. Berdasarkan afinitas lektin terhadap gugus gula maka lektin dapat dibagi menjadi beberapa macam yaitu lektin yang mampu mengikat gugus glukosa dan manosa, N-asetilglukosamin, galaktosa dan N-asetilgalaktosamin, L-fruktosa dan asam sialat (Kiernan 1990). Dalam proses reproduksi, gugus-gugus karbohidrat tersebut diduga berperan dalam beberapa proses biologis yang terjadi dalam suatu jaringan, seperti memperantarai interaksi antar sel dan antara sel dengan matriks ekstraseluler selama perkembangan embrionik pre dan postimplantasi.
Metode histokimia lektin merupakan salah satu metode yang sangat baik untuk menganalisa jenis karbohidrat melalui residu gula yang lebih spesifik pada jaringan karena kemampuannya dalam membeda-bedakan struktur karbohidrat yang sangat kompleks yang dapat ditemukan pada permukaan sel, matriks ekstraselular dan karbohidrat yang terikat dengan molekul lainnya seperti glikoprotein. Metode ini memiliki sensitivitas dan spesifisitas yang lebih tinggi dalam membedakan komponen gula serta mampu mengidentifikasi perbedaan yang sedikit pada struktur glikoprotein (Kiernan 1990; Munoz et al. 1999).
Pematangan Oosit In Vitro
Penerapan teknologi reproduksi seperti inseminasi buatan dan transfer embrio dalam rangka membantu perkawinan alam sudah banyak dilakukan terutama pada hewan-hewan ternak seperti sapi, kambing dan domba. Bahkan sekarang ini telah banyak diterapkan proses fertilisasi secara in vitro (in vitro fertilization/ IVF). Teknologi ini diharapkan dapat juga diterapkan pada kancil
sebagai hewan yang dijaga dari kepunahan dan suatu saat bisa digunakan sebagai alternatif sumber protein hewani. Sebelum teknologi reproduksi tersebut dapat diterapkan, fisiologi reproduksi kancil harus diketahui terlebih dahulu sehingga penerapan teknologi tersebut memberikan hasil yang tepat dan optimal. Penelitian ini memanfaatkan oosit kancil yang belum matang untuk dimatangkan secara in
vitro sehingga dapat difertilisasi. Pada umumnya, oosit yang dikoleksi berasal dari
folikel antral.
Perkembangan oosit meliputi tiga fase yaitu proliferasi, pertumbuhan dan pematangan. Fase proliferasi meliputi proses mitosis oogonium menjadi beberapa oogonia yang terjadi pada saat pralahir atau sesaat setelah lahir, kemudian oogonia berdiferensiasi menjadi oosit primer dengan inti tahap profase I (tahap diploten) serta dikelilingi oleh sel epitel pipih membentuk folikel primordial. Inti oosit pada tahap ini disebut germinal vesicle (GV) yang ditandai dengan adanya
membran inti yang utuh dan nukleus yang jelas (Hafez & Hafez 2000). Setelah fase proliferasi, oosit memasuki fase pertumbuhan dan pematangan yang berlangsung bersamaan dengan proses perkembangan folikel (folikulogenesis). Pada fase pertumbuhan, terjadi peningkatan volume dan diameter oosit akibat terjadi peningkatan dan penimbunan organel-organel dan inclusion body seperti
kompleks golgi, retikulum endoplasmik halus, butir lemak, serta peningkatan proses transkripsi untuk sintesis protein. Fase pematangan oosit terdiri dari beberapa proses perkembangan inti oosit yang meliputi : 1) germinal vesicle (GV)
yaitu pada kondisi inti oosit primer berada dalam folikel primordial, 2) germinal vesicle break down (GVBD) yaitu keadaan sesaat sebelum ovulasi dimana inti
oosit akan mengalami perkembangan yang dimulai dari robeknya membran inti, 3) metafase I yaitu terjadi perubahan oosit primer (2n) menjadi oosit sekunder (2n) dengan melepaskan badan kutub I akibat proses pembelahan meiosis I, dan 4) metafase II. Pada sebagian besar mamalia, oosit akan terovulasi setelah mengalami pembelahan meiosis II dan berhenti pada tahap metafase II (Hafez & Hafez 2000).
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Riset Anatomi dan Laboratorium Riset Embriologi, Departemen Anatomi, Fisiologi dan Farmakologi, Fakultas Kedokteran Hewan Institut Pertanian Bogor mulai bulan Februari 2005 sampai bulan Februari 2006.
Sampel yang Digunakan
Pada penelitian ini digunakan 6 ovarium (3 pasang) yang terdiri dari 4 ovarium (2 pasang) fase luteal dan 2 ovarium (sepasang) fase folikular serta 7 salurannya (tuba Fallopii, uterus, serviks dan vagina) dengan memanfaatkan sampel organ yang diperoleh dari kancil yang mati hasil tangkapan masyarakat. Penggunaan sampel sebagai bahan penelitian telah dilaporkan kepada pihak Direktorat Jenderal Perlindungan Hutan dan Konservasi Alam, Departemen Kehutanan Indonesia.
Metode Penelitian
Morfologi dan Morfometri Organ Reproduksi Kancil Betina
Pengamatan morfologi dan morfometri dilakukan terhadap seluruh ovarium (n=6) dan salurannya (n=7). Pengamatan morfologi dilakukan dengan mengamati bentuk dan situs viscerum organ reproduksi termasuk ovarium
sedangkan untuk pengamatan morfometri dilakukan melalui pengukuran panjang, lebar dan berat ovarium serta panjang salurannya. Panjang dan lebar ovarium serta panjang salurannya diukur menggunakan jangka sorong, sedangkan berat ovarium diukur menggunakan timbangan digital. Data morfologi yang diperoleh dipaparkan secara deskriptif, sedangkan data morfometri diolah dengan stastistik sederhana dengan menggunakan microsoft excel.
Karakteristik Histologi, Distribusi Karbohidrat dan Residu Gula pada Perkembangan Folikel Ovarium
Pembuatan Preparat Histologi
Untuk pengamatan terhadap karakteristik histologi dan perkembangan folikel ovarium digunakan 4 ovarium (2 pasang) fase luteal. Ovarium difiksasi dengan larutan Bouin (campuran asam pikrat : formalin : asam asetat glasial = 15 :
5 : 1) dan diproses menurut standar histologi sampai menjadi blok parafin (Histoplast, Thermo Shandon, Pittsburgh, USA). Blok parafin dipotong dengan ketebalan 5 µm menggunakan mikrotom, dilekatkan pada gelas objek dan diinkubasi semalam dalam inkubator 370C. Prosedur pembuatan preparat histologi disajikan padaLampiran 1.
Karakteristik Histologi Perkembangan Folikel
Untuk pengamatan karakteristik histologi perkembangan folikel, perhitungan jumlah folikel serta pengukuran diameter folikel dan oosit digunakan preparat histologi dengan pewarnaan hematoksilin-eosin atau HE (Kiernan 1990). Karakteristik perkembangan folikel diamati berdasarkan bentuk dan jumlah lapisan sel granulosa, zona pelusida dan ada tidaknya rongga (antrum) folikuli. Jumlah folikel dihitung dengan menggunakan metode estimasi (Candy et al. 1997,
Muammar et al. 2004) yaitu dengan mencari terlebih dahulu faktor pengali untuk
masing-masing tipe folikel. Jumlah setiap tipe folikel pada 25 sayatan serial pertama dijumlahkan kemudian dibandingkan dengan jumlah folikel pada setiap kelipatan lima. Folikel yang dihitung hanya folikel yang memiliki nukleolus dengan struktur yang jelas untuk menghindari perhitungan ganda.
Jumlah folikel pada 25 sayatan pertama Faktor pengali = ________________________________________
Jumlah folikel pada sayatan ke-1, 5, 10, 15, 20,dan 25
Diameter folikel dan oosit diukur dengan menggunakan mikrookuler. Ukuran diameter folikel dan oosit diperoleh dengan cara merata-ratakan ukuran sisi panjang dan sisi pendek dari folikel dan oosit. Hasil pengamatan karakteristik
histologi perkembangan folikel dideskripsikan secara deskriptif. Hasil perhitungan jumlah folikel dan pengukuran diameter folikel dan oosit diolah dengan menggunakan stastistik sederhana dengan microsoft excel.
Distribusi Karbohidrat dan Residu Gula
Untuk mengetahui distribusi karbohidrat dan residu gula pada setiap tahapan perkembangan folikel dilakukan dengan metode pewarnaan alcian blue/AB pH 2.5, periodic acid schiff/PAS (Kiernan 1990), dan histokimia lektin
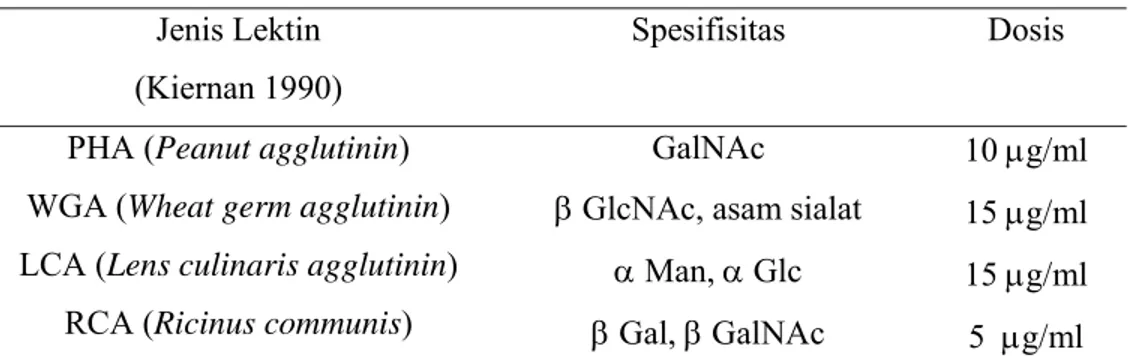
menggunakan lektin berlabel peroksidase (Honen Corp., Tokyo, Japan). Jenis, spesifisitas, dan dosis lektin yang digunakan disajikan pada Tabel 1.
Tabel 1 Jenis, spesifisitas dan dosis lektin yang digunakan Jenis Lektin
(Kiernan 1990)
Spesifisitas Dosis
PHA (Peanut agglutinin)
WGA (Wheat germ agglutinin)
LCA (Lens culinaris agglutinin)
RCA (Ricinus communis)
GalNAc
β GlcNAc, asam sialat α Man, α Glc β Gal, β GalNAc 10 µg/ml 15 µg/ml 15 µg/ml 5 µg/ml
Keterangan : GalNAc : N-asetilgalaktosamin, , GlcNAc : N-asetilglukosamin, Man : manosa, Glc : β-glukosa, Gal : β-galaktosa
Spesifisitas metode histokimia lektin dipastikan melalui prosedur kontrol positif dan kontrol negatif. Preparat ginjal mencit dan kelenjar submandibularis domba digunakan sebagai preparat kontrol positif, sedangkan pada prosedur kontrol negatif digunakan larutan phosphat buffer saline (PBS) sebagai pengganti
lektin. Hasil pengamatan diolah secara semikuantitatif yang didasarkan pada afinitas dan intensitas warna yang ditimbulkan pada setiap metode tersebut ke dalam empat kategori yaitu negatif (-), sangat lemah (±), lemah (+), sedang (++) dan kuat (+++).
Morfologi dan Pematangan Oosit In Vitro
Untuk mengetahui tingkat pematangan oosit secara in vitro digunakan 18
oosit dengan morfologi normal (sitoplasma homogen, membran utuh, dan dikelilingi oleh sel-sel kumulus) dari sepasang ovarium fase folikular. Ovarium yang diperoleh dimasukkan ke dalam larutan saline 0.89% dengan penambahan penisilin 100 µg/ml dan streptomisin 100 µg/ml pada suhu 30-350C. Ovarium dicacah dengan menggunakan silet yang steril dalam cawan petri yang berisi 2 ml PBS (Gibco USA) yang mengandung bovine serum albumin (BSA) 0.3% dan gentamycin sulphate 50 µg/ml (Sigma Chemical Co., St.Louis, MO, USA). Oosit
yang telah dikoleksi, dicuci sebanyak tiga kali dengan media maturasi yaitu MEM (minimum essential medium) yang diberi newborn calf serum (Sigma Chemical
Co., St.Louis, MO, USA) 10% (v/v) yang telah diinaktivasi, follicle stimulating hormone (Denka Pharmaceutical, Japan) 0.01 µg/ml dan gentamycin sulphate 50
µg/ml. Oosit dikultur dalam 100 µl drops MEM dan ditutup dengan mineral oil
atau cairan parafin (Sigma Chemical Co., St.Louis, MO, USA). Pematangan dilakukan dalam inkubator CO2 5% dengan suhu 380C selama 20-24 jam sampai terjadi ekspansi sel-sel kumulus. Lapisan sel kumulus dari oosit dihilangkan dengan pemberian enzim hyaluronidase 0.1%. Setelah pencucian, oosit kemudian
diwarnai dengan bis-benzimidize (hoechst)-propidium iodine. Tingkat kematangan
oosit dievaluasi menggunakan mikroskop flouresens (Nikon Eclips, Tokyo, Japan). Evaluasi tingkat kematangan oosit adalah berdasarkan ekspansi sel-sel
kumulus dan adanya badan kutub I (metafase II). Keberhasilan tingkat kematangan oosit dihitung dari jumlah oosit yang mencapai metafase II per jumlah oosit yang dikultur.
HASIL DAN PEMBAHASAN
Morfologi dan Morfometri Organ Reproduksi Kancil Betina
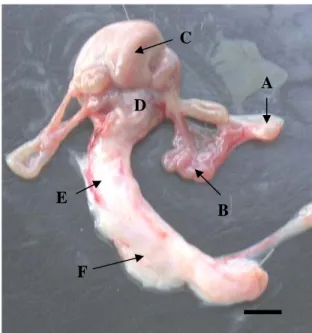
Organ reproduksi kancil betina memiliki susunan yang secara umum sama dengan hewan ruminansia lainnya, yaitu terdiri dari sepasang ovarium, tuba Fallopii, uterus, serviks dan vagina. Organ reproduksi kancil betina terletak retroperitoneal dalam rongga pelvis. Organ ini digantung oleh fascia yang luas yang terdiri dari penggantung ovarium (mesovarium), penggantung tuba Fallopii (mesosalphinx) dan penggantung uterus (ligamentum uteri). Ovarium kancil dibungkus oleh suatu selaput, bursa ovari. Kancil memiliki ovarium yang berbentuk oval yang sama juga terlihat pada ruminansia lainnya seperti domba dan sapi (Hafez 1987). Organ reproduksi kancil dapat dilihat pada Gambar 5.
Gambar 5 Organ reproduksi kancil betina setelah dikeluarkan dari rongga tubuh. (A) Ovarium, (B) Tuba Fallopii, (C) Kornua uteri, (D) Korpus uteri, (E) Serviks, (F) Vagina. Bar : 10 mm
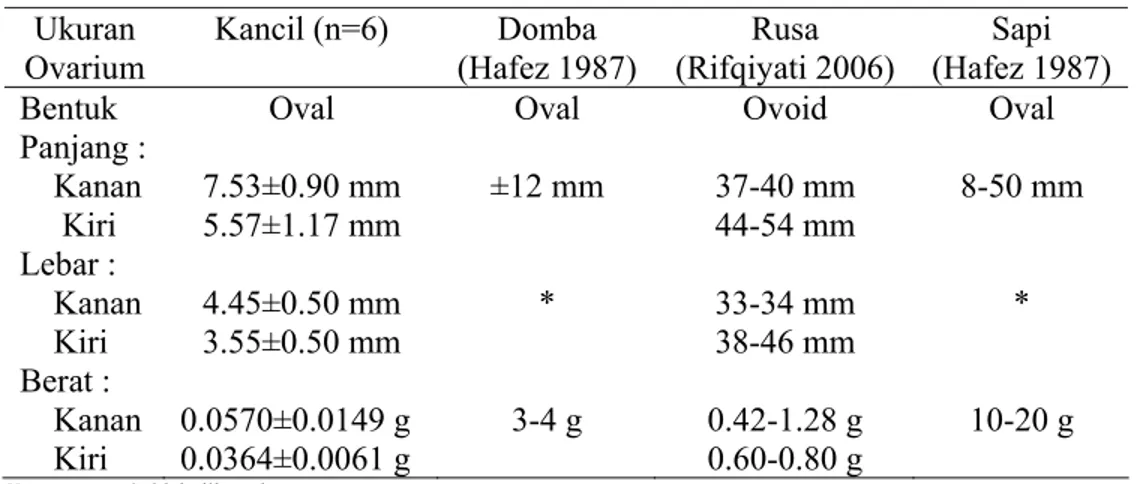
Tabel 2 menunjukkan ukuran ovarium kancil baik panjang, lebar dan berat serta perbandingannya dengan ukuran ovarium hewan lain seperti domba, rusa, dan sapi. Jika dibandingkan dengan ukuran ovarium domba, rusa, dan sapi, ovarium kancil memiliki ukuran yang lebih kecil. Ovarium kanan kancil berukuran lebih besar dibandingkan dengan ovarium kiri.
C A E F B D
Tabel 2 Ukuran ovarium kancil, domba, rusa, dan sapi Ukuran Ovarium Kancil (n=6) Domba (Hafez 1987) Rusa (Rifqiyati 2006) Sapi (Hafez 1987) Bentuk Oval Oval Ovoid Oval Panjang : Kanan Kiri 7.53±0.90 mm 5.57±1.17 mm ±12 mm 37-40 mm 44-54 mm 8-50 mm Lebar : Kanan Kiri 4.45±0.50 mm 3.55±0.50 mm * 33-34 mm 38-46 mm * Berat : Kanan Kiri 0.0570±0.0149 g 0.0364±0.0061 g 3-4 g 0.42-1.28 g 0.60-0.80 g 10-20 g Keterangan : * tidak dilaporkan
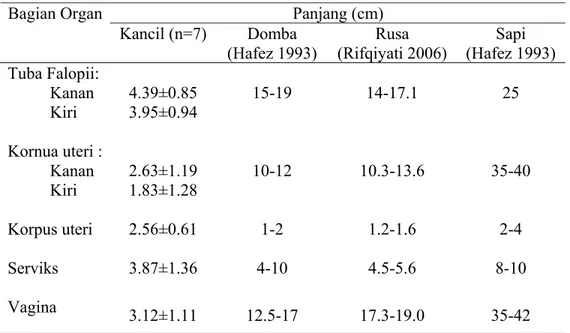
Ovarium kanan memiliki ukuran yang lebih besar dibandingkan dengan ovarium kiri dengan panjang 7.53±0.90 mm dan lebar 4.45±0.50 mm sedangkan ovarium kiri memiliki panjang 5.57±1.17 mm dan lebar 3.55±0.50 mm. Berat ovarium kanan sebesar 0.0570±0.0149 g dan ovarium kiri 0.0364±0.0061 g. Ukuran dan berat ovarium mencapai maksimum saat terbentuk korpus luteum setelah ovulasi terjadi dan seiring dengan bertambahnya umur hewan (Tian & Zhao 2000). Tian dan Zhao (2000) juga melaporkan bahwa berat ovarium kanan dan kiri relatif sama pada saat hewan lahir tetapi setelah mengalami pematangan seksual maka berat kedua ovarium tersebut menjadi tidak sama karena adanya kemungkinan perbedaan pada proses perkembangan folikel dan korpus luteum. Tabel 3 memperlihatkan ukuran panjang saluran reproduksi kancil betina dan perbandingannya dengan domba, rusa, dan sapi. Tuba Fallopii kanan memiliki panjang 4.39±0.85 cm dan yang kiri dengan panjang 3.95±0.94 cm. Kornua uteri kanan juga lebih panjang dan lebih besar yaitu 2.63±1.19 cm dibandingkan kornua kiri dengan panjang 1.83±1.28 cm. Korpus uteri memiliki panjang 2.56±0.61 cm. Serviks dan vagina masing-masing memiliki panjang 3.87±1.36 cm dan 3.12±1.11 cm. Tuba Fallopii dan kornua uteri bagian kanan lebih besar dibandingkan dengan bagian kiri. Kancil memiliki serviks yang lebih panjang dibandingkan panjang vagina. Pada domba, rusa, dan sapi, serviks memiliki ukuran yang lebih pendek dibandingkan vagina. Serviks yang panjang kemungkinan berkaitan dengan fisiologi kopulasi, ukuran penis kancil jantan atau sebagai reservoir sperma.
Namun demikian, dugaan ini masih perlu dipelajari lebih lanjut. Hafez dan Hafez (2000) melaporkan bahwa pada hewan-hewan ternak, serviks juga berfungsi sebagai reservoir sperma. Hal ini juga diduga terjadi pada kancil.
Tabel 3 Ukuran panjang saluran reproduksi betina pada kancil, domba, rusa, dan sapi Panjang (cm) Bagian Organ Kancil (n=7) Domba (Hafez 1993) Rusa (Rifqiyati 2006) Sapi (Hafez 1993) Tuba Falopii: Kanan Kiri Kornua uteri : Kanan Kiri Korpus uteri Serviks Vagina 4.39±0.85 3.95±0.94 2.63±1.19 1.83±1.28 2.56±0.61 3.87±1.36 3.12±1.11 15-19 10-12 1-2 4-10 12.5-17 14-17.1 10.3-13.6 1.2-1.6 4.5-5.6 17.3-19.0 25 35-40 2-4 8-10 35-42
Berdasarkan pengamatan terhadap saluran reproduksinya, diketahui bahwa kancil memiliki tipe uterus yang sama dengan ruminansia lainnya yaitu tipe bikornua dengan memiliki dua kornua uteri, satu korpus uteri dan satu serviks.
Data morfometri organ reproduksi kancil secara anatomi makroskopis akan sangat membantu untuk meningkatkan pemahaman tentang fisiologi reproduksi kancil betina antara lain untuk kemungkinan penerapan teknologi reproduksi dalam upaya pelestarian dan peningkatan populasi kancil.
Karakteristik Histologi, Distribusi Karbohidrat dan Residu Gula pada Perkembangan Folikel Ovarium
Karakteristik Histologi Perkembangan Folikel
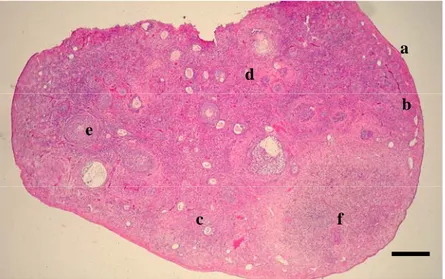
Struktur histologi ovarium kancil juga relatif sama dengan hewan ruminansia seperti domba dan sapi. Ovarium dilapisi oleh satu lapisan epitel yang disebut epitel germinativum yang berbentuk pipih hingga kuboid. Di bagian profundal lapisan epitel terdapat jaringan ikat yang disebut tunika albuginea. Selanjutnya, ovarium kancil terbagi atas dua bagian yaitu korteks yang berada di lateral dan bagian medula yang berada di bagian medial. Pada bagian korteks banyak ditemukan berbagai tahap perkembangan folikel. Pada bagian medula terdiri dari jaringan ikat longgar dan banyak ditemukan pembuluh darah dan saraf. Hal yang sama juga dilaporkan Kimura et al. (2004). Karakteristik ovarium
kancil secara mikroskopis memperlihatkan adanya suatu proses perkembangan folikel yang sangat dinamis. Ovarium yang dikoleksi berada pada fase luteal sehingga tidak ditemukan perkembangan folikel yang mencapai folikel yang telah matang secara sempurna (folikel de Graaf). Gambaran histologi dari ovarium kancil dapat dilihat pada Gambar 6.
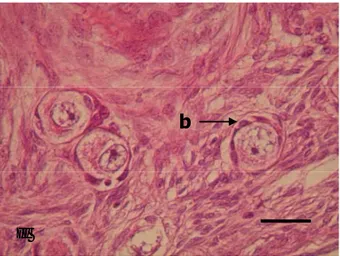
Gambar 6 Gambaran histologi ovarium kancil (sayatan transversal). (a) Epitel germinativum, (b) Tunika albuginea, (c) Korteks ovarium, (d) Medula ovarium, (e) Salah satu tipe folikel yang berkembang, (f) Korpus luteum. Pewarnaan HE. Bar : 300 µm
a b f c d e
Gambar 7 hingga Gambar 16 menunjukkan struktur histologi folikel pada berbagai tahapan perkembangan folikel dapat diamati pada ovarium fase luteal. Terdapat 10 tahapan perkembangan folikel yang diwakili oleh 10 tipe folikel. Pengelompokkan tipe folikel ini didasarkan pada bentuk dan lapisan sel-sel granulosa yang mengelilingi oosit, tebal tipisnya zona pelusida yang terbentuk, dan ada tidaknya serta besar kecilnya antrum folikuli yang terbentuk. Namun tahapan ini masih terus berkembang pada ovarium yang berada pada fase folikular hingga oosit dapat mencapai pertumbuhan yang optimal (diameter oosit mencapai sekitar 100 µm) dan akhirnya terjadi ovulasi dan membentuk korpus luteum.
Gambar 7 Folikel tipe 1 dengan ciri oosit (a) dilapisi satu lapis sel pregranulosa berbentuk pipih. Pewarnaan HE. Bar : 20 µm
Gambar 8 Folikel tipe 2 dengan ciri oosit dilapisi satu lapis sel pregranulosa (b) berbentuk transisi antara pipih dan kuboid. Pewarnaan HE. Bar : 20 µm
I
a
II
Gambar 9 Folikel tipe 3 dengan ciri oosit dilapisi satu lapis sel granulosa (panah) berbentuk kuboid. Pewarnaan HE. Bar : 20 µm
Gambar 10 Folikel tipe 4 dengan ciri oosit dilapisi satu-dua lapis sel granulosa berbentuk kuboid. Pewarnaan HE. Bar : 20 µm
Gambar 11 Folikel tipe 5 dengan ciri oosit telah dilapisi dua hingga lima lapis sel granulosa berbentuk kuboid. Pewarnaan HE. Bar : 20 µm V
III
Gambar 12 Folikel tipe 6 dengan ciri oosit telah dilapisi lebih dari lima lapis sel granulosa berbentuk kuboid. Zona pelusida (panah) sudah jelas terlihat dan sel-sel teka (t) mulai mengelilingi folikel. Pewarnaan HE. Bar : 20 µm
Gambar 13 Folikel tipe 7 dengan ciri oosit dilapisi lebih dari lima lapis sel granulosa berbentuk kuboid dan zona pelusida (panah) telah menebal. Pewarnaan HE. Bar : 20 µm
Gambar 14 Folikel tipe 8 dengan ciri oosit dilapisi lebih dari lima lapis sel granulosa berbentuk kuboid, zona pelusida tebal dan telah mulai terbentuk antrum folikuli (panah). Pewarnaan HE. Bar : 20 µm
VII VI
t
Gambar 15 Folikel tipe 9 dengan ciri oosit dilapisi lebih dari lima lapis sel granulosa berbentuk kuboid, zona pelusida tebal dan antrum folikuli (a) mulai membesar. Folikel dikelilingi sel teka. Pewarnaan HE. Bar : 20 µm
Gambar 16 Folikel tipe 10 dengan ciri oosit dilapisi lebih dari lima lapis sel granulosa berbentuk kuboid, zona pelusida tebal, antrum folikuli sudah membesar (a) dan oosit mulai ke arah tepi folikel. Pewarnaan HE. Bar : 20 µm
IX
X
a
Tabel 4 Karakteristik berbagai tahapan perkembangan folikel pada ovarium fase luteal kancil (T. javanicus)
Jumlah folikel (%) Diameter (µm)
Tahapan
folikel Karakteristik Ovarium
kanan Ovarium Kiri Folikel Oosit*
1
Oosit dilapisi satu lapis sel pregranulosa berbentuk pipih (68.38) 3020 (57.34) 5440 31.94±3.39 18.39±1.90
2 Oosit dilapisi satu lapis sel pregranulosa berbentuk transisi antara pipih dan kuboid 1335
(30.23) (40.11) 3805 40.67±8.13 26.57±4.91
3 Oosit dilapisi satu lapis sel granulosa yang telah berbentuk kuboid 24
(0.54) (0.25) 116 47.42±11.56 30.23±4.32
4 Oosit dilapisi satu sampai dua lapis sel granulosa berbentuk kuboid 2
(0.04) (0.06) 6 58.86±12.19 34.89±4.45
5 Oosit dilapisi dua hingga lima lapis sel granulosa berbentuk kuboid, zona pelusida
mulai terbentuk (0.68) 30 (1.11) 105 96.90±59.95 40.85±21.46
6 Oosit dilapisi lebih dari lima lapis sel granulosa berbentuk kuboid, zona pelusida tipis 1
(0.02) (0.01) 1 141.83±33.99 56.78±11.60 7 Oosit dilapisi lebih dari lima lapis sel granulosa berbentuk kuboid, zona pelusida mulai
menebal (0.02) 1 (0.04) 4 206.56±68.23 67.01±28.23
8 Oosit dilapisi lebih dari lima lapis sel granulosa berbentuk kuboid, zona pelusida tebal
dan mulai terbentuk antrum folikuli (0.04) 2 (0.01) 1 246.23±95.84 68.01±31.28
9 Oosit dilapisi lebih dari lima lapis sel granulosa berbentuk kuboid, zona pelusida tebal
dan antrum folikuli sudah mulai membesar (0.02) 1 (0.03) 3 499.80±83.78 84.29±3.85
10 Oosit dilapisi lebih dari lima lapis sel granulosa berbentuk kuboid, zona pelusida tebal
antrum folikuli sudah sangat besar dan oosit terdesak ke arah tepi folikel - (0.06) 6 841.92±177.53 85.71±4.59
Total 4416 9487
Diameter (cm)
Kanan Kiri
Korpus luteum
Sel-sel granulosa mengalami pembesaran dengan bentuk yang tidak beraturan. 2 2 22.37 14.57
Tabel 4 memperlihatkan karakteristik berbagai tahapan perkembangan folikel, jumlah folikel serta diameter folikel dan oosit. Folikel tipe 1 merupakan folikel awal yang banyak ditemukan pada bagian korteks ovarium kemudian folikel ini berkembang lebih lanjut menjadi folikel tipe 2, 3 hingga tipe 10. Folikel tipe 1 memiliki ciri oosit (disebut oosit primer) yang dikelilingi oleh satu lapis sel pregranulosa yang berbentuk pipih dengan diamater folikel sebesar 31.94±3.39 µm dan diameter oosit sebesar 18.39±1.90 µm. Folikel ini berkembang dari oogonia yang berproliferasi secara mitosis pada periode fetus (Senger 1999). Kemudian perkembangan folikel tipe 1 ini berhenti pada tahap diplotene (meiosis I) yang dapat ditemukan pada periode postnatal. Pada saat hewan mencapai pubertas, folikel tipe 1 mulai berkembang menjadi folikel tipe 2. Perkembangan folikel tipe 1 menjadi tipe 2 diperlihatkan dengan adanya perubahan bentuk sel pregranulosa dari bentuk pipih menjadi bentuk transisi antara pipih dan kuboid. Selain itu folikel semakin membesar. Hal ini dapat dilihat dengan peningkatan diameter folikel yang diikuti oleh peningkatan diameter oosit.
Folikel tipe 2 merupakan folikel dengan ciri oosit dikelilingi oleh satu lapis sel pregranulosa yang memiliki bentuk transisi antara pipih dan kuboid. Folikel ini juga banyak ditemukan pada bagian korteks ovarium. Diameter folikel tipe 2 sebesar 40.67±8.13 µm dan diameter oosit sebesar 26.57±4.91 µm.
Folikel tipe 3 merupakan folikel dengan ciri oosit telah dikelilingi oleh satu lapis sel granulosa yang seluruhnya telah berbentuk kuboid. Folikel ini memiliki diameter sebesar 47.42±11.56 µm dan diameter oosit sebesar 30.23±4.32 µm.
Folikel tipe 4 merupakan folikel dengan ciri oosit dikelilingi oleh 1-2 lapis sel granulosa yang berbentuk kuboid dengan diameter folikel 58.86±12.19 µm dan diameter oosit 34.89±4.45 µm. Peningkatan diameter folikel disebabkan oleh semakin meningkatnya jumlah sel-sel granulosa melalui proses proliferasi dan diferensiasi yang mengelilingi oosit sehingga membran basal semakin terdesak untuk meluas.
Folikel tipe 5 merupakan folikel yang terdiri dari 2-5 lapis sel granulosa dengan diameter folikel 96.90±59.95 µm dan diameter oosit 40.85±21.46 µm. Berdasarkan diameter folikel dan oosit tersebut terlihat bahwa perkembangan
folikel melalui proliferasi sel granulosa lebih cepat terjadi dibandingkan dengan perkembangan oosit. Jumlah sel granulosa yang semakin meningkat mengakibatkan diameter folikel semakin membesar akibat desakan sel-sel tersebut. Pada tahap ini, oosit telah dikelilingi oleh suatu lapisan yang disebut zona pelusida namun masih sangat tipis. Zona pelusida merupakan suatu glikoprotein yang disekresikan oleh oosit dan sel granulosa (Wu et al. 2004).
Zona pelusida sangat berperan penting dalam proses fertilisasi terutama pada proses binding spermatozoa pada oosit.
Folikel tipe 6 merupakan folikel yang memiliki ciri seperti folikel tipe 5. Namun pada folikel tipe 6, jumlah lapisan sel granulosa yang mengelilingi oosit semakin meningkat yaitu sekitar 8-12 lapis. Hal ini dapat dilihat dari diameter folikel dan oosit yang semakin meningkat pula yaitu masing-masing sebesar 141.83±33.99 µm dan 56.78±11.60 µm. Pada folikel tipe 6, lapisan sel-sel teka yang mengelilingi folikel telah terlihat dengan jelas.
Folikel tipe 7 merupakan folikel yang relatif sama dengan folikel tipe 6 namun zona pelusida telah menebal. Diameter folikel tipe ini sebesar 206.56±68.23 µm dan oosit 67.01±28.23 µm.
Folikel tipe 8 merupakan folikel yang mulai terbentuk antrum folikuli. Antrum ini berisi cairan yang mengandung hormon estrogen yang dihasilkan oleh sel-sel granulosa. Pada kelinci, pembentukan antrum folikuli dimulai ketika sel granulosa telah mencapai lebih kurang enam lapis sel granulosa (Zitny et al.
2004). Diameter folikel ini mencapai 246.23±95.84 µm dengan oosit mencapai 68.01±31.28 µm.
Folikel tipe 9 merupakan folikel dengan ciri antrum yang semakin membesar, oosit sudah mulai bergerak di bagian tepi folikel. Diameter folikel tipe 9 mencapai 499.80±83. µm dan oosit 84.29±3.85 µm. Diameter folikel semakin membesar akibat pembentukan antrum yang semakin membesar pula.
Folikel tipe 10 merupakan tipe folikel yang paling mendekati tahap matang yang oositnya telah siap untuk diovulasikan. Antrum folikuli telah membesar dan oosit sudah berada di bagian tepi folikel. Diameter folikel ini mencapai 841.92±177.53 µm dan oosit mencapai 85.71±4.59 µm. Namun pada penelitian ini tidak ditemukan folikel pada tahap yang matang secara sempurna.
Hal ini disebabkan oleh adanya pembentukan korpus luteum pada ovarium yang dikoleksi. Korpus luteum mensekresikan hormon progesteron yang dapat menghambat perkembangan folikel lebih lanjut dan menghambat terjadinya ovulasi.
Berdasarkan pengelompokkan folikel yang dilakukan oleh Erickson (2003), maka 10 tahapan perkembangan folikel ovarium kancil dapat dikelompokkan menjadi folikel primordial (1 dan 2), folikel primer (3 dan 4), folikel sekunder (5, 6 dan 7), folikel tertier (8, 9 dan 10). Folikel primordial hingga folikel sekunder termasuk folikel preantral, sedangkan folikel tertier termasuk folikel antral. Sedangkan berdasarkan pengelompokkan yang dilakukan oleh Cushman et al. (2000), maka folikel tipe 1 dan 2 disebut folikel primordial,
tipe 3 dan 4 disebut folikel primer, tipe 5, 6, 7 dan 8 disebut folikel sekunder sedangkan tipe 9 dan 10 disebut folikel tertier.
Distribusi setiap tipe folikel tidaklah sama. Folikel tipe 1 dan tipe 2 banyak ditemukan pada bagian korteks ovarium dan tidak mengelompok. Pada hewan multipara seperti anjing, perkembangan folikel tipe 1 terdapat dalam suatu kelompok (Kimura et al. 2004). Pada folikel tipe 3 hingga tipe 8, folikel
berkembang ke arah medula yang nantinya pada folikel tipe 9 dan 10, perkembangan folikel kembali mengarah ke bagian korteks ovarium karena di dalam folikel tersebut terdapat oosit yang hampir matang yang nantinya akan dilontarkan ke dalam saluran reproduksi untuk difertilisasi oleh spermatozoa melalui suatu proses yang disebut ovulasi.
Pada ovarium kancil juga ditemukan folikel yang mengalami atresia yang ditandai dengan sel-sel granulosa yang mengalami piknotis dan luruhnya sel-sel granulosa ke bagian antrum. Di duga, folikel-folikel tersebut mengalami atresia ketika mencapai ukuran tertentu tergantung pada spesies (species-spesific size).
Beberapa peneliti menduga salah satu faktor yang menyebabkan folikel mengalami atresia adalah adanya kelebihan proses metabolik pada folikel tersebut (Fortune 1994). Hasil metabolisme (metabolit) yang berlebihan akibat proses metabolik yang tinggi akan bersifat racun bagi sel-sel pada folikel tersebut sehingga terjadilah kematian sel-sel yang menyebabkan folikel atresia dan folikel tidak dapat berkembang menjadi tahap selanjutnya. Folikel-folikel yang tidak
mengalami atresia akan terus berkembang menjadi folikel matang dan siap untuk melakukan ovulasi.
Pada ovarium fase luteal terlihat adanya perkembangan folikel yang mengindikasikan bahwa pada ovarium baik yang berada pada fase folikular maupun fase luteal terjadi proses perkembangan folikel. Hal ini menunjukkan bahwa ovarium kancil memiliki minimal ada dua gelombang folikular (follicular wave). Pada ruminansia seperti sapi memiliki 2-3 gelombang folikular dalam satu
siklus estrusnya (Vasenna et al. 2003). Adanya gelombang folikular pada ovarium
fase luteal menunjukkan bahwa proses koleksi oosit pada ovarium kancil dapat dilakukan tanpa harus memperhatikan siklus ovarium.
Dari hasil perhitungan jumlah folikel (Tabel 4 dan Gambar 17), diketahui bahwa persentase folikel yang berkembang pada ovarium kiri lebih banyak dibandingkan ovarium kanan. Namun demikian, kedua ovarium memiliki keaktifan yang sama. Hal ini didasarkan pada jumlah korpus luteum yang terbentuk pada kedua ovarium adalah sama.
Gambar 17 Persentase jumlah folikel yang berkembang pada ovarium kancil fase luteal 0 10 20 30 40 50 60 70 80 Tipe folikel P e rs en tase (% )
Ovarium kanan Ovarium kiri
Ovarium kanan 68.38 30.23 0.54 0.04 0.68 0.02 0.02 0.04 0.02 Ovarium kiri 57.34 40.11 0.25 0.06 1.11 0.01 0.04 0.01 0.03 0.06
Perkembangan dan pertumbuhan folikel diinisiasi oleh pasase folikel tipe 1 (primordial) dari fase tidak tumbuh ke fase pertumbuhan yang terdiri dari tiga peristiwa utama yaitu 1) perubahan bentuk sel pregranulosa dari pipih menjadi kuboid, 2) proliferasi sel granulosa dan 3) pembesaran oosit melalui peningkatan diameter oosit. Pada beberapa spesies, perubahan sel granulosa mendahului pertumbuhan oosit (Braw-Tal & Yossefi 1997). Pada mencit dan tikus, oosit mulai tumbuh ketika telah terjadi sekitar 10 sel granulosa berbentuk kuboid (Lintern-Moore & Moore diacu dalam Braw-Tal & Yossefi 1997).
Pada manusia dan domba, oosit masuk ke fase pertumbuhan ketika oosit dikelilingi oleh 15 sel granulosa berbentuk kuboid (Gougeon & Chainy diacu dalam Braw-Tal & Yossefi 1997). Mhawi et al. (1991) diacu dalam Braw-Tal &
Yossefi (1997) melaporkan bahwa pada sapi yang baru lahir, bentuk transisi sel granulosa dari pipih menjadi kuboid diikuti oleh perubahan ultrastruktur pada oosit dan oosit masuk ke tahap pertumbuhan ketika telah terbentuk 40 sel granulosa. Pada kancil hal ini belum dapat dijelaskan.
Gambar 18 Diameter folikel dan oosit yang berkembang pada ovarium kancil fase luteal 0 100 200 300 400 500 600 700 800 900 Tipe folikel D iam et e r ( u m ) Folikel Oosit Folikel 31.94 40.67 47.42 58.86 96.9 141.83 206.56 246.23 499.8 841.92 Oosit 18.39 26.57 30.23 34.89 40.85 56.78 67.01 68.01 84.29 85.71 1 2 3 4 5 6 7 8 9 10