APLIKASI METODE
POLYMERASE CHAIN
REACTION
-
RESTRICTION FRAGMENT LENGTH
POLYMORPHISM
(PCR-RFLP) UNTUK
DETEKSI MUTASI PROMOTER
inhA
PADA PASIEN
MULTIDRUG RESISTANT Mycobacterium tuberculosis
(MDR-TB)
Skripsi
IDA AYU RATIH DWI NUGRAHA PUTRI
1208505001
JURUSAN FARMASI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
ALAM
i
APLIKASI METODE
POLYMERASE CHAIN
REACTION
-
RESTRICTION FRAGMENT LENGTH
POLYMORPHISM
(PCR-RFLP) UNTUK
DETEKSI MUTASI PROMOTER
inhA
PADA PASIEN
MULTIDRUG RESISTANT Mycobacterium tuberculosis
(MDR-TB)
Skripsi
IDA AYU RATIH DWI NUGRAHA PUTRI
1208505001
JURUSAN FARMASI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
ALAM
ii
Lembar Pengesahan
APLIKASI METODE
POLYMERASE CHAIN
REACTION
-
RESTRICTION FRAGMENT LENGTH
POLYMORPHISM
(PCR-RFLP) UNTUK DETEKSI
MUTASI PROMOTER
inhA
PADA PASIEN
MULTIDRUG RESISTANT Mycobacterium tuberculosis
(MDR-TB)
Tugas Akhir II
Tugas Akhir II (Skripsi) ini diajukan sebagai syarat untuk memperoleh gelar
Sarjana Farmasi (S. Farm) di Jurusan Farmasi
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Udayana
Oleh
IDA AYU RATIH DWI NUGRAHA PUTRI
1208505001
Menyetujui:
Mengesahkan:
KATA PENGANTAR Pembimbing I
Dr. Sagung Chandra Yowani, S.Si., Apt., M.Si. NIP. 197102101997022001
Pembimbing II
Dr. I Nengah Wirajana, S.Si., M.Si. NIP. 197102191997021001
Ketua Jurusan Farmasi
Fakultas Matematika dan Ilmu Pengetahuan Alam
iii
KATA PENGANTAR
Puji syukur penulis panjatkan ke hadapan Tuhan Yang Maha Esa karena berkat rahmat-Nya penulis dapat menyelesaikan Tugas Akhir II (Skripsi) yang
berjudul “APLIKASI METODE POLYMERASE CHAIN REACTION-RESTRICTION FRAGMENT LENGTH POLYMORPHISM (PCR-RFLP)
UNTUK DETEKSI MUTASI PROMOTER inhA PADA PASIEN
MULTIDRUG RESISTANT Mycobacterium tuberculosis (MDR-TB)” tepat
pada waktunya. Tugas Akhir II ini diajukan sebagai syarat untuk memperoleh gelar Sarjana Farmasi (S.Farm) di Jurusan Farmasi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana.
Penulisan Tugas Akhir II ini tentunya tidak terlepas dari dukungan dan bantuan dari berbagai pihak, baik secara langsung maupun tidak langsung. Oleh karena itu penulis ingin menyampaikan rasa terima kasih yang sebesar-besarnya kepada:
1. Drs. Ida Bagus Made Suaskara, M.Si., selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Udayana.
2. Dr. rer. nat. I Made Agus Gelgel Wirasuta, M.Si., Apt, selaku Ketua Jurusan Farmasi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Udayana.
3. Dr. Sagung Chandra Yowani, S.Si., Apt., M.Si., selaku dosen pembimbing I yang banyak mengarahkan serta memberi semangat dan dukungan yang tak henti demi kelancaran penyusunan Tugas Akhir II ini.
4. Dr. I Nengah Wirajana, S.Si., M.Si., selaku dosen pembimbing II yang banyak mengarahkan serta memberi semangat dan dukungan demi kelancaran penyusunan Tugas Akhir II ini.
5. Seluruh teknisi di Laboratorium Biologi Molekular FK, khususnya Mbok Nanik, Kak Echi, dan Bu Komang yang telah banyak memberi bantuan dan dukungan.
iv
banyak memberikan ilmu serta dukungan sejak awal penulis mengenyam pendidikan di Jurusan Farmasi.
7. Kedua orang tua penulis, Ida Bagus Ngurah Sucarma dan I Gusti Ayu Ketut Rasminiati yang tak henti memberi doa. Kedua saudari penulis, Mbk Ewik dan Gek Agung yang selalu memberikan dukungan dan semangat kepada penulis sehingga Tugas Akhir II ini dapat diselesaikan.
8. Sahabat tersayang penulis, Eni, Claudia, Sonia yang selalu memberikan motivasi, dukungan, menjadi teman berbagi suka dan duka sejak awal perkuliahan, serta Nia, Desak, Risma, Wiwik, Diah yang juga selalu memberikan motivasi dan dukungan.
9. TB Team Linda, Widya, Dek Tri, Ebi yang selalu memberikan motivasi selama penyusunan skripsi serta Rai yang menjadi teman diskusi sejak awal penyusunan skripsi dan berbagi suka duka selama penelitian berlangsung.. 10.Seluruh mahasiswa Jurusan Farmasi Fakultas MIPA Universitas Udayana,
khususnya teman-teman Dioscuri Hygeia yang telah berjuang bersama sejak awal.
11.Semua pihak yang tidak dapat penulis sebutkan satu per satu.
Penulis menyadari bahwa penulisan Tugas Akhir II (Skripsi) ini masih sangat jauh dari kesempurnaan. Penulis berharap kritik dan saran yang bersifat membangun dari berbagai pihak demi karya yang lebih baik di masa yang akan datang. Semoga skripsi ini dapat bermanfaat bagi pembaca dan perkembangan ilmu pengetahuan.
Denpasar, Juni 2016
v
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
LEMBAR PENGESAHAN ... ii
KATA PENGANTAR ... iii
DAFTAR ISI ... v
DAFTAR SINGKATAN ... viii
DAFTAR ISTILAH ... x
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
ABSTRAK ... xvi
ABSTRACT ... xvii
BAB I PENDAHULUAN... 1
1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 5
1.3 Tujuan Penelitian ... 5
1.4 Manfaat Penelitian ... 5
1.4.1 Manfaat Keilmuan ... 5
1.4.2 Manfaat Praktis ... 6
BAB II TINJAUAN PUSTAKA ... 7
vi
2.2 Multidrug Resistant Tuberculosis ... 8
2.3 Isoniazid ... 10
2.4 Gen resisten Isoniazid (inhA) ... 12
2.5 Mutasi Gen ... 13
2.5.1 Insersi ... 14
2.5.2 Delesi ... 14
2.5.3 Substitusi ... 15
2.6 DNA Metagenomik ... 15
2.7 Enzim restriksi ... 17
2.7.1 Enzim Restriksi Endonuklease Tipe II ... 19
2.7.2 Interaksi Enzim Restriksi Endonuklease Tipe II dengan DNA ... 21
2.7.3 Penempelan pada DNA dan Lokasi Situs Target ... 22
2.8 PCR ... 23
2.8.1 Tahapan Siklus PCR ... 24
2.8.2 Komponen dalam melakukan proses PCR ... 25
2.9 RFLP ... 27
2.10 Elektroforesis ... 28
BAB III METODE PENELITIAN ... 31
3.1 Rancangan Penelitian ... 31
3.2 Lokasi dan Waktu Penelitian ... 31
3.3 Bahan Penelitian ... 31
vii
3.5 Prosedur Penelitian ... 32
3.5.1 Pemilihan Enzim Restriksi ... 32
3.5.2 Isolasi DNA M. tuberculosis H37Rv ... 33
3.5.3 Amplifikasi DNA dengan PCR ... 34
3.5.4 Deteksi Produk PCR dengan Elektroforesis... 34
3.5.5 Digesti dengan menggunakan enzim restriksi ... 35
3.5.6 Deteksi Hasil Digesti Enzim Restriksi dengan elektroforesis ... 35
3.5.7 Interpretasi Hasil ... 36
BAB IV HASIL DAN PEMBAHASAN... 37
4.1 Pemilihan Enzim Restriksi ... 37
4.2 Isolasi DNA Mycobacterium tuberculosis H37Rv ... 41
4.3 Optimasi dan Amplifikasi Daerah Promoter inhA ... 44
4.4 Optimasi Formulasi dan Waktu Digesti Daerah Promoter inhA dengan Enzim Restriksi SacII ... 49
4.5 Digesti Daerah Promoter inhA ... 54
BAB V KESIMPULAN DAN SARAN... 58
5.1 Kesimpulan ... 58
5.2 Saran ... 58
DAFTAR PUSTAKA ... 59
viii
DAFTAR SINGKATAN
A : Adenin
ACP : acyl carrier protein
BSC : biological safety cabinet
bp : base pairs
EDTA : Ethylene diamine tetraacetic acid
ETH : etionamid
FAS-I : Fatty Acid Synthetase tipe I FAS-II : Fatty Acid Synthetase tipe II G : Guanin
HIV : Human Immunodeficiency Virus
INH : isoniazid (isonicotinic acid hydrazide)
INHr : isoniazid resistant
LAM : Lipoarabinomannan
LM : Lipomannan
ManLAM : Mannose Lipoarabinomannan
MDR : Multi-drug resistant
MTb : Mycobacterium tuberculosis
OAT : Obat Anti Tuberkulosis
ORF : Open Reading Frame
pb : pasang basa
PCR : Polymerase Chain Reaction
ix
PILAM : Phosphoinositol Lipoarabinomannan
PIM : Phosphatidylnositol mannosides
T : Timin TB : tuberkulosis
x
DAFTAR ISTILAH
Amplifikasi DNA : perbanyakan DNA Amplikon : produk PCR
Frameshift mutation : mutasi titik yang menunjukkan terjadinya penghapusan atau penyisipan nukleotida (bukan kelipatan tiga)
Gen : urutan DNA yang menyandi suatu protein
GenBank : database utama dalam biologi molekuler yang dikelola oleh NCBI
Genom : keseluruhan materi genetik (DNA/RNA) pada makhluk hidup
Hairpins : struktur primer yang terbentuk oleh DNA tunggal dimana terdapat suatu bagian tertentu dari DNA tersebut terhibridisasi pada bagian komplemen di dalam untai DNA yang sama, membentuk struktur menyerupai
hairpin
H37Rv : galur standar yang dijadikan wild type
In vitro : percobaan dilakukan dalam tabung yang menyerupai sistem in vivo agar dapat memberikan hasil yang sama dengan proses in vivo
xi
Kodon : deret nukleotida pada mRNA yang terdiri atas kombinasi tiga nukleotida berurutan yang menyandi suatu asam amino tertentu
Lokus : letak suatu gen pada suatu kromosom
Mutasi : terjadinya perubahan basa dari urutan nukleotida yang lazim dari suatu sekuen DNA organisme yang dapat menyebabkan perubahan sifat fenotip
Nukleotida : unit monomer pembentuk DNA
Nonsense mutation : mutasi akibat perubahan kodon sehingga kodon stop terbentuk prematur
ORF : segmen dari urutan nukleotida yang diawali dengan start
kodon dan diakhiri dengan stop kodon dan memiliki panjang yang cukup untuk mengkode protein
PCR : teknik perbanyakan urutan DNA dengan menggunakan reaksi enzimatis
Primer : oligonukleotida pendek yang mempunyai urutan nukleotida yang komplementer dengan urutan nukleotida DNA templat
Polimerisasi : reaksi pembentukan polimer
Prodrug : senyawa yang tidak aktif dan bersifat labil, di dalam tubuh akan mengalami perubahan melalui proses kimia atau enzimatik menjadi senyawa induk aktif dan kemudian berinteraksi dengan reseptor untuk menghasilkan efek farmakologis
Promoter : suatu sekuen DNA spesifik yang berperan dalam mengendalikan transkripsi gen struktural
Resistensi : kemampuan bakteri untuk bertahan terhadap adanya obat yang dengan konsentrasi normal dapat membunuh atau menghambat pertumbuhannya
Runs : pengulangan basa tunggal pada sekuen primer
xii
Sekuensing : proses penentuan urutan basa nukleotida pada suatu molekul DNA
Silent mutation : mutasi yang menunjukkan perubahan nukleotida dapat mengakibatkan perubahan kodon tetapi tidak ada perubahan fenotipik yang diamati pada individu
Transkripsi : proses sintesis RNA dengan menggunakan DNA sebagai templat
Tray : alat yang digunakan sebagai cetakan gel agarosa
Well : kolom-kolom tempat diletakkannya zat yang akan dielektroforesis
xiii
DAFTAR TABEL
Halaman
Tabel 2.1 Rentang Pemisahan pada Gel Agarosa ... 30
Tabel 4.1 Hasil enzim restriksi yang spesifik mengenal daerah promoter InhA ... 38
Tabel 7.1 Formulasi Digesti I ... 76
Tabel 7.2 Formulasi Digesti II ... 76
xiv
DAFTAR GAMBAR
Halaman
Gambar 2.1 Isoniazid ... 10
Gambar 2.2 Mutasi pada lokus inhA... 12
Gambar 2.3 Contoh insersi ... 14
Gambar 2.4 Contoh delesi ... 14
Gambar 2.5 Contoh transisi dan transversi ... 15
Gambar 2.6 Pemotongan molekul DNA dengan enzim restriksi tipe I, II, dan III ... 18
Gambar 2.7 Ujung blunt dan ujung sticky... 19
Gambar 2.8 Skema Ilustrasi Proses Pengikatan DNA dan Pemotongan dengan Enzim Restriksi Endonuklease ... 22
Gambar 4.1 Hasil pemotongan enzim restriksi SacII menghasilkan ujung asimetris (sticky end) ... 40
Gambar 4.2 Peta restriksi enzim restriksi SacII ... 41
Gambar 4.3 Elektroforegram produk PCR hasil optimasi suhu isolat M. tuberculosis H37Rv... 45
Gambar 4.4 Elektroforegram hasil amplifikasi fragmen region promoter inhA M. tuberculosis pada suhu annealing 54oC ... 47
Gambar 4.5 Elektroforegram hasil amplifikasi fragmen region promoter inhA M. tuberculosis pada suhu annealing 54oC ... 47
xv
DAFTAR LAMPIRAN
Halaman
xvi
ABSTRAK
Mutasi pada promoter inhA tidak hanya mengakibatkan terjadinya resistensi terhadap isoniazid (obat anti tuberkulosis lini pertama), tetapi juga bertanggung jawab terhadap terjadinya resistensi silang pada etionamid (obat anti tuberkulosis lini kedua).Mutasi yang pernah dilaporkan terjadi adalah pada nukleotida -15 dan -24 dari promoter inhA. Deteksi mutasi secara molekuler dapat dilakukan dengan cara Polymerase Chain Reaction-Restriction Fragment Length Polymorphism
(PCR-RFLP), yang menggunakan enzim restriksi spesifik untuk mengenal urutan nukleotida tertentu. Penelitian ini bertujuan untuk mengetahui enzim restriksi yang dapat secara spesifik mengenal mutasi pada -24 dari daerah promoter inhA
dan mendeteksi adanya mutasi tersebut dengan menggunakan teknik PCR-RFLP. Metode penelitian yang digunakan adalah metode eksploratif laboratoris, dengan tahapan sebagai berikut: pemilihan enzim restriksi, isolasi DNA M. tuberculosis
H37Rv, amplifikasi daerah promoter inhA, deteksi produk PCR, optimasi dan digesti dengan menggunakan enzim restriksi, deteksi hasil digesti, dan interpretasi hasil.
Hasil analisis dengan menggunakan aplikasi Clone Manager Suite 6 memperlihatkan bahwa enzim restriksi SacII mampu mengenal secara spesifik urutan nukleotida -24 dari promoter inhA. Hasil optimasi digesti menunjukkan bahwa enzim SacII bekerja secara optimal pada suhu 37oC dengan waktu inkubasi 3 jam. Inaktivasi enzim dilakukan pada suhu 65oC selama 20 menit. Hasil digesti memperlihatkan bahwa enzim restriksi SacII memotong daerah promoter inhA
pada isolat P10, P11, P16, 86, dan 134 menghasilkan 2 pita, yang menunjukkan bahwa tidak terjadi mutasi pada isolat-isolat tersebut.
Dari penelitian ini dapat disimpulkan bahwa enzim restriksi yang digunakan untuk mendeteksi mutasi pada nukleotida -24 dari promoter inhA adalah enzim restriksi SacII. Pada keseluruhan isolat yang diteliti, yaitu P10, P11, P16, 86, dan 134 tidak ditemukan adanya mutasi pada titik -24 dari promoter inhA.
xvii
ABSTRACT
The mutation of inhA promoter is not only result in isoniazid resistance (first line antituberculosis drugs), but also have responsible for cross resistance in ethionamide (second line antituberculosis drug). The mutations that have been reported was at -15 and -24 in promoter region of inhA. Molecular detection of mutations could be done by Polymerase Chain Reaction-Restriction Fragment Length Polymorphism (PCR-RFLP), which uses specific restriction enzymes to recognize specific nucleotide sequences. Changes in the nucleotide sequence due to mutation, will be quickly recognized by this method. This study aims to determine the restriction enzyme which can specifically recognize the mutation at promoter region of inhAand detect the mutation using PCR-RFLP technique. This research were conducted in several steps which are: selection of restriction enzyme, DNA isolation of H37Rv Mycobacterium tuberculosis, amplification promoter region of inhA, detection of PCR product, optimization and digestion using restriction enzyme, detection of digestion product, and interpretation of result.
The analysis result using Clone Manager Suite 6 showed that SacII restriction enzyme could recognize specifically at -24 promoter region of inhA. The result of digestion optimization showed that SacII restriction enzyme have optimal work at 37oC for 3 hours incubation time, heat inactivation at 65oC for 20 minutes. Digestion result showed that SacII restriction enzyme cleave inhA
promoter region of P10, P11, P16, 86, and 134 isolates into 2 bands, that showed there was no mutation in all isolates.
In conclusion, the enzyme that could detect the mutation at -24 in promoter region of inhA is SacII. There were no mutation found at all isolates at -24 promoter region of inhA.
1
BAB I PENDAHULUAN
1.1 Latar Belakang
Berdasarkan data Global tahun 2014, sekitar 9,6 juta orang diperkirakan telah terkena penyakit tuberkulosis (TB). Sekitar 63% (6 juta) kasus baru dari 9,6 juta orang yang mengidap penyakit TB dilaporkan pada WHO. Hal ini berarti sekitar 37% kasus baru TB tidak terdiagnosis atau tidak dilaporkan pada WHO. Dari sekitar 480.000 kasus penyakit TB yang telah berkembang menjadi MDR-TB, hanya sekitar seperempat dari ini (123.000 kasus) yang baru terdeteksi dan dilaporkan (World Health Organization, 2015).
MDR-TB merupakan penyakit TB yang disebabkan oleh strain
Mycobacterium tuberculosis yang resisten terhadap Obat Anti Tuberkulosis (OAT) lini pertama, sekurang-kurangnya isoniazid dan rifampisin (World Health Organization, 2014). Dengan terjadinya resistensi pada OAT lini pertama maka dibutuhkan deteksi dini MDR-TB untuk penanganan awal dan tepat untuk pasien.
Penggunaan Isoniazid (INH) sebagai antituberkulosis lini pertama menyebabkan resistensi terhadap INH menjadi lebih sering terjadi (Karakousis, 2009). Resistensi terhadap INH dapat disebabkan oleh mutasi pada gen katG, gen
inhA, promoter inhA, dan daerah intergenik oxyR-ahpC. Mutasi pada isolat klinik yang resisten terhadap INH dideteksi terjadi paling banyak pada gen katG
2
Penelitian yang dilakukan oleh Zhang et al. (2005), pada isolat
Mycobacterium tuberculosis yang dikumpulkan dari 5 provinsi di Cina, menemukan adanya mutasi pada gen katG yang resisten terhadap INH sebesar 94,3%, daerah promoter inhA sebesar 14,9%, gen inhA sebesar 4,6%, dan 11,5% pada daerah intergen oxyR-ahpC. Muller et al. (2011) menyatakan bahwa persentase isolat dengan mutasi pada promoter inhA meningkat secara signifikan dari 30,1% (pada non MDR-TB yang resisten INH) menjadi sebesar 48,4% (pada kasus MDR-TB). Mutasi pada daerah promoter inhA menyebabkan peningkatan ekspresi inhA yang menyebabkan terjadinya resistensi INH tingkat rendah (Machado et al., 2013). Mutasi pada inhA tidak hanya mengakibatkan resistensi terhadap INH tetapi juga bertanggung jawab terhadap terjadinya resistensi silang terhadap etionamid (ETH), yang merupakan OAT lini kedua (Morlock et al., 2003). Adanya fenomena resistensi silang pada OAT lini kedua menyebabkan deteksi mutasi pada promoter inhA penting dilakukan untuk ketepatan penanganan pasien.
3
menggunakan metode PCR-based sequencing, menemukan adanya mutasi pada posisi yang sama, yaitu posisi -15 dengan mutasi (CT).
4
Keuntungan PCR-RFLP adalah murah, sederhana, mudah dalam penafsiran hasil, tidak memerlukan instrumen mahal, dan tidak memerlukan pelatihan khusus bagi staf laboran (Rasmussen, 2012). Pada dasarnya metode PCR-RFLP melalui proses amplifikasi sekuen target sebelum dilakukan pemotongan dengan enzim restriksi. Untuk memperoleh sekuen target dengan proses PCR maka diperlukan primer yang sesuai dan terbukti mampu untuk mengamplifikasi sekuen target. Penelitian sebelumnya yang dilakukan Kusdianingrum (2014) dan Septiari (2014) dengan menggunakan metode PCR-based sequencing telah melakukan pemilihan primer dan optimasi pada kondisi PCR. Penggunaan primer dan kondisi PCR yang didapat dari penelitian sebelumnya dapat digunakan pada metode PCR-RFLP apabila sekuen target yang digunakan adalah sama dengan penelitian sebelumnya. DNA sebagai cetakan yang digunakan untuk diagnosis laboratorium umumnya berasal dari pengkulturan. Proses pengkulturan memerlukan waktu yang lama (kurang lebih 3 minggu), sehingga menyebabkan proses identifikasi menjadi lebih lama dan akan memperlambat proses penanganan pasien (Pfyffer et al., 1997). Untuk mengatasi keterbatasan tersebut, diperlukan metode deteksi M. tuberculosis yang cepat, sensitif, dan spesifik.
5
metode PCR-RFLP dengan kondisi PCR dan penggunaan primer berdasarkan penelitian sebelumnya untuk deteksi adanya mutasi pada promoter inhA. Sehingga, diharapkan terapi MDR-TB menjadi lebih efektif dan penyebaran MDR-TB dapat dihambat
1.2 Rumusan Masalah
Dari latar belakang yang telah diuraikan di atas, maka dapat disusun rumusan masalah sebagai berikut.
1.2.1 Enzim restriksi apakah yang digunakan untuk memotong daerah yang mengalami mutasi pada daerah promoter inhA secara spesifik?
1.2.2 Apakah terjadi mutasi pada daerah promoter inhA isolat DNA MDR-TB yang diidentifikasi dengan metode PCR-RFLP?
1.3 Tujuan Penelitian
1.3.1 Mengetahui enzim restriksi yang digunakan untuk memotong daerah yang mengalami mutasi pada daerah promoter inhA secara spesifik. 1.3.2 Mengetahui ada tidaknya mutasi pada daerah promoter inhA isolat
DNA MDR-TB yang diidentifikasi dengan metode PCR-RFLP.
1.4 Manfaat Penelitian
1.4.1 Manfaat Keilmuan
6
menggunakan metode PCR-RFLP untuk deteksi adanya mutasi pada daerah promoter inhA serta menambah wawasan keilmuan mengenai ada atau tidaknya mutasi yang terjadi pada daerah promoter inhA.
1.4.2 Manfaat Praktis
7
BAB II
TINJAUAN PUSTAKA
2.1 Mycobacterium tuberculosis
Mycobacterium tuberculosis (M. tuberculosis) merupakan bakteri intraseluler sebagai agen penyebab penyakit tuberkulosis pada manusia. Bakteri ini berbentuk batang dan memiliki laju pertumbuhan yang lambat, yaitu sekitar 24 jam untuk replikasinya (Eklund, 2013). M. tuberculosis membutuhkan waktu 3-4 minggu untuk membentuk koloni secara in vitro. Pada manusia, M. tuberculosis
memiliki siklus hidup yang kompleks yang dapat melibatkan fase dorman atau fase laten di mana proses metabolisme bakteri ini di dalam tubuh dapat berkurang karena bakteri tersebut terdapat dalam granuloma, yang terorganisasi pada sel-sel kekebalan. Bakteri yang dorman dapat aktif kembali dan menyebabkan penyakit sesak napas bertahun-tahun kemudian. Waktu replikasi yang lambat dan kemampuan bertahan dalam keadaan latennya menyebabkan penyakit tuberkulosis bersifat kronis. M. tuberculosis dengan genus Mycobacterium
tergolong ke dalam ordo Actinomycetales yang terdiri dari sejumlah besar spesies yang berhubungan terhadap penyebab penyakit pada manusia dan hewan (Uplekar, 2012).
8
dinding sel, baik protein maupun lipoglikan dapat ditemukan. Lipoglikan-lipoglikan tersebut termasuk phosphatidylinositol mannosides (PIMs) yang pada tahap additional glycosylation dapat membentuk Lipomannan (LM) dan
Lipoarabinomannan (LAM). PIM, LM, dan terutama LAM memiliki kemampuan untuk memodulasi respon imun host. LAM dapat dimodifikasi lebih lanjut dengan penambahan Mannose (ManLAM) atau phosphoinositol (PILAM) yang banyak ditemukan pada bakteri patogen, seperti M. tuberculosis. PILAM dapat menginduksi produksi sitokin (IL-12, IL-18, dan TNF) sehingga dapat menginduksi terjadinya apoptosis makrofaga. Sedangkan ManLAM dapat secara aktif menghambat mekanisme antimikroba yang penting pada makrofaga (Eklund, 2013).
2.2 Multidrug Resistant Mycobacterium tuberculosis
Multidrug Resistant Mycobacterium tuberculosis (MDR-TB) merupakan penyakit tuberkulosis yang disebabkan oleh bakteri yang resisten terhadap setidaknya isoniazid (INH) dan rifampisin (RIF), yang merupakan Obat Anti Tuberkulosis (OAT) lini pertama yang paling efektif (WHO, 2014). MDR-TB dapat disebabkan oleh terjadinya infeksi primer oleh bakteri yang resisten ataupun terjadi selama masa pengobatan pasien (World Health Organization, 2014).
9
resistensi yang didapat selama terapi pada orang yang sebelumnya sensitif obat (Mc Donald, et al., 2003).
Jalur yang terlibat dalam perkembangan dan penyebaran MDR-TB akibat mutasi dari gen mikobakterium tuberkulosis. Basil tersebut mengalami mutasi menjadi resisten terhadap salah satu jenis obat akibat mendapatkan terapi OAT tertentu yang tidak adekuat. Terapi yang tidak adekuat dapat disebabkan oleh konsumsi hanya satu jenis obat saja (monoterapi direk) atau konsumsi obat kombinasi tetapi hanya satu saja yang sensitif terhadap basil tersebut (indirek monoterapi). Pasien TB dengan resistensi obat sekunder dapat menginfeksi yang lain di mana orang yang terinfeksi tersebut dikatakan resistensi primer. Transmisi difasilitasi oleh adanya infeksi HIV, adanya prosedur kontrol infeksi yang tidak adekuat, dan terlambatnya penegakkan diagnostik (Leitch, 2000).
Ada beberapa hal penyebab terjadinya resistensi terhadap OAT yaitu (Aditama, 2006):
1. Pemakaian obat tunggal dalam pengobatan tuberkulosis.
2. Penggunaan paduan obat yang tidak adekuat, yaitu jenis obatnya yang kurang atau di lingkungan tersebut telah terdapat resistensi terhadap obat yang digunakan, misalnya memberikan rifampisin dan INH saja pada daerah dengan resistensi terhadap kedua obat tersebut.
10
4. Fenomena “addition syndrome” yaitu suatu obat ditambahkan dalam
suatu paduan pengobatan yang tidak berhasil. Bila kegagalan itu terjadi karena kuman TB telah resisten pada paduan yang pertama, maka
“penambahan” (addition) satu macam obat hanya akan menambah
panjangnya daftar obat yang resisten saja.
5. Penggunaan obat kombinasi yang pencampurannya tidak dilakukan secara baik sehingga mengganggu bioavailabilitas obat.
6. Penyediaan obat yang tidak reguler, kadang-kadang terhenti pengirimannya sampai berbulan-bulan.
2.3 Isoniazid
Isoniazid (INH: isonicotinic acid hydrazide) merupakan obat anti tuberkulosis yang paling utama digunakan sejak pengenalan aktivitas kliniknya tahun 1952. INH merupakan analog nicotinamide yang terdiri atas cincin piridin dan gugus hidrazid, yang ditunjukkan pada gambar 2.1. INH digunakan sebagai obat anti tuberkulosis lini pertama karena aktivitas bakterinya yang signifikan, walaupun dalam 2 dekade terakhir resistensi INH dilaporkan terjadi peningkatan frekuensi (Kolyva and Petros, 2012).
11
INH mudah berpenetrasi menembus dinding sel host dan berdifusi melintasi membran M. tuberculosis. INH merupakan prodrug yang memerlukan aktivasi katG (enzim katalase peroksidase) pada M. tuberculosis (Zhang and Heym., 1992). Meskipun metabolit aktif INH dilaporkan dapat menghambat beberapa jalur seluler penting, termasuk sintesis asam nukleat, jalur utama yang bertanggung jawab dalam aktivitas anti tuberkulosis ini adalah dengan menghambat sintesis asam mikolik (Winder and Collins, 1970; Takayama and Wang, 1972; Takayama, Schnoes et al., 1975). INH akan membentuk radikal asil isonikotinat yang bersifat aktif. Selanjutnya akan terbentuk kompleks kovalen INH-NAD setelah bentuk aktif radikal asil isonikotinat memecah gugus nikotinamid pada NAD+. Terbentuknya kompleks INH-NAD menyebabkan terhambatnya produksi inhA dan menghalangi aktivitas Fatty Acid Synthetase tipe II (FAS–II). Terhalangnya FAS-II mengakibatkan terjadinya akumulasi produk akhir Fatty Acid Synthetase tipe I (FAS-I), sehingga tidak dapat menghasilkan asam mikolat yang dibutuhkan dalam proses sintesis dinding sel dan mengakibatkan terjadinya lisis sel (Cole et al., 2005).
Resistensi terhadap Isoniazid (INH) dapat disebabkan oleh mutasi pada gen
katG, gen inhA, promoter inhA, dan daerah intergen oxyR-ahpC. Mutasi pada isolat klinik yang resisten terhadap INH dideteksi terjadi paling banyak pada gen
12
provinsi di Cina, ditemukan adanya mutasi pada gen katG yang resisten terhadap INH sebesar 94,3%, daerah promoter inhA sebesar 14,9%, gen inhA sebesar 4,6%, dan 11,5% pada daerah intergen oxyR-ahpC.
2.4 Gen Resisten Isoniazid (inhA)
inhA merupakan gen pengkode enzim Enoil-ACP reduktase yang merupakan target kerja dari INH (Rozwarski et al., 1999). Enoil-ACP reduktase berperan dalam biosintesis asam mikolat (asam lemak rantai panjang pada
Mycobacterium) dengan memanfaatkan NADH untuk mengurangi ikatan rangkap trans antara posisi C2 dan C3 dari rantai asil lemak yang berhubungan dengan protein pembawa asil (Rozwarski et al., 1999). ETH sebagai OAT lini kedua memiliki struktur yang analog dengan INH diduga memiliki kemampuan dalam menghambat biosintesis asam mikolat dan beberapa studi menunjukkan bahwa resistensi yang rendah pada INH berkorelasi dengan resistensi pada ETH (Ramaswamy and Musser, 1998).
Lokus inhA terdiri dari dua Open Reading Frame (ORF), yaitu inhA dan
mabA (Mycolic acid biosynthesis) yang terlibat dalam biosintesis asam mikolat (Musser et al., 1996).
13
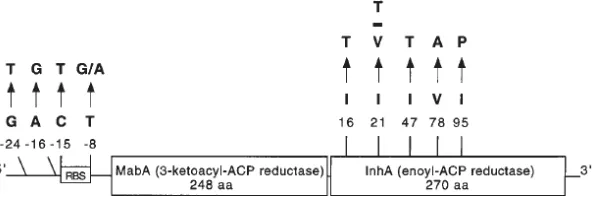
Pada penelitian yang dilakukan oleh Ramaswamy and Musser (1998), mutasi pada daerah promoter inhA yang sering terlihat adalah pada posisi -24(G-T), -16(A-G), -8(T-G/A) dan -15(C--24(G-T), seperti yang ditunjukkan pada gambar 2.2. Mutasi pada promoter ini menyebabkan terjadinya overekspresi inhA yang menyebabkan terjadinya resistensi INH. Sampai saat ini sekitar 70-80% resistensi INH pada isolat klinis M. tuberculosis dapat dikaitkan dengan mutasi pada gen
katG dan gen inhA, sebanyak 20-42% strain M. tuberculosis mengalami mutasi pada daerah promoter inhA (Ramaswamy and Musser, 1998),
Berdasarkan penelitian yang dilakukan oleh Guo et al., (2006) dengan isolat klinik dari USA, ditemukan terjadinya mutasi pada promoter inhA sebanyak 51%. Mutasi yang paling banyak terjadi pada posisi -15 (C→T) sebesar 76%. Sedangkan penelitian yang dilakukan oleh Mai et al., (2013), sebanyak 28,2% ditemukan terjadi mutasi pada promoter inhA dengan mutasi terbesar pada posisi -15 (C→T) sebesar 95,3%. Mutasi pada daerah promoter inhA juga ditemukan terjadi pada posisi -24 sebesar 2,2% (1 dari 45 isolat) pada isolat MDR-TB di Itali (Rindi et al., 2005).
2.5 Mutasi Gen
14
Struktur DNA memungkinkan hanya terjadi 3 jenis dasar perubahan atau mutasi, yaitu substitusi satu nukleotida dengan nukleotida lain (mutasi titik), penghapusan satu atau lebih nukleotida, dan penyisipan satu atau lebih nukleotida (Schleif, 1993).
2.5.1 Insersi
Insersi merupakan mutasi yang mengakibatkan terjadinya penyisipan nukleotida ke dalam sekuen DNA seperti pada gambar 2.3 (Bergeron, 2004).
Gambar 2.3. Contoh insersi (Bergeron, 2004)
2.5.2 Delesi
Delesi adalah penghapusan satu atau lebih nukleotida dalam sekuen DNA seperti pada gambar 2.4 (Bergeron, 2004).
15
2.5.3 Subsitusi
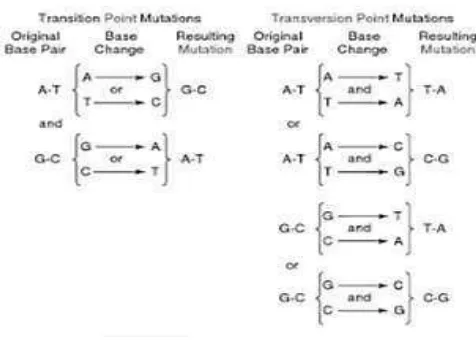
Substitusi adalah penggantian satu nukleotida dan pasangannya dengan sepasang nukleotida lain. Substitusi dapat dibedakan menjadi dua, yaitu:
a. Transisi, yaitu ketika basa pirimidin diganti dengan pirimidin lain (T digantikan oleh C atau sebaliknya) atau basa purin diganti dengan purin lain (A digantikan oleh G atau sebaliknya). Contoh transisi seperti yang terlihat pada gambar 2.5.
b. Transversi, yaitu ketika basa purin digantikan dengan basa pirimidin atau sebaliknya. Contoh transversi seperti yang terlihat pada gambar 2.5.
(Elrod and William, 2002)
Gambar 2.5. Contoh transisi (kiri) dan transversi (kanan) (Woodbury, 2012)
2.6 DNA Metagenomik
16
genomnya, lalu dilakukan penelitian lebih lanjut untuk mencari enzim baru (Lorenz and Schleper, 2002). Teknik tersebut merupakan sebuah teknik yang mengkombinasikan beberapa metode dan bidang ilmu, seperti genetika, mikrobiologi, dan bioinformatika. Berbeda dengan teknik analisis genom bakteri pada umumnya, teknik metagenom dilakukan dengan langsung mengekstraksi DNA genom dari lingkungan dan tidak memerlukan proses pengkulturan bakteri pada medium buatan (Handelsman, 2007).
Teknik metagenomik dapat digunakan untuk mempelajari bakteri yang tidak dapat dikultur yang diperkirakan terdapat lebih dari 99% dari populasi bakteri di seluruh lingkungan. Metagenomik memberikan peluang besar dalam penemuan diversitas enzim yang baru yang memiliki fungsi spesifik (Uchiyama & Mizaki, 2009).
17
Analisis metagenomik dengan pendekatan sequence-based merupakan metode metagenomik yang digunakan untuk melihat kekerabatan mikroorganisme yang dianalisis melalui pendekatan bioinformatika. Klon DNA metagenomik dilihat urutan basanya, kemudian disusul menjadi pohon filogeni. Pendekatan tersebut melibatkan penggunaan mesin PCR dan primer-primer spesifik untuk mengisolasi dan memperbanyak suatu daerah target pada DNA genom. Produk-produk PCR inilah yang digunakan untuk konstruksi pustaka genom (Uria et al., 2005).
2.7 Enzim Restriksi
18
Enzim restriksi dibagi menjadi 3 kelas. Enzim restriksi kelas I mengandung subunit pemotong, subunit metilasi, subunit pengenalan sekuens. Enzim ini memotong pada sisi yang jauh dari sekuen pengenalannya. Enzim restriksi kelas II memiliki sekuen pengenalan dan aktivitas pemotong. Enzim ini memotong DNA pada sisi yang dekat atau berada di antara sekuen pengenalan dan paling banyak digunakan dalam analisis DNA. Enzim restriksi kelas III memiliki subunit pemotongan yang berasosiasi dengan subunit pengenalan dan subunit metilasi. Enzim ini memotong DNA di luar sekuen yang dikenal dan memerlukan 2 sekuens yang sama pada orientasi yang berlawanan pada untai DNA yang sama untuk dapat memotong. Enzim-enzim ini jarang menghasilkan potongan yang sempurna (Schleif, 1993). Pada gambar 2.6 dapat dilihat bahwa enzim restriksi tipe I dan tipe III memotong pada daerah yang jauh dan bervariasi dari titik pemotong yang dikenali oleh enzim restriksi, sedangkan enzim restriksi tipe II memotong pada daerah yang dekat dengan titik pengenalan enzim restriksi.
Gambar 2.6 Pemotongan molekul DNA dengan enzim restriksi tipe I, II, dan III (Brown, 2002)
Enzim restriksi menghasilkan dua macam hasil pemotongan, yaitu ujung
19
menghasilkan fragmen yang double stranded, sedangkan ujung sticky atau
cohesive akan menghasilkan potongan dengan ujung 5’ atau ujung 3’ yang
menggantung, seperti yang ditunjukkan pada gambar 2.7.
Gambar 2.7 Ujung blunt (sebelah kiri) dan ujung sticky (sebelah kanan)
2.7.1 Enzim Restriksi Endonuklease Tipe II
Enzim restriksi endonuklease tipe II merupakan enzim restriksi yang mengenal urutan sekuens nukleotida secara spesifik, melakukan pemotongan pada untai ganda DNA, dan menghasilkan fragmen-fragmen DNA. Enzim restriksi ini dapat dengan mudah dikontrol, mudah diprediksi hasil pemotongannya, dan memotong DNA pada situs yang spesifik, sehingga enzim restriksi endonuklease tipe II banyak digunakan dalam aplikasi molekuler (Mulhardt, 2007).
20
dengan adanya Mg2+ akan memotong kedua untai DNA pada situs pengenalan sehingga menghasilkan ujung 5’-fosfat dan ujung 3’-OH (Pingoud and Albert, 2001).
Enzim ini harus disimpan pada suhu -20oC. Jika enzim tersebut dikeluarkan dari freezer, enzim restriksi harus diletakkan pada es atau diletakkan pada cooler, yang tetap menjaga enzim pada suhu -20oC (Mulhardt, 2007). Sebagian besar enzim restriksi tipe II disediakan dengan buffer yang tepat untuk menjaga enzim tetap stabil selama penyimpanannya, tetapi buffer ini mengandung 25-50% gliserol untuk mencegah enzim membeku selama penyimpanan pada suhu -20oC. Konsentrasi gliserol di atas 5% (v/v) pada saat proses digesti dapat menghambat aktivitas sebagian besar enzim restriksi. Hal ini dikarenakan konsentrasi gliserol yang tinggi selama proses digesti menyebabkan spesifisitas sekuen beberapa enzim restriksi menjadi berkurang, sehingga menghasilkan kesalahan pemotongan. Penurunan aktivitas enzim restriksi karena adanya kondisi tertentu disebut dengan star activity. Faktor-faktor lain, seperti pH, etanol, kandungan garam yang tidak tepat juga dapat menyebabkan star activity atau penurunan aktivitas, sehingga pemilihan kondisi yang tepat sangat penting untuk dilakukan (Davis et al., 1986).
21
enzim dan mencegah inaktivasi enzim tersebut. Kesalahan konsentrasi NaCl atau Mg2+, tidak hanya menurunkan aktivitas dari enzim restriksi, tetapi juga menyebabkan perubahan pada spesifisitas enzim, sehingga menyebabkan kesalahan pengenalan sekuens (Brown, 2016).
Faktor lain yang perlu dipertimbangkan adalah suhu inkubasi. Sebagian besar enzim restriksi memiliki aktivitas yang paling baik pada suhu 37oC, meskipun beberapa enzim lainnya memiliki suhu inkubasi yang berbeda. Pada suhu inkubasi optimalnya, suatu enzim restriksi melakukan proses digesti dengan aktivitas yang paling optimum. Setelah proses digesti dilakukan, aktivitas enzim restriksi dihentikan. Penghentian aktivitas enzim restriksi dapat dilakukan dengan berbagai metode seperti penambahan SDS atau EDTA. Selain itu aktivitas enzim restriksi dapat dihentikan dengan melakukan pemanasan pada suhu tinggi (Wu et al., 1989).
2.7.2 Interaksi Enzim Restriksi Endonuklease Tipe II dengan DNA
22
pemotongan ikatan fosfodiester pada untai DNA dan menghasilkan dua untai produk. Proses interaksi tersebut seperti yang terlihat pada gambar 2.8 (Pingoud and Albert, 2001).
Gambar 2.8 Skema ilustrasi proses pengikatan DNA dan pemotongan dengan enzim restriksi endonuklease
2.7.3 Penempelan pada DNA dan Lokasi Situs Target
Semua enzim restriksi endonuklease menempel pada DNA tidak selalu secara spesifik, tetapi ada juga dengan afinitas yang lebih lemah, dan non spesifik, sama dengan protein lain yang mengenal sekuen DNA spesifik. Pada formasi kompleks non spesifik, counterions dan molekul air dilepaskan dari permukaan protein-DNA. Pada penempelan DNA non spesifik, perubahan konformasi terjadi, terutama pada protein, yang menyebabkan adaptasi pada kedua permukaan makromolekul.
23
pengikatan antara DNA dengan pusat katalitiknya pada jarak yang aman dari ikatan fosfodiester. Difusi dimensi pertama menggambarkan translokasi sepanjang molekul DNA yang tidak hanya melibatkan protein yang bebas, tetapi juga melibatkan proses sliding (pergerakan helical melewati galur DNA), hopping
(pergerakan paralel menuju DNA, selama protein tidak meninggalkan DNA domain), dan transfer intersegmen. Pada kondisi optimum, enzim restriksi endonuklease dapat membaca dengan cepat ±106 pasang basa (pb) pada satu kali proses penempelan. Pada pengamatan ini apabila terjadi pergerakan yang acak, proses pembacaan ukuran menjadi lebih kecil yaitu ±1000 pb. Pergerakan acak terjadi ketika enzim restriksi melakukan pencarian terhadap DNA target (Pingoud and Albert, 2001)
2.8 PCR
Polymerase Chain Reaction (PCR) merupakan teknik sintesis dan amplifikasi DNA yang dilakukan secara in vitro, pertama kali dikembangkan oleh Karry Mullis pada tahun 1985. Melalui teknik ini sejumlah kecil segmen DNA dapat dikalikan jumlahnya hingga lebih dari satu juta kali lipat hanya dalam beberapa jam. PCR memiliki sensitivitas yang sangat tinggi sehingga diaplikasikan pada banyak hal (Handoyo dan Ari, 2001; Stephenson dan Maria, 2012).
24
molekul DNA, dan begitu seterusnya. Jumlah kopi fragmen DNA target (amplikon) yang dihasilkan pada akhir siklus PCR dapat dihitung secara teoritis menurut rumus: Y= (2n – 2n)X, di mana Y merupakan jumlah amplikon, n merupakan jumlah siklus, dan X merupakan jumlah molekul DNA templat semula (Handoyo dan Ari, 2001). Sensitifitas metode ini dapat dilihat dari kemampuannya untuk mengamplifikasi DNA dalam jumlah kecil dan berasal dari sumber DNA yang tidak berkualitas (Erlich, 1989; Crocker and Paul, 2003).
2.8.1 Tahapan Siklus PCR
Proses PCR melibatkan beberapa tahap, yaitu: pradenaturasi, denaturasi, penempelan primer pada templat (annealing), pemanjangan primer (extension) dan pemantapan (post-extension). Tahap denaturasi hingga ekstensi merupakan suatu siklus.
a. Tahap Denaturasi
Pada tahap ini fragmen DNA dipanaskan pada suhu tinggi (95°C) selama ±1 menit untuk memutus ikatan double helix DNA menjadi untai tunggalnya. Kondisi denaturasi yang optimal dapat dilakukan pada suhu 95°C selama 30 detik atau 97°C selama 15 detik. Suhu yang lebih tinggi dapat diterapkan pada target templat dengan konsentrasi G+C (G=Guanin; C=Sitosin) yang tinggi. Proses denaturasi yang terlalu lama akan mengakibatkan hilangnya aktivitas enzim (Erlich, 1989; Innis and Gelfand, 1990).
b. Penempelan (annealing)
25
Kisaran suhu tersebut akan membantu dalam proses penempelan salah satu primer pada untai templat (5-3’) sedangkan primer yang lain akan menempel pada untai komplemennya (3-5’). Suhu dan lama waktu yang diperlukan untuk penempelan primer tergantung dari komposisi basa, panjang primer, dan konsentrasi primer. Suhu annealing yang diaplikasikan selama proses PCR adalah ±5°C daripada Tm primer (Innis and Gelfand, 1990).
c. Pemanjangan (extension)
Pada tahap ini suhu kembali dinaikkan pada kisaran 72-78 °C. Pada tahap ini memungkinkan Taq DNA polimerase mampu bekerja secara optimal dalam proses ekstensi DNA. Umumnya suhu yang digunakan pada proses ekstensi primer adalah 72°C. Waktu ekstensi tergantung pada panjang dan konsentrasi sekuen target serta suhunya. Kecepatan penggabungan nukleotida pada suhu 72°C bervariasi tergantung pada buffer, pH, konsentrasi garam, dan sifat templat DNA (Innis and Gelfand, 1990; Sambrook and Russel, 2001).
2.8.2 Komponen dalam melakukan proses PCR
Untuk melakukan proses PCR diperlukan komponen-komponen sebagai berikut:
1. DNA Templat
DNA untai ganda merupakan templat yang mengandung sekuen yang akan
26
adalah dengan melakukan isolasi DNA kromosom atau DNA plasmid dengan menggunakan metode standar yang ada (Winter et al., 1998; dan Handoyo dan Ari, 2000).
2. Primer
Primer merupakan potongan untai tunggal DNA yang menempel ke sekuen komplementernya pada templat. Pada proses PCR, sepasang primer berfungsi sebagai pembatas fragmen DNA target dan sekaligus menyediakan gugus hidroksi (-OH) pada ujung 3’ untuk proses ekstensi DNA.
Keberhasilan suatu proses PCR sangat tergantung dari primer yang digunakan.
Ukuran primer yang optimal adalah 18-28 nukleotida dengan presentase GC sebesar
50-60% dan dibuat secara sintesis, sehingga beberapa informasi mengenai sekuen
yang diinginkan/diamplifikasi harus tersedia (Innis andGelfand, 1990; Handoyo dan
Ari, 2000; Crocker and Paul, 2003)
3. dNTP (deoxynucleotide triphosphates)
Pada PCR dNTPs bertindak sebagai building block dalam proses ekstensi DNA. dNTP terdiri dari 4 komponen yaitu dATP, dCTP, dGTP dan dTTP. dNTP akan menempel pada gugus –OH ujung 3’ dari primer membentuk untai baru yang komplementer dengan untai DNA templat (Winter et al., 1998; Handoyo dan Ari, 2000).
4. Buffer PCR dan MgCl2
27
menstimulasi aktivitas DNA polimerase, sehingga dapat meningkatkan interaksi primer dengan templat yang membentuk komplek larut dengan senyawa dNTP (Handoyo dan Ari, 2001; Stephenson dan Maria, 2012)
5. DNA Polimerase
DNA polimerase berfungsi sebagai katalisis untuk reaksi polimerisasi DNA. Enzim ini diperlukan untuk tahap ekstensi DNA. Enzim DNA polimerase yang digunakan pada proses PCR bersifat termostabil sampai 950C yang dikenal dengan
Taq polymerase (Innis and Gelfand; 1990; Crocker and Paul, 2003; Sulistyaningsih,
2007).
2.9 RFLP
Metode RFLP adalah metode analisis dengan menggunakan suatu enzim restriksi yang secara spesifik mengenal urutan nukleotida tertentu yang dikenal
sebagai “situs restriksi”. Hal tersebut akan menyebabkan terjadinya pemotongan
28
Berdasarkan penelitian yang dilakukan oleh Caws et al (2007), metode PCR-RFLP memiliki beberapa keuntungan, yaitu murah, mudah untuk dilakukan, dan mudah dalam menafsirkan hasil. Spesifisitas yang dihasilkan dengan metode ini adalah 100% berdasarkan uji prospektif pada 100 kultur M. tuberculosis yang dikumpulkan dari pasien di rumah sakit Ngoc Thach untuk Penyakit Tuberkulosis dan Paru, kota Ho Chi Minh (Caws et al., 2007).
2.10 Elektroforesis
Elektroforesis gel merupakan suatu teknik untuk memisahkan dan memurnikan sebagian molekul berdasarkan karakteristik fisik molekul tersebut seperti ukuran, bentuk maupun titik isoelektrik. Dengan menempatkan molekul dalam sumur (well) pada gel dan menerapkan tegangan listrik pada gel, molekul akan bergerak melalui matriks dengan kecepatan yang berbeda (Helms, 2008).
29
Metode standar yang digunakan untuk memisahkan, mengidentifikasi, dan memurnikan fragmen DNA adalah elektroforesis gel agarosa. Teknik ini sederhana, cepat terbentuk, dan mampu memisahkan campuran potongan DNA sesuai dengan ukurannya secara akurat dibanding dengan densitas gradien sentrifugasi. DNA dari 200 basa sampai 50 kilo basa dapat dipisah dengan gel agarosa dengan berbagai konsentrasi agarosa. Gel agarosa biasanya dilakukan dalam konfigurasi horizontal dalam kekuatan medan listrik dan arah tetap (Watson, 2007).
Kecepatan migrasi dalam elektroforesis ditentukan oleh ukuran (panjang) DNA, konformasi DNA, konsentrasi agarosa, dan besaran tegangan yang digunakan. Fragmen DNA yang berukuran pendek bergerak lebih cepat daripada yang lebih panjang. Fragmen DNA yang lebih panjang bergerak lebih lambat karena terjadi gesekan lebih besar. Hal ini disebabkan DNA yang berukuran lebih panjang harus melewati pori-pori gel sehingga lajunya kurang efisien dibandingkan fragmen DNA yang lebih kecil (Sudjadi, 2012).
30
Tabel 2.1. Rentang Pemisahan pada Gel Agarosa (Sudjadi, 2012)
DNA yang berbentuk sirkuler superkoil (I), sirkuler bernoktah (II), dan linier (III) dari DNA yang berukuran sama akan bermigrasi melalui gel dengan kecepatan berbeda. Mobilitas relatif dari ketiga bentuk itu tergantung dari banyak faktor. Pada umumnya bentuk I yang berbentuk kompak akan bermigrasi lebih cepat dari bentuk III (Sudjadi, 2012).