TINGKATAN DOSIS YANG BERBEDA
PROGRAM STUDI TEKNOLOGI DAN MANAJEMEN PERIKANAN BUDIDAYA DEPARTEMEN BUDIDAYA
FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR
TINGKATAN DOSIS YANG BERBEDA
A. GALIH HARDITA
PROGRAM STUDI TEKNOLOGI DAN MANAJEMEN PERIKANAN BUDIDAYA DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR
2010
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul:
EVALUASI KUALITAS DAN KUANTITAS SPERMA IKAN GURAME Osphronemus gouramy Lac. DENGAN PENYUNTIKAN OVAPRIM PADA TINGKATAN DOSIS YANG BERBEDA
adalah benar merupakan karya yang belum pernah diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Mei 2010
A. GALIH HARDITA C 14050466
A. GALIH HARDITA. Evaluasi Kualitas dan Kuantitas Sperma Ikan Gurame Osphronemus gouramy Lac. dengan Penyuntikan Ovaprim pada Tingkatan Dosis yang Berbeda. Dibimbing oleh MUHAMMAD ZAIRIN JUNIOR dan HARTON ARFAH.
Ikan gurame Osphronemus gouramy Lac. adalah salah satu ikan konsumsi air tawar yang berasal dari Indonesia dan memiliki nilai ekonomis yang tinggi. Akan tetapi benih yang mutlak dibutuhkan untuk kegiatan budidaya masih mengandalkan hasil pemijahan alami sehingga ketersediaannya masih terbatas dan tidak kontinyu. Pemijahan buatan adalah salah satu cara untuk mengatasi permasalahan tersebut. Oleh karena itu dibutuhkan informasi dan teknologi mengenai pemijahan buatan ikan gurame. Volume semen yang sangat sedikit dan masih sedikitnya informasi mengenai kualitas dan kuantitas sperma ikan gurame menjadi kendala dalam kegiatan pemijahan buatan ikan gurame. Pengetahuan tentang kualitas sperma dibutuhkan untuk pembuahan buatan. Pemberian hormon perangsang pemijahan dapat dilakukan untuk meningkatkan volume cairan semen ikan gurame. Pada penelitian kali ini hormon yang diberikan adalah analog GnRH yang ditambahkan antidopamin atau lebih dikenal dengan nama dagang Ovaprim.
Penelitian ini bertujuan mengevaluasi efek penyuntikan Ovaprim pada tingkatan dosis yang berbeda terhadap kualitas dan kuantitas sperma ikan gurame. Dalam penelitian ini terdapat tiga macam dosis penyuntikan Ovaprim pada ikan gurame jantan yaitu 0 ml/kg bobot tubuh, 0,35 ml/kg bobot tubuh, dan 0,7 ml/kg bobot tubuh. Sedangkan pada induk betina hanya diberikan satu macam dosis penyuntikan yaitu 0,7 ml/kg bobot tubuh. Ovaprim diberikan pada ikan melalui teknik penyuntikan intramuscular. Jeda antar penyuntikan pertama dan kedua adalah 12 jam dengan volume penyuntikan pada ikan jantan adalah 50% dari volume total pada penyuntikan pertama dan 50% dari volume total pada penyuntikan ke-2. Sedangkan volume penyuntikan pada induk betina adalah 30% dari volume total pada penyuntikan pertama dan 70% dari volume total pada penyuntikan ke-2. Pemijahan atau stripping dilakukan 17 jam pasca penyuntikan ke-2. Setelah kegiatan stripping, dilakukan pengamatan hasil terhadap parameter
volume cairan semen, durasi motilitas sperma, skor motilitas sperma, jumlah sel sperma/ml cairan semen, spermatokrit, dan morfologi sperma. Pada penelitian ini tidak dilakukan pengukuran parameter derajat pembuahan dan derajat penetasan karena tiga jam pasca dilakukannya pembuahan telur oleh sperma, seluruh telur berwarna putih keruh.
Berdasarkan pengamatan yang dilakukan menunjukan hasil bahwa penyuntikan Ovaprim dosis 0,7 ml/kg bobot tubuh pada induk gurame jantan mampu meningkatkan volume cairan semen hingga 0,184±0,13 ml/kg dengan jumlah sel sperma 12.43±2.25x109 sel/ml cairan semen. Pada ikan yang diberi Ovaprim dengan dosis 0 ml/kg bobot tubuh menghasilkan cairan semen dengan volume 0,013±0,01 ml/kg bobot tubuh dengan jumlah sel sperma 10,6x109sel/ml cairan semen. Pada parameter durasi motilitas sperma terdapat perbedaan yang kecil antara durasi motilitas sperma tertinggi dari ikan yang disuntik Ovaprim dengan dosis 0,7 ml/kg bobot tubuh (103,50±2,12 detik) dengan durasi motilitas sperma terendah dari ikan yang disuntik Ovaprim dengan dosis 0,35 ml/kg bobot tubuh (101,50±2,12 detik). Akan tetapi penyuntikan Ovaprim tidak memberikan hasil yang berbeda terhadap parameter skor motilitas sperma dan spermatokrit cairan semen. Dari pengamatan lebar kepala sperma didapatkan hasil bahwa lebar kepala sperma ikan gurame adalah 4,8±1,53 µm dengan panjang ekor 42,8±5,60 µm.
Penyuntikan Ovaprim terhadap ikan gurame jantan dengan tingkatan dosis 0,7 ml/kg bobot tubuh mampu meningkatkan volume cairan semen dan jumlah sel sperma/ml cairan semen. Akan tetapi penyuntikan Ovaprim tidak memberikan pengaruh terhadap persentase padatan cairan semen (spermatokrit), nilai motilitas, dan durasi motilitas. Selain itu didapatkan hasil bahwa lebar kepala sperma ikan gurame adalah 4,8±1,53 µm dengan panjang ekor 42,8±5,60 µm.
TINGKATAN DOSIS YANG BERBEDA
A. GALIH HARDITA
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
PROGRAM STUDI TEKNOLOGI DAN MANAJEMEN PERIKANAN BUDIDAYA DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR
Judul skripsi : Evaluasi Kualitas dan Kuantitas Sperma Ikan Gurame Osphronemus gouramy Lac. dengan Penyuntikan Ovaprim pada Tingkatan Dosis yang Berbeda
Nama mahasiswa : A. Galih Hardita
Nomor pokok : C 14050466
Disetujui
Pembimbing I Pembimbing II
Prof. Dr. Ir. Muhammad Zairin Junior, M. Sc
NIP. 19590218 198601 1 001 NIP. 19661111 199103 1 003Ir. Harton Arfah, M. Si
Diketahui :
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Ir. Indra Jaya, M. Sc NIP. 19610410 198601 1 002
Puji syukur kehadirat Allah S.W.T atas rahmat dan anugrah-Nya hingga penulis mampu menyelesaikan penelitian dan skripsi dengan judul ”Evaluasi Kualitas dan Kuantitas Sperma Ikan Gurame Osphronemus gouramy Lac. dengan Penyuntikan Ovaprim pada Tingkatan Dosis yang Berbeda”.
Melalui kesempatan ini penulis mengucapkan terima kasih kepada :
1. Prof. Dr. Ir. Muhammad Zairin Junior, M. Sc dan Ir. Harton Arfah, M. Si selaku pembimbing dalam penelitian dan skripsi.
2. Bapak (Alm.) Drs. Slamet Haryono, MAP., ibunda Dra. Ita Jualita Tri Astuti, adinda Dyas dan Rafi yang selalu memberikan doa restu, dukungan semangat, dan bantuan yang kepada penulis selama menempuh studi di BDP.
3. Dr. Ir. Nur Bambang Priyo Utomo, M. Si yang telah bersedia menjadi dosen penguji tamu pada sidang skripsi.
4. Dr. Ir. Munti Yuhana, M. Sc selaku pembimbing akademik selama penulis menempuh studi di BDP.
5. Seluruh pengajar di Departemen Budidaya Perairan FPIK IPB yang telah memberikan bimbingan selama penulis menempuh studi di BDP. 6. Seluruh staf Stasiun Lapangan Lab. PBGI khususnya Pak Aam, Pak
Henda, Dedi, dan Bang Ozi atas bantuannya selama penelitian.
7. Teman-teman BDP khususnya Andhini, Mance, Azis, Gilang, Sahel, Toim, Hari, Evan, Wawang, Wanya, dan Wastu. Dan (THP42), Uli (THP42), Ade (THP42), Teteh (THP42) dan Darminto (Biokim42) atas bantuannya selama penulis melakukan penelitian dan menyusun skripsi. 8. Pak Maryanta, Mbak Yuli, Kang Asep, dan Ovie atas bantuannya
selama penyusunan skripsi ini hingga selesai.
Penulis menyadari bahwa skripsi ini jauh dari kesempurnaan dan tidak luput dari kekurangan serta kesalahan. Semoga skripsi ini bermanfaat bagi perkembangan ilmu pengetahuan khususnya bidang budidaya perairan.
Bogor, Mei 2010 Penulis
RIWAYAT HIDUP
Penulis dilahirkan di Bandar Lampung, 13 Maret 1988 anak pertama dari tiga bersaudara dari pasangan bapak (Alm.) Drs. Slamet Haryono, MAP. dan ibu Dra. Ita Jualita Tri Astuti. Penulis menyelesaikan pendidikan dasar di SD Al-Azhar 3 Way Halim pada tahun 1999. Pada tahun 2002, penulis berhasil menyelesaikan pendidikan di SLTPN 4 Bandar Lampung. Pada tahun 2005, penulis berhasil menyelesaikan pendidikan di SMAN 9 Bandar Lampung.
Tahun 2005 penulis berhasil diterima di Institut Pertanian Bogor melalui Undangan Seleksi Mahasiswa IPB (USMI) dan menyelesaikan Tingkat Persiapan Bersama (TPB) selama satu tahun. Pada tahun 2006 penulis diterima pada Mayor Teknologi dan Manajemen Perikanan Budidaya, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Selama menjadi mahasiswa penulis pernah menjadi pengurus Himpunan Mahasiswa Akuakultur (Himakua) pada tahun kepengurusan 2006/2007. Penulis juga pernah menjadi asisten mata kuliah Oseanografi Umum tahun 2007/2008 dan 2008/2009 jenjang S1, asisten mata kuliah Dasar-dasar Genetika Ikan 2007/2008 dan 2008/2009 jenjang S1, asisten mata kuliah Teknologi Produksi Pakan Alami, Bentos, dan Alga 2008/2009 jenjang S1, asisten mata kuliah Fisiologi Reproduksi Biota Akuatik 2008/2009 jenjang D3 dan Teknik Pengembang Biakan Ikan 2008/2009 jenjang D3. Untuk menambah wawasan dan pengetahuan di bidang perikanan penulis juga pernah melakukan Praktek Lapang Akuakultur Pembenihan Udang Vanamei di PT. Biru Laut Khatulistiwa, Lampung.
Sebagai salah satu syarat memperoleh gelar sarjana dalam bidang perikanan penulis melakukan penelitian dan menyusun skripsi dengan judul “Evaluasi Kualitas dan Kuantitas Sperma Ikan Gurame Osphronemus gouramy Lac. dengan Penyuntikan Ovaprim pada Tingkatan Dosis yang Berbeda”.
i
Halaman
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
DAFTAR LAMPIRAN... v
I. PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
II. TINJAUAN PUSTAKA 2.1 Biologi Ikan Gurame Osphronemus gouramy Lac... 3
2.2 Spermatogenesis... 4
2.3 Kontrol Hormonal dan Manipulasi Hormonal pada Pemijahan ... 8
2.4 Rangsangan Spermiasi dengan Analog GnRH ...10
III. METODOLOGI 3.1 Waktu dan Tempat ...13
3.2 Induk...13 3.3 Metode Penelitian...13 3.4 Prosedur Kerja...14 3.4.1 Seleksi Induk ...14 3.4.2 Penyuntikan Ovaprim ...14 3.4.3 Pemijahan...15
3.4.4 Pembuatan Preparat Ulas Sperma ...17
3.4.5 Pengamatan Hasil ...17
3.5 Analisis Data ...20
IV. HASIL DAN PEMBAHASAN 4.1 Hasil...21
4.1.1 Volume Cairan Semen ...21
4.1.2 Durasi dan Penentuan Skor Motilitas Sperma...22
4.1.3 Jumlah Sel Sperma dan Spermatokrit ...24
4.1.4 Morfologi Sperma...26
ii V. KESIMPULAN DAN SARAN
5.1 Kesimpulan ...32
5.2 Saran ...32
DAFTAR PUSTAKA ...33
iii
Halaman 1 Kriteria skor motilitas sperma ...18 2 Ukuran lebar kepala dan panjang ekor sperma ikan gurame...26
iv
DAFTAR GAMBAR
Halaman
1 Ikan gurame Osphronemus gouramy Lac. ... 3
2 Proses spermatogenesis... 5
3 Proses spermatogenesis dan spermiogenesis oleh kelenjar endokrin pada ikan teleostei jantan ... 9
4 Volume cairan semen ikan gurame tiap perlakuan dosis Ovaprim ...21
5 Durasi motilitas sperma ikan gurame tiap perlakuan dosis Ovaprim ...22
6 Skor motilitas sperma ikan gurame tiap perlakuan dosis Ovaprim ...23
7 Jumlah sel sperma/ml cairan semen ikan gurame tiap perlakuan dosis Ovaprim...24
8 Spermatokrit cairan semen ikan gurame tiap perlakuan dosis Ovaprim...25
v
Halaman 1 Bobot dan volume cairan semen ikan gurame Osphronemus gouramy Lac.
dengan dosis penyuntikan Ovaprim yang berbeda ...37 2 Rata-rata volume cairan semen ikan gurame Osphronemus gouramy Lac.
dengan dosis penyuntikan Ovaprim yang berbeda ...37 3 Bobot, durasi dan skor motilitas sperma ikan gurame Osphronemus gouramy
Lac. dengan dosis penyuntikan Ovaprim yang berbeda ...38 4 Rata-rata durasi dan skor motilitas sperma ikan gurame Osphronemus
gouramy Lac. dengan dosis penyuntikan Ovaprim yang berbeda...38 5 Bobot, jumlah sel sperma/ml dan spermatokrit cairan semen ikan gurame
Osphronemus gouramy Lac. dengan dosis penyuntikan Ovaprim yang berbeda ...39 6 Rata-rata jumlah sel sperma/ml dan spermatokrit cairan semen ikan gurame
Osphronemus gouramy Lac. dengan dosis penyuntikan Ovaprim yang berbeda ...39 7 Data hasil pengukuran lebar kepala dan panjang ekor sperma ikan gurame
Osphronemus gouramy Lac...40 8 Tabel sidik ragam volume cairan semen ikan gurame Osphronemus gouramy
Lac. dengan dosis penyuntikan Ovaprim yang berbeda ...41 9 Tabel sidik ragam durasi motilitas sperma ikan gurame Osphronemus
gouramy Lac. dengan dosis penyuntikan Ovaprim yang berbeda...42 10 Tabel sidik ragam jumlah sel sperma/ml ikan gurame Osphronemus gouramy Lac. dengan dosis penyuntikan Ovaprim yang berbeda ...43
I. PENDAHULUAN
1.1 Latar Belakang
Ikan gurame Osphronemus gouramy Lac. adalah salah satu ikan konsumsi air tawar yang berasal dari Indonesia dan sudah banyak dikenal oleh masyarakat serta memiliki nilai ekonomis yang tinggi. Akan tetapi, pasokan ikan gurame sering kali tidak mencukupi permintaan pasar. Hal ini dapat disebabkan beberapa kendala dalam budidaya ikan gurame. Beberapa kendala dalam budidaya ikan gurame antara lain pertumbuhannya yang relatif lambat jika dibandingkan ikan konsumsi air tawar lainnya, seperti ikan nila dan ikan lele. Selain itu, ketersediaan benih ikan gurame yang tidak kontinyu dan masih sangat terbatas. Sementara itu, benih merupakan salah satu faktor dapat terlaksananya kegiatan budidaya.
Ketersediaan benih yang tidak kontinyu dan masih sangat terbatas terjadi karena benih ikan gurame yang banyak digunakan tersebut masih merupakan hasil dari pemijahan alami. Di perairan bebas, ikan gurame berbiak pada musim kemarau, tetapi di kolam-kolam dapat berbiak sepanjang tahun (Sumantadinata, 1983). Ikan gurame dapat memijah secara spontan, akan tetapi belum dapat dipijahmasalkan secara serentak (Zairin, 2003). Permintaan benih ikan gurame dari tahun ke tahun cenderung mengalami peningkatan. Oleh karena itu, diperlukan teknologi intensif dalam pemijahan ikan gurame yang dapat menunjang ketersediaan benih. Agar budidaya dapat berjalan dengan baik maka diperlukan ketersediaan benih yang tepat waktu, tepat jumlah, tepat kualitas, dan tepat harga. Untuk mencapai hal tersebut maka kontrol sepenuhnya terhadap siklus reproduksi ikan di dalam sistem budidaya mutlak diperlukan (Zairin, 2003). Salah satu cara untuk mengatasi masalah ketersediaan benih ikan gurame yang tidak kontinyu dan masih terbatas adalah dengan metode pemijahan secara buatan. Pada jenis ikan yang sudah dapat dipijahkan di kolam, cara pemijahan dengan penyuntikan biasanya digunakan untuk efisiensi penggunaan induk serta peningkatan kualitas dan kuantitas anak ikan (Sumantadinata, 1983). Pengetahuan tentang kualitas sperma dibutuhkan untuk pembuahan buatan dan cara penanganan sperma. Akan tetapi, terkadang kualitas dan kuantitas sperma tidak mencukupi kebutuhan yang ada, dan sering kali menjadi hambatan dalam kegiatan
budidaya, terutama pembuahan buatan. Motilitas sperma adalah parameter yang umum digunakan untuk mengetahui kualitas sperma. Percobaan terdahulu yang meneliti teknik pemijahan ikan gurame secara buatan telah dilakukan oleh Maftuca (2005). Akan tetapi hasil yang didapatkan masih belum maksimal. Salah satu kendala yang ditemui adalah sangat sedikitnya sperma yang dihasilkan oleh induk jantan. Salah satu cara peningkatan jumlah sperma adalah dengan memberikan rangsangan hormonal pada induk jantan.
Pemberian rangsangan hormonal pada induk jantan dapat meningkatkan jumlah sperma yang dihasilkan. Menurut Affandi dan Tang (2002), penggunaan hormon atau zat perangsang pada ikan mas jantan dapat meningkatkan volume cairan semen dan kualitas sperma. Selain itu, menurut Moon et al. (2002), pemberian hormon GnRH mampu meningkatkan volume cairan semen dan jumlah sel sperma pada Platichthys stellatus. Produksi cairan semen dan sperma pada ikan – ikan teleostei dewasa dapat dipacu melalui pemberian Human Chorionic Gonadotropin (HCG) atau Gonadotrophin Releasing Hormone analog atau sintetisnya (GnRHa) (Zohar dan Mylonas, 2001).
1.2 Tujuan
Penelitian ini bertujuan mengevaluasi efek penyuntikan Ovaprim pada tingkatan dosis yang berbeda terhadap kualitas dan kuantitas sperma ikan gurame.
II. TINJAUAN PUSTAKA
2.1 Ikan Gurame Osphronemus gouramy Lac.
Klasifikasi dan sistematika ikan gurame Osphronemus gouramy Lac. menurut Saanin (1984) adalah sebagai berikut :
Filum: Chordata Kelas: Pisces Ordo: Labirinthici Subordo: Anabantoidei Famili: Anabantidae Genus: Osphronemus
Spesies: Osphronemus gouramy Lac.
Gambar 1. Ikan gurame Osphronemus gouramy Lac.
Ikan gurame adalah ikan budidaya yang berasal dari rawa. Berat badannya bisa mencapai 6-8 kilogram per ekor meskipun pertumbuhannya lambat. Ikan ini adalah ikan omnivor yang menyukai tumbuh-tumbuhan (Sumantadinata, 1983). Jenis kelamin pada ikan gurame dapat diketahui berdasarkan ciri kelamin sekundernya. Beberapa ciri untuk membedakan ikan gurame jantan dan betina diantaranya perbedaan-perbedaan pada kepala, dasar sirip dada, operculum, dan sirip ekor. Ikan gurame jantan yang sudah tua mempunyai “cula” (semacam tonjolan pada kepala, antara bibir atas dengan mata), sedangkan yang betina tanpa “cula” ini. Makin tua ikan jantan, makin besar “cula”nya. Dasar sirip dada ikan jantan keputih-putihan, sedangkan betina agak hitam. Operculum berwarna kekuning-kuningan pada ikan jantan dan berwarna putih agak coklat pada ikan betina. Ujung sirip ekor ikan jantan relatif rata, sedangkan ikan betina lebih melengkung (Sumantadinata, 1983).
Pada umumnya ikan gurame dapat mulai dipijahkan pada umur sekitar 4-5 tahun, yaitu ketika individu mencapai berat berat sekitar 1,5-2 kilogram (Sumantadinata, 1983). Ikan betina yang sudah matang telur dicirikan oleh perutnya yang membundar dan agak lunak kalau diraba. Biasanya ikan gurame dapat dipijahkan setiap 3-4 bulan sekali. Induk betina yang sudah dipijahkan 6-7 kali, perlu diganti oleh induk yang baru (Sumantadinata, 1983).
2.2 Spermatogenesis
Spermatogenesis adalah proses yang terjadi secara terorganisir yang mencakup perubahan sel spermatogonia diploid menjadi sperma yang haploid (Segatelli et al., 2009). Menurut Mruk and Cheng (2004), spermatogenesis adalah proses dari satu spermatogonia menjadi 256 sperma dan tiap – tiap sperma mampu membuahi telur yang matang. Spermatogenesis dibagi menjadi tiga tahap utama, yaitu pembelahan spermatogonia, meiosis, dan spermiogenesis (Ozaki et al., 2006).
Menurut Sukumasavin (2007), proses spermatogenesis meliputi pembelahan mitosis untuk memproduksi sel kelamin dalam jumlah besar dan meiosis unutk menciptakan variasi genetik dan pengurangan kromosom menjadi setengahnya. Proses ini dipengaruhi oleh faktor lingkungan yang diterima oleh otak dan diteruskan ke hipotalamus. Hipotalamus akan melepas Gonadotrophin Releasing Hormone (GnRH) yang akan bekerja pada hipofisa, menghasilkan Follicel Stimulating Hormon (FSH) dan Luteneizing Hormon (LH). Selanjutnya FSH merangsang Leydig cells pada testis untuk memproduksi testosteron. Testosteron akan menyebabkan spermatogonia (2n) mengalami pembelahan mitosis menjadi spermatosit pertama (2n). Spermatosit pertama akan mengalamami pembesaran ukuran dan mengurangi jumlah kromosomnya melalui pembelahan meiosis pertama, dan menjadi spermatosit kedua (n). Spermatosit kedua selanjutnya berkembang menjadi spermatid pada akhir pembelahan meiosis. Selanjutnya LH akan dilepaskan dan merangsang Leydig cells untuk memprooduksi 11-ketotestosteron, yang menyebabkan spermatid mengalami pertumbuhan ekor menjadi sperma (Gambar 2). Sperma adalah sperma dewasa yang berada pada lumen testis. Selanjutnya 17α-20β-dihidroprogesteron yang
5
berasal dari rangsangan LH, menyebabkan sperma dihirasi oleh larutan seminal yang menghasilkan larutan sperma yang disebut cairan semen. Menurut Waynarovich dan Horvath (1980), spermatogonia primitif akan mengalami pembelahan mitosis di dinding testis. Dari spermatogonia, spermatosit primer akan berkembang menjadi dua sel spermatosit sekunder. Tiap spermatosit sekunder akan berkembang menjadi dua sel sperma atau sperma. Selanjutnya sperma akan berkumpul pada tubulus testis dan akan mengalami fase dorman hingga mendapat sinyal lingkungan yang sesuai, ketika ada mekanisme kerja Gonadotropin, dan betina siap memijah. Meskipun dalam fase dorman dan tidak motil dalam testis, sperma akan motil bila ada kontak dengan air sehingga mampu membuahi sel telur yang sudah matang.
Gambar 2. Proses spermatogenesis (www.bio1151.nicerweb.com, 2009) Sperma adalah gamet jantan yang dihasilkan oleh testis (Afandi dan Tang, 2002). Sperma merupakan suatu sel kecil, kompak dan sangat khas, yang tidak bertumbuh dan membagi diri (Toelihere, 1981). Secara garis besar, sperma ikan yang sudah matang terdiri dari 2 bagian yaitu kepala dan ekor. Ginzburg (1972)
mengemukakan bahwa pada umumnya sperma terdiri atas dua bagian, yaitu bagian kepala dan ekor. Menurut Affandi dan Tang (2002), kepala sperma berbentuk bulat atau oval. Panjang pendeknya ukuran ekor sperma dapat menentukan keaktifan sperma dalam bergerak. Semakin panjang ekor sperma maka semakin aktif sperma tersebut bergerak.
Ukuran sel sperma sangat kecil. Pada umunya ukuran panjang kepala sperma antara 2-3 µm dan panjang total spermanya antara 40-60 µm (Affandi dan Tang, 2002). Beberapa spesies ikan teleostei, ukuran kepala spermanya adalah 2-3 µm. Selain itu diameter lubang mikrofil berhubungan erat dengan lebar kepala sperma. Lebar kepala sperma Oncorhynchus keta adalah 3 µm dan diameter lubang mikrofil telurnya adalah 3 µm, lebar kepala sperma Salmo salar adalah 3,5-4 µm dengan diameter lubang mikrofil 3-4 µm, lebar kepala sperma Salmo trutta m. lacustris adalah 3 µm dan diameter lubang mikrofil telurnya adalah 3 µm, lebar kepala sperma Carrasius carrasius adalah 3,2 µm dan diameter lubang mikrofil telurnya adalah 3,5-4 µm, dan lebar kepala sperma Crenilabrus griseus adalah 1,7-1,8 µm dan diameter lubang mikrofil telurnya adalah >2 µm. Akan tetapi, beberapa hal yang harus diperhatikan adalah peningkatan salinitas larutan dan beberapa bahan kimia dapat menyebabkan ukuran kepala sperma mengalami pembesaran atau pembengkakan (Ginzburg, 1972).
Sperma ikan yang fertilisasinya berlangsung secara internal mempunyai selubung mitokondria pada bagian tengahnya yang dibutuhkan untuk aktifitas metabolik yang ekstensif termasuk glikolisis. Sperma tersebut dapat bertahan hidup beberapa bulan di dalam saluran reproduksi betina. Sedangkan pada ikan-ikan yang fertilisasinya berlangsung secara eksternal struktur sperma sangat sederhana dan masa hidupnya pendek sesudah dilepaskan ke perairan (Ernawati, 1999). Menurut Waynarovich dan Horvath (1980), waktu motilitas sperma sangat pendek dan bergantung pada suhu air. Sperma ikan-ikan perairan hangat bergerak menggunakan ekornya dengan waktu motil antara setengah hingga satu menit. Ginzburg (1972), mengatakan bahwa durasi motilitas pada ikan-ikan yang memijah di air tawar tidak lebih dari 2-3 menit. Pada rainbow trout Oncorhynchus mykiss, durasi motilitas spermanya adalah 72,4±26,98 detik (Bozkurt, 2006). Menurut Fitzpatrick (2005), motilitas sperma coho salmon Oncorhynchus kisutch
7
mengalami penurunan yang signifikan pada detik ke 20 dan ke 30 setelah aktivasi. Hal ini terjadi pada tiap kelompok perlakuan yaitu sperma yang diperoleh secara alami, melalui stripping, dan pengambilan langsung dari gonad. Akan tetapi proporsi tertinggi sperma yang motil pada 10 detik setelah aktivasi adalah sperma yang berasal dari ikan jantan yang di-stripping biasa. Pada percobaan yang dilakukan oleh He dan Woods (2004), durasi motilitas sperma striped bass Morone saxatilis adalah 29±0,6 detik dan 29±0,5 detik. Menurut Schiavone et al. (2006), durasi motilitas European sea bass Dicentrarchus labrax murni yang diberi perlakuan HCG 1000 IU kg-1 adalah 67±10 detik sampai 83±5 detik. Sedangkan pada ikan yang tidak diberi perlakuan hormon memiliki durasi motilitas sperma antara 68±18 detik hingga 80±8 detik. Selain itu skor motilitas dari European sea bass Dicentrarchus labrax murni yang diberi perlakuan hormon berkisar antara 4,2-4,6 (80-100% sperma bergerak maju) dan pada ikan yang tidak diberi perlakuan hormon berkisar antara 4,2-4,5 (80-100% sperma bergerak maju). Menurut Joachim (1983), sperma ikan imotil di dalam cairan plasma dan baru bergerak apabila telah bercampur dengan air. Respon rangsangan aktivitas spermatozoa tergantung pada pH, tekanan osmosis, dan kandungan ion pada medium yang mengelilinginya.
Menurut Huet (1971), 1 ml cairan semen mengandung kurang lebih 10 miliar sperma. Selanjutnya Ginzburg (1972) mengemukakan bahwa dalam 1 ml cairan semen ikan mengandung 20 miliar sperma. Jumlah sel sperma dalam 1 cm3 diduga berkisar antara 10-20 miliar sel sperma (Waynarovich dan Horvath, 1980). Menurut Schiavone et al. (2006) melaporkan bahwa jumlah sel sperma European sea bass Dicentrarchus labrax yang diberi perlakuan HCG 1000 IU kg-1 adalah 53±8x109sel/ml sampai58±8x109sel/ml. Sedangkan pada ikan yang tidak diberi perlakuan menghasilkan jumlah sel sperma 50±8x109 sel/ml sampai 55±8x109 sel/ml. Menurut Bozkurt (2006), jumlah sel sperma pada rainbow trout (Oncorhynchus mykiss) adalah 7,7±4,431x109sel/ml cairan semen. Menurut Lim et al. (2004), pada ikan Greenback flounder Rhomboselea tapirina yang tidak diberi perlakuan GnRH konsentrasi sel spermanya adalah 108,9±12,3x106/ml, pada ikan yang diberi perlakuan 50 µg/kg GnRH konsentrasi sel spermanya adalah 100,1±15,7x106/ml, pada ikan yang diberi perlakuan 100 µg/kg GnRH
konsentrasi sel spermanya adalah 77,5±10,1x106/ml, dan pada ikan yang diberi perlakuan 200 µg/kg GnRH konsentrasi sel spermanya adalah 72,2±9,9x106/ml. Menurut Kucharczyk et al. (2005), pemberian treatment GnRH pada Abramis brama menghasilkan cairan semen dengan kepadatan 10,2±1,4x109 sel/ml, sedangkan ikan kontrol menghasilkan cairan semen dengan kepadatan 6,8±1,1x109sel/ml.
2.3 Kontrol Hormonal dan Manipulasi Hormonal pada Pemijahan
Kegiatan pemijahan pada ikan diatur oleh faktor lingkungan eksternal yang selanjutnya akan mempengaruhi faktor internal yang selanjutnya akan berpengaruh pada organ reproduksi. Menurut Zairin (2003), ada tiga faktor yang terlibat dalam reproduksi ikan, yaitu sinyal lingkungan, sistem hormon serta organ reproduksi. Untuk ikan-ikan yang hidup di alam, sinyal lingkungan bukanlah suatu masalah untuk kegiatan pemijahan. Akan tetapi, untuk beberapa ikan yang dipelihara di lingkungan budidaya, sinyal lingkungan terkadang menjadi masalah untuk kegiatan pemijahan. Kondisi lingkungan yang berbeda antara wadah budidaya dan lingkungan alami sering kali menjadi penghambat yang menyebabkan kegagalan pemijahan ikan di lingkungan budidaya.
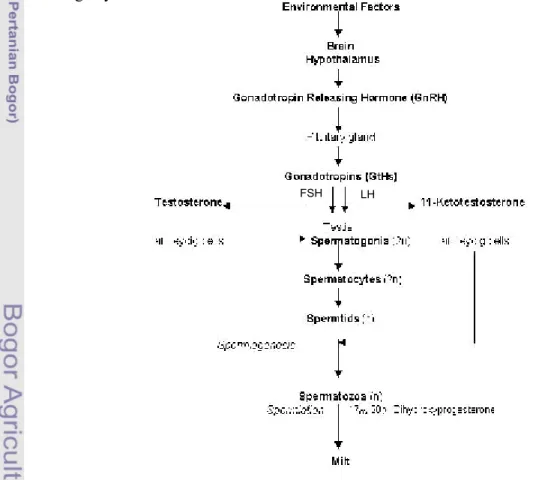
Faktor lingkungan eksternal akan diterima oleh sistem syaraf pusat yang kemudian diteruskan ke hipotalamus. Hipotalamus akan melepaskan Gonadotropin Realeasing Hormone (GnRH) yang akan merangsang kelenjar pituitari untuk memproduksi Hormon Gonadotropin (GtH) (Gambar 3). Sejalan dengan dilepasnya GnRH oleh hipotalamus, akan dilepas juga faktor penghambat hormon gonadotropin, yaitu dopamine. Hormon Gonadotropin yang diproduksi oleh kelenjar pituitari akan merangsang gonad untuk mensintesis steroid dan prostagladin yang menyebabkan ikan memijah (Rottman et al., 1991). Menurut Zairin (2003), pada proses pemijahan kelenjar hipofisa tidak mensekresikan hormon FSH yang berperan dalam pematangan gonad, akan tetapi akan mensekresikan hormon LH. Menurut Lin dan Peter (1996), hormon LH diproduksi oleh kelenjar hipofisa setelah mendapat rangsangan GnRH dan dihambat oleh dopamine.
9
Manipulasi hormon adalah salah satu upaya untuk mengatasi kegagalan pemijahan ikan di lingkungan budidaya. Menurut Zairin (2003), ada tiga cara yang dapat digunakan untuk mengatasi kegagalan ini yaitu penyuntikan ekstrak kelenjar hipofisa, penyuntikan analog LHRH, dan sistem induksi. Sedangkan menurut Rottman et al. (1991), ada lima cara yang dapat digunakan untuk mengatasi kegagalan pemijahan ikan di lingkungan budidaya yaitu, penyuntikan ekstrak kelenjar hipofisa, gonadotropin murni, analog LHRH, kombinasi analog LHRH dan zat penghambat dopamine dan steroid. Organ target dari tiap penyuntikan berbeda-beda. Misalnya pada penyuntikan ekstrak kelenjar hipofisa organ targetnya adalah gonad, karena kelenjar hipofisa mengandung hormon gonadotropin yang akan merangsang terjadinya pemijahan. Menurut Zairin (2003), selain mengandung hormon Gonadotropin, ekstrak kelenjar hipofisa mengandung hormon lain seperti prolaktin, hormon tumbuh, somalaktin, dan sebagainya.
Gambar 3. Proses spermatogenesis dan spermiogenesis oleh kelenjar endokrin pada ikan teleostei jantan (Sukumasavin, N., 2007)
LH FSH
Metode manipulasi hormon lain yang banyak digunakan adalah penyuntikan analog LHRH. LHRH adalah hormon dari golongan protein yang dihasilkan oleh hipotalamus. Hormon ini molekulnya sangat kecil dibandingkan dengan hormon lainnya yang terdiri dari 10 asam amino (dekapeptida). LHRH sebenarnya sama persis dengan GnRH. Karena waktu paruhnya pendek sehingga mudah terurai dari dalam tubuh, maka para ahli menciptakan LHRH sintetik yang lebih tahan dan dikenal dengan analog LHRH (Zairin, 2003).
Penyuntikan analog LHRH bertujuan untuk merangsang hipofisa agar mensintesis hormon Gonadotropin yang akan merangsang pemijahan. Akan tetapi, sintesin hormon Gonadotropin akan terhambat oleh dopamine. Pada beberapa spesies penyuntikan analog LHRH saja, misalnya goldfish, redtailed black shark, rainbow shark, tidak memberikan respon yang positif (Rottman et al., 1991). Selain itu, menurut Lin dan Peter (1996), pada goldfish dan catfish, pengaruh penghambatan oleh dopamine sangat kuat. Hal ini dibuktikan dengan penyuntikan zat penghambat dopamine, misalnya domperidon (DOM), memberikan efek yang sama dengan dengan analog GnRH, dan merangsang pelepasan LH dan ovulasi. 2.4 Rangsangan Spermiasi dengan Analog GnRH
Ovaprim adalah peptida dalam bentuk cairan yang digunakan untuk memanipulasi musim pemijahan, mengatur waktu pemijahan, dan meningkatkan produksi sperma pada jantan, dengan aman dan hasil yang dapat diperkirakan. Ovaprim adalah produk buatan Syndel Laboratories, Vancouver, British Columbia, Canada. Ovaprim mengandung salmon Gonadotropin Releasing Hormone analog (sGnRHa [D-Arg6-Pro9- NetsGnRH]) dan dopamine antagonis, domperidone. Ovaprim ditemukan pada tahun 1980-an dan lebih efektif dari Luteinizing Hormone Releasing Hormone (LHRH) yang dapat merangsang pengeluaran hormon gonadotropin pada ikan (Abdullah, 2007). Analog LHRH dan Dopamin antagonis dijual dengan nama. Ovaprim-C merupakan suatu produk komersial yang diproduksi oleh Syndell Laboratories. Ovaprim – C dikemas dalam 1 botol bervolume 10 ml. Setiap 1 ml ovaprim – C mengandung 20µg sGnRH (D-Arg6, Trp7, Leu8, Pro9 Net)-LH-RH dan 10 mg domperidone
11
(Nandeesha, 1990). Produk ini merupakan suatu suplemen peptida cair yang memiliki beberapa fungsi, diantaranya yaitu (Anonimus, 2009b):
Mempersingkat musim pemijahan Mengatur musim pemijahan
Meniingkatkan propduksi sperma pada ikan jantan Hasil dari pemijahan lebih aman dan dapat diprediksi
Di Indonesia, khususnya di sentra-sentra pembenihan ikan, ovaprim-c sering digunakan sebagai hormon perangsang pemijahan pada ikan. Dalam merangsang ikan memijah, pemakaian ovaprim-c lebih efektif daripada implantasi ekstrak hipofisa. Dosis pemakaian dari ovaprim-c sebesar 0,5 ml/kg untuk ikan konsumsi dan 0,7 ml/kg untuk ikan hias.
Proses spermatogenesis dan spermiasi dipengaruhi oleh hormon Gonadotropin. Hormon Gonadotropin akan merangsang sintesis testosteron dan 11-ketotestosteron yang mengakibatkan spermatogenesis dan spermiasi. Hal ini ditunjukan peningkatan kadar testosteron dan 11-ketotestosteron pada Anguila japonica yang diberi suntikan HCG (Nagahama, 1994). Menurut Schiavone et al. (2006), pemberian HCG 1000 IU kg-1 setiap minggu selama 3 minggu pada European sea bass Dicentrarchus labrax galur murni menghasilkan cairan semen kira-kira 3,6 ml/kg bobot tubuh, sedangkan yang tidak diberi HCG hanya 1,1 ml/kg bobot tubuh. Jadi untuk meningkatkan produksi hormon Gonadotropin yang berperan pada spermatogenesis dan spermiasi, ikan dapat diberi treatment GnRH atau dopamine antagonis.
GnRH adalah produk hipotalamus yang akan merangsang hipofisa untuk mensekresikan hormon Gonadotropin. Hormon Gonadotropin akan bekerja pada gonad dan merangsang sekresi testosteron dan 11-ketotestoseron. Matty (1985), penyuntikan LHRH sintetik dapat meningkatkan pelepasan hormon Gonadotropin dalam plasma dari beberapa spesies teleostei. Menurut Kucharczyk et al. (2005), pemberian treatment GnRH pada Abramis brama menghasilkan cairan semen yang lebih banyak (4,4±0,2 ml/kg) dibandingkan kontrol yang tidak diberi treatmen hormon apapun (2,1±0,3 ml/kg), selain itu kualitas sperma yang dihasilkan juga paling baik dibandingkan perlakuan lainnya dan kontrol. Penelitian yang dilakukan Lim et al. (2004), menunjukan bahwa Rhombosolea
tapirina yang diberi perlakuan GnRH 200 µg/kg bobot tubuh melalui implan pellet kolesterol menghasilkan volume cairan semen antara 400 µl/100 gram bobot tubuh sampai 600 µl/100 gram bobot tubuh. Jika dibandingkan dengan perlakuan kontrol tanpa GnRH yang menghasilkan kurang dari 100 µl/100 gram bobot tubuh. Menurut Moon et al. (2003), pada Platichthys stellatus yang diberi implan pellet kolesterol GnRH dengan dosis 200 µg/kg bobot tubuh menghasilkan volume cairan semen tertinggi yaitu 7,8 ml/kg bobot tubuh, pada ikan yang diberi dosis 100 µg/kg bobot tubuh memberikan hasil produksi cairan semen 5,2 ml/kg bobot tubuh, pada ikan yang diberi dosis 50 µg/kg bobot tubuh memberikan hasil produksi cairan semen 4,5 ml/kg bobot tubuh, dan pada ikan yang tidak diberi implan pellet kolesterol GnRH dan diberi implan pellet kolesterol tanpa GnRH menghasilkan cairan semen 0,8 ml/kg bobot tubuh. Penyuntikan pimozide dosis 10 mg/kg+LHRH dosis 10 µg/kg bobot badan pada ikan Mas menghasilkan cairan semen 4.29±310 ml/kg bobot badan, sedangkan tanpa disuntik hanya menghasilkan cairan semen 0.49±0.34 ml/kg bobot badan (Billard et al., 1987).
III. METODOLOGI
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan November 2009 sampai dengan Februari 2010 di Stasiun Lapangan Laboratorium Reproduksi dan Genetika Organisme Akuatik, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Pembuatan preparat histologi sperma dilakukan di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Dokumentasinya dilakukan di Laboratorium Embriologi dan Laboratorium Histologi, Fakultas Kedokteran Hewan Institut Pertanian Bogor.
3.2 Induk
Induk yang digunakan dalam penelitian kali ini adalah ikan gurame yang sudah berumur 4-5 tahun dengan ukuran 2-3,5 kilogram dan telah mencapai matang gonad. Jumlah induk yang digunakan adalah 9 ekor induk jantan dan 3 ekor induk betina. Induk-induk ini berasal dari desa Ciseeng Kabupaten Bogor. Selanjutnya induk dipelihara di kolam dengan dasar tanah dan diberi pakan
3.3 Metode Penelitian
Sembilan ekor induk jantan ikan gurame dan tiga ekor induk betina ikan gurame yang telah matang gonad, mendapatkan perlakuan dengan dosis penyuntikan ovaprim yang berbeda. Dosis penyuntikan ovaprim untuk induk jantan ikan gurame adalah 0 ml/kg, 0,35/kg, dan 0,7 ml/kg,. Jeda antar tiap penyuntikan adalah 12 jam dan jeda antara penyuntikan ke-2 hingga stripping adalah 17 jam. Penentuan dosis penyuntikan dan waktu inkubasi ini didapatkan berdasarkan penelitian pendahuluan yang telah dilakukan. Masing-masing perlakuan di ulang sebanyak tiga kali. Sedangkan dosis penyuntikan induk betina hanya satu macam yaitu 0,7 ml/kg yang diberikan dengan dua kali penyuntikan. Jeda antar tiap penyuntikan adalah 12 jam dan jeda antara penyuntikan ke-2 hingga stripping adalah 17 jam.
3.4 Prosedur Kerja
Prosedur kerja yang dilakukan pada penelitian kali ini adalah seleksi induk, penyuntikan ovaprim, pemijahan, pembuatan preparat ulas sperma, dan pengamatan hasil.
3.4.1 Seleksi Induk
Seleksi induk adalah tahapan yang dilakukan untuk mendapatkan induk ikan gurame yang sudah matang gonad dan siap dipijahkan. Kriteria induk yang digunakan adalah induk dengan umur lebih dari 4 tahun, memiliki bobot minimal 2 kilogram. Tahapan yang pertama dilakukan adalah penjaringan induk jantan yang dipelihara di kolam pemeliharaan yang terpisah dengan induk betina. Dari induk-induk jantan yang berhasil ditangkap, dilakukan stripping ringan di bagian perut ke arah lubang genital. Apabila keluar berwarna cairan putih susu, induk tersebut yang digunakan. Hal ini dilakukan untuk mengetahui ada atau tidaknya sperma yang dikandung oleh induk jantan. Sedangkan induk betina diseleksi dengan cara pemuasaan induk betina selama 3 hari. Induk yang selanjutnya dipilih adalah induk yang sudah dipuasakan tetapi secara visual terlihat perutnya sudah membesar. Hal ini bertujuan untuk mengetahui apakah perut induk besar karena pakan atau telur. Jika induk tersebut mengandung telur, maka setelah pemuasaan perut induk tetap besar dan diraba dengan perlahan pada bagian perut terasa lembek. Selanjutnya dilakukan penjaringan dan dilakukan stripping ringan terhadap induk betina di bagian perut ke arah lubang genital, apabila terlihat seperti ada telur berwarna kuning bening yang akan keluar dari luubang genital, maka induk tersebut yang akan digunakan.
3.4.2 Penyuntikan Ovaprim
Induk-induk hasil seleksi yang sudah matang gonad, selanjutnya ditimbang dan diletakkan di dalam happa berukuran 1x1x1 m yang berada di dalam bak beton dengan dimensi 4x3x1 m. Tiap induk jantan dan induk betina ikan gurame diletakkan dalam happa yang terpisah di dalam bak beton yang sama. Hal ini dilakukan agar ikan antar perlakuan tidak tertukar dan mempermudah dalam proses penangkapan. Selain itu untuk mencegah terjadinya pemijahan yang tidak
15
diharapkan akan tetapi masih ada pengaruh antara induk jantan dan betina. Penimbangan dilakukan untuk mengetahui dosis Ovaprim yang akan disuntikkan ke tiap-tiap ikan. Sebelum disuntikkan ke ikan, Ovaprim diencerkan menggunakan aquabides dengan perbandingan 1:1. Pada saat dilakukan penyuntikan, bagian kepala induk ditutupi dengan kain basah untuk mengurangi stres dan mencegah ikan berontak yang dapat mengakibatkan luka pada ikan. Penyuntikan dilakukan sebanyak dua kali dengan teknik penyuntikan intramuscular. Setelah penyuntikan pertama, masing-masing induk diletakkan pada happa yang berbeda agar memudahkan pada proses penyuntikan ke-2.
Pada penyuntikan ke-2 ikan tidak lagi ditimbang akan tetapi langsung disuntik sejumlah sisa penyuntikan pada dosis pertama. Apabila penyuntikan dilakukan pada bagian tubuh sebelah kanan, maka pada penyuntikan kedua dilakukan pada bagian tubuh sebelah kiri dan begitu juga sebaliknya. Jeda antar penyuntikan pertama dan ke-2 adalah 12 jam. Untuk induk jantan gurame, pada penyuntikan pertama diberikan 50% dari total dosis yang akan diberikan dan sisanya sebesar 50% dari dosis total diberikan pada pentuntikan ke-2. Sedangkan pada induk betina ikan gurame, pada penyuntikan pertama diberikan 30% dari total dosis yang akan diberikan. Pada penyuntikan ke-2 ovaprim yang diberikan adalah 70% dari dosis total. Jeda antar penyuntikan pertama dan ke-2 adalah 12 jam, sedangkan jeda antara penyuntikan ke-2 hingga stripping adalah 17 jam. 3.4.3 Pemijahan
Setelah tahapan penyuntikan dilaksanakan, induk jantan dan betina ikan gurame tetap diletakkan di dalam happa yang berbeda pada bak beton yang sama. Hal ini dilakukan untuk mempermudah penangkapan saat akan dilakukan stripping dan agar ikan tidak tertukar, selain itu agar tidak terjadi pemijahan yang tidak diharapkan. Induk jantan dan betina dibiarkan di dalam happa sebelum dilakukan stripping. Jeda antara penyuntikan ke-2 hingga stripping adalah 17 jam. Sebelum dilakukan stripping pada induk betina, induk jantan di-stripping terlebih dahulu.
Induk jantan yang akan diambil spermanya diletakkan pada posisi terbalik dengan perut menghadap ke atas sambil ditutup kepalanya menggunakan kain
basah. Selanjutnya bagian lubang genital dikeringkan menggunakan kertas tissue. Hal ini dilakukan untuk mencegah terjadinya kontak sperma dengan air. Kemudian dilakukan pengurutan secara perlahan pada bagian perut ke arah lubang genital, sperma yang keluar dikumpulkan menggunakan syringe 1 ml yang jarumnya telah dilepas. Ketika sperma dikumpulkan menggunakan syringe saat stripping dilakukan, usahakan tidak ada urine yang ikut tersedot ke dalamnya. Sperma yang didapat selanjutnya dicatat volume cairan semennya. Sebagian sperma digunakan untuk membuahi telur dan sisanya diletakkan di dalam Eppendorf dan disimpan di dalam coolbox berisi es.
Cara stripping induk betina hampir sama dengan cara pengambilan sperma pada induk jantan. Akan tetapi posisi induk betina tidak dibalik seperti induk jantan. Sebelum striipping dilakukan, lubang genital induk betina juga dikeringkan menggunakan kertas tissue. Induk betina yang akan di-stripping ditutup kepalanya menggunakan kain basah, lalu dilakukan pengurutan dari bagian perut ke arah lubang genital dengan sedikit tekanan saat dilakukan stripping. Telur yang keluar ditampung pada mangkuk besar yang sebelumnya telah dikeringkan menggunakan kertas tissue. Selanjutnya telur dibagi menjadi tiga bagian dan diletakkan pada mangkuk plastik yang lebih kecil. Mangkuk plastik yang digunakan juga dikeringkan terlebih dahulu. Kemudian telur pada tiap mangkuk plastik dibuahi menggunakan sperma dari tiap perlakuan. Sperma dan telur pada tiap mangkuk diaduk menggunakan bulu ayam yang berbeda agar sperma tercampur merata pada tiap telur. Sebelum telur ditebar pada wadah penetasan, mangkuk yang berisi telur dan sperma diberi sedikit air agar sperma menjadi aktif sehingga dapat membuahi telur dan didiamkan beberapa menit. Telur yang sudah dibuahi kemudian ditebar pada akuarium dengan dimensi 10x10x20 cm. Air yang digunakan sebagai media penetasan telur sebelumnya sudah diberi methylen blue dan diaerasi selama 24 jam.
17
3.4.4 Pembuatan Preparat Ulas Sperma
Semen yang diencerkan menggunakan larutan fisiologis (cairan infuse NaCl 0,9%) digunakan untuk pembuatan preparat sperma. Cairan semen yang akan dibuat preparat ulas diteteskan di atas gelas objek yang sebelumnya sudah direndam pada larutan metanol. Cairan semen yang yang sudah diteteskan di atas gelas objek selanjutnya diratakan menggunakan gelas objek lainnya. Setelah itu lapisan cairan semen yang terbentuk dikering anginkan. Kemudian lapisan tersebut difiksasi dengan cara merendam gelas objek, yang di atasnya terdapat lapisan cairan semen, pada larutan metanol selama lima menit. Preparat yang sudah difiksasi selanjutnya dibilas menggunakan akuades dan dikering anginkan kembali. Tahapan selanjutnya adalah pewarnaan dengan cara merendam preparat pada larutan giemsa 5% selama 15 menit.
3.4.5 Pengamatan Hasil 3.4.5.1 Volume Cairan Semen
Volume cairan sperma diukur ketika kegiatan stripping induk jantan telah selesai dilakukan. Ketika cairan sperma yang didapatkan sudah tertampung seluruhnya di dalam syringe 1 ml, dilakukan pencatatan terhadap volume cairan sperma yang didapat. Volume cairan semen dapat dilihat dari skala yang tertera pada syringe yang digunakan untuk mengumpulkan cairan semen. Setiap kali melakukan stripping pada induk jantan pada tiap perlakuan, dilakukan pencatatan. 3.4.5.2 Durasi Motilitas Sperma
Lama motilitas sperma diamati bersamaan dengan penentuan skor motilitas sperma. Pengamatan lama motilitas sperma dilakukan dengan mencatat waktu sperma bergerak hingga sperma tidak bergerak lagi. Pengamatan ini dapat dilakukan menggunakan alat bantu berupa CCTV yang sudah terpasang pada mikroskop. Pengamatan lama motilitas dilakukan pada setiap sampel sperma dari tiap perlakuan.
3.4.5.3 Penentuan Skor Motilitas Sperma
Penentuan skor motilitas sperma dilakukan menggunakan mikroskop perbesaran 400x (perbesaran lensa obyektif 40x). Cairan sperma diteteskan pada gelas objek dan di samping cairan sperma tersebut diteteskan juga akuades. Setelah sel sperma terlihat pada bidang pandang dan sperma tidak dalam kondisi motil, aquabides dicampurkan menggunakan tusuk gigi. Pengamatan motilitas dilakukan pada setiap sampel sperma dari tiap perlakuan. Penentuan skor sperma dilakukan berdasarkan kriteria yang dibuat oleh Guest et al. (1976) dalam Tabel 1 berikut
Tabel 1. Kriteria skor motilitas sperma (Guest et al., 1976) Angka
Motilitas Kriteria
5 Semua sperma bergerak sangat cepat dengan pergerakan ekor bervariasi
4
Banyak sperma bergerak sangat cepat dengan pergerakan ekor cepat, beberapa sperma memperlihatkan getaran yang kuat di tempat
3 Banyak sperma bergerak cepat dan yang lain bergetar di tempat 2 Banyak sperma bergetar dengan sedikit memperlihatkan pergerakan
cepat
1 Banyak sperma bergetar tetapi sangat sedikit yang bergerak cepat 0,75 Banyak sperma tidak bergerak dan sangat sedikit sekali sperma
yang bergetar dengan gerakan lemah
0,50 Banyak sperma tidak bergerak dan sangat sedikit sekali sperma yang bergetar, kadang-kafang terlihat bergerak lemah
0,25 Banyak sperma tidak bergerak, kadang-kadang terlihat bergetar lemah
0 Semua sperma tidak bergerak dan bergetar 3.4.5.4 Jumlah Sel Sperma
Penghitungan jumlah sel sperma dilakukan menggunakan hemasitometer dan mikroskop dengan perbesaran 100x (obyektif 10x). Cairan semen yang akan
19
dihitung jumlah sel spermanya diencerkan hingga seribu kali menggunakan larutan fisiologis (cairan infus NaCl 0,9%). Kemudian diambil sepuluh mikroliter (10 µl) dan diteteskan ke hemasitometer. Selanjutnya bagian hemasitometer yang sudah ditetesi sampel sperma ditutup menggeunakan kaca penutup. Penghitungan dilakukan dengan mengambil lima titik sampel dari bidang pandang haemacytometer. Setelah itu jumlah sel sperma yang merah dihitung dengan rumus :
Sel sperma (sel/ml) = rataan sel sperma x KB vol.
1
x Faktor pengenceran Keterangan: KB= Kotak besar (0,2 mm x 0,2 mm x 0,1 mm)
Faktor pengenceran: 1000
Hasil yang didapat satuannya adalah jumlah sel/mm3dan selanjutnya dikonversi menjadi jumlah sel/ml cairan semen.
3.4.5.5 Penghitungan Kadar Spermatokrit
Penghitungan kadar spermatokrit dilakukan dengan cara sampel cairan semen dimasukkan dalam tabung mikrohematokrit sampai 4/5 bagian. Ujung tabung disumbat dengan crytoceal. Tabung mikrohematokrit disentrifuse selama 5 menit dengan kecepatan 8000 rpm. Setelah itu dilakukan pengukuran kadar hematokrit dengan rumus sebagai berikut :
Kadar Spermatokrit (%) = 100% y
x
Keterangan: x : padatan cairan semen (cm) y : total cairan semen (cm)
3.4.5.6 Morfologi Sperma
Pengamatan morfologi sperma dilakukan dengan cara melakukan pengukuran terhadap ukuran kepala dan panjang ekor sperma. Pengamatan ini dilakukan pada preparat ulas sperma yang telah dibuat sebelumnya. Untuk mempermudah proses pengukuran, dilakukan pemotretan terhadap preparat ulas sperma dibawah mikroskop dengan perbesaran 400x. Lalu dilakukan pengukuran sampel sperma. Hasil yang didapat selanjutnya dikonversi dengan mikrometer
sesuai perbesaran yang digunakan pada mikroskop dan satuannya diubah menjadi mikrometer (µm).
3.5 Analisis Data
Data yang diperoleh disajikan dalam bentuk tabel dan grafik serta dianalisis secara deskriptif untuk parameter volume cairan semen, kadar spermatokrit, durasi motilitas, skor motilitas, jumlah sel sperma, dan morfologi sperma.
IV. HASIL DAN PEMBAHASAN
4. 1 Hasil
4.1.1 Volume Cairan Semen
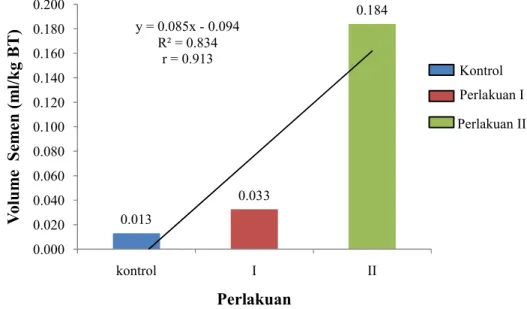
Penghitungan volume cairan semen dilakukan pada tiap ikan uji dengan perlakuan yang berbeda. Hasil rata-rata volume cairan semen yang didapatkan disajikan pada Gambar 4 sebagai berikut.
Gambar 4. Volume cairan semen ikan gurame tiap perlakuan dosis Ovaprim Rata-rata volume cairan semen tertinggi adalah 0,184±0,13 ml/kg bobot tubuh ikan dan didapatkan dari ikan perlakuan 2 yaitu penyuntikan Ovaprim dengan dosis 0,7 ml/kg bobot tubuh. Sedangkan volume cairan semen terendah adalah 0,013±0,01 ml/kg bobot tubuh ikan dan didapatkan dari ikan kontrol yang tidak disuntikkan Ovaprim. Penyuntikan Ovaprim dapat meningkatkan volume cairan semen dan semakin tinggi dosis penyuntikan maka volume cairan semen yang dihasilkan juga akan mengalami peningkatan.
Volume cairan semen ikan gurame yang didapat dari tiap perlakuan mengalami peningkatan dan menghasilkan persamaan garis linier y=0,085x-0,094 dengan y sebagai volume cairan semen yang dihasilkan dan x sebagai dosis penyuntikan Ovaprim. Jadi persamaan y=0,085x-0,094 berarti setiap penambahan dosis Ovaprim sebesar x satuan, akan meningkatkan volume cairan semen ikan uji
0.013 0.033 0.184 y = 0.085x - 0.094 R² = 0.834 r = 0.913 0.000 0.020 0.040 0.060 0.080 0.100 0.120 0.140 0.160 0.180 0.200 kontrol I II V ol u m e S em en ( m l/ k g B T ) Perlakuan Kontrol Perlakuan I Perlakuan II
sebesar 0,085 kali. Nilai R2=0,834 berarti penyuntikan Ovaprim pada ikan uji memberikan pengaruh sebesar 83,4% terhadap volume cairan semen yang dihasilkan. Sedangkan nilai r=0,913 berarti perlakuan penyuntikan Ovaprim pada ikan uji memiliki korelasi yang kuat terhadap volume cairan semen yang dihasilkan (r ≥ 0,75).
4.1.2 Durasi dan Penentuan Skor Motilitas Sperma
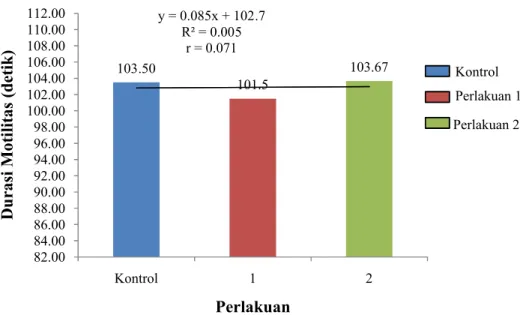
Penghitungan durasi dan skor motilitas sperma dilakukan pada tiap ikan uji dengan perlakuan yang berbeda. Hasil rata-rata durasi motilitas sperma ikan uji dengan perlakuan yang berbeda disajikan pada Gambar 5 sebagai berikut.
Gambar 5. Durasi motilitas ikan gurame tiap perlakuan dosis Ovaprim Rata-rata durasi motilitas tertinggi adalah 103,50±2,12 detik dan didapatkan dari ikan perlakuan 2 yaitu penyuntikan Ovaprim dengan dosis 0,7 ml/kg bobot tubuh. Sedangkan rata-rata durasi motilitas terendah adalah 101,50±2,12 detik dan didapatkan dari ikan perlakuan 1 yang disuntikkan Ovaprim dengan dosis 0,35 ml/kg bobot tubuh. Akan tetapi selisih rata-rata durasi motilitas antar tiap perlakuan tidak terlalu jauh. Selisih antara rata-rata durasi motilitas tertinggi dan terendah adalah 2,17 detik.
Durasi motilitas sperma ikan gurame yang didapat dari tiap perlakuan menghasilkan persamaan garis linier, y=0,085x+102,7 dengan y sebagai durasi
103.50 101.5 103.67 y = 0.085x + 102.7 R² = 0.005 r = 0.071 82.00 84.00 86.00 88.00 90.00 92.00 94.00 96.00 98.00 100.00 102.00 104.00 106.00 108.00 110.00 112.00 Kontrol 1 2 D u ras i M ot il it as ( de ti k ) Perlakuan Kontrol Perlakuan 1 Perlakuan 2
23
motilitas sperma dan x sebagai dosis penyuntikan Ovaprim. Arti dari persamaan garis y= 0,085x+102,7 adalah setiap penambahan dosis penyuntikan Ovaprim sebesar x satuan akan meningkatkan durasi motilitas sperma sebesar 0,085 kali. Nilai R2 dari data rata-rata durasi motilitas sperma adalah 0,005. Artinya penyuntikan Ovaprim pada ikan uji memberikan pengaruh yang sangat kecil terhadap durasi motilitas sperma, yaitu 0,5%. Sedangkan nilai r=0,071 berarti penyuntikan Ovaprim memilki korelasi yang lemah terhadap durasi motilitas sperma (r ≤ 0,5).
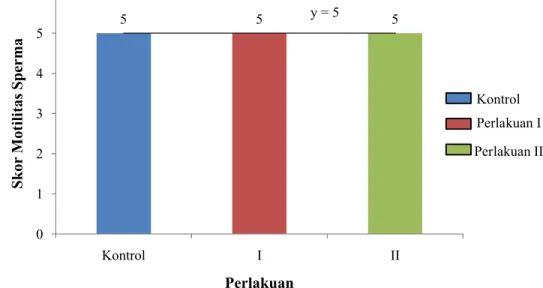
Gambar 6. Skor motilitas sperma ikan gurame tiap perlakuan dosis Ovaprim Skor motilitas tiap perlakuan penyuntikan Ovaprim menunjukan hasil yang sama tiap ikan uji (Gambar 6). rata skor dari tiap perlakuan adalah 5. Rata-rata skor motilitas sperma ikan gurame yang didapat dari tiap perlakuan menghasilkan persamaan garis linier y=5 dengan y sebagai skor motilitas sperma yang didapatkan dan x sebagai dosis penyuntikan Ovaprim. Jadi persamaan y=5 berarti setiap penambahan dosis Ovaprim seberapapun, akan menghasilkan sperma dengan skor 5. Skor motilitas sperma gurame tidak memiliki nilai R2 karena rata-rata skor motilitas sperma pada semua perlakuan adalah sama. Dengan kata lain, penyuntikan Ovaprim terhadap ikan uji tidak memberikan pengaruh terhadap skor motilitas sperma ikan uji.
5 5 y = 5 5 0 1 2 3 4 5 6 Kontrol I II S k or M ot il it as S p er m a Perlakuan Kontrol Perlakuan I Perlakuan II
4.1.3 Jumlah Sel Sperma dan Spermatokrit Cairan Semen
Penghitungan jumlah sel sperma dan spermatokrit cairan semen dilakukan pada tiap ikan uji dengan perlakuan yang berbeda Hasil rata-rata pengamatan jumlah sel sperma/ml ikan uji dengan perlakuan yang berbeda adalah sebagai berikut.
Gambar 7. Jumlah sel sperma/ml cairan semen ikan gurame tiap perlakuan dosis Ovaprim
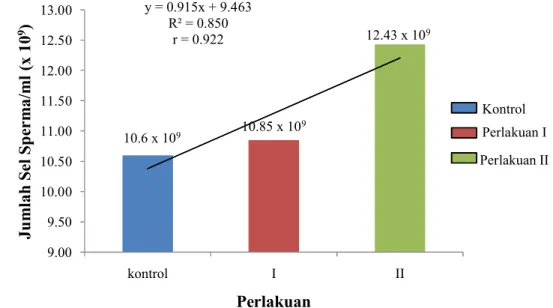
Data rata-rata jumlah sel sperma/ml cairan semen ikan uji pada Gambar 7, menunjukan hasil yang berbeda-beda. Jumlah sel sperma tertinggi dihasilkan oleh ikan uji yang diberi perlakuan penyuntikan Ovaprim dengan dosis 0,7 ml/kg bobot tubuh (12.43±2.25x109), sedangkan jumlah sel sperma terendah dihasilkan oleh ikan uji yang tidak diberi perlakuan penyuntikan Ovaprim (10,6x109).
Data rata-rata jumlah sel sperma/ml disajikan pula dalam bentuk grafik (Gambar 7). Rata-rata jumlah sel sperma/ml dari ikan uji pada tiap perlakuan mengalami peningkatan dan menghasilkan persamaan garis y=0,915x+9,463 dengan y sebagai jumlah sel sperma/ml cairan semen dan x sebagai dosis penyuntikan Ovaprim. Persamaan garis y=0,915x+9,463 berarti setiap peningkatan dosis penyuntikan Ovaprim sebesar x satuan akan meningkatkan jumlah sel sperma/ml sebesar 0,915 kali. Dari data rata-rata jumlah sel sperma/ml didapatkan nilai R2=0,850 yang artinya penyuntikan Ovaprim pada ikan uji
12.43 x 109 10.85 x 109 10.6 x 109 y = 0.915x + 9.463 R² = 0.850 r = 0.922 9.00 9.50 10.00 10.50 11.00 11.50 12.00 12.50 13.00 kontrol I II Ju m lah S el S p er m a/ m l (x 10 9) Perlakuan Kontrol Perlakuan I Perlakuan II
25
memberikan pengaruh sebesar 85% terhadap jumlah sel sperma/ml cairan semen. Sedangkan nilai r=0,922 berarti penyuntikan Ovaprim pada ikan uji memiliki korelasi yang kuat terhadap jumlah sel sperma/ml yang dihasilkan (r ≥ 0,75).
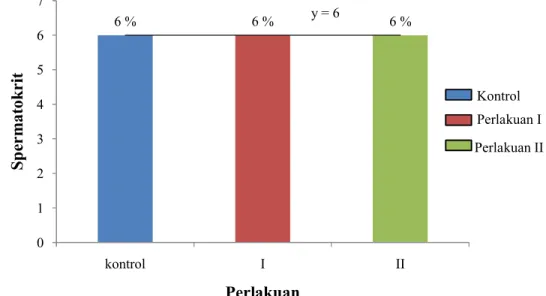
Gambar 8. Spermatokrit semen ikan gurame tiap perlakuan dosis Ovaprim Gambar 8 menunjukan bahwa spermatokrit cairan semen ikan uji pada tiap perlakuan penyuntikan Ovaprim adalah sama. Rata-rata spermatokrit cairan semen ikan uji pada tiap perlakuan adalah 6% padatan. Nilai rata-rata spermatokrit cairan semen ikan gurame yang didapatkan disajikan dalam bentuk grafik (Gambar 8). Rata-rata spermatokrit cairan semen ikan gurame yang didapat dari tiap perlakuan menghasilkan persamaan garis linier y=6 dengan y sebagai nilai motilitas sperma yang didapatkan dan x sebagai dosis penyuntikan Ovaprim. Jadi persamaan y=6 berarti seberapapun penambahan dosis penyuntikan Ovaprim pada ikan uji, akan menghasilkan spermatokrit cairan semen sebesar 6%. Rata-rata spermatokrit cairan semen ikan gurame tidak memiliki nilai R2 karena data rata-rata spermatokrit cairan semen pada semua perlakuan adalah sama. Dengan kata lain, penyuntikan Ovaprim terhadap ikan uji tidak memberikan pengaruh terhadap nilai spermatokrit cairan semen sperma ikan uji.
6 % 6 % y = 6 6 % 0 1 2 3 4 5 6 7 kontrol I II Sp er m at ok ri t Perlakuan Kontrol Perlakuan I Perlakuan II
4.1.4 Morfologi Sperma
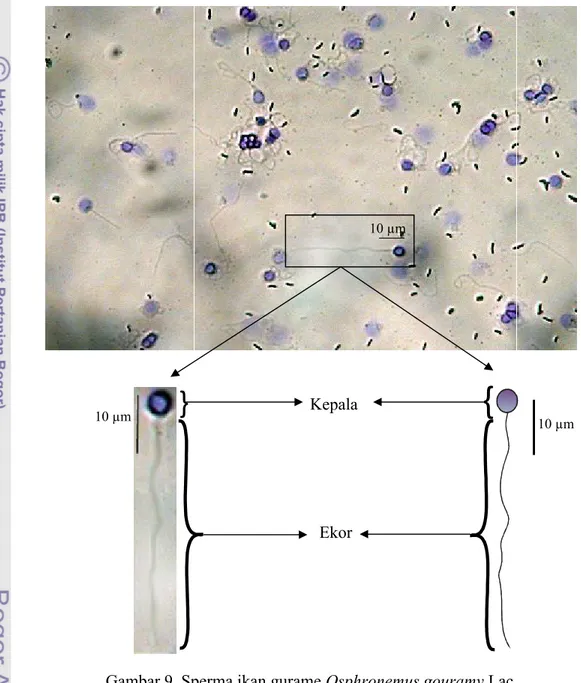
Gambar 9 menunjukan bahwa sperma ikan gurame terdiri dari bagian kepala dan ekor. Selain itu, dapat dilihat bahwa kepala sperma ikan gurame berbentuk bulat.
Gambar 9. Sperma
Hasil pengamatan preparat ulas
diameter kepala sperma ikan gurame berkisar antara 4,7
rata-rata 4,8±1,53 µm. panjang ekor sperma ikan gurame berkisar antara -44.0±7.1 µm dengan rata
10 µm
}
Morfologi Sperma
Gambar 9 menunjukan bahwa sperma ikan gurame terdiri dari bagian Selain itu, dapat dilihat bahwa kepala sperma ikan gurame
Gambar 9. Sperma ikan gurame Osphronemus gouramy Lac.
pengamatan preparat ulas sperma menunjukan bahwa ukuran diameter kepala sperma ikan gurame berkisar antara 4,7±1.2-4.9±1.7 µm
. panjang ekor sperma ikan gurame berkisar antara dengan rata-rata 42.8±5.60 µm (Tabel 2). Dari rata-rat
10 µm
Kepala
Ekor
{
Gambar 9 menunjukan bahwa sperma ikan gurame terdiri dari bagian Selain itu, dapat dilihat bahwa kepala sperma ikan gurame
Lac.
sperma menunjukan bahwa ukuran 4.9±1.7 µm dengan . panjang ekor sperma ikan gurame berkisar antara 42.2±5.6 rata diameter
27
kepala dan panjang ekor sperma gurame, panjang total sperma ikan gurame adalah 46,8 µm
Tabel 2. Ukuran lebar kepala dan panjang ekor ikan gurame
Morfologi Sperma Ulangan 1 Ulangan 2 Ulangan 3 Rata-rata Kepala 4,7±1,2 µm 4,8±1,7 µm 4,9±1,7 µm 4,8±1,53 µm
Ekor 42,2±5,6 µm 43,1±5,7 µm 44,0±7,1 µm 42,8±5,60 µm .
4.2 Pembahasan
Rata-rata volume cairan semen ikan gurame dari masing-masing perlakuan memperlihatkan pola yang meningkat seiring peningkatan dosis penyuntikan Ovaprim. Ikan yang diberi perlakuan penyuntikan Ovaprim dengan dosis 0,7 ml/kg bobot tubuh menghasilkan rata-rata volume cairan semen yang lebih tinggi (0,184±0,13 ml/kg bobot tubuh) dibanding rata-rata volume cairan semen yang dihasilkan oleh ikan yang tidak diberi perlakuan (0,013±0,01 ml/kg bobot tubuh). Pada ikan yang diberi perlakuan penyuntikan Ovaprim 0,35ml/kg bobot tubuh menghasilkan rata-rata volume cairan semen sebesar (0,033±0,02 ml/kg bobot tubuh). Dapat dilihat bahwa semakin tinggi dosis penyuntikan Ovaprim maka volume cairan semen yang dihasilkan akan semakin banyak. Moon et al. (2003) melaporkan bahwa pada Platichthys stellatus yang diberi GnRH dengan dosis 200 µg/kg bobot tubuh menghasilkan volume cairan semen 7,8 ml/kg bobot tubuh, dosis 100 µg/kg bobot tubuh menghasilkan cairan semen 5,2 ml/kg bobot tubuh, dosis 50 µg/kg bobot tubuh menghasilkan cairan semen 4,5 ml/kg bobot tubuh, dan pada ikan yang tidak diberi implan pellet kolesterol GnRH dan diberi implan pellet kolesterol tanpa GnRH menghasilkan cairan semen 0,8 ml/kg bobot tubuh. Penyuntikan pimozide dosis 10 mg/kg + LHRH dosis 10 µg/kg bobot badan menghasilkan cairan semen 4,29±3,10 ml/kg bobot badan, sedangkan tanpa disuntik hanya menghasilkan cairan semen 0,49±0,34 ml/kg bobot badan (Billard et al., 1987). Dari hasil penelitian di atas, dapat dilihat bahwa GnRH mampu meningkatkan volume cairan semen yang dihasilkan oleh ikan yang diberi perlakuan.
Peningkatan volume cairan semen ini diduga disebabkan karena peningkatan kadar GnRH di dalam tubuh akan menyebabkan peningkatan hormon
FSH dan LH dalam tubuh. Penyuntikan LHRH sintetik dapat meningkatkan pelepasan hormon gonadotropin dalam plasma dari beberapa spesies teleostei (Matty, 1985). Dengan meningkatnya kadar hormon FSH dan LH dalam tubuh, maka akan terjadi peningkatan kadar testosteron yang berperan dalam pembentukan spermatogonia menjadi spermatid dan 11-ketotestosteron yang berperan dalam pembentukan spermatid menjadi sperma. Menurut Nagahama (1994) hormon gonadotropin akan merangsang sintesis testosteron dan 11-ketotestosteron yang mengakibatkan spermatogenesis dan spermiogenesis. Selain itu, Sukumasavin (2007) mengemukakan bahwa 17α-20β-dihidroprogesteron yang berasal dari rangsangan LH, menyebabkan sperma dihidrasi oleh larutan seminal yang menghasilkan larutan sperma yang disebut cairan semen.
Parameter skor motilitas sperma menunjukan hasil yang sama pada setiap perlakuan. Skor motilitas sperma pada tiap perlakuan adalah 5. Skor 5 pada skoring motilitas berarti semua sperma bergerak sangat cepat dengan pergerakan ekor bervariasi (Guest et al., 1976). Menurut Schiavone et al. (2006), skor motilitas dari European sea bass Dicentrarchus labrax murni yang diberi perlakuan hormon berkisar antara 4,2-4,6 (80-100% sperma bergerak maju) dan pada ikan yang tidak diberi perlakuan hormon berkisar antara 4,2-4,5 (80-100% sperma bergerak maju). Akan tetapi, pada penelitian kali ini persentase sperma yang motil sulit untuk dihitung dengan pasti karena belum diketahui kadar pengencer yang dapat digunakan dengan tepat terhadap sperma ikan gurame. Jadi dalam pengamatan skor motilitas sperma digunakan sperma yang segar dan belum diencerkan, sehingga sangat sulit untuk dihitung. Dari informasi di atas dapat dilihat perlakuan hormon tidak akan mempengaruhi motilitas sperma. Menurut Joachim (1983), sperma ikan imotil di dalam cairan semen dan baru bergerak apabila telah bercampur dengan air.
Parameter motilitas lainnya yang diamati adalah durasi motilitas sperma. Berdasarkan pengamatan yang dilakukan terhadap durasi motilitas sperma ikan gurame, durasi motilitas sperma gurame berkisar antara 101,50±2,12 detik hingga 103,67±2,52 detik. Durasi motilitas sperma ikan gurame masih di bawah 2 menit. Meskipun terdapat perbedaan antar perlakuan, tapi selisih waktu motilitasnya tidak terlalu jauh, hanya dalam kisaran kurang dari 5 detik. Jadi dapat dikatakan
29
bahwa durasi motilitas sperma tidak terlalu berbeda. Hal ini diduga karena kondisi media yang digunakan untuk aktivasi sperma adalah sama. Pada sperma yang didapatkan perlakuan 1, yaitu penyuntikan ikan uji menggunakan Ovaprim dengan dosis 0,35 ml/kg bobot tubuh, memiliki rata-rata durasi motilitas sperma yang lebih rendah dari pada durasi motilitas sperma dari ikan kontrol. Meskipun durasi motilitas sperma ikan gurame pada perlakuan 1 lebih rendah dari kontrol, masih dalam kisaran durasi motilitas ikan air tawar. Hal ini sesuai dengan pernyataan Waynarovich dan Horvath (1980), bahwa sperma ikan periran hangat bergerak menggunakan ekornya dengan waktu motil antara setengah hingga satu menit. Ginzburg (1972), mengatakan bahwa durasi motilitas pada ikan yang memijah di air tawar tidak lebih dari 2-3 menit. Menurut Schiavone et al. (2006), durasi motilitas European sea bass Dicentrarchus labrax murni yang diberi perlakuan HCG 1000 IU kg-1 adalah 67±10 detik sampai 83±5 detik. Sedangkan pada ikan yang tidak diberi perlakuan hormon memiliki durasi motilitas sperma antara 68±18 detik hingga 80±18 detik. Menurut Joachim (1983), respon rangsangan aktivitas spermatozoa tergantung pada pH, tekanan osmotik, dan kandungan ion pada medium yang mengelilinginya. Affandi dan Tang (2002), mengatakan bahwa panjang pendeknya ukuran ekor sperma dapat menentukan keaktifan sperma dalam bergerak. Semakin panjang ekor sperma maka semakin aktif sperma tersebut bergerak.
Parameter kualitas sperma selanjutnya yang diamati adalah jumlah sel sperma/ml dan spermatokrit cairan semen. Spermatokrit cairan semen pada tiap perlakuan adalah sama yaitu 6%. Semakin tinggi spermatokrit cairan semen, maka tingkat kepekatan cairan semen akan semakin tinggi. Dari sini dapat diduga kepadatan sel sperma pada cairan semen dan zat-zat yang dibutuhkan untuk motilitas sperma banyak terkandung dalam cairan semen. Akan tetapi pada penelitian kali ini tidak diuji lebih lanjut mengenai zat-zat yang terkandung dalam padatan cairan semen. Rata-rata jumlah sel sperma/ml cairan semen ikan gurame berkisar antara 10,6-12,43x109 sel sperma/ml. Menurut Bozkurt (2006), jumlah sel sperma pada rainbow trout (Oncorhynchus mykiss) adalah 7,7±4,431x109 sel/ml cairan semen. Pada penelitian kali ini, rata-rata jumlah sel sperma tertinggi ikan gurame (12,43x109sel sperma/ml) dihasilkan oleh ikan yang diberi perlakuan
2 dan terendah (10,6x109 sel sperma/ml) dihasilkan oleh ikan yang tidak diberi perlakuan penyuntikan Ovaprim. Dari Gambar 7 dapat dilihat bahwa peningkatan dosis penyuntikan Ovaprim akan diikuti oleh peningkatan jumlah sel sperma/ml cairan semen. Schiavone et al. (2006) melaporkan bahwa jumlah sel sperma European sea bass Dicentrarchus labrax yang diberi perlakuan HCG 1000 IU kg-1 adalah 53±8x109sel/ml sampai 58±8x109sel/ml. Sedangkan pada ikan yang tidak diberi perlakuan menghasilkan jumlah sel sperma 50±8x109 sel/ml sampai 55±8x109 sel/ml. Selain itu Lim et al. (2004) melaporkan pada ikan Greenback flounder Rhomboselea tapirina yang tidak diberi perlakuan GnRH konsentrasi sel spermanya adalah 108,9±12,3x106/ml, pada ikan yang diberi perlakuan 50 µg/kg GnRH konsentrasi sel spermanya adalah 100,1±15,7x106/ml, pada ikan yang diberi perlakuan 100 µg/kg GnRH konsentrasi sel spermanya adalah 77,5±10,1x106/ml, dan pada ikan yang diberi perlakuan 200 µg/kg GnRH konsentrasi sel spermanya adalah 72,2±9,9x106/ml, Menurut Kucharczyk et, al,, (2005), pemberian treatment GnRH pada Abramis brama menghasilkan cairan semen dengan kepadatan 10,2±1,4x109 sel/ml, sedangkan ikan kontrol menghasilkan cairan semen dengan kepadatan 6,8±1,1x109sel/ml.
Dari informasi diatas dapat dilihat bahwa pemberian perlakuan hormon pada ikan uji dapat meningkatkan densitas atau kepadatan sel sperma di dalam cairan semen. Peningkatan jumlah sel sperma dalam cairan semen diduga disebabkan karena peningkatan kadar GnRH di dalam tubuh akan menyebabkan peningkatan hormon FSH dan LH dalam tubuh. Penyuntikan LHRH sintetik dapat meningkatkan pelepasan hormon gonadotropin dalam plasma dari beberapa spesies teleostei (Matty, 1985). Dengan meningkatnya kadar hormon FSH dan LH dalam tubuh, maka akan terjadi peningkatan kadar testosteron yang berperan dalam pembentukan spermatogonia menjadi spermatid dan 11-ketotestosteron yang berperan dalam pembentukan spermatid menjadi sperma. Menurut Nagahama (1994) hormon gonadotropin akan merangsang sintesis testosteron dan 11-ketotestosteron yang mengakibatkan spermatogenesis dan spermiogenesis. Dengan kata lain, semakin tinggi testosteron dan 11-ketotestosteron di dalam tubuh maka jumlah sel sperma yang dihasilkan akan semakin banyak. Akan tetapi,
31
pada penelitian kali ini tidak dilakukan pengukuran terhadap kadar tetosteron dan 11-ketotestosteron di dalam tubuh ikan pasca penyuntikan Ovaprim.
Sperma ikan gurame terdiri dari dua bagian yaitu kepala dan ekor (Gambar 9). Hal ini sesuai dengan pendapat Ginzburg (1972) mengemukakan bahwa pada umumnya sperma terdiri atas dua bagian, yaitu bagian kepala dan ekor. Selain itu bentuk kepala sperma ikan gurame adalah bulat. Hal ini didukung pendapat Affandi dan Tang (2002), kepala sperma berbentuk bulat atau oval. Rata-rata ukuran diameter kepala sperma ikan gurame berkisar adalah 4,8±1,53 µm dengan rata-rata panjang ekor sperma ikan gurame adalah 42.8±5.60 µm. Dari rata-rata diameter kepala dan panjang ekor sperma gurame, panjang total sperma ikan gurame adalah 46,8 µm. Hal ini sesuai dengan pendapat Affandi dan Tang (2002) panjang total sperma ikan antara 40-60 µm. Menurut Gisnzburg (1972), diameter lubang mikrofil berhubungan erat dengan lebar kepala sperma. Lebar kepala sperma Clupea harengus pallasi adalah 1,5 µm dan diameter lubang mikrofil telurnya adalah 2,5 µm, lebar kepala sperma Oncorhynchus keta adalah 3 µm dan diameter lubang mikrofil telurnya adalah 3 µm, lebar kepala sperma Salmo salar adalah 3,5-4 µm dengan diameter lubang mikrofil 3-4 µm, lebar kepala sperma Salmo trutta m. lacustris adalah 3 µm dan diameter lubang mikrofil telurnya adalah 3 µm, lebar kepala sperma Carrasius carrasius adalah 3,2 µm dan diameter lubang mikrofil telurnya adalah 3,5-4 µm, dan lebar kepala sperma Crenilabrus griseus adalah 1,7-1,8 µm dan diameter lubang mikrofil telurnya adalah >2 µm. Jadi, dapat diduga lebar kepala sperma ikan gurame dipengaruhi oleh diameter lubang mikrofil pada telur gurame. Akan tetapi pada penelitian kali ini tidak dilakukan pengukuran terhadap diameter lubang mikrofil telur ikan gurame.