BAB V. KESIMPULAN DAN SARAN
V.1. Kesimpulan
6. Terdapat polimorfisme rs7903146 gen TCF7L2 pada individu yang mempunyai riwayat keluarga DM tipe 2.
7. Frekuensi genotip CT dan TT tidak berbeda bermakna antara individu yang mempunyai riwayat dan tanpa riwayat keluarga DM.
8. Frekuensi alel T tidak berbeda bermakna antara individu yang mempunyai riwayat dan tanpa riwayat keluarga DM.
9. Nilai HOMA-β dan HOMA-IR pada individu dengan riwayat keluarga DM tipe 2 lebih rendah dari pada individu tanpa riwayat keluarga DM. 10. Pada individu yang mempunyai riwayat keluarga DM tipe 2, nilai
HOMA-β dan HOMA-IR tidak berbeda bermakna antara genotip CC dan genotip CT.
V.2. Saran
1. Penelitian lanjutan polimorfisme gen TCF7L2 pada SNP yang lain pada subyek dengan RK DM tipe 2.
2. Sebaiknya memeriksa kadar insulin dan nilai HOMA-β yang dapat menjadi skrining awal untuk mengetahui risiko DM tipe 2 bagi individu dengan kadar glukosa darha puasa (GDP) normal pada individu dengan riwayat keluarga DM tipe 2.
3. Sebaiknya faktor lingkungan seperti asupan, aktivitas fisik perlu diteliti dan diperhatikan baik individu dengan dan tanpa riwayat keluarga DM tipe 2.
V.3. Ringkasan
1. Latar Belakang
Diabetes melitus (DM) tipe 2 merupakan penyakit multifaktorial dengan komponen genetik dan non-genetik yang akan mempercepat fenotip diabetes (Singh, 2011). Riwayat alamiah untuk timbulnya DM tipe 2 yaitu terjadi interaksi antara predisposisi faktor genetik dan faktor lingkungan. Interaksi antara faktor genetik dan lingkungan dapat mempengaruhi biosintesa insulin, sekresi insulin dan kerja insulin (International Diabetes Federation/IDF, 2000).
Riwayat keluarga diketahui sebagai faktor risiko terjadinya perkembangan DM tipe 2. Berdasarkan penelitian Benner et al. (2013) risiko penderita DM paling tinggi terjadi bila salah satu atau kedua orang tuanya penderita DM dibandingkan dengan orang tua yang bukan penderita DM. Berdasarkan penelitian Harrison et al. (2003) bahwa risiko DM akan meningkat 2 sampai 4 kali lipat jika salah satu atau kedua orang tua penderita DM tipe 2. Menurut Radha dan Mohan (2007) bahwa pada keluarga dengan salah satu orang tua penderita DM tipe 2 memiliki risiko menderita DM tipe 2 dengan odds ratio (OR) 3,5 dibandingkan dengan keluarga yang orang tuanya normal. Angka ini akan meningkat dengan OR sebesar 6,1 jika kedua orang tuanya menderita DM tipe 2.
Prevalensi DM selalu meningkat tiap tahunnya, menurut data World Health Organization (WHO) pada tahun 2011 sekitar 346 juta penderita diabetes diseluruh dunia dan meningkat menjadi 438 juta pada tahun 2030. Di Indonesia, penderita diabetes pada tahun 2000 mencapai 8,4 juta orang dan menduduki
peringkat ke-4 setelah India, Cina, dan Amerika Serikat. World Health Organization (WHO) juga memperkirakan di Indonesia DM akan meningkat pada tahun 2030 nanti sekitar 21,3 juta (Wild et al., 2004). Di Yogyakarta merupakan peringkat pertama terbanyak penderita DM di Indonesia yaitu sebesar 2,6% pada tahun 2012 (Depkes, 2013).
Pada DM tipe 2, gangguan metabolisme glukosa disebabkan oleh dua faktor utama yakni tidak adekuatnya sekresi insulin (defisiensi insulin) dan kurang sensitifnya jaringan tubuh terhadap insulin (resistensi insulin) (Merentek, 2006). Abnormalitas metabolisme karbohidrat, lemak, dan protein pada penderita DM adalah akibat defisiensi kerja insulin pada jaringan target. Defisiensi kerja insulin merupakan akibat dari sekresi insulin yang tidak adekuat atau respon jaringan terhadap insulin menurun pada satu titik atau lebih pada jalur kerja hormon (ADA, 2013). Sekresi insulin terdiri dari dua fase. Pada fase 1, pemberian glukosa akan menginduksi sekresi insulin untuk mencegah kenaikan kadar glukosa darah dan kenaikan glukosa darah selanjutnya akan merangsang fase 2 untuk meningkatkan sekresi insulin (Merentek, 2006). Terjadinya gangguan sekresi insulin sel β pankreas menyebabkan sekresi insulin pada fase 1 tertekan, kadar insulin dalam darah turun menyebabkan produksi glukosa oleh hepar meningkat sehingga kadar glukosa darah puasa meningkat dan kemampuan fase 2 juga pun menurun secara bertahap untuk menghasilkan insulin sehingga terjadi hiperglikemia (Merentek, 2006). Dikatakan resisten insulin bila dibutuhkan kadar insulin yang lebih banyak untuk mencapai kadar glukosa darah yang normal (Merentek, 2006). Resistensi insulin terjadi akibat gangguan respon metabolik terhadap kerja insulin, akibatnya
untuk kadar glukosa plasma tertentu dibutuhkan kadar insulin yang lebih banyak daripada ‘normal’ untuk mempertahankan keadaan normoglikemi (euglikemi). Resistensi insulin dapat disebabkan oleh gangguan pre reseptor, reseptor dan post reseptor (Defronzo, 1997; Groop, 1999). Adanya riwayat keluarga DM tipe 2 memanifestasi terjadinya resistensi insulin dan disfungsi sel β pankreas (Arslanian et al., 2005). Danadian et al. (1999) bahwa adanya riwayat keluarga DM tipe 2 menyebabkan terjadinya penurunan sensitivitas insulin sebesar 25%.
Salah satu gen yang berperan pada DM tipe 2 adalah transcription factor 7-like 2 (TCF7L2). Gen TCF7L2 mengkode faktor transkripsi yang berperan pada jalur sinyal Wingless-type mouse mammary tumor virus (MMTV) integration site family member (Wnt). Sinyal Wnt berperan penting dalam meregulasi ekspresi gen progulakagon yang mengkode hormon insulinotropik glucagon –like peptide-1 (GLP-peptide-1) melalui aktivasi dari TCF7L2 yang mengaktivasi ekspresi gen proglukagon didalam sel L intestinal sehingga mampu mensekresikan GLP-1. GLP-1 berperan penting dalam homeostasis glukosa darah dan meningkatkan sekresi insulin sehingga TCF7L2 secara tidak langsung berperan sebagai faktor regulasi sekresi insulin dan homeostasis glukosa darah (Tong et al., 2009 dan Yu et al., 2009). Single nucleotide polymorphism (SNP) rs7903146 pada intron 3 kromosom 10 merupakan perubahan alel C menjadi alel T (IVS3C>T). Polimorfisme rs7903146 (IVS3C/T) gen TCF7L2 berperan dalam patogenesis DM tipe 2 yaitu mempengaruhi regulasi transkripsi pada hormon insulinotropik GLP-1 sehingga menurunkan sekresi insulin dan meningkatkan produksi glukosa dihepatik. Alel T pada rs7903146 genTCF7L2 dihubungkan dengan gangguan
sekresi insulin dan peningkatan sensitivitas insulin (Alibegovic et al., 2010). Dalam semua populasi, TCF7L2 menunjukkan hubungan yang kuat terhadap terjadinya DM tipe 2 dengan frekuensi 30% - 50% untuk setiap alel (Hattersley, 2007). Wegner et al. (2008) menunjukkan pada individu dengan alel T pada polimorfisme rs7903146 gen TCF7L2 mengalami penurunan sekresi insulin dan peningkatan produksi glukosa.
Mengingat tingginya prevalensi kejadian DM dan terus meningkat tiap tahunnya maka perlu dilakukan pencegahan sedini mungkin. Berdasarkan penelitian-penelitian yang telah dilakukan bahwa individu yang memiliki riwayat keluarga penderita DM tipe 2 lebih berisiko akan menderita DM tipe 2 dibanding individu yang tidak memiliki riwayat keluarga penderita DM (Wicaksono, 2011). Sehingga perlu diteliti polimorfisme genetika pada individu yang mempunyai riwayat keluarga DM tipe 2 sebagai pencegahan dan pengendalian individu terhadap terjadi DM tipe 2.
2. Tinjauan Pusataka
Diabetes melitus (DM) merupakan penyakit metabolik yang kompleks dan dipengaruhi oleh interaksi genetika dan lingkungan yang disebabkan oleh gangguan sekresi insulin dan/atau resistensi insulin sehingga terjadi peningkatan kadar gula darah (hiperglikemia) kronik (ADA, 2013; Smushkin et al., 2010 dan Singh, 2011).
Diabetes melitus tipe 2 ditandai dengan terjadinya berbagai gangguan homeostasis glukosa yaitu terjadinya gangguan sekresi insulin, resistensi insulin
dan gangguan ambilan glukosa pada pankreas (defronzo, 2004). Defisiensi kerja insulin merupakan akibat dari sekresi insulin yang tidak adekuat atau respon jaringan terhadap insulin menurun pada satu titik atau lebih pada jalur kerja hormon (ADA, 2013).
Berdasarkan World Health Organization (WHO) pada tahun 2011 sekitar 346 juta penderita diabetes diseluruh dunia dan diperkirakan meningkat menjadi 438 juta pada tahun 2030. Di Indonesia, penderita diabetes pada tahun 2008 mencapai 5,4% atau 8,4 juta orang (Susanto et al., 2011). Diperkirakan tahun 2030 meningkat 10% atau 21,3 juta orang (WHO, 2011). Di Yogyakarta angka penderita DM tahun 2012 sebesar 2,6% dan merupakan peringkat pertama terbanyak di Indonesia (Riskesdas, 2013). Di Indonesia juga menduduki peringkat ke-4 jumlah penderita DM setelah India, Cina, dan Amerika Serikat (Wild et al., 2004). Selain itu, jumlah kasus DM terbanyak diderita yaitu DM tipe 2, sekitar 90 – 95% dari seluruh jumlah kasus DM (ADA, 2013). Diabetes melitus tipe 2 menjadi masalah kesehatan yang serius, baik dinegara-negara maju maupun dinegara berkembang, termasuk Indonesia. Diabetes melitus tipe 2 biasanya terjadi pada usia diatas 50 tahun, tetapi pada tahun-tahun terakhir dijumpai adanya kasus DM tipe 2 pada remaja dan anak-anak (Thevenod, 2008).
Diabetes melitus merupakan penyakit multifaktorial yaitu terjadinya interaksi kompleks antara faktor genetik dan faktor lingkungan (Benner et al., 2013). Faktor risiko DM tipe 2 antara lain riwayat keluarga penderita diabetes (orangtua atau saudara menderita DM tipe 2), obesitas (Body mass index (BMI) ≥ 25 kg/m2), kurangnya aktivitas fisik, ras/etnik, sebelumnya diidentifikasi kadar
glukosa darah puasa terganggu (GDPT) atau toleransi glukosa terggangu (TGT), riwayat diabetes melitus gestasional (DMG) atau bayi lahir > 4 kg, hipertensi (tekanan darah ≥ 140/90 mmHg), HDL ≤ 35 mg/dL dan trigliserida ≥ 250 mg/dL (ADA, 2013 dan Singh, 2011). Diabetes melitus tipe 2 dapat timbul sebagai akibat adanya polimorfisme pada gen yang mengkode ion kanal, mengatur fungsi ion kanal atau gen pada target insulin dan diperparah dengan adanya faktor lingkungan seperti obesitas, perubahan gaya hidup, kurangnya aktifitas fisik, dan merokok (Ashcroft and Rorsman, 2004). Faktor genetik berperan penting dalam penentuan penyakit DM dalam suatu keluarga (Benner et al., 2013). Dilaporkan oleh Erasmus et al. (2001) bahwa terjadinya DM tipe 2 dipicu oleh adanya peran genetik dan agregasi keluarga dalam beberapa populasi. Berdasarkan penelitian Harrison et al. (2003) bahwa diagnosa DM akan meningkat dua sampai empat kali lipat jika salah satu atau kedua orang tua menderita DM dan sekitar 25% - 30% pasien DM tipe 2 mempunyai riwayat keluarga DM. Faktor riwayat keluarga biasanya digunakan dalam pengobatan klinik untuk menilai risiko terjadinya penyakit, untuk mendeteksi dini terjadinya penyakit dan untuk pencegahan terjadinya penyakit. (Das et al., 2012). Mengetahui besarnya risiko terjadinya DM bagi individu yang mempunyai riwayat keluarga DM sehingga menimbulkan kesadaran akan risiko terjadinya penyakit dan perilaku mengurangi risiko terjadinya penyakit (Scheuner et al., 1997).
Insulin merupakan hormon peptida yang disekresikan oleh sel β dari Langerhans pankreas (Seino et al., 2011). Fungsi insulin adalah untuk mengatur kadar normal glukosa darah. Insulin bekerja memperantarai masuknya glukosa
seluler, regulasi metabolisme karbohidrat, lemak, dan protein, serta mendorong diferensiasi dan pertumbuhan sel melalui efek mitogenik pada insulin (Wilcox, 2005 dan Merentek., 2006). Mekanisme sekresi insulin yaitu insulin disekresikan dari sel β pankreas sebagai respon adanya nutrien seperti glukosa, asam lemak dan asam amino tertentu (Wilcox, 2005). Glukosa plasma yang tinggi setelah makan akan ditransport ke dalam sel β pankreas melalui transporter glukosa tipe 2 (GLUT 2). Glukosa mengalami fosforilasi membentuk glukosa-6-fosfat oleh enzim glukokinase dan selanjutnya mengalami glikolisis menghasilkan piruvat dan ATP (Merentek, 2006). Piruvat kemudian ditranspor ke dalam mitokondria, masuk kedalam siklus krebs, fosforilasi oksidatif dan rantai transpor elektron sehingga menghasilkan ATP. Kenaikan rasio ATP/ADP akan merangsang kanal KATP untuk menutup sehingga K+ tertumpuk disitosol. Penumpukan muatan
positif dari ion kalium dalam sitosol menyebabkan depolarisasi membran sel dari -70 mv (pada kondisi resting state) menjadi -30 mv (depolarisasi) menginduki pembukaan voltage dependent kanal Ca2+ sehingga terjadi influsi ion Ca2+. Peningkatan kadar kalsium intrasel menyebabkan eksositosis vesikel yang mengandung insulin sehingga disekresikan dari sel β pankreas (Riedel et al., 2003, Merentek, 2006 dan Wilcox, 2005).
Sekresi insulin oleh sel β pankreas setelah distimulasi oleh glukosa bersifat bifasik. Fase dini (fase 1) terjadi 3-10 menit pertama setelah makan. Insulin yang disekresikan pada fase ini adalah insulin yang disimpan dalam sel β (siap dipakai). Fase selanjutnya atau fase 2 yaitu sekresi insulin yang dimulai 20 menit setelah adanya stimulasi glukosa. Insulin yang disekresikan pada fase ini adalah insulin
yang baru disintesis. Pada DM tipe 2, sekresi insulin pada fase 1 tidak dapat menurunkan glukosa darah sehingga merangsang fase 2 untuk menghasilkan insulin yang lebih banyak, tetapi sudah tidak mampu meningkatkan sekresi insulin sebagaimana pada orang normal. Perjalanan DM tipe 2 dimulai dengan gangguan fase 1 yang menyebabkan hiperglikemia dan selanjutnya gangguan fase 2 yang menyebabkan gangguan sel β pankreas tetapi tidak terjadi hiperinsulinemia (Merentek, 2006).
Resistensi insulin adalah suatu keadaan terjadinya gangguan respons metabolik terhadap kerja insulin, akibatnya untuk kadar glukosa plasma tertentu dibutuhkan kadar insulin yang lebih banyak daripada ‘normal’ untuk mempertahankan keadaan normoglikemi (euglikemi). Resistensi insulin dapat disebabkan oleh gangguan pre reseptor, reseptor dan post reseptor. Gangguan pre-reseptor dapat disebabkan oleh antibodi insulin dan gangguan pada insulin. Gangguan reseptor dapat disebabkan oleh jumlah reseptor yang kurang atau kepekaan reseptor yang menurun. Sedangkan gangguan post reseptor disebabkan oleh gangguan pada proses fosforilasi dan pada signal transduksi di dalam sel otot. Daerah utama terjadinya resistensi insulin adalah pada postreseptor sel target di jaringan otot rangka dan sel hati. Kerusakan postreseptor ini menyebabkan kompensasi peningkatan sekresi insulin oleh sel beta, sehingga terjadi hiperinsulinemi pada keadaan puasa maupun postprandial (Groop, 1999; Defronzo, 1997).
Gen transcription factor 7 - like 2 (TCF7L2) disebut juga transcription factor 4 (TCF4). TCF7L2 merupakan faktor transkripsi dari famili box
high-mobility group (HMG) yang spesifik terhadap sel T yang berikatan dengan β-catenin, sinyal transduksi yang dihasilkan oleh reseptor Wingless-type mouse mammary tumor virus (MMTV) integration site family member (Wnt) pada permukaan sel untuk memodifikasi ekspresi berbagai gen yang berhubungan dengan siklus sel (Xavier et al., 2009). Gen ini mempunyai 215,863 basa terletak pada lengan panjang kromosom 10 (10q25.3) (Helgason et al., 2007). Gen TCF7L2 terdiri dari 14 exon dan 13 intron, namun penelitian sebelumnya menyatakan bahwa gen TCF7L2 terdiri dari 17 exon (Tong et al., 2009). Heterodimerisasi TCF7L2 dengan β-catenin meregulasi transkripsi sejumlah gen termasuk gen proglukagon intestinal (Lyssenko et al., 2007). Mekanisme patogenik TCF7L2 menyebabkan intoleransi glukosa atau DM tipe 2 yaitu berkurangnya sekresi insulin, efek resistensi insulin atau penurunan proses sel proinsulin (Yu et al., 2009). Jalur Wnt berperan penting dalam regulasi ekspresi gen proglukagon dan sekresi produk GLP-1 pada sel L intestinal melalui aktivasi dari TCF7L2. Transcription factor-7 like-2 yang mengaktivasi ekspresi gen proglukagon didalam sel intestinal sehingga mampu mensekresikan GLP-1 dan GLP-1 berperan menginduksi sekresi insulin (Yu et al., 2009). Aktivasi sinyal Wnt menyebabkan akumulasi β-catenin didalam nukleus yang akan berikatan dengan T-cell factor (TCF)/limfoid pada faktor transkripsi sehingga meregulasi transkripsi gen target sinyal Wnt (Yang et al., 2012).
Grant et al. (2006) melaporkan adanya hubungan kuat terjadinya DM tipe 2 dalam marker mikrosatelit tetranukleotida yaitu DG10S478 yang berlokasi dalam intron 3 pada gen TCF7L2. Didapatkan lagi lima SNP yang berhubungan
dengan DG10S478 dalam linkage disequilibrium (LD) dari intron 3 sampai intron 4 yang menunjukkan hubungan dengan terjadinya DM tipe 2. Ada dua SNP yang berperan kuat terhadap terjadinya DM tipe 2 yaitu rs7903146 dan rs12255372 (Kunika et al., 2008). Single nucleotide polymorphism rs7903146 pada intron 3 merupakan perubahan alel C menjadi alel T (IVS3C>T). Polimorfisme rs7903146 (IVS3C/T) gen TCF7L2 berperan dalam patogenesis DM tipe 2 yaitu mempengaruhi regulasi transkripsi pada hormon insulinotropik GLP-1 sehingga menurunkan sekresi insulin dan meningkatkan produksi glukosa dihepatik. Alel T pada rs7903146 gen TCF7L2 dihubungkan dengan gangguan sekresi insulin dan peningkatan sensitivitas insulin (Alibegovic et al., 2010).
Glucagon like-peptide-1 disekresi oleh sel L intestinal dalam merespon glukosa, dan nutrisi lainnya. Ketika GLP-1R berikatan dengan GLP-1 akan teraktivasi membentuk kompleks G-protein dan memfasilitasi subunit Gαs. Ikatan
ini akan mengaktivasi adenylate cyclase (AC) yang akan memproduksi cyclic adenosine 3′,5′-monophosphate (cAMP) dan konsentrasi cAMP meningkat didalam intraseluler dan juga mengaktivasi protein kinase A (PKA) dan (the cAMP-regulated guanine nucleotide exchange factor (cAMP-GEF) (Epac) (Meloni et al., 2012). Glucagon like-peptide-1 memediasi aktifitas PKA dalam fosforilasi subunit kanal K+ATP melalui mekanisme ADP-dependen. Diikuti oleh
depolarisasi membran dan memicu jalur sekresi insulin. Epac2 juga mengahambat fungsi kanal K+ATP pada sel beta pankreas melalui interaksi dengan SUR1.
Terjadinya metabolisme glukosa juga menyebabkan peningkatan ATP yang menyebabkan penutupan kanal K+ATP (Meloni et al., 2012). Penutupan ini,
memfasilitasi terbukanya voltage-dependent Ca2+ channel (VDCC) dan menghambat repolarisasi membran melalui terbukanya voltage-dependent K+ channel (Kv). Terjadinya depolarisasi membran, Kv terbuka untuk kembali keluar
kemembran potensial sehingga terjadi peningkatan ion K+ diekstraseluler (Meloni et al., 2012). Glucagon like-peptide-1 – receptor agonis (GLP-1 dan exendin-4) melawan aliran K+ yaitu exendin-4 menghambat K+ keluar sehingga terjadinya kelambatan repolarisasi membran dan Ca2+ mempunyai waktu yang panjang untuk masuk kedalam intraseluler melalui VDCC sehingga terjadinya sekresi insulin. Sekresi insulin ini merupakan fase pertama terjadinya sekresi insulin (Meloni et al., 2012).
Peningkatan Ca2+ bebas diintraseluler memicu peningkatan exositosis insulin, GLP-1R menstimulasi CICR untuk memfasilitasi produksi ATP. GLP-1 meningkatkan konsentrasi Ca2+ dan konsentrasi ATP. Peningkatan Ca2+ mengaktivasi dehidrogenase mitokondria (piruvat, isositrat, dan 2-oxoglutarat dehidrogenase) untuk meningkatkan produksi ATP karena adanya glukosa. Produksi ATP dan modulasi ATP/ADP seluler menyebabkan berkelanjutan penutupan kanal K+ATP dan depolarisasi sehingga terjadi peningkatan sekresi
insuin. Stimulasi GLP-1 menyebabkan berkelanjutnya terus menerus sekresi insulin sampai konsentrasi glukosa turun dalam respon insulin (Meloni et al., 2012).
Transcription factor 7-like 2/β-catenin juga meregulasi ekspresi gen IRS-1 sebagai sinyal dalam perkembangan sel kanker (Bomer et al., 2009). Insulin receptor substrate-1 juga berperan penting pada proses sekresi insulin sebagai
reseptor dalam sekresi insulin yang memediasi aksi seluler insulin (Wilcox, 2005). β–catenin berikatan dengan TCF pada elemen intron pertama dan pada daerah downstream star-transcription IRS-1 (Bomer et al., 2009).
3.Landasan Teori
Diabetes melitus tipe 2 adalah penyakit metabolik kompleks yang dipengaruhi oleh interaksi genetik dan lingkungan yang ditandai oleh peningkatan kadar glukosa dalam plasma yang disebabkan oleh gangguan sekresi insulin dan/atau resistensi insulin.
Transcription factor-7 like-2 merupakan gen yang mengkode faktor transkripsi yang berperan dalam jalur sinyal Wnt yang berfungsi untuk meregulasi ekspresi gen proglukagon, ekspresi gen IRS-1 dan sekresi GLP-1. Transcription factor-7 like-2 dan β-catenin berikatan dengan promotor gen proglukagon didalam sel intestinal sehingga mengahasilkan GLP-1. Transcription factor-7 like-2 dan β-catenin juga berikatan dengan promoter gen IRS-1 pada daerah intron sehingga dapat berperan sebagai reseptor dalam sekresi insulin.
Glucagon like-peptide-1 berperan meningkatkan sekresi insulin. Glucagon like-peptide-1 mensekresikan insulin melalui ikatan dengan GLP-1R pada sel β pankreas sehingga mengaktivasi adenylate cyclase (AC) yang akan memproduksi cAMP dan juga mengaktivasi protein kinase A (PKA) dan (the cAMP-regulated guanine nucleotide exchange factor (cAMP-GEF) (Epac) yang memfasilitasi terjadinya penutupan kanal K+ dan depolarisasi dan memfasilitasi terbukanya voltage-dependent Ca2+ channel (VDCC) sehingga terjadi sekresi insulin.
Kelebihan Ca2+ dalam intraseluler menyebabkan peningkatan exositosis granula yang menyebabkan peningkatan sekresi insulin.
Polimorfisme rs7903146 gen TCF7L2 menyebabkan penurunan aktivitas GLP-1 untuk meregulasi sekresi insulin. Penurunan sekresi insulin menyebabkan peningkatan produksi glukosa hepatik dan penurunan penggunaan glukosa oleh jaringan sehingga mengakibatkan hiperglikemia kronis. Hiperglikemia kronis yang berkepanjangan menyebabkan kelelahan sel β pankreas sehingga terjadi DM tipe 2.
4.Metode Penelitian
Penelitian ini merupakan penelitian desain case-control. Subyek dalam penelitian ini dibagi menjadi 2 kelompok. Kelompok kasus adalah subyek dengan riwayat keluarga DM tipe 2 yang didapat di RSUP. Sardjito-Yogyakarta. Kelompok kontrol adalah subyek tanpa riwayat keluarga DM diambil dari masyarakat umum Kota Yogyakarta.
Adapun kriteria inklusi yang digunakan adalah individu yang sehat, laki-laki atau perempuan dengan usia 19 - 39 tahun, mempunyai riwayat keluarga DM tipe 2, IMT ≤ 24 kg/m2 dan bersedia menjadi subyek penelitian. Penelitian ini meliputi pengambilan sampel darah sebanyak 5 mL, pemeriksaan glukosa darah puasa (GDP), pemeriksaan kadar insulin menggunakan metode enzyme-linked immunosorbent assay (ELISA) dari kit DRG insulin, dihitung nilai HOMA-β dan HOMA-IR, dan pemeriksaan polimorfisme rs7903146 gen TCF7L2 dengan metode Restriction Fragment length Polymorphism (RFLP).
1. Pemeriksaan glukosa darah menggunakan metode glucose oxydase-p-amino phenazone (GOD-PAP)
Pemeriksaan ini dilakukan dengan pencampuran sampel sebanyak 2 µL dan reagen masing-masing sebanyak 1000 µL. Setelah dicampur, diinkubasi pada suhu 25oC selama 10 menit. Kadar diukur menggunakan alat microlab 300 dengan panjang gelombang 450 nm. Intensitas warna yang terbentuk sebanding dengan konsentrasi glukosa pada sampel.
2. Pemeriksaan kadar insulin plasma menggunakan metode enzyme immunoassay (EIA) dari kit ELISA insulin DRG
Pemeriksaan ini menggunakan plat microtiter well yang sudah berisi anti-insulin monoclonal. Sumuran pada lajur 1 berisi 25 µL larutan standar 0-5, lajur 2-6 berisi 25 µL sampel kelompok kasus dan lajur 7-11 berisi 25 µL sampel kelompok kontrol. Setiap sumuran masing-masing diisi 25 µL enzim konjugat dan dicampur dengan cara well digoyang cepat selama 10 detik dan diinkubasi selama 30 menit pada suhu ruang. Setelah inkubasi, well dicuci sebanyak 3 kali menggunakan 400 µL wash solution dan well dihentakkan pada tisu untuk membersihkan sisa reagen. Pada setiap well ditambahkan lagi 50 µL enzim kompleks dan diinkubasi selama 30 menit pada suhu ruang. Setelah inkubasi, well dicuci lagi sebanyak 3 kali menggunakan 400 µL wash solution dan well dihentakkan pada tisu untuk membersihkan sisa reagen. Pada setiap well ditambahkan lagi 50 µL substrate solution dan diinkubasi selama 15 menit pada suhu ruang. Setelah inkubasi, setiap well ditambahkan lagi 50 µL stop solution dan dibaca nilai absorban pada setiap well dengan menggunakan microtiter plate reader dengan panjang gelombang 450±10 nm.
Setelah didapatkan kadar insulin, dihitunglah nilai β dan HOMA-IR untuk mengetahui fungsi sel beta dan nilai resistensi insulin dengan rumus:
3. Pemeriksaan polimorfisme rs7903146 (IVS3C/T) gen TCF7L2
a. Isolasi DNA (menggunakan kit Wizard® Genomic DNA Purification
Promega)
Pada isolasi DNA dibutuhkan 400 µL sampel leukosit menggunakan tube 1,5 mL. Sampel ditambahkan 900 µL erythrocyte lysis buffer, dibolak-balik agar tercampur rata dan diinkubasi selama 10 menit pada suhu 2-8oC. Setelah inkubasi, sampel disentrifus selama 10 menit dengan kecepatan 13000 rpm pada suhu 10oC. Setelah sentrifus, supernatan dibuang dan tube dibersihkan dengan cara membalikkan tube pada kertas tisu. Diperhatikan kejernihan supernatan, jika belum jernih lakukan langkah awal sampai langkah pembersihkan tube sebanyak 7 kali. Setelah didapatkan supernatan jernih, ditambahkan 300 µL nucleid lysis solution dan 100 µL protein precipitation solution dan divortex selama 20 detik. Setelah divortex, disentrifus selama 5 menit dengan kecepatan 13000 rpm. Setelah disentrifus, dituang supernatan ada tube baru yang telah berisi isopropanol, dibolak balik hingga merata dan disentrifus selama 5 menit dengan kecepatan 13000 rpm. Setelah itu, dibuang supernatan dan ditambahkan 300 µL etanol 70% dan disentrifus selama 5 menit dengan kecepatan 13000 rpm. Setelah disentrifus,
HOMA β = 360 x insulin puasa (µU/mL) % glukosa puasa (mg/dL) – 63
HOMA-IR = glukosa puasa (mg/dL) x insulin puasa (µU/mL) 405
etanol 70% dibuang dari dalam tube dan tube dikeringkan dalam oven 37oC selama 30 menit. Setelah dikeringkan, ditambahkan 100 µL DNA rehydration solution dan diinkubasi selama 12 jam pada suhu 4oC. Disimpan pada suhu -20oC jika belum di PCR.
b. Amplifikasi DNA untuk gen TCF7L2
Pemeriksaan ini dilakukan dengan pencampuran 15 µL PCR mix, 11 µL H2O, 2 µL primer, 2 µL DNA kedalam satu tube dan disentrifus selama 1 menit
dengan kecepatan 3500 rpm. Susunan primer yang digunakan yaitu forward primers 5' - GAG AGC TAAGCA CTT TTT AGGTA - 3', reverse primers 5' - CTG ACA TTG ACT AAG TTA CTT GC - 3'.
Kondisi temperatur siklus PCR: Denaturasi awal pada suhu 95oC selama 15 menit. Dilanjutkan 35 siklus PCR: denaturasi pada suhu 95oC selama 30 detik, annealing pada 54oC 30 detik, extension pada 72oC 30 detik, final extension pada suhu 72oC selama 5 menit, dan Cooling pada suhu 4oC. PCR running selama 1 jam 36 menit.
c. Pemotongan produk PCR dengan metode Restriction Fragment length Polymorphism (RFLP)
Pemeriksaan ini dilakukan dengan mencampur 0,5 µL enzim restriksi Rsa1, 4,5 µL H2O, 1 µL buffer tango, 4 µL DNA kedalam satu tube dan
disentrifus selama 1 menit dengan kecepatan 3500 rpm. Diinkubasi pada suhu 37oC selama 16 jam. Alel C terpotong menjadi 2 fragmen (91 dan 22 bp) dan alel T tidak terpotong (113 bp).
Pemeriksaan ini dimulai dengan pembuatan gel agarosa 3% dengan cara menimbang 3 g agarosa untuk dilarutkan ke dalam buffer TBE 0,5x hingga volumenya 100 mL dan dididihkan hingga larut. Setelah didih, ditambahkan 4 µL ethidium bromide (EtBr) dan dituang kedalam baki gel agarosa hingga padat. Baki yang berisi gel agarosa dimasukkan kedalam tangki eletroforesis yang telah berisi larutan buffer TBE 0,5x. Setelah itu, dipipet produk PCR sebanyak 10 µL, marker 1,7 µL dan kontrol 10 µL ke dalam sumuran gel agarosa. Kabel dari sumber arus listrik dihubungkan ke tangki elektroforesis dan sumber arus dinyalakan dengan diatur voltase sebesar 100 V dan waktu running selama 35 menit. Setelah running selesai, gel dikeluarkan dan pita-pita DNA dibaca menggunakan UV transilluminator.
5.Hasil dan Pembahasan
1. Karakteritik subyek penelitian
Subyek penelitian ini adalah individu sehat yang mempunyai riwayat keluarga DM tipe 2 (orang tua DM tipe 2) sebagai subyek kasus dan individu
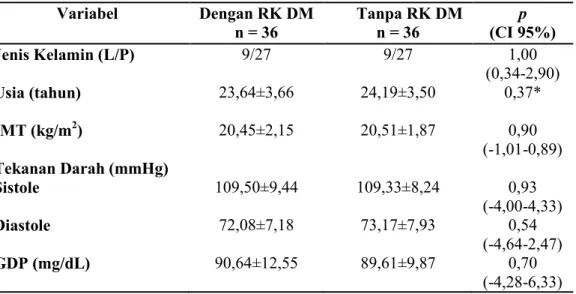
yang tidak mempunyai riwayat keluarga DM sebagai subyek kontrol. Semua subyek dalam penelitian ini memliki karakteristik kondisi tubuh yang normal (Tabel 1). Nilai kadar glukosa puasa pada semua subyek ≤ 126 mg/dL. Hal ini sesuai dengan karakteristik subyek yaitu individu sehat (tidak menderita DM). Menurut PERKENI (2011) bahwa diagnosis DM ditegakkan apabila kadar gula darah puasa (GDP) ≥ 126 mg/dL (7,0 mmol/L), tidak obesitas (≤ 25 kg/m2) dengan nilai rerata IMT kedua kelompok 20 kg/m2 dan memiliki nilai tekanan darah yang normal ( ≤ 140/90 mmHg) (WHO, 2011).
Tabel 1. Karakteristik subyek dengan dan tanpa RK DM Data dilaporkan dalam bentuk mean±SD.
Sebaran data diuji dengan Shapiro-Wilk : p ≥ 0,05.
Uji Independent sampel T-test: p ≤ 0,05:berbeda bermakna. *Uji Mann-Whitney U: p < 0,05:berbeda bermakna.
2. Hasil pemeriksaan polimorfisme rs7903146 gen TCF7L2
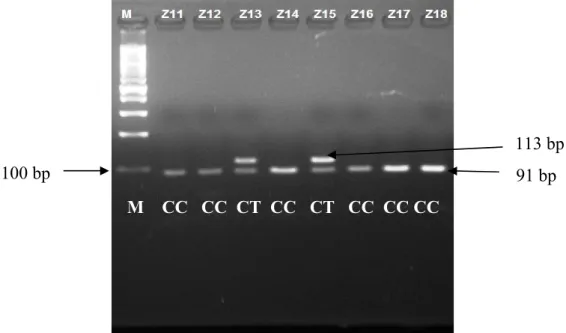
Hasil pemeriksaan genotip polimorfisme rs7903146 gen TCF7L2 pada penelitian ini hanya ditemukan 2 genotip pada setiap kelompok. Genotip yang ditemukan yaitu genotip homozigot wild type (CC) yang terdiri dari 2 band DNA
Variabel Dengan RK DM n = 36 Tanpa RK DM n = 36 p (CI 95%) Jenis Kelamin (L/P) Usia (tahun) IMT (kg/m2) Tekanan Darah (mmHg) Sistole Diastole GDP (mg/dL) 9/27 23,64±3,66 20,45±2,15 109,50±9,44 72,08±7,18 90,64±12,55 9/27 24,19±3,50 20,51±1,87 109,33±8,24 73,17±7,93 89,61±9,87 1,00 (0,34-2,90) 0,37* 0,90 (-1,01-0,89) 0,93 (-4,00-4,33) 0,54 (-4,64-2,47) 0,70 (-4,28-6,33)
dengan panjang 91 bp dan 22 bp, dan genotip mutasi heterozigot (CT) yang terdiri dari 2 band dengan panjang 113 bp dan 91 bp. Genotip mutan homozigot (TT) tidak ditemukan (113 bp).
Gambar 12.Hasil pemeriksaan genotip polimorfisme rs7903146 gen TCF7L2. M = Marker. Genotip CC = wild-type (91 bp dan 22 bp (tidak terlihat)), CT = mutan heterozigot (113 bp dan 91 bp).
Hasil ini berbeda dengan dengan penelitian-penelitian lain yang menemukan adanya genotip TT dalam populasi Jepang dan India (Miyake et al., 2007; Jyothi et al., 2008). Penelitian Wang et al. (2013) juga menemukan genotip TT pada populasi Cina dan penelitian Marquizine et al. (2008) juga menemukan genotip TT pada populasi Brazil. Kemungkinan tidak ditemukannya genotip TT pada penelitian ini karena (1) penelitian ini memeriksa subyek yang sehat (bukan penderita DM), (2) jumlah sampel yang lebih kecil dibanding penelitian lain.
3. Distribusi Frekuensi Genotip dan Alel Polimorfisme rs7903146 Gen TCF7L2 Pada Subyek dengan dan tanpa RK DM
113 bp 91 bp 100 bp
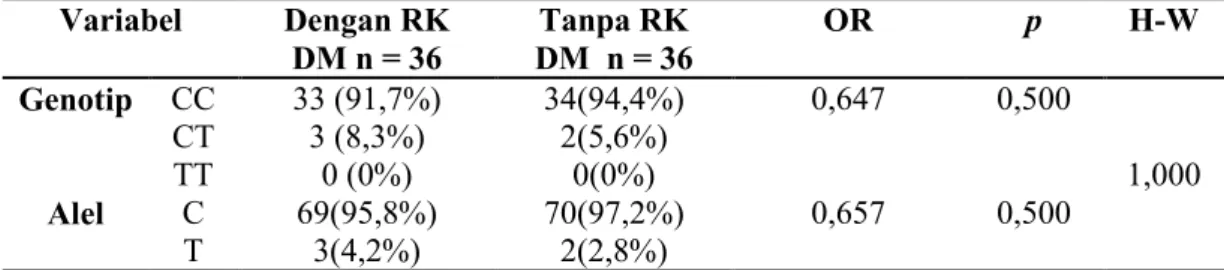
Pada penelitian ini didapatkan frekuensi genotip homozigot wild type CC lebih tinggi dibandingkan genotip mutan heterozigot CT. Subyek dengan RK DM ditemukan adanya genotip CC sebanyak 33 orang (91,7%) dan genotip CT sebanyak 3 orang (8,3%) dan pada subyek tanpa RK DM ditemukan genotip CC sebanyak 34 orang (94,4%) dan genotip CT sebanyak 2 orang (5,6%). Didapatkan frekuensi alel wild type C juga lebih tinggi dibanding alel mutan T. Subyek dengan RK DM ditemukan alel C sebanyak 69 orang (95,8%) dan alel T sebanyak 3 orang (4,2%) dan pada subyek tanpa RK DM ditemukan alel C sebanyak 70 orang (97,2%) dan alel T sebanyak 2 orang (2,8%) (Tabel 2).
Tabel 2. Distribusi genotip (TT, CT, dan CC) dan alel (T dan C) polimorfisme rs7903146 gen TCF7L2 pada subyek dengan dan tanpa RK DM
Uji Pearson Chi-square-Fishers Exact Test: p < 0,05: berbeda bermakna. H-W= Keseimbangan Hardy-Weinberg.
Hasil ini sejalan dengan beberapa penelitian lain yang mendapatkan frekuensi genotip wild type CC lebih tinggi dibanding genotip mutan CT pada populasi Jepang, India Hyderabad, India Pima (Miyake et al., 2008; Jyothi et al., 2013; Guo et al., 2007) Berbeda dengan penelitian pada populasi Brazil, Italia, dan Belanda mendapatkan frekuensi genotip wild type CC lebih rendah dibanding genotip mutan CT (Marquizine et al., 2008; Gambino et al., 2010; Vliet et al., 2006). Variabel Dengan RK DM n = 36 Tanpa RK DM n = 36 OR p H-W Genotip CC CT TT 33 (91,7%) 3 (8,3%) 0 (0%) 34(94,4%) 2(5,6%) 0(0%) 0,647 0,500 1,000 Alel C T 69(95,8%) 3(4,2%) 70(97,2%) 2(2,8%) 0,657 0,500
Distribusi genotip rs7903146 gen TCF7L2 pada penelitian ini tidak menyimpang dari keseimbangan Hardy-Weinberg. Dihitung dengan rumus keseimbangan Hardy-Weinberg didapatkan nilai p = 1,000. Artinya bahwa frekuensi genotip dan alel tersebut merata dalam populasi.
Pengaruh genotip CT kurang berisiko terhadap subyek dengan RK DM tipe 2 pada populasi Jawa dengan nilai OR sebesar 0,647. Hasil OR < 1 menunjukkan arti kurang berisiko, sehingga genotip CT kurang berisiko terhadap terjadinya DM tipe 2 pada subyek dengan RK DM tipe 2 pada populasi Jawa. Alel T juga menunjukkan kurang berisiko terhadap subyek dengan RK DM tipe 2 pada populasi Jawa dengan nilai OR sebesar 0,657.
Hasil ini sama dengan penelitian pada populasi Arab dan India Pima bahwa rs7903146 kurang berisiko terhadap terjadinya DM tipe 2 (OR=1,04; OR=1,04) (Alsmadi et al., 2008 ; Guo et al., 2007). Berbeda dengan hasil penelitian pada populasi Perancis dan Italia bahwa rs7903146 merupakan faktor risiko terjadinya DM tipe 2 (OR=2,64; OR=3,56) (Moczulski et al., 2007; Gambino et al., 2010).
4. Perbedaan Rerata Kadar Insulin, Nilai HOMA-β dan Nilai HOMA-IR Pada Subyek Dengan dan Tanpa RK DM
Berdasarkan hasil analisis statistik didapatkan perbedaan yang bermakna rerata kadar insulin , nilai HOMA-β dan nilai HOMA-IR antara subyek dengan RK DM tipe 2 dengan subyek tanpa RK DM (p = 0,00) (Tabel 3). Hal ini menunjukkan subyek dengan RK DM mengalami penurunan sekresi insulin.
Tabel 3. Perbedaan rerata kadar insulin, HOMA-β dan HOMA-IR antara subyek dengan dan tanpa RK DM
Variabel Dengan RK DM n = 36
Tanpa RK DM n = 36
p Kadar Insulin (µIU/mL) 9,77±6,35 16,18±3,76 0,00
HOMA-β (%) 132,56±62,48 266,09±1,68 0,00
HOMA-IR 2,28±1,66 3,64±0,95 0,00*
Hasil ini sejalan dengan hasil penelitian Chen et al. (2012) dan Arslanian et al. (2005) yang mendapatkan kadar insulin yang lebih rendah pada subyek dengan RK DM dibanding subyek tanpa RK DM. Kadar insulin yang rendah mengindikasikan terjadinya penurunan sekresi insulin akibat abnormalitas fungsi sel beta pankreas. Metode yang digunakan pada penelitian ini untuk menilai fungsi sel beta pankreas dalam mensekresikan insulin yaitu HOMA-β. Hal ini sejalan dengan penelitian Chen et al. (2012) yang menyatakan individu yang mempunyai riwayat keluarga DM mengalami penurunan fungsi sel β yang ditandai dengan rendahnya nilai HOMA-β dibandingkan dengan nilai HOMA-β pada individu tanpa riwayat keluarga DM.
Nilai HOMA-IR pada penelitian ini lebih tinggi pada subyek tanpa RK DM dibanding subyek dengan RK DM tetapi berdasarkan statistik menunjukkan perbedaan yang tidak bermakna. Hasil ini berbeda dengan hasil penelitian Chen et al. (2012) yang secara signifikan nilai HOMA-IR lebih tinggi pada individu dengan riwayat keluarga DM dibanding individu tanpa riwayat keluarga DM atau lebih besar risiko terjadinya resistensi insulin pada individu dengan riwayat keluarga DM. Penelitian Arslanian et al. (2005) juga mendapatkan nilai sensitivitas insulin yang rendah pada subyek dengn RK DM dibanding subyek
tanpa RK DM sehingga mengindikasikan nilai resistensi insulin yang tinggi pada subyek dengan RK DM tipe 2.
5. Pengaruh Genotip CC dan CT Polimorfisme rs7903146 Gen TCF7L2 Terhadap Kadar Insulin, Nilai HOMA-β dan HOMA-IR Pada Subyek Dengan dan Tanpa RK DM
Berdasarkan analisis statistik didapatkan kadar insulin pada genotip CC dan CT pada masing-masing subyek dengan dan tanpa RK DM tidak berbeda bermakna (p = 0,40 dan p = 0,54). Nilai HOMA-β pada genotip CC dan CT pada subyek dengan dan tanpa RK DM juga masing-masing tidak berbeda bermakna (p = 0,53 dan p = 0,30) dan nilai HOMA-IR pada genotip CC dan CT pada subyek dengan RK DM tipe 2 juga tidak berbeda bermakna (p = 0,34) dan juga subyek tanpa RK DM (p = 0,75). Hal ini bisa terjadi, kemungkinan karena (1) pada populasi Jawa kurang berisiko polimorfisme rs7903146 gen TCF7L2 sehingga penurunan sekresi insulin berdasarkan polimorfisme genotip kurang signifikan menurun, (2) pada penelitian ini menggunakan subyek sehat (subyek dengan riwayat keluarga DM tipe 2) dan penelitian lain menggunakan subyek penderita DM tipe 2 sehingga penurunan sekresi insulinnya akan signifikan menurun.
6. Kesimpulan
Dari hasil penelitian disimpulkan bahwa terdapat polimorfisme rs79030143 gen TCF7L2 pada individu yang mempunyai riwayat keluarga DM
tipe 2. Frekuensi genotip CT dan TT tidak berbeda bermakna antara individu yang mempunyai riwayat dan tanpa riwayat keluarga DM. Nilai β dan HOMA-IR pada individu dengan riwayat keluarga DM tipe 2 lebih rendah dari pada individu tanpa riwayat keluarga DM dan nilai HOMA-β dan HOMA-IR tidak berbeda bermakna antara genotip CC dan genotip CT.