IV. HASIL DAN PEMBAHASAN
4.1 Hasil4.1.1 Perhitungan Kepadatan Artemia dan Kutu Air serta Jumlah Koloni Bakteri
Sebanyak 1,2 x 108 sel bakteri hasil kultur yang membawa konstruksi gen keratin-GFP ditambahkan ke dalam media perendaman Artemia dengan kepadatan 15.000 ekor (202,17±0,12 mg berat basah) atau sekitar 100 ekor/ml (Tabel 4). Karena ukuran naupli Artemia dan kutu air berbeda, maka jumlah individu kutu air yang dimasukkan ke dalam media perendaman disesuaikan berdasarkan persamaan berat basah. Dengan berat basah yang sama, dalam 202,57±0,10 mg kutu air terdapat sebanyak 5.450 ekor. Hasil ini menunjukkan bahwa dengan berat yang sama, perbandingan jumlah individu antara Artemia dan kutu air adalah sekitar 1:3.
Tabel 4. Jumlah sel bakteri, kepadatan Artemia dan kutu air
No Perlakuan Bobot Basah
(mg) Jumlah Artemia (ekor) Jumlah Sel Bakteri (cfu/ml)
1 Artemia 202,17 ± 0,12a 15.000
1,2 x 108
2 Kutu Air 202,57 ± 0,10a 5.450
Keterangan: huruf yang sama di belakang nilai bobot basah Artemia dan kutu air menunjukkan tidak berbeda nyata (p>0,05).
4.1.2 Produk Isolasi DNA Genom Artemia dan Kutu Air
Isolasi DNA genom dari Artemia dan kutu air telah berhasil dilakukan dengan kualitas (kemurnian) dan kuantitas berdasarkan spektrofotometer ditunjukkan pada Tabel 5. Analisis kualitas berdasarkan elektroforesis pada gel agarosa 0,7% ditunjukkan pada Gambar 5. DNA hasil isolasi genom Artemia dengan rasio berkisar antara 1,778-1,949 menunjukan bahwa DNA pada masing-masing perlakuan adalah bersih atau bebas kontaminan. Hal ini seperti dikatakan oleh Muladno (2002), bahwa DNA dikatakan murni apabila nilai rasio (λ260/λ280) berkisar antara 1,8-2,0. Dengan demikian, DNA hasil isolasi tersebut layak digunakan untuk proses amplifikasi PCR. Konsentrasi DNA hasil isolasi berkisar antara 92-176 ng/µL.
Tabel 5. Konsentrasi dan kemurnian DNA genom hasil isolasi dari Artemia
Perlakuan [DNA] (ng/µl) Rasio (λ260/λ280) Kemurnian (%)
A1 96 1,794 99 A2 160 1,896 100 A3 172 1,811 100 A4 176 1,778 98 A5 124 1,949 100 A6 132 1,833 100 NA 92 1,806 100
Gambar 5. Elektroforesis hasil isolasi DNA Artemia. A1: perlakuan perendaman Artemia selama 30 menit, A2: selama 1 jam, A3: selama 1,5 jam, A4: selama 2 jam, A5: selama 2,5 jam, dan A6: selama 3 jam. NA: DNA Artemia tanpa perlakuan perendaman. M: Marker DNA 1 kb ladder. Angka di sebelah kiri gambar menunjukkan ukuran fragmen DNA marker.
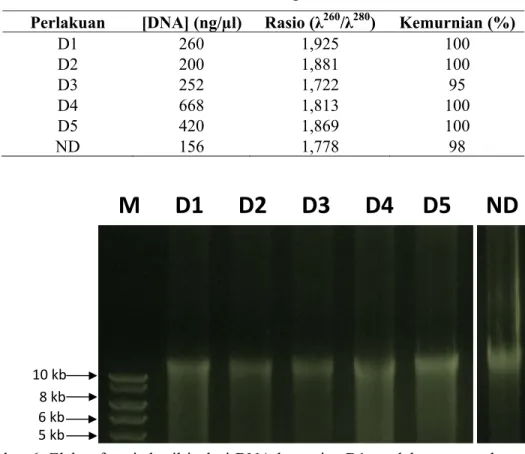
Seperti halnya Artemia, isolasi DNA genom dari kutu air pun telah berhasil dilakukan dengan kualitas (kemurnian) dan kuantitas berdasarkan spektrofotometer ditunjukkan pada Tabel 6, dan pengecekan kualitas berdasarkan elektroforesis pada gel agarosa 0,7% ditunjukkan pada Gambar 6. Rasio (1,722-1,925) dan kemurnian (95-100%) yang baik pun ditunjukan pada DNA genom hasil isolasi dari kutu air (Tabel 6). Kualitas DNA tersebut layak digunakan untuk proses amplifikasi PCR. Konsentrasi DNA hasil isolasi berkisar antara 156-668 ng/µL, lebih tinggi dibandingkan dengan DNA genom dari Artemia.
M A1 A2 A3 A4 A5 A6 NA
10 kb 5 kb 3 kb 2 kb 8 kb 1,2 kbTabel 6. Konsentrasi dan kemurnian DNA genom hasil isolasi dari kutu air
Perlakuan [DNA] (ng/µl) Rasio (λ260/λ280) Kemurnian (%)
D1 260 1,925 100 D2 200 1,881 100 D3 252 1,722 95 D4 668 1,813 100 D5 420 1,869 100 ND 156 1,778 98
Gambar 6. Elektroforesis hasil isolasi DNA kutu air. D1: perlakuan perendaman kutu air selama 2 jam, D2: selama 4 jam, D3: selama 6 jam, D4: selama 8 jam, dan D5: selama 10 jam. NA: DNA kutu air tanpa perlakuan perendaman. M: Marker DNA 1 kb ladder. Angka di sebelah kiri gambar menunjukkan ukuran fragmen DNA marker.
4.1.3 Perancangan Primer β-Aktin Artemia dan Kutu Air
Primer β-aktin Artemia dan kutu air dirancang sebagai kontrol internal loading DNA dalam amplifikasi PCR. Baik primer β-aktin Artemia maupun kutu air dirancang dengan memilih lokasi potensial primer hasil penyejajaran basa nukloetida yang memiliki tingkat homologi paling tinggi (Gambar 7). Panjang sekuen berkisar 22-24 basa nukleotida. Sekuen basa nukleotida untuk primer β-aktin Artemia adalah BAr-F (5’-GCCATGTATGTTGCCATCCARG-3’) dan BAr-R (5’-TCAGCAGTGTGGTGGTRAARGA-3’), sedangkan sekuen primer β-aktin kutu air adalah BDa-F (5’-GACATCAAGGAGAARYTBTGCTAY-3’) dan BDa-R (5’-GTACAGATCCTTACGGATGTCGAC-3’). Primer forward dan reverse untuk Artemia, dan forward untuk kutu air merupakan primer mix, dengan R=A+G; Y=C+T; dan B=C+G+T.
M D1 D2 D3 D4 D5 ND
8 kb 10 kb 6 kb 5 kb
Gambar 7. Alignment sekuen parsial β-aktin Artemia fransciscana (no. Aksesi Bank Gen: AM850110.1), β-aktin Artemia sp. (no. Aksesi Bank Gen: X52605.1), dan β-aktin Calanus finmarchicus (no. Aksesi Bank Gen: U21222.1). Posisi primer forward BAr-F (5’-GCCATGTATGT-TGCCATCCARG-3’) dan primer reverse BAr-R (5’-TCAGCA-GTGTGGTGGTRAARG-A-3’) ditunjukan dengan tanda panah.
Artemia franciscana.txt 361 ACTCAGATTATGTTTGAGACCTTCAACAGCCCAGCCATGTATGTTGCCATCCAAGCCGTA 420 Artemia sp.txt 360 ACTCAGATCATGTTCGAAACATTCAACACCCCTGCCATGTATGTTGCCATCCAAGCCGTG 419 Calanus.txt 124 ACCCAGATCATGTTCGAGACCTTCAACATGCCCGCCATGTATGTTGCCATCCAGGCTGTC 183 AC CAGAT ATGTT GA AC TTCAACA CC GCCATGTATGTTGCCATCCA GC GT AC CAGAT ATGTT GA AC TTCAACA CC GCCATGTATGTTGCCATCCA GC GT AC CAGAT ATGTT GA AC TTCAACA CC GCCATGTATGTTGCCATCCA GC GT Artemia franciscana.txt 421 CTTTCACTCTACGCTTCCGGTCGTACAACTGGTATTGTCCTCGACTCTGGTGATGGTGTT 480 Artemia sp.txt 420 CTTTCCCTCTACGCATCTGGTAGAACTACTGGTATCGTTCTTGATTCAGGCGATGGTGTC 479 Calanus.txt 184 CTCTCCCTCTATGCTTCCGGCCGTACCACTGGTATCGTCATGGACTCTGGAGATGGTGTC 243 CT TC CTCTA GC TC GG G AC ACTGGTAT GT T GA TC GG GATGGTGT CT TC CTCTA GC TC GG G AC ACTGGTAT GT T GA TC GG GATGGTGT CT TC CTCTA GC TC GG G AC ACTGGTAT GT T GA TC GG GATGGTGT Artemia franciscana.txt 481 TCTCACACCGTTCCCATCTATGAAGGTTATGCCCTTCCTCATGCCATTCTCCGTCTTGAC 540 Artemia sp.txt 480 TCACATACCGTACCCATCTACGAAGGCTACGCTCTTCCACACGCAATTTTGAGATTGGAT 539 Calanus.txt 244 TCCCACGGTGTCCCCGTCTATGAAGGTTATGCCCTTCCCCATGCCATTGTCCGTCTTGAT 303 TC CA GT CCC TCTA GAAGG TA GC CTTCC CA GC ATT T G T GA TC CA GT CCC TCTA GAAGG TA GC CTTCC CA GC ATT T G T GA TC CA GT CCC TCTA GAAGG TA GC CTTCC CA GC ATT T G T GA
Artemia franciscana.txt 541 CTTGCTGGCCGTGACTTGACTGATTATTTGATGAAAATCTTGACTGAACGAGGTTACTCT 600 Artemia sp.txt 540 CTTGCTGGTCGAGATTTAACCGATTATTTGATGAAAATCCTAACCGAGCGAGGATATTCC 599 Calanus.txt 304 CTTGCTGGACGTGAGCTCACCAACTACCTGATGAAGATCCTCACTGAGCGTGGCTACTCT 363
CTTGCTGG CG GA T AC A TA TGATGAA ATC T AC GA CG GG TA TC CTTGCTGG CG GA T AC A TA TGATGAA ATC T AC GA CG GG TA TC CTTGCTGG CG GA T AC A TA TGATGAA ATC T AC GA CG GG TA TC
Artemia franciscana.txt 601 TTCACCACCACTGCTGAGCGTGAAATTGTCCGTGACATAAAGGAAAAACTTTGCTATGTC 660 Artemia sp.txt 600 TTTACCACCACTGCTGAAAGAGAAATTGTTCGTGATATCAAAGAAAAACTTTGTTATGTC 659 Calanus.txt 364 TTCACCACCACTGCTGAGCGCGAGATTGTCCGTGACATCAAGGAGAAGCTTTGCTATGAA 423 TT ACCACCACTGCTGA G GA ATTGT CGTGA AT AA GA AA CTTTG TATG TT ACCACCACTGCTGA G GA ATTGT CGTGA AT AA GA AA CTTTG TATG TT ACCACCACTGCTGA G GA ATTGT CGTGA AT AA GA AA CTTTG TATG BAr‐F BAr‐R
Daphnia magna Daphnia pulex Daphnia pulex Daphnia pulex Daphnia pulex Daphnia magna Daphnia pulex Daphnia pulex Daphnia pulex Daphnia pulex Daphnia magna Daphnia pulex Daphnia pulex Daphnia pulex Daphnia pulex Daphnia magna Daphnia pulex Daphnia pulex Daphnia pulex Daphnia pulex Daphnia magna Daphnia pulex Daphnia pulex Daphnia pulex Daphnia pulex 601 TTCACCAC CACCGCTGAGCGTGAA ATCGTCCGTGACATCAAGGAGAA ATTGTGCTATGTC 660 340 TTCACCAC CACTGCCGAGCGTGAA ATCGTTCGTGACATCAAGGAGAA ACTT TGCTATGTC 399 601 TTAACCAC CACCGCCGAGCGTGAAATCGTTCGTGACATCAAGGAGAA ATTGTGCTACGTC 660 601 TTCACCAC CACCGCTGAGCGTGAA ATCGTCCGTGACATCAAGGAGAA ATTGTGCTATGTC 660 601 TTCACCAC CACCGCCGAGCGTGAAATCGTTCGCGACATCAAGGAGAAGCTCTGCTATGTC 660 TT ACCAC CAC GC GAGCGTGAA ATCGT CG GACATCAAGGAGAA T TGCTA GTC TT ACCAC CAC GC GAGCGTGAA ATCGT CG GACATCAAGGAGAA T TGCTA GTC TT ACCAC CAC GC GAGCGTGAA ATCGT CG GACATCAAGGAGAA T TGCTA GTC TT ACCAC CAC GC GAGCGTGAA ATCGT CG GACATCAAGGAGAA T TGCTA GTC TT ACCAC CAC GC GAGCGTGAA ATCGT CG GACATCAAGGAGAA T TGCTA GTC 661 GCCCTTGACTTTGAACAGGA AATG GCCACTGCTGCTGCCTCCACCTCTTTG GAGA AATCC 720 400 GCTT TGGACTTCGAACAAGAGATG GCCACTGCTGC CTCCTCCACTTCATTG GAGA AGTCT 459 661 GCCCTAGACTTCGAACAGGA AATG GCCACCGCCGATGCCTCCACCTC CTTG GAGA AATCC 720 661 GCCCTGGACTTTGAACAGGA AATG GCCACTGCTGCTGCCTCCACCTCTTTG GAGA AATCC 720 661 GCCCTCGACTTTGAACAGGAGATGCCCACCGCCGC CTCCTCCACCTC CCTG GAAA AGTCG 720 GC T GACTT GAACA GA ATG CCAC GC G CCTCCAC TC TG GA A A TC GC T GACTT GAACA GA ATG CCAC GC G CCTCCAC TC TG GA A A TC GC T GACTT GAACA GA ATG CCAC GC G CCTCCAC TC TG GA A A TC GC T GACTT GAACA GA ATG CCAC GC G CCTCCAC TC TG GA A A TC GC T GACTT GAACA GA ATG CCAC GC G CCTCCAC TC TG GA A A TC 721 TATGAATTGCCCGATG GTCAGGTCATCACCATTGGCAACGAGCGATTCCGCTGCC CCGAG 780 460 TACGAACTCCCCGACG GTCAGGTCATCACCATTGGCAATGAGCGATTCCGT TGCC CAGAG 519 721 TACGAATTGCCCGATG GCCAGGTCATCACCATCGGTAACGAACGTTTCCGT TGCCCCGAA 780 721 TATGAATTGCCCGATG GTCAGGTCATCACCATTGGCAACGAGCGATT TCGCTGCC CCGAG 780 721 TACGAGCT TCCCGACG GTCAGGTCATCACCATCGGCAATGAGCGATTCCGT TGCCCCGAG 780 TA GA T CCCGA G G CAGGTCATCACCAT GG AA GA CG TT CG TGCC C GA TA GA T CCCGA G G CAGGTCATCACCAT GG AA GA CG TT CG TGCC C GA TA GA T CCCGA G G CAGGTCATCACCAT GG AA GA CG TT CG TGCC C GA TA GA T CCCGA G G CAGGTCATCACCAT GG AA GA CG TT CG TGCC C GA TA GA T CCCGA G G CAGGTCATCACCAT GG AA GA CG TT CG TGCC C GA 781 GCCCTCTTCCAGCCCTCATTCTTG GGTATGGAATCTTGCGGTATCCACGAGACCGTCTAC 840 520 GCCCTCTTCCAGCCTTCATTCTTG GGTATGGAGTCTTGCGGTCTGCATGAGACTACCTAC 579 781 GCCCTCTTCCAACCCTCATTCTTG GGTATGGAATCTTGCGGCATACACGAGACGGTCTAC 840 781 GCCCTCTTCCAGCCCTCATTCTTG GGTATGGAATCTTGCGGTATCCACGAGACCGTCTAC 840 781 GCTCTCTTCCAGCCCAGCTTCTTG GGTATGGAGTCTTGCGGCATCCACGAGACCACCTAC 840 GC CTCTTCCA CC TTCTTG GGTATGGA TCTTGCGG T CA GAGAC CTAC GC CTCTTCCA CC TTCTTG GGTATGGA TCTTGCGG T CA GAGAC CTAC GC CTCTTCCA CC TTCTTG GGTATGGA TCTTGCGG T CA GAGAC CTAC GC CTCTTCCA CC TTCTTG GGTATGGA TCTTGCGG T CA GAGAC CTAC GC CTCTTCCA CC TTCTTG GGTATGGA TCTTGCGG T CA GAGAC CTAC 841 AACTCGATCATGAAGTGCGACGTCGACATCCGTAAGGATCTGTACGC CAACACTGTCT TG 900 580 AACTCGATCATGAAGTGCGATGTCGACATCCGTAAGGATCTGTACGC CAACACTGTCCTT 639 841 AGCTCGATCATGAAGTGTGACGTCGACATCCGTAAGGATCTGTACGC CAACAATGTCCTC 900 841 AACTCGATCATGAAGTGCGACGTCGACATCCGTAAGGATCTGTACGC---A ACTGTCT TG 897 841 AACTCGATCATGAAGTGCGACGTCGACATCCGTAAGGATCTGTACGC CAACACTGTCCTG 900 A CTCGATCATGAAGTG GA GTCGACATCCGTAAGGATCTGTACGC A TGTC T A CTCGATCATGAAGTG GA GTCGACATCCGTAAGGATCTGTACGC A TGTC T A CTCGATCATGAAGTG GA GTCGACATCCGTAAGGATCTGTACGC A TGTC T A CTCGATCATGAAGTG GA GTCGACATCCGTAAGGATCTGTACGC A TGTC T A CTCGATCATGAAGTG GA GTCGACATCCGTAAGGATCTGTACGC A TGTC T BDa‐F BDa‐R
Gambar 8. Alignment sekuen parsial β-aktin Daphnia magna (no. Aksesi Bank Gen: AJ292554.1) dan beberapan sekuen β-aktin Daphnia pulex (no. Aksesi Bank Gen: AJ245730.1; AJ245731.1; AJ245732.1; AJ245733.1. Posisi primer forward BDa-F GACATCAAGGA-GAARYTBTGCTAY-3’) dan primer reverse BDa-R (5’-GTACAGATCCTTACGGATGTCGAC-3’) ditunjukan dengan tanda panah.
4.1.4 Visualisasi Produk PCR DNA Artemia dan Kutu Air
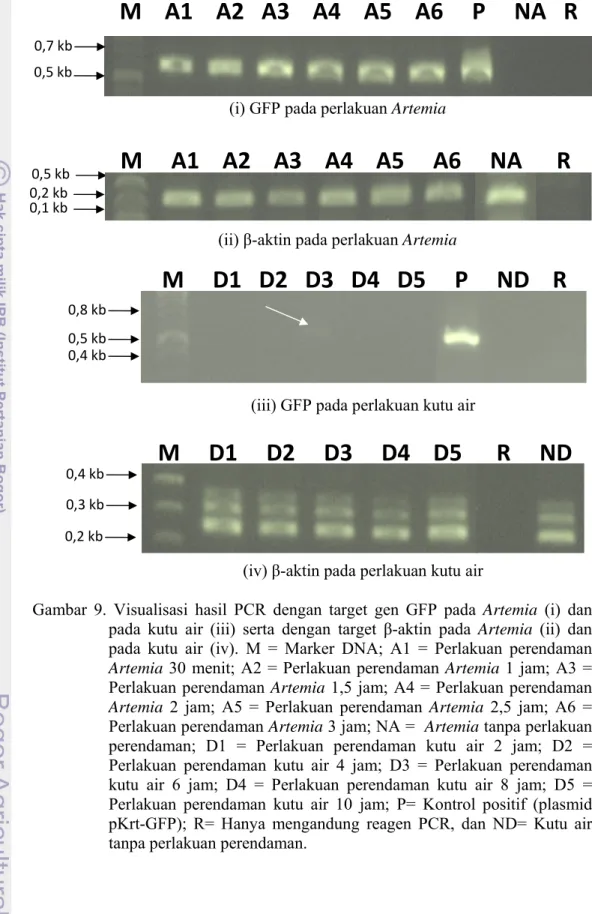
Produk PCR yang dihasilkan dengan menggunakan primer GFP berukuran 600 bp (Gambar 9). Secara umum pada Artemia, produk ini terlihat di setiap perlakuan. Sementara pada kutu air, produk PCR hanya terlihat pada 6 jam setelah pemberian bakteri. Produk PCR menggunakan primer β-aktin diperoleh pada semua perlakuan Artemia dan kutu air. Hal ini menunjukkan bahwa terdapat DNA genom sebagai cetakan dalam proses amplifikasi PCR.
0,5 kb 0,1 kb 0,2 kb
M A1 A2 A3 A4 A5 A6 NA R
(i) GFP pada perlakuan Artemia(ii) β-aktin pada perlakuan Artemia
(iii) GFP pada perlakuan kutu air
(iv) β-aktin pada perlakuan kutu air
Gambar 9. Visualisasi hasil PCR dengan target gen GFP pada Artemia (i) dan pada kutu air (iii) serta dengan target β-aktin pada Artemia (ii) dan pada kutu air (iv). M = Marker DNA; A1 = Perlakuan perendaman Artemia 30 menit; A2 = Perlakuan perendaman Artemia 1 jam; A3 = Perlakuan perendaman Artemia 1,5 jam; A4 = Perlakuan perendaman Artemia 2 jam; A5 = Perlakuan perendaman Artemia 2,5 jam; A6 = Perlakuan perendaman Artemia 3 jam; NA = Artemia tanpa perlakuan perendaman; D1 = Perlakuan perendaman kutu air 2 jam; D2 = Perlakuan perendaman kutu air 4 jam; D3 = Perlakuan perendaman kutu air 6 jam; D4 = Perlakuan perendaman kutu air 8 jam; D5 = Perlakuan perendaman kutu air 10 jam; P= Kontrol positif (plasmid pKrt-GFP); R= Hanya mengandung reagen PCR, dan ND= Kutu air tanpa perlakuan perendaman.
M A1 A2 A3 A4 A5 A6 P NA R
0,7 kb 0,5 kbM D1 D2 D3 D4 D5 P ND R
0,8 kb 0,5 kb 0,4 kb 0,4 kb 0,3 kb 0,2 kbM D1 D2 D3 D4 D5 R ND
4.1.5 Jumlah Copy DNA Asing dalam Artemia dan Kutu Air
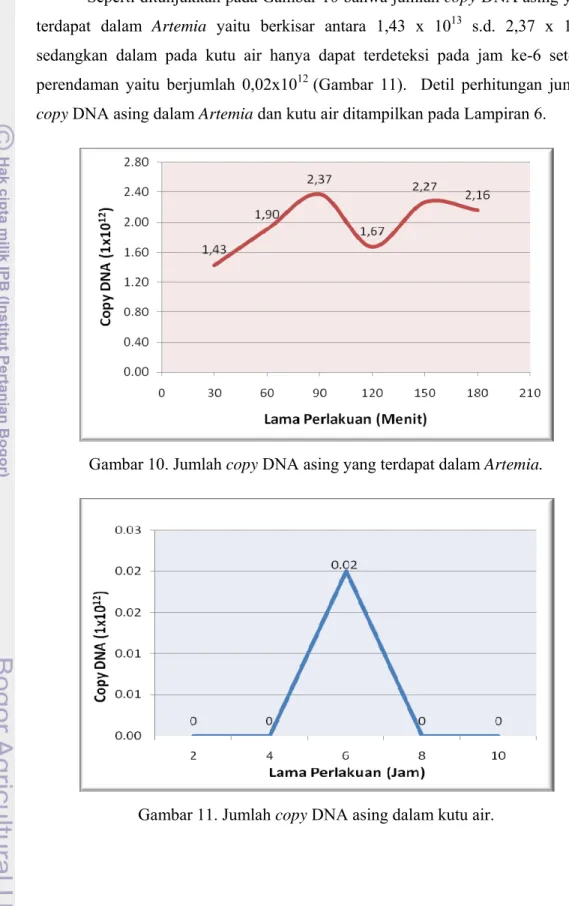
Seperti ditunjukkan pada Gambar 10 bahwa jumlah copy DNA asing yang terdapat dalam Artemia yaitu berkisar antara 1,43 x 1013 s.d. 2,37 x 1012, sedangkan dalam pada kutu air hanya dapat terdeteksi pada jam ke-6 setelah perendaman yaitu berjumlah 0,02x1012 (Gambar 11). Detil perhitungan jumlah copy DNA asing dalam Artemia dan kutu air ditampilkan pada Lampiran 6.
Gambar 10. Jumlah copy DNA asing yang terdapat dalam Artemia.
4.2. Pembahasan
Aplikasi protein rekombinan seperti rekombinan growth hormone (rGH) dan DNA rekombinan seperti halnya DNA vaksin, membutuhkan metode pemberian yang tepat. Dalam penelitian ini digunakan pakan alami sebagai vektor penyampaian DNA asing dalam bentuk konstruksi gen keratin-GFP sebagai model bagi vaksin DNA. Metode ini juga telah dibuktikan oleh Lin et al. (2005) bahwa Artemia mampu mengkonsumsi bakteri E. coli yang membawa konstruksi pET24a-GFP. Lebih lanjut Lin et al. (2005) melaporkan bahwa terdapat 105 bakteri yang terkandung dalam 1 ekor Artemia dan sekitar 80-90% mengandung antigen setelah 2 jam diberikan bakteri terkonstruksi pET24a-NNV VP. Penelitian ini mengacu kepada penelitian Lin et al. (2005). Pada penelitian ini digunakan 15.000 ekor naupli Artemia diberi bakteri sebanyak 15 x 108 cfu/ml yang membawa konstruksi gen pKrt-GFP (keratin-GFP). Selain itu, pada penelitian ini juga digunakan kutu air (Daphnia dan Moina) yang mewakili pakan alami untuk komoditas ikan air tawar. Jumlah kutu air dalam penelitian ini adalah sebanyak 5.450 ekor dengan cara menyamakan bobot basah dari 15.000 ekor Artemia yaitu 202,17 ± 12 mg, sehingga dapat dikatakan bahwa bobot Artemia berbanding kutu air adalah 1:3.
Hasil isolasi DNA genom dari Artemia dan kutu air termasuk bersih atau kontaminasi dari protein atau fenol sangat rendah, karena rasio λ260/λ280 adalah mendekati 1,800 (Muladno, 2002) dan kemurniannya lebih dari 95%. Selanjutnya, dengan menggunakan DNA genom hasil isolasi tersebut, produk PCR menggunakan primer β-aktin juga berhasil diperoleh dengan ukuran fragmen DNA sesuai dengan yang diprediksi yaitu sekitar 240 bp pada Artemia. Namun demikian pada kutu air terdapat tiga pita DNA yaitu sekitar 240 bp, 300 bp, dan antara 300-400 bp. Jumlah pita DNA lebih dari 1 ini diduga disebabkan karena primer didisain dari penyejajaran sekuen β-aktin dari Daphnia magna dan Daphnia pulex, sementara DNA yang digunakan berasal dari kutu air yang merupakan campuran antara Daphnia dan Moina. Diduga bahwa primer β-aktin yang digunakan mempunyai situs annealing berbeda antara Daphnia dan Moina.
Semua perlakuan waktu perendaman pada Artemia mengandung bakteri yang membawa DNA asing, sedangkan pada kutu air hanya terdapat pada
perlakuan 6 jam (Gambar 9i dan Gambar 9iii). Selain itu, waktu yang diperlukan oleh Artemia untuk memakan bakteri dalam jumlah tinggi lebih cepat dibandingkan dengan kutu air. Perbedaan ini diduga berhubungan dengan perilaku makan dari kedua spesies tersebut. Artemia bersifat non selective filter feeder sehingga mampu memakan apapun yang terdapat disekitarnya yang berukuran <50 mikron (Isnansetyo & Kurniastuty, 1995), sedangkan kutu air bersifat selective filter feeder artinya ukuran suspensi bahan organik yang dilalui dan masuk ke dalam tubuhnya adalah sama dengan ukuran mulutnya atau organ penyaringnya (Djarijah, 1996). Dengan demikian, dari segi jumlah bakteri atau dengan kata lain jumlah copy DNA asing yang dapat dimakan, maka Artemia lebih potensial digunakan sebagai pembawa DNA vaksin dibandingkan dengan kutu air.
Jumlah copy DNA asing yang terdapat dalam Artemia mencapai nilai tertinggi pada perendaman 1,5 jam (2,37x1012 copy DNA dalam 100 ekor Artemia). Jumlah copy DNA ini sebanding dengan 22,19 µg DNA (Lampiran 6).
Zheng et al. (2006), melaporkan dosis yang digunakan pada uji ekspresi vaksin DNA terhadap ikan Japanese flounder Paralichthys olivaceus adalah 15µg. Begitu pula dengan penelitian Zahro (2010), mengatakan bahwa dosis vaksin DNA terbaik yang digunakan pada uji tantang terhadap sintasan ikan mas yang diinfeksi koi herpes virus (KHV) adalah 12,5 µg (dengan jumlah copy DNA yaitu 13 x 1012).
Jika dikaitkan dengan hasil penelitian Zahro (2010) tersebut, dapat dikatakan jumlah copy DNA pada 100 ekor Artemia belum cukup dibanding dengan injeksi vaksin KHV sebesar 12,5 µg per ekor ikan mas dengan bobot rata-rata 15-20 gram. Hasil yang sebanding diperoleh jika 1 ekor ikan mas dengan umur dan ukuran yang sama, memakan 500 ekor Artemia atau sekitar 5 kali lipat dari jumlah copy DNA yang ada. Namun, dalam penelitian ini penyampaian konstrusksi DNA pKrt-GFP cukup efektif mengingat pakan alami dapat diberikan pada larva yang berumur lebih dari 2 minggu. Hal ini sesuai dengan Kordi (2004), menyatakan bahwa vaksin DNA kurang efektif diberikan pada ikan yang digunakan kurang dari 2 minggu dan berat badannya kurang dari 1 gram. Hal ini karena organ tubuh yang merespon kekebalan belum sempurna memproduksi
antibodi. Organ tubuh ikan yang berfungsi merespon kekebalan, akan tercapai sempurna setelah 2 minggu. Kordi (2004), juga menganjurkan melakukan vaksinasi pada umur tersebut dan kemudian dapat diulangi pada saat ikan berumur 2 bulan. Lin et al. (2005) melakukan pemberian vaksin VNN VP pada larva ikan kerapu melalui Artemia. Artemia yang telah disisipkan vaksin VNN VP diberikan pada larva kerapu yang berumur 18 hari. Pemberian Artemia tersebut dilakukan selama 17 hari sampai terbentuk sistem imun. Sehingga penelitian menggunakan konstruksi pKrt-GFP ini dengan perendaman 1,5 jam bisa dikatakan cukup sebanding untuk menginduksi sistem imun ikan mas.
Selanjutnya, Artemia diduga berhenti sementara untuk makan setelah 1,5 jam. Sebagian dari bakteri dilisis dan plasmid DNA dirusak oleh enzim restriksi endogenus sehingga jumlah copy DNA menurun menjadi 1,67 x 1012 copy pada perlakuan 2 jam perendaman. Dugaan tersebut diperkuat dengan munculnya pola yang sama apabila perendaman dilanjutkan, meskipun rentang waktunya lebih singkat dibandingkan dengan perlakuan 30 menit - 1,5 jam. Jumlah copy DNA meningkat kembali pada perlakuan 2,5 jam (2,27 x 1012 copy DNA) dan menurun pada perlakuan 3 jam (2,16 x 1012 copy DNA). Dalam hubungannya dengan vaksinasi melalui Artemia, lama waktu perendaman dan tingkat pemberian pakan yang efektif dalam arti memberikan induksi imunitas terbaik masih perlu diteliti.
Pada kutu air, keberhasilan dalam uptake bakteri yang mengandung DNA dengan konstruksi pKrt-GFP muncul pada 2 jam ketiga atau pada 6 jam setelah perendaman yaitu sebanyak 0,02 x 1012 copy DNA dengan konsentrasi 0,15 µl. Hal ini karena kutu air memiliki proses pencernaan internal yang mampu melisiskan sel bakteri (Hadas, 1983) dan diduga memotong DNA pKrt-GFP.
![Tabel 5. Konsentrasi dan kemurnian DNA genom hasil isolasi dari Artemia Perlakuan [DNA] (ng/µl) Rasio (λ 260 /λ 280 ) Kemurnian (%)](https://thumb-ap.123doks.com/thumbv2/123dok/4786138.3440807/2.918.182.737.137.644/tabel-konsentrasi-kemurnian-isolasi-artemia-perlakuan-rasio-kemurnian.webp)