I. Pendahuluan: Relevansi dengan Objektif Pendidikan
Bab ini memperkenalkan skripsi yang berfokus pada pengembangan sensor kimia bentuk stik untuk deteksi Rhodamin B dalam sampel makanan. Latar belakang menekankan pentingnya keamanan pangan dan dampak negatif Rhodamin B terhadap kesehatan. Rumusan masalah yang diajukan secara langsung berkaitan dengan pengembangan, pengoptimalan, dan validasi metode sensor kimia ini. Tujuan penelitian berfokus pada penentuan parameter kinerja sensor, termasuk sensitivitas, presisi, dan limit deteksi. Manfaat penelitian dijelaskan dari perspektif pendidikan, menekankan potensi aplikasi praktis dalam pengajaran kimia analitik dan peningkatan kesadaran konsumen. Secara keseluruhan, bab ini menggariskan bagaimana penelitian ini relevan dengan objektif pembelajaran yang menekankan pada penerapan prinsip-prinsip kimia analitik dalam konteks dunia nyata.
1.1 Latar Belakang
Bagian ini membincangkan isu keselamatan makanan dan bahaya Rhodamin B, memberikan konteks yang penting bagi pelajar untuk memahami keperluan sensor kimia yang efektif dan tepat. Ia menghubungkan isu semasa dengan prinsip-prinsip kimia analitik, membina pemahaman tentang aplikasi teori dalam penyelesaian masalah. Ia juga memperkenalkan metode-metode analisis sedia ada dan kelemahannya, seterusnya menekankan keunikan dan kelebihan pendekatan sensor kimia bentuk stik yang dicadangkan dalam penelitian ini. Oleh itu, bahagian ini membantu pelajar menilai keberkesanan pelbagai kaedah analisis dan membuat pertimbangan kritikal tentang pilihan kaedah yang sesuai.
1.2 Rumusan Masalah
Rumusan masalah berfungsi sebagai panduan pembelajaran dengan menerangkan soalan-soalan penyelidikan yang akan dijawab melalui penelitian ini. Ia membimbing pelajar dalam memahami langkah-langkah metodologi penyelidikan saintifik. Pelajar boleh belajar bagaimana untuk merumuskan soalan penyelidikan yang spesifik dan boleh diuji secara empirikal. Soalan-soalan ini juga memberi peluang kepada pelajar untuk mempraktikkan kemahiran penyelesaian masalah dan pemikiran kritis. Secara ringkasnya, bahagian ini mendedahkan proses penjanaan hipotesis dan persoalan penyelidikan yang jitu.
1.3 Tujuan Penelitian
Tujuan penelitian yang dinyatakan dengan jelas membolehkan pelajar memahami hala tuju dan skop penyelidikan. Ia memberikan sasaran pembelajaran yang spesifik dan boleh diukur. Pelajar dapat menilai seberapa jauh kajian ini berjaya mencapai objektifnya berdasarkan hasil dan perbincangan yang dibentangkan. Ia juga dapat membantu pelajar dalam merancang dan melaksanakan eksperimen sendiri, dengan menggariskan langkah-langkah yang sistematik dan terperinci. Ini menunjukkan nilai objektif yang jelas dan mudah difahami dalam proses pembelajaran.
1.4 Manfaat Penelitian
Bagian ini menjelaskan implikasi praktikal kajian, baik dari segi manfaat kepada masyarakat (penggunaan sensor yang cepat dan tepat) mahupun kepada bidang pendidikan (penambahbaikan kaedah pengajaran). Ia menekankan kepentingan kajian ini dalam mengaplikasikan pengetahuan saintifik untuk menyelesaikan masalah kehidupan seharian. Pelajar dapat memahami impak penyelidikan saintifik dan menghargai aplikasinya yang luas dalam menyelesaikan masalah dan meningkatkan kehidupan masyarakat. Ini menunjukkan nilai aplikasi pengetahuan dalam konteks masyarakat.
II. Tinjauan Pustaka: Pengukuhan Teori dan Prinsip
Bab ini menyediakan asas teori yang kukuh untuk memahami konsep-konsep utama yang berkaitan dengan penyelidikan, termasuk bahan tambahan makanan, zat pewarna, Rhodamin B, sensor kimia, dan spektrofotometri UV-Vis. Ia merangkumi teori-teori dan prinsip-prinsip kimia analitik yang relevan, memberikan rujukan kepada kajian-kajian terdahulu untuk menunjukkan perkembangan dan pemahaman sedia ada. Penggunaan rujukan yang pelbagai dan terperinci menunjukkan pendekatan akademik yang teliti dan sistematik. Secara umumnya, bab ini membina pemahaman pelajar terhadap konsep asas dan teori-teori yang mencorakkan keseluruhan kajian.
2.1 Bahan Tambahan Makanan
Subseksyen ini memberi latar belakang tentang bahan tambahan makanan, termasuk jenis-jenis dan fungsinya. Ia menghubungkan penggunaan bahan tambahan makanan dengan keperluan untuk memastikan keselamatan makanan dan kepentingan pengawalan. Perbincangan ini memberikan konteks penting tentang mengapa sensor kimia untuk mengesan zat berbahaya seperti Rhodamin B diperlukan. Pelajar dapat memahami implikasi penggunaan bahan tambahan makanan dalam industri makanan dan keperluan untuk teknologi analisis yang canggih.
2.2 Zat Warna
Subseksyen ini menerangkan tentang jenis-jenis zat warna, termasuk pewarna semula jadi dan sintetik, serta perbezaan di antara keduanya. Ia menggariskan bahaya penggunaan pewarna sintetik yang tidak dikawal dan keperluan untuk pemantauan dan pengawalan yang ketat. Ini membantu pelajar untuk memahami latar belakang mengapa Rhodamin B menjadi tumpuan kajian ini. Perbincangan tentang zat warna ini mendedahkan tentang sifat-sifat dan implikasinya dalam industri makanan dan kesihatan awam.
2.3 Rhodamin B
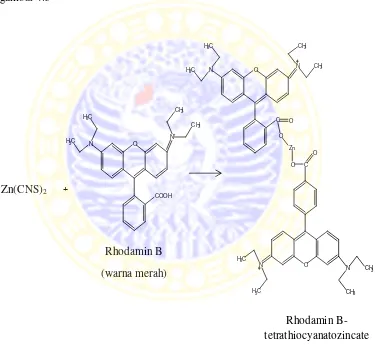
Subseksyen ini memfokuskan kepada sifat-sifat kimia dan toksikologi Rhodamin B, menjelaskan bahaya penggunaan bahan ini dalam makanan. Ia mengkaji maklumat tentang struktur kimia, sifat-sifat fizikal, dan kesan toksik Rhodamin B. Ini menjadi asas kepada keperluan untuk membangunkan sensor kimia untuk mengesan bahan berbahaya tersebut. Pelajar dapat memahami bahaya Rhodamin B dan mengapa ia menjadi bahan utama kajian ini.
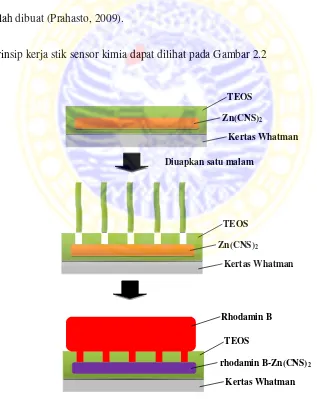
2.4 Sensor Kimia Bentuk Stik
Subseksyen ini membincangkan prinsip kerja sensor kimia bentuk stik, termasuk keupayaan untuk mengesan zat secara kualitatif dan semikuantitatif. Ia memberikan penerangan tentang kaedah pembuatan dan aplikasi sensor ini. Ini memperkenalkan pelajar kepada teknologi analisis yang inovatif dan peranannya dalam pemantauan keselamatan makanan. Pelajar dapat memahami kelebihan kaedah ini berbanding kaedah-kaedah konvensional.
2.5 Sol-gel
Subseksyen ini menjelaskan tentang metode sol-gel yang digunakan dalam pembuatan sensor kimia bentuk stik. Ia memberikan penerangan tentang proses dan mekanisme pembentukan gel daripada sol. Ini membolehkan pelajar memahami langkah-langkah pembuatan sensor secara saintifik dan teknikal. Pelajar dapat mengaplikasikan pengetahuan ini dalam pembangunan teknologi bahan baru.
2.6 Logam Zn (Seng)
Subseksyen ini menerangkan tentang sifat-sifat kimia dan fizikal logam seng, serta peranannya dalam reaksi kimia yang berkaitan dengan sensor. Ia memberikan maklumat tentang kegunaan logam seng dan sifat-sifatnya yang menjadikan ia sesuai untuk digunakan dalam sensor kimia. Pelajar dapat memahami sifat-sifat logam seng dan aplikasinya dalam teknologi sensor.
2.7 Senyawa Kompleks
Subseksyen ini menjelaskan tentang konsep senyawa kompleks dan peranannya dalam sensor kimia. Ia menerangkan tentang jenis-jenis ligan dan bilangan koordinasi. Ia memberikan maklumat asas tentang pembentukan senyawa kompleks yang digunakan dalam sensor. Pelajar dapat memahami konsep penting dalam kimia koordinasi dan peranannya dalam analisis kimia.
2.8 Kompleks Tiosianat
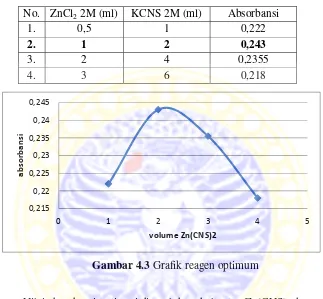
Subseksyen ini memfokuskan kepada sifat-sifat kompleks tiosianat dan peranannya dalam reaksi dengan Rhodamin B. Ia memberikan maklumat tentang struktur dan sifat kimia kompleks ini. Ia menerangkan bagaimana kompleks tiosianat digunakan dalam sensor untuk mengesan Rhodamin B. Pelajar dapat memahami peranan kompleks tiosianat dalam proses deteksi.
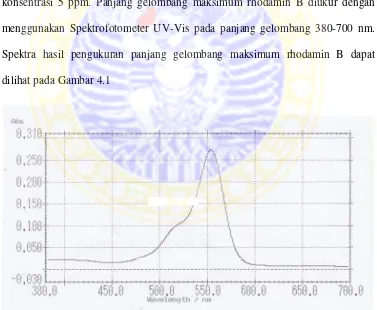
2.9 Spektrofotometer UV-Vis
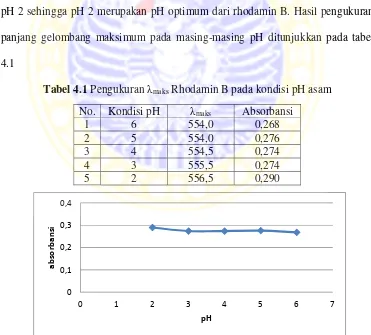
Subseksyen ini menerangkan prinsip dan aplikasi spektrofotometer UV-Vis dalam kuantifikasi Rhodamin B. Ia memberikan maklumat tentang persamaan Lambert-Beer dan bagaimana ia digunakan dalam analisis kuantitatif. Ini menunjukkan bagaimana spektrofotometer digunakan untuk mengesahkan hasil daripada sensor kimia. Pelajar dapat memahami prinsip analisis kuantitatif dan kegunaannya dalam kajian ini.
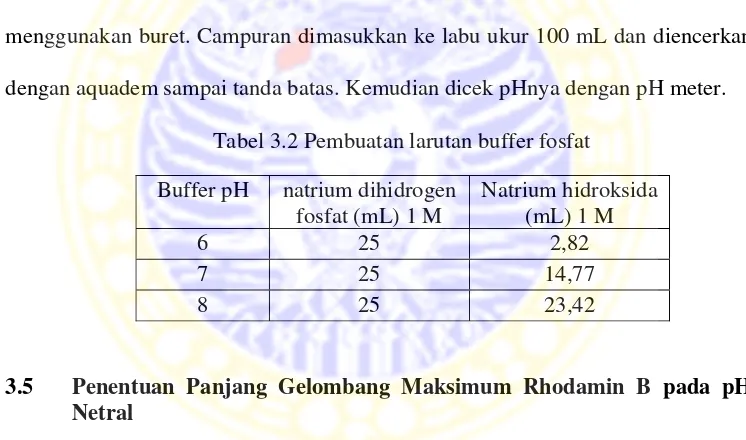
III. Metodologi Penelitian: Aplikasi Prinsip-prinsip Saintifik
Bab ini membentangkan kaedah dan prosedur yang digunakan dalam penelitian ini. Ia menunjukkan langkah-langkah eksperimen yang sistematik dan terperinci, bermula dari penyediaan larutan sehingga analisis data. Diagram alir yang disertakan memberikan gambaran keseluruhan metodologi penyelidikan. Penggunaan kaedah-kaedah saintifik yang teliti menunjukkan ketepatan dan kesahan kajian. Bab ini memberikan peluang pembelajaran yang berharga kepada pelajar untuk mempelajari tentang reka bentuk eksperimen, pengumpulan data, dan analisis data secara saintifik.
IV. Hasil dan Perbahasan: Analisis Data dan Tafsiran
Bab ini membentangkan hasil kajian dan perbincangan secara terperinci. Ia menunjukkan data yang diperoleh daripada eksperimen, termasuk grafik dan jadual. Perbincangan memberikan analisis terperinci ke atas hasil dan kaitannya dengan teori dan prinsip yang telah dibincangkan dalam bab tinjauan pustaka. Analisis data yang komprehensif menunjukkan penguasaan pelajar dalam menggunakan kaedah statistik dan mentafsir data. Ia juga membincangkan batasan kajian dan saranan untuk kajian akan datang.
V. Kesimpulan dan Saran: Implikasi dan Cadangan
Bab ini merumuskan penemuan-penemuan utama kajian dan memberikan cadangan untuk kajian akan datang. Kesimpulan memberikan ringkasan yang jelas dan ringkas tentang hasil kajian. Cadangan memberikan idea-idea untuk penambahbaikan dan pengembangan kajian seterusnya. Ini menunjukkan pemikiran kritikal dan kemampuan pelajar untuk mengaplikasikan pengetahuan mereka dalam mencadangkan penambahbaikan kajian.