MATERI -3 (1)
SPEKTROSKOPI INFRA MERAH
Sub Capaian Pembelajaran
Menjelaskan konsep dasar dan metode analisis struktur secara IR, menganalisis data
spektroskopi IR.
Materi Pembelajaran
Konsep dasar spektroskopi IR
Prinsip penentuan spektroskopi IR
SPEKTROSKOPI INFRA MERAH (Bagian-1)
Hampir setiap senyawa memiliki ikatan kovalen, baik senyawa organik atau anorganik, akan menyerap berbagai frekuensi radiasi elektromagnetik dalam daerah spektrum inframerah. Daerah spektrum elektromagnetik inframerah terletak pada panjang gelombang yang lebih besar bila dibandingkan dengan daerah sinar tampak yang terletak pada panjang gelombang sekitar 400-800 nm, tetapi terletak pada panjang gelombang yang lebih pendek daripada gelombang mikro yang mempunyai panjang gelombang lebih besar daripada 1 nm. Sinar inframerah berada pada kisaran panjang gelombang 1-100 µm. Daerah 0,7-2,5 µm disebut inframerah dekat dan daerah 14,3-50 µm disebut inframerah jauh. Daerah yang paling berguna untuk mengenal struktur senyawa adalah daerah 2,5-15 µm. Daerah spektroskopi infra merah biasa dinyatakan dalam satuan bilangan gelombang (cm-1), yang biasa digunakan dalam identifikasi senyawa organik pada daerah 4000 -700 cm-1.
Konsep dasar spektroskopi inframerah
Spektroskopi infra red atau infra merah merupakan suatu metode yang mengamati interaksi molekul dengan radiasi elektromagnetik yang berada pada daerah panjang gelombang 0,75–1.000 μm atau pada bilangan gelombang 13.000–10 cm-1 dengan menggunakan suatu alat yaitu Spektrofotometer Inframerah.
Selanjutnya Hooke mengemukakan suatu senyawa yang terdiri atas dua atom atau diatom dapat digambarkan dengan dua buah bola yang saling terikat oleh pegas, jika pegas direntangkan atau ditekan pada jarak keseimbangan maka energi potensial dari sistim tersebut akan naik. Setiap senyawa pada keadaan tertentu mempunyai tiga macam gerak, yaitu gerak translasi (perpindahan dari satu titik ke titik lain), gerak rotasi (berputar pada porosnya), dan gerak vibrasi (bergetar pada tempatnya).
Spektrum absorbsi IR merupakan perubahan simultan dari energi vibrasi dan energi rotasi dari suatu molekul. Kebanyakan molekul organik cukup besar sehingga spektrum absorbsinya sangat kompleks. Konsep dasar dari spektra vibrasi dapat diterangkan dengan menggunakan molekul sederhana yang terdiri dari dua atom dengan ikatan kovalen. Dengan menggunakan Hukum Hooke, dua atom tersebut dihubungkan dengan sebuah pegas. Persamaan yang diturunkan dari Hukum Hooke menyatakan hubungan antara frekuensi, massa atom, dan tetapan dari kuatnya ikatan (forse constant of the bond).
Persamaan Hukum Hooke dinyatakan sebagai berikut:
v = frekuensi vibrasi (cm-1) (bilangan gelombang
c = kecepatan cahaya (cm/sec) k = tetapan ikatan (dynes/cm) m = massa atom (g)
µ = m1 . m2 ; massa atom dalam gram atau µ = M1 . M2-
m1 + m2 M1 + M2 (6,02 x 1023)
Kekuatan ikatan (k) dipengaruhi oleh jenis ikatan apakah ikatan tunggal, rangkap, atau ikatan rangkap tiga, seperti data berikut, menunjukkan harga k naik sesuai jumlah ikatan:
Harga µ juga akan naik sesuai dengan massa atom yang berikatan seperti data berikut:
- = 1 2 c
K
Kekuatan ikatan juga dipengaruhi oleh jenis hibridisasi atom yang berikatan sesuai data berikut:
Jenis-Jenis Vibrasi
Vibrasi regangan (Streching)
Dalam vibrasi ini, atom bergerak terus sepanjang ikatan yang menghubungkannya sehingga akan terjadi perubahan jarak antara keduanya, walaupun sudut ikatan tidak berubah. Vibrasi regangan ada dua macam, yaitu: regangan simetri dan asimetri. Regangan simetri, yaitu unit struktur bergerak bersamaan dan searah dalam satu bidang datar, sedangkan regangan asimetri, yaitu unit struktur bergerak bersamaan dan tidak searah tetapi masih dalam satu bidang datar.
Vibrasi bengkokan (Bending)
Jika sistem tiga atom merupakan bagian dari sebuah molekul yang lebih besar, maka dapat menimbulkan vibrasi bengkokan atau vibrasi deformasi yang mempengaruhi osilasi atom atau molekul secara keseluruhan. Vibrasi bengkokan ini terbagi menjadi empat jenis, yaitu :
1. Vibrasi goyangan (Rocking), unit struktur bergerak mengayun asimetri tetapi masih dalam bidang datar
2. Vibrasi guntingan (Scissoring), unit struktur bergerak mengayun simetri dan masih dalam bidang datar
3. Vibrasi kibasan (Wagging), unit struktur bergerak mengibas keluar dari bidang datar 4. Vibrasi pelintiran (Twisting), unit struktur berputar mengelilingi ikatan yang
menghubungkan dengan molekul induk dan berada di dalam bidang datar Beberapa vibrasi pada gugus senyawa organik dapat dilihat pada data berikut:
Faktor-faktor yang mempengaruhi frekuensi vibrasi
Ada beberapa faktor yang mempengaruhi frekuensi vibrasi suatu molekul dan biasanya tidak bisa dihilangkan pengaruhnya antara satu dengan lainnya. Oleh karena lingkungan di sekitar atom yang berikatan turut menentukan besarnya frekuensi vibrasi. Beberapa faktor yang mempengaruhi frekuensi vibrasi antara lain:
1. Kopling vibrasi
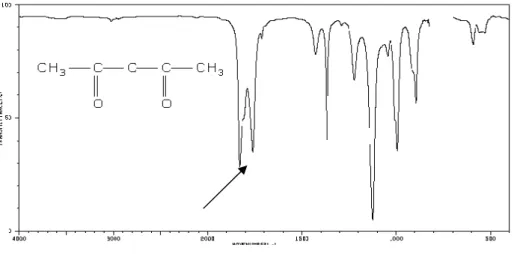
Kopling vibrasi dapat terjadi antara dua ikatan yang bervibrasi dengan frekuensi hampir sama yang dihasilkan oleh ikatan yang cukup dekat letaknya dalam molekul itu. Kopling vibrasi dapat terjadi dari dua vibrasi fundamental atau vibrasi fundamental dengan overtone dari vibrasi lainnya, yang disebut resonansi Fermi. Sebagai contoh terjadinya kopling vibrasi adalah serapan gugus C=O pada senyawa asam asetat anhidrid yang menunjukkan adanya dua puncak pada daerah sekitar 1800 -1900 cm-1 dengan perbedaan antara kedua puncak sekitar 65 cm-1 (Gambar III.1). Penjodohan tersebut diakibatkan oleh adanya dua gugus karbonil yang terikat oleh atom oksigen dan dapat mengalami resonansi. Contoh yang lain pada senyawa amida muncul dua serapan pada daerah 1600 -1700 cm-1 yang diakibatkan oleh vibrasi ulur C=O dan vibrasi tekuk N-H, dimana salah satunya merupakan interaksi kopling vibrasi yang kuat antara ulur C=O dan tekuk N-H (Gambar III.2). Demikian juga pada
senyawa aldehid serapan dari vibrasi ulur C-H biasanya muncul sebagai puncak ganda sebagai akibat dari kopling vibrasi fundamental ulur C-H dan overtone tekuk C-H (Gambar III.3).
Gambar III.1. Spektrum IR asam asetat anhidrida
Gambar III.2. Spektrum IR suatu amida
Gambar III.3 Spektrum IR aldehid
2. Ikatan hidrogen
Pengaruh ikatan hidrogen terjadi pada senyawa yang mengandung OH dan N-H, misalnya pada senyawa alkohol, fenol, asam karboksilat. Ikatan hidrogen dapat terjadi secara intramolekul maupun intermolekul. Adanya ikatan hidrogen menyebabkan munculnya serapan yang melebar.
Gambar III. 4. Spektrum IR fenol
3. Efek elektronik
Frekuensi vibrasi dipengaruhi oleh adanya resonansi maupun efek induksi yang berakibat terjadinya pergeseran ke arah frekuensi vibrasi yang lebih tinggi atau lebih rendah. Salah satu contoh pengaruh resonansi pada gugus C=O p-metoksi asetofenon, adanya gugus metoksi memberi efek induksi positif, delokalisasi elektron ke arah atom karbonil yang berakibat karater ikatan rangkap berkurang, sehingga frekuensi vibrasi dari C=O turun, sedangkan pada senyawa p-nitro asetofenon, adanya gugus NO2 bersifat menarik elektron, delokalisasi elektron bergerak dari atom oksigen gugus karbonil menunju ke arah gugus nitro, sehingga karakter ikatan rangkap bertambah, akibatnya frekuensi vibrasi C=O meningkat. Hal sama terjadi pada pada senyawa asil klorida, dimana atom Cl bersifat menarik elektron dari oksigen pada gugus karbonil, yang menyebabkan frekuensi vibrasi gugus karbonil meningkat.
CH3 O O O N O O = = +M - M
str C=O turun
str C=O naikO O
Cl 1715 cm-1 1800 cm-1
Contoh lain terjadinya efek resonansi yang menyebabkan frekuensi vibrasi ulur C=O menurun (bergeser ke kanan), karena ikatan tunggal antara atom C dan O berubah menjadi ikatan rangkap dua dalam kesetimbangan, sehingga akan menurunkan kekuatan ikatan (k) dari C=O, seperti berikut:
4. Ukuran cincin
Ukuran cincin mempengaruhi absorsi vibrasi ulur C=C. Cincin kecil memerlukan lebih karakter p untuk ikatan C-C sudut kecil, untuk itu memindahkan karakter p dari ikatan s ikatan rangkap, sehingga ikatan rangkap lebih berkarakter s. Akibatnya k naik. Makin kecil ukuran cincin, makin besar frekuensi vibrasi C=C (bergeser ke kiri), kecuali untuk siklopropena. Berikut adalah serapan vibrasi dari C=C dalam cincin (endo double bond) dan C=C luar cincin (exo double bond).
Bagaimana Memaknai Spektrum Inframerah
Spektrum inframerah mengandung banyak serapan yang dihubungkan dengan sistem vibrasi yang berinteraksi dalam molekul, karena mempunyai karakteristik yang unik untuk
setiap molekul maka dalam spektrum memberikan pita-pita serapan yang karakteristik juga. Daerah spektrum inframerah terbagai menjadi dua, yakni daerah antara 4000-1500 cm-1 disebut daerah gugus fungsi utama, serta daerah 1400 -1000 disebut daerah sidik jari atau
finger print. Daerah sidik jari mengandung sejumlah vibrasi tertentu tidak dapat ditelaah,
namun bersifat spesifik untuk setiap senyawa organik. Oleh karena itu daerah sidik jari biasa digunakan untuk mengidentifikasi senyawa yang tidak dikenal dengan membandingkan spektrum inframerah dengan sederet senyawa standar yang dibuat pada kondisi yang sama. Apabila spektra-spektra di daerah sidik jari menunjukkan kemiripan lebih dari 95% diduga senyawa yang tidak dikenal tersebut sejenis dengan senyawa standar.
Salah satu fungsi utama dari spektroskopi inframerah adalah untuk identifikasi gugus fungsi. Serapan gugus fungsi yang utama biasanya terdapat pada daerah 4000 – 1500 cm-1, seperti serapan dari gugus O-H terdapat pada daerah 3500 -3000 cm-1 biasanya mempunyai serapan yang melebar; C-H alifatik terdapat pada daerah 2800-2950 cm-1; C-H aromatik terdapat pada daerah 3000-3100 cm-1; N-H terdapat pada daerah sekitar 3500 cm-1 dengan puncak lemah sampai medium; C=O terdapat pada daerah sekitar 1700 cm-1 dengan puncak yang sangat tajam; serta C=C terdapat pada daerah 1650-1500 cm-1. Dengan mengenali serapan pada daerah gugus fungsi utama tersebut akan memudahkan kita untuk menganalisis data spektrum inframerah.
Sebagai contoh spektrum inframerah dari 1-propanol dan 2-propanol. Kedua senyawa ini mempunyai jenis dan jumlah ikatan yang sama persis. Kedua senyawa ini menghasilkan serapan yang sama pada daerah sekitar 3300 cm-1 dari gugus OH dan serapan pada daerah 2900 dari ikatan C-H alifatik, tetapi menunjukkan pola serapan yang berbeda pada daerah sidik jari antara 1500-500 cm-1.
Gambar III.5. Spektrum inframerah dari 1-propanol CH3CH2CH2OH
Gambar III.6. Spektrum inframerah dari 2-propanol
Pola pada daerah sidik jari kedua senyawa tersebut sangat berbeda satu dengan yang lain, sehingga serapan di daerah sidik jari karakteristik untuk masing-masing senyawa. Oleh karena itu, daerah sidik jari dapat digunakan untuk mengidentifikasi suatu senyawa yang tidak diketahui dengan data pembanding, biasanya disimpan dalam database komputer dalam instrumen tersebut. Apabila memiliki kemiripan lebih dari 95% dimungkinkan merupakan senyawa yang mirip atau sejenis.
Dalam menganalisis suatu spektra yang tak diketahui, perhatian harus dipusatkan pada ada atau tidaknya beberapa gugus fungsional utama seperti C=0, 0-H, N-NH, C-O, C=C, C≡ N, dan NO2. Serapan pada daerah sekitar 3000 cm-1 tidak perlu dianalisis secara detail, oleh karena hampir semua senyawa mempunyai pita serapan pada daerah tersebut. Di samping itu lingkungan dari gugus fungsional tertentu tidak perlu dianalisis secara mendalam. Beberapa langkah untuk memeriksa pita-pita yang penting dalam analisis data spektrum IR antara lain:
1. Apakah terdapat gugus karbonil ?
Gugus C = 0 terdapat pada daerah 1820 cm-1 – 1600 cm-1 puncak ini biasanya yang terkuat dengan lebar medium dalam spektrum. Serapan tersebut sangat karekteristik. 2. Bila gugus C = 0 ada, ujilah seperti berikut :
a. Asam : apakah ada –OH ? serapan melebar di dekat 3400 cm-1 -2400 cm -1 (biasanya tumpang tindih dengan C-H).
b. Amida : apakah ada –NH ? Serapan medium di dekat 3500 cm-1 kadang puncak rangkap dengan perubahan yang sama.
c. Ester : Apakah ada C-O ? Serapan kuat di dekat 1300 cm-1 – 1000 cm-1 d. Anhidrida : Mempunyai dua serapan C = 0 di dekat 1810 cm-1 dan 1760 cm-1,
e. Aldehida : Apakah ada CH aldehida ? Dua serapan lemah di dekat 2850 cm -1 dan 2750 cm-1 ), yaitu di sebelah kanan serapan CH.
f. Keton : Bila kelima kemungkinan di atas tidak ada. 3. Bila gugus C = 0 tidak ada.
a. Alkohol : Ujilah untuk OH
i. Serapan melebar di dekat 3600 sampai 3300 cm-1
ii. Pembuktian selanjutnya yaitu adanya serapan C-O di dekat 1300 cm -1 – 1000 cm-1
b. Amida : Ujilah untuk NH, serapan medium di dekat 3500 cm-1
c. Eter : Ujilah serapan C – O (serapan OH tidak ada) di dekat 1300 cm-1 - 1000 cm-1.
4. Ikatan rangkap dua atau cincin aromatik.
C = C memiliki serapan lemah di dekat 1650 cm-1.
Serapan medium tinggi kuat pada daerah 1650 cm-1 sampai 1450 cm-1 . Sering menunjukkan adanya cincin aromatik
Aromatik dan vinil CH terdapat disebelah kiri 3000 cm-1 . Sedangkan CH alifatik terjadi di sebelah kanan daerah tersebut
5. Ikatan rangkap tiga.
C≡ N memiliki serapan medium dan tajam di dekat 2250 cm-1
C≡C memiliki serapan lemah tapi tajam di dekat 2150 cm-1. Ujilah CH asetilenik di dekat 3300 cm-1
6. Gugus nitro, dua serapan kuat pada 1600 cm-1 –1500 cm-1 dan 1390 cm-1 – 1300 cm -1
7. Hidrokarbon
Keenam serapan di atas tidak ada, memiliki serapan utama untuk CH di dekat 3000 cm-1. Spektrumnya sangat sederhana hanya terdapat serapan lain-lain di dekat 1450 cm-1 dan 1375 cm-1 .