TPP DENGAN METODE EMULSI
TYAS WULANDARY
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Tyas Wulandary. SINTESIS NANOPARTIKEL EKSTRAK TEMULAWAK (Curcuma
xanthorrhiza Roxb.) BERBASIS POLIMER KITOSAN-TPP DENGAN METODE EMULSI. Dibimbing oleh Mersi Kurniati, M.Si dan Dr. Laksmi Ambarsari, MS.
Abstrak
Telah dilakukan penyalutan ekstrak temulawak dengan mengunakan kitosan. Penyalutan dengan menggunakan partikel nano dapat mengoptimalisasi penyerapan ekstrak temulawak dalam mencapai target. Salah satu metode yang dapat digunakan untuk pembuatan nanopartikel ekstrak temulawak adalah emulsi dengan perlakuan sonikasi menggunakan ultrasonics processor (Cole-Parmer 20 kHz 130 watt). Penelitian ini menggunakan variasi konsentrasi TPP (0,5% dan 1%) dan waktu sonikasi (30 menit dan 60 menit), serta menggunakan wadah beaker glass 500 mL. Hasil penelitian menunjukkan bahwa pada penambahan 0,5% TPP dengan waktu sonikasi 30 menit menghasilkan ukuran partikel sebesar 430 nm hingga 2900 nm dan untuk waktu sonikasi selama 60 menit sebesar 422 nm hingga 4700 nm, sedangkan pada konsentrasi TPP 1% dengan waktu sonikasi 30 menit ukuran partikel yang dihasilkan adalah 444 nm hingga 4200 nm dan untuk waktu sonikasi selama 60 menit sebesar 418 nm hingga 2300 nm. Hasil menggunakan SEM memperlihatkan bahwa partikel yang dihasilkan berupa bulatan menyerupai bola dan berkerut, hasil analisis XRD menunjukkan adanya struktur amorf, dan keberadaan ekstrak temulawak dalam penyalut dapat diketahui berdasarkan hasil FTIR. Dengan demikian dapat disimpulkan bahwa sampel dengan konsentrasi TPP 1% dengan waktu sonikasi 60 menit, menunjukkan hasil yang terbaik berdasarkan ukuran, kehomogenan, dan keberadaan ekstrak temulawak dalam penyalut kitosan. Apabila dilihat dari bentuk wadah yang digunakan pada penelitian ini, sampel yang menggunakan wadah beaker glass 500 mL ukuran partikelnya lebih homogen jika dibandingkan dengan menggunakan wadah Erlenmeyer 250 mL.
TPP DENGAN METODE EMULSI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Oleh :
Tyas Wulandary
G74061240
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Sintesis Nanopartikel Ekstrak Temulawak (Curcuma xanthorrhiza Roxb.)
Berbasis Polimer Kitosan-TPP dengan Metode Emulsi
Nama : Tyas Wulandary
NRP : G74061240
Menyetujui,
Pembimbing 1
Pembimbing 2
Mersi Kurniati, M.Si
NIP. 19681117 199802 2 001
Dr. Laksmi Ambarsari, MS
NIP. 19601118 199403 2 001
Mengetahui :
Kepala Departemen Fisika FMIPA IPB
Dr. Ir. Irzaman, M.Si
NIP. 19630708 199512 1 001
pertama dari empat bersaudara dari pasangan Endang Kusdiman dan Tetty Mutiara Sutresnawaty. Penulis menyelesaikan pendidikan dasar di SD Negeri Jatiseeng I Kec. Ciledug Kab. Cirebon pada tahun 2000, pendidikan menengah tingkat pertama di SLTP Negeri 1 Kota Cirebon pada tahun 2003, dan melanjutkan ke SMA Negeri 3 Kota Cirebon. Pada tahun 2006, penulis diterima sebagai mahasiswi di Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI). Pada tahun kedua penulis masuk jurusan mayor Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam dengan mengambil Supporting Course (SC). Selama menempuh pendidikan di IPB, penulis pernah menjadi asisten praktikum Mekanika I (2008-2009), asisten praktikum Gelombang (2008-2009), asisten praktikum Fisika Dasar (2008-2009), asisten praktikum Mekanika I (2009-2010), pernah aktif sebagai staf infokom HIMAFI (2008-2009), serta pernah mengikuti beberapa kegiatan kepanitiaan diantaranya Pesta Sains Nasional (2007-2008), COSMIC (2008), dan Kompetisi Fisika Pesta Sains Nasional (2008-2009).
KATA PENGANTAR
Alhamdulillaahhirabbal’alamiin. Puji syukur penulis panjatkan kehadirat Allah Swt atas segala rahmat, karunia dan hidaya-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Sintesis Nanopartikel Ekstrak Temulawak (Curcuma xanthorrhiza Roxb.) Berbasis
Polimer Kitosan-TPP dengan Metode Emulsi” tepat pada waktunya. Pada kesempatan ini,
penulis ingin mengucapkan terima kasih kepada:
1. Mama dan Papa tersayang yang senantiasa memberikan do’a, nasehat, kasih sayang, dan motivasinya yang tidak pernah terputus untuk penulis.
2. De’ Priska, De’ Riza, dan De’ Anugrah (adik penulis) yang selalu memberikan canda dan tawa serta semangat yang tiada henti.
3. Ibu Mersi Kurniati, M.Si selaku pembimbing I yang telah sabar memberikan bimbingan, motivasi, serta arahan kepada penulis.
4. Ibu Dr. Laksmi Ambarsari, M.S selaku pembimbing II yang telah membimbing penulis dengan penuh kesabaran. Terimakasih atas nasehat dan motivasinya.
5. Bapak Agus Kartono dan Bapak Irmansyah selaku penguji, terimakasih atas masukan dan sarannya.
6. Bapak Nurwanto dari Pusat Antar Universitas IPB untuk spray drying. 7. Bapak Wawan dari PPGL Bandung untuk karakterisasi SEM.
8. Bapak Didik dari Pusat Penelitian dan Pengembangan Kehutanan Bogor untuk karakterisasi XRD.
9. Mba Pipit dari Universitas Islam Negeri Syarif Hidayatullah Jakarta untuk karakterisasi FTIR. 10. Bapak/Ibu dosen Departemen Fisika, Bapak Irzaman, Bapak Indro, Bapak Dahlan, Bapak
Irmansyah, Bapak Agus, Ibu Mersi, Bapak Umar, Bapak Husin, Bapak Sidik, Bapak Faozan, Bapak Hanedi, Ibu Anik, Bapak Akhir, Bapak Jajang, Bapak Jamil, Bapak Doddy, Bapak Mahfudin, Bapak Ardian, Bapak Amin, Bapak Edward terima kasih atas ilmu yang telah diberikan.
11. Seluruh staf dan karyawan di Departemen Fisika FMIPA IPB.
12. Sahabat terdekat penulis, Alm. Nurohman (Pelangi Merah). You are the best my friend till the end of time.
13. Faridah (Pelangi Ungu) yang juga merupakan sahabat terdekat penulis dan tempat sandaran bagi penulis. Terima kasih atas doa, motivasi, bantuan, keceriaan, serta persahabatan yang indah dan tak terlupakan.
14. Sahabat-sahabat penulis lainya yaitu Diana (Pelangi Jingga), Diani (Pelangi Nila), Anjar (Pelangi Kuning), dan Diki (Pelangi Hijau), terima kasih atas persahabatan yang indah dan tak terlupakan.
15. Teman seperjuangan dalam penelitian, Ka Taufik Biokimia 42. Terima kasih atas semangat dan kerja samanya.
16. Teman- teman fisika angkatan 43: Lea, Dida, Santi, Galih, Uliz, Afni, Dina, Rosyid, Fabian, Camot, Rendra, Mufti, Mila, Ridwan, Gesang, Nady, Husein, Ratih, Desna, Sastri, Yuas, Misbah, Vian, Marsya, Fariza, Rudi, Alm. Bobby, Wandi, Pandu, Chanse, Adi Agus, Agus Ismangil, Budi, Alex, Mara, Iqbal. Terima kasih atas keceriaan dan kebersamaannya. Senang dan bangga menjadi bagian dari kalian semua.
17. Rekan-rekan fisika angkatan 40, 41, 42, 44, 45, dan teman- teman kost.
18. Serta semua pihak yang tidak dapat disebutkan satu per satu, terimakasih atas do’a dan motivasinya terhadap penulis selama ini.
Akhir kata, semoga skripsi ini dapat memberikan manfaat untuk kita semua. Penulis juga menyadari bahwa skripsi ini masih jauh dari sempurna sehingga kritik dan saran yang membangun sangat penulis harapkan. Semoga Allah SWT senantiasa melimpahkan rahmat dan karunia-Nya untuk kita semua. Amin.
Bogor, Januari 2010
DAFTAR ISI
Halaman
DAFTAR ISI ... i
DAFTAR TABEL ... ii
DAFTAR GAMBAR ... iii
DAFTAR LAMPIRAN ... iv PENDAHULUAN ... 1 Latar Belakang ... 1 Tujuan Penelitian ... 1 Hipotesis ... 1 TINJAUAN PUSTAKA ... 1 Kitosan ... 1 Gel Kitosan ... 2
Temulawak (Curcuma xanthorrhiza Roxb.) ... 3
Sonikasi ... 4
Pengeringan Semprot (spray drying) ... 5
XRD (X-Ray Diffraction) ... 5
SEM (Scanning Electron Microscope) ... 6
FTIR (Fourier Transform Infrared) ... 7
BAHAN DAN METODE ... 7
Waktu dan Tempat Penelitian ... 7
Alat dan Bahan ... 7
Metode Penelitian ... 7
Pembuatan Nanopartikel Ekstrak Temulawak Tersalut Kitosan ... 7
Karakterisasi XRD ... 8
Karakterisasi SEM ... 8
Karakterisasi FTIR ... 8
HASIL DAN PEMBAHASAN ... 8
Nanopartikel Ekstrak Temulawak Tersalut Kitosan ... 8
Hasil analisis XRD ... 9
Hasil analisis SEM ... 10
Hasil analisis FTIR ... 11
KESIMPULAN ... 12
SARAN ... 12
DAFTAR PUSTAKA ... 12
DAFTAR TABEL
Halaman
Tabel 1 Spesifikasi kitosan niaga ... 2 Tabel 2 Kandungan kimia ekstrak temulawak hasil ekstraksi alkohol 70% ... 3 Tabel 3 Kode Sampel ... 8 Tabel 4 Ukuran partikel nanopartikel ekstrak temulawak tersalut kitosan dengan konsentrasi
TPP 0,5% ... 9 Tabel 5 Ukuran partikel hasil foto SEM ... 11 Tabel 6 Pita transmitan standar kurkumin ... 11
10
DAFTAR GAMBAR
Halaman
Gambar 1 Struktur kimia kitosan ... 2
Gambar 2 Struktur hidrogel kitosan: (a) ikatan silang kitosan-kitosan, (b) jaringan polimer hibrida, (c) jaringan semi-IPN, dan (d) kitosan berikatan silang (Berger et al., 2004) ... 3
Gambar 3 Rimpang temulawak ... 3
Gambar 4 Struktur kimia kurkumin ... 3
Gambar 5 Alat Ultrasonics Processor ... 4
Gambar 6 Hukum Bragg ... 6
Gambar 7 Skema SEM ... 6
Gambar 8 Sistem optik Spektrofotometer FTIR ... 7
Gambar 9 Foto SEM nanopartikel ekstrak temulawak tersalut kitosan sonikasi 30 menit (a) dan sonikasi 60 menit (b) dengan menggunakan wadah erlenmeyer, serta sonikasi 30 menit (c) dan sonikasi 60 menit (d) dengan menggunakan wadah beaker glass pada perbesaran 2000 kali ... 9
Gambar 10 Proses sonikasi menggunakan wadah erlenmeyer 250 mL (a) dan proses sonikasi menggunakan wadah beaker glass 500 mL (b) ... 9
Gambar 11 Pola XRD kode sampel A1, A2, A3, dan A4 ... 10
Gambar 12 Morfologi nanopartikel ekstrak temulawak tersalut kitosan; A1(a), A2(b), A3(c), dan A4(d) ... 11
DAFTAR LAMPIRAN
Halaman
Lampiran 1 Diagram Alir Penelitian ... 16
Lampiran 2 Derajat kristalinitas kode sampel A1 ... 17
Lampiran 3 Derajat kristalinitas kode sampel A2 ... 17
Lampiran 4 Derajat kristalinitas kode sampel A3 ... 17
Lampiran 5 Derajat kristalinitas kode sampel A4 ... 17
Lampiran 6 Data JCPDS Kitosan ... 18
Lampiran 7 Data JCPDS Kurkumin ... 18
Lampiran 8 Hasil Foto SEM kode sampel A1 ... 19
Lampiran 9 Hasil Foto SEM kode sampel A2 ... 20
Lampiran 10 Hasil Foto SEM kode sampel A3 ... 21
Lampiran 11 Hasil Foto SEM kode sampel A4 ... 22
Lampiran 12 Spektra Inframerah kode sampel A1 ... 23
Lampiran 13 Spektra Inframerah kode sampel A2 ... 23
Lampiran 14 Spektra Inframerah kode sampel A3 ... 24
1
PENDAHULUAN
Latar Belakang
Indonesia merupakan salah satu negara megabiodiversitas terbesar di dunia dan juga dikenal sebagai gudangnya tumbuhan obat (herbal). Salah satu tanaman herbal yang dapat dimanfaatkan dalam teknologi nanobiomedis adalah temulawak.
Temulawak (Curcuma xanthorrhiza
Roxb.) merupakan tanaman obat berupa tumbuhan rumpun berbatang semu yang paling banyak digunakan sebagai bahan baku pembuatan obat dan jamu. Bagian temulawak yang biasa dimanfaatkan adalah rimpangnya. Hasil penelitian di bidang kedokteran, diketahui bahwa khasiat temulawak terutama disebabkan oleh kurkuminoid dan minyak atsiri.
Kurkuminoid memberikan warna kuning pada rimpang temulawak dan mempunyai khasiat medis (Suwiah 1991). Zat ini berkhasiat menetralkan racun, sebagai anti bakteri dan antioksidan, menghilangkan rasa nyeri pada sendi, menurunkan kadar kolesterol dan trigliserida darah. Sedangkan minyak atsiri pada temulawak berkhasiat sebagai colagoga, yaitu bahan yang dapat merangsang pengeluaran cairan empedu yang berfungsi sebagai penambah nafsu makan dan anti
spasmodicum, yaitu menenangkan dan
mengembalikan kekejangan otot (Liang et
al. 1985).
Konsumsi ekstrak temulawak secara oral dapat mengurangi efisiensi penyerapan oleh tubuh. Salah satu upaya yang telah dikembangkan untuk mengatasi permasalahan tersebut adalah penyalutan dengan metode enkapsulasi. Salah satu penyalut yang aman digunakan adalah kitosan yang merupakan hasil ekstraksi limbah kulit hewan golongan Crustacea (Hu
et al. 2007).
Kitosan merupakan produk deasetilisasi kitin yang bersifat tidak beracun, biokompatibel, dan biodegradabel. Selain itu, kitosan bersifat polikatonik dalam suasana asam (Sutriyo et al. 2005) dan dapat membentuk gel karena adanya ikatan silang ionik kitosan-kitosan (Berger et al. 2005). Dengan struktur yang mirip dengan selulosa dan kemampuannya membentuk gel dalam suasana asam, kitosan juga memiliki sifat sebagai matriks dalam sistem penghantaran obat ke dalam tubuh (Sutriyo et al. 2005).
Kitosan telah banyak digunakan sebagai penyalut obat dengan tujuan
mengoptimalisasi penyerapan obat pada sel target. Kitosan juga dapat digunakan sebagai penyalut ekstrak temulawak. Sifat mekanik kitosan yaitu mudah rapuh. Untuk menstabilkan sifat mekanik tersebut, digunakan TPP (tripolyphosphate) sebagai ikatan silangnya. Desai & Park (2005) membuktikan bahwa mikrosfer kitosan yang berikatan silang dengan tripolifosfat dapat digunakan sebagai penyalut obat dengan metode pengeringan semprot (spray drying).
Enkapsulasi dengan menggunakan partikel nano menyebabkan ekstrak mudah menyebar dalam darah dan lebih akurat dalam mencapai target (Poulain & Nakache 1998). Teknologi nanokapsul berkembang dalam dunia medis karena manfaatnya dalam sistem penghantaran obat dimana dengan ukuran nano obat dapat dihantarkan tepat mencapai bagian yang sakit di dalam tubuh. Metode yang umum digunakan dalam pembuatan nanopartikel adalah atrisi dan pirolisis. Metode lain yang sedang berkembang saat ini adalah metode sonokimia dengan memanfaatkan gelombang ultrasonik. Penggunaan gelombang ultrasonik dalam pembentukan materi berukuran nano merupakan metode yang sangat efektif.
Tujuan Penelitian
Membuat nanopartikel ekstrak temulawak tersalut kitosan dengan variasi konsentrasi TPP dan waktu sonikasi, serta penggunaan wadah yang berbeda dalam proses pembuatannya.
Hipotesis
1. Semakin banyak konsentrasi TPP diharapkan dapat meningkatkan kekuatan mekanik kitosan.
2. Semakin bertambahnya waktu sonikasi, diharapkan akan menghasilkan nanopartikel ekstrak temulawak dan kehomogenan larutan.
3. Kehomogenan ukuran partikel jika ditinjau dari bentuk wadah yang digunakan untuk suatu sampel.
TINJAUAN PUSTAKA
Kitosan
Kitin adalah polisakarida terbanyak kedua setelah selulosa dan berasal dari kerangka luar hewan kelas Crustaceae. Kitin bersifat sangat hidrofobik dan tidak larut dalam air, basa, atau pelarut organik umum (Thatte 2004). Kitosan tersusun atas
senyawa polisakarida (1-4)-2-amino-2-deoksi-D-glukosa yang saling berikatan beta (Sutriyo et al. 2005). Struktur kitosan disajikan pada Gambar 1.
Gambar 1 Struktur kimia kitosan
Kitosan merupakan kitin yang terdeasetilasi dengan rumus molekul (C6H11NO4)n berupa padatan amorf dan
merupakan salah satu dari sedikit polimer alami yang berbentuk polielektrolit kationik dalam larutan asam organik. Kitosan tidak larut dalam air, alkohol, dan aseton. Dalam asam anorganik, seperti HCl dan HNO3,
kitosan larut pada konsentrasi 1,1%, tetapi tidak larut pada konsentrasi 10%. Sifat kelarutan ini dipengaruhi oleh bobot molekul dan derajat deasetilasi (Muzi dalam Jamaludin 1994).
Kitosan tidak beracun dan mudah terbiodegradasi. Struktur yang mirip dengan selulosa dan dengan kemampuannya membentuk gel dalam suasana asam, kitosan mempunyai sifat sebagai matriks dalam sistem pengantaran obat (Sutriyo et al. 2005).
Sejauh ini kitosan telah digunakan dalam bidang pertanian, pengolahan air, industri pangan, industri kosmetika, farmasi, kedokteran, industri aneka (seperti industri cat dan tekstil), bioteknologi, dan sektor industri lainnya (Hirano 1996). Dalam bidang makanan, kitosan dapat berfungsi sebagai bahan pembentuk gel, pembentuk tekstur, dan pelembut (Sanford 1989). Dalam bidang kesehatan dan farmasi, kitosan dapat digunakan sebagai diet serat dan obat penurun kandungan kolesterol di dalam darah (Kato et al. 1994).
Karakteristik fisiokimia kitosan seperti fleksibilitas rantai dalam larutan, sifat reologi, ukuran kristal dan kristalinitas kitosan bergantung pada faktor intrinsik seperti derajat deastilasi, distribusi grup asetil, bobot molekular, dan distribusinya (Jin Li et al. 2008). Karakteristik fisiokimia kitosan dapat dilihat pada Tabel 1.
Sifat mekanik kitosan yaitu mudah rapuh. Untuk menstabilkan sifat mekanik tersebut, digunakan TPP (tripolyphosphate)
sebagai cross-linknya. TPP merupakan polianion yang tidak beracun jika dinteraksikan dengan kitosan dalam media asam melalui kekuatan elektrostatik ion untuk membentuk jaringan cross-link.
Tabel 1 Spesifikasi kitosan niaga No Parameter Ciri 1 Ukuran Partikel Serbuk sampai
bubuk 2 Warna Putih kelabu 3 Kelarutan 97% dalam 1%
asam asetat 4 Kadar abu (%) ≤ 2.0 5 Kadar air (%) ≤ 10.0 6 Warna larutan Tak berwarna 7 N-deasetilasi (%) ≥ 70.0 8 Ph 6.5-8.0 9 Viskositas (cPs) rendah < 200 medium 200 – 799 tinggi 800 – 2000 sangat tinggi > 2000 10 Titik leleh Tak ada data
Gel Kitosan
Gelasi atau pembentukan gel merupakan gejala penggabungan atau pengikatan silang rantai-rantai polimer membentuk jaringan tiga-dimensi yang sinambung dan dapat memerangkap air di dalamnya menjadi suatu struktur yang kompak dan kaku yang tahan terhadap aliran bertekanan (Fardiaz 1989). Gel yang dapat menahan air dalam strukturnya disebut hidrogel (Wang et al. 2004). Hidrogel dapat diklasifikasikan menjadi hidrogel kimia dan fisika. Hidrogel kimia dibentuk dari reaksi yang tidak dapat balik, sedangkan fisika dibentuk oleh reaksi yang dapat balik. Contoh hidrogel kimia adalah hidrogel kitosan yang berikatan silang secara kovalen (Stevens 2001; Berger et al. 2004).
Larutan kitosan pada batas konsentrasi tertentu dalam asam asetat 1% dapat membentuk gel. Gel kitosan yang terbentuk dapat diperbaiki sifatnya (menurunnya waktu gelasi dan meningkatnya kekuatan mekanik gel) dengan penambahan PVA (Wang et al. 2004).
Ikatan silang kovalen dalam hidrogel kitosan dapat dibedakan menjadi 4 bagian, yaitu ikatan silang kitosan-kitosan, jaringan polimer hibrida atau HPN (hybrid polymer
network), jaringan polimer saling-tembus
tanggung atau utuh (semi-IPN atau full-IPN,
3
kitosan berikatan silang ionik yang ditunjukkan pada Gambar 2. Ikatan silang kitosan-kitosan terjadi diantara dua unit struktur pada rantai polimer kitosan yang sama. Pada HPN, ikatan silang terjadi antara satu unit dari struktur rantai kitosan dan unit lain dari struktur polimer tambahan. Semi- atau full-IPN terjadi jika ada penambahan polimer lain yang tidak bereaksi dengan larutan kitosan sebelum terjadi taut silang. Pada semi-IPN, polimer yang ditambahkan hanya melilit. Pada full-IPN ada penambahan dua senyawa penaut silang yang terlibat pada jaringan (Berger at al. 2004).
Gambar 2 Struktur hidrogel kitosan: (a) ikatan silang kitosan-kitosan, (b) jaringan polimer hibrida, (c) jaringan semi-IPN, dan (d) kitosan berikatan silang (Berger et
al. 2004)
Temulawak (Curcuma xanthorrhiza
Roxb.)
Temulawak merupakan tanaman obat berupa tumbuhan rumpun berbatang semu. Di daerah Jawa Barat temulawak disebut sebagai koneng gede sedangkan di Madura disebut sebagai temu lobak. Berdasarkan klasifikasi botani, temulawak termasuk dalam dunia Plantae, divisi Spermatophyta, sub divisi Angiospermae, kelas Monocotyledoneae, keluarga Zingiberaceae, genus Curcuma, dan spesies Curcuma
xanthorrhiza Roxb.
Bagian temulawak yang biasa dimanfaatkan adalah rimpangnya (Gambar 3). Kandungan kimia rimpang temulawak sebagai sumber bahan pangan, bahan baku industri atau bahan baku obat dapat dibedakan atas beberapa fraksi yaitu fraksi pati, kurkuminoid, dan fraksi minyak atsiri (Sidik et al. 1995 dalam Irawati 2008).
Selain ketiga fraksi tersebut, masih terdapat kandungan lain dalam rimpang temulawak yaitu lemak, serat kasar, dan protein (Suwiah 1991 dalam Aan 2003). Senyawa aktif yang banyak dimanfaatkan dari ekstrak tanaman temulawak adalah kurkuminoid dan xanthorrhizol. Presentase komposisi ekstrak temulawak dapat dilihat pada Tabel 2.
Fraksi kurkuminoid merupakan komponen yang memberi warna kuning berbentuk serbuk dengan rasa pahit, larut dalam aseton, alkohol, asam glasial, alkohol hidroksida, memiliki aroma yang khas, dan tidak bersifat toksik. Kurkuminoid rimpang temulawak terdiri atas desmetoksikurkumin dan kurkumin yang memiliki rumus struktur (Gambar 4) dan bobot molekul 368 g/mol (Sidik et al. 1995 dalam Irawati 2008).
Gambar 3 Rimpang temulawak
Tabel 2 Kandungan kimia ekstrak temulawak hasil ekstraksi alkohol 70%
Kandungan ekstrak temulawak Kadar Minyak atsiri 6.48 Kurkumin 1.36 Xanthorrhizol 1.86 Sumber: Materia Medika Indonesia (1979) dalam Sembiring et al. (2006).
Gambar 4 Struktur kimia kurkumin
Di Indonesia, rimpang temulawak biasanya digunakan untuk jamu godog. Manfaat lain dari rimpang temulawak adalah sebagai obat jerawat, meningkatkan nafsu
makan, anti kolesterol, anti inflamasi, anemia, antioksidan, pencegah kanker, dan anti mikroba. Khasiat temulawak yang menyehatkan dan menyembuhkan berbagai penyakit disebabkan oleh adanya senyawa kurkuminoid. Kekurangan temulawak adalah rasanya yang pahit dengan bau aromatik yang tajam dan lama penyimpanan akan mengurangi kadar minyak atsiri dan kurkuminoidnya. Salah satu cara untuk menutupinya adalah dengan menyalut obat dalam nanokapsul gel.
Sonikasi
Gelombang ultrasonik merupakan gelombang mekanik longitudinal yang memiliki frekuensi 20 KHz ke atas. Pada alat Ultrasonics Processor Cole-Parmer (Gambar 5), spesifikasi yang dapat diperoleh yaitu frekuensi yang tidak bisa dirubah-rubah sebesar 20 kHz dan daya sebesar 130 watt. Pada alat tersebut juga terdapat waktu sonikasi, amplitudo, dan pulsa gelombang yang dapat diatur sesuai kebutuhan.
Gelombang suara ultrasonik dapat didengar dan digunakan sebagai alat komunikasi oleh pendengaran beberapa jenis binatang, seperti anjing, kelelawar, dan lumba-lumba. Gelombang ultrasonik juga merupakan rambatan energi dan momentum mekanik, sehingga membutuhkan medium untuk merambat sebagai interaksi dengan molekul. Medium yang digunakan antara lain padat, cair, dan gas (Tipler 1998).
Gambar 5 Alat Ultrasonics Processor
Batas atas rentang ultrasonik mencapai 5 MHz untuk gas dan mencapai 500 MHz untuk cairan dan padatan. Penggunaan ultasonik berdasarkan rentangnya yang luas ini dibagi menjadi dua bagian. Bagian pertama adalah suara beramplitudo rendah (frekuensi lebih tinggi). Gelombang beramplitudo rendah ini secara umum digunakan untuk analisis pengukuran
kecepatan dan koefisien penyerapan gelombang pada rentang 2 hingga 10 MHz. Bagian kedua adalah gelombang berenergi tinggi dan terletak pada frekuensi 20 hingga 100 KHZ. Gelombang ini dapat digunakan untuk pembersihan, pembentukan plastik, dan modifikasi bahan-bahan organik maupun anorganik (Mason et al. 2002).
Ultrasonik intensitas tinggi dapat menginduksi konsekuensi fisika dan kimia yang cukup luas. Efek fisika dari ultrasonik intensitas tinggi adalah emulsifikasi. Pada sistem polimer termasuk dispersi bahan pengisi dan bahan lainnya kedalaman polimer dasar (contohnya pada formulasi cat), enkapsulasi partikel inorganik dengan polimer, modifikasi ukuran partikel pada serbuk polimer, hingga pembentukan dan pemotongan termoplastik (Suslick et al. 1999). Efek kimianya, gelombang ultrasonik tidak secara langsung berinteraksi dengan molekul-molekul untuk menginduksi suatu perubahan kimiawi. Hal ini dikarenakan panjang gelombang ultrasonik yang terlalu panjang jika dibandingkan dengan panjang gelombang molekul-molekul.
Penggunaan gelombang ultrasonik (sonikasi) sangat efektif dalam pembentukan materi berukuran nano. Gelombang ultrasonik banyak diterapkan pada berbagai bidang seperti dalam bidang instrumentasi, kesehatan, dan sebagainya. Salah satu yang terpenting dari aplikasi gelombang ultrasonik adalah pemanfaatannya dalam menimbulkan efek kavitasi akustik. Efek ini akan digunakan dalam pembuatan bahan berukuran nano dengan metode emulsifikasi (Nakahira 2007 dalam Hapsari 2009).
Ketika gelombang ultrasonik menjalar pada fluida, terjadi siklus rapatan dan regangan. Tekanan negatif yang terjadi ketika regangan menyebabkan molekul dalam fluida tertarik dan terbentuk kehampaan, kemudian membentuk gelembung yang akan menyerap energi dari gelombang suara sehingga dapat memuai. Gelembung akan berosilasi dalam siklus rapatan dan regangan.
Selama osilasi, sejumlah energi berdifusi masuk atau keluar gelembung. Energi masuk terjadi ketika regangan dan energi keluar ketika rapatan, dalam hal ini energi yang keluar lebih kecil daripada energi yang masuk sehingga gelembung memuai sedikit demi sedikit selama regangan kemudian menyusut selama rapatan. Ukuran kritis gelembung ini disebut ukuran resonan yang tergantung pada fluida
5
dan frekuensi suara. Dalam kondisi ini, gelembung tidak dapat lagi menyerap energi secara efisien. Tanpa energi input, gelembung tidak dapat mempertahankan dirinya, fluida di sekitarnya akan menekannya dan gelembung akan mengalami ledakan hebat yang menghasilkan tekanan sangat besar. Gelembung inilah yang disebut sebagai gelembung kavitasi.
Selama perambatan gelombang suara dalam medium intensitas gelombang semakin menurun seiring makin besarnya jarak dari sumber radiasi dengan persamaan
I = I0 exp (-2αd) (1)
α merupakan koefisien atenuasi. Lamanya waktu sonikasi juga mempengaruhi energi yang diberikan pada molekul. Semakin lama waktu sonikasi, maka akan semakin besar enegi yang diberikan. Hal ini terkait dengan persamaan
E = P t (2)
dengan P sebagai daya.
Dalam penelitian ini, efek kavitasi digunakan dalam proses emulsifikasi yang melibatkan polimer di dalamnya. Efek ultrasonik pada polimer adalah pemutusan dan pembentukan ikatan, sehingga memungkinkan terjadi perubahan struktur. Dalam proses kavitasi terbentuk gelembung yang berasal dari salah satu fasa yang didispersikan dalam fasa yang lain, di mana gelembung kavitasi merupakan fasa minyak yang didispersikan dalam fasa air karena memiliki volume yang lebih rendah. Dengan efek pecahnya kavitasi, maka emulsifikasi yang disebabkan oleh penjalaran ultrasonik akan efektif dengan terdispersinya fasa minyak yang mengandung agregat nanosfer dalam fasa air, sehingga nanosfer yang telah terbentuk dapat dapat terdispersi stabil. Bentuk dan ukuran gelembung akan mempengaruhi bentuk dan ukuran nanopartikel yang terbentuk (Hielscher 2005).
Pada proses sonikasi terjadi siklus peredaman gelombang dimana terjadi penurunan energi mekanik terhadap waktu dan resonansi, ketika frekuensi gelombang mendekati frekuensi gelembung kavitasi (f0
f), gelembung akan pecah (Tipler 1998).
Hal inilah yang menyebabkan nanopartikel yang terkungkung di dalamnya juga dapat terpisah satu sama lain sehingga didapatkan
nanosfer dengan ukuran kecil (Hapsari 2009).
Suspensi dalam larutan menghasilkan kecepatan tumbuk antar partikel yang dapat merubah morfologi permukaan, komposisi, dan reaktivitas (Suslick et al. 1999). Semakin lama proses sonikasi ini akan menyamaratakan energi yang diterima partikel diseluruh bagian sisi larutan, sehingga ukuran partikel semakin homogen.
Pengeringan Semprot (spray drying)
Metode pengeringan semprot (spray
drying) merupakan metode yang paling
mudah dan sederhana untuk mengkapsulasi suatu bahan karena larutan suspensi yang akan dinanoenkapsulasi cukup dimasukkan ke dalam alat pengering semprot dengan serbuk nanokapsul sebagai produk. Metode ini dapat dilakukan melalui beberapa tahapan, yaitu (1) produk yang berupa cairan didispersikan dalam penyemprot (sprayer), (2) kontak antara semprotan dengan udara panas, (3) pengeringan semprotan, dan (4) pemisahan antara produk kering (aliran serbuk bebas) dan udara.
Keuntungan nanoenkapsulasi dengan metode pengeringan semprot ini diantaranya ialah (1) meningkatnya stabilitas serbuk, (2) teknik yang dapat dipercaya, (3) biaya yang murah, (4) menghasilkan serbuk berupa partikel mikrokapsul yang kecil, (5) teknik yang ramah, terhindar dari penggunaan pelarut organik, (6) dilakukan satu tahap, atau dengan kata lain prosesnya sinambung (continuous), dan (7) merupakan metode yang fleksibel, dapat digunakan untuk enkapsulasi polimer-polimer yang berbeda dan suhu berbeda (Yundhana 2008).
XRD (X-Ray Diffraction)
Analisis XRD dapat memberikan informasi mengenai struktur sampel, seperti sistem kristal, parameter kisi, dan orientasinya. Selain itu juga berguna untuk mengidentifikasi suatu campuran yang merupakan identifikasi fase sampel semi kuantitatif dengan menghitung fraksi volume suatu sampel, rasio fraksi area kristalin terhadap fraksi total area.
Analisis XRD menggunakan emisi sinar-X dihasilkan dari tumbukan antara elektron dan target berupa Cr, Fe, Co, Cu, Mo, atau W (Cullity 1956). Emisi sinar-X didistribusikan secara kontinyu dan spesifik untuk setiap panjang gelombang target. Sinar-X ditransmisikan melewati sampel yang akan dikarakterisasi, sehingga sinar-X
akan ditransform menjadi beragam jenis energi dan diserap sebagian.
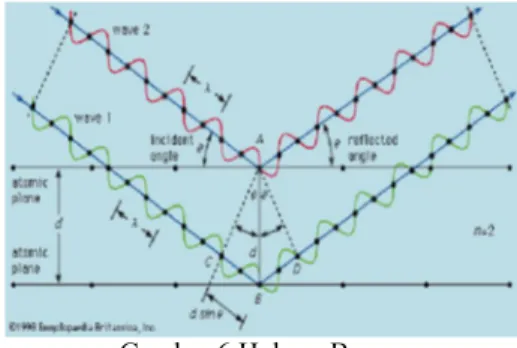
Interaksi sinar-X dengan sampel menimbulkan difraksi sekunder yang dihubungkan dengan jarak interplanar dalam serbuk kristal sesuai dengan Hukum Bragg di bawah ini:
n λ = 2 d sin θ (3) n merupakan bilangan bulat, λ merupakan
panjang gelombang sinar-X, d merupakan jarak interplanar penyebab difraksi, dan θ merupakan sudut difraksi. Besaran λ dan d dihitung dalam satuan yang sama, biasanya dalam angstroms (Cullity 1956).
Gambar 6 Hukum Bragg
Berdasarkan Hukum Bragg (Gambar 6), jika seberkas sinar-X di jatuhkan pada sampel kristal,maka bidang kristal itu akan membiaskan sinar-X yang memiliki panjang gelombang sama dengan jarak antar kisi dalam kristal tersebut. Sinar yang dibiaskan akan ditangkap oleh detektor kemudian diterjemahkan sebagai sebuah puncak difraksi. Makin banyak bidang kristal yang terdapat dalam sampel, makin kuat intensitas pembiasan yang dihasilkannya. Tiap puncak yang muncul pada pola XRD mewakili satu bidang kristal yang memiliki orientasi tertentu dalam sumbu tiga dimensi. Puncak-puncak yang didapatkan dari data pengukuran ini kemudian dicocokkan dengan standar difraksi sinar-X untuk hampir semua jenis material. Standar ini disebut JCPDS.
SEM (Scanning Electron Microscope)
Metode yang cukup terkenal dalam mengkarakterisasi nanopartikel adalah dengan menggunakan SEM. Analisis SEM digunakan untuk mengidentifikasi morfologi permukaan nanopartikel kitosan yang terlihat melalui suatu gambar.
Scanning Electron Microscope (SEM)
memberikan penjelasan yang detail dari
permukaan, memberikan informasi mengenai ukuran dan bentuk yang homogen atau tidak dari bahan nanopartikel. Terdapat percepatan elektron (electron gun) dalam SEM untuk memproduksi elektron dengan menghasilkan pancaran elektron, serta lensa-lensa elektromagnetik yang dihubungkan dengan sistem kondensor. Lensa-lensa tersebut dioperasikan pada permukaan sampel.
Lensa pemfokus pertama menghasilkan pancaran dan batas arus, pada celah lensa berfungsi untuk mengurangi pembelokan sudut. Lensa pemfokus kedua membentuk pelemahan (pancaran sinar koheren), celah lensa dikendalikan untuk mengurangi pembelokan sudut dari pancaran lensa pertama (Gabriel 1985).
Tembakan elektron hanya mengenai sampel pada daerah yang sangat kecil. Elektron direfleksikan dari sampel atau diserap oleh sampel secara elastis dan memberinya elektron sekunder dengan energi sangat rendah bersamaan dengan sinar-X. Elektron-elektron tersebut terserap dan meningkatkan emisi cahaya tampak, kemudian meningkatkan arus listrik pada sampel. Hal ini dapat menghasilkan gambar yang terbentuk dari elektron sekunder yang berenergi rendah (Gabriel 1985).
Prinsip kerja dari SEM yaitu sebuah percepatan elektron (electron gun)
memproduksi sinar elektron dan dipercepat dengan anoda. Lensa magnetik memfokuskan elektron menuju ke sampel. Sinar elektron yang terfokus mendeteksi keseluruhan sampel dengan diarahkan oleh koil pendeteksi. Ketika elektron mengenai sampel maka sampel akan mengeluarkan elektron baru yang akan diterima oleh detektor dan dikirim ke monitor (CRT). Secara lengkap skema SEM dijelaskan oleh gambar dibawah ini:
7
FTIR (Fourier Transform Infrared)
FTIR (Fourier Transform Infrared) merupakan suatu metode spektroskopi IR. Spektrometer Infrared (IR) dapat mengidentifikasi kandungan gugus kompleks dalam senyawa tetapi tidak dapat menentukan molekular-unsur penyusunnya.
Pada spektroskopi IR, radiasi IR dilewatkan pada sempel. Sebagian dari radiasi IR diserap oleh sampel dan sebagian lainnya diteruskan. Jika frekuensi dari suatu vibrasi spesifik sama dengan frekuensi radiasi IR yang langsung menuju molekul, molekul akan menyerap radiasi tersebut. Spektrum yang dihasilkan menggambarkan absorpsi dan transmisi molekular, membentuk sidik jari molekular suatu sampel (Anonim 2001).
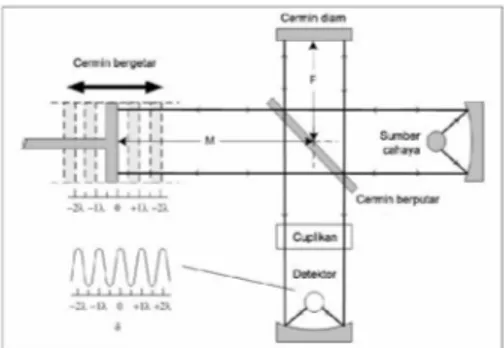
Sistem optik Spektrofotometer FTIR seperti pada gambar dibawah ini (Gambar 8) dilengkapi dengan cermin yang bergerak tegak lurus dan cermin yang diam. Dengan demikian radiasi infra merah akan menimbulkan perbedaan jarak yang ditempuh menuju cermin yang bergerak (M) dan jarak cermin yang diam (F). Perbedaan jarak tempuh radiasi tersebut adalah 2 yang selanjutnya disebut sebagai retardasi (δ). Hubungan antara intensitas radiasi IR yang diterima detektor terhadap retardasi disebut sebagai interferogram. Sedangkan sistim optik dari Spektrofotometer IR yang didasarkan atas bekerjanya interferometer disebut sebagai sistim optik Fourier Transform Infra Red.
Pada sistim optik FTIR digunakan radiasi LASER (Light Amplification by
Stimulated Emmission of Radiation) yang
berfungsi sebagai radiasi yang diinterferensikan dengan radiasi infra merah agar sinyal radiasi infra merah yang diterima oleh detektor secara utuh dan lebih baik.
Detektor yang digunakan dalam Spektrofotometer FTIR adalah TGS (Tetra
Glycerine Sulphate) atau MCT (Mercury Cadmium Telluride). Detektor MCT lebih
banyak digunakan karena memiliki beberapa kelebihan dibandingkan detektor TGS, yaitu memberikan respon yang lebih baik pada frekwensi modulasi tinggi, lebih sensitif, lebih cepat, tidak dipengaruhi oleh temperatur, sangat selektif terhadap energi vibrasi yang diterima dari radiasi infra merah.
Gambar 8 Sistem optik Spektrofotometer FTIR
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan September 2009 sampai dengan bulan Januari 2010 di Laboratorium Biofisika Departemen Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Alat dan Bahan
Bahan yang digunakan dalam penelitian ini adalah serbuk kitosan, asam asetat 2%, tripolifosfat (TPP) dengan konsentrasi 0,5% dan 1%, ekstrak temulawak dalam etanol teknis 70%, dan aquades. Peralatan yang digunakan adalah neraca analitik, magnetic
stirrer, Ultrasonics Processor (Cole-Parmer
20 kHz 130 watt), beaker glass 500 mL,
beaker glass 1000 mL, gelas ukur, sudip,
pipa voltmetrik, dan balmer.
Metode Penelitian
Pembuatan Nanopartikel Ekstrak
Temulawak Tersalut Kitosan
Kitosan sebanyak 4 gram dilarutkan dalam 200 ml asam asetat 2% menggunakan
magnetic stirrer sehingga diperoleh konsentrasi kitosan 2% (b/v). 200 ml larutan kitosan ditambahkan ke dalam 100 mL TPP 0,5% yang larut dalam aquades, kemudian larutan tersebut disonikasi menggunakan prosesor ultrasonik dengan daya 130 watt dan frekuensi 20 kHz selama 30 menit. Setelah disonikasi, larutan tersebut dikeringkan dengan menggunakan spray
dryer sehingga diperoleh sampel dalam
bentuk serbuk. Serbuk larutan kitosan dan TPP 0,5% dari sampel tersebut, dilarutkan kembali dalam 200 mL asam asetat 2% dan 100 mL aquades menggunakan magnetic
stirrer dengan pemanasan sedang (30°C)
agar serbuk larut sempurna. Sebanyak 2 mL ekstrak temulawak 5% ditambahkan pada
serbuk terlarut tersebut yang kemudian disonikasi kembali selama 30 menit. Larutan ekstrak temulawak tersebut, dikeringkan dengan menggunakan spray dry agar diperoleh sampel dalam bentuk serbuk. Untuk variasi waktu sonikasi dan konsentrasi TPP lainnya (Tabel 3), metodenya sama seperti langkah di atas.
Tabel 3 Kode sampel
Nanopartikel ekstrak temulawak tersalut kitosan dengan
Kode Sampel TPP 0.5% selama 30 menit TPP 0.5% selama 60 menit TPP 1% selama 30 menit TPP 1% selama 60 menit A1 A2 A3 A4 Karakterisasi XRD
Sekitar 200 mg sampel ditaburkan ke dalam holder berupa kaca preparat yang dibagi dua, sampel tersebut ditaburkan pada bagian holder berukuran 2 x 2 cm2 yang kemudian diratakan tipis hingga kaca holder pada bagian tersebut tertutup serbuk sampel secara sempurna. Sampel dikarakterisasi menggunakan alat XRD dengan sumber Cu
( ).
Karakterisasi SEM
Sampel diletakkan pada plat aluminium yang memiliki dua sisi, kemudian dilapisi dengan lapisan emas dengan waktu coating ± 30 detik. Sampel yang telah dilapisi, diamati menggunakan SEM dengan tegangan 10 kV dan perbesaran hingga 20.000 kali.
Karakterisasi FTIR
Sebanyak 2 mg sampel nanopartikel dicampur dengan 100 mg KBr untuk dibuat pelet dengan pencetak vakum. Pelet yang terbentuk dikenai sinar infra merah dengan jangkauan bilangan gelombang 4.000-400 cm-1. Latar belakang absorpsi dihilangkan dengan cara pelet KBr dijadikan satu pada setiap pengukuran.
HASIL DAN PEMBAHASAN
Nanopartikel Ekstrak Temulawak
Tersalut Kitosan
Nanopartikel ekstrak temulawak tersalut kitosan disintesis melalui 2 variasi yaitu konsentrasi TPP dan waktu sonikasi. TPP yang digunakan pada penelitian ini yaitu TPP dengan konsentrasi 0,5% dan 1%. Penambahan TPP bertujuan untuk
membentuk ikatan silang ionik antara melekul kitosan sehingga dapat digunakan sebagai bahan penjerap (Mi et al. 1999). Sifat kitosan yang mudah rapuh dapat distabilkan menggunakan TPP. Variasi waktu sonikasi selama 30 menit dan 60 menit dilakukan untuk mengetahui ukuran nanopartikel dan kehomogenan larutan dengan penambahan waktu sonikasi.
Pada penelitian ini digunakan alat berupa beaker glass 500 mL sebagai wadah untuk membuat larutan nanopartikel ekstrak temulawak tersalut kitosan, sedangkan penelitian pendahuluan yang telah dilakukan menggunakan Erlenmeyer 250 mL sebagai wadahnya (komunikasi pribadi). Hal ini dilakukan untuk mengetahui pengaruh perbedaan wadah terhadap penjalaran energi.
Berdasarkan hasil foto SEM, diperoleh data yang ditunjukkan pada Tabel 4. Dari Tabel 4 terlihat bahwa sampel yang menggunakan wadah Erlenmeyer 250 mL menghasilkan ukuran partikel yang lebih kecil dibandingkan menggunakan wadah
beaker glass 500 mL. Jika dilihat dari
kehomogenan distribusi ukuran partikel, sampel yang menggunakan wadah beaker
glass 500 mL distribusi ukuran partikelnya
cenderung lebih homogen dibandingkan dengan menggunakan wadah Erlenmeyer 250 mL (Gambar 9). Ketika gelombang
sonic menjalar dalam wadah Erlenmeyer
250 mL, penyebaran energinya tidak sama. Hal ini terkait dengan geometri wadah Erlenmeyer 250 mL yang tidak beraturan atau cenderung mengerucut ke atas dan jarak antara sumber gelombang terhadap dinding wadah yang berbeda-beda (Gambar 10 (a)), sehingga energi yang dipantulkan pada molekul larutan emulsi berbeda-beda pula. Terjadinya pemantulan yang berbeda-beda ini menyebabkan molekul larutan emulsi ada yang pecah lebih cepat dan ada juga yang pecah lebih lama sehingga menghasilkan ukuran partikel yang paling kecil namun tidak homogen. Berbeda dengan sampel yang menggunakan wadah beaker glass 500 mL (Gambar 10 (b)) penyebaran energi pada wadah tersebut cenderung merata karena geometri wadah yang beraturan, serta jarak antara sumber gelombang terhadap dinding wadah yang sama, sehingga seluruh molekul yang ada pada wadah tersebut terkena energi yang sama dan molekul larutan emulsi akan terpecah dengan ukuran yang sama serta distribusi ukuran partikelnya cenderung lebih homogen. Hal ini yang menyebabkan
9
distribusi ukuran partikel menggunakan wadah Erlenmeyer 250 mL kurang homogen.
Dalam proses sonikasi terjadi resonansi, ketika frekuensi gelombang sonic mendekati frekuensi gelembung kavitasi (f ≈ f0) yang
pada waktu tertentu dianalogikan pecah, karena pada saat itu sistem memiliki energi maksimal yang dapat diserap oleh gelembung kavitasi. Hal inilah yang menyebabkan nanopartikel yang terkungkung di dalamnya juga akan dapat terpisah satu sama lain sehingga didapatkan nanosfer dengan ukuran kecil (Hapsari 2009).
Tabel 4 Ukuran partikel nanopartikel ekstrak temulawak tersalut kitosan dengan konsentrasi TPP 0,5% wadah Diameter partikel sonikasi 30 menit (nm) sonikasi 60 menit (nm) Erlenmeyer 250 mL 222-3500 333-4600 beaker glass 500mL 430-2900 422-4700 (a) (b) (c) (d)
Gambar 9 Foto SEM nanopartikel ekstrak temulawak tersalut kitosan sonikasi 30 menit (a) dan sonikasi 60 menit (b) dengan menggunakan wadah Erlenmeyer, serta sonikasi 30 menit (c) dan sonikasi 60 menit (d) dengan menggunakan wadah
beaker glass pada perbesaran
2000 kali.
(a)
(b)
Gambar 10 proses sonikasi menggunakan wadah Erlenmeyer 250 mL (a) dan proses sonikasi menggunakan wadah beaker
glass 500 mL (b). Hasil analisis XRD
Analisis XRD digunakan untuk mengetahui struktur sampel. Data yang diperoleh dari analisis XRD berupa grafik hubungan antara sudut difraksi sinar-X pada sampel dengan intensitas sinar yang
dipantulkan oleh sampel. Menurut Kencana (2009), bentuk amorf ditandai dengan puncak lemah pada sudut . Pada pola XRD dapat dilihat terbentuknya peak pada sudut 2 antara hingga dengan variasi konsentrasi TPP dan waktu sonikasi.
Berdasarkan hasil XRD yang diperoleh (Gambar 11), keempat sampel menunjukkan sifat amorf karena terdapat pola difraksi dengan puncak 21,04° pada sampel A1; 20,62° pada sampel A2; 20,14° pada sampel A3; dan 19,48° pada sampel A4. Hal tersebut bersesuaian dengan data kitosan dan kurkumin dalam JCPDS. Pergeseran puncak yang terlihat pada keempat sampel menunjukkan bahwa keempat sampel telah mengalami perubahan struktur kristal menjadi bentuk amorf. Terjadinya perubahan struktur ini terkait dengan sifat biodegradabel, karena semakin amorf strukturnya maka akan semakin mudah untuk diuraikan dalam tubuh (Hapsari 2009). Hal ini berkaitan dengan aplikasi dalam penghantaran obat, dimana kurkumin diharapkan dapat terbungkus oleh kitosan sehingga jika dikonsumsi mudah terdegradasi.
Nilai derajat kristalinitas yang diperoleh untuk sampel A1 25,99%; sampel A2 25,99%; sampel A3 26,50%; dan sampel A4 29,34%. Besarnya nilai derajat kristalinitas bertambah besar seiring dengan banyaknya konsentrasi TPP dan lamanya waktu sonikasi. Pada gambar 11 juga terlihat puncak-puncak yang cukup tinggi pada sudut 44, 64, dan 77. Puncak-puncak tersebut bukan merupakan karakteristik dari sampel melainkan adanya pengotor yang terdapat pada sampel tersebut.
Gambar 11 Pola XRD kode sampel A1, A2, A3, dan A4
Hasil analisis Morfologi SEM
Hasil karakterisasi SEM nanopartikel ekstrak temulawak tersalut kitosan yang telah dibuat dengan metode sonikasi diperoleh bentuk partikel berupa bulatan menyerupai bola dan berkerut (Gambar 12). Ukuran partikel dapat ditentukan dengan mengukur diameter bola tersebut. Perbesaran yang digunakan yaitu mulai dari 1000 kali hingga 20.000 kali. Bentuk bola partikel ekstrak temulawak tersalut kitosan masih bisa terlihat jelas hingga perbesaran 20.000 kali.
Setelah dilakukan pengukuran diameter berdasarkan foto SEM diperoleh data yang ditunjukkan pada Tabel 5. Dari Tabel 5 terlihat bahwa kode sampel A4 menghasilkan ukuran partikel yang paling kecil dan distribusi ukuran partikelnya lebih homogen dibandingkan dengan kode sampel A1, A2, dan A3. Berdasarkan Gambar 12, kerutan pada partikel semakin berkurang dengan bertambahnya TPP dan waktu sonikasi. Perbedaan ukuran yang diperoleh memperlihatkan bahwa penambahan TPP dan waktu sonikasi cenderung mempengaruhi ukuran partikel dan meningkatkan kehomogenan ukurannya.
Menurut Mi et al. (1999), penambahan TPP bertujuan untuk membentuk ikatan silang ionik antara melekul kitosan sehingga dapat digunakan sebagai bahan penjerap. Semakin banyaknya penambahan TPP, ekstrak temulawak yang tersalut kitosan semakin kuat dan dapat mengurangi kerutan. Meningkatnya kehomogenan ukuran partikel juga dapat dilihat pada Gambar 12. Semakin lama waktu sonikasi, akan menyamaratakan energi yang diterima partikel diseluruh bagian sisi larutan sehingga ukuran partikel semakin homogen.
Gambar foto SEM kode sampel A3 berbeda dengan kode sampel lainnya (Gambar 12). Hal tersebut dikarenakan terjadi penundaan proses spray dry setelah melakukan proses sonikasi. Larutan yang telah disonikasi sebaiknya langsung dilakukan proses spray dry agar larutan tersebut tidak membentuk gel. Tujuan dilakukan spray dry agar menghasilkan serbuk berupa partikel nanokapsul yang kecil, teknik yang ramah sehingga dapat terhindar dari penggunaan pelarut organik, dan dapat meningkatkan stabilitas serbuk (Yundhana, 2008).
11
A1(a)
A2(b)
A3(c)
A4(d)
Gambar 12 Morfologi nanopartikel ekstrak temulawak tersalut kitosan; A1(a), A2(b), A3(c), dan A4(d)
Tabel 5 ukuran partikel hasil foto SEM Kode sampel Diameter (nm)
A1 430-2900 A2 422-4700 A3 444-4200 A4 418-2300
Hasil analisis FTIR
Karakterisasi FTIR dalam penelitian ini digunakan untuk mengetahui keberadaan ekstrak temulawak yang disalut oleh kitosan. Secara umum, spektrum inframerah dapat mengidentifikasi kandungan gugus fungsi dalam senyawa. Pada penelitian ini, pembanding yang digunakan adalah standar kurkumin. Hal ini disebabkan belum adanya data FTIR ekstrak temulawak.
Menurut Firdaus et al. (2008), gugus fungsi khas yang terdapat pada nanokitosan murni adalah gugus hidroksil (-OH) dan gugus amida (-NH2). Gugus fungsi hidroksil
pada kitosan muncul pada bilangan gelombang 3450-3200 cm-1 (Firdaus et al. 2008), sedangkan gugus fungsi amida muncul pada bilangan gelombang 1660-1500 (Colthup et al. 1975). Gugus fungsi khas yang terdapat pada kurkumin dapat dilihat pada Tabel 6 (Colthup et al. 1975).
Berdasarkan hasil FTIR yang diperoleh (Gambar 13), menunjukkan bahwa keempat sampel terdapat gugus fungsi hidroksil pada bilangan gelombang masing-masing 3350,62 cm-1; 3370,05 cm-1; 3341,62 cm-1; dan 3378,00 cm-1. Gugus fungsi amida pada penelitian ini muncul dalam bilangan gelombang 1567,15 cm-1 pada sampel A1; 1564,70 cm-1 pada sampel A2; 1557,33 cm-1 pada sampel A3; dan 1559,86 cm-1 pada sampel A4. Gugus fungsi khas yang dimiliki kurkumin seperti C=O, C=C, C-O, dan C-H tekuk juga terdapat pada keempat sampel. Terjadi sedikit perubahan bilangan gelombang dari keempat sampel, hal ini menunjukkan adanya interaksi kembali antar gugus fungsi akibat penambahan TPP dan waktu sonikasi.
Tabel 6 Pita transmitan standar kurkumin dan data literatur
4000.0 3600 3200 2800 2400 2000 1800 1600 1400 1200 1000 800 600 450.0 -1.0 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17.4 cm-1 %T
Laboratory Test Result
Kitosan 2%+TPP 1%+temulawak 5% (30 mnt) Kitosan 2%+TPP 0.5%+temulawak 5% (30mnt)
Kitosan 2%+TPP 0.5%+temulawak 5% (60mnt)
Kitosan 2%+TPP 1%+temulawak 5% (60mnt)
Gambar 13 Pola Spektra FTIR kode sampel A1, A2, A3, dan A4
KESIMPULAN
Telah dilakukan pembuatan nanopartikel ekstrak temulawak tersalut kitosan dengan variasi konsentrasi TPP dan waktu sonikasi. Konsentrasi TPP yang tinggi dapat menguatkan sifat mekanik kitosan yang mudah rapuh dan dapat membentuk ikatan silang ionik antara melekul kitosan. Lamanya waktu sonikasi dapat meningkatkan kehomogenan ukuran partikel. Penggunaan wadah dengan menggunakan beaker glass 500 mL lebih menghasilkan distribusi ukuran partikel yang lebih homogen dibandingkan menggunakan wadah Erlenmeyer. Sampel dengan konsentrasi TPP 1% dan waktu sonikasi 60 menit menunjukkan bahwa ekstrak temulawak yang tersalut kitosan semakin kuat dan kerutan pada partikel semakin berkurang. Ukuran partikel yang diperoleh pada sampel tersebut sebesar 418 nm hingga 2300 nm.
Hasil XRD menunjukkan bahwa nanopartikel ekstrak temulawak tersalut kitosan berstruktur amorf. Besarnya nilai derajat kristalinitas bertambah besar seiring dengan banyaknya konsentrasi TPP dan lamanya waktu sonikasi. Berdasarkan foto SEM (Gambar 12), menunjukkan bahwa partikel yang dihasilkan berupa bulatan menyerupai bola dan berkerut. Keberadaan ekstrak temulawak dalam penyalut kitosan dapat dipastikan karena grafik spektra FTIR yang diperoleh hampir sama dengan standar kurkumin.
SARAN
Pada penelitian selanjutnya diharapkan untuk dapat divariasikan lagi konsentrasi TPP dan selang waktu sonikasi yang lebih lama. Sifat kitosan yang mudah rapuh dan dapat membentuk gel, sehingga perlu diberi
surfaktan untuk menjaga kestabilan emulsi dan memisahkan partikel satu sama lain agar tidak menggumpal kembali setelah disonikasi.
DAFTAR PUSTAKA
Berger J et al. 2004. Structure and interactions in covalently and ionically crosslinked chitosan hydrogels for biomedical applications. Eur J Pharm
Biophram 57:193-194.
Colthup NB, Daly LH, Wiberly SE. 1975.
Introduction to Infrared and Raman Spectroscopy. New York: Academic
Press.
Cullity BD. 1956. Element of X-Ray
Diffraction. Addison Wesley Publishing
Company, Inc.
Desai KGH, Park HJ. 2005. Preparation and characterization of drug-loaded chitosan–tripolyphosphate microspheres by spray drying. Drug Development
Res. 64:114–128.
Fardiaz D. 198. Hidrokoloid. Bogor: Pusat Antar Universitas Pangan dan Gizi, Institut Pertanian Bogor.
Firdaus F, Darmawan E, Mulyaningsih S. 2008. Karakteristik spectra infrared (IR) kulit udang, kitin, dan kitosan yang dipengaruhi oleh proses demineralisasi, deproteinisasi, deasetilasi I, dan deasetilasi II. Jurnal Ilmiah Farmasi 4:11-22.
Gabriel BL. 1985. SEM: A user’s Manual
for Materials Science. Ohio: Packer
Engineering Associates, Inc.
Hapsari BW. 2009. Sintesis nanosfer berbasis ferrofluid dan polylactic acid (PLA) dengan metode sonikasi [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Hielscher, T. 2005. Ultrasonic Production of
Nano-Size Dispersions and Emulsions,
dalam: Proceedings of European Nanosystems Conference ENS’05. Hirano S. 1996. Chitin biotechnology
application. Dalam: El-Gewely MR. 1996. Biotechnology Annual Review. Canada: Elsevier.
Hu Z, Chan WL, Szeto YS. 2007. Nanocomposite of chitosan and silver oxide and its antibacterial property. J
Appl Polym Sci. 108: 52–56.
Jamaludin MA. 1994. Isolasi dan pencirian kitosan limbah kulit udang windu (Penaeus monodon Fabricus) dan
13
afinitasnya terhadap ion logam Pb2+, Cr6+, dan Ni2+ [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Jin Li, Jun Cai, Lihong Fan. 2008. Effect of sonolysis on kinetics and physicochemical properties of treated chitosan. J Appl. Polym. Sci. 109: 2417-2425.
Kato H, Taguchi T, Okuda H, Kondo M, Takahara M. 1994. Antihypertensive effect of chitosan in rats and humans. J.
Trad. Med. 11: 198-205.
Kencana AL. 2009. Perlakuan sonikasi terhadap kitosan: viskositas dan bobot molekul [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Mason TJ, Lorimer JP. 2002. Applied
Sonochemistry : The Uses of Power Ultrasound in Chemistry and Processing.
Mi FL, Shyu SS, Lee ST, Wong TB. 1999. Kinetic study of chitosan-tripolyphosphate complex reaction and acid-resistive properties of the chitosan-tripolyphosphate gel beads prepared by in-liquid curing method. J Polym Sci. 37:1551-1564.
Muzarelli RAA, Peter MG. 1997. Chitosan
Handbook. Grottammare: Europan Chitin Society.
Nakahira A, Nakamura S, Horimoto M. 2007. Synthesis of modified hydroxyapatite (HAP) substituted with Fe ion for DDS Aplication. Osaka:
IEEE Transactions on Magnetic 43 (6):
2465-2467. Dalam Hapsari BW. 2009. Sintesis nanosfer berbasis ferrofluid dan
polylactic acid (PLA) dengan metode
sonikasi [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Nurhaida P. 2009. Berbagai Ragam Pemanfaatan Polimer. [Terhubung Berkala].
http://www.library.usu.ac.id/download/f t/tkimia-nurhaida.pdfn [27 September 2009].
Poulain N, Nakache E. 1998. Nanoparticles from vesicles polymerization II. evaluation of their encapsulation capacity. J. Polym. Sci. 36: 3035–3043. Sanford PA. 1989. Chitosan: Commercial
uses and potential application; Chitin and chitosan sources, chemistry, physical properties and crab mealsand their use in Salmond pigmentation.
Dalam: Kim SOF. 2004. Physicochemical and functional properties of crawfish chitosan as affected by different processing protocols [tesis]. Louisiana: Faculty of the Louisiana State University and Agricultural and Mechanical College. Sembiring BBr, Ma’mun, Ginting EI. 2006.
Pengaruh kehalusan bahan dan lama ekstraksi terhadap mutu ekstrak temulawak (Curcuma xanthorriza Roxb.). J. Bul. Littro. 17: 53 – 58.
Sidik, Mulyono MW, Mutadi A. 1995. Temulawak (Curcuma xanthorrhiza
Roxb). Jakarta: Phyto Medika. Dalam:
Irawati I. 2008. Perbandingan metode penentuan aktivitas antioksidan rimpang temulawak [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Stevens MP. 2001. Kimia Polimer. Sopyan I, penerjemah. Jakarta: PT Pradnya Paramita. Terjemahan dari: Polymer
Chemistry: An Introduction.
Suslick KS, Price GJ. 1999. Application of ultrasound to materials chemistry. Annu.
Rev. Sci. 29: 295-326.
Sutriyo, Joshita D, Indah R. 2005. Perbandingan pelepasan propanol hidroklorida dari matriks kitosan, etil selulosa, dan hidroksipropil metil selulosa. Majalah Ilmu Kefarmasian 2: 145-153.
Suwiah A. 1991. Pengaruh perlakuan bahan dan jenis pelarut yang digunakan pada pembuatan temulawak (Curcuma
xanthorrhiza Roxb) instan terhadap
rendemen dan mutunya. [skripsi]. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor. Dalam Aan. 2003. Pengaruh waktu, suhu, dan nisbah pelarut pada ekstraksi kurkumin temulawak dengan pelarut aseton [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Thatte MR. 2004. Synthesis and Antibacterial of Water-Soluble Hydrophobic Chitosan Derivatives Bearing Quaternary Ammonium Functionality [disertasi]. Baton Rouge: the Department of Chemistry, Louisiana State University and Agricultural and Mechanical College.
Tipler PA. 1998. Fisika Untuk Sains dan
Teknik. Ed ke-3. Prasetio Lea, Adi
Rahmad W, penerjemah; Sutrisno Joko, editor. Jakarta: Erlangga. Terjemahan
dari: Physics for Scientists and Engineers.
3
rd Ed.Wang T, Turhan M, Gunasekaram S. 2004. Selected properties of PH-sensitive, biodegradable chitosan-poly(vinyl alcohol) hydrogel. Polym Int 53:911-918.
Yundhana Y. 2008. Mikroenkapsulasi obat anti-peradangan ketroprofen yang tersalut gel kitosan-karboksimetil selulosa.
[Anonim]. 2001. Introduction to Fourier
Transform Infrared Spectrometry.
http://mmrc.caltech.edu/FTIRintro.pdf [27 September 2009].
15
Lampiran 1 Diagram Alir Penelitian
Penelusuran literatur awal
Larutan kitosan 2% b/v Kitosan Larutan TPP Sonikasi Spray dry + 2 ml temulawak 5% Sonikasi Spray dry SEM FTIR XRD Pengolahan data Penyusunan laporan (skripsi)
17
Lampiran 2 Derajat kristalinitas kode sampel A1
Lampiran 3 Derajat kristalinitas kode sampel A2
Lampiran 4 Derajat kristalinitas kode sampel A3
Lampiran 6 Data JCPDS Kitosan
19
Lampiran 8 Hasil foto SEM kode sampel A1
(perbesaran 1.000 kali) (perbesaran 2.000 kali)
(perbesaran 5.000 kali) (perbesaran 10.000 kali)
Lampiran 9 Hasil Foto SEM kode sampel A2
(perbesaran 1.000 kali) (perbesaran 2.000 kali)
(perbesaran 5.000 kali) (perbesaran 10.000 kali)
21
Lampiran 10 Hasil Foto SEM kode sampel A3
(perbesaran 1.000 kali) (perbesaran 2.000 kali)
(perbesaran 5.000 kali) (perbesaran 10.000 kali)
Lampiran 11 Hasil Foto SEM kode sampel A4
(perbesaran 1.000 kali) (perbesaran 2.000 kali)
(perbesaran 5.000 kali) (perbesaran 10.000 kali)
23
Lampiran 12 Spektra Inframerah kode sampel A1
4000.0 3600 3200 2800 2400 2000 1800 1600 1400 1200 1000 800 600 450.0 2.0 3 4 5 6 7 8 9 10 11 12 13 14 15 15.5 cm-1 %T
Kitosan 2% + TPP 0.5% + Temulawak 5% 30 menit
3743.77
3350.62
1567.15
1080.49
Lampiran 13 Spektra Inframerah kode sampel A2
4000.0 3600 3200 2800 2400 2000 1800 1600 1400 1200 1000 800 600 450.0 0.3 1 2 3 4 5 6 7 8 9 10 11 12 13 14.0 cm-1 %T
Kitosan 2% + TPP 0.5% + Temulawak 5% 60 menit
3370.05
1564.70 1412.25
1080.21
Lampiran 14 Spektra Inframerah kode sampel A3 4000.0 3600 3200 2800 2400 2000 1800 1600 1400 1200 1000 800 600 450.0 0.0 1 2 3 4 5 6 7 8 9 10 11 12 12.5 cm-1 %T
Kitosan 2% + TPP1% + Temulawak 5% 30 menit
3341.62
1557.33 1413.40
1025.97
620.00
Lampiran 15 Spektra Inframerah kode sampel A4
4000.0 3600 3200 2800 2400 2000 1800 1600 1400 1200 1000 800 600 450.0 0.0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17.4 cm-1 %T
Laboratory Test Result
Kitosan 2%+TPP 1%+temulawak 5% (60mnt) 3378.00 1559.86 1413.11 1079.53 619.38