37 BAB IV
HASIL DAN PEMBAHASAN
A. Kadar Air Biji Kawista
Berdasarkan Gardner et al. (1991) perkecambahan suatu biji berlangsung dalam beberapa peristiwa fisiologis dan morfologis berikut ini : 1) imbibisi, 2) pengaktifan enzim, 3) transpor molekul yang terhidrolisis ke embrio, 4) peningkatan respirasi, 5) inisiasi pembelahan dan pembesaran sel dan 6) munculnya radikula. Perkecambahan diawali dengan penyerapan air oleh biji yang disebut imbibisi. Air merupakan bahan pokok yang diperlukan dalam mengawali proses perkecambahan. Menurut Goldsworthy (1992) dalam Anggraini (2004) air berperan penting dalam mendorong aktivitas enzim dan respirasi, kemudian diikuti kegiatan katabolisme makromolekul menjadi mikromolekul. Embrio kemudian memanfaatkan mikromolekul seperti asam amino, glukosa dan asam lemak sebagai sumber energi untuk tumbuh dan berkembang. Adapun perubahan yang diamati dalam tahap imbibisi disajikan dalam tabel yang berisi berat kering biji kawista sebelum mendapatkan perlakuan perendaman dan berat basah setelah biji kawista mendapatkan perlakuan perendaman atau penanaman (Tabel 1).
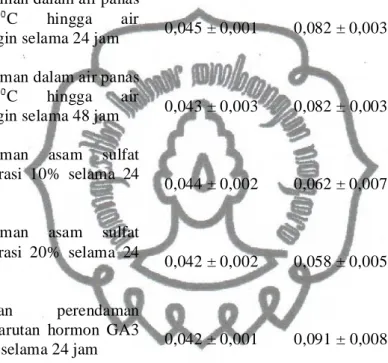
Tabel 1. Data Penambahan Berat Biji Selama Pengecambahan 24 Jam Pertama
Perlakuan
Berat biji (gram)
Penambahan Berat Berat Sebelum Perlakuan Berat Sesudah Perlakuan Kontrol 0,043 ± 0,003 0,077 ± 0,009 0,034 ± 0,006b Perendaman dalam air panas
± 95 C hingga air
mendingin selama 24 jam 0,045 ± 0,001 0,082 ± 0,003 0,037 ± 0,002 b
Perendaman dalam air panas ± 95 C hingga air
mendingin selama 48 jam 0,043 ± 0,003 0,082 ± 0,003 0,039 ± 0,000 bc
Perendaman asam sulfat konsentrasi 10% selama 24
jam 0,044 ± 0,002 0,062 ± 0,007 0,018 ± 0,005
a
Perendaman asam sulfat konsentrasi 20% selama 24
jam 0,042 ± 0,002 0,058 ± 0,005 0,016 ± 0,003
a
Perlakuan perendaman dalam larutan hormon GA3
15 ppm selama 24 jam 0,042 ± 0,001 0,091 ± 0,008 0,049 ± 0,007 cd
Perlakuan perendaman dalam larutan hormon GA3
30 ppm selama 24 jam 0,041 ± 0,003 0,095 ± 0,012 0,054 ± 0,009 d
Perendaman dalam larutan hormon IBA 15 ppm selama
24 jam 0,037 ± 0,002 0,079 ± 0,006 0,042 ± 0,004
bc
Perendaman dalam larutan hormon IBA 30 ppm selama
24 jam 0,041 ± 0,003 0,095 ± 0,012 0,054 ± 0,009
d
Pengikiran 0,043 ± 0,002 0,075 ± 0,004 0,032 ± 0,002b
Keterangan : Angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan hasil uji DMRT 95%.
Berdasarkan analisis varian (Lampiran 4) diketahui bahwa biji dengan perlakuan perendaman dalam air panas ± 95 C hingga air mendingin selama 24 jam dan pengikiran menghasilkan hasil berat basah biji yang tidak berbeda nyata dengan perlakuan kontrol, sedangkan perlakuan lainnya menunjukkan berbeda nyata dengan kontrol. Aktivitas penyerapan air tertinggi terjadi pada perlakuan hormon GA3 30 ppm, sedangkan aktivitas penyerapan air terendah terjadi pada perlakuan perendaman biji dalam asam sulfat konsentrasi 20%. Perlakuan fisik berupa pengikiran kulit biji dan perendaman dalam air panas menunjukkan kemungkinan bahwa kemampuan biji kawista dalam mengimbibisi air tidak begitu dipengaruhi oleh struktur kulit biji, namun juga bisa dipengaruhi oleh faktor kimia maupun fisiologis biji itu sendiri. Menurut Salisbury dan Ross (1995) faktor kimia dapat berupa komposisi makromolekul yang menyusun biji dan kulit biji serta senyawa metabolit yang bersifat menghambat perkecambahan seperti kumarin, sedangkan faktor fisiologis dapat berupa kondisi kemasakan embrio, ukuran biji, banyak sedikitnya endospermae, serta kondisi hormon endogen pada biji.
Menurut Sadjad (1975) kemampuan imbibisi biji berhubungan erat dengan sifat kimia biji dan sifat tanggap biji terhadap ketersediaan air di sekitarnya. Sifat kimia yakni berupa terjadinya proses hidrasi dari koloida-koloida hidrofil yang mengakibatkan pertambahan volume dan timbulnya tekanan imbibisi. Tekanan ini menimbulkan keretakan pada bagian kulit biji sehingga air dapat masuk. Menurut McDonald (2008) ada tiga faktor yang mempengaruhi terjadinya imbibisi, antara lain : 1) komposisi materi dalam biji, 2) permeabilitas kulit biji dan
3) kemampuan biji menyimpan air (water avaibility). Hubungan komposisi materi dalam biji terhadap kemampuan imbibisi biji terletak pada keberadaan makromolekul yang mendominasi pada sebuah biji. Biji yang lebih banyak mengandung protein lebih tinggi dalam menyerap air dibandingkan dengan biji yang lebih banyak mengandung pati dan atau lemak. Thomas dan Ponnamal (2005) menyebutkan bahwa biji buah kawista mengandung 16.50 ±0.83 mg/g protein dan 12.72 ± 0.47 mg/g karbohidrat. Perbandingan komponen jumlah protein dengan karbohidrat yang tidak jauh berbeda inilah yang mungkin menyebabkan biji kawista tidak menyerap air dalam jumlah yang tinggi.
Selain ditunjukkan dengan adanya perubahan perbedaan berat kering dan berat basah, biji yang mengalami imbibisi juga bisa dilihat dari perubahan volume bijinya. Pengamatan menggunakan mikroskop stereo menunjukkan perbedaan antara biji sebelum mengalami imbibisi dengan biji yang telah mengalami imbibisi (Gambar 4). Biji kawista yang belum mengalami imbibisi tampak pipih, sedangkan biji yang sudah mengalami imbibisi tampak menggembung.
(b)
Gambar 4. (a) Biji Sebelum Mengalami Imbibisi (b) Biji Sesudah Imbibisi (a)
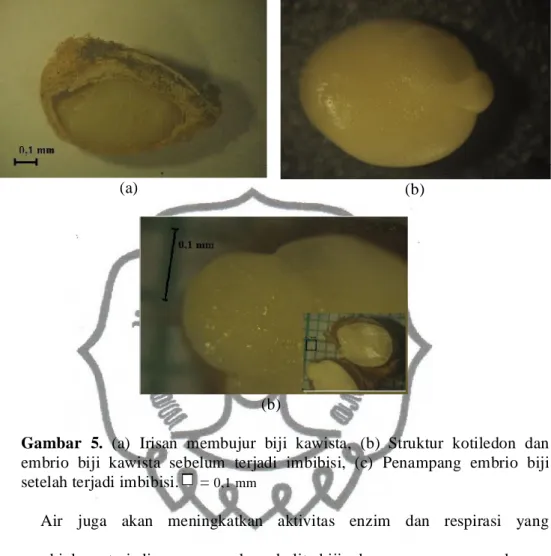
Perubahan ukuran biji merupakan efek dari aktivitas imbibisi. Menurut Saenong et al. (1989) biji yang mengalami imbibisi ditandai dengan terjadinya perubahan volume maupun ukuran biji. Setelah terjadinya imbibisi, air akan berperan mengaktivasi enzim hidrolitik untuk menyediakan energi bagi perkembangan embrio. Menurut Kucera et al. (2005) tahapan setelah imbibisi adalah perkembangan embrio yang ditandai dengan adanya pemanjangan embrio. Gambar 5 menunjukkan adanya perbedaan perkembangan embrio antara biji yang yang belum mengalami imbibisi dengan biji yang sudah berimbibisi. Biji kawista yang belum mengalami imbibisi ditunjukkan pada Gambar 5a dan 5b. Tampak pada Gambar 5a bahwa biji yang belum mengalami imbibisi ukuran panjang embrio bijinya adalah 0,92 mm, sedangkan pada Gambar 5b sebagai biji yang sudah mengalami imbibisi ukuran panjang embrio bijinya adalah 0,97 mm. Hasil ini menunjukkan bahwa perlakuan yang diberikan terhadap biji kawista menyebabkan aktivitas imbibisi lebih mudah terjadi.
Keberadaan air yang masuk ke dalam biji akan mendorong pertumbuhan embrio biji dan terjadinya perkecambahan. Menurut Byrd (1968) dalam Lensari (2009) air dalam proses perkecambahan berperan dalam berbagai reaksi biokimia. Salah satu proses biokimia yang terjadi adalah proses perombakan cadangan bahan makanan yang terdapat dalam biji. Air akan mengaktifkan enzim-enzim yang berperan dalam proses perombakan, seperti enzim amilase untuk merombak karbohidrat menjadi glukosa, enzim lipase untuk merombak lemak menjadi asam lemak dan gliserol, serta enzim protase untuk merombak protein menjadi asam amino.
(a) (b)
(b)
Gambar 5. (a) Irisan membujur biji kawista, (b) Struktur kotiledon dan embrio biji kawista sebelum terjadi imbibisi, (c) Penampang embrio biji setelah terjadi imbibisi. = 0,1 mm
Air juga akan meningkatkan aktivitas enzim dan respirasi yang memungkinkan terjadinya pemecahan kulit biji dan penggunaan cadangan makanan. Setelah terjadi penyerapan air, enzim diaktifkan dan masuk ke dalam endosperm dan mendegradasi zat cadangan makanan. Enzim amilase bekerja memecah tepung menjadi maltosa, selanjutnya maltosa dihidrolisis oleh maltase menjadi glukosa. Enzim lipase merombak lemak menjadi asam lemak dan gliserol, sedangkan enzim protease merombak protein menjadi asam amino. Senyawa-senyawa sederhana ini akan ditransport ke embrio untuk pertumbuhan. Senyawa glukosa masuk ke dalam proses metabolisme dan dipecah menjadi energi dan senyawa karbohidrat yang menyusun struktur tubuh. Asam-asam
amino tersebut dirangkai menjadi protein yang berfungsi menyusun struktur sel dan enzim-enzim baru. Asam lemak terutama digunakan untuk menyusun membran sel. Selain itu dari aktivitas kerja enzim protease akan dihasilkan asam
-amilase semakin meningkat maka proses hidrolisis amilum menjadi gula sederhana dapat berlangsung lebih cepat. -amylase juga dipengaruhi oleh giberelin yang ada dalam embrio. Pada awal perkecambahan -amylase (Gardner et al., 1991; Salisbury dan Ross, 1995).
Sumber-sumber energi yang dihasilkan, selanjutnya digunakan oleh embrio untuk tumbuh dan berkembang. Hal ini ditunjukkan dengan kemunculan radikula yang menembus kulit biji. Tipe perkecambahan pada biji kawista adalah epigeal. Perkecambahan biji kawista ini diawali dari kulit biji yang pecah sehingga menimbulkan celah, dari celah tersebut kemudian keluar radikula yang bewarna putih (Gambar 6).
Gambar 6. Penampang munculnya radikula kecambah biji kawista yang menandai awal perkecambahan
Setelah radikula keluar, bagian hipokotil mulai memanjang (ditandai dengan warna hijau muda). Selanjutnya diikuti keluarnya kotiledon yang terdiri atas sepasang daun lembaga kecil agak tebal berbentuk elips dengan panjang sekitar 1 cm berwarna hijau. Berdasarkan Gambar 7 kecambah biji kawista yang dihasilkan oleh perlakuan kontrol, GA3, H2SO4 dan pengikiran menunjukkan kenampakan morfologi yang tidak jauh berbeda satu sama lainnya. Pada perlakuan tersebut, kecambah yang dihasilkan selama 30 hari pengecambahan kondisi morfologinya termasuk dari kriteria kecambah normal. Menurut Nikvonda (2000) kecambah normal dapat dikategorikan berdasarkan ciri-ciri berikut : panjang akar dan hipokotil mencapai kurang lebih tiga kali panjang biji, akar primer yang berkembang baik, hipokotil berkembang, memiliki struktur tumbuh yang lengkap serta menunjukkan pertumbuhan yang normal. Sebaliknya untuk kecambah abnormal dicirikan sebagai berikut : kotiledon muncul terlebih dahulu dibanding akar dan hipokotil, tidak tumbuh akar primer serta akar primer tidak berkembang dengan baik atau membengkak pendek. Beberapa kondisi kecambah yang abnormal ini ditemukan pada perlakuan pengikiran. Ini mungkin dikarenakan pada perlakuan pengikiran, kotiledon lebih mudah terpengaruhi oleh kondisi lingkungan sekitar seperti kontaminasi oleh jamur sebagai akibat dari kulit biji yang terkelupas.
(a) (b)
(c) (d)
(e) (f)
(g) (h)
Gambar 7. Penampakan radikula dan plumula kecambah biji kawista setelah pengecambahan selama 30 hari : (a) Kecambah Kontrol, (b) Kecambah Perlakuan GA3 30 ppm, (c) Kecambah Perlakuan H2SO4 20%, (d) Kecambah Perlakuan Pengikiran, (e) Kecambah Perlakuan IBA 15 ppm, (f) Kecambah Perlakuan GA3 15 ppm, (g) Kecambah Perlakuan Air Panas, (h) Kecambah Perlakuan IBA 30 ppm.
B. Perkecambahan Biji Kawista
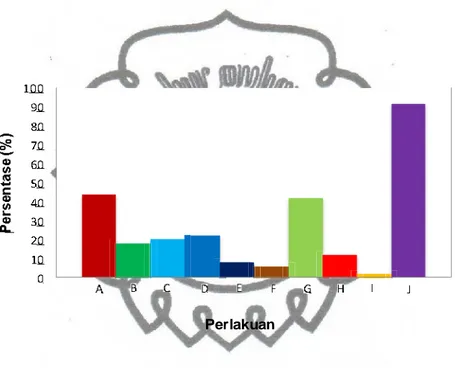
Selama periode waktu 30 hari didapatkan informasi mengenai persentase perkecambahan, pola perkecambahan biji harian, serta persentase biji harian biji kawista. Hasil tersebut disajikan dalam bentuk diagram dan kurva pada Gambar 8, Gambar 9 berikut ini:
Perlakuan
Keterangan
A: Kontrol F: H SO 10%
B: Giberelin 15 ppm G: H SO 20%
C: Giberelin 30 ppm H: Air Panas ± 95 C hingga air mendingin selama 24 jam D: IBA 15 ppm I: Air Panas ± 95 C hingga air mendingin selama 48 jam E: IBA 30 ppm J: Pengikiran
Gambar 8 Diagram persentase perkecambahan biji kawista selama 30 hari pengecambahan setelah mendapatkan perlakuan fisik dan kimia.
Hasil menunjukkan perlakuan pengikiran adalah yang paling efektif meningkatkan persentase perkecambahan biji kawista. Ini sesuai dengan pernyataan Schmidt (2002) dimana skarifikasi manual berupa penggoresan biji pada kertas gosok efektif mengatasi dormansi fisik selama tidak merusak bagian mikropil. Hasil ini ditunjukkan pada Gambar 8 dimana perlakuan pengikiran menghasilkan nilai tertinggi yakni sebesar 92%, kemudian diikuti masing-masing oleh kontrol (44%), perlakuan perendaman dalam asam sulfat 20% selama 24 jam (42%), perlakuan perendaman dalam larutan hormon IBA 15 ppm selama 24 jam (22%), perlakuan perendaman dalam larutan hormon GA330 ppm selama 24 jam (20%), perlakuan perendaman dalam larutan hormon GA315 ppm selama 24 jam (18%), perlakuan perendaman dalam air panas ± 95 C hingga air mendingin selama 24 jam (12%), perlakuan perendaman dalam larutan hormon IBA 30 ppm selama 24 jam (8%), perlakuan perendaman asam sulfat konsentrasi 10% selama 24 jam (6%) dan perlakuan perendaman dalam air panas ± 95 C hingga air mendingin selama 48 jam (0%). Hasil tersebut didukung pula dari hasil analisis varian (ANOVA) (Lampiran 3) di mana perlakuan perendaman dalam air panas ± 95 C hingga air mendingin selama 24 jam, perendaman dalam air panas ± 95 C hingga air mendingin selama 48 jam, perendaman asam sulfat konsentrasi 10% selama 24 jam, perendaman dalam larutan hormon GA315 ppm selama 24 jam, perendaman dalam larutan hormon GA3 30 ppm selama 24 jam, perendaman dalam larutan hormon IBA 15 ppm selama 24 jam, perendaman dalam larutan hormon IBA 30 ppm selama 24 jam dan pengikiran menunjukkan adanya beda
nyata dengan kontrol. Perlakuan yang tidak berbeda nyata dengan kontrol adalah perlakuan perendaman asam sulfat konsentrasi 20% selama 24 jam (Tabel 2).
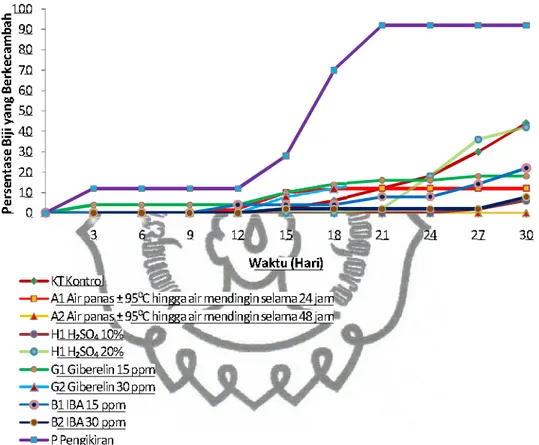
Gambar 9. Kurva persentase perkecambahan harian biji kawista dengan perlakuan fisik dan kimia
Tabel 2. Pengaruh perlakuan fisik dan kimia terhadap persentase perkecambahan biji kawista
Perlakuan Persentase
Perkecambahan (%) Kontrol
Perendaman dalam air panas ± 95 c hingga air mendingin selama 24 jam Perendaman dalam air panas ± 95 c hingga air mendingin selama 48 jam Perendaman asam sulfat konsentrasi 10% selama 24 jam
Perendaman asam sulfat konsentrasi 20% selama 24 jam
Perlakuan perendaman dalam larutan hormon GA315 ppm selama 24 jam Perlakuan perendaman dalam larutan hormon GA330 ppm selama 24 jam Perendaman dalam larutan hormon IBA 15 ppm selama 24 jam
Perendaman dalam larutan hormon IBA 30 ppm selama 24 jam
Pengikiran 44b 12a 0a 6a 42b 18ab 20ab 22ab 8a 92c
Keterangan: Nilai yang diikuti oleh huruf yang sama tidak berbeda nyata pada uji lanjut DMRT dengan taraf 95 %.
Berdasarkan kurva perkecambahan biji kawista Gambar 9, didapatkan informasi bahwa perlakuan pengikiran menyebabkan biji kawista mulai berkecambah pada hari ketiga. Perlakuan perendaman biji dalam larutan hormon GA315 ppm selama 24 jam juga menunjukkan kegiatan perkecambahan pada hari yang sama. Hasil yang berbeda ditunjukkan oleh perlakuan perendaman biji dalam
air panas ± 95 C hingga air mendingin selama 24 jam di mana aktivitas perkecambahan baru terjadi pada hari ke-12. Diikuti dengan perlakuan perendaman biji dalam larutan hormon GA3 30 ppm selama 24 jam, perendaman dalam larutan hormon IBA 15 ppm selama 24 jam dan perendaman dalam larutan hormon IBA 30 ppm selama 24 jam yang berkecambah pada hari ke-13, biji perlakuan kontrol mulai berkecambah pada hari ke-14 dan untuk perlakuan perendaman asam sulfat konsentrasi 10% selama 24 jam dan perendaman asam sulfat konsentrasi 20% selama 24 jam mulai berkecambah pada hari ke-21.
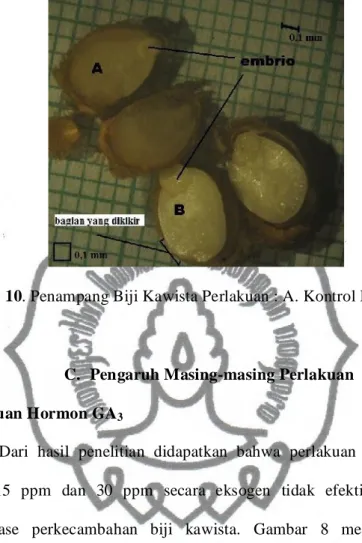
Terjadinya perkecambahan yang tercepat ditunjukkan oleh perlakuan pemakaian dosis hormon GA3 15 ppm dan perlakuan pengikiran yaitu tiga hari sejak pengecambahan, sedangkan kontrol baru menunjukkan terjadinya perkecambahan pada hari ke-14 sejak pengecambahan. Meskipun perlakuan perendaman biji dalam hormon GA3 dosis 15 ppm dan perlakuan pengikiran menunjukkan perkecambahan biji yang terjadi lebih awal dibandingkan dengan perlakuan yang lainnya, tetapi persentase tertinggi hanya ditunjukkan oleh perlakuan pengikiran yakni sebesar 92% perkecambahan, perlakuan dengan hormon giberelin 15 ppm hanya menghasilkan 18% perkecambahan. Hal ini juga dibuktikan dengan pengamatan menggunakan mikroskop stereo bahwa biji yang mendapatkan perlakuan pengikiran menunjukkan pertumbuhan ukuran embrio biji yang lebih besar dari ukuran embrio biji kontrol pada hari pertama setelah penanaman (Gambar 10).
Gambar 10. Penampang Biji Kawista Perlakuan : A. Kontrol B. Pengikiran
C. Pengaruh Masing-masing Perlakuan 1. Perlakuan Hormon GA3
Dari hasil penelitian didapatkan bahwa perlakuan pemberian GA3 dosis 15 ppm dan 30 ppm secara eksogen tidak efektif meningkatkan persentase perkecambahan biji kawista. Gambar 8 menunjukkan nilai persentase perkecambahan yang lebih rendah dibandingkan dengan kontrol. Hal ini menunjukkan bahwa tidak selamanya bisa dikatakan pemberian GA3 eksogen menjadi faktor yang dominan dalam menentukan keberhasilan perkecambahan (Rusmin, 2007 dalam Ilmiyah, 2009). Hasil ini juga sesuai dengan penelitian Al-Menaie et al. (2010) dimana penggunaan GA3 pada konsentrasi tinggi selama 24 jam tidak meningkatkan persentase perkecambahan biji Cassia fistula. Taiz dan Zeiger (1998) menjelaskan hal yang menyebabkan giberelin yang diberikan secara eksogen justru menjadi penghambat karena ada kemungkinan terjadinya penghambatan umpan balik
(feedback control). Secara alami hormon giberelin juga telah diproduksi di dalam biji itu sendiri sebagai hormon endogen. Menurut Yamaguchi (2008) giberelin endogen pada biji disintesis di embrio yang kemudian dipindahkan ke sel-sel aleuron. GA20oksidase merupakan enzim yang mengkatalisis GA12 menjadi giberelin aktif. Saat giberelin secara eksogen ditambahkan pada dosis yang tidak tepat maka dapat terjadi konsentrasi giberelin yang berlebihan. Pemberian giberelin yang berlebihan dapat menyebabkan penurunan transkripsi GA20 oksidase. Apabila transkripsi GA20 oksidase menurun maka akan terjadi pengeblokan biosintesis giberelin. Pengeblokan biosintesis giberelin akan menyebabkan aktivitas giberelin menurun.
Meskipun perlakuan dengan hormon giberelin tidak efektif dalam meningkatkan persentase perkecambahan, akan tetapi perlakuan ini ternyata efektif dalam mendorong terjadinya perkecambahan yang lebih cepat dibandingkan dengan kontrol. Grafik pada Gambar 9 menunjukkan pemberian giberelin berhasil mendorong terjadinya perkecambahan pada hari ketiga sedangkan pada kontrol perkecambahan mulai terjadi pada hari ke-14. Hasil ini sesuai dengan pernyataan Sinay (2011) dimana perlakuan dengan giberelin memberikan pengaruh yang nyata dalam meningkatkan kecepatan berkecambah karena giberelin memacu sintesis enzim hidrolitik untuk penguraian bahan cadangan makanan yang ada di dalam biji. Dengan tersintesisnya enzim-enzim hidrolitik, maka energi yang dibutuhkan untuk pertumbuhan kecambah juga akan cepat dihasilkan, sehingga proses perkecambahan akan berlangsung cepat. Penelitian menggunakan GA3 oleh
Agustin dan Aprilianti (2011) pada biji palem (Verschaffeltia splendida) juga menunjukkan hasil yang sama, yaitu terdapat perbedaan daya perkecambahan yang nyata antara biji yang diberi perlakuan GA3dengan biji tanpa perlakuan dimana penggunaan hormon GA3 yang dibantu dengan perendaman di air suhu ruang selama 24 jam memberikan pengaruh positif terhadap daya kecambah dan kecepatan kecambah biji V. splendida.
Mekanisme kerja pertama dari giberelin adalah menstimulus pembelahan sel dengan cara memacu sel pada fase pertumbuhan sel untuk memasuki fase sintesis. Dengan demikian terjadi peningkatan jumlah sel, yang berkaitan pertumbuhan yang lebih cepat. Apabila mekanisme kerja giberelin dikaitkan dalam proses perkecambahan, dapat dikatakan bahwa percepatan fase-fase dalam pembelahan sel akan mempercepat pembelahan sel, dan selanjutnya berakibat mempercepat perkecambahan (Salisbury & Ross, 1995).
Mekanisme kerja kedua adalah giberelin mampu memacu pertumbuhan sel, karena senyawa tersebut meningkatkan hidrolisis pati, fruktan dan sukrosa menjadi molekul glukosa dan fruktosa (Salisbury dan Ross, 1995). Wattimena (1998) menambahkan peningkatan hidrolisis pati dapat terjadi, karena giberelin mendorong sintesis enzim-enzim hidrolitik seperti - -glukogenase, protease, dan lain-lain. -amilase berperan merombak amilosa dan amilopektin menjadi dekstrin. -amilase berperan merombak dekstrin menjadi glukosa. Enzim glukoneogenik berperan mempercepat konversi dari asam lemak dan gliserol
menjadi glukosa. Enzim proteolitik berperan merombak protein menjadi asam amino. Hasil hidrolisis terutama gula heksosa merupakan penyedia energi melalui respirasi, yang sangat dibutuhkan oleh embrio biji untuk proses pertumbuhannya. Gula heksosa sebagai energi untuk pembentukan sel serta membuat potensial sel lebih negatif pada saat-saat tertentu. Akibat penurunan potensial air, air akan bergerak masuk lebih cepat dan menyebabkan pembesaran sel (Salisbury dan Ross, 1995).
Mekanisme kerja berikutnya dari giberelin adalah meningkatkan plastisitas dinding sel, sehingga dinding sel dapat dikendurkan oleh giberelin melalui peningkatan kecepatan sintesis hidrolase yang mencerna polisakarida dinding sel (Davies, 1995). Menurut Bratt dan Hillman (1985) auksin dan giberelin saling bersinergi dalam pembentangan dinding sel. Dalam Champbell et al. (2002) disebutkan bahwa mekanisme pemanjangan dinding sel oleh hormon auksin terjadi melalui adanya peningkatan aktivitas tekanan proton yang terjadi pada membran plasma. Adanya peningkatan tekanan proton tersebut mengakibatkan pH dinding sel di sekitar membran plasma menjadi asam. Kondisi pH yang asam mengaktifkan enzim dinding sel yang disebut ekspansin untuk memutus ikatan hidrogen antara mikrofibril selulosa, sehingga menyebabkan struktur lapisan dinding sel melonggar dan terjadi pemanjangan sel. Seperti halnya auksin, giberelin menyebabkan pula pelonggaran dinding sel, akan tetapi tidak mengasamkan dinding sel melainkan giberelin menstimulasi aktivitas enzim yang berperan dalam pembentangan dinding sel dan memfasilitasi penetrasi enzim ekspansin ke
dalam dinding sel. Di dalam batang yang sedang tumbuh, auksin berperan mengasamkan dinding sel dan mengaktifkan ekspansin; sedangkan giberelin memfasilitasi penetrasi ekspansin ke dalam dinding sel untuk bekerja sama dalam meningkatkan pemanjangan sel. Hal ini menyebabkan perluasan pada dinding sel.
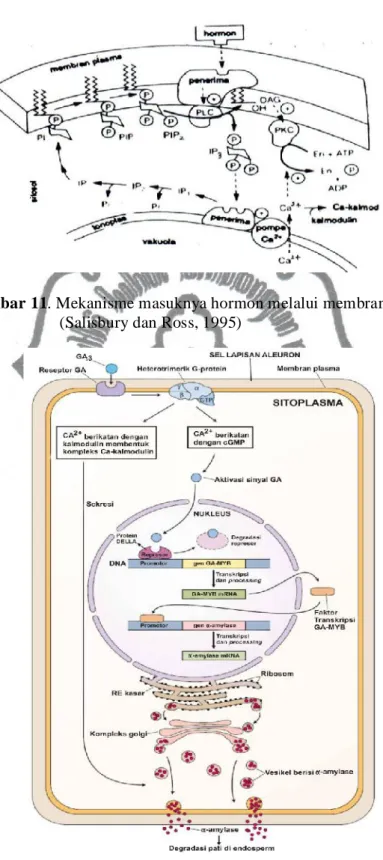
Proses awal hormon giberelin masuk ke dalam sel aleuron melalui membran plasma yang kemudian akan ditangkap oleh protein reseptor. Pengikatan hormon pada protein reseptor akan mengaktifan enzim fosfolipase c (PLC). PLC akan menghidrolisis lipid fosfatidilinositol-4,5-bisfosfat (PIP2) yang kemudian menghasilkan inositol-1,4,5-trifosfat (IP3) dan diasilgliserol (DAG). Inositol -1,4,5-trifosfat (IP3) bergerak menuju vakuola yang kemudian menyebabkan Ca2+ di sitosol dapat mengaktifkan beberapa enzim tertentu. DAG yang tetap terikat pada membran berfungsi mengaktifkan enzim protein kinase c (PKC). Peningkatan Ca2+ juga akan mengaktivasi enzim lain termasuk PKC. Enzim PKC ini menggunakan ATP untuk memfosforilasi beberapa enzim tertentu yang mengatur tahap-tahap metabolisme Empat buah ion Ca2+ berikatan dengan kalmodulin membentuk kompleks Ca-kalmodulin yang akan mengaktifkan beberapa enzim kinase seperti NAD+ kinase (memfosforilasi NAD+ menjadi NADP+) dan ATPase (Gambar 11) (Salisbury dan Ross, 2005).
Gambar 11. Mekanisme masuknya hormon melalui membran plasma (Salisbury dan Ross, 1995)
Gambar 12. Mekanisme masuknya hormon melalui membran plasma dan inti sel (Jones et al., 1998 dalam Astuti, 2012)
Reseptor pada membran plasma kemudian akan mentranslokasikan hormon menuju nukleus. Pada saat IP3 menuju vakuola terjadi dua pembagian ikatan Ca2+ yakni di mana terdapat Ca2+ yang berikatan dengan kalmodulin membentuk kompleks Ca-kalmodulin dan terdapat Ca2+ yang berikatan dengan cGMP. Ca2+ yang mengikat cGMP dapat mengaktifkan sinyal GA. Sinyal GA yang aktif kemudian ditranslokasikan ke nukleus dan berikatan dengan protein DELLA (Astuti, 2012).
-amilase berkaitan erat dengan kegiatan ekspresi gen yang bertanggung jawab dalam pembentukan enzim itu
sendiri. -amilase adalah
gen GA-MYB (Gocal et al., 2001). Kegiatan ekspresi gen memerlukan dua proses yakni transkripsi dan translasi. Pada proses transkripsi, komponen utama yang terlibat adalah gen yang akan diekspresikan yakni gen GA-MYB. Komponen gen GA-MYB terdiri dari tiga bagian utama yakni promoter, bagian struktural (bagian yang mengandung urutan DNA spesifik yang akan ditranskripsi), dan terminator (bagian yang berperan dalam pengakhiran proses transkripsi). Dalam kegiatan ekspresi gen dikenal dua sistem pengendalian ekspresi yakni pengendalian positif dan negatif (Lehninger, 2004).
Pengendalian ekspresi gen GA-MYB yang terjadi pada pembentukan -amilase adalah pengendalian negatif, dimana promoter menjadi tidak aktif (tidak dapat melakukan transkripsi) karena ditempeli oleh represor yakni protein DELLA. Promoter dapat diaktifkan kembali dengan adanya molekul
efektor dalam sel yang disebut induser yakni sinyal GA aktif. Induser ini kemudian akan berikatan dengan represor dan mengubah struktur (sisi allosterik) dari represor, sehingga mengubah secara allosterik konformasi molekul repressor, kemudian represor tidak dapat menempel lagi pada promoter (terdegradasi) dan represor tidak mampu menghambat trankripsi. Setelah repressor yang berupa protein DELLA terdegradasi maka proses transkripsi gen GA-MYB dapat berlangsung kembali. Gen GA-MYB ditranskripsi dan diubah menjadi protein MYB mRNA. Sintesis protein MYB mRNA kemudian akan masuk ke nukleus dan kemudian mentranskripsi -amilase menjadi enzim -amilase. -amilase dan enzim hidrolitik lainnya kemudian keluar dari nukleus dan ditransportkan menuju sitoplasma untuk ditranslasi di retikulum endoplasma kasar. Enzim-enzim hidrolitik tersebut diterjemahkan menjadi urutan asam amino dan berbagai jenis enzim lainnya. Enzim-enzim hidrolitik tersebut kemudian berdifusi ke dalam endosperm dan mengubah molekul makro yang terdapat di dalam endosperm menjadi molekul mikro yang diperlukan dalam pertumbuhan biji embrio (Gambar 12) (Jones et al., 1998; Gubler et al., 1994).
Menurut Trenggono (1990) adanya pengaktifan giberelin dalam perkecambahan akan menyebabkan hormon sitokinin menjadi aktif. Giberelin juga diketahui mendukung dalam pembentukan enzim proteolitik yang akan membebaskan triptophan sebagai prekursor IAA yang memacu pemanjangan sel. Hal ini menunjukkan bahwa dalam proses perkembangan dan
pertumbuhan perkecambahan tidak hanya dipengaruhi oleh hormon giberelin saja namun juga terdapat keterlibatan hormon-hormon lain seperti auksin dan sitokinin.
2. Perlakuan Hormon IBA
Perlakuan dengan hormon IBA hanya menghasilkan persentase perkecambahan 22% (perendaman dalam larutan hormon IBA 15 ppm selama 24 jam) dan 8% (perendaman dalam larutan hormon IBA 30 ppm selama 24 jam). Hasil ini lebih kecil dibandingkan dengan kontrol yang berkecambah sebesar 44%. Perlakuan menggunakan hormon IBA lebih efektif dalam mendorong terjadinya perkecambahan lebih awal dibandingkan dengan kontrol yang ditunjukkan dengan memacu perkecambahan pada hari ke-12.
Menurut Kusumo (1984) hormon IBA termasuk dalam kelompok auksin. Wudianto (1993) mengemukakan bahwa IBA paling cocok untuk merangsang aktifitas perakaran, karena kandungan kimianya lebih stabil dan daya kerjanya lebih lama. Selain dipakai untuk merangsang perakaran, hormon IBA juga mempunyai manfaat yang lain yakni seperti menambah daya kecambah, namun pernyataan ini tidak sesuai dengan kondisi yang terjadi pada perkecambahan biji kawista dimana penggunaan hormon IBA menghambat perkecambahan yang ditunjukkan dengan nilai persentase perkecambahan yang lebih rendah dibandingkan dengan kontrol.
Penghambatan ini terjadi mungkin dikarenakan dengan adanya penambahan auksin secara eksogen menyebabkan perubahan keseimbangan
komposisi hormon endogen dalam biji kawista. Auksin merupakan hormon yang meningkatkan pertumbuhan, sedangkan hormon yang menghambat pertumbuhan adalah asam absisat (ABA) dan etilen. Pada saat biji berhasil mengimbibisi air bisa terjadi kemungkinan bahwa giberelin telah teraktifkan, kehadiran giberelin dapat membentuk auksin karena giberelin mendukung enzim proteolitik yang menghasilkan triptophan sebagai asal bentuk dari auksin. Auksin eksogen yang ditambahkan pada penelitian ini kemungkinan mengalami kompetisi dengan hormon penghambat pertumbuhan (ABA dan etilen), sehingga dosis pemberian hormon eksogen yang tidak tepat justru dapat menghambat pertumbuhan.
3. Perlakuan Pengikiran
Dari hasil penelitian didapatkan bahwa pengikiran efektif meningkatkan persentase perkecambahan biji kawista. Gambar 8 menunjukkan perlakuan ini menghasilkan nilai persentase perkecambahan yang lebih tinggi dibanding kontrol. Gambar 13 menunjukkan bahwa biji kawista mempunyai kulit biji yang sangat keras dan terselubungi oleh rambut-rambut biji yang cukup padat sehingga memungkinkan biji impermeabel terhadap air dan oksigen. Dengan adanya perlakuan pengikiran kulit biji oksigen dan air lebih mudah masuk ke dalam embrio sehingga proses perkecambahan segera terjadi (Dennis, 1995 dalam Rofik dan Murniati, 2008). Selain itu teknik pengikiran ini diduga dapat mempercepat
proses penyerapan air oleh embrio untuk mengaktifkan enzim-enzim dalam proses perkecambahan.
Hasil penelitian ini juga sesuai dengan penelitian Rofik dan Murniati (2008) yang menyebutkan bahwa perlakuan skarifikasi biji merupakan teknologi sederhana yang sangat efektif dalam mematahkan masalah dormansi pada biji aren dengan meningkatkan nilai potensi tumbuh maksimum sebesar 96,9%. Perlakuan skarifikasi pada biji Rauvolfia serpentine menggunakan kertas amplas efektif dalam meningkatkan perkecambahan (Paul et al., 2008). Skarifikasi menggunakan kertas amplas juga efektif mematahkan dormansi dan meningkatkan perkecambahan biji Citrullus colocynthis (Saberi dan Shahriari, 2011). Perkecambahan biji Cassia nodosa yang mendapat perlakuan fisik berupa skarifikasi lebih bagus dibanding biji tanpa perlakuan fisik (Al-Menaie et al., 2010). Hasil penelitian dari Mistian et al. (2012) juga menunjukkan perlakuan pengikiran pada biji secara nyata meningkatkan laju perkecambahan biji pinang (Areca catechu L.) hingga 64% dibandingkan dengan biji tanpa perlakuan skarifikasi. Hal ini juga sesuai dengan keberhasilan penelitian Saleh et al. (2008) dimana skarifikasi memberikan pengaruh yang nyata terhadap kecepatan berkecambah dan persentase perkecambahan disebabkan ada unsur pelukaan yang dapat mempermudah penyerapan air.
Gambar 13. Penampang mikroskopis biji kawista 4. Perlakuan Perendaman Air Panas
Perlakuan perendaman biji dalam air panas hingga air mendingin yang dilakukan selama 24 jam tidak efektif dalam meningkatkan persentase perkecambahan karena hanya menghasilkan 12% perkecambahan, hasil ini lebih rendah daripada kontrol. Akan tetapi, perlakuan ini lebih efektif mendorong perkecambahan terjadi lebih cepat dibandingkan dengan kontrol. Gambar 9 menunjukkan bahwa biji membutuhkan waktu hingga hari ke-12 untuk memulai terjadi perkecambahan, hasil ini lebih cepat dibandingkan dengan kontrol. Hasil ini sesuai dengan dengan pernyataan Charomaini dan Kusumatuti (2005) di mana air panas akan memperlunak kulit biji sehingga memudahkan terjadinya imbibisi, mempercepat proses metabolisme dan mengaktifkan kerja enzim untuk melangsungkan proses perkecambahan.
(a) Kontrol (b) Air panas (+ 95oC) hingga air mendingin selama 48 jam Gambar 14. Perbandingan Perkembangan Embrio Biji Kontrol dengan
Perlakuan Air Panas (+ 95oC) Hingga Air Mendingin Selama 48 jam
Hasil yang berbeda ditunjukkan oleh perlakuan perendaman dengan air panas (+ 95oC) hingga air mendingin yang dilakukan selama 48 jam, di mana perlakuan tersebut tidak memberikan pengaruh terhadap biji kawista karena tidak menghasilkan persentase perkecambahan (0%). Hasil ini diperkuat dengan pengamatan menggunakan mikroskop stereo (Gambar 14) yang menunjukkan kondisi embrio biji dengan perlakuan tersebut tidak mengalami perkembangan atau dapat dikatakan kondisi embrionya hampir sama dengan kondisi embrio biji kontrol. Hal tersebut mungkin disebabkan karena biji terlalu lama direndam dalam air sehingga menciptakan lingkungan yang anaerob dan menyebabkan biji terhambat perkecambahannya. Pernyataan ini juga didukung oleh penelitan Astuti (2012) bahwa perendaman biji yang terlalu lama pada Casia siamea menyebabkan biji anaerob sehingga biji menjadi busuk dan tidak mampu berkecambah. Perlakuan perendaman dalam air panas oleh Paul et al. (2008) juga
menunjukkan hasil yang tidak efektif dalam meningkatkan persentase perkecambahan biji Rauvolfia serpentine.
Menurut Schmidt (2000) dalam Charomaini dan Windiasih (2005) perendaman yang terlalu lama akan menurunkan daya kecambah karena biji yang siap berkecambah membutuhkan oksigen lebih banyak untuk respirasi. Dikarenakan biji direndam terlalu lama dalam air menyebabkan perkecambahan terhambat dan bahkan embrio akan mati. Kelebihan air membuat kondisi aerasi buruk yang menyebabkan kerusakan pada jaringan biji. Selain itu menurut pernyataan Sinay (2011) bahwa temperatur tinggi umumnya mempengaruhi kerja enzim yang berfungsi dalam metabolisme perkecambahan biji. Menurut Wilbraham dan Matta (1992) dalam Sinay (2011) kisaran temperatur optimum untuk aktivitas enzim adalah 0 20oC sehingga jika temperatur berada di atas optimum enzim akan terdenaturasi yang menyebabkan penurunan aktivitas enzim. Cavanagh (1987) juga menegaskan bahwa efektivitas penggunaan air panas untuk memecahkan dormansi biji berkulit keras tidaklah sama untuk semua spesies tanaman. Perbedaan ketebalan, struktur anatomi dan morfologi kulit biji serta kualitas biji merupakan faktor yang menyebabkan adanya variasi.
5. Perlakuan Asam Sulfat (H2SO4)
Perlakuan perendaman biji kawista di dalam asam sulfat tidak efektif meningkatkan persentase perkecambahan. Hasil menunjukkan perlakuan asam sulfat konsentrasi 20% nilai persentase perkecambahan yang lebih
rendah dari kontrol dimana biji dengan perlakuan ini adalah 40% sedangkan kontrol 44%. Pada perlakuan perendaman dalam asam sulfat konsentrasi 10% menghasilkan persentase perkecambahan sebesar 6%.
Dari hasil yang didapatkan asam sulfat dengan konsentrasi yang lebih tinggi mampu melunakkan kulit biji sehingga mempermudah proses imbibisi, namun persentase perkecambahan yang didapatkan belum bisa melebihi kontrol. Ada kemungkinan jika konsentrasi dinaikkan sedikit lagi, presentase perkecambahan yang didapatkan dapat lebih besar dibandingkan sebelumnya. Konsentrasi 20% merupakan konsentrasi yang belum terlalu pekat, masih bersifat melunakkan kulit biji dan tidak terserap sampai ke embrio sehingga tidak sampai merusak embrio. Tetapi apabila perlakuan asam sulfat sampai pada embrio biji, maka embrio tidak akan mengalami pertumbuhan sehingga tidak sampai terjadi perkecambahan. Hasil tersebut sesuai dengan Salisbury dan Ross (1995) yang menyatakan bahwa perendaman biji dalam asam sulfat menyebabkan kulit biji menjadi lunak dan senyawa-senyawa inhibitor perkecambahan seperti fluoride dan kumarin larut dalam senyawa tersebut selama proses perendaman. Begitu pula dengan penelitian oleh Al-Menaie et al. (2010) dimana perlakuan perendaman dalam asam sulfat berhasil meningkatkan persentase perkecambahan biji Cassia fistula sebesar 83% dan Cassia nodosa (77%). Dormansi fisik pada biji Cercis siliquastrum (Leguminosae) juga efektif diatasi dengan perlakuan menggunakan asam sulfat (Pipinis et al., 2011).
Sadjad et al. (1975) diacu dalam Lensari (2009) menyatakan bahwa perlakuan menggunakan asam kuat dapat membebaskan koloid yang sifatnya hidrofil sehingga terjadi peningkatan imbibisi dan metabolisme biji. Prinsip dalam perlakuan tersebut adalah membuang lapisan lignin pada kulit biji yang keras dan tebal sehingga biji kehilangan lapisan yang permiabel terhadap gas dan air sehingga metabolisme dapat berjalan dengan baik. Berdasarkan Wareing dan Philips (1989) pelunakan kulit biji oleh senyawa asam terjadi melalui mekanisme sebagai berikut : dinding sel tersusun atas mikrofibril selulosa yang terikat pada matriks nonselulosik polisakarida. Mikrofibril selulosa terdiri dari protein, pektin dan polisakarida. Pektin dapat berubah menjadi Ca pektat melalui reaksi esterisasi dengan menambahkan Ca2+. Perlakuan asam sulfat dalam hal ini adalah merubah posisi ion Ca2+dari subtansi pektin, dikarenakan asam sulfat melepaskan hidrogen pada mikrofibril selulosa. Pengikatan komponen matrik satu dengan komponen matrik yang lain melalui ikatan hidrogen. Salah satu komponen matrik yaitu xiloglukan yang terikat dengan serat mikrofibril selulosa dengan membentuk ikatan hidrogen. Ikatan hidrogen ini mudah lepas dengan adanya asam sulfat sehingga terjadi perubahan komponen dinding sel kemudian dinding sel melonggar, turgor menjadi berkurang dan kulit biji menjadi lunak.
Rendahnya persentase perkecambahan dan kecepatan tumbuh pada biji kawista dapat disebabkan oleh beberapa hal berikut ini :
1. Ada kemungkinan biji kawista telah mengalami deteriorasi lanjut atau mati. Berdasarkan pernyataan Saenong et al. (1989) biji yang mengalami
deteriorasi lanjut dicirikan dengan kondisi dimana biji mengalami perubahan volume selama proses perkecambahan, akan tetapi setelah periode perkecambahan berakhir biji tetap tidak tumbuh meskipun biji telah mengalami imbibisi. Gejala ini ditandai dengan volume biji yang berubah, biji lunak saat dipegang dan terkadang ditumbuhi jamur.
2. Biji yang belum masak fisiologis (immature) dimana pada kondisi tersebut diduga berkaitan erat dengan pertumbuhan buah. Setelah terjadi pembuhan (fertilisasi) embrio akan terus berkembang. Bersamaan dengan itu juga akan terjadi pertumbuhan buah. Pada saat tersebut proses respirasi terus meningkat hingga mencapai tingkatan yang optimum yaitu pada saat buah telah mencapai masak fisiologis, setelah itu aktivitas respirasi akan menurun kembali. Hal inilah yang dapat menyebabkan rendahnya viabilitas pada biji-biji yang belum masak karena adanya peningkatan respirasi selama proses pertumbuhan buah yang tidak ditunjang oleh kecukupan cadangan makanan dan belum sempurnanya embrio (Kramar dan Koziowski, 1960 dalam Handayani, 2001). Hal tersebut juga diperkuat dengan pernyataan dari Baskin dan Baskin (1998) dalam Bowers et al. (2010) bahwa umumnya famili Rutaceae mengalami dormansi biji yang menghambat perkecambahannya yakni dormansi fisiologis dimana keadaan ini menunjukkan kondisi pertumbuhan embrio yang lambat. Pertumbuhan embrio yang belum berkembang menyebabkan biji tidak akan dapat berkecambah pada kondisi perkecambahan normal (Schmidth, 2002).
3. Selain kondisi embrio menurut Mugnisjah dan Setiawan (1990) menambahkan bahwa respirasi juga berperan penting pada kehidupan suatu makhluk hidup, salah satunya adalah pada proses terjadinya perkecambahan. Dalam proses respirasi dihasilkan energi bebas dalam bentuk ATP dan NADH yang sangat berguna dalam proses sintesis sel seperti asam amino, protein, lemak dan lain-lain. Kemampuan biji untuk berkecambah tergantung dari tersedianya energi dan senyawa-senyawa tersebut untuk sintesis sel-sel penyusun organ kecambah. Semakin tinggi ketersediaan senyawa tersebut, maka semakin tinggi pula kemampuan biji untuk berkecambah, dengan demikian biji tersebut memiliki kemampuan perkecambahan tinggi. Biji kawista yang berukuran kecil dan memiliki endospermae yang sedikit dapat dijadikan sebagai salah satu penyebab lambatnya perkecambahan biji tersebut.
4. Pendapat lain dari Bewley dan Black (1986) bahwa perkecambahan biji juga dipengaruhi oleh kulit biji. Kulit biji yang permeabel terhadap oksigen dan air memiliki dampak terhadap daya kecambah biji. Berdasarkan Jones (1992) kulit biji kawista tebal dan berambut. Kondisi tersebut yang memungkinkan kulit biji kawista menjadi impermeabel sehingga menghambat imbibisi sebagai awal pendorong terjadinya perkecambahan.