PENGARUH BASA TERHADAP PENURUNAN LIGNIN DAN
KONSENTRASI HCl PADA HIDROLISA SABUT KELAPA UNTUK
MEMPRODUKSI BIOETANOL
Faisol Asip*, Yoga Permana Wibowo, Reza Trisna Wahyudi
*)
Jurusan Teknik Kimia Fakultas Teknik Universitas Sriwijaya Jl. Raya Indralaya – Prabumulih KM. 32 Indralaya Ogan Ilir (OI) 30662
Email: faisol_asip@yahoo.com
Abstrak
Kebutuhan enargi pada saat ini terus mengalami peningkatan, sedangkan cadangan fosil terus mengalami penurunan seiring dengan penggunaannya. Tingginya penggunaan energi ini mendorong untuk dikembangkannya energi alternatif seperti biomassa salah satunya yaitu bioetanol. Bahan baku dalam pembuatan bioetanol yaitu biomassa yang mengandung selulosa, hemiselulosa dan lignin salah satunya adalah sabut kelapa. Sabut kelapa adalah limbah dari buah kelapa yang bisa menyebabkan pencemaran lingkungan dan aroma tidak sedap pada lingkungan jika tidak dimanfaatkan. Sabut kelapa memiliki kandungan selulosa yang cukup tinggi untuk diolah menjadi energi alternatif bioetanol. Penelitian ini bertujuan untuk memanfaatkan limbah sabut kelapa menjadi bioetanol melalui proses Alkaline pretreatment menggunakan NaOH dan NH4OH dengan konsentrasi 1%M, 3%M, dan 5%M, kemudian
dilanjutkan dengan proses hidrolisa asam menggunakan HCl 2%M, 4%M, dan 6%M. Glukosa yang dihasilkan dari proses hidrolisa kemudian difermentasi selama 7 hari dengan penambahan Saccaromyces cerevisiae 1% (w/v) dari volume yang difermentasi. Hasil penelitian menunjukkan kadar bioetanol tertinggi sebesar 5,3053% dihasilkan dari perlakuan pretreatment NaOH 5%M dengan hirolisa HCl 6%M saat hidrolisa.
Kata Kunci :Alkaline Pretreatment,Bioetanol, Fermentasi, Hidrolisa,Sabut Kelapa
Abstract
Energy consumptionat this time are continuously increase, while fossil energy reserve are decrease according to its consumption. The high of energy consumption are encourage to develop an alternative energy like a biomass, one of them is bioethanol. The raw materials to produce bioethanol is biomasscontaining cellulose, hemicellulose and lignin such as coconut fiber. Coconut fiber is a waste of coconut that cause pollution and unpleasant odor on the environment if not treated. Coconut fiber contains cellulose that high enough to be processed into alternative energy bioethanol. This study aims to utilize waste coconut fiber into bioethanol through process alkaline pretreatment using NaOH and NH4OH at 1%M, 3%M, and 5%M concentration and then proceed using acid hydrolysis at 2%M, 4%M,
and 6%M concentration. Glucose that produced from the hydrolysis process are fermented for 7 days with addition of 1% (w/v) yeast Saccharomyces cerevisiae of the fermented volume. The results showed that the highest level of bioethanol is 5,3053% that produced from pretreatment NaOH 5%Mand hydrolysis 6%M HCl.
Keywords :acid hydrolysis,alkaline pretreatment , bioethanol,Coconut fiber, fermentation
1. PENDAHULUAN
Pertumbuhan perekonomian dan indsutri serta pertumbuhan populasi di Indonesia yang semakin pesat menyebabkan tingginya tingkat kebutuhan energi, termasuk konsumsi bahan bakar fosil. Pada kenyataannya bahan bakar fosil yang dikonsumsi saat ini akan semakin kecil ketersediaanya dan tidak dapat diperbaharui sehingga diprediksikan akan langka dalam beberapa tahun yang akan datang. Sehingga bahan bakar alternatif diharapkan bisa menyelesaikan masalah kurangnya sumber energi saat ini. Salah satu bentuk dari energi
terbarukan yaitu pemanfaatan sumber biologi baik dari hewan maupun tumbuhan yang disebut biomassa. Salah satu contoh biomassa adalah bioetanol.
daging buahnya saja, sementara sabutnya biasanya tidak terpakai atau menjadi limbah. Hal ini menyebabkan ketersediaan sabut kelapa yang sangat melimpah dan dapat berpotensi untuk dijadikan bahan baku bioetanol.
Sabut Kelapa
Sabut kelapa adalah salah satu limbah perkebunan yang memiliki potensi besar untuk dimanfaatkan di Indonesia. Menurut data dari Direktorat Jenderal Perkebunan BPS Republik Indonesia tahun 2014, luas area perkebunan kelapa di Sumatera Selatan sekitar 118, 46 Ha dengan hasilnya sekitar 114, 35 ton. Dengan potensi sebesar itu maka dapat diperkirakan bahwa sabut kelapa sebagai salah satu komoditi yang memiliki potensi sebagai bahan baku pembuatan bioetanol yang cukup menjanjikan di masa yang akan datang..Sabut kelapa mempunyai komposisi kimia seperti yang ditunjukkan pada tabel 1.
Tabel 1. Komposisi Kimia Sabut Kelapa
Senyawa Persentase (%w/v)
Selulosa 43,44
Hemiselulosa 19,9
Lignin 45,84
Air 5,25
Abu 2,22
Sumber : Sukadarti,dkk,(2010)
Menurut Fatmawati dan Agustriyanto (2014), komponen utama sabut kelapa adalah lignin (45,4%), selulosa (43,44%), pektin (3%), hemiselulosa (0,25%) dan abu (2,22%) dari berat sabut kelapa, dimana secara alami senyawa selulosa, hemiselulosa, lignin dan pektin dapat mengalami penguraian dalam waktu yang relatif lama oleh mikroba.
Lignoselulosa
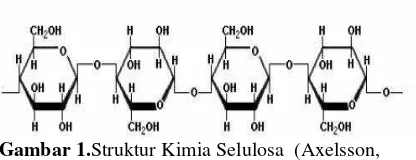
Lignoselulosa merupakan bahan penyusun tanaman yang mengandung tiga komponen utama yaitu selulosa, hemiselulosa, dan lignin (Wiratmaja, dkk, 2011). Bagian terbesar penyusun lignoselulosa yaitu selulosa sekitar 30-60% dari total massa (Axelsson, 2011). Selulosa adalah polisakarida generasi kedua dari glukosa sebagai struktur yang berserat. Sifat fisik selulosa adalah tidak larut dalam eter dan alkohol, padat, berwarna putih, dan kuat. Monomer selulosa atau yang disebut glukosa merupakan hasil hidrolisis sempurna dari selulosa (Ningrum, 2015).
Gambar 1.Struktur Kimia Selulosa (Axelsson, 2011)
Komponen kedua dari lingnoselulosa adalah hemiselulosa, sekitar 25-30% dari total massa kering.Hemiselulosa berfungsi sebagai bahan pendukung dalam dinding sel dan berlaku sebagai perekat antara sel tunggal yang terdapat didalam batang pisang dan tanaman lainnya. Perbedaan hemiselulosa dengan selulosa yaitu hemiselulosa mudah larut dalam alkali tapi sukar larut dalam asam, sedangkan selulosa adalah sebaliknya(Ningrum, 2015).
Salah satu zat komponen penyusun tumbuhan dikenal dengan lignin. Komposisi pada lignin ini berbeda-beda tergantung jenisnya. Lignin menunjang struktur dinding sel tumbuhan, sekitar 15-30% total massa kering (Axelsson, 2011).Lignin berfungsi untuk mengikat sel-sel tanaman satu dengan lainnya, sehingga dinding sel menjadi keras, teguh, dan kaku. Konversi lignoselulosa yang terdapat pada tumbuhan menjadi bioetanol terhalang oleh kandungan lignin tersebut. Lignin melingungi selulosa, maka pretreatment perlu dilakukan untuk menghilangkan lignin tersebut sehingga selulosa menjadi lebih mudah untuk dihidrolisa tanpa banyak kehilangan polisakaridanya (Gunam, dkk, 2011).
Bioetanol
Bioetanol adalah bioetanol yang berasal dari makhluk hidup, dalam hal ini adalah bahan nabati. Bioetanol adalah bahan bakar alternatif yang diolah sumber biologi yaitu tumbuhan, dimana memiliki keunggulan mampu menurunkan emisi CO2 hingga
18%(Fatmawati dan Agustriyanto, 2015). Bioetanol dibuat melalui proses hidrolisis dan fermentasi. Bioetanol dapat dihasilkan dari gula sederhana, pati, dan selulosa. Bioetanol merupakan zat cair, berbau khas, tidak berwarna, mudah menguap dan terbakar serta dapat bercampur dalam air.
Proses Lignoselulosik Bioetanol a) Pretreatment
meningkatkan pembentukan gula atau kemampuan untuk selanjutnya membentuk gula dengan hidrolisa enzimatik; (2) mencegah degradasi atau hilangnya karbohidrat; (3) mencegah pembentukan produk samping yang menghambat proses hidrolisis dan fermentasi; (4) biaya efektif (SunCheng, 2002).
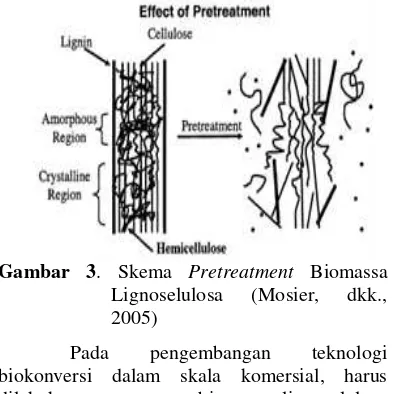
Gambar 3. Skema Pretreatment Biomassa
Lignoselulosa (Mosier, dkk., 2005)
Pada pengembangan teknologi biokonversi dalam skala komersial, harus dilakukan pretreatment biomassa lignoselulosa untuk mendapatkan hasil yang tinggi. Proses
pretreatment atau perlakuan awal disini sangat penting untuk mempermudah pemecahan atau pengubahan pati dan selulosa menjadi glukosa.
b) Hidrolisa
Hidrolisis adalah proses perubahan atau pemecahan molekul selulosa, hemiselulosa ataupun karbohidrat menjadi gula sederhana (glukosa). Terdapat beberapa metode yang digunakan untuk hidrolisis lignoselulosa yaitu hidrolisis kimia, hidrolisis enzimatik, dan hidrolisis yang menggunakan sinar gamma atau radiasi elektron atau radiasi gelombang mikro.
Pada kondisi reaksi normal asam konsentrasi rendah (encer) dapat lebih mudah menghidrolisis selulusa dan hemiselulosa, akan tetapi diperlukan kondisi ekstrim untuk menghidrolisa selulosa. Hidrolisa dengan asam encer tidak memerlukan recovery asam dan asam tidak akan menghilang selama proses. Asam yang digunakan biasanya memiliki konsentrasi sekitar 2-5% dan dengan suhu reaksi sekitar 160°C(Mussato dan Roberto, 2003). Dengan suhu yang tinggi, dekomposisi gula akan lebih mudah terjadi.
c) Fermentasi
Fermentasi mikroorganisme dilakukan untuk mengubah monomer gula menjadi bioetanol. Organisme yang digunakan dapat berupa bakteri, yeast dan fungi. Fermentasi
alkohol merupakan proses terjadi karena adanya aktifitas suatu jenis mikroba yang disebut khamir. Kuantitas dan kualitas alkohol ditentukan oleh besar kecilnya aktifitasi hidup mikroba. Sehingga kondisi atau lingkungan hidup mikroba termasuk nutrisinya harus dijaga dengan baik sesuai kebutuhan mikroba
Beberapa faktor memengaruhi proses fermentasi, antara lain; pemilihan mikroorganisme, bahan baku, metode
pretreatment, metode hidrolisa, dan faktor lingkungan atau kondisi operasi seperti pH, temperatur, substrat, dan konsentrasi bioetanol. Kandungan hidrolisat dan gula menjadi inhibitor yang membatasi fermentasi mikroorganisme sehingga menurunkan yield bioetanol (Axelsson, 2011).
d) Pemurnian Bioetanol
Setelah fermentasi, proses selanjutnya adalah pemurnian bioethanol menggunakan alat evaporator. Proses ini dilakukan untuk memisahkan bioetanol dari air dan massa sel. Pada prinsipnya, evaporasi dilakukan dengan pemanasan yang bertujuan untuk memekatkan suatu lautan yang terdiri dari zat terlarut yang memiliki titik didih yang tinggi dengan pelarut yang memiliki titik didih yang rendah sehingga pelarut yang memiliki titik didih rendah akan menguap dan hanya akan menyisakan larutan yang lebih pekat dan memiliki konsentrasi yang tinggi.
2. METODOLOGI PENELITIAN
Penelitian ini bertujuan untuk memanfaatkan libah sabut kelapa menjadi energi alternatif biomassa yaitu bioetanol. Proses penelitian ini merujuk pada metode yang digunakan Deviyanti, dkk,(2014). Tahapan penelitian terdiri dari dari persiapan bahan baku, alkali pretreatment menggunakan NaOH dan NH4OH, Hidrolisa asam encer menggunakan
HCl, fermentasi menggunakan Saccaromyces cerevisiae dan kemudian pemurnian bioetanol menggunakan evaporator.
Alat dan Bahan Penelitian a) Alat
Alat yang digunakan pada penelitian ini adalah Beaker Gelas 50, 100, 250, 500 mLErlenmeyer 250 mL, 500, 1000 mL, gelas ukur 10 mL, 50 mL, spatula, pH Universal,
b) Bahan
Bahan yang digunakan pada penelitian ini adalah sabut kelapa, NH4OH (1%M, 3%M,
5%M), NaOH (1%M, 3%M, 5%M), HCl (2%M, 4%M, 5%M), yeast Saccaromyces cerevisiae, C2H5OH, H2SO4 (1N, 3%, dan 72% v/v), larutan
amilum1%, Na2CO3, aquadest, larutan luff
schoorl, Na2S2O3 0,1 N, KI 20%. Prosedur Penelitian
Persiapan Bahan Baku
Sabut kelapa diperoleh dari rumah pembuatan santan di Jalan Merdeka (samping kantor Walikota) Kota Palembang, sabut kelapa berasal dari buah kelapa yang telah diambil santannya. Buah kelapa berasal dari daerah Banyuasin. Sabut kelapa kemudian dicuci hingga pengotor hilang, kemudian potong sabut kelapa menggunakan gunting hingga berukuran lebih kecil, jemur sabut kelapa selama 7 hari hingga kering. Sabut kelapa yang telah kering diperkecil ukurannya hingga 1mm menggunakan blender.
Alkaline Pretreatment
Sabut kelapa seberat 30g yang telah berukuran 1mm dimasukkan kedalam Erlenmeyer 1000 mL kemudian ditambahkan larutan NaOH dengan konsentrasi masing masing 1%M, 3%M, dan 5%M sebanyak 500mL. Tutup erlenmeyer dengan gabus, kemudian panaskan erlenmeyer pada suhu 121oC menggunakan autoclave selama 60 menit (Kholisoh& Sukardati, 2011). Dengan kondisi yang sama, lakukan perlakuan diatas dengan menggunakan larutan NH4OH 1%M, 3%M,
5%M. Setelah pemanasan dengan autoclave selesai, dinginkan sampel kemudian pisahkan larutan dan padatan. Sabut kelapa hasil
pretreatment dicuci menggunakan aquadest hingga pH netral. Keringkan substrat sabut kelapa hingga kering pada suhu 85oC selama kurang lebih 4 jam.
Hidrolisa Asam
Sabut kelapa seberat 18g yang telah kering dimasukkan kedalam erlenmeyer 1000mL untuk dihidrolisa. Tambakan HCl pada masing masing sampel dengan konsentrasi 2%M, 4%M, dan 6%M sebanyak 500 mL. Tutup erlenmeyer dengan menggunakkan gabus. Perlakuan hidrolisa diberikan dengan memanaskan erlenmeyer yang berisi sampel pada suhu 121oC menggunakan autoclave selama 60 menit. Setelah proses selesai, biarkan sampel dingin kemudian pisahkan substrat dan larutan. Lakukan analisa glukosa menggunakan
metoted Luff Schoorl dengan mengambil 50-100 mLfiltrat hasil hidrolisa.
Fermentasi
Filtrat sebanyak 300 mL hasil hidrolisa yang mengandung glukosa, selanjutnya difermentasi. Gunakan erlenmeyer 500mL yang telah di sterilisasi, kemudian tambahkan ragi
Saccharomyces cerevisiae sebanyak 1% (w/v) kemudian atur hingga pH larutan 4.5-5. Sampel yang telah siap, di tutup menggunakan gabus dan hubungkan erlenmeyer dengan botol berisi air menggunakan selang dan biarkan proses fermentasi berlangsung selama 7 hari.
Pemurnian Bioetanol
Siapkan 1 set peralatan evaporasi. Ambil larutan dari hasil fermentasi kemudian masukkan dalam labu, pasang labu pada alat evaporator. Pertahan temperatur pemanas air pada 50-60oC selama 15 menit dan suhu air pendingin pada 15oC . Simpan bioetanol dalam wadah yang tertutup rapat, simpan dalam lemari pendingin dengan suhu 5oC. Analisa kadar bioetanol menggunakan alat Gas Chromatography dan metode densitas.
Prosedur Analisa Hasil
Penentuan kadar Selulosa dan Lignin
menggunakan metode Chesson (Datta, 1981
dalam Mudyantini, 2008)
Sampel kering sebanyak 1 g (berat a) ditambahkan 150 mL aquades dan panaskan pada suhu 90-100oC selama 1 jam. Hasilnya disaring, residu dicuci dengan air panas 300mL, kemudian residu dikeringkan dengan oven pada suhu 105oC sampai kering dan kemudian ditimbang (berat b). Residu ditambah 150 mL H2SO4 1 N, kemudian dipanaskan selama 1 jam
pada suhu 90-100oC. Hasilnya dicuci dengan 300 mL aquadest, dan residu dikeringkan dengan oven pada 105oC hingga berat konstan, kemudian ditimbang (berat c). Residu kering kemudian ditambahkan 10 mL larutan H2SO4
72% dan direndam pada suhu kamar selama 4 jam. Setelah itu tambahkan 150 mL H2SO4 1N,
dan panaskan selama 1 jam padasuhu 90-100oC. Residu disaring dan dicuci dengan 400mL H2O.
Residu kemudian dipanaskan dengan oven pada suhu 105oC sampai beratnya konstan dan ditimbang (berat d). Selanjutnya residu diabukan pada suhu 600oC dengan furnace
selama 4 jam dan ditimbang (berat e).
Kadar Selulosa =
Penentuan kadar glukosa menggunakan metode Luff Schoorl SNI-01-2891-1992
Netralkan 25 mL sampel yang akan diuji. Tambahkan 25 mL larutan Luff kemudian panaskan selama 10 menit atau hingga mendidih dengan pemanas yang dilengkapi dengan pendingin balik. Dinginkan sampel analisa secara cepat hingga suhu kamar kemudian tambahkan larutan KI 20% sebanyak 15 mL. Tambahkan larutan H2SO4 26.5% sebanyak 25
mL secara perlahan. Tambahkan larutan kanji 1% sebanyak 2 mL sebagai indikator titrasi. Kemudian sampel dititrasi dengan menggunakan larutan Na2S2O2 0,1N hingga
berwarna putih kekuningan. Lakukan pada blanko (aquades) dengan proses yang sama.
% glukosa =
Vp = Volume HCl saat hidrolisa, 500 mL. Vs = Volume sampel analisa, 25 mL. Ms = Massa sampel hidrolisa, 18 g.
Penentuan kadar bioetanol dengan metode analisa densitas
Pengujian kadar bioetanol menggunakan densitas dengan membandingkan hasil perhitungan dengan table densitas bioetanol pada buku Farmakope Indonesia Edisi III. Ukur volume piknometer dengan cara menimbang pikno kosong (a), kemudian catat. Masukkan aquades kedalam piknometer kemudian di timbang (b).Setelah volume piknometer diketahui, hitung densitas sampel dengan memasukkan sampel kedalam piknometer hingga penuh kemudian ditimbang (d).Nilai densitas yang telah diketahui dibandingkan dengan tabel standar analisa densitas bioetanol.
Pengujian Kadar Bioetanol Dengan Analisa Gas Kromatography
Sebelum alat dihidupkan, buka valve N2, H2, He, dan hidupkan kompresor udara, atur
tekanan masing-masing 5bar. Setelah itu hidupkan GC dan Komputer. Pada komputer buka software GC Solution. Kemudian pilih metode yang digunakan, jika analisa kadar bioetanol maka pilih metode etanol pada daftar yang tersedia. Sebelum menganalisa sampel, tentukan nilai standar dengan menggunakan etanol murni (slope test). Klik tombol “single
run” pada komputer dan tunggu hingga muncul
tulisan “Ready”. Ambil etanol murni
menggunakan micro syringe sebanyak 1µL. Masukkan etanol kedalam GC melalui
splitinjectorkemudian klik tombol “Start” pada
GC. Etanol yang telah masuk kemudian akan menguap seketika dengan bantuan pemanas pada injector dan menuju kolom kapiler RTX-1 bersama dengan gas pembawa. Sampel yang mempunyai titik didih lebih rendah bergerak cepat melewati kolom kapiler menuju detector FID (Flame Ionization Detector), retensi waktu ini yang menjadi tolak ukur dalam penentuan senyawa yang dianalisa.Setelah senyawa terdeterksi, layar komputer kemudian akan memunculkan grafik serta luas area, catat luas area grafik untuk dijadikan sebagai standar. Lakukan hal yang sama menggunakan sampel bioetanol. Setelah semua sampel selesai diuji, lakukan Cooling down dengan menurunkan temperatur Oven, Split Injektor, dan Detector
menjadi 40oC. Setelah temperatur rendah,
kemudian matikan GC tekan tombol “Power”
pada GC.
3. HASIL DAN PEMBAHASAN
Pengaruh Konsentrasi NaOH Dan NH4OH
Terhadap Penurunan Lignin Pada Proses Pretreatment.
Proses pretreatment sabut kelapa pada penelitian ini menggunakan variasi senyawa dan konsentrasi. Senyawa larutan yang di gunakan yaitu NaOH dan NH4OH dengan variasi
konsentrasi 1%M, 3%M, dan 5%M. Pada penelitian ini waktu pretreatment selama 60 menit dan temperatur 121oC. Metode analisa yang digunakan unutk mendapatkan kadar lignin dan selulosa yaitu metode Chesson (Datta, 1981 dalam Mudyantini, 2008). Dari hasil penelitian ini, didapatkan nilai kadar lignin dan selulosa seperti pada tabel berikut.
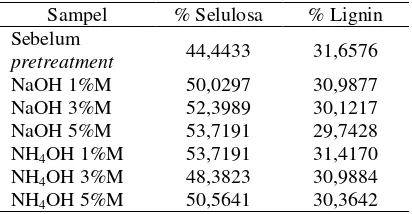
Tabel 3. Hasil analisa kadar lignin dan selulosa sebelum dan sesudah proses pretreatment.
Sampel % Selulosa % Lignin Sebelum
pretreatment 44,4433 31,6576
NaOH 1%M 50,0297 30,9877
NaOH 3%M 52,3989 30,1217
NaOH 5%M 53,7191 29,7428
NH4OH 1%M 53,7191 31,4170
NH4OH 3%M 48,3823 30,9884
Gambar 4. Pengaruh konsentrasi NaOH dan NH4OH terhadap kadar lignin.
Pada gambar 4 dapat dilihat bahwa dari sampel dengan pelarut NaOH 5%M didapatkan kadar lignin terendah sebesar 29,7428% sedangkan kadar lignin tertinggi ada pada sampel dengan pelarut NH4OH 1%M sebesar
31,4170%. Berdasarkan gambar 4 dapat dilihat bahwa penurunan kadar lignin semakin meningkat seiring dengan meningkatnya konsentrasi larutan. Penurunan kadar lignin tertinggi terdapat pada sampel dengan delignifikator NaOH 5%M yaitu 6,048%. Sedangkan pada sampel dengan delignifikator NH4OH 5%M penurunan kadar lignin lebih
kecil yaitu 4,086%. Ukuran sampel mempengaruhi proses pretreatment secara fisika.
Munurut Sun dan Cheng (2002) ukuran partikel akan meningkatkan porositas sampel yang mempengaruhi kontak terhadap senyawa delignifikator dan juga sebagai salah satu cara untuk memutuskan rantai polimer menjadi lebih pendek sehingga lignin lebih mudah untuk terpisah. Penggunaan senyawa alkali seperti NaOH dan NH4OH pada proses alkaline
pretreatment dapat menyebabkan pecahnya struktur lignin sehingga kadar lignin semakin berkurang.
Penggunaan suhu 121oC lebih efektif dalam proses pretreatment, karena suhu yang terlalu tinggi akan menyebabkan terdegradasinya selulosa. Sedangkan pada suhu rendah maka liginin akan sulit untuk terdelignifikasi sehingga masih menutupi selulosa, dan kadar lignin yang berkurang akan sedikit (Permatasari, dkk, 2014). Adanya lignin yang berkurang ditandai dengan berubahnya pelarut mejadi warna hitam. Menurut Marsden dan Gray (1986) dalam Gunam, dkk, (2014) ikatan selulosa dan lignin yang diberi perlakuan alkali akan lebih labil sehingga ikatan eter pada lignoselulosa akan terputus dan lignin akan bereaksi dengan alkali membentuk senyawa lignin-alkali yang mudah larut dalam air. Untuk penurunan kadar lignin yang leih besar diperlukan konsentrasi alkali yang lebih besar dan waktu pretreatment yang lebih lama.
Dari gambar 4 dapat dilihat bahwa penurunan kadar lignin oleh pelarut NaOH lebih baik dari pelarut NH4OH. Menurut Ariani dan
Idiawati (2011) dalamPermatasari,dkk, (2014) lignin akan mudah untuk terlarut pada pH yang tinggi, karena lignin dalamkeadaan terionisasi akan membentuk garam dan bersifat polar yang larut dalam air. Seperti yang kita ketahui bahwa NaOH merupakan golongan basa kuat, sedangkan NH4OH adalah basa lemah sehingga
NaOH mampu melarutkan lignin lebih baik daripada NH4OH.
Pengaruh Konsentrasi HCl pada proses hidrolisa.
Sabut kelapa hasil pretreatment dengan NaOH dan NH4OH diberikan perlakuan
hidrolisa. Pada proses hidrolisa digunakan larutan HCl sebagai katalis, temperatur hidrolisa 121oC dan waktu hidrolisa selama 60 menit. Variasi pada proses hidrolisa adalah konsentrasi HCl yaitu 2%M, 4%M, dan 6%M. Sebelum dilakukan proses hidrolisis, sabut kelapa yang telah didelignifikasi harus dicuci hingga air pembilas tidak berwarna untuk menghilangkan lignin yang terlarut pada air dan pH netral untuk membersihkan senyawa alkali yang tidak bereaksi selama proses pretreatment. Sampel yang telah dicuci kemudian dikeringkan dalam oven pada suhu 85oC selama 4 jam hingga kering. Pengeringan ini dilakukan untuk meningkatkan proses hidrolisis, agar senyawa HCl dan air bisa langsung masuk ke serat sampel dan melakukan hidrolisis. Hasil analisa kadar glukosa dapat dilihat pada tabel dibawah ini.
Gambar 5. Pengaruh Konsentrasi HCl terhadap kadar glukosa dengan
pretreatment NaOH.
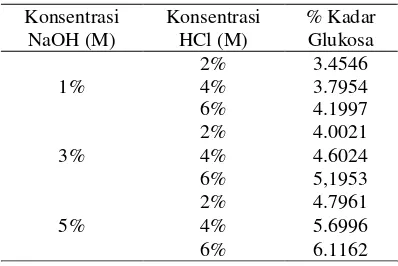
Gambar diatas menunjukkan kadar glukosa pada sampel yang melalui proses hidrolisa HCl dan pretreatment dengan larutan NaOH. Berdasarkan gambar 5 peningkatan kadar glukosa akan semakin meningkat seiring dengan meningkatnya konsentrasi HCl dan NaOH saat pretreatment. Peningkatan kadar glukosa dihasilkan oleh sampel dengan konsentrasi HCl 6%M dan 5%M NaOH saat
pretreatment yaitu sebesar 6,1162%. Kadar glukosa terendah pada sampel dengan
pretreatment NaOH terdapat pada konsentrasi 1%M dan hidrolisa 2%M sebesar 3,4546%.
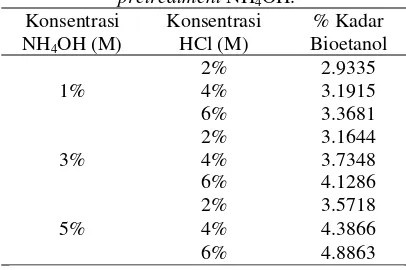
Tabel 5. Hasil analisa kadar glukosa setelah proses hidrolisa pada pretreatment NH4OH.
Konsentrasi
Gambar 6. Pengaruh Konsentrasi HCl
terhadap kadar glukosa dengan
pretreatment NH4OH.
Berdasarkan gambar 6 dapat dilihat bahwa peningkatan kadar glukosa beriringan dengan peningkatan konsentrasi HCl dan NH4OH. Kadar glukosa tertinggi yaitu sebesar
5,3796% dihasilkan oleh sampel HCl 6% dan
NH4OH 5% saat pretreatment. Sedangkan kadar
glukosa terendah dihasilkan oleh sampel HCl 2%M saat hidrolisa dan 1%M saat pretreatment
sebesar 3,2911%.
Gambar 5 dan gambar 6 menunjukkan bahwa peningkatan konsentrasi HCl akan meningkatkan kadar glukosa. Secara keseluruhan kadar glukosa tertinggi yang dihasilkan melalui pretreatment NaOH yaitu sebesar 6,1162% pada HCl 6%M dan NaOH 5%. Sedangkan kadar glukosa tertinggi yang pada pretreatment NH4OH dihasilkan oleh
sampel dengan konsentrasi HCl sebesar 6%M dengan konsentrasi NH4OH sebesar 5%M. Dari
perbedaan diatas dapat dilihat bahwa
pretreatment NaOH dapat menghasilkan glukosa yang lebih tinggi dibandingkan dengan NH4OH. Hal ini terjadi karena pada sampel
dengan pretreatment NaOH memiliki kadar lignin yang lebih rendah dan jumlah selulosa yang lebih besar dibandingkan dengan sampel dengan pretreatment NH4OH. Menurut
Oktavianus,dkk, (2013) kadar lignin yang rendah akan mempermudah kontak selulosa untuk terdegradasi menjadi monomer glukosa. Lignin yang terdapat pada sampel dapat menghambat katalis HCl dalam pembentukan glukosa, sehingga kadar glukosa yang dihasilkan lebih sedikit.
Pada proses hidrolisis, penggunaan konsentrasi optimal HCl yaitu sebesar 80% M. Konsentrasi HCl yang terlalu tinggi akan berpengaruhpada kekentalan larutan, larutan yang terlalu kental akan memperkcil tumbukan antara katalis dan sampel yang akan dihidrolisa sehingga glukosa yang dihasilkan akan lebih kecil. (ZahrodanIstiorini, 2010). Dalam proses hidrolisa gugus H+ dari asam akan mengubah
Pengaruh Konsentrasi HCl Saat Hidrolisis Terhadap Kadar Bioetanol.
Proses fermentasi dilakukan dengan penambahan yeastSaccaromyce cerevisiae dan berlangsung pada kondisi anaerob sehingga selama proses fermentasi berlangsung tidak boleh ada udara yang masuk maupun keluar dari sistem fermentasi. Hasil fermentasi kemudian dimurnikan menggunakan alat evaporator, kemudian dianalisa dengan metode densitas dan alat Gas chromatography.
3.4546
Konsentrasi HCl (% M)
NaOH 1%
Konsentrasi Hcl (% M)
Tabel 6. Hasil analisa densitas pada
pretreatment NaOH terhadap kadar bioetanol.
Pada gambar 7 dapat dilihat kadar bioetanol dari proses fermentasi pada sampel dengan proses pretreatment NaOH dan hidrolisis HCl. Kenaikan kadar bioetanol terus meningkat seiring dengan meningkatnya konsentrasi NaOH dan HCl. Kadar bioetanol tertinggi dihasilkan oleh sampel dengan konsentrasi NaOH 5%M saat pretreatment dan HCl 6%M saat hidrolisis yaitu sebesar 5,3053%. Sedangkan kadar bioetanol terendah dihasilkan oleh sampel dengan konsentrasi NaOH 1%M saat pretreatment dan HCl 6%M saat hidrolisa yaitu sebesar 3,0150%.
Tabel 7. Hasil analisa densitas pada
pretreatment NH4OH.
Konsentrasi
pretreatmentNH4OH terhadap
kadar bioetanol.
Dari gambar 8 dapat dilihat bahwa kadar bioetanol juga terus meningkat seiring dengan bertambahnya konsentrasi NH4OH dan
HCl. Kadar bioetanol tertinggi dihasilkan dari perlakuan hidrolisa HCl 6%M dengan
pretreatment 5%M NH4OH yaitu 4,8836%.
Sedangkan kadar bioetanol terendah dihasilkan oleh sampel dengan konsentrasi NH4OH 1%M
dan HCl dengan konsentrasi 2%M yaitu 2,9335%.
Dalam proses fermentasi tidak ada variasi yang diberikan. Penelitian ini menggunakan yeast Saccharomyces cerevisiae
dengan penambahan 1% massa dari volume
Saccharomyces cerevisiae dalam proses fermentasi.
Berdasarkan hasil yang ditunjukkan oleh gambar 7 dan gambar 8 dapat dilihat bahwa kadar bioetanol yang dihasilkan melalui
pretreatment NaOH lebih tinggi dibandingkan dengan pretreatment melalui NH4OH. Kadar
bioetanol tertinggi melalui pretreatment NaOH yaitu 5,3053% sedangkan pada NH4OH
dihasilkan bioetanol tertinggi sebesar 4,8863%. Perbedaan kadar bioetanol yang dihasilkan dipengaruhi oleh kadar glukosa yang sebelumnya dihasilkan pada proses hidrolisa. Kadar glukosa tertinggi dihasilkan pada sampel yang melalui pretreatment NaOH 5%M dan hidrolisa HCl 6%M yaitu 6,1162% sehingga menghasilkan produk bioetanol sebesar 5,3053. Pada sampel yang melalui pretreatment NH4OH
5%M dan HCl 6%M kadar glukosa yang dihasilkan yaitu 5,3796% sehingga
menghasilkan produk bioetanol sebesar 4,8863%. Kadar bioetanol pada penelitian ini berbanding lurus dengan kadar glukosa yang dihasilkan, hal ini terjadi karena tidak adanya variasi dalam proses fermentasi.
Produk bioetanol dari juga dianalisa dengan alat Gas chromatography. Dari hasil analisa menggunakan alat Gas chromatography
didapatkan hasil analisa pada sampel dengan
pretreatment NaOH 5%M dan hidrolisa HCl 6%M sebesar 4,1938% dan sampel dengan pretreatmen NH4OH 5%M dan hidrolisa HCl
6%M sebesar 3,3789%. Hasil analisa dengan metode densitas dan alat Gas Chromatography
menunjukkan perbedaan, hal ini terjadi karena alat gas chromatography memiliki tingkat keakuratan yang lebih baik dibandingkan dengan metode densitas.
4. KESIMPULAN
Kesimpulan yang didapat dari hasil penelitian ini adalah sebagai berikut :
1. Konsentrasi NaOH yang semakin tinggi akan menghasilkan kadar lignin yang semakin rendah. Kadar lignin terendah yaitu 29,7428% yang dihasilkan melalui
pretreatment NaOH dengan konsentrasi NaOH 5%.
2. Semakin tinggi konsentrasi NH4OH yang
akan digunakan maka akan semakin kecil kadar lignin yang tersisa. Kadar lignin terendah yang dihasilkan melalui
pretreatment NH4OH terdapat pada sampel
dengan konsentrasi 5%MH4OH yaitu
30,3642 %.
3. Kadar glukosa pada proses hidrolisa akan semakin meningkat seiring dengan meningkatnya konsentrasi HCl. Kadar glukosa terbaik dihasilkan melalui
pretreatment NaOH 5% yang kemudian dihidrolisa dengan HCl 6% yaitu 6,1162 %. 4. Kadar bioetanol tertinggi dipengaruhi oleh
kadar glukosa dari proses hidrolisa. Kadar etanol tertinggi terdapat pada sampel dengan konsentrasi HCl 6%M saat hidrolisa yang melalui proses pretreatment NaOH 5%M yaitu sebesar 5,3053%.
DAFTAR PUSTAKA
Andini, S., dan Dian, W. 2013. Pemanfaatan Sabut Kelapa dan Pewarna Alam Indigofera sebagai Material Alternatif pada Produk Kriya. Jurnal Tingkat
Sarjana bidang Senirupa dan Desain. Institut Teknologi Bandung.
Anonim. 1979. Farmakope Indonesia Edisi Ketiga. Departemen Kesehatan Republik Indonesia.
Anonim. 2014. Peraturan Menteri ESDM No. 20 Tahun 2014. (online) www. esdm.go.id. (diakses tanggal 20 Febuari 2016).
Anonim. 2014. Perkebunan Kelapa. (online) www.bps.go.id. (diakses tanggal 13 Febuari 2016)
Axelsson, J. 2011. Separate Hydrolysis and Fermentation of Pretreated Spruce. Department of Physics, Chemistry and Biology Linkoping University : Sweden.
Badan Standarisasi Nasional. 1992. Cara Uji Makanan dan Minuman. SNI : 01-2891-1992.
Badan Standarisasi Nasional. 2012. Bioetanol Terdenaturasi Untuk Gasohol. SNI: 7390-2012.
Deviyanti, P., Rumiyati, dan Faisol, A. 2014. Pengaruh Variabel Konsentrasi Asam Sulfat dan Waktu Fermentasi terhadap Pembentukan Kadar Bioetanol dari Sabut Kelapa. Jurusan Teknik Kimia. Universitas Sriwijaya.
Fatmawati, A., dan Rudy, A. 2014. Model Dinamika Orde Satu untuk Menentukan Parameter Kinetika Reaksi Hidrolisa Enzimatis Sabut Kelapa. Program Studi Teknik Kimia. Universitas Surabaya..
Gunam, I. B., Ni, M. W., Anak, A.M.D., dan Pande, M. S. 2011. Delignifikasi Ampas Tebu dengan Larutan Natrium Hidroksida Sebelum Sakarifikasi secara Enzimatis Menggunakan Enzim Selulase Kasar dari Aspergillus Niger FNU 6018. Teknologi Indonesia LIPI Press, 34 (Edisi Khusus 2011): 24-32. Hanum, F., Nurhasmawaty, P., Mulia, R., Ratih,
Idral, D. I., Salim, M., dan Elida, M. 2012. Pembuatan Bioetanol dari Ampas Sagu dengan Proses Hidrolisis Asam dan Menggunakan Saccharomyces cerevisae. Universitas Andalas. Jurnal Kimia Unand. 1(1): 34-39.
Kholisoh, S. D., dan Sri, S. 2011. Delignifikasi Sabut Kelapa dengan NaOH untuk Produksi Gula Pereduksi secara
Enzimatik. UPN “Veteran”
Yogyakarta. Seminar Rekayasa Kimia dan Proses.
Kristina, Evi, R. S., dan Novia. 2012. Alkaline Pretreatment dan Proses Simultan Sakarifikasi-Fermentasi Untuk Produksi Etanol dari Tandan Kosong Kelapa Sawit. Universitas Sriwijaya. Jurnal Teknik Kimia. 3 (8): 34-43. Mosier, N., Charles, W., Bruce, D., Richard, E.,
Y.Y. Lee, Mark, H., Michael, L. 2005. Features Of Promising Technologies For Pretreatment Of Lignocellulosic Biomass. Bioresource Technology. 96, 673-686.
Mudyantini, W. 2008. Pertumbuhan, Kandungan Selulosa, dan Lignin pada Rami (Boehmeria nivea L. Gaudich) dengan Pemberian Asam Giberelat (GA3). Jurusan Biologi. Universitas Sebelas Maret Surakarta. Biodiversitas 9(4): 269-274.
Mussatto, S.I., dan Ines, C. R. 2004. Alternatives For Detoxification Of Dilute-Acid Lignocellulosic Hydrolyzates For Use In Fermentative Process: A Review. Bioresource Technology, 93, 1-10.
Ningrum, E.F. 2015. Pembuatan Bioetanol dari Mahkota Buah Nenas Varietas Queen dengan Menggunakan Mikroba Saccharomyces cerevisae. Politeknik Negeri Sriwijaya.
Oktavianus, F., Roy, M.S., dan M. Djoni, B. 2013. Pembuatan Bioetanol dari Batang Jarak Menggunakan Metode Hidrolisa dengan Katalis Asam Sulfat. Universitas Sriwijaya. Jurnal Teknik Kimia. 2 (19): 27-32.
Osvaldo Z.S., Panca P.S., dan M. Faizal. 2012. Pengaruh Konsentrasi Asam dan
Waktu pada Proses Hidrolisis dan Fermentasi Pembuatan Bioetanol dari Alang-Alang. Universitas Sriwijaya. Jurnal Teknik Kimia. 2 (18): 52-62. Permatasari, H.R., Fakhili, G., dan Bety, L.,
dkk., Pengaruh Konsentrasi H2SO4 dan NaOH terhadap Delignifikasi Serbuk Bambo (Gigantochloa apus). Program Studi Pendidikan Kimia FKIP. Universitas Sriwijaya.
Perry, R.H., dan Green, D. 1997. Perry’s Chemical Engineers’ Hdanbook, 7th
Edition. McGraw-Hill Book Company : New York.
Polii, F.F. 2012. Pembuatan Etanol dari Limbah Industri Serat Kelapa. Jurnal Penelitian Teknologi Industri. Baristand Industri Manado. 4(1): 20-27.
Putri, M., Marniati, S., dan Elida, M. Pengaruh Penambahan NaOH-NH4OH untuk Produksi Bioetanol dari Ampas Tebu dengan Metode Simultaneous Saccharification Fermentation (SSF). Jurusan Kimia FMIPA. Universitas Andalas.
Sitorus, D.O. 2014. Peningkatan Potensi Campuran Serat Sabut Kelaoa dan Serbuk Kayu Gergaju Teraktivasi H2SO4 sebagai Media Adsorben Zat Warna Terhadap Limbah Kain Songket. Politeknik Negeri Sriwijaya. Sukadarti, S., Siti, D.K., Heri, P., Wasis, P., dan
Tri, M. 2010. Produksi Gula Reduksi dari Sabut Kelapa Menggunakan Jamur Trichoderma reesei. Prosiding Seminar
Nasional Teknik Kimia “Kejuangan”.
Program Studi Teknik Kimia. UPN
“Veteran” Yogyakarta.
Sun, Y., dan Cheng, J. 2002. Hydrolysis Of Lignocellulosic Materials For Ethanol Production: A Review. Bioresource Technol., 83, 1-11.
Walker, G. M. 2010. Bioethanol : Science and Technology of Fuel Alcohol. University of Abertay : Scotland. Wiratmaja, I. G., Kusuma, I.G. dan Winaya,
Baku. Universitas Udayana. Jurnal Ilmiah Teknik Mesin. 5 (1) : 75-84. Zahro, L. M. dan Mareta, I. 2010. Penyiapan