KARAKTERISASI BERBAGAI AKSESI SAGU (
Metroxylon
spp.) DI KABUPATEN SORONG SELATAN, PAPUA BARAT
RATIH KEMALA DEWI
A252120081
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Karakterisasi Berbagai Aksesi Sagu (Metroxylon spp.) di Kabupaten Sorong Selatan, Papua Barat adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2015
Ratih Kemala Dewi
RINGKASAN
RATIH KEMALA DEWI. Karakterisasi Berbagai Aksesi Sagu (Metroxylon spp.) di Kabupaten Sorong Selatan, Papua Barat. Dibimbing oleh HMH BINTORO DJOEFRIE dan SUDRADJAT.
Sagu merupakan tanaman sumber karbohidrat terbesar di dunia karena memiliki kandungan karbohidrat tertinggi dibandingkan dengan tanaman pangan lainnya. Pati kering yang dihasilkan mencapai 200-400 kg batang-1. Lebih dari 50% populasi sagu dunia terdapat di Indonesia dan 90% dari sagu di Indonesia terdapat di Papua. Oleh karenanya, Papua merupakan sumber keragaman genetik tanaman sagu. Penelitian ini bertujuan untuk melakukan karakterisasi terhadap berbagai aksesi sagu di Kabupaten Sorong Selatan, Papua Barat. Terdapat 12 aksesi sagu di Kecamatan Saifi, Kabupaten Sorong Selatan, Papua Barat yaitu Fasai, Fasampe, Falia, Fanomik, Fasongka, Fafion, Fakattao, Fanke, Fablen, Failik, Fakreit dan Fanke. Pengambilan data dilakukan dengan melakukan pengamatan pada morfologi, potensi produksi, dan DNA. DNA dianalisis dengan menggunakan teknik RAPD (Randomly Amplified Polymorphic DNA). Sebanyak 2 cm2 dari pucuk daun anakan diambil dari setiap aksesi untuk keperluan analisis DNA.
Terdapat perbedaan karakter morfologi dari dua belas aksesi sagu di lokasi penelitian, seperti warna kuncup daun muda anakan, bentuk tajuk, jumlah daun, tinggi batang, keberadaan duri, kandungan pati, serta warna empulur dan pati. Aksesi Fablen merupakan satu-satunya aksesi yang tidak berduri. Berdasarkan hasil analisis RAPD ternyata berbagai aksesi sagu tersebut memiliki hubungan yang cukup jauh. Hanya aksesi Fanke dan Fakreit yang memiliki tingkat kemiripan sebanyak 81%, aksesi lainnya memiliki nilai kemiripan dibawah 80%.
Sebagian besar aksesi sagu tersebut merupakan aksesi unggul yang berpotensi untuk lebih dikembangkan karena memiliki kandungan pati lebih dari 200 kg batang-1. Aksesi Fanomik merupakan aksesi sagu yang memiliki potensi hasil tertinggi. Berdasarkan perhitungan jumlah pohon masak tebang per hektar di hutan sagu alami Kecamatan Saifi, Kabupaten, Sorong Selatan, akan didapatkan pati kering sebanyak 38.43 ton ha-1 tahun-1.
SUMMARY
RATIH KEMALA DEWI. Characterization of Sago Palm (Metroxylon spp.) Accessions in South Sorong District, West Papua. Supervised by HMH BINTORO DJOEFRIE and SUDRADJAT
Sago palm is the world largest carbohydrate source. It can produce dry
starch about 200-400 kg trunk-1. More than 50% sago palm population in the
world belongs to Indonesia and 90% sago palm in Indonesia found in Papua with a large genetic variations. This research was aim to determine morphological characteristics and genetic relationship of sago palm accessions in South Sorong District, West Papua. Based on local people, there are 12 accessions of sago palm, they are Fasai, Fasampe, Falia, Fanomik, Fasongka, Fafion, Fakattao, Fanke, Fablen, Failik, Fakreit and Fanke. Observation was taken in morphological characteristics, yield potential, and DNA. DNA analyzed by RAPD
technique. About 2 cm2 of shoots tip taken in every accession.
Among these accessions, there are so many differences based on morphological characteristics such as shoots color, crown shape, trunk height, number of leaf, existence of spine, starch content, also pith and starch color. Based on RAPD marker, only Fanke and Fakreit that has a close relationship (81%) and the other is quite far in relationship (less than 80% in similarity test).
Almost all of them were high yielding accsseions. They can produce more
than 200 kg trunk-1 of dry starch without maintenance. Fanomik is high yielding
accessions. It can produce more than 400 kg trunk-1 of dry starch. Sago palm
productivity in the natural forest of Saifi Subdistrict, South Sorong District, West
Papua was estimated to reach approximately 38.43 ton ha-1year-1 of sago dry
starch.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Agronomi dan Hortikultura
KARAKTERISASI BERBAGAI AKSESI SAGU (
Metroxylon
spp.) DI KABUPATEN SORONG SELATAN, PAPUA BARAT
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2015
Judul Tesis : Karakterisasi Berbagai Aksesi Sagu (Metroxylon spp.) di Kabupaten Sorong Selatan, Papua Barat
Nama : Ratih Kemala Dewi NIM : A252120081
Disetujui oleh Komisi Pembimbing
Prof Dr Ir HMH Bintoro Djoefrie, M Agr Ketua
Dr Ir Sudradjat, MS Anggota
Diketahui oleh
Ketua Program Studi Agronomi dan Hortikultura
Dr Ir Maya Melati, MS MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga laporan penelitian ini dapat diselesaikan. Penelitian ini bertujuan untuk melakukan karakterisasi terhadap berbagai aksesi sagu di Kabupaten Sorong Selatan, Papua Barat.
Terima kasih penulis ucapkan kepada Prof Dr Ir HMH Bintoro Djoefrie, M Agr dan Dr Ir Sudrajat, MS selaku pembimbing yang telah banyak memberi saran. Penulis juga berterimakasih kepada Pemerintah Daerah Sorong Selatan, BPPT, dan Program Diploma IPB yang telah memberikan dukungan dana penelitian serta kepada Direktorat Pendidikan Tinggi atas beasiswa yang diberikan melalui program Beasiswa Unggulan. Penulis juga berterimakasih kepada para petani di Kampung Sayal, Distrik Saifi, Kabupaten Sorong Selatan atas bantuan selama pelaksanaan penelitian serta kepada keluarga Ibu Dewi Heremba yang telah menyediakan akomodasi selama penulis menjalani penelitian. Ungkapan terima kasih juga disampaikan kepada suami, ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Saat ini sebagian dari hasil penelitian sedang diproses untuk dipublikasikan ke Jurnal Agronomi Indonesia (JAI) dengan judul Potensi Produksi Beberapa Aksesi Sagu (Metroxylon spp.) di Kabupaten Sorong Selatan, Papua Barat dan telah memasuki tahap penelaahan oleh reviewer.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2015
DAFTAR ISI
DAFTAR TABEL xi
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xii
PENDAHULUAN 1
Latar Belakang 1
Tujuan 2
Hipotesis 2
TINJAUAN PUSTAKA 3
Taksonomi Tanaman Sagu 3
Botani Tanaman Sagu 4
Ekologi Tanaman Sagu 7
Panen dan Potensi Produksi Sagu 8
Penyebaran Sagu di Papua dan Papua Barat 8
Keragaman Genetik Sagu 9
Penanda Genetik 10
METODE 12
Waktu dan Tempat 12
Bahan dan Alat 12
Pengambilan Data 13
Analisis Data 13
Pelaksanaan Penelitian 13
HASIL DAN PEMBAHASAN 21
Hasil 21
Gambaran Umum Lokasi Penelitian 21
Karakter Morfologi 21
Potensi Produksi 33
Pembahasan 35
Karakter Morfologi 35
Hubungan Kekerabatan 36
Potensi Produksi 38
Kualitas Pati Sagu 40
SIMPULAN DAN SARAN 41
Simpulan 41
Saran 41
DAFTAR TABEL
1 Sebaran potensi sagu dengan beberapa faktor persyaratan tempat
tumbuh di Provinsi Papua Barat 9
2 Informasi awal berbagai aksesi sagu di Kecamatan Saifi,
Kabupaten Sorong Selatan 12
3 Karakter batang berbagai aksesi sagu di Kampung Sayal, Distrik Saifi, Kabupaten Sorong Selatan, Papua Barat 22 4 Karakteristik daun berbagai aksesi sagu di Kampung Sayal,
Kecamatan Saifi, Kabupaten Sorong Selatan, Papua Barat 28 5 Karakteristik buah berbagai aksesi sagu di Kampung Sayal,
Distrik Saifi, Kabupaten Sorong Selatan, Papua Barat 29 6 Kerapatan stomata epidermis bagian bawah berbagai aksesi sagu
di Kampung Sayal, Distrik Saifi, Kabupaten Sorong Selatan,
Papua Barat 32
7 Komposisi kimia pati dalam bobot basah (%) berbagai aksesi sagu di Kampung Sayal, Kecamatan Saifi, Kabupaten Sorong
Selatan, Papua Barat 32
8 Potensi produksi berbagai aksesi sagu di Kampung Sayal, Kecamatan Saifi, Kabupaten Sorong Selatan, Papua Barat 33 9 Potensi Produksi Sagu di Kampung Sayal, Kecamatan Saifi,
Kabupaten Sorong Selatan, Papua Barat 33
10 Potensi produksi tanaman sagu di beberapa Kabupaten di
Provinsi Papua dan Papua Barat (pohon ha-1) 40
DAFTAR GAMBAR
1 Bagian apex batang pada saat fase vegetative 5
2 Skema cabang pertama pada tandan bunga sagu 6
3 Perkembangan tandan bunga 6
4 Ilustari anak daun 14
5 Ilustrasi daun sagu 14
6 Perkembangan bunga tanaman sagu 15
7 Perkembangan buah tanaman sagu 16
8 Bagan Warna 17
9 Cara analisis DNA dengan skoring 20
10 Cara membedakan aksesi sagu yang berduri menurut penduduk di Kampung Sayal, Kecamatan Saifi, Kabupaten Sorong
Selatan, Papua Barat 23
11 Variasi Bentuk tajuk berbagai aksesi sagu di Kampung Sayal, Kecamatan Saifi, Kabupaten Sorong Selatan, Papua Barat 24 12 Variasi batang berbagai aksesi sagu di Kampung Sayal,
Kecamatan Saifi, Kabupaten Sorong Selatan, Papua Barat 25 13 Akar nafas yang muncul di permukaan tanah dan batang 26 14 Warna kuncup daun muda anakan berbagai aksesi sagu di
Kampung Sayal, Kecamatan Saifi, Kabupaten Sorong Selatan,
Papua Barat 27
16 Bentuk buah berbagai aksesi sagu di Kampung Sayal, Kecamatan Saifi, Sorong Selatan, Papua Barat 29 17 Penampang melintang buah sagu yang tidak berbiji 29 18 Pola duri pada pangkal pelepah daun dewasa berbagai aksesi Kecamatan Saifi, Sorong Selatan, Papua Barat 31 21 Hasil amplifikasi DNA berbagai aksesi sagu di Kampung Sayal,
Distrik Saifi, Sorong Selatan, Papua Barat 34 22 Dendogram berbagai aksesi sagu berdasarkan karakter genetik
di Kampung Sayal, Kecamatan Saifi, Sorong Selatan, Papua
Barat 34
23 Dendogram berbagai aksesi sagu berdasarkan karakter morfologi di Kampung Sayal, Kecamatan Saifi, Sorong Selatan,
Papua Barat 35
DAFTAR LAMPIRAN
1 Peta indikatif sebaran sagu di Provinsi Papua Barat 46
2 Deskripsi aksesi Fasinan 47
3 Deskripsi aksesi Fasampe 50
4 Deskripsi aksesi Fablen 52
5 Deskripsi aksesi Fakreit 55
6 Deskripsi aksesi Fafion 57
7 Deskripsi aksesi Failik 60
8 Deskripsi aksesi Fablen 62
9 Deskripsi aksesi Fasai 65
10 Deskripsi aksesi Fanke 68
11 Deskripsi aksesi Fasongka 71
12 Deskripsi aksesi Fanomik 73
13 Deskripsi aksesi Fakattao 76
14 Hasil skoring berdasarkan analisis RAPD berbagai aksesi sagu di Kecamatan Saifi, Kabupaten Sorong Selatan, Papua Barat 79 15 Hasil similarity test berbagai aksesi sagu di Kecamatan Saifi,
Kabupaten Sorong Selatan, Papua Barat (NTSYS 2.02) 81 16 Hasil skoring berdasarkan karakter morfologi berbagai aksesi
sagu di Kecamatan Saifi, Kabupaten Sorong Selatan, Papua Barat 82 17 Kode ciri dan skoring berdasarkan karakter morofologi berbagai
aksesi sagu di Kecamatan saifi, Kabupaten Sorong Selatan,
Papua Barat 83
18 Hasil similarity test berdasarkan karakter morfologi berbagai aksesi sagu di Kecamatan Saifi, Kabupaten Sorong Selatan, Papua
Barat 85
19 Hasil uji t kerapatan stomata dan potensi hasil tanaman sagu 86
PENDAHULUAN
Latar Belakang
Sagu merupakan tanaman sumber karbohidrat terbesar di dunia karena memiliki kandungan karbohidrat tertinggi dibandingkan tanaman pangan lainnya. Karbohidrat tersebut diperoleh dari pati sagu yang tersimpan dalam batang sagu. Kandungan pati dalam satu batang sagu diperkirakan mencapai 200-400 kg bah-kan sagu jenis Para yang terdapat di daerah Sentani, Papua memiliki bah-kandungan pati sebanyak 975 kg per pohon (Bintoro et al. 2010). Sagu telah lama dikonsumsi sebagai makanan pokok, terutama oleh penduduk Indonesia bagian Timur. Kebijakan pemerintah untuk melaksanakan revolusi hijau di seluruh Nusantara menyebabkan konsumsi sagu mengalami penurunan secara drastis (Wardis 2013). Walaupun dalam jumlah yang kecil, sagu masih menjadi makanan pokok untuk sebagian penduduk Indonesia bagian Timur karena ketersediaan beras yang terbatas.
Selain menjadi makanan pokok, sagu dapat digunakan sebagai bahan baku industri, baik industri pangan maupun nonpangan. Sagu dapat dijadikan gula cair, bioetanol, dan plastik yang dapat terurai. Adeni et al (2010) menyatakan, sagu dapat menghasilkan bioetanol sekitar 80 000 - 10 000 L ha-1 tahun-1 dan dapat mengurangi pemanasan global karena sagu mampu memproduksi oksigen sebanyak 9.52 ton ha-1 dan menyerap 0.3% CO2 dari setiap 1 juta hektar hutan sagu. Adeni et al (2010) juga menyatakan bahwa limbah dari tanaman sagupun masih dapat dimanfaatkan sebagai bahan baku pembuatan bioetanol dan kompos.
Indonesia memiliki populasi tanaman sagu terbesar di dunia. Lebih dari 50% populasi sagu dunia dimiliki oleh Indonesia dan 90% dari populasi tersebut ditemukan di Papua dan Papua Barat (Bintoro 2008). Luas sebaran sagu di Provinsi Papua sekitar 4.7 juta hektar dan di Papua Barat sekitar 510 ribu hektar (Bintoro et al. 2014). Ketersediaan sagu yang melimpah dapat digunakan sebagai upaya untuk membantu menyelesaikan permasalahan dunia terutama dalam hal pangan dan energi. Menurut Konuma (2013) sejak tahun 1990 jumlah penduduk dunia yang memerlukan bahan pangan sekitar 7 milyar jiwa dan sekitar 868 juta (12%) diantaranya mengalami gizi buruk. Pada tahun 2050 diprediksikan jumlah penduduk akan mencapai 9.2 milyar jiwa.
Sagu merupakan tanaman C3 yang dapat hidup pada lahan marginal se-perti di lahan gambut, rawa dan tanah yang tergenang (Okazaki et al. 2013). Sagu dapat tumbuh pada pH tanah yang bervariasi dari 3.6-5.7 (Anugoolprasert et al.
2012). Sagu merupakan tanaman potensial yang harus dikembangkan.
Papua dan Papua Barat merupakan daerah yang memiliki populasi terluas di dunia sehingga keragaman genetik di tempat tersebut sangat tinggi. Abbas et al
Karakter morfologi belum cukup untuk menggambarkan keragaman gene-tik karena masih dipengaruhi oleh lingkungan. Terdapat kemungkinan aksesi sagu tersebut memiliki kekerabatan yang dekat atau bahkan merupakan aksesi yang sa-ma. Boosermsuk et al. (1995) menyatakan Populasi tanaman sagu yang diambil dari Thailand memiliki variasi isozime yang rendah. Hal tersebut menunjukkan ta-naman sagu yang satu dengan yang lainnya memiliki hubungan genetik yang de-kat.
Kjaer et al. (2004) menyatakan perbedaan geografi menyebabkan variasi genetik. Abbas et al. (2009) menyatakan populasi sagu yang diambil dari 6 pulau di Indonesia memiliki hubungan genetik. Berdasarkan analisis RAPD, tanaman sagu dari Papua memiliki kekerabatan genetik yang dekat dengan tanaman sagu dari Kalimantan dan Sumatra, sedangkan tanaman sagu dari Maluku berkerabat dekat dengan tanaman sagu dari Sulawesi, dan tanaman sagu dari Jawa tidak memiliki kekerabatan dengan yang lainnya.
Keberadaan duri merupakan ciri yang sering dipakai penduduk lokal untuk membedakan aksesi sagunya. Jong (1995) menyatakan tanaman sagu yang berduri dapat berasal dari tanaman sagu yang tidak berduri begitupun sebaliknya. Novero
et al. (2012) menambahkan bahwa adanya duri pada tanaman sagu merupakan
peristiwa epigenetik yang dipengaruhi oleh lingkungan. Berdasarkan analisis terhadap methylation DNA, terdapat perbedaan yang signifikan terhadap per-sentase methylation DNA antara tanamaan sagu yang berduri dan tidak berduri yang disebabkan oleh lingkungan tumbuh yang tergenang. Karakterisasi berbagai aksesi sagu penting untuk dilakukan, terutama untuk pengembangan aksesi sagu yang memiliki produktivitas tinggi.
Tujuan
1. Mendapatkan informasi mengenai karakter berbagai aksesi sagu di Kabupaten Sorong Selatan, Papua Barat
2. Mengetahui potensi produksi dari berbagai aksesi sagu di Kabupaten Sorong Selatan, Papua Barat
3. Menentukan hubungan kekerabatan genetik antar aksesi sagu di Kabupaten Sorong Selatan, Papua Barat
Hipotesis
TINJAUAN PUSTAKA
Taksonomi Tanaman Sagu
Menurut GRIN (2011) tanaman sagu (Metroxylon sagu Rottb.) termasuk dalam famili Arecaceae (alt. Palmae) dengan genus Metroxylon. Secara harfiah tanaman sagu berasal dari kata metro yang berarti pati dan xylon yang berarti xilem sehingga Metroxylon adalah pati yang tersimpan dalam batang. Sebelumnya Beccari (1918) dalam Barahima (2006) membagi spesies Metroxylon menjadi dua kelompok, yaitu Eumetroxylon yang memiliki tiga spesies (M. sagu Rottb., M.
rumphii Mart., dan M. Squarossum Becc.) dan Coelococcus yang memiliki enam
spesies (M. warburghii Heim., M. upoluense Becc., M. vitiense Benth. Et hook,
M. amicarum var. Commune Becc., dan var. Majus Becc., M. salmonense Becc.,
dan M. bougainvilense Becc.). Klasifikasi Beccari tersebut didasarkan pada
ukuran dan bentuk buah, oleh karenanya klasifikasi tersebut dianggap belum akurat.
Rauwerdink (1986) mereduksi klasifikasi Beccari dan mengklasifikasikan-nya berdasarkan adamengklasifikasikan-nya duri, membentuk rumpun atau tidak, dan jumlah sisik yang menutupi buah. Metroxylon dibagi menjadi lima spesies yaitu M. sagu yang membentuk rumpun, berduri, dan buahnya memiliki 18 baris yang membujur, M.
amicarum, M. vitiense, M. salomonense, dan M. warburghii yaitu jenis sagu yang
tidak berduri dan buahnya ditutupi 24 - 28 sisik longitudinal. Pada kenyataannya, sagu yang berduri memiliki kemungkinan untuk memproduksi sagu yang berduri dan tidak berduri. Hal tersebut mengindikasikan karakter yang heterozigot dan mungkin membentuk embrio dari dua genotipe (Rauwerdink 1986). Studi selan-jutnya mengenai adanya sagu yang berumpun dan yang menyendiri dipelajari oleh McClatchey pada tahun 1998 dan pada tahun 2005, Ia mendeskripsikan genus
Metroxylon yang terdiri atas enam spesies yaitu M. amicarum (H. Wendland)
Beccari, M. paulcoxii McClatchey, M. sagu Rottboell, M. salomonense (Warburg) Beccari, M. vitiense (H. Wendland) H. wendland ex Bentham & Hooker f., M.
warburghii (Heim) Beccari (McClatchey et al. 2006).
Perkembangan selanjutnya mengenai taksonomi tanaman sagu mulai terjawab dengan berkembangnya metode penanda molekuler. Miftahorrachman et al. (1998) dan Kjaer et al. (2004) menggunakan teknik amplified fragment length
polymorphism (AFLP) untuk menginvestigasi struktur genetik dari 76 M. sagu
yang dikoleksi dari tujuh lokasi dari Papua New Guinea (PNG) dan mencoba mengkorelasikan variasi genetik dengan variasi morfologi serta jarak distribusi. Mereka menyimpulkan variasi morfologi dari karakter vegetatif tidak selalu berhubungan dengan muncul atau tidaknya duri dan tidak berhubungan secara genetik, tetapi genetik dan jarak distribusi memiliki linkage. Hasil tersebut mendukung klasifikasi Rauwerdink 1986 yang menyatakan hanya ada satu spesies
M. sagu di PNG. Ehara et al (2003) menemukan kesimpulan yang sama dari 38
Botani Tanaman Sagu
Tanaman sagu mempunyai daun seperti daun kelapa. Menurut Flach (1997) daun sagu merupakan pinnate-leaved. Jumlah daun pada tanaman sagu yang tumbuh dalam kondisi optimum 24 daun. Setiap bulan akan muncul tunas daun baru, dan daun yang paling tua akan mengalami gugur (senescens) dan kemudian mati. Daun yang telah membuka sempurna (dewasa) memiliki panjang daun antara 5-8 m dengan 100-140 helai anak daun. Beberapa anak daun memiliki panjang 150 cm dengan lebar lebih dari 10 cm. Daun yang sudah tua biasanya akan gugur (senescens) dan digantikan oleh daun yang baru pada bagian terminal. Terdapat bekas luka (leaf scar) pada batang setiap kali daun mengalami gugur, namun terdapat juga varietas yang bekas pelepah tuanya tetap menempel pada batang.
Pada masa rosette, sebelum terbentuk batang, daun sagu lebih kecil dari ukuran daun dewasa. Kecepatan produksi daun lebih cepat dibandingkan pada saat telah terbentuk batang. Rata-rata pembentukan daun sekitar 2 daun per bulan. Kecepatan pembentukan daun lebih konstan setiap bulannya dibandingkan dengan perkembangan panjang daun. Pada kondisi lingkungan dengan unsur hara kurang, panjang daun akan lebih pendek, walaupun kecepatan pembentukan daun masih dalam keadaan tetap. Namun demikian, perubahan kondisi ekologi, misalnya tergenang dalam waktu yang lama, akan memperlambat kecepatan pembentukan daun (Flach 1997).
Flach (1997) juga menyatakan diameter batang sagu tanpa pelepah berkisar antara 35-60 cm dengan tinggi 6-16 m tergantung varietas dan kondisi lingkungan. Pati sagu tersimpan dalam jaringan parenkim, pada umumnuya kandungan pati 10-25% dari bobot batang, bobot batang berkisar (1-2 ton). Menurut Flach (1997) lamanya pertumbuhan batang sagu dapat diketahui dari bekas pelepah yang masih terlihat pada batang saat inisiasi bunga. Pada kondisi yang normal, akan terbentuk 54 bekas pelepah, jika setiap bulan muncul satu daun, maka secara fisiologis usia tanaman sagu tersebut adalah 54 bulan. Diperkirakan dalam satu siklus tanaman sagu menghabiskan waktu sekitar 11-12 tahun. Terdapat juga tipe lainnya yang memiliki masa pertumbuhan yang lebih lama, pembentukan batang lebih dari 4.5 tahun dan siklus hidup lebih dari 16 tahun. Tanaman sagu tipe tersebut biasanya, tidak hanya memiliki batang yang tinggi tetapi juga memiliki ukuran daun yang lebih besar.
Pada kondisi yang tergenang, tanaman sagu membentuk pneumatophores
Tanaman sagu merupakan palma soboliferous yang memproduksi banyak anakan (sucker). Secara alami, anakan sagu akan muncul pada bagian bawah batang dan membentuk rumpun dalam berbagai tahap pertumbuhan. Kadang-kadang, anakan tersebut dapat muncul dari batang bagian atas. Siklus hidup tanaman sagu hepaksantik diakhiri dengan munculnya tandan bunga yang sangat besar dengan buah yang sangat banyak. Setelah buah terbentuk, pohon akan segera mati. Kemudian, satu atau lebih anakan dalam satu rumpun tersebut akan menggantikan tanaman induk yang telah mati.
Menurut Haryanto dan Pangloli (1992) terdapat dua tipe tanaman sagu berdasarkan munculnya bunga, yaitu tanaman sagu hepaksantik yang siklus hidupnya diakhiri dengan munculnya bunga dan tanaman pleonantik yang dapat berbunga dan berbuah lebih dari satu kali. Bunga tanaman sagu hepaksantik hanya muncul sekali dalam satu siklus hidupnya. Setelah tanaman berbunga dan daun mengalami senescens yang sempurna maka tanaman sagu akan mati.
Menurut Flach (1997) tanaman sagu mulai memasuki generatif sejak terjadinya inisiasi bunga (inflorescens). Pembungaan sagu hepaksantik diawali dengan munculnya jantung pada bagian terminal (ujung batang) sagu. Inisiasi bunga akan terjadi jika jumlah daun sudah terbentuk secara sempurna. Waktu yang diperlukan untuk pematangan buah minimal 3 tahun sejak inisiasi bunga. Pembungaan telah sempurna jika bunga sudah keluar dari cabang tandan bunga yang ke-3. Terjadi perubahan pada bagian meristem apex ketika masa vegetatif dan masa generatif. Pada masa vegetatif, apex berbentuk concave dan pada saat memasuki generatif menjadi convex (Gambar 1). Cabang bunga ke dua dan ke tiga tidak akan muncul jika cabang pertama belum mencapai pertumbuhan yang maksimum (Gambar 2 dan Gambar 3). Munculnya bunga dimulai dari ranting terbawah menuju ke atas.
Gambar 2 Skema cabang pertama pada tandan bunga sagu (Schuiling 2009)
Gambar 3 Perkembangan tandan bunga (ax0) pada inisiasi bunga sagu (a. Jantung bunga sagu yang masih tertutup oleh braktea, b. inisiasi bunga pada tahap jantung, semua cabang dihilangkan, c. tandan (cabang utama) dalam kondisi pertumbuhan maksimum, d. braktea yan
jantan, ginoecium direduksi menjadi pistillode. Pada saat awal perkembangan bunga, tunas bunga selalu berpasangan. Satu bunga merupakan staminate (bunga jantan), bunga yang lainnya hermafrodit. Selanjutnya, salah satu dari bunga tersebut akan menggugurkan diri sebelum antesis. Pada umumnya bunga jantan lebih banyak yang manggugurkan diri dibandingkan bunga hermafrodit. Bunga jantan masak setelah 30 hari sejak bunga membuka, sedangkan bunga hermafrodit akan reseptif setelah 50 hari. Bunga jantan masak lebih awal dan membuka 2-4 minggu sebelum bunga hermafrodit. Kadang-kadang juga terdapat kemungkinan masak bersamaan (Flach 1997).
Buah sagu ditutupi oleh baris-baris vertikal seperti buah salak. Embrio terletak basal buah dan menempel seolah-olah seperti homogenous endosperm. Sebagian besar buah sagu merupakan buah partenokarpri yang terjadi tanpa adanya fertilisasi. Buah tersebut hanya diisi oleh mesokarp yang lunak. Buah tersebut tidak berbiji. Buah partenokarpri biasanya lebih kecil dibandingkan buah yang berbiji. Biji sagu dapat berkecambah jika telah masak secara fisiologis dan disimpan dalam lingkungan yang lembab. Jika biji sagu disimpan dalam tempat yang kering, maka biji tersebut akan kehilangan viabilitas dengan segera. Buah yang telah masak memiliki ukuran yang besar dan telah mengalami perubahan warna menjadi kuning keemasan (Flach 1997).
Tanaman sagu hepaksantik secara umum terbagi menjadi lima varietas yaitu M. rumphii Mart (sagu tuni), M. sagu Rottb. (sagu molat), M. silvester Mart. (sagu ihur), M. longispinum Mart. (sagu makanaru), dan M. micracantum Mart. (sagu rotan). Dari kelima varietas tersebut yang memiliki arti ekonomi penting adalah Ihur, Tuni, dan Molat (Bintoro et al. 2010).
Ekologi Tanaman Sagu
Menurut Okazaki et al (2013) tanaman sagu merupakan tanaman C3. Sagu dapat dijumpai pada daerah tropika basah di Asia Tenggara dan Oseania. Tanaman sagu mendominasi lahan rawa baik yang tergenang permanen atau semi permanen, juga ditemukan tumbuh pada tanah gambut dan mineral dengan minimal pH 4.5. Anugoolpraset et al (2012) menyatakan sagu dapat tumbuh pada pH tanah yang bervariasi dari 3.6 - 5.7. Tanaman sagu dapat tumbuh baik pada ketinggian 0 - 700 m dpl, dengan rata-rata suhu tahunan 17 - 35 oC dan curah hujan lebih dari 2000 mm tahun-1.
Hasil penelitian studi ekologi tanaman sagu menunjukkan bahwa tidak semua varietas sagu dapat tumbuh pada setiap tipe habitat. Varietas sagu yang dapat tumbuh dan berkembang pada semua tipe habitat yaitu sagu Tuni, Makanaru, dan Silvester. Sagu Rotan dan Molat tumbuh pada habitat terbatas. Sagu rotan hanya ditemukan tumbuh pada tipe habitat lahan kering, sedangkan sagu molat ditemukan tumbuh pada dua tipe habitat yaitu tergenang temporer air tawar dan tergenang permanen (Botanri et al. 2011)
Berdasarkan tipe habitat dan kemampuan beradaptasinya, Botanri et al
(2011) menyatakan sagu tuni memiliki kemampuan adaptasi yang luas
(eury-tolerance), sedangkan sagu makanaru, silvester, dan molat mempunyai daya
adaptasi sedang (meso tolerance), dan sagu rotan memiliki daya adaptasi yang terbatas (steno tolerance).
Panen dan Potensi Produksi Sagu
Sagu dipanen ketika kandungan pati dalam batang dalam keadaan maksimum. Sagu paling baik dipanen saat memasuki fase inisiasi bunga (Flach 1997). Menurut Schuiling (2009) kandungan dan distribusi pati sagu berbeda disetiap fase pertumbuhan. Akumulasi pati dimulai sejak masa vegetatif dan meningkat secara signifikan menjelang masa generatif (inisiasi bunga). Kandungan pati (starch density) pada batang saat berakhirnya vegetatif diperkirakan sebesar 260 kg m-3, sedangkan rata-rata kandungan pati (starch
density) saat masa generatif diperkirakan sebesar 230-240 kg m-3.
Menurut Bintoro et al (2010) sagu dapat menghasilkan 200-400 pati pohon-1. Apabila dilakukan penanaman dengan jarak tanam 8 m x 8m sampai 10 m x 10 m maka populasi dapat mencapai 100-150 pohon ha-1. Namun, populasi sagu di alam yang tumbuh secara alami sangat jauh dari perhitungan tersebut. Menurut hasil survei di beberapa kabupaten di Provinsi Papua dan Papua Barat, rata-rata populasi sagu di hutan alami yang siap panen sekitar 70 pohon ha-1 dan memiliki kecenderungan menurun untuk panen pada tahun berikutnya (Bintoro et al. 2014).
Penyebaran Sagu di Papua dan Papua Barat
Sagu di Papua dan Papua Barat tersebar pada beberapa kabupaten. Berdasarkan faktor persyaratan tempat tumbuh tanaman sagu dan sebaran penggunaaan lahan serta pertimbangan biofisik (ketinggian tempat, kelas lereng, jenis tanah, iklim dan penutupan lahan) menunjukkan bahwa secara indikatif luas potensi sagu di Provinsi Papua 4.7 ha dan di Provinsi Papua Barat 510 ha (Tabel 1) (Bintoro et al. 2014).
Tabel 1 Sebaran potensi sagu dengan beberapa faktor persyaratan tempat tumbuh di Provinsi Papua Barat
Lokasi Luas (ha)
Kawasan hutan dan Perairan (ha) Tata ruang berkembangnya spesies tanaman sagu (center of origin). Analisis mengenai hubungan kekerabatan sagu di Indonesia disampaikan oleh Ehara (2009) menggunakan metode RAPD. Hasil dari analisis tersebut menghasilkan 2 sub kelompok utama. Kelompok A terdiri atas 2 sub kelompok A1 dan A2. Sub kelompok A1 terdiri atas 9 populasi dari Johor, 8 populasi dari Sumatera, 1 populasi dari Jawa Barat, dan 2 populasi dari Roe (roe 1, Roe 2), Sulawesi Tenggara. Sub kelompok A2 terdiri atas 3 populasi lainnya dari Sulawesi Tenggara, Indonesia dan 2 populasi dari Mindanao, Filipina. Sub kelompok A1 terutama terdiri atas sagu di sebelah barat Malay Archipelago. Kelompok B terdiri atas 12 populasi di sebelah timur Malay Archipelago, yaitu 8 populasi dari Seram, 4 populasi dari Ambon di Pulau Maluku, Indonesia. Sub kelompok B1 terdiri atas 6 populasi dari Seram (Tuni 1, 2, 3; Molat 1,2, dan Ihur). Sub kelompok B2 terdiri atas 2 populasi dari Seram (Makanaru 1, 2) dan 4 populasi dari Ambon (Makanaru 3, 4; Tuni 4, 5). Terdapat aksesi Wakar yang terdapat di luar kelompok utama yang berasal dari Papua New Guinea. Berdasarkan hasil tersebut jarak genetik tanaman sagu berhubungan dengan jarak distribusi secara geografi.
Penanda Genetik
DNA (deoxyribo nucleic acid) merupakan material genetik pada manusia dan hampir seluruh organisme termasuk tumbuhan. Sebagian besar DNA terletak pada inti sel (nukleus) yang disebut nuclear DNA, tetapi juga ada sebagian kecil yang tersimpan dalam mitokondria yang disebut mitochondrial DNA atau mt-DNA). Informasi pada DNA disimpan sebagai kode yang tersusun dalam 4 basa yaitu adenin (A), guanin (G), sitosin (C), dan timin (T).
Setiap sel mengandung ratusan mitokondria yang bertempat di sitoplasma. Mitokondria bertugas memproduksi energi melalui proses fosforilasi oksidatif. Reaksi tersebut menggunakan oksigen dan gula sederhana untuk membuat
adenosine triphosphate (ATP) sebagai sumber energi utama sel. Sejumlah enzim
membantu proses fosforilasi tersebut di dalam mitokondria. Mitokondria memiliki mtDNA yang mengandung 37 gen untuk memastikan mitokondria berfungsi dengan baik. Tiga belas diantaranya merupakan gen yang menginstruksikan un-tuk membuat enzim termasuk dalam proses fosforilasi oksidatif, selebihnya adalah gen yang menginstruksikan untuk membuat molekul transfer RNA (tRNA) dan
ribosomal RNAs (rRNA). Kedua jenis RNA tersebut berfungsi melakukan
transkripsi protein.
Rangkaian basa nukleotida pada sekuen DNA dapat berubah yang disebabkan oleh beberapa peristiwa seperti delesi, inversi, translokasi, dan transposisi. Peristiwa tersebut dapat terjadi secara alami maupun secara induksi. Perubahan-perubahan pada sekuen DNA tersebut tidak selalu mengubah fenotip (keadaan morfologi) tanaman. Oleh karenanya, penggunaan penanda morfologi menjadi terbatas pemanfaatannya. Adanya penanda DNA yang langsung menyatu dengan sistem genetik tanaman lebih mencerminkan keadaan genom yang sebenarnya. Penggunaan penanda DNA memungkinkan untuk melakukan analisis keragaman genetik (DNA finger printing) yang lebih baik terutama untuk mengkarakterisasi suatu populasi tanaman. Penanda DNA mampu menyediakan polimorfisme pita DNA dalam jumlah yang banyak, konsisten, dan tidak dipengaruhi oleh lingkungan.
Penggunaan DNA sebagai penanda ditentukan berdasarkan polimorfisme DNA. Restriction fragment length polymorphism (RFLP) merupakan teknik yang digunakan untuk menganalisis keragaman genetik banyak spesies dan dapat digunakan untuk menyusun peta genetik (genetic linkage map). Namun, penggunaan teknik RLFP tersebut memerlukan waktu yang lama dan juga membutuhkan tenaga kerja yang banyak. Oleh itu, lebih dari satu dekade teknik
polymerase chain reaction (PCR) menjadi pilihan teknik yang banyak digunakan
Selain itu mampu menghasilkan karakter yang tidak terbatas jumlahnya, bahan-bahan yang digunakan relatif murah, mudah dalam preparasi dan memberikan hasil yang cepat dibanding teknik molekuler lainnya (Tingey et al. 1992, Weising
et al. 1995).
Prinsip standar teknik RAPD menggunakan oligonukleotida rantai pendek (10 basa) dari sekuen DNA acak sebagai primer untuk mengamplifikasi total genom DNA pada suhu yang rendah untuk proses penempelan primer (
an-nealing) dengan menggunakan teknik PCR. Produk amplifikasi pada umumnya
dipisahkan dalam gel agarosa dan etidium bromida. Welsh dan McClelland (1990) telah mengembangkan metode yang mirip dengan menggunakan primer sepan-jang 15 nukleotida dengan amplifikasi dan elektroforesis yang berbeda dari RAPD. Teknik tersebut disebut arbitrarily primed polymerase chain reaction
(AP-PCR). Selain itu, juga terdapat tenik PCR yang menggunakan primer yang lebih pendek (kurang dari 10 nukleotida) yang disebut DNA amplification
fingerprinting (DAF). Teknik tersebut juga menghasilkan profil finger printing
DNA yang komplek.
Profil amplifikasi DNA yang dihasilkan bergantung pada sekuen homolog nukleotida diantara cetakan DNA dan primer oligonukleotida pada setiap akhir produk amplifikasi. Variasi nukleotida diantara cetakan DNA yang berbeda akan menghasilkan ada atau tidaknya pita (band) karena perubahan tempat primer. Pada umumnya, setiap primer mengamplifikasi secara langsung pada beberapa lo-kus sehingga alelisme tidak dapat dibedakan. Berdasarkan hal tersebut, pada tek-nik RAPD heterozigot tidak dapat dibedakan. Oleh karenanya, penanda RAPD adalah penanda dominan (Bardakci 2001). Kelemahan lain dari teknik RAPD
ada-lah reproducibility yang rendah. Hal tersebut dikarenakan PCR sangat sensitif
ter-hadap perubahan keadaan reaksi. Rendahnya reproducibility juga disebabkan in-tensitas pita yang rendah. Perbedaan antara konsentrasi cetakan DNA dari 2 indi-vidu sampel menyebabkan hilang atau bertambahnya pita (Bardakci 1996).
METODE
Waktu dan Tempat
Pengambilan data dilakukan pada bulan April-Juni 2014 bertempat di Dusun Sagu Sayal, Kecamatan Saifi, Kabupaten Sorong Selatan, Provinsi Papua Barat. Analisis DNA dengan metode RAPD dan pengamatan stomata dilakukan pada bulan Juni-Juli 2014 di Laboratorium PMB (Plant Molecular and
Biotechnology Laboratorium) dan Laboratorium Mikro Teknik, Departemen
Agronomi dan Hortikultura, IPB.
Bahan dan Alat
Bahan yang digunakan adalah 12 aksesi tanaman sagu yang terdapat di Kecamatan Saifi, Kabupaten Sorong Selatan (Tabel 2)
Tabel 2 Informasi awal berbagai aksesi sagu di Kecamatan Saifi, Kabupaten Sorong Selatan
Sumber : Melianus Saflafo (Kepala Kampung Sayal, Kecamatan Saifi) melalui Amarillis (2013), Konsultasi pribadi
Alat yang digunakan adalah alat ukur tinggi dan diameter, kamera digital, GPS, timbangan, plastik klip, cooler box, blue ice, dan parang serta peralatan laboratorium.
Aksesi Produksi Warna Pati
Berduri/ tidak berduri
Keterangan
Fasampe Sangat tinggi Putih Berduri Budidaya Fanke Sangat tinggi Putih Berduri Budidaya Fafion Sangat tinggi Putih Berduri Budidaya Fakreit Sangat tinggi Putih Berduri Budidaya Failik Sangat tinggi Putih Berduri Budidaya Fasinan Tinggi Putih Berduri Budidaya
Falia Tinggi Putih Berduri batang licin, umur berbunga pendek Fanomik Tinggi Putih Berduri Budidaya
Fakattao Tinggi Putih Berduri Budidaya Fablein Tinggi Putih tidak
berduri
Budidaya Fasongka Tinggi Putih Berduri Budidaya
Pengambilan Data
Data diambil dengan pengamatan secara langsung pada tanaman contoh terpilih. Pengamatan terkait dengan morfologi diambil sebelum tanaman contoh ditebang. Metode pengambilan contoh dilakukan dengan mengambil contoh secara acak pada setiap aksesi tanaman sagu. Tanaman contoh yang diambil telah memenuhi kriteria panen, yaitu pada saat tanaman sagu dalam fase generatif (pada saat inisiasi bunga). Selain pengambilan data primer, juga diambil data sekunder berupa keterangan terkait cuaca seperti curah hujan, suhu, serta kelembaban.
Analisis Data
Data yang didapatkan dari karakterisasi berdasarkan morfologi dianalisis secara deskriptif. Hubungan kekerabatannya dapat diketahui berdasarkan jumlah pita polimorfik yang dimiliki bersama, yang selanjutnya diolah dengan menggu-nakan program NTSYS-pc version 2.02 (Jamshidi dan Jamshidi 2011). Dendo-gram dibuat berdasarkan karakter morfologi dan genetik.
Pelaksanaan Penelitian
Pengamatan dilakukan terhadap karakter morfologi, produksi, dan genetik. Informasi mengenai karakter tersebut didapatkan dengan pengamatan secara langsung melalui pengukuran (kuantitatif) dan pemotretan (kualitatif) pada bagian batang, daun, bunga, dan buah termasuk habitus tanaman sagu dan produksinya dengan rincian sebagai berikut :
1. Habitus tanaman
Peubah yang diamati adalah tahapan pertumbuhan rumpun sagu, bentuk tajuk, dan membentuk rumpun atau tidak.
2. Batang
Tinggi batang
Tinggi batang diukur pada pohon yang dipanen dengan mengukur panjang batang hingga ujung batang (pelepah terakhir). Tinggi batang yang masih tersisa (tunggul), masih tertanam di tanah, juga diukur untuk mendapatkan tinggi batang dari permukaan tanah sampai ujung batang (pelepah terakhir). Diameter batang
Diameter batang diamati dengan menggunakan meteran lingkar diambil pada beberapa titik pada bagian pangkal, tengah, dan ujung. Diameter batang diamati setelah batang ditebang. Kemudian ditentukan tiga titik untuk diambil diameternya.
3. Daun Warna daun
Warna daun diamati secara visual dengan cara diambil gambarnya pada fase anakan.
Jumlah daun pada fase masak dewasa
Jumlah daun diamati dengan menghitung jumlah pelepah daun pada tanaman induk.
Panjang dan lebar anak daun diamati pada daun yang telah dewasa pada tanaman induk. Anak daun yang diamati adalah anak daun yang pertum-buhannya telah mencapai maksimum/dewasa (30 - 40% jarak dari pangkal daun).
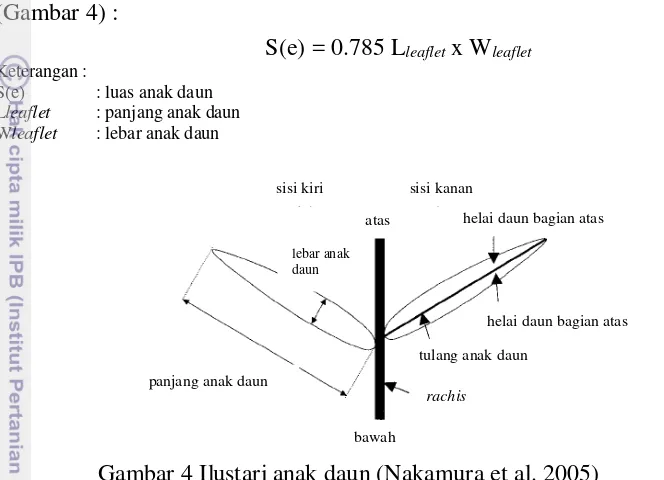
Luas anak daun
Luas anak daun dihitung dengan menggunakan rumus sebagai berikut (Gambar 4) :
S(e) = 0.785 Lleaflet x Wleaflet
Keterangan :
S(e) : luas anak daun
Lleaflet : panjang anak daun Wleaflet : lebar anak daun
Gambar 4 Ilustari anak daun (Nakamura et al. 2005) Jumlah anak daun
Jumlah anak daun diamati pada daun yang telah dewasa pada tanaman induk pada sisi kiri dan kanan tulang daun dan dihitung secara manual (Gambar 5).
Gambar 5 Ilustrasi daun sagu (Nakamura et al. 2004) Panjang tulang daun (rachis)
Panjang tulang daun diamati pada daun yang telah dewasa, diukur pada tulang daun yang terdapat anak daun (Gambar 5).
sisi kiri sisi kanan atas
bawah
helai daun bagian atas
helai daun bagian atas
panjang anak daun
lebar anak daun
tulang anak daun rachis
panjang rachis petiol
panjang petiol
anak daun
panjang daun
leaf blade length pelepah daun
sisi kiri (L)
Panjang dan lebar petiol
Panjang petiol diamati pada daun yang telah dewasa, diukur dari pangkal pelepah sampai anak daun pertama (Gambar 5). Lebar petiol diamati dan diukur pada bagian pangkal pelepah (Gambar 5).
4. Bunga
Bentuk bunga, warna, dan bentuk tandan bunga diamati secara visual dan diambil gambarnya. Berikut perkembangan bunga pada tanaman sagu sebagai pedoman pengamatan di lapangan (Gambar 6),
Gambar 6 Perkembangan bunga tanaman sagu (Schuiling 2009) 5. Buah
Bentuk dan warna buah diamati secara visual dan diambil gambarnya. Berikut perkembangan pembentukan buah pada tanaman sagu sebagai pedoman pengataman di lapangan (Gambar 7).
Diameter Buah
Diameter buah diukur dengan menggunakan jangka sorong pada buah tua. 6. Kerapatan Duri
Kerapatan duri diamati secara visual dengan mengklasifikasikan ke dalam 3 kategori yaitu sangat padat, padat, dan jarang dengan kriteria sebagai berikut : Sangat padat : > 70% menutupi permukaan
Padat : 50-70% menutupi permukaan
a. Bunga masih tertutup oleh braktea b. Bunga telah
mekar c. Bunga telah
Jarang : < 50% menutupi permukaan
Kerapatan duri diamati pada daun sagu (pelepah dan helai anak daun) pada fase anakan dan dewasa.
Gambar 7 Perkembangan buah tanaman sagu (Schuiling 2009) 7. Produksi, Rendemen dan Kadar Air Pati
Produksi pati didekati dengan menggunakan perbandingan volume. Pati diperoleh dari empulur sagu. Empulur diambil dari batang dengan meng-gunakan wadah yang telah diketahui volumenya (ring sample) setiap 2-3 m. Empulur yang didapatkan dihancurkan dan diletakkan dalam wadah yang telah berisi air, kemudian empulur diramas-ramas untuk diekstrak pati-nya. Ekstrak pati diulangi sebanyak 3 kali, masing-masing dengan mengguna-kan 200 ml air. Volume air yang digunakan untuk memeras empulur sama pada setiap ulangan. Air perasan kemudian diendapkan untuk mendapatkan pati, kemudian pati tersebut dikeringkan. Setelah didapatkan pati kering kemudian ditimbang. Produksi pati per pohon kemudian dihitung dengan menggunakan rumus sebagai berikut :
� � �= volume batang
ℎ x bobot pati kering contoh
Volume batang = � 2 x tinggi, dengan �= 3. 14 dan r = jari-jari batang sagu Bobot pati kering merupakan rata-rata dari contoh yang diambil.
Rendemen pati dihitung dengan rumus sebagai berikut :
a. Zygot terbentuk dalam ovari dan ovari menuju perkembangan buah b. Buah yang belum
matang, c. Buah yang telah
matang
d. Buah yang relatif kecil tapi telah matang, tanpa biji (kanan) dan berbiji (kiri)
e. Buah yang berbiji (atas) dan tidak berbiji (bawah) f. Embrio menempel
� =bobot pati kering contoh
bobot empulur x 100%
Kadar air dihitung dengan menggunakan rumus sebagai berikut : Kadar air = ��−�
�� x 100%
Keterangan :
BB = bobot basah pati BK = bobot kering pati
8. Warna pati
Warna pati diamati secara visual dan diambil gambarnya. Warna pati dicocokkan dengan bagan warna (munsell color chart) yang telah disiapkan (Gambar 8).
Gambar 8 Bagan Warna (munsell color chart) 9. Kerapatan stomata
Jumlah stomata diamati dengan cara melihat duplikasi stomata pada epidermis bagian bawah daun ketiga dari daun termuda. Daun tersebut diambil dari anakan yang telah memiliki batang. Stomata diduplikat dengan menggunakan cat kuku yang telah dioleskan pada bagian atas dan bawah daun. Lapisan yang telah menempel pada cat kuku diambil dan diletakkan pada kaca preparat. Kaca preparat disimpan sampai siap digunakan, selanjut-nya jumlah stomata diamati dengan menggunakan mikroskop pada perbe-saran 400 kali.
Kerapatan Stomata = Jumlah Stomata�� � � �
10. Komposisi kimia pati sagu
Untuk mengetahui kandungan karbohidrat dalam pati sagu dilakukan analisis dengan metode luff schrool. Prosedur penetapan karbohidrat adalah sebagai berikut :
a. contoh pati ditimbang sebanyak 5 gram dan dimasukkan ke dalam erlenmeyer asah,
b. 200 ml HCl 10% dan batu didih ditambahkan ke dalam erlenmeyer, c. larutan dihidrolisis dengan pemanasan yang menggunakan pendingin
tegak selama 3 jam,
d. setelah dingin, larutan dinetralkan dengan NaOH 10% (dicek dengan kertas lakmus),
e. larutan tersebut dipindahkan dan diencerkan dengan air dalam labu ukur 500 ml dan ditempatkan sampai tanda tera,
f. larutan selanjutnya disaring dengan menggunakan kertas saring berlipat kering dan dipipet 10 ml ke dalam erlenmeyer asah,
g. ke dalam larutan tersebut ditambahkan 25 ml larutan luff schrool dan 15 ml aquadest serta beberapa batu didih,
h. hidrolisis kembali selama 10 menit dengan menggunakan pendingin tegak dan didinginkan dalam air mengalir (tidak boleh dikocok),
i. 10 ml larutan KI 30% dan 25 ml H2SO4 25% selama perlahan-lahan dan hati-hati ,
j. larutan tersebut dititrasi dengan menggunakan larutan natrium tio sulfat 0.1 N dengan indikator kanji,
k. blanko ditetapkan, Perhitungan :
Jumlah ml tio sulfat 0.1 N = (volume tio blanko – vol tio contoh) x N tio x 10 Jumlah ml tio sulfat 0.1 N setara dengan mg glukosa pada Tabel Luff schroorl (LF)
Kadar glukosa = mg glukosa dari tabel LF x fp
ℎ ( �) x 100%
Kadar karbohidrat = 0.90 x kadar glukosa
Kadar karbohidrat dalam 100 gram contoh = kadar karbohidrat contoh x 20 11. Karakter genetik
Ekstraksi DNA
Tahapan ekstraksi DNA adalah sebagai berikut,
a. larutan buffer dan contoh daun dikeluarkan dari tube dan dimasukkan ke dalam mortar
b. PVP (polyvinyl-pyrrolidone) ditambahkan ke dalam mortar dan digerus bersama
c. contoh daun yang telah digerus dipindahkan ke dalam mikrotube berukuran 1.5 ml
d. mikrotube direndam di dalam water bath 65 oC selama 30 menit dan diinkubasikan selama 10 menit pada suhu ruang
e. pada setiap mikrotube dimasukkan larutan CIA sebanyak 700 µL f. mikrotube divortex untuk mencampurkan larutan hingga homogen g. contoh disentrifuse dengan kecepatan 10 000 - 15 000 rpm selama 5
menit
h. supernatan (fase atas) diambil dan dimasukkan ke dalam mikrotube baru berukuran 2 ml
i. CIA ditambahkan lagi, ke dalam supernatan, tube divortex dan disentrifuse kembali
j. supernatan diambil kembali dan dipindahkan ke mikrotune baru berukuran 2 ml
k. etanol absolut (100%) sebanyak 2 kali volume awal ditambahkan ke dalam supernatan (dipenuhi sampai 2 ml)
l. larutan diinkubasi pada suhu dingin
m. mikrotube disentrifuse kembali dengan kecepatan 8 000 rpm selama 5 menit
n. didapatkan pelet DNA (endapan)
o. air dibuang dan pelet DNA dikeringkan dalam desicator vacum
p. pelet DNA disimpan dalam freezer sampai siap digunakan Amplifikasi PCR untuk RAPD
Primer RAPD yang digunakan pada percobaan yaitu 8 jenis (8 mer) primer yang telah diseleksi oleh Ehara et al.(2003) sebagai berikut : P04 (CGT CTG CCC G), P06 (TTC CGC GGG C), P17 (ATG ACG ACG G), OPG02 (GGC ATC GAG G), OPA04 (AAT CGG GCT G), OPAB04 (GGC ACG CGT T), OPAA17 (GAG CCC GAC T), OPAB18 (CTG GCG TGT C). Primer dilarutkan dalam air aquabidest dan dibuat dalam konsentrasi 100 µM seba-gai larutan stok (stock solution). Banyaknya air yang harus ditambahkan un-tuk membuat larutan stok dihitung dengan cara mengalikan jumlah molekul yang tertera pada kemasan dengan 10 µL. Selanjutnya, untuk memudahkan pekerjaan, dibuat larutan kerja (working solution) pada setiap primer dengan pengenceran sebanyak 5 kali.
agarose ke dalam 40 ml TAE dan dipanaskan di atas hot plate sampai homogen (mendidih) kira-kira selama 3 menit. Setelah dingin, larutan dituangkan ke dalam cetakan dan comb (sisir) dipasang untuk membuat lubang (well), kemudian ditunggu hingga memadat. Setelah memadat, sisir diambil dan dimasukkan larutan TAE sampai menutupi gel agarose.
Larutan hasil PCR (DNA) dimasukkan ke dalam well sebanyak 2.5 µL. Di-akhir well dimasukkan marker (ladder) sebanyak 5 µL. Gel hasil elektrofore-sis kemudian diberi pewarnaan dengan cara memasukkannya ke dalam laru-tan etidium bromida selama 5 menit dan kemudian diambil gambarnya. Hasil PCR yang telah dielektroforesis difoto dan dianalisis dengan melakukan skoring. Profil pita DNA hasil analisis RAPD diskoring berdasarkan ada atau tidaknya hasil amplifikasi. Jika terdapat pita maka genotipe tersebut dinilai 1 dan jika tidak terdapat pita pada genotipe yang lain dinilai 0 (Gambar 9). Skoring dilakukan pada areal lokus yang memiliki pita yang jelas.
HASIL DAN PEMBAHASAN
Hasil
Gambaran Umum Lokasi Penelitian
Kabupaten Sorong Selatan terletak pada 01o00’ hingga 02o30’ lintang selatan (LS) dan 131o00’ hingga 133o00’ bujur timur (BT). Kabupaten tersebut terletak pada ketinggian 0 - 1 362 m dpl. Lokasi penelitian bertempat di Kampung Sayal, Distrik (Kecamatan) Saifi termasuk dalam dataran rendah. Secara administrasi, Kabupaten Sorong Selatan dibatasi oleh Kabupaten Maybrat di sebelah utara, Teluk Bintuni dan Laut Seram di sebelah selatan, Laut Seram dan Sorong di sebelah Barat, dan Kabupaten Maybrat dan Teluk Bintuni di sebelah Timur. Rata-rata suhu udara minimum dan maksimum di Kabupaten Sorong Selatan pada tahun 2012 berkisar 24.10 oC - 31.10 oC dengan kelembaban udara sebesar 86% dan rata-rata penyinaran matahari sebesar 48.02%. Curah hujan pada tahun 2012 mencapai 3 085 mm (BPS 2013). Pada saat pelaksanaan penelitian, terjadi hujan yang cukup sering, sehingga sebagian areal tergenang oleh air sampai setinggi 30 cm.
Sagu di Kampung Sayal secara umum tumbuh pada tanah mineral dengan lahan yang tergenang, baik tergenang sementara maupun tergenang permanen. Areal pertanaman sagu tumbuh secara alami dan membentuk komunitas ter-sendiri. Walaupun sagu tumbuh di dalam hutan, tetapi vegetasi lain yang ber-campur dengan vegetasi sagu tidak terlalu banyak. Beberapa diantaranya adalah bambu, pohon nangka, matoa hutan, dan kayu merbau (kayu besi).
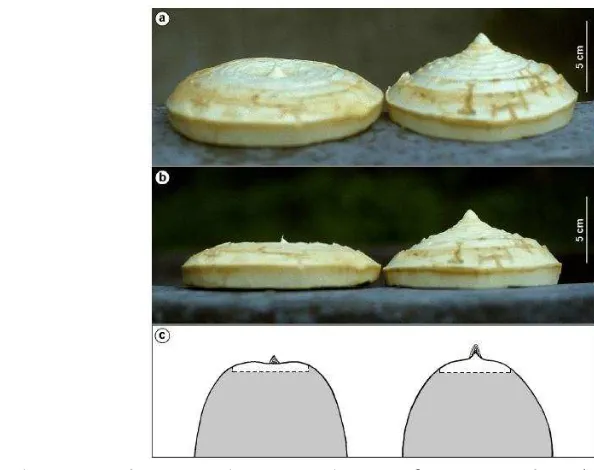
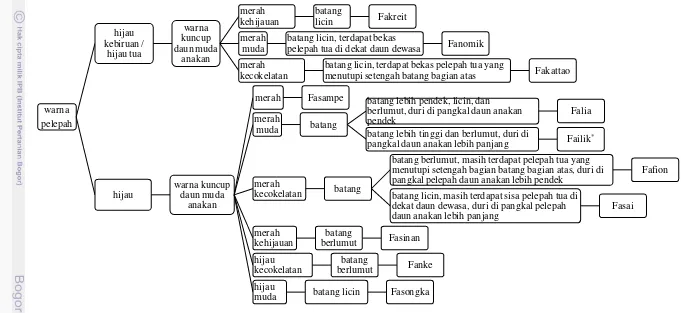
Sebagian besar sagu yang tumbuh di lokasi penelitian merupakan sagu yang berduri. Hanya ditemukan satu aksesi sagu yang tidak berduri yaitu Fablen. Aksesi sagu yang lainnya yaitu Fasinan, Falia, Fasampe, Fanomik, Fakreit, Fanke, Fafion, Failik, Fasai, Fasongka, dan Fakattao. Masyarakat setempat membedakan sagu berdasarkan karakter fisiknya (morfologinya) dengan ciri - ciri yang dida-patkan secara turun menurun dari leluhurnya. Karakter utama yang sering dipakai oleh penduduk lokal untuk membedakan sagu yang berduri adalah warna pelepah, warna pucuk daun anakan, tinggi batang, dan ada atau tidaknya bekas pelepah tua pada pohon sagu (Gambar 10). Diantara keduabelas aksesi sagu tersebut, terdapat satu aksesi sagu liar yang menurut masyarakat setempat memiliki kandungan pati yang sangat rendah sehingga jarang sekali ada petani yang mau memanen. Sagu liar tersebut adalah Fasai, yang biasanya tumbuh di sembarang tempat seperti di pinggir-pinggir jalan atau di areal perumahan warga, tidak menyatu dengan komunitas sagu lainnya.
Karakter Morfologi
Berikut disajikan beberapa karakter dari keduabelas aksesi sagu yang diamati, 1. Habitus tanaman,
memiliki batang), fase pohon dewasa yang sudah masak tebang, dan pohon yang sudah lewat masak tebang. Sagu di lokasi penelitian tumbuh secara alami sehingga anakan yang tumbuh tidak terkontrol. Terdapat rumpun yang hanya memiliki satu induk dan anakan yang sangat rapat tetapi masih dalam fase semai dan sapihan. Keseluruhan aksesi sagu merupakan tanaman hepaksantik, yaitu tanaman sagu yang berbunga dan berbuah satu kali, jika sudah berbuah pati yang terkandung dalam empulur sudah sangat berkurang kemudian tanaman akan mati. Kebanyakan aksesi sagu memiliki bentuk tajuk yang tegak, namun ada juga aksesi sagu yang memiliki bentuk tajuk agak terbuka seperti Fasinan, Fakreit, dan Fanke (Gambar 11).
2. Batang
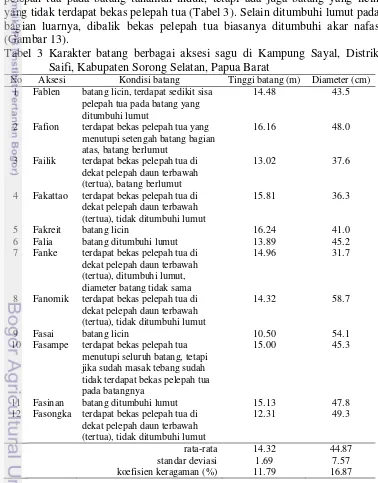
Kondisi batang sagu bervariasi (Gambar 12). Secara umum terdapat bekas pelepah tua pada batang tanaman induk, tetapi ada juga batang yang licin yang tidak terdapat bekas pelepah tua (Tabel 3). Selain ditumbuhi lumut pada bagian luarnya, dibalik bekas pelepah tua biasanya ditumbuhi akar nafas (Gambar 13).
Tabel 3 Karakter batang berbagai aksesi sagu di Kampung Sayal, Distrik Saifi, Kabupaten Sorong Selatan, Papua Barat
No Aksesi Kondisi batang Tinggi batang (m) Diameter (cm) 1 Fablen batang licin, terdapat sedikit sisa
pelepah tua pada batang yang ditumbuhi lumut
14.48 43.5
2 Fafion terdapat bekas pelepah tua yang menutupi setengah batang bagian atas, batang berlumut
16.16 48.0
3 Failik terdapat bekas pelepah tua di dekat pelepah daun terbawah (tertua), batang berlumut
13.02 37.6
4 Fakattao terdapat bekas pelepah tua di dekat pelepah daun terbawah (tertua), tidak ditumbuhi lumut
15.81 36.3
5 Fakreit batang licin 16.24 41.0
6 Falia batang ditumbuhi lumut 13.89 45.2 7 Fanke terdapat bekas pelepah tua di
dekat pelepah daun terbawah (tertua), ditumbuhi lumut, diameter batang tidak sama
14.96 31.7
8 Fanomik terdapat bekas pelepah tua di dekat pelepah daun terbawah (tertua), tidak ditumbuhi lumut
14.32 58.7
9 Fasai batang licin 10.50 54.1
10 Fasampe terdapat bekas pelepah tua menutupi seluruh batang, tetapi jika sudah masak tebang sudah tidak terdapat bekas pelepah tua pada batangnya
15.00 45.3
11 Fasinan batang ditumbuhi lumut 15.13 47.8 12 Fasongka terdapat bekas pelepah tua di
dekat pelepah daun terbawah (tertua), tidak ditumbuhi lumut
12.31 49.3
Gambar 10 Cara membedakan aksesi sagu yang berduri menurut penduduk di Kampung Sayal, Kecamatan Saifi, Kabupaten Sorong
pelepah tua di dekat daun dewasa Fanomik
merah kecokelatan
batang licin, terdapat bekas pelepah tua yang
menutupi setengah batang bagian atas Fakattao
hijau
batang lebih pendek, licin, dan berlumut, duri di pangkal daun anakan pendek
Falia
batang lebih tinggi dan berlumut, duri di
pangkal daun anakan lebih panjang Failik*
merah
kecokelatan batang
batang berlumut, masih terdapat pelepah tua yang menutupi setengah bagian batang bagian atas, duri di pangkal pelepah daun anakan lebih pendek
Fafion
Gambar 11 Variasi Bentuk tajuk berbagai aksesi sagu di Kampung Sayal, Kecamatan Saifi, Kabupaten Sorong Selatan, Papua Barat
Fasinan Fasampe Falia
Fablen Fasai Fanke
Fakreit Fafion Failik
Gambar 12 Variasi batang berbagai aksesi sagu di Kampung Sayal, Kecamatan Saifi, Kabupaten Sorong Selatan, Papua Barat
Fablen Fasai Fanke
Fakreit Fafion Failik
3. Daun
Jumlah daun tidak terlalu berbeda antar aksesi. Aksesi Fanomik dan Fanke memiliki jumlah daun yang cukup banyak dibandingkan dengan aksesi lainnya. Warna kuncup daun anakan cukup bervariasi antar aksesi, kuncup anakan tersebut merupakan penanda yang paling mudah diamati dibandingkan dengan karakter lainnya (Gambar 14). Luas anak daun, jumlah anak daun, panjang rachis dan lebar petiol tidak terlalu bervariasi, namun panjang petiol memiliki variasi yang cukup tinggi. Fasinan memiliki jumlah anak daun paling banyak, sedangkan Fafion memiliki panjang rachis dan petiol paling panjang (Tabel 4).
Gambar 13 Akar nafas yang muncul di permukaan tanah dan batang 4. Bunga dan Buah
Tidak semua aksesi dapat diamati bunga dan buahnya karena sagu biasa dipanen sebelum berbunga atau berbuah. Secara umum, bunga sagu tersusun dalam tandan, bercabang-cabang seperti tanduk rusa dengan bentuk bunga seperti buah sirih. Panjang bunga berkisar 9 - 12 cm dengan warna bunga cokelat (Gambar 15). Buah sagu memiliki kulit yang bersisik tersusun seperti buah salak, namun memiliki bentuk yang bulat (Gambar 16). Secara umum buah sagu terbagi atas 3 karpel dan kebanyakan buah sagu tidak berbiji (Gambar 17). Bentuk dan ukuran buah sagu tidak terlalu bervariasi antar aksesi (Tabel 5).
5. Duri
Gambar 14 Warna kuncup daun muda anakan berbagai aksesi sagu di Kampung Sayal, Kecamatan Saifi, Kabupaten Sorong Selatan, Papua Barat
Fasinan Fasampe Falia
Fablen Fasai Fanke
Fakreit Fafion Failik
Gambar 15 Susunan tandan bunga sagu aksesi Fasinan
Tabel 4 Karakteristik daun berbagai aksesi sagu di Kampung Sayal, Kecamatan Saifi, Kabupaten Sorong Selatan, Papua Barat
Gambar 16 Bentuk buah berbagai aksesi sagu di Kampung Sayal, Kecamatan Saifi, Sorong Selatan, Papua Barat
Gambar 17 Penampang melintang buah sagu yang tidak berbiji
Tabel 5 Karakteristik buah berbagai aksesi sagu di Kampung Sayal, Distrik Saifi, Kabupaten Sorong Selatan, Papua Barat
No Aksesi Bentuk buah Diameter buah tua (mm)
1 Fablen NA*) NA*)
2 Fafion bulat 31.5
3 Failik bulat 32.0
4 Fakattao agak lonjong 34.0
5 Fakreit bulat 29.5
6 Falia bulat 29.5
7 Fanke agak lonjong 33.0
8 Fanomik bulat 30.5
9 Fasai agak lonjong 27.0
10 Fasampe bulat 29.0
11 Fasinan bulat 30.5
12 Fasongka agak lonjong 32.5
rata-rata 30.8
standar deviasi 2.03
koefien keragaman (%) 6.58
*)
Gambar 18 Pola duri pada pangkal pelepah daun dewasa berbagai aksesi sagu di Kampung Sayal, Kecamatan Saifi, Sorong Selatan, Papua Barat Fablen Fafion Failik
Fanke Fanomik Fasai
Fakattao Fakreit Falia
6. Warna Empulur dan Pati
Warna empulur sagu hampir semuanya berwarna merah muda saat pertama kali dibuka. Empulur sangat mudah teroksidasi oleh udara. Jika empulur sudah terkena udara maka warnanya akan segera berubah menjadi cokelat (Gambar 19). Begitupun dengan warna pati, mengikuti warna empulur, jika empulur berwarna merah muda, maka pati juga akan berwarna merah muda (Gambar 20).
Gambar 19 Empulur sagu yang teroksidasi udara (bagian yang berwarna cokelat)
Gambar 20 Warna empulur (a) dan pati basah (b) berbagai aksesi sagu di Kampung Sayal, Kecamatan Saifi, Sorong Selatan, Papua Barat a
7. Kerapatan Stomata
Sebagian besar stomata tersebar pada epidermis bagian bawah dengan kerapatan yang cukup tinggi. Perbedaan kerapatan stomata tidak terlalu berbeda antar aksesi. Fanomik memiliki kerapatan stomata paling rendah dibandingkan aksesi lainnya (Tabel 6). Rata-rata kerapatan stomata berbagai aksesi sagu di lokasi penelitian cukup tinggi (> 400 mm-2)
Tabel 6 Kerapatan stomata epidermis bagian bawah berbagai aksesi sagu di Kampung Sayal, Distrik Saifi, Kabupaten Sorong Selatan, Papua Barat
No Aksesi Kerapatan Stomata
(epidermis bagian bawah)
koefien keragaman (%) 14.28
Keteranngan : *) NA = stomata tidak terlihat pada preparat – kemungkinan karena daun kotor Stomata diamati pada daun anakan sagu fase sapihan, yang belum membantuk batang
8. Komposisi Kimia Pati Sagu
Kandungan bahan ekstrak tanpa nitrogen (BETN) berbagai aksesi sagu lebih besar dari 70%. BETN kaya akan karbohidrat (Tabel 7).
Tabel 7 Komposisi kimia pati dalam bobot basah (%) berbagai aksesi sagu di Kampung Sayal, Kecamatan Saifi, Kabupaten Sorong Selatan, Papua Barat
Aksesi Kadar Air
Kadar Abu
Potensi Produksi
Potensi Produksi Individu
Aksesi Fasai (sagu liar) memiliki rendemen paling rendah dibandingkan dengan aksesi lainnya sehingga memiliki produksi pati yang juga paling rendah. Sebagian besar aksesi sagu mampu memproduksi pati kering lebih dari 200 kg batang-1. Rata-rata potensi hasil 236.70 pati kering kg batang-1. Aksesi tersebut diantaranya Fafion, Fakreit, Falia, Fanomik, Fasampe, Fasinan, dan Fasongka. Fanomik merupakan aksesi yang paling banyak memproduksi pati (Tabel 8). Tabel 8 Potensi produksi berbagai aksesi sagu di Kampung Sayal, Kecamatan
Saifi, Kabupaten Sorong Selatan, Papua Barat
Aksesi Rendemen (%) KA (%) Produksi pati kering (kg
koefisien keragaman (%) 14.56 11.43 34.21
Potensi Produksi per Hektar
Berdasarkan jumlah pohon masak tebang per hektar maka dari hutan sagu alami di Kampung Sayal, Kecamatan Saifi, Kabupaten Sorong Selatan, Papua Ba-rat, akan didapatkan potensi produksi sebanyak 38.43 ton pati kering ha-1 tahun-1 (Tabel 9).
Hubungan Kekerabatan
Elektroforesis DNA dengan menggunakan delapan primer menghasilkan amplifikasi DNA yang jelas, yang ditandai dengan munculnya pita polimorfik (Gambar 21). Berdasarkan hasil analisis tersebut, sagu di Kampung Sayal, Distrik Saifi, Papua Barat terdapat 10 grup aksesi sagu dan memiliki kekerabatan genetik yang cukup jauh. Hanya Fakreit dan Fanke yang memiliki kemiripan cukup dekat (81%), sedangkan aksesi lainnya memiliki kemiripan dibawah 80% (Gambar 22).
keterangan : 1= Fasinan, 2 = Fafion, 3= Falia, 4 = Fakreit, 5 = Fasampe, 6 = Fablen, 7 = Fasai, 8 = Failik, 9 = Fanke, 10 = Fasongka, 11 = Fanomik, 12 = Fakattao, L = DNA ladder
Gambar 21 Hasil amplifikasi DNA berbagai aksesi sagu di Kampung Sayal, Distrik Saifi, Sorong Selatan, Papua Barat
Gambar 22 Dendogram berbagai aksesi sagu berdasarkan karakter genetik di Kampung Sayal, Kecamatan Saifi, Sorong Selatan, Papua Barat
Fasinan Fakattao
Fasai Fakreit Fanke Fasampe Failik Fanomik Fafion Fablen Fasongka Falia
0.55 0.61 0.68 0.74 0.81
Kemiripan
Primer A4 Primer AA17 Primer AB4 Primer AB18
Terdapat perbedaan kedekatan hubungan antar aksesi berdasarkan karakter genetik (RAPD) dan karakter morfologi. Berdasarkan karakter morfologi, aksesi Fablen merupakan aksesi yang memiliki hubungan terjauh dengan aksesi lainnya (38%), sedangkan aksesi yang memiliki hubungan terdekat adalah Falia dan Fasampe dengan kemiripan 93%. Aksesi Fanke dan Fakreit yang sangat dekat berdasarkan karakter genetik terletak pada kelompok yang berbeda pada dendogram berdasarkan karakter morfologi. Aksesi Fanke lebih dekat dengan Fakattao (75%) dibandingkan dengan Fakreit, sedangkan Fakreit lebih dekat dengan Fasinan (84%) (Gambar 23). Hubungan kekerabatan secara morfologi dibuat berdasarkan 29 karakter.
Gambar 23 Dendogram berbagai aksesi sagu berdasarkan karakter morfologi di Kampung Sayal, Kecamatan Saifi, Sorong Selatan, Papua Barat
Pembahasan
Karakter Morfologi
Sagu di lokasi penelitian tumbuh dan berkembang pada satu kawasan yang sama, namun memiliki ciri morfologi yang berbeda-beda. Menurut Syukur et al
(2012) penampilan tanaman (morfologi) dipengaruhi oleh faktor genetik, lingkungan, dan interaksi antar keduanya. Karakter tertentu seperti warna bunga atau polong dikendalikan oleh gen sederhana yang terdiri atas 1 atau 2 gen dan tidak dipengaruhi atau sedikit sekali dipengaruhi oleh lingkungan. Sebagian besar karakter tanaman yang berhubungan dengan produksi tanaman, seperti tinggi dan diameter batang, jumlah daun, dan kerapatan stomata sangat dipengaruhi oleh banyak gen dan lingkungan sehingga agak sulit untuk dijadikan penanda.
Penduduk lokal membedakan aksesi sagu berdasarkan ada tidaknya duri. Sebagian besar sagu di lokasi penelitian merupakan sagu yang berduri. Sagu yang tidak berduri sangat jarang ditemukan. Ehara (2009) melaporkan bahwa sagu yang berduri dan tidak berduri memiliki perbedaan yang sangat kecil. Keberadaan duri pada petiol dan rachis daun sagu tidak berkaitan secara genetik. Novero et al (2012) juga menyatakan bahwa adanya duri pada tanaman sagu merupakan peris-tiwa epigenetik yang dipengaruhi oleh lingkungan. Berdasarkan analisis terhadap
0.38 0.51 0.65 0.79 0.93
methylation DNA, terdapat perbedaan yang signifikan terhadap persentase
methy-lation DNA antara tanamaan sagu yang berduri dan tidak berduri yang disebabkan
oleh lingkungan tumbuh yang tergenang. Dengan demikian, keberadaan duri tidak dipengaruhi secara genetis, namun sangat dipengaruhi oleh lingkungan mikro tanaman.
Beberapa aksesi sagu yang berduri memiliki ciri-ciri yang mirip sehingga beberapa karakter sulit untuk dibedakan. Warna kuncup daun muda anakan merupakan salah satu karakter sagu yang mudah untuk dibedakan dan dapat digunakan sebagai ciri khas karena tidak dipengaruhi oleh lingkungan. Ketika dewasa, kuncup daun tanaman dewasa (induk) sulit untuk diamati dan pada umumnya berwarna hijau muda. Karakter lain yang mudah untuk diamati adalah warna pelepah dan bentuk tajuk. Warna pelepah merupakan penanda pertama yang dipakai penduduk lokal untuk membedakan berbagai aksesi sagu yang berduri di lokasi penelitian. Selanjutnya penduduk lokal membedakan berbagai aksesi sagu tersebut dengan melihat warna kuncup daun muda anakan, kondisi batang, bentuk tajuk, ataupun jumlah daunnya.
Kondisi batang yang umum digunakan sebagai penanda oleh penduduk setempat diantaranya adalah keberadaan bekas pelepah tua dan ada tidaknya lumut atau pakis yang tumbuh pada bekas pelepah tua tersebut. Tanaman sagu di lokasi penelitian cukup rapat, sehingga menyebabkan lingkungan mikro di sekitar tanaman menjadi lembab. Kelembaban udara yang tinggi memicu tumbuhnya lumut dan tumbuhan pakis tumbuh pada bekas pelepah tua di batang sagu. Beberapa aksesi yang memiliki batang licin dan bersih tumbuh pada areal yang mendapatkan penyinaran yang cukup, sehingga bekas pelepah cepat mengering dan tidak ditumbuhi oleh lumut. Namun, aksesi Fakreit memiliki batang yang licin (tidak terdapat bekas pelepah tua yang masih menempel pada batang dan juga tidak ditumbuhi lumut atau pakis) walaupun tumbuh pada kondisi yang rapat. Penyebab mengenai hal tersebut belum diketahui secara pasti.
Berdasarkan uraian di atas, penanda morfologi yang sering dijadikan acuan oleh penduduk lokal tidak selalu benar, karena penanda tersebut sangat dipengaruhi oleh lingkungan. Diantara karakter morfologi yang lainnya, warna kuncup daun muda anakan merupakan karakter yang dapat dijadikan penanda yang lebih stabil karena tidak dipengaruhi oleh lingkungan.
Hubungan Kekerabatan